PowerPoint-Präsentation
Werbung

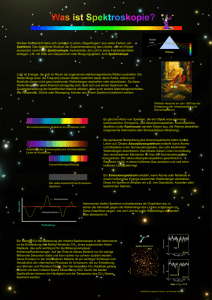
Erzeugung von Licht in Atomen Für die Erklärung reicht das Atommodell von Niels Bohr vom Beginn des 20. Jahrhunderts. Im Wasserstoffatom kreist ein Elektron auf einer bestimmten Bahn um den Atomkern. Es stehen aber auch andere Bahnen zur Verfügung. Um diese zu erreichen, muss Energie aufgenommen werden. Erzeugung von Licht in Atomen Wenn diese Energie, z.B. in Form von Wärme, zugeführt wird, bewegt sich das Elektron auf die energiereichere äußere Bahn. Erzeugung von Licht in Atomen Das Elektron bleibt nicht auf dieser Bahn, sondern „fällt“ wieder auf seine energetisch günstigere Bahn zurück. Dabei wird ein Lichtquant abgegeben, dessen Energie genau dem Differenzbetrag der Energien beider Bahnen entspricht. Für uns heißt das: Licht einer wohldefinierten Farbe. Erzeugung von Licht in Atomen Das Elektron bleibt nicht auf dieser Bahn, sondern „fällt“ wieder auf seine energetisch günstigere Bahn zurück. Dabei wird ein Lichtquant abgegeben, dessen Energie genau dem Differenzbetrag der Energien beider Bahnen entspricht. Für uns heißt das: Licht einer wohldefinierten Farbe. Erzeugung von Licht in Atomen Diese Lichtemission ist für jede Atomsorte spezifisch. Links abgebildet sind die Farben, die das Wasserstoffatom bei den verschiedenen möglichen „Bahnsprüngen“ seiner Elektronen abgibt. Kontinuierliches Spektrum Ein Spektrum, dessen Linien so dicht sind, dass lückenlos alle Farben sichtbar sind, heißt “kontinuierliches Spektrum”. Es ist z. B. zu beobachten, wenn man ein Spektroskop auf ein glühendes Stück Metall richtet (Wolframfaden einer Glühlampe). Emissionsspektrum Da für jedes Element charakteristische Energiesprünge typisch sind, hat auch jedes Element sein typisches Linienspektrum. Da bei dieser Art Spektren die Energie aktiv ausgesandt wird, heißt sie Emissionsspektrum (lat. emittare: aussenden). Emissions- und Absorptionsspektrum Gelangt ein kontinuierliches Spektrum durch ein relativ kühles Gas (z. B. die Sonnenatmosphäre), so werden genau die Farben, die bei einer Emission ausgesandt würden, von den Atomen absorbiert. Daher kann man ein kontinuierliches Spektrum mit Lücken, den sog. “Linien”, beobachten. Dieses Linien- oder Absorptionsspektrum kann ebenso genaue Rückschlüsse über die Zusammensetzung des Gases ermöglichen wie ein Emissionsspektrum. Linienspektren verschiedener Elemente Wasserstoff Helium Natrium Kalzium Quecksilber Emissions- und Absorptionsspektrum von Wasserstoff Helium – zuerst auf der Sonne entdeckt