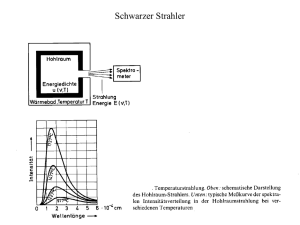
Atomsymbole_Formelsprache - HMTC
Werbung
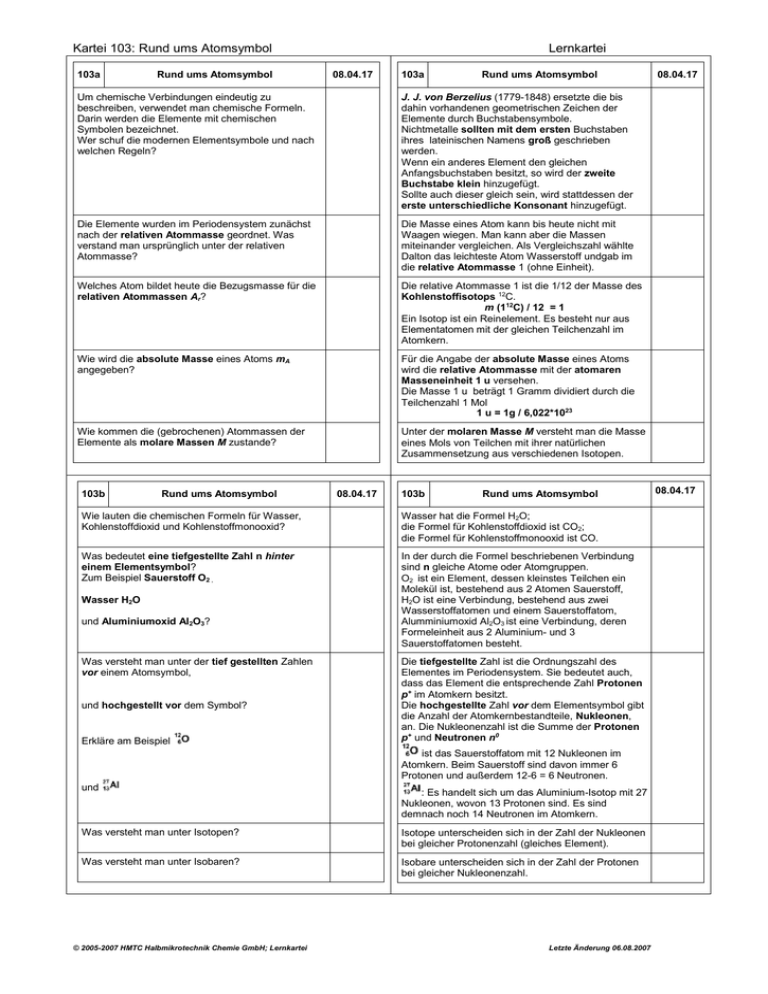
Kartei 103: Rund ums Atomsymbol 103a Rund ums Atomsymbol Lernkartei 08.04.17 103a Rund ums Atomsymbol Um chemische Verbindungen eindeutig zu beschreiben, verwendet man chemische Formeln. Darin werden die Elemente mit chemischen Symbolen bezeichnet. Wer schuf die modernen Elementsymbole und nach welchen Regeln? J. J. von Berzelius (1779-1848) ersetzte die bis dahin vorhandenen geometrischen Zeichen der Elemente durch Buchstabensymbole. Nichtmetalle sollten mit dem ersten Buchstaben ihres lateinischen Namens groß geschrieben werden. Wenn ein anderes Element den gleichen Anfangsbuchstaben besitzt, so wird der zweite Buchstabe klein hinzugefügt. Sollte auch dieser gleich sein, wird stattdessen der erste unterschiedliche Konsonant hinzugefügt. Die Elemente wurden im Periodensystem zunächst nach der relativen Atommasse geordnet. Was verstand man ursprünglich unter der relativen Atommasse? Die Masse eines Atom kann bis heute nicht mit Waagen wiegen. Man kann aber die Massen miteinander vergleichen. Als Vergleichszahl wählte Dalton das leichteste Atom Wasserstoff undgab im die relative Atommasse 1 (ohne Einheit). Welches Atom bildet heute die Bezugsmasse für die relativen Atommassen Ar? Die relative Atommasse 1 ist die 1/12 der Masse des Kohlenstoffisotops 12C. m (112C) / 12 = 1 Ein Isotop ist ein Reinelement. Es besteht nur aus Elementatomen mit der gleichen Teilchenzahl im Atomkern. Wie wird die absolute Masse eines Atoms mA angegeben? Für die Angabe der absolute Masse eines Atoms wird die relative Atommasse mit der atomaren Masseneinheit 1 u versehen. Die Masse 1 u beträgt 1 Gramm dividiert durch die Teilchenzahl 1 Mol 1 u = 1g / 6,022*1023 Wie kommen die (gebrochenen) Atommassen der Elemente als molare Massen M zustande? Unter der molaren Masse M versteht man die Masse eines Mols von Teilchen mit ihrer natürlichen Zusammensetzung aus verschiedenen Isotopen. 103b Rund ums Atomsymbol 08.04.17 103b Rund ums Atomsymbol Wie lauten die chemischen Formeln für Wasser, Kohlenstoffdioxid und Kohlenstoffmonooxid? Wasser hat die Formel H2O; die Formel für Kohlenstoffdioxid ist CO2; die Formel für Kohlenstoffmonooxid ist CO. Was bedeutet eine tiefgestellte Zahl n hinter einem Elementsymbol? Zum Beispiel Sauerstoff O2 , In der durch die Formel beschriebenen Verbindung sind n gleiche Atome oder Atomgruppen. O2 ist ein Element, dessen kleinstes Teilchen ein Molekül ist, bestehend aus 2 Atomen Sauerstoff, H2O ist eine Verbindung, bestehend aus zwei Wasserstoffatomen und einem Sauerstoffatom, Alumminiumoxid Al2O3 ist eine Verbindung, deren Formeleinheit aus 2 Aluminium- und 3 Sauerstoffatomen besteht. Wasser H2O und Aluminiumoxid Al2O3? Was versteht man unter der tief gestellten Zahlen vor einem Atomsymbol, und hochgestellt vor dem Symbol? Erkläre am Beispiel Die tiefgestellte Zahl ist die Ordnungszahl des Elementes im Periodensystem. Sie bedeutet auch, dass das Element die entsprechende Zahl Protonen p+ im Atomkern besitzt. Die hochgestellte Zahl vor dem Elementsymbol gibt die Anzahl der Atomkernbestandteile, Nukleonen, an. Die Nukleonenzahl ist die Summe der Protonen p+ und Neutronen n0 ist das Sauerstoffatom mit 12 Nukleonen im Atomkern. Beim Sauerstoff sind davon immer 6 Protonen und außerdem 12-6 = 6 Neutronen. und : Es handelt sich um das Aluminium-Isotop mit 27 Nukleonen, wovon 13 Protonen sind. Es sind demnach noch 14 Neutronen im Atomkern. Was versteht man unter Isotopen? Isotope unterscheiden sich in der Zahl der Nukleonen bei gleicher Protonenzahl (gleiches Element). Was versteht man unter Isobaren? Isobare unterscheiden sich in der Zahl der Protonen bei gleicher Nukleonenzahl. © 2005-2007 HMTC Halbmikrotechnik Chemie GmbH; Lernkartei Letzte Änderung 06.08.2007 08.04.17 08.04.17 Kartei 103: Rund ums Atomsymbol 103c Rund ums Atomsymbol Lernkartei 08.04.17 103c Rund ums Atomsymbol Was bedeuten römische Zahlen mit Vorzeichen genau über einem Elementsymbol? Die römischen Zahlen mit Vorzeichen über dem Elementsymbol nennt man formale Oxidationszahlen. Sie geben an, wie viele Elektronen das Atom in der bestehenden Verbindung aufgenommen (-) oder abgegeben (+) hat. Wie lautet die Formel für Aluminiumoxid? Die Formel für Aluminiumoxid lautet Al2O3. Sauerstoff steht in der 6. Hauptgruppe. Das Sauerstoffatom nimmt daher in der Regel 2 Elektronen auf, um die Elektronenkonfiguration des nächstliegenden Edelgases zu erreichen. Das Aluminium ist ein Metall und gibt daher gemäß seiner Stellung im Periodensystem in der 3. Hauptgruppe drei Elektronen ab. Am Ende des Redoxprozesses (Elektronenübertragung) muss die Zahl der abgegebenen Elektronen gleich der aufgenommenen Elektronenzahl sein (Elektroneutralitätsbedingung). Man benötigt daher 2 Aluminium-Atome, die zusammen 2*3= 6 Elektronen abgeben und von 3 Sauerstoffatome zu je 2 Elektronen aufgenommen werden. Leite die Formel aus der Stellung der Elemente Aluminium und Sauerstoff im Periodensystem ab. Schreibe die Formel des Aluminiumoxids mit den zugehörigen formalen Ladungen. Die Formel mit formalen Ladungszahlen lautet Was versteht man unter dem Begriff Ionenladungszahl? Ionen sind tatsächlich unter bestimmten Bedingungen existierende geladene Teilchen. Anders als die formale Oxidationszahl, die nur der Berechnung bei Redox-Vorgängen dient, gibt die Ionenladungszahl die elektrisch messbare Ladung eines Teilchens an. Unter welchen Bedingungen können häufig Ionen auftreten und ihre Ionenladungszahl gemessen werden? Ionen können in Schmelzen von Salzen auftreten oder beim Lösen von Salzen in Wasser (polares Lösemittel). 103d Rund ums Atomsymbol Wo findet man bei einem Elementsymbol die Angabe der Ionenladung? Formuliere eine Reaktionsgleichung, die das Auftreten von Ionen bei der Schmelze von Aluminiumoxid beschreibt. Formuliere eine Reaktionsgleichung, die das Auftreten von Ionen beim Lösen von Aluminiumsulfat in Wasser (aq) beschreibt. Was wird durch die eckige Klammer in einer Verbindungsformel symbolisiert? Finde aus der Formel des Aluminiumsulfats und Grundkenntnissen des Periodensystems die formalen Oxidationszahlen der beteiligten Atome. Erläutere das Zustandekommen der Ionenladungszahl 2- für Sulfat © 2005-2007 HMTC Halbmikrotechnik Chemie GmbH; Lernkartei 08.04.17 08.04.17 103d Rund ums Atomsymbol Die Ionenladung eines Atoms oder einer Gruppe von Atomen schreibt man hochgestellt hinter das Elementsymbol oder die Gruppe. Dabei stellt man die Anzahl der Ladung in arabischen Ziffern der Ladungsart voran. Durch Zufuhr von Energie (+E) beim Schmelzen dissoziert das Aluminiumoxid in zwei dreifach positiv geladene Ionen (Kationen) und drei zweifach geladene Sauerstoffionen (Anionen). Beim Auflösen von Aluminiumsulfat in Wasser dissoziert das Salz in zwei dreifach geladene Aluminiumionen und drei zweifach geladene Sulfationen. Die Ionen sind von einer nicht näher beschriebenen Anzahl Wassermoleküle hydratisiert. Eine eckige Klammer in einer Verbindungsformel bezeichnet eine Gruppe von Atomen, die einen sogenannten Komplex bilden. Ein Komplex ist eine, meistens elektrisch geladene, Atomgruppe, die fester als der Rest miteinander verbunden ist. Elemente der ersten drei Hauptgruppen sind Metalle (Ausnahme H) und geben fast immer die maximal mögliche Anzahl von Elektronen ab; Folge: Aluminium ist formal dreifach positiv. Sauerstoff nimmt fast immer zwei Elektronen auf; Folge: Sauerstoff ist formal zweifach negativ. Sauerstof ist im Komplex an Schwefel gebunden, Folge: Schwefel lädt sich formal sechsfach positiv auf. Die Sulfatgruppe hat die Ionenladungszahl 2-. Letzte Änderung 06.08.2007 08.04.17