Die meisten Elemente die schwerer sind als Wasserstoff bis hin zum
Werbung

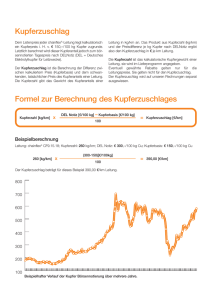
GOLD AURUM Au Symbol: Au (aurum) Ordnungszahl: 79 Massenanteil an der Erdhülle: 0,004 ppm (4 g/1.000 t Gestein) 3 Dichte: 19,3 g/cm Mohshärte: 2,5 bis 3 Schmelzpunkt: 1.064,18 °C Ursprung des irdischen Goldes Die meisten Elemente die schwerer sind als Wasserstoff bis hin zum Eisen (siehe Periodensystem) entstehen unter Energieabgabe durch Kernfusion im Inneren von Sternen. Das auf der Erde vorkommende Gold ist – wie alle Elemente, die schwerer sind als Eisen – bei einem Supernova-Kernkollaps unseres Sonnenvorgängers unter Energieaufnahme entstanden. Solange die frühe Erde noch keine feste Kruste hatte, wanderte alles Gold aufgrund seiner hohen Dichte in den Erdkern. Wir finden heute nur noch Gold, welches nach der Krustenbildung auf die Erde gelangte oder durch vulkanische Prozesse wieder an ihre Oberfläche kam. Die Gier nach Gold ... wurde mit der Vormachtstellung der europäischen Seemächte Spanien, Portugal, England und Italien zu einem maßgeblichen Grund für Kriege und Eroberungszüge der Neuzeit. Besonders der Goldreichtum Mittel- und Südamerikas lockte nach deren Entdeckung im Jahre 1492 europäische und insbesondere spanische Eroberer an. Ganze Schiffsladungen des Edelmetalles erreichten Spanien, das dadurch eine Zeit lang zu den reichsten Länder Europas gehörte; die indigenen Kulturen hingegen wurden durch die »Conquistadores« bzw. durch eingeschleppte Krankheiten zum Großteil zerstört. Gold von indogermanisch »ghel«: glänzend, gelb Immer wieder lockten Goldfunde große Scharen von Abenteurern an. Im 19. Jahrhundert kam es auf verschiedenen Kontinenten zu »Goldrausch« genannten Massenbewegungen von Glücksrittern in die Gebiete mit großen Vorkommen. Beispiel hierfür ist der kalifornische Goldrausch im Jahre 1849. Auch heute führt ein schwankender Goldpreis in manchen Regionen der Welt ( z.B. Südafrika, Brasilien) zu bedeutenden sozialen Veränderungen. Dr. Peter Unfried Das derzeit geförderte Gold wird zu etwa 85% zu Schmuck verarbeitet, 12% verwendet die Industrie (Elektronik, Medizin, Optik). Die restlichen 3% gelangen als Währungsdeckung in die Tresore von Zentralbanken. GOLD Goldpreis pro Feinunze (31,1 g) nominal Monatsdurchschnittswerte in US-Dollar 2.000 1.750 1.500 1.250 1.000 750 500 250 0 1970 1980 1990 2000 2010 15 Q.: London Bullion Market Association. © 2016 Österreichisches Gesellschafts- und Wirtschaftsmuseum GOLD AURUM Au Vitrine A B GOLD AURUM Au Fach A 3 5 1 2 4 1. Größerer Ring (1983) Während Laborarbeiten mit Quecksilber (Hg) getragen. Täglich wurde der Ring oberflächlich amalgamiert und durch den „Abrieb“ immer dünner. Nach ½ Jahr erfolgte dann plötzlicher Bruch des Ringes ... Kleinerer Ring (1983): Nie getragen ! 2. Goldschmuck Orientalischer Schmuck ist meist aus hochkarätigem Gold (Armband und Kugel, 24kt = „Feingold“; Persien) Europäischer Schmuck etwas dünkler (18-20 kt) 3. Mit „Echt-Gold“ vergoldete Gläser und Gegenstände 4. GOLD (Au) auf QUARZ Laznica/Serbien 5. „Modeschmuck“ Fast immer Messing (Cu/Zn) mit unterschiedlichem Gehalt an Zink und Nickel (Ni). Dadurch ergeben sich die farblichen Unterschiede … GOLD AURUM Au Fach B 6 7 8 6. Amalgamverfahren Goldgewinnung unter ausnützen der Legierungsbildung zu Amalgam zwischen Gold und Quecksilber. Im Dschungel von Nord-Venezuela: Goldhaltige Sande und Schlämme werden (im Flußschlamm sitzend) in einer Goldwaschschüssel stundenlang intensiv mit Quecksilber vermischt. Das Gold löst sich dabei im Quecksilber. Durch kreisende Bewegung der Schüssel wird der Schlamm immer wieder über der Schüsselrand geschlämmt und erneuert. Goldamalgam hat eine silberne Farbe; je nachdem, wie viel Quecksilber im Überschuss vorliegt, ist es flüssig bis pastös teigig. Das teigige Amalgam schwimmt am überschüssigen Quecksilber am Schüsselboden. und die Amalgambrocken werden nach einigen Stunden vom Quecksilber abgeschöpft. Auf einer Schaufel überm Lagerfeuer werden die nussgroßen Amalgambrocken so lange erhitzt, bis es „nicht mehr nach Quecksilber riecht….“! Zurück bleibt kompaktes Rohgold. Das Quecksilber dampft dabei in die Umgebungsluft ab und kondensiert alsbald in der Umwelt, was zur Quecksilberverseuchung dieser Landstriche, der Flüsse und der dort lebenden Menschen führt. Es wurde geschätzt, dass 20 bis 30 Prozent des weltweit geförderten Goldes durch nicht industrielles Schürfen, also von Goldsuchern gewonnen wird. 7. Gold(III)-chlorid AuCl3 Ehering (ca. 3g Au) in Königswasser (HCl/HNO3) aufgelöst 8. Goldwaschen Einfachstes Verfahren zur Goldgewinnung. Goldhaltiger Sand mit Wasser aufgeschlämmt. Da Gold schwerer ist als der umgebende Sand, setzt sich das Gold schneller am Boden ab und kann so abgetrennt werden. MINERALIEN Vitrine A B C MINERALIEN Fach A 1 2 3 5 4 1. SILIZIUM (Treibacher Chemische Werke) Si Künstlich hergestellt zum Zulegieren 2. PYRIT FeS2 Navajun/Spanien 3. KUPFER gediegen Cu Ajo Pima Co./Arizona 4. MESOLITH Na2Ca2[Al6Si9O30].8H2O 5. GALENIT PbS Joplin/Missouri, USA 6. ZINNOBER, »Lebererz« HgS Izria/Jugoslawien 6 MINERALIEN Fach B 8 9 10 7 7. ACHAT-Scheibe SiO2 Arizona/USA 8. SELENIT, »Marienglas« CaSO4.2H2O Marambaia/Brasilien 9. ARAGONIT CaCO3 Erzberg/Stmk., Österreich 10. MALACHIT Cu2[(OH)2CO3] Kongo/Afrika 11. AZURIT Cu3[(OH)2(CO3)2] Katanga/Zaire, Afrika 11 MINERALIEN Fach C 14 12 16 13 12. HÄMATIT Fe2O3 Cumberland/England 13. AMAZONIT mit RAUCHQUARZ K[AlSi3O8] + SiO2 Konso, Provinz Sidamo/Äthiopien 14. »SANDROSE« Sandkörner in Gips oder Baryt eingelagert El Queed/Algerien 15. AMETHYST SiO2 + (Al, Fe, Ca, Mg, Li, Na) Catalan Grande/Uruguay 16. RAUCHQUARZ mit CHLORIT SiO2 + (Fe, Mg, Al, Zn)6(Si, Al)4O10(OH)8 Kolmkar/Rauris in Salzburg, Österreich 15 GLAS Vitrine A B C GLAS Fach A 5 6 2 1 1. Grüner Stil: Fe (II), (Mn) 2. Gelb: Cr, Fe (III) Rot: Cu, (Co, Fe, As) Blau: Cu, Fe, As (Ni) 3. Gelbgrün : Cr, (Pb) 4. Grüner Boden: Fe (II), As, (Ni) Rosa Hals: Fe, As, Se, (Fe, Ni) 5. Dunkelrot: Cu, Fe (Pb) 6. Rot: As, Se, Fe (III), (Zn, Cd, Co) 3 4 GLAS Fach B 10 12 13 7 8 9 7. Blaugrün: Cu, (As, Pb) 8. Rosa: Se, (Fe, Ni) 9. Glasfärbung durch Aufdampfen von Metallen Gelblich: Silber (Ag) Rötlich: Gold (Au) 10. Braun: Mn, (Fe) 11. Dunkelblau: Co, (Fe) 12. Blau: Fe (II), As, (Zn) 13. »Bleiglas« farblos: Pb, K 11 GLAS Fach C 19 15 17 14 20 16 14. Glaskolben von innen mit Silber (Ag) verspiegelt 15. Dunkelrosa: Mn, (Pb) 16. „URAN-GLAS“, grünliches Gelb: U (fluoresziert stark im UV-Licht) 17. Blau: Cu, (Ba, Ca) 18. GLASPERLEN Violett: Nd Grün: Pr Rosa: Er 19. Dunkles Rot: Cu, As, (Pb) 20.Grün: Cu, (Pb) 21. Die Farben unserer Bier- und Weinflaschen grün: Fe(II), braun: Fe(III) 18 21 KOHLENSTOFF CARBONEUM C Symbol: C (Carboneum) Ordnungszahl: 6 Massenanteil an der Erdhülle: 0,087 % 3 Dichte: 2,26 g/cm Mohshärte: 0,5 bis 10 Sublimationspunkt: 3.642 °C Kohlenstoff kommt in der Natur sowohl in gediegener (reiner) Form (Diamant, Graphit) als auch chemisch gebunden (z. B. in Form von Carbonaten, Kohlenstoffdioxid, Erdöl, Erdgas und Kohle) vor. Es gibt aber noch weitere Formen elementaren Kohlenstoffs: Amorpher Ruß, so wie wir ihn von unvollständigen Verbrennungen C-hältiger Substanzen kennen, und das erst 1970 künstlich synthetisierte »Fulleren«. Ein Fulleren-Molekül besteht aus exakt 60 C-Atomen, die, so wie die Ecken bei einem Fußball, miteinander verbunden sind. Diamant Aufgrund seiner besonderen Elektronenkonfiguration besitzt Kohlenstoff die Fähigkeit zur Bildung komplexer Moleküle und weist von allen chemischen Elementen die größte Vielfalt an Verbindungen auf. Kohlenstoffverbindungen bilden die molekulare Grundlage allen irdischen Lebens. Fulleren Braunkohle Die einfachsten und wichtigsten C-Verbindungen sind solche mit Sauerstoff (z.B. Kohlendioxid), mit Wasserstoff (kettenförmige Alkane wie Methan, ringförmige wie Benzol) und mit Wasserstoff + Sauerstoff (z.B. Alkohole, Zucker, Ketone, Fette, Alkaloide) H H C C C C C H H H H Benzol C H H Methan H H H C C H H O H Ethanol H Dr. Peter Unfried H C KOHLENSTOFF CARBONEUM C Bild 1 Bild 2 Bild 3 KOHLENSTOFF CARBONEUM C Bild 1 A B C Vitrine KOHLENSTOFF CARBONEUM C Bild 1 Fach A 1 2 1. Graphit-Sintermaterial (für Hochtemperaturexperimente) Bei einer Temperatur von über 2500 °C wird Graphit plastisch verformbar und sublimiert in einer sauerstofffreien Umgebung bei einer Temperatur von 3750 °C. Hervorragender Werkstoff zur Herstellung von Kathoden und Tiegel für extreme Temperaturen. 2. Anthrazit Fundort: Rumänien KOHLENSTOFF CARBONEUM C Bild 1 Fach B 4 3 3 3. Polyethylen („PE“) H n H C C H H H H H H H H C C C C C C H H H H H H Polyethen Ethen 4. „Styropor“ (Polystyrol) gewinnt man durch die Polymerisation von monomerem Styrol. Das Rohpolymerisat liegt als Flüssigkeit vor, die aushärten kann und kommt als Granulat in den Handel. Das Granulat (expandierbares Polystyrol) erhält während der Polymerisation zu festen Kügelchen Gaseinschlüsse. Werden die Kügelchen dann unter Wasserdampf etwas über 100 °C erwärmt, expandiert das Gas und der thermoplastische Kunststoff bläht sich auf. Die Ränder der Blasen verschmelzen. Zurück bleibt ein Feststoffkörper, der je nach Form, in der der Prozess stattgefunden hat, als Platte oder bis hin zum geometrisch komplizierten Verpackungsteil, erscheint. H n C H C H Styrol H H H H H H C C C C C C H Polystyrol H H KOHLENSTOFF CARBONEUM C Bild 1 Fach C 6 5 5. Papier („Zellulose“) Papier besteht hauptsächlich aus Cellulosefasern, die wenige Millimeter bis zu einigen Zentimetern lang sind. Die Cellulose (häufig auch „Zellulose“) ist der Hauptbestandteil von pflanzlichen Zellwänden (Massenanteil etwa 50 %) und damit die häufigste organisch Verbindung und auch das häufigste Polysaccharid (Vielfachzucker). HO O OH HO O O O H OH 6. Alkohol („Ethanol“) H H H C C H H H O O OH H O O HO O OH O n KOHLENSTOFF CARBONEUM C Bild 2 A B C Vitrine KOHLENSTOFF CARBONEUM C Bild 2 Fach A 3 1 2 1 1. Karbonisiertes Holz 2. Braunkohle („Lignit“) Fundort: Krassowa 3. Torf karbonisiert Fundort: Oberösterreich 3 2 KOHLENSTOFF CARBONEUM C Bild 2 Fach B 5 1 4 2 4. „Wachs“ (Paraffin) bezeichnet ein Gemisch aus acyclischen Alkanen (gesättigten Kohlenwasserstoffen) mit der allgemeinen Summenformel CnH2n+2. 5. Benzol („Benzen“) wird in der Petrochemie für die Synthese vieler Verbindungen gebraucht, vorwiegend Ethylbenzol (52 %), Cumol (20 %), Cyclohexan (13 %) und Nitrobenzol (9 %); (Quelle: Wikipedia). Diese Verbindungen sind wiederum Ausgangsstoffe zur Synthese von Verbindungen, wie Styrol, Phenol, Aceton, Cyclohexanol, Cyclohexanon und Anilin. Auf ihnen basieren Kunststoffe, wie Polystyrol, Styrol-Butadien-Kautschuk, Polyamide (Nylon) und Epoxidharze. Viele weitere Produkte basieren auf Benzol bzw. auf den Folgeprodukten H H H C C C C C C H H H KOHLENSTOFF CARBONEUM C Bild 2 Fach C 1 7 2 6 6. Zucker CH2OH O OH CH2OH O HO CH2OH O OH OH OH 7. Stärke ist „zuckerähnlich“ und zählt als Polysaccharid mit der Formel (C6H10O5)n zu den Kohlenhydraten. CH2OH O OH O CH2OH O O OH OH CH2OH O O OH O OH O OH O OH O OH KOHLENSTOFF CARBONEUM C Bild 2 Fach C 1 2 8 8. Polyethylenterephthalat („PET“) „PET“ hat vielfältige Einsatzbereiche und wird unter anderem zur Herstellung von Kunststoffflaschen (PET-Flaschen), Folien und Textilfasern verwendet. Die weltweite Produktion liegt bei 40 Millionen Tonnen im Jahr. O O C C O ( CH2 )4 O n KOHLENSTOFF CARBONEUM C Bild 3 A B C Vitrine KOHLENSTOFF CARBONEUM C Bild 3 Fach A 3 2 1 4 1. Steinkohle Fundort: Steierdorf 2. Holzkohle Der Weg vom Holz zur Kohle („Inkohlung“): Als „Inkohlung“ wird der natürliche Prozess der Entstehung von Kohle bezeichnet. Die Inkohlung führt in Zeiträumen von Jahrmillionen von frischem Pflanzenmaterial zu Torf, dann über Braunkohle und Steinkohle zum Anthrazit, in einzelnen Fällen sogar zum Graphit. Der Anteil an Wasser und flüchtigen Bestandteilen nimmt dabei laufend ab, so dass der relative Anteil an Kohlenstoff zunimmt, der im Graphit nahezu 100 % beträgt. 4. Pfeil aus „Carbon-Faser“ Kohlenstofffasern werden aus organischen Ausgangsmaterialien hergestellt. Es kommen in erster Linie solche Verbindungen in Frage, die sich zunächst in eine unschmelzbare Zwischenstufe umwandeln lassen und anschließend unter Formerhalt in einem Pyrolyseprozess zum Kohlenstoff carbonisiert werden können. Durch Verstreckung (Anlegen einer Zugspannung) bei diesem Temperaturbehandlungsschritt lässt sich die Orientierung der atomaren Struktur in den Fasern so verändern, dass bei der Carbonisierung höhere Festigkeiten und Steifigkeiten der Fasern erreicht werden. Bei dieser Carbonisierungsbehandlung werden alle Elemente bis auf den Hauptanteil Kohlenstoff gasförmig abgespalten. Der relative Kohlenstoffanteil steigt mit zunehmender Temperatur, die üblicherweise im Bereich von 1300-1500 °C liegt. Damit wird ein Kohlenstoffanteil von 96 bis 98 Gewichtsprozenten erreicht. 4. Bitumen Rückstand der Vakuumdestillation von Rohöl. Einblasen von Luft macht Bitumen viskoser. Die Viskosität kann so auf den Bedarf eingestellt werden ... (ÖMV/Raffinerie Schwechat) KOHLENSTOFF CARBONEUM C Bild 3 Fach B 5 5. Polypropylen („PP“) H n C H H H H H H H H C C C C C C C CH3 H C H3 H C H3 H C H3 Propen Polypropylen KOHLENSTOFF CARBONEUM C Bild 3 Fach C 6 7 6. Öle bzw. Fette sind Gemische von Fettsäuretriglyceriden (Verbindungen zwischen Glycerin und „Höheren Fettsäuren“; sog. Ester), die bei Raumtemperatur flüssig (Öle) oder fest (Fette) sind. O O R1 R2 O O O R3 O 7. Essig („Essigsäure“) H H C H O C O H KOBALT COBALTUM Co Symbol: Co (Colbaltum) Ordnungszahl: 27 Massenanteil an der Erdhülle: 37 ppm (37 g/1.000 t Gestein) 3 Dichte: 8,90 g/cm Mohshärte: 5,0 Schmelzpunkt: 1.495 °C Geschichte Kobalterze und Kobaltverbindungen sind schon seit sehr langer Zeit bekannt und fanden vorwiegend zum Färben von Glas und Keramik Verwendung (Kobaltblau). Im Mittelalter wurden sie häufig für wertvolle Silber- und Kupfererze gehalten. Da sie sich aber nicht verarbeiten ließen und wegen des Arsengehalts beim Erhitzen schlechte Gerüche abgaben, wurden sie als »verhext« angesehen. Angeblich hätten Kobolde das kostbare Silber aufgefressen und an seiner Stelle wertlose, silberfarbene Erze ausgeschieden. Die stärksten Permanentmagnete der Welt Viele Jahrzehnte waren »Ferromagnete« (Eisenmagnete) die Permanentmagnete schlechthin. Kopfhörer und leistungsstarke Lautsprecher waren, bedingt durch deren relative Schwäche, groß und schwer. In den 1970er Jahren eröffneten die weitaus stärkeren »SamariumKobalt-Fünf-Magnete« (SmCo5) den ersten Schritt in Richtung »Verkleinerungstechnologie«. Mobile Telefone konnten wesentlich kompakter gebaut werden und begannen ihren Siegeszug. Mikromotoren revolutionierten den Fahrzeugbau. 1982 wurde die neuartige Legierung »Neodym-Eisen-Bor« (Nd2Fe14B) als noch viel stärker magnetisierbar gefunden. Es handelt sich dabei – bis heute – um die stärksten Permanentmagnete der Welt. Somit begann der zweite Schritt der »Verkleinerungstechnologie« und brachte etwaewinzige »Schrittmotoren« (Modellbau, Fahrzeugbau, Roboter), extrem leistungsfähige Stromgeneratoren (Windräder), die kleinsten Kopfhörer und winzige Displays mit extrem hoher Auflösung etwa für Handys und Digitalkameras hervor. »Samarium-Kobalt-Fünf«-Magnete (SmCo5) Vitamin B12 (Cobalamin) Dr. Peter Unfried Cobalamine sind organometallische Verbindungen und die bisher einzigen bekannten kobalthaltigen Naturstoffe. Sie kommen in allen Lebewesen vor und werden auch als Vitamin-B12-Gruppe bezeichnet. Vereinfachend zusammengefasst ist Vitamin B12 wichtig für die Zellteilung und Blutbildung sowie für die Funktion des Nervensystems. Ein Mangel davon führt demzufolge zu einer Erkrankung bzw. Schädigung der genannten Bereiche. Der menschliche und tierische Organismus sowie Pflanzen sind nicht in der Lage Vitamin B12 selbst herzustellen. Vitamin B12 wird in der Natur von Mikroorganismen – insbesondere Bakterien – produziert, die als Symbionten sowohl im Verdauungstrakt von Tieren als auch auf der Oberfläche pflanzlicher Wirte vorkommen. Kobalt (Co), Lithium (Li), Neodym (Nd) – Gefragter als Gold? Elektroautos sollen Europa Separator unabhängiger vom Öl aus dem + Nahen Osten machen. Doch für die Laden Batterien der neuen Vehikel brauchen die Hersteller Rohstoffe, von denen viele fast nur im Kongo, in China und in Bolivien zu finden sind. Vor allem werden Lithium-IonenEntladen Akkumulatoren verwendet, die auch in Laptops und Mobiltelefonen zum Cu Al Einsatz kommen. Als Anodenmaterial Elektrolyt Sauerstoff Lithium-Ion enthalten sie unter anderem Kobalt. Grafit Kobalt/Nickel Nach Schätzungen könnte der globale Lithium-Ionen-Akkumulatoren Rohstoffbedarf an Kobalt allein durch die steigende Nachfrage nach LithiumIonen-Akkumulatoren bis zum Jahr 2030 um ein Vielfaches steigen. Daraus resultierende Engpässe bei der Verfügbarkeit von Kobalt seien nur zu vermeiden, indem die weltweiten Förderkapazitäten rechtzeitig und in ausreichendem Umfang erweitert werden. Das Problem: Dr. Peter Unfried Kobalt-Gräber im Kongo Kobalt muss nach Europa importiert oder durch Recycling aus Schrott gewonnen werden. Ein Teil der Bestände liegt in Australien, Kanada und den USA, das meiste jedoch in Afrika (Kongo, Sambia). Etwas besser ist die Verfügbarkeit von Lithium. Doch auch hier braucht Europa Importe, vor allem aus Argentinien, Bolivien und Chile, wo sich rund 80 Prozent der Lithiumreserven finden. Der marktbeherrschenden Stellung weniger Unternehmen, die das Leichtmetall fördern und verkaufen, kann nur verstärktes Recycling entgegengesetzt werden. Bolivien alleine besitzt 40 Prozent der gesamten Weltreserven, die vor allem in einem Salzsee namens Salar de Uyuni lagern. Die heißbegehrten Abbaurechte befinden sich zumindest teilweise in staatlicher Hand. Wegen der steigenden Produktion von Elektromotoren ist auch mit einem wachsenden Bedarf an Aluminium, Kupfer und dem Seltenerdmetall Neodym zu rechnen. Fachleute gehen davon aus, dass die Nachfrage nach Neodym um das Dreifache zulegen wird. Dieses Seltenerdmetall kommt jedoch fast ausschließlich aus China und das Land hat großes Interesse daran, diesen Rohstoff zu behalten und selbst zu verarbeiten. KOBALT COBALTUM Co Vitrine A B C KOBALT COBALTUM Co Fach A 3 1 2 1. Exsikkator Laborgerät aus dickwandigem Glas zum Trockenen von Präparaten. Im unteren Teil befindet sich das Trockenmitten (hier z.B. blaues Silikagel), im oberen Teil ist die zu trocknende Substanz. Der Trocknungsvorgang dauert zumeist viele Stunden bis Tag … 2. „Silikagel“ (Silikat-Gel) Diese Kieselsäuregel-Kügelchen sind in der Lage, durch ihre feinen Poren und Kanäle Wasser aufzunehmen und festzuhalten (Verwendung als Trockenmittel). Sie geben das aufgenommene Wasser bei ca. 110°C wieder ab – das Trockenmittel ist „regenerierbar“. Als Indikator dient eingeschlossenes Kobalt(II)-chlorid CoCl2. Mit viel Wasser ist es rosa gefärbt (Trockenmittel muss regeneriert werden), mit wenig Wasser ist es blau (Trockenmittel ist aufnahmefähig für Wasser). 3. Der „stärkste Magnet der Welt“ und Eisen im Sand eines Badestrands … Der Sand an der fast 30 km langen „Beach“ von Baia di Gaeta (nördlich von Napoli/Italien) ist relativ schwer, stellenweise dunkelschwarz gefärbt und enthält bis zu 10% Magnetit. Der hier ausgestellte Magnet (Neodym-Eisen-Bor) ist „der stärkste Magnet der Welt“ und zieht mühelos diese Magnetit-Anteile aus dem Sand … Anm.: Fast jeder hat so eine Nd/Fe/B-Magnet bei sich! z.B. im winzigen Knopf-Ohrenhörer vom iPhone … KOBALT COBALTUM Co Fach B 8 6 5 4 7 4. Reinstes „Kobalt-Glas“ Die „Flammenfärbung“ ist eine klassische Methode der Analytik. Natrium färbt die Flamme gelb, Kalium blau. Da die Gelbfärbung des Natriums viel intensiver ist als die Blaufärbung des Kaliums, ist es unmöglich Kalium neben Natrium so nachzuweisen. Betrachtet man die Flamme durch das „Kobaltglas“, wird das Gelb des Natriums absorbiert und man sieht nur mehr das Blau des Kaliums. Der Nachweis ist also doch möglich … 5. PORZELLANSCHALE für „Chemische Laborsynthesen“ mit KOBALT-LASUR 6. GLASKRUG Grüner Teil: Cu, (Zn, Co) Blauer Teil: Co, (Zn, Fe) Das »schönste« Blau in Gläsern und in Keramik wird durch Kobalt erzeugt. Reines Kobalt (Co) in Glas gibt tief-dunkles »Kobaltblau«. Durch geringe Beimengungen von Eisen Fe(II) und/oder Kupfer (Cu) werden Nuancen ins Grünliche erzeugt. 7. KREUZ Blaues Glas: Co, Fe, (Cu, Zn, Pb, Zr) 8. „Smalte“ SiO2.K2O.CoO Als Vorläufer des Kobaltblau das älteste bekannte Kobaltpigment. Erste Anwendungen bereits im alten Ägypten. Die mittelalterliche venezianische Blauglasherstellung beruht ebenfalls auf der Verwendung von Smalte. Im 15. Jahrhundert gewann Smalte in der europäischen Tafelmalerei an Bedeutung. In der Malerei des Barock war es für Himmelsdarstellungen bedeutsam. Die bedeutendste Produktionsstätte für Smalte befand sich ab dem 16. Jahrhundert in Schneeberg in Sachsen, so dass die sächsischen Kurfürsten für längere Zeit einen Großteil der mitteleuropäischen Smalteproduktion kontrollierten. Bei der Papierherstellung wurde Smalte früher als Weißmacher benutzt. KOBALT COBALTUM Co Fach C 11 9 10 13 12 9. Bis-ethylendiammin-dinitro-cobalt(III)-nitrat [Co(en)2(NO2)2]NO3 („en“ = ethylendiamin) 10. Cobalt(II)-oxicarbonat Co2OCO3 Cobalt(II)-carbonat und Cobalt(II)-oxicarbonat werden als Katalysator und Pigment verwendet und sind in Keramikglasuren als Farbstoff (blau) enthalten 11. Pentammin-chloro-cobalt(III)-dichlorid [Co(NH3)5Cl]Cl2 Neben den Amminkomplexen existieren eine Vielzahl von Verbindungen mit unterschiedlichen Liganden. Beispiele sind das Kaliumhexacyanocobaltat(II) (K4[Co(CN)6]), das Kaliumtetrathiocyanatocobaltat(II) (K2[Co(SCN)4]), das Kaliumhexanitritocobaltat(III) (Fischers Salz, Cobaltgelb), sowie Komplexe mit organischen Liganden wie Ethylendiamin oder dem Oxalation. 12. Cobalt(II)-sulfat-heptahydrat CoSO4.7H2O Cobalt(II)-sulfat wird zur Herstellung von Pigmenten, Glasuren, in der Porzellanmalerei, zur Tonung von Papieren (Fotografie) verwendet. Zudem wurde das Salz in den 1960er-Jahren Bier beigemischt, um die Stabilität des Schaumes zu erhöhen. 13. Cobalt(II)-oxalat (COO)2Co KUPFER CUPRUM Cu Symbol: Cu (Cuprum) Ordnungszahl: 29 Massenanteil an der Erdhülle: 0,01 % Dichte: 8,92 g/cm³ Mohshärte: 3,0 Schmelzpunkt: 1.084,62 °C Verwendung als Metall Wegen seiner extrem hohen Leitfähigkeit wird reines Kupfer vorwiegend für elektrische Leitungen verwendet. Die hervorragenden Legierungseigenschaften als Bestandteil von Messing (Kupfer + Zink) bzw. Bronze (Kupfer + Zinn) sind schon seit Jahrtausenden bekannt. in Verbindungen Breite Anwendung findet Kupfer in Farbpigmenten (vorwiegend blau und grün), im Pflanzenschutz als Fungizid (Weinbau) und in der Pharmazie. Kupfer-Strangguss-Stücke Beständigkeit Neben der hohen elektrischen Leitfähigkeit oder den prächtigen Farben der diversen Verbindungen, besticht Kupfer durch eine weitere wesentliche Eigenschaft: Metallisches Kupfer ist in herkömmlicher (feuchter) Atmosphäre ziemlich korrosionsbeständig. Im Laufe der Zeit bildet sich eine grüne Schicht, die »Patina« (Kupfercarbonat/-sulfat/-chlorid/ -hydroxid-Gemisch), die vor weiterer Verwitterung schützt. Karlskirche, Kupferdach mit »Patina« Dehnbarkeit, Walzbarkeit Dr. Peter Unfried Kupfer und Kupferlegierungen lassen sich hervorragend schmelzen, gießen und plastisch verformen. Als ältestes bekanntes Metall der Menschheit war es mit seiner leichten Bearbeitbarkeit ein Segen für unsere Vorfahren. Da es mit modernen Methoden leicht gelötet und geschweißt werden kann, gilt es als »Allroundmaterial« und ist mittlerweile z.B. im Heizungsbau konkurrenzlos (früher: verzinkte Eisenrohre, Gewindeschneiden, Einhanfen usw.). KUPFER CUPRUM Cu Kupfergewinnung »Einst und Jetzt« Der Zeitraum 5.000-3.000 v.Chr. (Jungsteinzeit) wird von den Historikern »Kupfer-Zeit« genannt. Das erste Kupfer wurde aus Malachit und Azurit durch thermische Reduktion mit Holzkohle gewonnen (»Vinca-Kultur« im heutigen Serbien, ca. 5.000 v. Chr.). Das so gewonnene Kupfer war zwar nicht »waffenfähig«, weil viel zu weich, aber für Haushaltsartikel und Schmuck sehr willkommen. Das gemeinsame Reduzieren von Kupfer- und Zinnerzen ergab die viel härtere und waffenfähige Bronze. Dies gab der »Bronze-Zeit« von etwa 2.200-800 v.Chr. ihren Namen. Messing (Kupfer + Zink) liegt in der Härte zwischen Kupfer und Bronze und wurde bereits von den alten Römern in großem Maßstab durch »Zusammenschmelzen« hergestellt. Heute wird Kupfer aus dem Erz »Kupferkies« (CuFeS2) durch »Rösten« (Erhitzen und Zusatz von Koks und Sauerstoff) gewonnen. Pyrometallurgie Bei der pyrometallurgischen Raffination (thermische Verarbeitung) werden Erze bzw. Metalle geschmolzen und bei Temperaturen von etwa 1.200°C gereinigt. Im Schachtofen werden niedrig kupferhältige Materialien (wie Shredderkupfer, Cu-Fe-Material) zusammen mit Koks, Quarz und Kalk vermengt. Das so entstandene »Schwarzkupfer« mit einem Kupferanteil von ca. 75 % wird zusammen mit Legierungsmaterialien wie Messing, Bronze und Rotguss im Konverter weiterverarbeitet. Dabei werden mit Hilfe von Sauerstoff die Metalle Blei, Zinn und Zink als Mischoxid abgeschieden. Die aus dem Konverter gewonnene Schmelze besteht bis zu 96 % aus Kupfer und kommt zur weiteren Reinigung in den Anodenofen. Die fertige Schmelze aus dem Anodenofen enthält ca. 99 % Kupfer und wird zu Anodenplatten vergossen. Dr. Peter Unfried Dieses »Rohkupfer« wird durch Elektrolyse zum »Feinkupfer« raffiniert. KUPFER DIE SCHÖNSTEN FARBEN DES KUPFERS Kupfer(I)oxid Cu2O Azurit Cu3 (OH)2 (CO3)2 Malachit Cu2 (OH)2 CO3 Kupferdraht Dr. Peter Unfried Kupfersulfat CuSO4 5H2O KUPFER CUPRUM Cu Vitrine A B C KUPFER CUPRUM Cu Fach A 1 1. „Halbzeug“ und Drehspäne aus Kupfer Cu (Mechanische Werkstätten der Chemischen Fakultät / Uni-Wien) 2. „Halbzeug“ und Drehspäne aus Messing Cu /Zn –Legierung (Mechanische Werkstätten der Chemischen Fakultät / Uni-Wien) 2 KUPFER CUPRUM Cu Fach B 11 12 9 4 bis 8 3 10 13 3. ATACAMIT Cu2(OH)3Cl Copiapo/Chile 4. KUPFER gediegen Cu Ray Mine »Pinal Co.«/Arizona, USA 5. ROTKUPFERERZ (CUPRIT) Auf gediegenem Kupfer CuO2 Calama/Chile 6. MALACHIT Cu2[(OH)2CO3] Bou-Beker/Marokko 7. KUPFERHÄLTIGE SCHLACKE Aus einem Schmelzofen bei der Kopphütte Prähistorischer Bergbau Illyrer, 1800-800 v. Chr.) Mühlbach am Hochkönig/Österreich 8.BORNIT, BUNTKUPFERKIES Cu5FeS4 Bisbee/Arizona, USA 9. CuCO3 10. KUPFERKIES (Chalkopyrit) auf Quarz CuFeS2 Cavnica/Rumänien 11. Kupfer(I)-aluminiumalaun CuAl(SO4)2.12H2O 12. „Schweinfurter Grün“ Cu(CH3COO)2.3Cu(AsO2)2 Schweinfurter Grün fand im 19. Jahrhundert als Malerfarbe Verwendung. Es wurde wegen seiner Farbintensität und Lichtechtheit geschätzt, allerdings war seine Giftigkeit schon früh bekannt. In der zweiten Hälfte des 19. Jahrhunderts bis etwa zur Mitte des 20. Jahrhunderts wurde es als eines der ersten Pflanzenschutzmittel eingesetzt. 14 15 13. Kupfer-Pulver, hochrein Cu 14. „Schwarzes“ Kupfer(II)-oxid CuO Kupfer(II)-oxid adsorbiert leicht Sauerstoff, Stickstoff, Kohlendioxid und andere Gase. Beim Erhitzen über etwa 800 °C wird Kupfer(II)-oxid unter Sauerstoffabgabe zu Kupfer(I)-oxid reduziert. Kupfer(II)-oxid wird als Pigment zum Färben von Glas, Keramik, Porzellan und künstlichen Edelsteinen verwendet. Daneben findet es Anwendung als Kathodenmaterial in Batterien, als Katalysator, zur Entschwefelung von Erdöl und für fäulnishemmende Anstriche. 15. „Rotes“ Kupfer(I)-oxid Cu2O Kupfer(I)-oxid wird beim Erhitzen schwarz, nimmt jedoch nach dem Abkühlen wieder seine ursprüngliche Farbe an. Kupfer(I)-oxid wird für fäulnishemmende Anstriche verwendet, beispielsweise für Unterwasserschiffsanstriche.Das in Lösung gehende Kupfer ist giftig für Algen und hemmt deren Ansatz auf den Schiffswänden („Antifouling“). Daneben wird Kupfer(I)-oxid als Ausgangsstoff für die Herstellung von verschiedenen Kupferverbindungen genutzt. Weitere Anwendung findet es als Pigment zum Rotfärben von Glas und Emaille, zur Herstellung von Goldfluss, als Fungizid und als Katalysator. KUPFER CUPRUM Cu Fach C 18 17 16 16. „Kupfervitriol“ (Kupfersulfat-pentahydrat) CuSO4.5H2O Kupfersulfat wird zum Verkupfern, zur Herstellung von kupferhaltigen Farben, zur Kupferstichätzung, in Silvester-Raketen (erzeugt einen bläulich-grünen Farbton) und vieles mehr verwendet: So z.B. in der Galvanotechnik zur galvanischen Verkupferung, gemischt mit einer Calciumhydroxid-Suspension als Bordeauxbrühe im Weinbau zur Bekämpfung von Pilzerkrankungen und in größerem Maßstab als Pflanzenschutzmittel. 17. Kalium-KupferII-chlorid-dihydrat 2KCl.CuCl2.2H2O Beispiel für ein „inkongruent lösliches Doppelsalz“: Die Lösung hat eine andere Zusammensetzung wie die Kristalle ... 18. Typische AZURIT/MALACHIT- Mineralien aus den antiken Silber-Stollen bei Lavrion Bis zu 20.000 Sklaven förderten im 5. Und 6. Jhdt. v. Chr. in den Stollen von Lavrion (südlich von Athen Silbererz zu Tage. Das gebrochene Erz wurde vor Ort durch Schlämmen mit Meerwasser angereichert. Die ausgestellten Mineralien (Malachit und Azurit auf eisenhältigem rötlichem Gestein) sind typisch für die antiken Stollen (gebrochen etwa 200 m unter Tag). EISEN Symbol: Fe (Ferrum) Ordnungszahl: 26 Massenanteil an der Erdhülle: 4,7 % 3 Dichte: 7,874 g/cm Mohshärte: 4,0 Schmelzpunkt: 1.538 °C FERRUM Fe »Reineisen« ... ist beständig an trockener Luft, in trockenem Chlor sowie in konzentrierter Schwefelsäure und Salpetersäure und basischen Agenzien (außer heißer Natronlauge) mit einem pH-Wert größer als 9. In Salzsäure sowie verdünnter Schwefel- oder Salpetersäure löst sich Eisen rasch unter Entwicklung von Wasserstoff auf. An feuchter Luft und in Wasser, das Sauerstoff oder Kohlenstoffdioxid enthält, wird Eisen leicht unter Bildung von Eisenoxidhydrat oxidiert (es rostet). »Gußeisen« ... ist mit einem Kohlenstoffgehalt von etwas über 2,06% als Schmelze dünnflüssig und daher gut gießbar, erkaltet aber nicht schmiedbar. Eisen-Strangguss-Stück »Stahl« »Roheisen« ... entsteht als Produkt beim Hochofenprozess. Der hohe Kohlenstoffgehalt von 4-5% macht es hart und spröde; es ist somit weder schmiednoch schweißbar... ... ist Eisen mit einem Kohlenstoffgehalt unter 2,06%. Je nach Wahl der Legierungsbestandteile ist Stahl hart, zähelastisch, gut schweißbar und somit ideal als Werkstoff. Vom »Roheisen« zum »Stahl« Durch das Einblasen von Sauerstoff in die Schmelze (»LD-Verfahren«) kann der Entkohlungsgrad (C-Gehalt) exakt festgelegt werden. »Stahl« mit wenig Kohlenstoff (0,6-1%) ist sehr »duktil« (verformbar, walzbar) und wird u.a. für Bleche verwendet. Stahl mit höherem C-Gehalt ist hart und spröde und findet z.B. in der Produktion von Messerklingen Anwendung. »Stahlkochen« Linz-Donawitz-Verfahren Dr. Peter Unfried Durch »Zulegieren« von weiteren Elementen (Chrom, Nickel, Mangan, Vanadium usw.) können ganz besondere Eigenschaften erreicht werden: •besonders hart (Chrom) •besonders hitzebeständig (Wolfram) •besonders korrosionsfest (Chrom, Nickel) •besonders zähelastisch (Vanadium) EISEN FERRUM Fe Der Hochofenprozess Erz, Koks + Zuschläge Gichtgas Zuschläge Gichtgas Die Zuschläge (z.B. Kalkstein) werden hinzugemischt, damit das taube Gestein schmilzt und als Schlacke abgetrennt wird. Das Gichtgas besteht aus 60% Stickstoff, 20% CO sowie Wasserstoff und Methan und wird zum Aufheizen der Luft verwendet. Trocken- und Vorwärmzone 200 Eisenerz, Koks und Zuschlag werden vom durchströmenden Gas getrocknet und vorgewärmt. Reduktionszone 400 Eisenoxid wird dorch CO und C reduziert. Das dabei entstehende Eisen ist noch fest. Fe2O3 + 3 CO 2 Fe + 3 CO2 Kohlungszone 900 Es bildet sich ein Eisen-Kohlenstoffgemisch, dessen Schmelzpunkt bei etwa 1.100 - 1.200 Grad Celsius liegt. 1.200 Schmelzzone Der Koks verbrennt an der eingeblasenen Luft und bringt das Eisen-Kohlenstoffgemisch zum Schmelzen. Restliche Eisenverbindungen werden von CO und C zu Eisen reduziert. 1.800 2.000 Luft Schlacke h c ti Roheisen Luft Abstic h Roheisen Roheisen enthält etwa 3-4% Kohlenstoff. Es ist deshalb spröde und nicht schmiedbar. Dr. Peter Unfried A s b EISEN FERRUM Fe Der »Geruch« des Eisens Reines Eisen ist geruchlos! Der typische, als metallisch klassifizierte Geruch, wenn man Eisengegenstände berührt, entsteht durch eine chemische Reaktion von Stoffen des Schweißes und des Fetts der Haut mit den sich dabei bildenden zweiwertigen Eisenionen. O H2C CH3 1-Octen-3-on Einer der wichtigsten Duftträger ist 1-Octen-3-on, das noch in großer Verdünnung pilzartig-metallisch riecht. Die zweiwertigen Eisenionen entstehen durch Korrosion des Eisens bei Berührung mit dem Handschweiß, der korrosive organische Säuren und Chloride enthält. CH2 CH3 CH2 H3C N N Fe 2 N N CH3 H3C O OH O OH »Häm« des Hämeglobins Und der Knoblauchduft von Stahl? Organophosphine heißen hier die Schuldigen. Gusseisen und Stahl enthalten Kohlenstoff und Phosphor. Wenn das Metall durch die Säure des Schweißes aufgelöst wird, können daher Kohlenwasserstoffe und Phosphin (PH3) entstehen, die sich wiederum zu Organophosphinen verbinden. Zwei davon, Methylphosphin und Dimethylphosphin, erzeugen dann die liebliche Knoblauchfahne. Dr. Peter Unfried Beim Verreiben von Blut auf der Haut entsteht ein ähnlicher Geruch. Blut enthält ebenfalls Eisenionen. Und ein feiner Spürsinn für frisches Blut könnte für unsere Vorfahren überlebenswichtig gewesen sein. EISEN FERRUM Fe Vitrine A B C EISEN FERRUM Fe Fach A 1 2 1. Rost (xFeO.yFe2O3.zH2O) Chemisch gesehen setzt sich Rost allgemein aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser zusammen. Rost ist somit ein wasserhaltiges Oxid des Eisens (Oxidhydrat). Er entsteht durch die Oxidation des Eisens, ohne dass höhere Temperaturen erforderlich wäre und bildet lockere Gefüge geringer Festigkeit. Die Oxidation bewirkt eine Zunahme der Masse und des Volumens. Letztere führt zu Spannungen und zum Abplatzen der Rostschicht 2. Stahlwolle Handelsübliche Stahlwolle besteht aus einem dicken Band aus scharfkantigen feinen Metallfasern. Diese Fasern haben idealerweise einen 3- oder 4-eckigen Querschnitt, sodass der gewünschte „Ziehklingeneffekt“ entsteht, wenn mit den Stahlwollefasern rechtwinklig zur Schleifrichtung gearbeitet wird. Stahlwolle wird zur Bearbeitung unterschiedlichster Oberflächen wie Holz, Metall, Kunststoff, Stein und Glas eingesetzt, auch zum Mattschleifen von polierten und lackierten Flächen. EISEN FERRUM Fe Fach B 3 5 4 3. Werkzeugstahl (Fe mit Cr, Mo, W legiert) Legierte Werkzeugstähle werden in höher beanspruchten Werkzeugen eingesetzt. 4. Waffen und Feuerschlag-Eisen (Sammlung: Dr.Unfried) 5. „NIRO“-Halbzeug (Fe mit Cr, Ni legiert) Nichtrostender („rostfreier“) Stahl zeichnet sich durch einen Anteil von mehr als 10,5 % Chrom aus. Weitere Legierungsbestandteile wie Nickel, Molybdän, Mangan und Niob führen zu einer noch besseren Korrosionsbeständigkeit oder günstigeren mechanischen Eigenschaften. EISEN FERRUM Fe Fach C 6 8 7 9 10 6. „Rotes“ Eisen(III)-Oxid Fe2O3 Eisen(III)-oxid wird als Pigment verwendet und als Eisenoxidrot bezeichnet. Der Farbton variiert dabei etwa zwischen rotorange und tiefrot;] auch ist es Hauptbestandteil der natürlichen roten Erden. 7. Eisenbahnschiene („Schmalspur“) Fe/Mn-Legierung 8. „Eisenvitriol“, Eisen(II)-sulfat-heptahydrat FeSO4.7H2O Früher: Ab dem dem 3. Jahrhundert v. Chr. wurde Eisengallustinte, eine aus Eisen(II)-sulfat, Galläpfeln, Wasser und Gummi arabicum hergestellte Tinte, als dokumentenechte schwarze Tinte zum Schreiben auf Pergament und später Papier gebräuchlich. Heute: Bei der Abwasserreinigung dient es als Fäll- und Flockungsmittel. Besonders große Kläranlagen verwenden häufig Eisen(II)-sulfat zur Phosphat- elimination. 9. Berlinerblau“ (stark verdünnt) Fe(III) + „Gelbes Blutlaugensalz“ K4[Fe(CN)6] Berliner Blau wird bis heute für Aquarell-, Öl- und Druckfarben verwendet. Das 1709 durch Pieter van der Werff in Rotterdam geschaffene Gemälde „Die Grablegung Christi“ stellt den frühesten bisher bekannten Nachweis der Verwendung des Pigments in der Malerei dar. 10. Eisen-Drehspäne mit den typ. „Anlauf-Farben“ „Anlauffarben“, auch „Anlassfarben“, sind oberflächliche, irisierende bunte Färbungen eines Stoffes, die durch Interferenz an dünnen Schichten entstehen. Auf Metallen entstehen die Anlauffarben meist durch eine Oxidation der Oberfläche. Die Dicke der Oxidschicht wird durch die Tiefe bestimmt, in die die Sauerstoffatome diffundieren können. Diese Tiefe ist stark von der Temperatur abhängig. SCHWEFEL Symbol: S (Sulpur) Ordnungszahl: 16 Massenanteil an der Erdhülle: 0,048 % 3 Dichte: 2,07 g/cm Mohshärte: 2 Schmelzpunkt: 115,21 °C SULPUR S Elementarer Schwefel Erhitzt man Schwefelpulver auf über 119°C, bildet sich eine hellgelbe leichtbewegliche Flüssigkeit. Bei weiterem Erhitzen entsteht bei ca. 187°C eine dunkelgelbe zähe Masse. Bei Temperaturen über 187°C wird die Schmelze rotbraun und immer dünnflüssiger. Siedepunkt 444°C! Beim »Abschrecken« bleiben die verschiedenen Zustände mit ihren Farben erhalten. Daher gibt es um Vulkanschlote immer das bunte Farbenspiel des Schwefels von weißgelb über braun bis rot ... Vulkanischer Schwefel auf der Insel Java Wichtigste Verbindungen 90% des »elementaren Schwefels« werden direkt zu Schwefelsäure H2SO4 (Salze: Sulfate) weiterverarbeitet. 60% davon gehen in die Düngemittelindustrie. Wichtige Säuren sind die Schwefelige-Säure (Salze: Sulfite) und die Schwefelwasserstoff-Säure (Salze: Sulfide). • Natriumsulfat Na2SO4.10H2O (»Glaubersalz«): Waschmittel, Lebensmittel (E 514), Dünger • Kupfersulfat CuSO4.5H2O (»Kupfervitriol«): Galvanotechnik, Weinbau • Ammoniumaluminiumsulfat NH4Al(SO4)2.12H2O (»Ammonalaun«): Papierindustrie, Gerberei und Lebensmittelindustrie (E 523), Kosmetikindustrie »Adstringens« • Calciumsulfat CaSO4.2H2O (»Gips«) • Natriumsulfit Na2SO3 • Natriumsulfid Na2S Gewinnung Früher wurde Schwefel ausschließlich bergmännisch in der Nähe von Vulkanschloten abgebaut. Auch heute geschieht dies noch auf primitivste und »höchst ungesunde« Weise in den ärmsten Teilen der Welt. Die heißen Dämpfe enthalten ätzende und giftige Schwefeloxide und Säuren und zerstören die Schleimhäute der Arbeiter/-Innen in kürzester Zeit. Um zur heißbegehrten Schwefelsäure - als wichtigsten Bestandteil der Düngenmittelindustrie – im Tonnenmaßstab zu gelangen, bewährt sich die Methode Sulfidische Erze zu rösten, wie z.B. Pyrit FeS2. Das so erhaltene SO2 wird dann direkt zu SO3 und Schwefelsäure (H2SO4) weiterverarbeitet. Rohschwefel fällt zum Großteil bei der Entschwefelung von Erdöl und Erdgas an. Er wird direkt zu Schwefeldioxid verbrannt und über Schwefeltrioxid mit Wasser zu Schwefelsäure weiterverarbeitet. Dr. Peter Unfried Schwefel aus Erzen Schwefel aus Erdöl Vulkanisieren SCHWEFEL SULPUR S »Schwarze und Weiße Raucher« Die Vulkanisation ist ein 1839 von Charles Goodyear entwickeltes chemisch-technisches Verfahren. Kautschuk wird unter Einfluss von Zeit, Temperatur und Druck gegen atmosphärische und chemische Einflüsse sowie gegen mechanische Beanspruchung widerstandsfähig gemacht (Gummi). Eine Kautschukmischung, bestehend aus Rohkautschuk und 1,8 bis 2,5 % Schwefel, wird auf 120 bis 160° C erhitzt. Dabei gehen die plastischen Eigenschaften des Kautschuks bzw. der Kautschukmischung verloren; der Stoff wird in einen elastischen Zustand überführt. Im austretenden Wasser der »Raucher« (hydrothermale Quellen am Grund der Tiefsee) sind vor allem Sulfide und andere Salze von Eisen, Mangan, Kupfer und Zink gelöst. Das beim Austritt zum Teil über 400 °C heiße Wasser trifft mit dem 2 °C kalten Wasser des Meeresgrundes zusammen. Bei der Abkühlung werden Mineralien in feinen Partikeln »ausgefällt«, die die »Rauchfahne« bilden. Durch Sedimentation entsteht der Schornstein oder Kegel. Ist die Sedimentwolke reich an Eisensalzen (z. B. Pyrit), bildet sich die charakteristische schwarzgraue Farbe des »Schwarzen Charles Goodyear bei der Rauchers«, sind dagegen in größerer Menge Sulfate, wie Entdeckung der Vulkanisation. Anhydrit und Gips oder Siliziumdioxid gelöst, wird die helle Sedimentwolke des »Weißen Rauchers« gebildet. Mit 464 Grad Celsius werden die höchsten Wassertemperaturen von »Schwarzen Rauchern« auf dem Mittelatlantischen Rücken – in 3000 Metern Tiefe bei einem Wasserdruck von 298 bar – gemessen. Die Schlote erreichen Höhen bis zu 60 Meter. Hydrothermale Tiefseequellen sind nur ungefähr 20 Jahre aktiv. Dann verstopfen die ausgefällten Mineralien die Röhren und Spalten und die Quellen versiegen. »Saurer Regen« Bekämpfung der Symptome Als Gegenmaßnahme versucht man in vielen Gegenden Europas (in der Schweiz verboten) mit Kalk, der per Hubschrauber verstreut wird, die Übersäuerung zu neutralisieren. In der Nähe von Kalk- oder Zementwerken mit schlechter Entstaubung kann die unbeabsichtigte Emission von Kalkstaub im Extremfall sogar zur Umkehrung des Phänomens führen und es entsteht basischer Regen. Dieser entsteht auch bei großflächigen Waldbränden oder Vulkanausbrüchen. Bekämpfung der Ursachen Seit den 80er-Jahren werden Rauchgase zum Gutteil entschwefelt. Dabei wird das SO2 aus dem Abgas entfernt und meist zu CaSO4 (Gips) umgewandelt, welches sich als REA-Gips (RauchgasEntschwefelungsAnlage) nutzen oder deponieren lässt. Aus Kraftstoffen wie Benzin, Diesel, Kerosin und Erdgas wird der Schwefel mittels spezieller Verfahren entfernt. Dadurch konnte zumindest in den Industrieländern der Eintrag von SO2 in die Atmosphäre erheblich verringert werden. Übersäuerung durch Schwefelsäure: Dieser Reaktionsmechanismus benötigt das Wasser erst zur Bildung der Schwefelsäure aus dem Schwefeltrioxid (z. B. Regen oder Wassertropfen im Nebel ): 2 SO2 + O2 2 SO3 SO3 + H2O H2SO4 Übersäuerung durch Salpetersäure: Bei jedem Blitzschlag und bei jeder Verbrennung entstehen durch Umwandlung des im Brennstoff und in der Luft enthaltenen Stickstoffs Stickoxide (NOx). Diese bilden mit Wasser und Sauerstoff Salpetersäure (HNO3). 2 NO2 + H2O HNO2 + HNO3 N2O4 + H2O HNO2 + HNO3 Die Schwefelsäure ist zu etwa zu zwei Drittel, die Salpetersäure zu etwa zu einem Drittel für die Versauerung der Niederschläge verantwortlich. Dr. Peter Unfried Hauptverantwortlich dafür ist die Luftverschmutzung durch Abgase. Insbesondere durch Einsatz schwefelhaltiger fossiler Brennstoffe, wie Kohle und Heizöl, entstehen Schwefeloxide (SOx). Vornehmlich entsteht bei der Verbrennung zunächst Schwefeldioxid, das mit Wasser und Sauerstoff letztlich Schwefelsäure (H2SO4) bildet. SCHWEFEL SULPUR S »Die Schwefelkugel« – Der Jupitermond Io Ios Oberfläche unterscheidet sich gravierend von den Oberflächen aller anderen Körper im Sonnensystem. Zunächst einmal gibt es dort offenbar keine Einschlagkrater, was bedeutet, dass die Oberfläche extrem jung ist. Stattdessen besitzt Io eine verblüffende Vielfalt von Geländeformen. Es gibt dort Seen flüssigen Schwefels, die sich in Calderen (Krater) befinden, Berge nichtvulkanischen Ursprungs, Lavaströme und vulkanische Öffnungen. Außerdem zeigt sich Io in einer reichen Farbenpracht, die durch das Vorherrschen von Schwefel und seinen Verbindungen hervorgerufen wird. Manche der über 300 Calderen auf Io, die bis zu 200 Kilometer im Durchmesser erreichen und bis zu mehreren Kilometern tief sind, sind aktive Vulkane. Diese Entdeckung war der erste Beweis dafür, dass das Innere anderer erdähnlicher Körper heiß und aktiv ist. Bislang wurden auf Io etwa 300 Vulkane entdeckt, die Rauchwolken von bis zu 300 Kilometer Höhe eruptieren. Das ausgeworfene Material besteht offenbar hauptsächlich aus Schwefel und Schwefeldioxid. Nach einer Eruption kondensiert das ausgeworfene Material wieder und bildet eine Art Ascheregen wahrscheinlich aus weißem Schwefeldioxidschnee. Ios gesamte Oberfläche ist von diesen vulkanischen Ablagerungen überzogen. Io besitzt eine sehr dünne Atmosphäre aus Schwefeldioxid, Kochsalzdampf, Schwefelmonoxid, zweiatomigem Schwefel und vermutlich noch anderen Gasen. Dr. Peter Unfried Jupitermond Io SCHWEFEL SULPUR S Vitrine A B C SCHWEFEL SULPUR S Fach A 1 2 17 3 1. Schwefeltrioxids SO3 Anhydrid der Schwefelsäure. Bildet bei Normbedingungen farblose, nadelförmige Kristalle, die äußerst hygroskopisch sind und sehr heftig (explosiv) mit Wasser reagieren. Gasförmiges Schwefel-trioxid dient hauptsächlich zur Herstellung von Schwefelsäure. 2. Schwefelsäure H2SO4 Technisch wichtigste Chemikalie überhaupt! Zählt zu den meistproduzierten chemischen Grundstoffen. Wird im „Millionen-Tonnen-Maßstab“ jährlich weltweit produziert und vor allem in der Düngemittelproduktion und zur Darstellung anderer Mineralsäuren, etwa der Salzoder Phosphorsäure verwendet. 3. Vulkanisierter Autoreifen Der Großteil der industriellen Gummiproduktion geht in die Reifenherstellung. Naturkautschuk ist bernsteinfarben und wird für Autoreifen mit künstlich hergestelltem Ruß zur Modifikation der Eigenschaften (z. B. Abrieb, Reißfestigkeit, Härte) gemischt. Daraus resultiert die schwarze Färbung. Naturkautschuk besteht aus langen Polyisopren-Ketten, welche durch Zusatz von Schwefel unter Druck und Hitze vernetzt werden können, wodurch ein elastisches Material entsteht. Dieser Vulkanisation genannte Vorgang wurde 1839 von Charles Goodyear entdeckt. Laut Archäologen des MIT kannten mittelamerikanische Ureinwohner das Erhitzen von Kautschuk mit Schwefel allerdings schon vor 3600 Jahren. SCHWEFEL SULPUR S Fach B 4 6 5 7 4. CdS Cadmium ist ein Schwermetall, das bereits in relativ niedriger Dosierung die menschliche Gesundheit schädigen kann. Cadmium schädigt die Nieren und die Knochen und beeinflusst das Hormonsystem. Jede Freisetzung aus weiteren Quellen ist daher nach Möglichkeit zu unterbinden. Bei Produkten mit bedeutenden Cadmiumgehalten wie Nickel/Cadmium-Akkus ist unbedingt auf eine Entsorgung als Sondermüll und nicht als Hausmüll zu achten. 5. Schwarzpulver Schwarzpulver besteht im Mittel aus 75 % Salpeter (Kaliumnitrat), 10 % Schwefel und 15 % Holzkohle. Schwarzpulver ist wenig schlag- und reibungsempfindlich. Die Zündtemperatur liegt sehr niedrig (ca. 170 °C). Ein wichtiger Einsatzort ist im Steinbruch zur Gewinnung wertvoller Werksteine wie Marmor oder Granit. Aufgrund der stark zerstörenden Wirkung von Detonationssprengstoffen kommen diese dort nicht zum Einsatz. Da Sprengpulver nicht brisant ist, sondern schiebende Wirkung hat, wird das Gestein relativ schonend losgebrochen, man erhält Bruchstücke in verwendbarer Größe und es entstehen keine Haarrisse. 6. MnSO4.H2O Mangan(II)-sulfat findet Verwendung in der Landwirtschaft, der Porzellanfabrikation, zur Desinfektion, in der Färberei und in der Holzbeize. 7. „Ultramarin-Blau“ Farbloser Sodalith (ein Mineral) hat sehr kleine Hohlräume. Diese Hohlräume sind so klein, dass nur wenige Atome in diese Käfige passen. Bei den Ultramarinen enthalten die Hohlräume einfach negativ geladene Polysulfid-Radikalanionen. Diese „eingesperrten“ S3-Ionen verhalten sich anders als elementarer Schwefel. Sie absorbieren das Licht bestimmter Energie, dies entspricht einer bestimmten Wellenlänge: Sie bilden ein „Farbzentrum“. Fällt weißes Licht – wie etwa Sonnenlicht – auf das Pigment, so fehlt nach der Reflexion durch das Pigment der absorbierte Anteil des Lichts. Der Mensch empfindet nun eine Farbe. „Ultramarin“ wird aus dem Mineral „Lapislazuli“ gewonnen, von dem der beste nur an einem Fundort in Nord-Afghanistan vorkommt. Das Pigment wurde schon im Mittelalter am Seeweg nach Europa gebracht und hier mit Gold aufgewogen ... SCHWEFEL SULPUR S Fach B 9 8 8. Zinnober HgS Historische Anwendung fand Zinnober (Mineral: „Cinnabarit“) als rotes Pigment, dem „Zinnoberrot“. Als Pigment wurde das Mineral seit dem Altertum in der Wand-, Tafel- und Buchmalerei eingesetzt. Weiters wurde das enthaltene Quecksilber nach Reduktion des Quecksilbersulfids als Material für Spiegel verwendet. 9. Ammonalaun (Ammoniumaluminiumsulfat-dodekahydrat) NH4Al(SO4)2.12H2O Alaun (englisch: Alum, französisch: Alun, lateinisch: Alumen) wurde früher nur das kristallisierte wasserhaltige schwefelsaure Doppelsalz von Kalium und Aluminium (Kaliumaluminiumsulfat) genannt. Neuerdings bezeichnet man so bisweilen auch das entsprechende Ammoniumaluminiumsalz, während der Name Alaune für alle schwefelsauren Doppelverbindungen gleichartiger chemischer Konstitution gilt MIMIII(SO4)2.12H2O, wobei dann das für Kalium bzw. Aluminium eintretende Metall der Bezeichnung vorgesetzt wird, zum Beispiel Chromalaun für das schwefelsaure Doppelsalz von Kalium und Chrom. Hauptsächlich wird Alaun in der Papierfabrikation, in der Gerberei zum Weißgarmachen der Häute, in der Kattundruckerei und in der Zeugfärberei zum Beizen vorkommt. Das Pigment wurde schon im Mittelalter am Seeweg nach Europa gebracht und hier mit Gold aufgewogen ... SCHWEFEL SULPUR S Fach C 10 11 12 10. Erdöl direkt aus der „AWP“ – Adria-Wien-Pipeline (ÖMV/Raffinerie-Schwechat) 11. Kristallisierter Schwefel auf Calzit (Sizilien/Italien) 12. Schwefel-Brocken und „Schwefel-Blumen“ direkt aus der Entschwefelung des Rohöls gewonnen (ÖMV/Raffinerie-Schwechat) Ca. 95% des so gewonnenen Schwefels wird zu Schwefeldioxid verbrannt (DONAUCHEMIE, Werk „Pischelsdorf“) und direkt zu Schwefelsäure (H2SO4) weiterverarbeitet. Diese geht dann fast quantitativ in die Düngemittelproduktion ... GESTEIN Vitrine A B C GESTEIN Fach A 2 1 1. Vulkanischer Schwefe (Kraterrand von Vulcano/Liparische Inseln/Italien) 2. Obsidian und Bimsstein (Lipari/Liparische Inseln/Italien) Der Name „Obsidian“ leitet sich von dem Römer Obsius her, der in der Antike den ersten Obsidian von Äthiopien nach Rom gebracht haben soll. Obsidian entsteht bei rascher Abkühlung von Lava mit einem Massenanteil an Wasser von maximal 3–4 %. Bei höheren Gehalten an flüchtigen Stoffen (neben Wasser hauptsächlich CO2) würde sich sonst, auch bei schneller Abkühlung, das Gestein zu Bimsstein aufblähen. D.h. Obsidian und Bimsstein sind chemisch ident und verhalten sich wie erstarrte Flüssigkeit mit erstarrtem Schaum ... Die Bildung vulkanischer Gläser ist in hohem Maße von der Zähflüssigkeit und deshalb vom Kieselsäuregehalt (je höher, desto zähflüssiger) der Lava abhängig. Aufgrund der raschen Abkühlung kommt es nicht zur Ausbildung regelmäßiger Kristallstrukturen. Das Glas, aus dem der Obsidian besteht, hat damit ein chaotisches, amorphes Gefüge. Obsidian war wegen seines scharfen muscheligen Bruchs von der Steinzeit bis zum Mittelalter heiß begehrt für Messerklingen oder Pfeilspitzen. GESTEIN Fach B 4 3 6 7 5 3. Olivinbombe (Kapfenstein, Stmk) Dieses Mineralgeschoß aus dem obersten Erdmantel wurde vor ca. zwei Millionen Jahren mit dem Magma durch die gesamte Erdkruste transportiert und bei einem stark explosiven Vulkanausbruch durch die Luft gewirbelt. Diese eisenhältigen und daher schweren Kristalle gehören zu den ersten Mineralbildungen einer abkühlenden Gesteinsschmelze. 4. Granitplatte rot 5. Flußspat-Gang (Erzgebirge, Sachsen) 6. Versteinerte Auster (Stetten bei Korneuburg) Das größte fossile Austernriff der Welt liegt am Teiritzberg bei Stetten. Die Hauptsedimentations-Phase im Korneuburger Becken setzt erst im Karpatium vor ca. 17 Millionen Jahren ein. Nun beginnt der Untergrund rasch abzusinken. Gleichzeitig liefern Flüsse genug Sand und Schlamm, um dieses Absinken auszugleichen. Obwohl das Becken im Laufe der Zeit hunderte Meter absinkt, bleibt das Meer daher immer sehr seicht und wird kaum tiefer als 20-30 Meter. Vor 16 Millionen Jahren endete das Absinken des Untergrundes. Das Meer zieht sich aus dem Korneuburger Becken zurück. 7. Uraninit aus 1000 m Tiefe (Dolny Rozinka/Tschechien) Dolny Rozinka ist das letzte noch aktive Uran-Bergwerk in Europa. Das Erz (Uraninit) enthält Uranoxid („Pechblende“) im hundertstel Prozent-Bereich. Das Erz wird in weitverzweigten Stollen in 1000 m Tiefe bergmännisch abgebaut, in Hunten kilometerweit zum Förderschacht gebracht, zu Tage befördert und über Tage nasschemisch aufgeschlossen. GESTEIN Fach C 8 10 9 8. Basalt (Fundort: Fichtelgebirge) Basalt: Entsteht bei der Aufschmelzung des Erdmantels, dünnflüssiges, SiO2-armes Magma erkaltet an der Erdober-fläche oder im Ozean beim Austritt relativ schnell zu Basaltlava. Die Magmenhaben bei ihrem Austritt in der Regel Temperaturen zwischen 900 °C und 1200 °C abhängig von ihrem Chemismus. Es befinden sich häufig auch Einschlüsse von Mineralen oder ganzen Gesteinen mit einem höheren Schmelzpunkt darin, die beim Aufstieg mitgerissen wurden. Basalt ist, betrachtet man sowohl die Festländer als auch den Grund der Meere, das Gestein mit der größten Verbreitung. 9. Roter Sandstein (Fundort: Langen bei Darmstadt/ Deutschland) Sandstein: Entsteht durch die Verkittung (Zementation) von lockerem Sand und Beimengungen groberer oder feinerer Sedimentpartikel (Ton, Silt, Gerölle). Er ist, im Gegensatz zu chemischen und biogenen (überwiegend aus Resten von Lebewesen zusammengesetzten) Gesteinen, wie Kalkstein oder Kohle, klastischen (detritischen) Ursprungs, besteht also aus Kleinsttrümmern verwitterter und abgetragener Gesteine. (Quelle: Wikipedia) 10. Granate in Glimmerschiefer (Fundort: Donnersbachwald / Steiermark) Granate: Kommen in massiver Form oder körnig, häufig aber auch als makroskopische Kristalle vor, die bis zu 700 kg schwer werden können. Besonders häufig findet man Granate in metamorphen Gesteinen wie Gneis oder Glimmerschiefer; daneben treten sie auch in magmatischen Gesteinen und sedimentär in Schwermineralseifen (Strandsedimente, Flusssedimenten) auf. Die Korngröße von Glimmerschiefer ist mittel- bis grobkörnig, die aufbauenden Minerale sind parallel zueinander eingeregelt. Glimmerschiefer: Wie für Schiefer charakteristisch, zeigt Glimmerschiefer ebene, unebene oder gewellte Schieferungsflächen, anhand derer das Gestein zu Platten aufgespalten werden kann. Typisch für frisch aufgebrochene Glimmerschieferplatten ist der intensiv schimmernde Glanz. Glimmerschiefer entsteht durch Umwandlung (Metamorphose) von Tonmineralen, Tonsteinen oder sandigen Gesteinen in Glimmerminerale . Infolge von mittleren bis hohen Temperaturund Druckverhältnissen werden die Gemengeteile (d.h. die gesteinsaufbauenden Minerale) aufgeschmolzen, anschließend erfolgt die Rekristallisation und durch den dabei vorherrschenden einseitigen Druck entsteht das charakteristische Schiefergefüge. GESTEIN Fach C 11 13 12 11. Granitplatte (Gesteinsfund: Herschenberg / Niederösterreich) Granite entstehen durch die Erstarrung von Gesteinsschmelzen (Magma) innerhalb der Erdkruste, meistens in einer Tiefe von mehr als zwei Kilometern unter der Erdoberfläche. Im Gegensatz dazu stehen die vulkanischen Gesteine, bei denen das Magma bis an die Erdoberfläche dringt. Granit ist deshalb ein Tiefengestein (Fachausdruck: Plutonit). Die Schmelztemperatur von granitischen Magmen unter Atmosphärendruck liegt bei 960 °C. Granite entstehen in den meisten Fällen nicht aus Material des Erdmantels, sondern aus aufgeschmolzenem Material der unteren Erdkruste. (Quelle: Wikipedia) 12. Glimmer aus einem Pegmatitgang (Fundort: Königsalm / Niederösterreich) Glimmer : Eine ganze Reihe von Schichtsilikaten mit Aluminium-Silizium-Sauerstoff-Tetraeder als Grundbausteine, die in Ebenen angeordnet sind. Diese Kristallgitterschichten werden durch Elemente wie Mg, Ca, Na, K, Al u.a. locker zusammengehalten. Als Folge dieses schichtartigen Aufbaus lassen sich Glimmer sehr gut spalten. Pegmatit: Grobkristalline Ganggesteine, die aus sehr großen, meist etwa 2 bis 2,5 cm großen Kristallen bestehen und im wesentlichen der Zusammensetzung von Granit entsprechen. Sie bestehen also hauptsächlich aus den Mineralen Feldspat, Quarz und Glimmer und haben durch die hellen Hauptbestandteile Quarz und Feldspat ein sehr helles Aussehen. 13. Magnetkies, „Pyrrhotin“ (Fundort: Erzgebirge/Sachsen) Pyrrhotin, veraltet auch als Magnetkies bezeichnet, ist ein häufig vorkommendes Mineral aus der Mineralklasse der „Sulfide und Sulfosalze“. Bronzefarbenes bis braunes, metallisch glänzendes, undurchsichtiges, ferromagnetisches Mineral der näherungsweisen Zusammensetzung FeS, dazu etwas Nickel. NICKEL NICCOLUM Ni Symbol: Ni (Niccolum) Ordnungszahl: 28 Massenanteil and der Erdhülle: 0,015 % Dichte: 8,908 g/cm3 Mohshärte: 4,0 Schmelzpunkt: 455 °C Der größte Teil der Ni-Produktion wird für nichtrostenden Stähle (»Chrom-Nickel-Stahl«) und Münzen (z.B. in unserem Euro) verwendet. Die Reserven an nach heutigen Gesichtspunkten abbauwürdigen Nickelvorkommen liegen zwischen 70 und 170 Millionen Tonnen. Gegenwärtig werden weltweit jährlich weit mehr als eine Million Tonnen (2006: 1,340 Mio. Tonnen) gefördert. Reinstes Nickelmetall wird darüber hinaus in feinverteilter Form als Katalysator bei der Hydrierung ungesättigter Fettsäuren (Margarine-Herstellung) verwendet. Electrolytisch raffiniertes 99,9% Nickel als Knolle Nickelmetall dient weiters als Überzugsmetall zum Korrosionsschutz (»Vernickeln«) von Metallgegenständen: Wegen seiner vor Oxidation schützenden Eigenschaften werden Metalle (insbesondere Eisen) mittels galvanischer Technik für bestimmte technische Zwecke mit einer Nickelschicht überzogen. Nickel in Akkus hat zwar große technologische Bedeutung, fällt aber mengenmäßig nicht sonderlich ins Gewicht. Das Fünf-Cent-Stück ist eine Münze der Vereinigten Staaten. Sein Wert entspricht einem Zwanzigstel US-Dollar. Die seit 1866 aus unedlem Metall (Kupfernickel) geprägte Münze hat den Übernamen Nickel bekommen, der sich als allgemein gebräuchliche Bezeichnung durchgesetzt hat. Seit 1938 ist auf der Vorderseite der Münze das Porträt von Thomas Jefferson, dem dritten US-Präsidenten, abgebildet und auf der Rückseite (mit einer kurzen Unterbrechung 2004/05) sein Landsitz Monticello. Nickelchlorid NiCI2 Nickelsulfat NiSO4 7H2O NICKEL NICCOLUM Ni Vitrine A B C NICKEL NICCOLUM Ni Fach A 1 1. Schalen aus Nickel „Abdampfschalen“, wie sie in chemischen Laboratorien verwendet werden. Fach B 2 3 2. Cis-/trans-cyclohexandiammin-Nickel (gelb bzw.violett) [Ni(cis-chxn)2]Cl2: blassgelbes, feinkristallines Komplexsalz. Diamagnetisch; planar-quadratische Konfiguration. [Ni(trans-chxn)2(H2O)2]Cl2: violettes feinkristallines Komplexsalz. Paramagnetisch; oktaedrische Konfiguration. 3. Hexamminnickel(II)-chlorid [Ni(NH3)6]Cl2 Löst man etwas Nickelchlorid NiCl2 in Wasser auf, so erhält man eine Lösung in der die Nickel(II)-Ionen von je 6 Wassermolekülen umgeben sind: [Ni(H2O]6]2+ Die Lösung ist grün! Gibt man ausreichend Ammoniaklösung hinzu (NH3), färbt sich die Lösung intensiv violett ! Durch „Ligandenaustausch“ hat sich volettes [Ni(NH3)6]2+ gebildet, das sich beim Einengen mit zwei Cl Gegen-ionen vereinigt und als tiefviolettes Salz auskristallisiert ... NICKEL NICCOLUM Ni Fach C 19 17 4 5 4. Chromnickel-Stahl Halbzeug und Laborgeräte 5. Nickel(II)-nitrat-hexahydrat Ni(NO3)2.6H2O Besonderheiten: Starkes Oxidationsmittel! Gibt beim Erhitzen ab 45°C das Tetrahydrat Ni(NO3)2.4H2O, ab 80°C das Dihydrat Ni(NO3)2.2H2O und bei 120°C basisches Nickelnitrat Ni(OH)NO3. Beim Abkühlen bildet sich das u.A Nanohydrat Ni(NO3)2.9H2O! Verwendung: - als braunes Pigment in der Keramikindustrie - in der Färberei als Beizmittel - zum elektrolytischen Vernickeln - zum Herstellen von reinstem Katalysatornickel