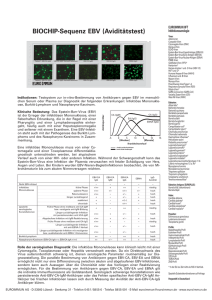
EUROPLUS BIOCHIP-Sequenz EBV
Werbung
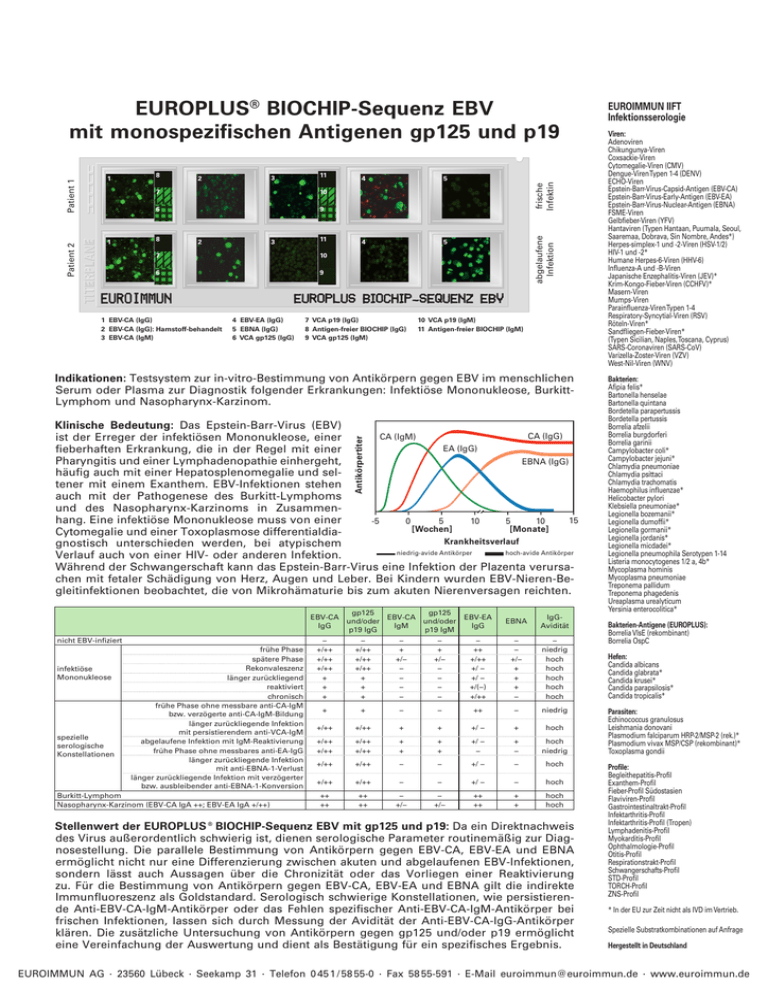
1 8 3 2 11 7 10 6 9 8 2 3 11 7 10 6 9 1 EBV-CA (IgG) 2 EBV-CA (IgG): Harnstoff-behandelt 3 EBV-CA (IgM) 4 EBV-EA (IgG) 5 EBNA (IgG) 6 VCA gp125 (IgG) 4 5 4 5 frische Infektin 1 7 VCA p19 (IgG) 8 Antigen-freier BIOCHIP (IgG) 9 VCA gp125 (IgM) abgelaufene Infektion Patient 2 Patient 1 EUROPLUS® BIOCHIP-Sequenz EBV mit monospezifischen Antigenen gp125 und p19 10 VCA p19 (IgM) 11 Antigen-freier BIOCHIP (IgM) Indikationen: Testsystem zur in-vitro-Bestimmung von Antikörpern gegen EBV im menschlichen Serum oder Plasma zur Diagnostik folgender Erkrankungen: Infektiöse Mononukleose, BurkittLymphom und Nasopharynx-Karzinom. Antikörpertiter Klinische Bedeutung: Das Epstein-Barr-Virus (EBV) CA (IgG) CA (IgM) ist der Erreger der infektiösen Mononukleose, einer EA (IgG) fieberhaften Erkrankung, die in der Regel mit einer Pharyngitis und einer Lymphadenopathie einhergeht, EBNA (IgG) häufig auch mit einer Hepatosplenomegalie und seltener mit einem Exanthem. EBV-Infektionen stehen auch mit der Pathogenese des Burkitt-Lymphoms und des Nasopharynx-Karzinoms in Zusammenhang. Eine infektiöse Mononukleose muss von einer 15 -5 0 5 10 5 10 [Wochen] [Monate] Cytomegalie und einer Toxoplasmose differentialdiaKrankheitsverlauf gnostisch unterschieden werden, bei atypischem niedrig-avide Antikörper hoch-avide Antikörper Verlauf auch von einer HIV- oder anderen Infektion. Während der Schwangerschaft kann das Epstein-Barr-Virus eine Infektion der Plazenta verursachen mit fetaler Schädigung von Herz, Augen und Leber. Bei Kindern wurden EBV-Nieren-Begleitinfektionen beobachtet, die von Mikrohämaturie bis zum akuten Nierenversagen reichten. gp125 gp125 EBV-CA EBV-CA und/oder und/oder IgG IgM p19 IgG p19 IgM nicht EBV-infiziert infektiöse Mononukleose spezielle serologische Konstellationen frühe Phase spätere Phase Rekonvaleszenz länger zurückliegend reaktiviert chronisch frühe Phase ohne messbare anti-CA-IgM bzw. verzögerte anti-CA-IgM-Bildung länger zurückliegende Infektion mit persistierendem anti-VCA-IgM abgelaufene Infektion mit IgM-Reaktivierung frühe Phase ohne messbares anti-EA-IgG länger zurückliegende Infektion mit anti-EBNA-1-Verlust länger zurückliegende Infektion mit verzögerter bzw. ausbleibender anti-EBNA-1-Konversion Burkitt-Lymphom Nasopharynx-Karzinom (EBV-CA IgA ++; EBV-EA IgA +/++) EBV-EA IgG EBNA IgGAvidität − +/++ +/++ +/++ + + + − +/++ +/++ +/++ + + + − + +/− − − − − − + +/− − − − − − ++ +/++ +/ − +/ − +/(−) +/++ − − +/− + + + − − niedrig hoch hoch hoch hoch hoch + + − − ++ − niedrig +/++ +/++ + + +/ − + hoch +/++ +/++ +/++ +/++ + + + + +/ − − + − hoch niedrig +/++ +/++ − − +/ − − hoch +/++ +/++ − − +/ − − hoch ++ ++ ++ ++ − +/− − +/− ++ ++ + + hoch hoch Stellenwert der EUROPLUS®BIOCHIP-Sequenz EBV mit gp125 und p19: Da ein Direktnachweis des Virus außerordentlich schwierig ist, dienen serologische Parameter routinemäßig zur Diagnosestellung. Die parallele Bestimmung von Antikörpern gegen EBV-CA, EBV-EA und EBNA ermöglicht nicht nur eine Differenzierung zwischen akuten und abgelaufenen EBV-Infektionen, sondern lässt auch Aussagen über die Chronizität oder das Vorliegen einer Reaktivierung zu. Für die Bestimmung von Antikörpern gegen EBV-CA, EBV-EA und EBNA gilt die indirekte Immunfluoreszenz als Goldstandard. Serologisch schwierige Konstellationen, wie persistierende Anti-EBV-CA-IgM-Antikörper oder das Fehlen spezifischer Anti-EBV-CA-IgM-Antikörper bei frischen Infektionen, lassen sich durch Messung der Avidität der Anti-EBV-CA-IgG-Antikörper klären. Die zusätzliche Untersuchung von Antikörpern gegen gp125 und/oder p19 ermöglicht eine Vereinfachung der Auswertung und dient als Bestätigung für ein spezifisches Ergebnis. EUROIMMUN IIFT Infektionsserologie Viren: Adenoviren Chikungunya-Viren Coxsackie-Viren Cytomegalie-Viren (CMV) Dengue-Viren Typen 1-4 (DENV) ECHO-Viren Epstein-Barr-Virus-Capsid-Antigen (EBV-CA) Epstein-Barr-Virus-Early-Antigen (EBV-EA) Epstein-Barr-Virus-Nuclear-Antigen (EBNA) FSME-Viren Gelbfieber-Viren (YFV) Hantaviren (Typen Hantaan, Puumala, Seoul, Saaremaa, Dobrava, Sin Nombre, Andes*) Herpes-simplex-1 und -2-Viren (HSV-1/2) HIV-1 und -2* Humane Herpes-6-Viren (HHV-6) Influenza-A und -B-Viren Japanische Enzephalitis-Viren (JEV)* Krim-Kongo-Fieber-Viren (CCHFV)* Masern-Viren Mumps-Viren Parainfluenza-Viren Typen 1-4 Respiratory-Syncytial-Viren (RSV) Röteln-Viren* Sandfliegen-Fieber-Viren* (Typen Sicilian, Naples, Toscana, Cyprus) SARS-Coronaviren (SARS-CoV) Varizella-Zoster-Viren (VZV) West-Nil-Viren (WNV) Bakterien: Afipia felis* Bartonella henselae Bartonella quintana Bordetella parapertussis Bordetella pertussis Borrelia afzelii Borrelia burgdorferi Borrelia garinii Campylobacter coli* Campylobacter jejuni* Chlamydia pneumoniae Chlamydia psittaci Chlamydia trachomatis Haemophilus influenzae* Helicobacter pylori Klebsiella pneumoniae* Legionella bozemanii* Legionella dumoffii* Legionella gormanii* Legionella jordanis* Legionella micdadei* Legionella pneumophila Serotypen 1-14 Listeria monocytogenes 1/2 a, 4b* Mycoplasma hominis Mycoplasma pneumoniae Treponema pallidum Treponema phagedenis Ureaplasma urealyticum Yersinia enterocolitica* Bakterien-Antigene (EUROPLUS): Borrelia VlsE (rekombinant) Borrelia OspC Hefen: Candida albicans Candida glabrata* Candida krusei* Candida parapsilosis* Candida tropicalis* Parasiten: Echinococcus granulosus Leishmania donovani Plasmodium falciparum HRP-2/MSP-2 (rek.)* Plasmodium vivax MSP/CSP (rekombinant)* Toxoplasma gondii Profile: Begleithepatitis-Profil Exanthem-Profil Fieber-Profil Südostasien Flaviviren-Profil Gastrointestinaltrakt-Profil Infektarthritis-Profil Infektarthritis-Profil (Tropen) Lymphadenitis-Profil Myokarditis-Profil Ophthalmologie-Profil Otitis-Profil Respirationstrakt-Profil Schwangerschafts-Profil STD-Profil TORCH-Profil ZNS-Profil * In der EU zur Zeit nicht als IVD im Vertrieb. Spezielle Substratkombinationen auf Anfrage Hergestellt in Deutschland EUROIMMUN AG · 23560 Lübeck · Seekamp 31 · Telefon 0 45 1 / 58 55-0 · Fax 58 55-591 · E-Mail [email protected] · www.euroimmun.de Test-Charakteristika EUROPLUS® BIOCHIP-Sequenz EBV EUROIMMUN IIFT Autoimmun-Diagnostik Gewebe-/Zellsubstrate: Auge, Affe Crithidia luciliae Darm, Affe Erythrozyten, human* Granulozyten, human (Ethanol-fixiert) Granulozyten, human (Formaldehyd-fixiert) Granulozyten, human (Methanol-fixiert) Großhirn, Affe Harnblase, Ratte HEp-2-Zellen HEp-20-10-Zellen Herz, Affe Hoden, Affe HUVEC Hypophyse, Affe Hypothalamus, Affe* Kleinhirn, Affe Knorpel (Trachea), Affe* Leber, Affe Leber, Maus Leber, Ratte Lippe, Affe* Lobus temporalis, Affe* Lunge, Affe Lymphknoten, Affe* Lymphozyten, human* Magen, Affe Magen, Maus Magen, Ratte Mamma, Affe* Milz, Affe* Mundschleimhaut, Affe* Nabelschnur, human Nebenniere, Affe Nebenschilddrüse, Affe Nerv, Affe Niere, Affe Niere, Maus Niere, Ratte Ösophagus, Affe Ösophagus, Ratte Ovar, Affe Pankreas, Affe Parotis, Affe Placenta, Affe* Prostata, Affe Rückenmark, Affe Saccharomyces cerevisiae Schilddrüse, Affe Skelettmuskel, Affe Spermatozoen, human Synovia, Affe Thrombocyten, human Thymus, Affe Tränendrüse, Affe VSM47-Zellen Zunge, Affe EUROPLUS®-Substrate: AIH (LC-1 + SLA/LP) Gliadin Intrinsic Faktor Myeloperoxidase (MPO) PBC (AMA-M2 + Sp100) Proteinase 3 (PR3) ribosomale P-Proteine + Jo-1 nRNP/Sm + Sm + SS-A SS-A + SS-B SS-B + ribosomale P-Proteine + Jo-1 SS-B + Scl-70 + Jo-1 Thyreoglobulin (TG) BIOCHIP-Mosaiken®: ANA-Globaltest: HEp-20-10/Leber (Affe) Autoantikörper-Profile: Kombinationen von 30 verschiedenen Geweben pro Objektträger CIBD-Profil: Pankreas (Affe)/intest. Becherz. (Kultur)/ Granulozyten (EtOH)/Saccharomyces cerevisiae Basisprofil: HEp-20-10/Leber (Affe)/ Niere (Ratte)/Magen (Ratte) EUROPLUS® Endomysium + Gladin: Darm (Affe)/Leber (Affe)/Gliadin Granulozyten-Mosaik: Granulozyten (EtOH)/ Granulozyten (HCHO)/HEp-2/Leber (Affe) Leber-Mosaik: HEp-2/Leber (Affe)/Leber (Ratte) Niere (Ratte)/Magen (Ratte)/Herz (Affe) Neuronale Antikörper: Kleinhirn (Affe)/ Nerv (Affe)/Darm (Affe) Polyendokrinopathie-Mosaik: Schilddrüse (Affe)/ Pankreas (Affe)/Nebenniere (Affe)/Ovar (Affe)/ Hoden (Affe)/Magen (Affe) Weitere Mosaiken ebenfalls erhältlich Spezielle Substratkombinationen auf Anfrage Testprinzip: Die indirekte Immunfluoreszenz ist ein in-vitroTest für die Bestimmung spezifischer Antikörper gegen EBV-Antigene. Auf den Testfeldern eines Objektträgers sind BIOCHIPs fixiert, die mit EBV-infizierten Zellen bzw. monospezifischen Antigenen beschichtet sind. Bei positiven Reaktionen binden sich spezifische Antikörper der Klassen IgG bzw. IgM an die viralen Antigene. Gebundene Antikörper werden in einem zweiten Inkubationsschritt mit Fluorescein-markierten Anti-Human-Antikörpern angefärbt und im Fluoreszenzmikroskop sichtbar gemacht. Hergestellt in Deutschland ;;; ;; ;; ;; ;; ;;; ;; ;; ;; ;; Reagenzträger Mit BIOCHIPs bestückter Objektträger Testdurchführung: Objektträger mit EUROIMMUN-BIOCHIPs werden mit Hilfe der TITERPLANE®-Technik inkubiert. Die Ergebnisse werden am Fluoreszenzmikroskop ausgewertet. Die Inkubation der Substrate mit den Positiv- und Negativ-Kontrollen, die in jedem Testsatz enthalten sind, zeigt an, ob der Test korrekt durchgeführt wurde und hilft bei der Auswertung. Avidität (EBV-CA): Bei 129 Seren (Herkunft: Deutschland) wurden parallel zum EBV-CA-Aviditätstest Antikörper gegen EBV-CA (IgM), EBNA und EBV-EA (IgG) bestimmt. Aufgrund der sich daraus ergebenden serologischen Konstellation konnte jeweils eine frische Infektion angenommen oder ausgeschlossen werden. Bei einer frischen Infektion treten in der Regel niedrig-avide Antikörper auf, in allen anderen Fällen hoch-avide Antikörper. Die Übereinstimmung zwischen Ergebnis und Erwartungswert lag bei 97 %. ; ;; ;; ;; ;;; ;; ;; ;; ;; ; ;; ;; ;; ;;; ;; ;; ;; ;; Erwartungswert n = 129 Anti-EBVCA-IIFT (Avidität) niedrigavid hochavid 39 1 3 86 niedrigavid hochavid Spezifität und Sensitivität: Substrat (Ig-Klasse) Referenz (Probenanzahl, Probenherkunft) Spezifität Sensitivität Charakterisierung von Referenzzentren (n = 61, Europa) 100 % 100 % Anti-EBV-CA-IgG-IIFT (n = 320, Europa) 98 % 100% Charakterisierung von Referenzzentren (n = 84, Europa) 100 % 100 % Anti-EBV-CA-IgM-IIFT (n = 322, Europa) 98 % 99 % EBV-EA (IgG) Charakterisierung von Referenzzentren (n = 48, Europa) 100 % 100 % EBNA Charakterisierung von Referenzzentren (n = 80, Europa) 95 % 100 % EBV-CA (IgG) gp125 und/oder p19 (IgG) EBV-CA (IgM) gp125 und/oder p19 (IgM) Technische Daten: Antigensubstrat EBV-CA-exprimierende Zellen (P3HR1), gp125 (natives Antigen; P3HR1), p19 (rekombinantes Antigen), EBV-EA-exprimierende Zellen (EU 33), EBNA-exprimierende Zellen (Raji). Probenverdünnung Serum oder Plasma. Qualitativ: 1:10, quantitativ: 1:10 / 100 / 1000 etc. Bezüglich des Messbereiches gibt es keine Obergrenze. Testablauf 60 min (Probe) / 30 min (PBS-Tween, Harnstoff, Komplement) / 30 min (Konjugat). Raumtemperatur. Mikroskopie Objektiv 20x Anregungsfilter: 488 nm, Farbteiler: 510 nm, Sperrfilter: 520 nm Lichtquelle: Quecksilberdampflampe, 100 W, EUROIMMUN-LED oder EUROStar-Bluelight. Reagenzien Gebrauchsfertig, mit Ausnahme des PBS-Tween-Puffers (für Verdünnungen und Waschschritte) und des Komplements. Stabilität Alle Bestandteile des Testsatzes sind ab dem Tag der Herstellung mindestens 18 Monate haltbar. Packungsformate 10 oder 20 Objektträger, jeder mit 1, 2 oder 10 Sequenzen. Die Testsätze enthalten alle notwendigen Reagenzien (bei RF-Absorption zusätzlich erforderlich: EUROSORB, Bestellnr. ZF 1270-0145). Bestellnummer FI 2799-####-21 X Verwandte Produkte FI 2791-####-2 A (IIFT-Mosaik: Anti-EBV-CA und Anti-EBV-EA, IgA) * In der EU zur Zeit nicht als IVD im Vertrieb. Version: 02/09 FI_2799_D_DE_B01 Inkubation mit der TITERPLANE®-Technik EUROIMMUN AG · 23560 Lübeck · Seekamp 31 · Telefon 0 45 1 / 58 55-0 · Fax 58 55-591 · E-Mail [email protected] · www.euroimmun.de