Phenylpropylether
Werbung

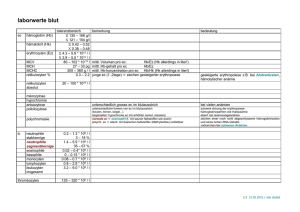
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 17./19.06.2008 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie In diesem Versuch wurde Phenylpropylether aus Brompropan und Phenol hergestellt. Dabei handelt es sich um eine bimolekulare nucleophile Substitutionsreaktion zweiter Ordnung, die auch als SN2‐ Reaktion bezeichnet wird. Der Mechanismus einer SN2‐Reaktion läuft wie folgt ab: Das Nucleophil greift am Zentralatom an, sodass sich im langsamen geschwindigkeitsbestimmenden Reaktionsschritt gleichzeitig eine Bindung zum Nucleophil (Nu) bildet und die Bindung zur Abgangsgruppe (X) aufgebrochen wird. Im instabilen Übergangszustand sind beide Bindungen nicht vollständig ausgebildet. Da die Reaktionsgeschwindigkeit von beiden Molekülen abhängt, gilt das Geschwindigkeitsgesetz für eine Reaktion zweiter Ordnung: Das Energiediagramm der Reaktion sieht wie folgt aus: Um den Übergangszustand erreichen zu können, muss die Aktivierungsenergie EA aufgebracht werden. Die Produkte der Reaktion haben weniger Energie als die Edukte, daher läuft der zweite Reaktionsschritt spontan ab. Versuchsdurchführung: In einem 250 mL‐Dreihalskolben wurden in 105 mL Ethanol 1,30 g (56,5 mmol) Natrium vorgelegt. Nachdem das Natrium unter Rühren in Lösung gegangen war, wurden 4,70 g (49,9 mmol) Phenol in 20 mL Ethanol sowie 8,56 g (69,6 mmol) Brompropan und eine Spatelspitze Kaliumiodid hinzugefügt. Die Lösung wurde 2 ½ Stunden unter Rückfluss und Feuchtigkeitsausschluss gekocht. Am nächsten Tag wurde das Ethanol abdestilliert und der Rückstand in 35 mL 5%iger Natronlauge gelöst. Die Lösung wurde fünf Mal mit 20 mL tert‐Butylmethylether im Scheidetrichter extrahiert, die organische Phase mit Magnesiumsulfat getrocknet und filtriert. Das Lösungsmittel wurde am Rotationsverdampfer entfernt (Badtemperatur 25°C) und der Rückstand fraktioniert destilliert. Auswertung: M(C9H12O) = 136,19 gmol‐1 Theoretische Ausbeute: mTheorie = 6,8 g / nTheorie = 49,9 mmol (100%) Literaturausbeute: mLiteratur = 5,44 g / nLiteratur = 39,9 mmol (80% der Theorie) Ausbeute: mExp = 3,16 g / nExp = 23,2 mmol (46% der Theorie, 58% der Literatur) Siedepunkt: 80°C Versuch 2.1: Handversuche zur Reaktivität der Halogenverbindungen Handversuch 1: Einleitung: In diesem Versuch wurden die Reaktionen von verschiedenen organischen Chloridverbindungen mit ethanolischer Silbernitratlösung untersucht: Versuchsdurchführung: Zu 1 mL der folgenden Chloridverbindungen wurde ein Tropfen 2%ige ethanolische Silbernitratlösung gegeben: Chlorbenzol, Benzylchlorid, n‐Butylchlorid, tert‐Butylchlorid, Acetylchlorid. Falls bei Raumtemperatur keine Reaktion eintrat, wurde die Lösung erhitzt. Auswertung: Bei Zugabe von ethanolischer AgNO3‐Lösung zu Chlorbenzol war bei Raumtemperatur eine leichte Trübung zu erkennen, beim Erwärmen fiel ein farbloser Niederschlag aus. Benzylchlorid reagierte sofort bei Raumtemperatur mit der ethanolischen Silbernitratlösung unter Bildung viel farblosen Niederschlags. Bei n‐Butylchlorid war bei Raumtemperatur keine Reaktion zu beobachten, beim Erwärmen fiel etwas farbloser Niederschlag aus. Tert‐Butylchlorid bildete sofort nach Zugabe der ethanolischen Silbernitratlösung einen farblosen Niederschlag. Die Zugabe der ethanolischen Silbernitratlösung zu Acetylchlorid führte zu einer heftigen Reaktion im Reagenzglas, dabei bildete sich ein farbloser Niederschlag. Aus den oben genannten Beobachtungen lässt sich folgende Reaktivitätsreihe aufstellen (Reaktivität steigend): Chlorbenzol < n‐Butylchlorid < tert‐Butylchlorid < Benzylchlorid < Acetylchlorid. In allen Reaktionen wird das Chlorid‐Ion abgespalten. Ebenso wird das Proton der Hydroxidgruppe des Ethanols abgespalten und die beiden Ionen bilden Salzsäure: Diese dissoziiert jedoch sofort wieder und durch das in der Lösung vorliegende Silber fällt AgCl aus: Das Ethanol wird jeweils an den organischen Rest gebunden, sodass ein Ether entsteht: 1) Chlorbenzol 2) Benzylchlorid 3) n‐Butylchlorid 4) tert‐Butylchlorid 5) Acetylchlorid Handversuch 2: Einleitung: In diesem Versuch wurde die Reaktivität von n‐Butylhalogeniden mit ethanolischer Silbernitratlösung untersucht. Versuchsdurchführung: Zu 2 mL n‐Butyliodid, n‐Butylchlorid und n‐Butylbromid wurde jeweils etwas 2%ige ethnolische Silbernitratlösung gegeben. Auswertung: Bei Zugabe der ethanolischen Silbernitratlösung zu n‐Butylchlorid bildete sich sofort eine Trübung und ein farbloser Niederschlag. Die Iodid‐Lösung verfärbte sich und es fiel ein Niederschlag aus, bei der Bromid‐Lösung war eine Trübung zu erkennen, erst später fiel wenig Niederschlag aus. Die beobachteten Niederschläge sind wie schon in Handversuch 1 schwerlösliche Silberhalogenide. Bei Verwendung von Natriumnitrat würden zwar prinzipiell die gleichen Reaktionen stattfinden, allerdings sind die Natriumhalogenide wesentlich besser löslich, sodass kein Niederschlag zu erkennen wäre. Literatur: Organikum,22. Auflage, WILEY‐VCH, Weinheim 2004. Merck ChemDAT, Version 2.17.5, Merck KGaA, Darmstadt 2007.