Standards in der LUNGEN- UND PLEURAPATHOLOGIE in
Werbung

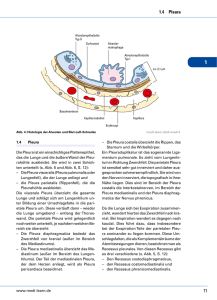
ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 3.7 LUNGEN- UND PLEURAPATHOLOGIE H. Popper, G. Dekan, U. Gruber-Mösenbacher, M. Tötsch, O. Braun MAKROSKOPIE Bei transbronchialen Biopsien Vermerk, ob transbronchial gewonnenes Lungengewebe (schwimmt/schwebt schwämmchenartig im Formol), oder Schleimhautbiopsien (sinken zu Boden; ev. kurz schütteln). Autopsielungen und offene Biopsien (VATS): Folgende Verhältnisse sind zu beschreiben: A) Entzündliche Prozesse: Pleuraoberfläche glatt oder mitbetroffen (siehe auch Pleura), Konsistenz der Lunge, Schnittfläche trocken/feucht, Farbe der Flüssigkeit, Infiltrate diffus/nodulär, Emphysem, Zysten, Ausbreitung peribronchiolär, perivasculär *, pleuranahe periphere Prozesse ** (siehe Schema). _____________ * hier bewährt sich eine Schnittführung tangential zur Pleura, da dabei die Gefäße und Bronchiolen quer zum Verlauf geschnitten werden, und das Ausbreitungsmuster besser beurteilt werden kann; ** dafür ist die radiäre Schnittführung besser geeignet; Version: März 2002 3.7.1 ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 B) Pneumokoniosen: Pleuraoberfläche glatt/narbig eingezogen/Beläge, Konsistenz und Farbe der Lunge, Prozess nodulär/diffus, Größe der Noduli, Konfluenz, Zysten/Emphysem, Fibrose, Anthrakose, noduläre Veränderungen in Lymphknoten (LN) und Bezeichnung der LN (intrapulmonal, hilär, obere/untere Bifurkation, etc.) C) Tumor: Lokalisation (Zuordnung zu Segment-, Subsegment-, oder Lappenbronchus, oder Zuordnung zu Segment/Subsegment), Größe (3 Durchmesser) und Farbe des Tumors, Struktur auf der Schnittfläche, Verhalten zur Umgebung (strahlig, glatt abgegrenzt, Verhalten zur Pleura bei peripheren Herden). Intrapulmonale Metastasen gesondert beschreiben, sonstige Begleitprozesse ebenfalls (z.B. zusätzliche TBC, Retentionspneumonie, Bronchitis, Emphysem, etc.; Beschreibung wie bei entzündlichen Prozessen). Sofern nicht im Prästaging erfasst, LN in intrapulmonale (Lappen zugeordnet) und Hilus-LN trennen, sodann die zumeist getrennt eingelangten N2-LN beschreiben (Infiltrationen, Sonstiges inclusive Anthrakose). Bei zentralen Tumoren Abstand zum Resektionsrand angeben (befallene LN im RR ergeben kein R1!) D) Autopsielungen: Vorgehen wie bei den entsprechenden Resektionspräparaten (1-3). Zusätzlich Beschreibung von LN-Stationen über N2 hinaus (paratracheal, mediastinal, etc.), parietale Pleura und Thoraxwand (siehe auch Pleura). Wichtig bei Pneumokoniosen Befall abdomineller LN (paraaortal, parapankreatisch, etc.), sowie extrapulmonaler Organbefall - dies geht in die Pneumokonioseklassifikation ein (s.u.). E) Pleura (sinngemäß auch andere seröse Häute): Oberfläche glatt/rauh, flächig entzündlich/tumorös infiltriert, nodulär entzündlich /tumorös; weiters Farbe, etwaige Beläge, Verschieblichkeit der Beläge, Pleuraverdickung flächig/nodulär, Verwachsung, Infiltrationen in der Pleura diffus/streifig/netzig, bei Autopsielungen auch Art des Pleuraergusses (Menge, Farbe, Phasen flüssig/korpuskulär nach Abstehen oder Zentrifugieren). VERARBEITUNG DER PROBEN Version: März 2002 3.7.2 ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 A) Transbronchiale und bronchiale Lungenbiopsien Übliche Fixation und Einbettung, alles verarbeiten. Wünschenswert sind 8-10 Schnittebenen, die ersten 2-3 HE-gefärbt auf einem Objektträger (OT), dann 4 ungefärbte auf je einen OT und dann nochmals 2-3 HE-gefärbt auf einem OT. Ungefärbte OTs für Sonderfärbungen; HE-Schnitte vor und nachher ermöglichen Kontrolle, ob Läsion noch vorhanden. B) Offene Lungenbiopsie/VATS Metallklammerreihe mit Schere abschneiden, Lamellierung tangential oder radial zur Pleura (Begründung siehe oben), nach Erfordernis. Kleines Stück für mikrobiologische Untersuchungen und Abklatschzytologie, weiteres für Gefrierschnittuntersuchung, drittes für Spezialuntersuchungen (s.u.); restliche Biopsie durch mehrfaches Einstechen mit Spritzennadel und Auffüllen mit Formalin für 2-20 Std. fixieren (gute Fixierung bereits nach 3 Stunden), Schnittführung nach bisheriger Gewohnheit. Alles einbetten, besonders wichtig bei nicht-tumorösen Prozessen. 5-6 Schnittebenen, Gefrierschnitt zur Orientierung: wichtig ist die Aussage, ob diagnostisches Material getroffen wurde. Wichtig bei interstitiellen Prozessen eine präoperative Festlegung der Entnahmestelle. Für Gefrierschnittuntersuchung empfehlen wir Rezept von Langston (PBS mit 30% Sucrose, 1:1 mit OCT gemischt, und lauwarm mit Spritze injiziert), ergibt sehr gute Gewebsstruktur im Gefrierschnitt; Diagnose wird nach Möglichkeit durchgegeben. An weiterführenden Untersuchungen EM mit Glutaraldehyd-fixiertem Gewebe: besonders für Elementanalysen, aber auch bei kindlichen Lungen für StrukturFunktionskorrelation. Weiters DNA- und RNA-Analysen, sowie Immunhistologie mit speziell asserviertem Gewebe. C) Lobektomie, Pneumonektomien Bei Bedarf Gefrierschnittuntersuchung; Fixation des restlichen Präparats über Bronchialsystem mit Formalin unter physiologischem Druck; Weiterverarbeitung am nächsten Tag; bei neoplastischen Prozessen Schnittechnik nach bisheriger Gewohnheit. Pro Tumorschnittfläche (0,5-0,8 cm dick) je 2 Blöcke. LN entweder in Gruppen trennen und einbetten, oder wenn bereits via Gefrierschnitt benannt eingelangt, entspechend aufarbeiten. LN immer zur Gänze verarbeiten. Im Gefrierschnitt unbedingt RR und LN untersuchen. Makroskopisch auffällige Bezirke hist. untersuchen; immer 1-3 Parenchymproben pro Lungenlappen und 12 Bronchialschleimhautproben von größeren Bronchien; je nach Lokalisation des Tumors 1-5 Pleuraproben. Bei nichtneoplastischen Prozessen: Kleine Probe für mikrobiologische Untersuchungen; Perfusionsfixation mit Formol 2-20 Stunden (bei alveolären Prozessen eventuell via Pulmonalarterien - es bleibt dadurch Exsudat besser erhalten); Schnittführung richtet sich nach der radiologischen Untersuchung: sagittal bei Korrelation mit Röntgen, horizontal bei Korrelation mit HRCT. Pro Version: März 2002 3.7.3 ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 Scheibe 4-8 Proben mit Vermerk der Segmente, bzw. bronchovasculär oder alveolär, LN können gepoolt werden. Bei Zerfallshöhlen immer Inhalt einbetten. Gefrierschnitt mit OCT / PBS / Sucrose-Injektion, tentative Diagnose, wenn möglich. D) Gefrierschnitt: Grundsätzlich keine Kontraindikation. Auch Tuberkulose kann im Gefrierschnitt untersucht werden. Wichtig ist es, die MTA auf die Möglichkeit einer TBC (Makro) hinzuweisen, dann sind weder Kontamination des Arbeitsplatzes noch Infektion des Personals zu befürchten. Wichtig ist Gefrierschnittdiagnose des RR und der LN bei Tumoren, bei entzündlichen Prozessen die Bestätigung einer adäquaten Probenentnahme. Durch Gefrierschnittdiagnose wird auch nachfolgende Schnittführung vorbestimmt, z.B. zusätzliche Schnitte tangential zur Pleura bei peribronchiolären und perivasculären Prozessen. E) Pneumokoniosen: Wie sonstige entzündliche Lungenerkrankungen behandeln. Ein Unterschied besteht aber in der ILO-Klassifikation, die sich aus Makroskopie (Knotengröße, Zahl, Konfluenz, Fibrose, Emphysem, etc.) und aus Histologie (Identifikation des auslösenden Agens, TBC, etc.) ergibt. ILO-Klassifikation zumindest aus Segment-, besser aus Lobektomiepräparaten angegeben. Elementanalyse ist jenen Fällen vorbehalten, wo mit lichtoptischen Methoden das auslösende Agens nicht eindeutig bestimmbar (z.B. Hartmetallunge, Kunststoffaser-Pneumonie, Keramikfaserlunge, etc.); bei klassischen Pneumokoniosen Silikose/Anthrakosilikose, und Asbestose erfolgt qualitative Diagnose mit lichtoptischen Methoden, Elementanalyse bringt bestenfalls Ergänzung. In einzelnen Fällen ist auch ergänzende Untersuchung aus Blut oder Lavage erforderlich (z.B. Lymphozytenstimulationstests bei Berylliose oder Isozyanatlunge, etc.). Erforderlich ist Elementanalyse in Streitfällen, wenn z.B. bei Glasfaser- oder Keramik-Pneumokoniose Nachweis erbracht werden muss, dass das Material tatsächlich aus dem in Frage kommenden Betrieb stammt. Hier kommt es auf den Nachweis von Begleitmaterialien an. Für Gutachten aus allen Segmenten 3-10 Blöcke einbetten und untersuchen. Wenn Technik der Papiergroßschnitte durchgeführt werden kann, kann die Zahl der Proben für die Histologie reduziert werden (vor allem bei Silikosen und Silikatosen). Version: März 2002 3.7.4 ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 F) Pleura Je nach Größe und klin. Fragestellung 2-5 Blöcke einbetten. Bei Tumoren Vorgangsweise analog zu den Lungentumoren. Bei Bedarf Entnahme von glutaraldehydfixierten Proben für Elementanalyse. ZYTOLOGIE A) BAL Zentrifugieren, 8-10 Ausstriche, färben nach Gewohnheit, zumindest zwei verschiedene Färbungen. Nachweis von Bakterien, Pilzen mittels Gram, ZN / Auramin-Rhodamin, Grocott. Immuntypisierung (nur bei lymphozytärer Alveolitis, wenn keine wesentliche Blutbeimengung) mittels Durchflusszytometrie oder Immunzytologie auf CD3, CD4, CD8, CD20 (CD19), CD56; bei Bedarf CD57, CD45, CD45RO / RA, CD11a, CD1a. EM-Analysen auf Fremdmaterial bei Bedarf. Bewährt hat sich die Asbestkörperchenbestimmung im BAL-Sediment. Die Auszählung ist nicht so gut wie Quantifizierung in Gewebskaltveraschung, gibt aber doch relative Aussage über Expositionsmenge und kann gutachterlich verwertet werden. BAL-Flüssigkeit für Mediatoranalysen tieffrieren (Durchführung auf Klinikanforderung). Hier ist in Zukunft mit einem klinischen Bedarf zu rechnen. Folgende Nachweise auf Basis eines ELISA-Assays sind derzeit etabliert: Interleukine (bes. IL-2Rezeptor), Prostaglandine (bes. bei Asthma), PDGF bei Fibrose. B) Bürste, Feinnadelpunktionszytologie Fixiert oder unfixiert, alle eingelangten Ausstriche mit PAP und Methylenblau (Giemsa, May-Grünwald-Giemsa, AzurII-Giemsa, etc.) gefärbt; bei Bedarf Immunzytologie (s.u.). C) Ergusszytologie Fixiert oder unfixiert, 4-6 Ausstriche anfertigen und mit PAP und Methylenblau (Giemsa, May-Grünwald-Giemsa, AzurII-Giemsa, etc.) färben. Reserveausstriche asservieren; bei Bedarf Immunzytologie (s.u.). Version: März 2002 3.7.5 ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 FÄRBUNGEN A) Standardfärbungen und Sonderfärbungen HE, PAS, Alcianblau, EvG oder Movat, Kongorot; Keime: Gram, ZN oder Auramin-Rhodamin, Fite, PAS, Versilberungen (am besten Grocott); B) Immunhistochemie CK, Vim, neuroendokrine Marker (CGA, Synaptophysin, NCAM statt NSE, Immunglobuline und Komplement (C5-9), Erregerdiagnostik eventuell mittels Antikörpern, übliche Lymphomimmunhistochemie; weitere Marker bei Bedarf oder auf Anforderung wie Hormone, Peptide und biogene Amine, CK-Komponenten, CD1a, S-100, mesenchymale Differenzierungsmarker (Des, SMA, F VIII oder CD34, etc.). C) Molekularbiologische Methoden In situ Hybridisierung auf CMV, EBV, Adenoviren, RSV, HSV I u. II, HPV, Chlamydien. PCR auf Mycobakterien (auch atypische), ev. auch EBV. D) EM-Einsatz Bei Bedarf bei Pneumokoniosen. Ciliendyskinesiesyndrom und Elementanalysen bei REFERENZZENTREN Einer Empfehlung des Vorstandes der ÖGP entsprechend wird auf die konkrete Nennung von Referenzzentren in Österreich verzichtet. Es steht jedem Pathologen frei, sich seine Referenzstelle selbst auszusuchen und seine Problemfälle dorthin zu senden ( in Österreich oder im Ausland). Als Referenz- und Konsultationszentren bieten sich an: Für Tumoren: Travis (AFIP, Washington D.C.), Colley (Mayoklinik) Version: März 2002 3.7.6 ÖGP Qualitätsstandards in der Pathologie Lungen- & Pleurapathologie 3.7 Für interstitielle entzündliche Lungenerkrankungen: Colby (Mayoklinik), Scottdale und Corrin (London) Für Transplantationsfälle: Yousem (Pittsburgh) Pädiatrische Pulmopathologie: Langston (Houston) Pneumokoniosen: Churg (Vancouver), Roggli (Durham) Pleuratumoren: Gallateau-Salle (Caen), Henderson (BedfordPark) LITERATUR AFIP – Atlas of Tumor Pathology: Tumors of the Lower Respiratory Tract Th. Colby, M. Koss, W. Travis, 1995 WHO: Histological Typing of Lung and Pleural Tumours W.Travis, T. Colby, B. Corvin, Y. Shimosato, E. Brombillo, 1999 Katzenstein and Askin´s Surgical Pathology of Non-Neoplastic Lung Disease A.-L. A. Katzenstein, W.B. Saunders Company 1997 Pulmonary Pathology, D. H. Dail, S. P. Hammar, Springer 1994 Version: März 2002 3.7.7