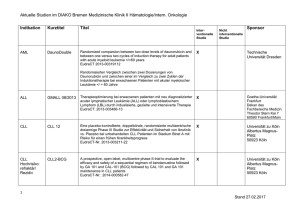
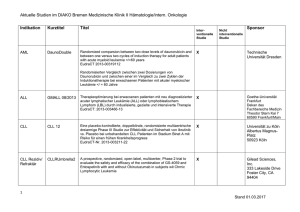
Zevalin® als Erstlinientherapie beim follikulären Lymphom Studientitel
Werbung

CharitéCentrum für Tumormedizin (CC14) Studienzentrale Hämatologie und Onkologie, Campus Virchow-Klinikum Tel.: 030 450 553 862, 030 450 653 862, FAX: 030 450 553 966 Kurztitel: Zevalin® als Erstlinientherapie beim follikulären Lymphom Studientitel: Multizentrische europäische Pilotstudie mit 90 Yttrium-Ibritumomab- Tiuxetan (90Y-Ibritumomab-Tiuxetan) (Zevalin) als Erstlinientherapie für follikuläre Lymphome im Stadium III-IV (und ausgewählte Patienten mit ausgedehntem abdominellem Stadium II) gefolgt von einer Konsolidierungstherapie mit Rituximab für Patienten mit kompletter Remission aber persistierender molekularer Erkrankung EudraCT-Nummer: 2006-005778-34 Studiendesign: Prospektive, multizentrische, nicht-randomisierte Phase II Studie Prof. Dr. med. A. Pezzutto (LKP nach § 40 AMG) PD Dr. med. C. Scholz (Studienkoordinator) Prüfärzte: PD Dr. med. C. Scholz, Dr. med. Kristina Lerch Leitungsbüro der Studienzentrale Hämatologie und Onkologie Studiensekretariat: CharitéCentrum für Tumormedizin (CC14) Medizinische Klinik m.S. Hämatologie und Onkologie Direktor: Prof. Dr. med. B. Dörken Campus Virchow-Klinikum Charité Universitätsmedizin-Berlin, D-13353 Berlin Tel.: ++49 30 450 553 862 / - 653 862 (DECT) Fax: ++49 30 450 553 966 Molekulare Diagnostik: Dr. med. Christiane Pott Universitätsklinikum Schleswig-Holstein, II. Medizinische Klinik Follikuläre Lymphome sind sehr strahlensensitive Malignome. In den Rationale: Studienleitung: frühen Stadien I und Lymphombestrahlung erreicht. Bei den II werden langandauernde fortgeschrittenen mit einer komplette Stadien III konventionellen Remissionen oder IV und ausgedehntem abdominellem Stadium II ist eine konventionelle Bestrahlung aufgrund der Toxizität nicht möglich. Zwei kürzlich durchgeführte kleinere Studien mit den Radioimmunotherapeutika Tositumomab (Bexxar®) und 90 131 I- Y-Ibritumomab-Tiuxetan (Zevalin®) ergaben bei Patienten mit bisher nicht therapierten, fortgeschrittenen follikulären Lymphomen exzellente komplette Remissionsraten und langanhaltende progressionsfreie Intervalle. Die Behandlung mit 90 Y- Ibritumomab-Tiuxetan (Zevalin®) erwies sich als nebenwirkungsarm. Wir rechnen daher damit, dass wir bei einem Teil der Patienten mit follikulärem Lymphom mit dieser nebenwirkungsarmen Therapie sehr langanhaltende Remissionen erreichen und dass diesen Patienten die 1 CharitéCentrum für Tumormedizin (CC14) Studienzentrale Hämatologie und Onkologie, Campus Virchow-Klinikum Tel.: 030 450 553 862, 030 450 653 862, FAX: 030 450 553 966 Nebenwirkungen und Spätkomplikationen einer Chemotherapie erspart bleiben. Therapieindikation: a.) B-Symptome und/oder b.) Tumorprogression > 50% in den letzten 6 Monaten und/oder c.) Organkompression durch das Lymphom und/oder d.) Tumorbulk > 5 cm in wenigstens einer Messachse und/oder e.) Histologischer Grad IIIa Studienziele: Primäres Ziel: Klinische und molekulare Remissionsrate nach Primärtherapie mit 90 Sekundäre Ziele: Y-Ibritumomab-Tiuxetan (Zevalin) a.) Zeit bis zur Progression nach Behandlung mit Zevalin b.) Molekulares Ansprechen nach Konsolidierungstherapie mit Rituximab bei Patienten in klinischer Remission mit persistierender molekularer Erkrankung 6 Monate nach Zevalin c.) Sicherheit und Verträglichkeit einer Therapie mit Zevalin Patientenzahl: 60 Registrierungsbeginn Juni 2007 Einschlusskriterien Alter > 50 Jahre Follikuläres Lymphom Grad I, II, IIIa (REAL/WHO Kriterien) Ann Arbor Stadium III, IV oder II mit disseminiertem abdominellem Ausschlusskriterien Befall, der eine extensive abd. Bestrahlung erfordern würde Keine vorherige Chemotherapie, Immuntherapie oder Bestrahlung Lymphomzellen CD 20 positiv Messbare Lymphknotenmanifestation (klinisch oder radiologisch) WHO/ECOG Performance Status 0-2 Schriftliche Einverständniserklärung Knochenmarkinfiltration > 25% Leukozytopenie < 2500/µl Thrombozytopenie < 100000/µl Lymphombulk >10 cm ZNS Lymphom Manifestation Zirkulierende Lymphomzellen > 500/µl Ausgeprägte Pleuraergüsse oder Aszites (> 1000 ml, sonographisch oder computertomographisch geschätzt) Schwere Begleiterkrankungen, die eine protokollgerechte Therapie unmöglich machen (z.B. Herzinsuffizienz, Myokardinfarkt innerhalb der letzten 6 Monate vor Studieneinschluss, schwerer, nicht kontrollierter Hypertonus, dialysepflichtige Niereninsuffizienz, Lungenerkrankung, Lebererkrankung) Abnormale Leberfunktion: Transaminasen oder Gesamtbilirubin >2 2 CharitéCentrum für Tumormedizin (CC14) Studienzentrale Hämatologie und Onkologie, Campus Virchow-Klinikum Tel.: 030 450 553 862, 030 450 653 862, FAX: 030 450 553 966 Therapie: x obere Normgrenze (soweit nicht durch das Lymphom verursacht) Abnormale Nierenfunktion: Serum-Kreatinin >2 x obere Normgrenze (soweit nicht durch das Lymphom verursacht) Vorausgegangenes Malignom außer Nicht-Melanom Hautkrebs Schwangere und stillende Patienten (bei fertilen Frauen ist ein negativer Schwangerschaftstest erforderlich), keine ausreichende Kontrazeption HIV Infektion Bekannte Überempfindlichkeit gegen körperfremde Proteine, murine Antikörper, Vorliegen einer humanen anti-murinen Antikörper (HAMA) Reaktivität Schwere psychiatrische Erkrankung Patienten, die den Ein- und Ausschlusskriterien entsprechen und in die Studie einwilligen, werden für die Studie registriert. Anschließend erhalten sie am Tag 1 der Studie eine Infusion von 250 mg/m2 Rituximab über ca. 2 Stunden sowie im Anschluss hieran zur Dosimetrie die Substanz 111 Indium-Ibritumomab-Tiuxetan i.v. über 10 Minuten. Zur Dosimetrie werden dann Ganzkörperszintigramme sofort nach der Injektion sowie nach 3-4, 24, 48 und nach 60 bzw. 72 Stunden durchgeführt. Am Tag 8 erhalten die Patienten erneut eine Infusion von 250 mg/m2 Rituximab über ca. 2 Stunden und anschließend das Radioimmuntherapeutikum 90 Y-Ibritumomab- Tiuxetan (die Substanz wird von Bayer Vital gestellt) als langsame i.v. Infusion über 10 min. Damit ist die Radioimmunotherapie im Rahmen der Studie abgeschlossen. Die Studienmedikation wird gestellt und die gesamte Behandlung findet ambulant statt. Nach Durchführung der Radioimmuntherapie im Rahmen der Studie werden die Patienten, ähnlich wie nach einer Chemoimmuntherapie ausserhalb von Studien, regelmäßig nachuntersucht. Patienten, die 6 Monate nach Zevalin-Gabe eine klinische und bildgebende komplette Remission, aber keine molekularbiologische Remission erreichen (das heisst Persistenz des Bcl-2/IgH-Fusionstranskriptes im Blut oder Knochenmark, falls dieses initial befallen war), erhalten im weiteren 4 mal im wöchentlichen Abstand 375 mg/m2 Rituximab und dann 4 mal im zweimonatlichen Abstand Rituximab 375 mg/m2 über jeweils ca. 3 Stunden. Auch diese Behandlung erfolgt ambulant. Anschließend 3 CharitéCentrum für Tumormedizin (CC14) Studienzentrale Hämatologie und Onkologie, Campus Virchow-Klinikum Tel.: 030 450 553 862, 030 450 653 862, FAX: 030 450 553 966 werden auch diese Patienten regelmäßig nachuntersucht. Patienten deren Erkrankung unter Therapie progredient ist oder die ein Rezidiv erleiden, werden ausserhalb der Studie nach Maßgabe der jeweilig verantwortlichen Ärzte behandelt. Fließschema: 4