Document
Werbung
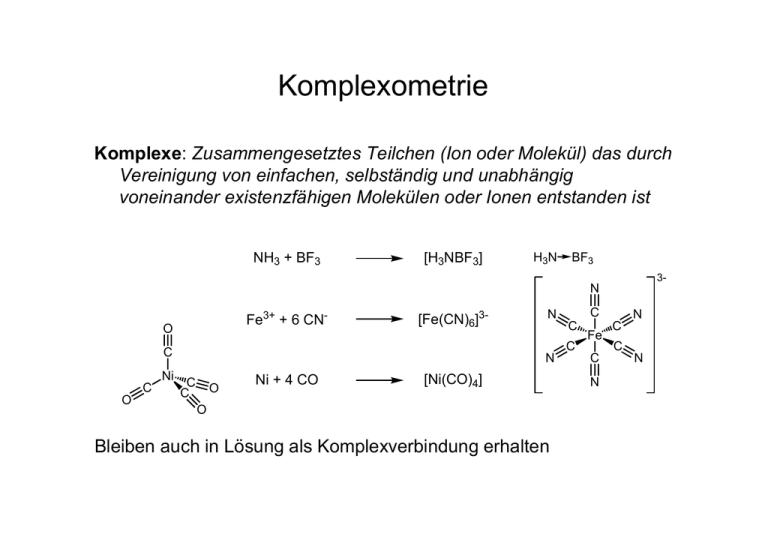
Komplexometrie Komplexe: Zusammengesetztes Teilchen (Ion oder Molekül) das durch Vereinigung von einfachen, selbständig und unabhängig voneinander existenzfähigen Molekülen oder Ionen entstanden ist NH3 + BF3 [H3NBF3] H3N BF3 3- N Fe3+ + 6 CN- O [Fe(CN)6]3- O C C C C C N N Ni C C O Ni + 4 CO [Ni(CO)4] O Bleiben auch in Lösung als Komplexverbindung erhalten Fe C N N C C N Aufbau der Komplexe • Komplex besteht aus Zentralatom oder -ion und Liganden • Zusammenhalt über koordinative Bindungen (Donor-AkzeptorBindung) • Anzahl der koordinativen Bindungen (des Zentralteilchens): Koordinationszahl (häufig 4 oder 6) Aufbau der Komplexe • Bestimmte Koordinationszahlen ergeben (oft) bestimmte Koordinationsgeometrien Cl O H3 N C H3N Ag NH3 Ni C C C O Cl Pt C N C C NH3 O N NH3 Cl + O Pt N NH3 3- Fe N C C C N Cl linear tetraedrisch 2 4 quadratisch planar 4 oktaedrisch 6 N Chelatkomplexe • „Zähnigkeit“ eines Liganden: Anzahl der koordinativen Bindungen, die ein Ligand aufbauen kann. • Chelatkomplex: Mehrzähniger Ligand besetzt mehrere Koordinationsstellen am gleichen Zentralteilchen (besonders stabil) Chelateffekt • Chelatkomplexe weisen eine besondere thermodynamische Stabilität auf: • Grund: Entropieeffekt [Fe(H2O)6]3+ + 3 C2O42- [Fe(C2O4)3]3- + 6 H2O ∆G = ∆H − T∆S ∆S > 0 ⇒ ∆G < 0 Komplexbildungskonstante M 2+ Fe x+ +nL + 6 CN - [MLn] c([ML n ]x + ) K= c ( M x + ) ⋅ c ( L) n x+ [Fe(CN)6] 4- c([Fe(CN) 6 ]4− ) K= c(Fe 2+ ) ⋅ c(CN − ) 6 • Gleichgewichtskonstante K (Komplexbildungskonstante) gibt Maß für die Stabilität einer Komplexverbindung • Beim Vergleich: Koordinationszahl beachten ! Komplexbildungstitrationen Cu2+ + 4 NH3 [Cu(NH3)4]2+ K = 3,89·1012 • Einzähnige Liganden nicht geeignet, weil keine sprunghafte Konzentrationsänderungen auftreten (schrittweise Substitution) Cu2+ + NH3 [Cu(NH3)]2+ + NH3 [Cu(NH3)]2+ [Cu(NH3)2]2+ K = 1,35·104 K = 3,02·103 [Cu(NH3)2]2+ + NH3 [Cu(NH3)3]2+ K = 7,41·102 [Cu(NH3)3]2+ + NH3 [Cu(NH3)4]2+ K = 1,29·102 Komplexbildungstitrationen H2N NH NH + Cu2+ HN NH Cu2+ N H2 K=3,16·1020 N H2 NH2 • Mehrzähnige Liganden verwenden (Substitution in einem Schritt) • Sehr stabile Chelatkomplexe (spannungsfreie 5- oder 6-Ringe) Komplexbildungstitrationen • Sehr häufig verwendet wird EDTA (Ethylendiamintetraessigsäure) H4Y • Wegen besserer Löslichkeit in Wasser als Dinatriumsalz Na2H2Y (Titriplex III) O HO C O CH2 N HO O C C OH H2C C OH O O O O C H HO CH2 H2C H2 H2 C C N C O CH2 N CH2 H2C C H2 H2 C C N H H2C C O OH O O O N EDTA-Komplexe O M N O O O C H O C O O CH2 N H2C C H2 H2 C C N H H2C C O + Mx+ + 2 H+ O O H2Y2- + Mx+ MYx-4 + 2 H+ • Bei der Titration werden H+ freigesetzt: Puffer verwenden ! Indikation des Endpunkts Prinzip: • Indikator bildet Komplex mit Metallion • Während der Titration bildet sich Metall-EDTA-Komplex • Zum Schluss wird das Metall aus dem Indikatorkomplex verdrängt • Freier Indikator hat andere Farbe als komplexierter Indikator M2+ M2+ M2+ 2+ [MInd] M2+ M2+ M2+ M2+ M M2+ 2+ • M2+ [MInd]2+ [MY]2- [MY]2[MY]2[MInd]2+ 22- [MY] [MY]2[MY] 2- [MY]2- 2- [MY]2- [MY] [MY] [MInd]2+ [MY]2- [MY]2[MY]2[MY]2- Ind 2[MY]2- [MY]2- [MY] [MY] 2- [MY]2- 2- [MY]2- [MY] Indikator muss schwächeren Komplex mit Metall bilden als EDTA [MY]2Ind Indikation des Endpunkts - O3S OH - N + N O 2N O3S O M2+ HO N M N O + O2N COOH Eriochromschwarz T O O S O COOH N COOH OH OH N N CH3 SO3H N HO Calconcarbonsäure HOOC HO COOH CH3 Xylenolorange 2 H+ Anwendung: Wasserhärte Wasserhärte: Gesamtkonzentration an Calcium und Magnesiumsalzen im Wasser (Gesamthärte) Wir unterscheiden in: • Temporäre Härte: verursacht durch lösliche Hydrogencarbonate, lässt sich durch Kochen beseitigen: Ca(HCO3)2 • CaCO3 + H2O + CO2 Permanente Härte: verursacht durch Mineralsalze (Chloride, Sulfate, Nitrate etc.), lässt sich durch Kochen nicht beseitigen Angabe in deutscher Härtegrad (°d) 1°d entspricht 10 mg CaO pro Liter Wasser Anwendung: Wasserhärte Vorgehen: • Bestimmung der Gesamtkonzentration von Ca2+ und Mg2+ (Gesamthärte) durch Titration gegen Erio T bei pH ca. 10 • Bestimmung der Konzentration von Ca2+ (Calciumhärte) durch Titration gegen Calconcarbonsäure bei pH ca. 12 Mg2+ + 2 OH- Mg(OH)2 Beispiel • Bei der Wasserhärtebestimmung wurden für 50 ml Trinkwasser 12 ml (V1, Gesamthärte) bzw. 10 ml (V2, Calciumhärte) EDTALösung (0,01 mol/l) verbraucht. Wie ist der Gesamthärtegrad in °dH und wie viel mg Ca2+ bzw. Mg2+ ist pro Liter Wasser enthalten ? n (Ca + Mg) = c ⋅ V1 = 0,01 mol l −1 ⋅ 0,012 L = 1,2 ⋅ 10-4 mol m(CaO, 50ml) = n (Ca + Mg) ⋅ M (CaO ) = 1,2 ⋅ 10-4 mol ⋅ 56,08 g mol−1 = 6,73 ⋅ 10-3 g m(CaO, 1000ml) = m(CaO, 50ml) ⋅ 20 = 6,73 ⋅ 10-3 g ⋅ 20 = 0,1346 g 0,1346 g m(CaO, 1000ml) °dH = = = 13,46 10 mg(CaO, 1000ml) 0,010 g n (Ca,50ml) = c ⋅ V2 = 0,01 mol l −1 ⋅ 0,010 L = 1,0 ⋅ 10-4 mol n ( Mg,50ml) = n (Ca + Mg) − n(Ca ) = 1,2 ⋅ 10-4 mol − 1,0 ⋅ 10-4 mol = 0,2 ⋅ 10-4 mol m(Ca,1000ml) = 20 ⋅ n (Ca ) ⋅ M (Ca ) = 20 ⋅ 1,0 ⋅ 10-4 mol ⋅ 40,08 g mol−1 = 80,2 mg m( Mg,1000ml) = 20 ⋅ n( Mg) ⋅ M ( Mg) = 20 ⋅ 0,2 ⋅ 10-4 mol ⋅ 24,31 g mol−1 = 9,7 mg Bestimmung von Al3+ mit Rücktitration Al3+ bildet nur langsam einen Komplex mit EDTA. Vorgehen: • Abgemessener Überschuss von EDTA verwenden • Überschuss an EDTA wird mit Titration durch Zn2+ bestimmt • Indikator: Xylenolorange (Erio T kann auch verwendet werden, bildet aber mit Al3+ langsam einen sehr stabilen Komplex) Beispiel Bei der Al3+ - Bestimmung wurde Al3+ mit 20,00 ml EDTA-Lösung (0,1 mol/l) komplexiert. Der Überschuss an EDTA wird mit ZnSO4 (0,2 mol/l) zurücktitriert. Verbrauch: 4,00 ml. Wieviel Al3+ war in der Probe enthalten ? n ( EDTA ) = c( EDTA ) ⋅ V ( EDTA ) = 0,1 mol l −1 ⋅ 0,020 L = 2,0 ⋅ 10-3 mol n ( Zn 2+ ) = c( Zn 2+ ) ⋅ V ( Zn 2+ ) = 0,2 mol l −1 ⋅ 0,004 L = 0,8 ⋅ 10-3 mol n ( Al3+ ) = n ( EDTA ) − n ( Zn 2+ ) = 2,0 ⋅ 10-3 mol − 0,8 ⋅ 10-3 mol = 1,2 ⋅ 10-3 mol m( Al3+ ) = n( Al3+ ) ⋅ M ( Al3+ ) = 1,2 ⋅ 10-3 mol ⋅ 26,98 g mol−1 = 32,4 ⋅ 10-3 g = 32,4 mg











