ANGEBORENER HERZFEHLER
Werbung

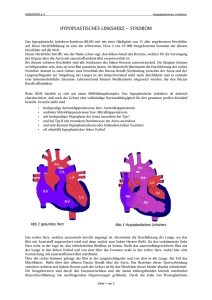
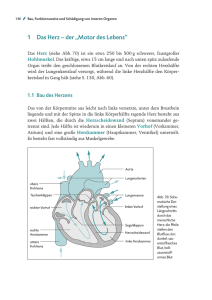
Herz für KinderH KinderHerzen Kinder Herzen informationen zu angeborenen HerzfeH HerzfeHlern Herzfe Hlern Herz für KinderHerzen informationen zu angeborenen HerzfeHlern Kardiologie ist unsere Leidenschaft, deshalb arbeitet St. Jude Medical kontinuierlich daran, Technologien weiterzuentwickeln und voranzutreiben. Doch bei aller Innovation verlieren wir das Wichtigste nie aus den Augen: den Menschen. Jedes Jahr kommen in Deutschland geschätzte 6.500 Babys mit einem angeborenen Herzfehler zur Welt und bei nahezu 25 Prozent dieser Kinder muss im ersten Lebensjahr eine Operation durchgeführt werden1. Damit sie die notwendige Behandlung bekommen, ist eine Frühdiagnose von größter Wichtigkeit. Dank medizinischer Forschung und entsprechender Fortschritte erreichen heute mehr Kinder als je zuvor das Erwachsenenalter. Viele Kinder werden jedoch mit Medizintechnik in Erwachsenengrößen behandelt, was nicht immer die beste Option für sie ist. Aus diesem Grund widmet sich St. Jude Medical der Erforschung und Entwicklung von sicheren und wirksamen medizinischen Geräten, deren Größe auf die noch nicht ausgewachsenen Herzen von Kindern abgestimmt ist. St. Jude Medical hat sich dazu verpflichtet, sichere und effektive Medizintechnik zu entwickeln, die für wachsende Kinderherzen geeignet ist. Mit unserer Unterstützung wohltätiger Organisationen möchten wir Vereinen und Stiftungen helfen, die sich als Ziel gesetzt haben, den Zugang zu einer hochwertigen Kinderherzmedizin zu vereinfachen, und daran arbeiten, dass jedes herzkranke Kind auf dieser Welt eine rasche Behandlung bekommen kann. St. Jude Medical Macht KinderKardiologie zur herzenSangelegenheit 1 Deutscher Herzbericht 2015, Deutsche Herzstiftung Ein weiterer Schwerpunkt von Herz für Kinderherzen ist die Herausgabe von Informationen für Eltern von Kindern mit einem angeborenen Herzfehler. Der Elternratgeber von MendedLittle Little Hearts spricht viele Themen an, mit denen sich Eltern und Betreuer konfrontiert sehen. Als zusätzliche Quelle gibt es diese Broschüre von Herz für Kinderherzen. folgende tHemen werden näHer erörtert: Diagnose: Angeborener Herzfehler Implantate für Kinder mit einem angeborenen Herzfehler Familienorientierte Rehabilitation – Die ganze Familie ist der Patient Klinikwegweiser Nützliche Links für weitere Informationen: Aktionsbündnis angeborene Herzfehler/Patientenorganisationen Fachgesellschaft Stillen & Ernährung Kinderbücher zum Thema „Krankenhaus und OP“ Beratung bei Entwicklungsstörungen Finanzielle Beratung diagnose: angeborener HerzfeHler Etwa jedes 100. lebendgeborene Kind ist betroffen von einem angeborenen Herzfehler, welcher damit als häufigste angestammte Fehlbildung beim Menschen gilt. Etwa 40 Prozent sind dabei so komplex, dass Betroffene unter ärztlicher Beobachtung stehen und sich behandeln lassen müssen2. Bei den meisten Herzerkrankungen handelt es sich um einfache, ungefährliche Fehlbildungen, dennoch bedarf jedes erkrankte Kind einer individuell zugeschnittenen Therapie. Grundlegend ist dabei, dass sowohl Kind wie auch Eltern ausführlich über das jeweilige Krankheitsbild, die Behandlungsmöglichkeiten und die Aussichten auf ein normales Leben informiert und begleitet werden. Warum einige Kinder mit Herzfehlern zur Welt kommen, ist bis heute nicht bekannt. Obwohl angeborene Herzfehler in einigen Familien vermehrt auftreten, ist die Erkrankung nicht erblich bedingt. Auffällig ist, dass etwa jedes fünfte betroffene Kind bei der Geburt unter einer weiteren Krankheit, dem Down-Syndrom, auch als Trisomie 21 bekannt, leidet. in deutSchland KoMMen JedeS Jahr 6.500 Kinder Mit eineM ahF zur Welt Innovativen Diagnose- und Behandlungsmöglichkeiten ist es zu verdanken, dass heutzutage immer mehr Kinder mit angeborenem Herzfehler, auch in ihrer schwersten Form, das Erwachsenenalter erreichen. So können viele Kinder, die noch vor wenigen Jahren nur geringe Überlebenschancen gehabt hätten, heute auf ein weitgehend beschwerdefreies Leben hoffen. 2 5 Deutscher Herzbericht 2015, Deutsche Herzstiftung Aortenisthmusstenose Unter einer Stenose verstehen Mediziner eine Verengung eines Blutgefäßes. Bei einer Aortenisthmusstenose ist die Aorta – die Hauptschlagader, welche sauerstoffreiches Blut vom Herzen in den Rest des Körpers leitet – verengt und die linke Herzkammer muss somit deutlich mehr Pumparbeit leisten, um das Blut durch die verengte Hauptschlagader zu treiben. Eine schwerwiegendere Form dieses Herzfehlers ist der unterbrochene Aortenbogen. In diesem Zusammenhang bedeutet „unterbrochen“, dass einzelne Teile der Hauptschlagader voneinander abgeschnitten sind und die Aorta kein sauerstoffreiches Blut in den Körper weiterleiten kann. Auch bei gesunden Neugeborenen besteht zwischen Aorta und Lungenschlagader ein Verbindungsgang, der Bestandteil des fetalen Blutkreislaufs ist und sich nach der Entbindung schließt. Bei einigen Kindern mit Aortenisthmusstenose bleibt dieser Gang jedoch offen. Für Babys mit unterbrochenem Aortenbogen ist diese Verbindung als einzige mögliche Passage für den Blutkreislauf sogar überlebenswichtig. Verschließt sich der Gang, verschlechtert sich auch der Zustand dieser Kinder rapide. Aortenstenose Bei einer Aortenstenose kommt es zu einer Verengung der sogenannten Aortenklappe. Dadurch kann das sauerstoffreiche Blut nicht mehr ausreichend von der linken Herzkammer in die Hauptschlagader gepumpt werden. In der Folge kommt es zu einer Unterversorgung des Körpers mit Sauerstoff. Manchmal liegt die Verengung auch ober- oder unterhalb der Herzklappe. Zudem kann eine Stenose in leichter, mittelschwerer und schwerer Form auftreten. Atrioventrikulärer septumdefekt eptumdefekt (Avsd) (Avsd) (A „Atrio-“ bezieht sich auf die Vorhöfe, sogenannte Atrien. „Ventrikulär“ bezeichnet die Kammern (Ventrikel) – die vier Hohlräume des Herzens. Unter „Septum“ verstehen Experten die Scheidewand, welche die rechte und die linke Herzhälfte voneinander trennt. Mit einem „Defekt“ ist in diesem Zusammenhang ein Loch gemeint. 6 Kommt es zu einem atrioventrikulären Septumdefekt (AVSD,) ist in der Vorhofscheidewand (atriale Komponente) eine Öffnung, die sich in der Scheidewand zwischen den Herzkammern fortsetzt (ventrikuläre Komponente). Anstelle der beiden separaten Herzklappen liegt lediglich eine einzige gemeinsame Klappe vor. In der Herzmitte befindet sich somit ein Loch. Aufgrund des AVSD kommt es zu einem höheren Druck in der linken Herzhälfte. Daher fließt das Blut vom linken in den rechten Vorhof sowie von der linken in die rechte Herzkammer. Aus diesem Grund wird gleichzeitig zu viel Blut mit sehr hohem Druck in die Lungenschlagader und in die Lunge gepumpt. In der Folge muss das Herz mehr Arbeit leisten. Häufig ist die gemeinsame Herzklappe undicht, sodass Blut in den linken oder den rechten Vorhof oder auch in beide Vorhöfe übertritt. Dies führt zu einer weiteren Mehrbelastung des Herzens. Neben der sogenannten „kompletten“ Form gibt es auch „partielle“ AVSD sowie den „intermediären“ Typ. Bei einem intermediären AVSD liegt eine kleine ventrikuläre Komponente vor. Ein partieller AVSD äußert sich dadurch, dass lediglich eine atriale Komponente vorliegt und die gemeinsame Herzklappenanlage in zwei getrennte Klappen unterteilt ist. Häufig ist die sogenannte Mitralklappe auf der linken Seite undicht. ebstein-AnomAlie Diese Fehlbildung verdankt ihren Namen dem Arzt Wilhelm Ebstein und wird ergänzt durch den Begriff „Anomalie“, der auf eine Unregelmäßigkeit beziehungsweise Fehlentwicklung hinweist. Die wesentlichen Merkmale einer Ebstein-Anomalie sind: Es kommt zu einer Verlagerung der Trikuspidalklappe. Diese befindet sich nicht mittig zwischen rechtem Vorhof und rechter Herzkammer, sondern ist in die Tiefe der rechten Herzkammer verschoben. Der rechte Vorhof ist entsprechend größer und die rechte Herzkammer kleiner als bei einem normalen Herz. Es wird somit weniger sauerstoffarmes Blut in die Lunge gepumpt, das sich dort mit Sauerstoff anreichern könnte. Das aus der linken Herzkammer in die Hauptschlagader gepumpte und von dort durch den Körper geleitete Blut enthält nicht genug Sauerstoff, um eine ausreichende Versorgung sicherstellen zu können. Die Wand zwischen den Vorhöfen hat häufig ein Loch – einen sogenannten Atriumseptumdefekt –, durch das sauerstoffarmes Blut vom rechten in den linken Vorhof übertritt. Eine Ebstein-Anomalie kann in verschiedenen Schweregraden auftreten. Dabei wird von sehr leicht und symptomarm bis hin zu sehr schwer differenziert. Wie stark sich eine Fehlbildung auf das Befinden von Betroffenen auswirkt, hängt davon ab, wie viel Blut die Lunge erreicht, dort Sauerstoff aufnimmt und im Anschluss den Körper versorgen kann. Im Falle einer leicht 7 ausgeprägten Anomalie kann der Patient abgesehen von Herzgeräuschen völlig beschwerdefrei sein. Bei einigen Babys ist eine bläuliche Hautverfärbung zu beobachten. In schwereren Fällen, in denen kaum Blut zur Lunge gelangt, können Neugeborene bereits während der Geburt lebensbedrohlich betroffen sein und benötigen sofort ärztliche Hilfe. fAllot-tetrAlogie Diese Bezeichnung der Fehlbildung lässt sich auf den französischen Arzt Étienne Fallot zurückführen, der diesen Herzfehlerkomplex als Erster beschrieb. „Tetralogie“ bedeutet „aus vier Teilen bestehend“ und weist darauf hin, dass bei diesem Komplex vier Fehlbildungen zugleich auftreten. Dabei handelt es sich um folgende vier Fehlbildungen: VeNtRIKeLsePtumDeFeKt (VsD) „Ventrikel“ lautet der Fachbegriff für die Herzkammern, die das Blut aus dem Herzen herauspumpen. „Septum“ bezeichnet die Scheidewand, welche die rechte und linke Herzhälfte voneinander trennt. Unter einem Defekt ist ein Loch zu verstehen. Bei einem sogenannten VSD handelt es sich somit um ein Loch in der Wand zwischen den beiden Herzkammern. Über dieses Loch kann folglich Blut von der einen zur anderen Seite übertreten. subPuLmoNALsteNose „Pulmonal-“ bedeutet, dass bei dieser Fehlbildung die Lunge betroffen ist. Eine Stenose ist eine Verengung. Bei einer Subpulmonalstenose handelt es sich um eine Verengung unterhalb der Pulmonalklappe. Hier ist somit der Blutfluss von der rechten Herzkammer in die Lungenschlagader beeinträchtigt. VeRDIcKuNg DeR RecHteN HeRzKAmmeR In diesem Fall verdickt sich die Muskulatur der rechten Herzkammer, da sie stärker pumpen muss, um das Blut durch die verengte Lungenschlagader zu pressen. ReIteNDe AoRtA t tA Bei einem normalen Herzen versorgt die Hauptschlagader, die Aorta, den Körperkreislauf mit sauerstoffreichem Blut. Wurde eine reitende Aorta diagnostiziert, entspringt sie oberhalb des VSD. Aus diesem Grund pumpt die rechte Herzkammer auch einen Teil des durch den VSD übertretenden sauerstoffarmen Bluts direkt in die Aorta. Es kommt vor, dass eine Fallot-Tetralogie auch als Teil eines Syndroms, etwa eines Down-Syndroms oder eines DiGeorge-Syndroms, auftritt. 8 hypoplAstisches linksherzsyndrom „Hypoplastisch“ bedeutet „unterentwickelt“. Der Begriff „Linksherz“ schließt alle Strukturen der linken Herzseite mit ein. Der Ausdruck „Syndrom“ zeigt auf, dass bei diesem Krankheitsbild mehrere Fehlbildungen zusammen auftreten. Im Falle eines hypoplastischen Linksherzsyndroms (HLHS) ist somit die linke Herzseite unterentwickelt. Die linke Herzkammer, welche bei einem normalen Herz sauerstoffreiches Blut in den Körper pumpt, ist außerdem komplett von der Hauptschlagader (Aorta) abgeschnitten. Gleichzeitig ist die Aorta, welche eigentlich den Körper mit sauerstoffreichem Blut versorgen müsste, für diese Aufgabe viel zu klein. kongenitAl kongenitA ongenit l korrigierte trAnsposition ongenitA Hierbei handelt es sich um einen angeborenen Herzfehler, der nur sehr selten auftritt. Im Falle einer Erkrankung sind die Stämme von Lungen- und Hauptschlagader seitenvertauscht. Durch eine ebenfalls seitenverkehrte Anordnung der Herzkammern wurde diese Fehlbildung vom Körper sozusagen „korrigiert“. Daher ist der rechte Vorhof mit der linken Herzkammer und diese mit der Lungenschlagader verbunden. Der linke Vorhof ist mit der rechten Herzkammer und diese wiederum mit der Hauptschlagader verbunden. Somit wird aus der rechten Kammer Blut in den Körper und aus der linken Kammer Blut in die Lunge gepumpt. Bei einem gesunden Herzen ist es umgekehrt. Da die Schlagadern ebenfalls vertauscht sind, gelangt jedoch wie im Normalfall sauerstoffarmes Blut in die Lunge und sauerstoffreiches Blut in den Körper. Abhängig vom Patienten kann die kongenital korrigierte Transposition unterschiedlich ausgeprägt sein. In der Regel geht sie mit weiteren Fehlbildungen einher. Dazu zählen unter anderem: Ventrikelseptumdefekt (VSD) unterhalb der Lungenschlagader kompletter Herzblock Pulmonalstenosen Ebstein-Anomalie fehlgebildete und undichte Herzklappen Lungenvenenfehlmündung Bei einer Lungenvenenfehlmündung sind alle oder zumindest ein Teil der Venen, die das mit Sauerstoff angereicherte Blut von der Lunge zurück zum Herz leiten, nicht mit dem linken Vorhof verbunden. Die Abkürzung für diesen Herzfehler lautet APVC (Anomalous Pulmonary Venous Connection). 9 Weitere Kürzel sind: APVD – Anomalous Pulmonary Venous Drainage (Fehldrainage der Lungenvenen) APVR – Anomalous Pulmonary Venous Return (Fehlrückfluss aus den Lungenvenen) Falls keine der Lungenvenen in den linken Vorhof mündet, spricht man von einer TAPVC – einer totalen Lungenvenenfehlmündung. Mündet ein Teil der Lungenvenen in den linken Vorhof, sprechen Experten von einer PAPVC – einer partiellen Lungenvenenfehlmündung. Statt das Blut aus der Lunge in den linken Vorhof zu leiten, können die Lungenvenen in folgende Gefäße münden: in die obere Hohlvene – hierbei handelt es sich um die große Vene, welche das sauerstoffarme Blut aus dem oberen Körperbereich zurück zum Herz bringt (hier liegt die Fehlmündung oberhalb des Herzens) in den Koronarsinus – die Vene, welche sauerstoffarmes Blut aus dem Herzmuskel selbst in den rechten Vorhof leitet (intrakardiale Fehlmündung) in die untere Hohlvene – die große Vene, die das sauerstoffarme Blut aus dem unteren Körperbereich zurück zum Herz bringt (intrakardiale Fehlmündung) Ganz gleich, mit welchem Gefäß die Venen verbunden sind – der Körper wird immer mit zu wenig sauerstoffreichem Blut versorgt. Gleichzeitig strömt jedoch erneut zu viel sauerstoffreiches Blut in die Lunge. In vielen Fällen haben Kinder mit einer Lungenvenenfehlmündung auch einen Atriumseptumdefekt (ein Loch in der Wand zwischen dem rechten und linken Vorhof). Durch diese Öffnung gelangt eine kleine Menge sauerstoffreiches Blut aus dem rechten in den linken Vorhof. Das so entstehende Gemisch strömt in die linke Herzkammer und in die Hauptschlagader. Je größer der Atriumseptumdefekt, desto mehr sauerstoffreiches Blut kann in den linken Vorhof übertreten und umso geringer die Belastung, welche für das Kind aufgrund der Fehlbildung entsteht. persistierender ductus Arteriosus Unter „persistierend“ ist so viel wie „fortbestehend“ zu verstehen. Beim sogenannten „Ductus arteriosus“ handelt es sich um einen Verbindungsgang beim ungeborenen Kind, über den Blut zwischen der Haupt- (Aorta) und der Lungenschlagader ausgetauscht wird. Von einem persistierenden Ductus arteriosus (PDA) ist die Rede, wenn diese Verbindung nach der Geburt weiterhin besteht. Vor der Geburt zählt der Bluttransport von der Lungenschlagader über den Ductus arteriosus in die Aorta zu den wichtigsten Bestandteilen des sogenannten fetalen Blutkreislaufs. Bereits in den ersten Stunden nach der Geburt beginnt sich diese Verbindung zu schließen. Bleibt ein Verschluss allerdings aus, gelangt Blut von der Aorta in die Lunge, was zu einer Überbelastung von Herz und 10 Lunge führt. In diesem Fall sprechen Experten von einem persistierenden Ductus arteriosus oder auch einem offenen Ductus arteriosus. Oftmals tritt dies bei Frühgeborenen auf. Ein PDA geht auch in Kombination mit anderen Herzfehlern einher, etwa mit einer Aortenstenose. Teilweise setzt der Kardiologe dann ein Medikament namens Prostaglandin ein, um die Verbindung künstlich offen zu halten. Bei Fehlbildungen wie etwa der Pulmonalatresie kann dadurch die Blutzufuhr in die Lunge erhöht werden. Bei anderen Fehlbildungen wie der Aortenstenose wird die Blutmenge, welche in die Aorta und somit in den Körper gelangt, erhöht. pulmonAlklAppenstenose „Pulmonal-“ heißt, dass bei dieser Form der Fehlbildung die Lungengefäße betroffen sind. Unter einer Stenose ist eine Verengung zu verstehen. Somit handelt es sich bei einer Pulmonalklappenstenose um eine Verengung der Pulmonalklappe. Aufgrund dieser Einschränkung kommt es zu einer Mehrbelastung der rechten Herzkammer, die stärker pumpen muss. Nur so gelangt das sauerstoffarme Blut durch die Pulmonalklappe in die Lungenschlagader und schließlich in die Lunge, um dort Sauerstoff aufzunehmen. trAnsposition der grossen gefässe (tgA) Unter „Transposition“ ist in diesem Fall „Vertauschung“ zu verstehen. Der menschliche Körper hat zwei große Gefäße, dabei handelt es sich um die Lungenschlagader, welche üblicherweise sauerstoffarmes Blut aus der rechten Herzkammer in die Lunge leitet und um die Hauptschlagader (Aorta), welche in der Regel sauerstoffreiches Blut aus der linken Herzkammer in den Körper transportiert. Im Falle einer Transposition der beiden großen Gefäße entspringt die Lungenschlagader dort, wo normalerweise die Aorta abgeht, und pumpt das sauerstoffreiche Blut aus der linken Herzkammer wieder in die Lunge. Die Aorta nimmt hingegen den Platz der Lungenschlagader ein und leitet das sauerstoffarme Blut erneut durch den Körper. Neben der TGA kann auch ein Ventrikelseptumdefekt (VSD) bestehen – ein Loch in der Wand zwischen den beiden unteren Herzkammern. Über dieses Loch kann Blut von der einen zur anderen Seite übertreten. Teilweise tritt eine TGA mit weiteren Fehlbildungen wie einer Aortenisthmus- oder einer Pulmonalstenose auf. 11 trikuspidAlAtresie A Atresie Der erste Wortteil weist darauf hin, dass bei dieser Fehlbildung die Trikuspidalklappe betroffen ist. Als Atresie bezeichnen Experten den Verschluss oder die Nichtanlage eines Organs. Bei einer Trikuspidalatresie ist: die Trikuspidalklappe verschlossen oder nicht angelegt die Pulmonalklappe unter Umständen verengt die Lungenschlagader enger als in einem normalen Herzen die rechte Herzkammer kleiner als in einem normalen Herzen Zwischen rechtem Vorhof und rechter Herzkammer fungiert die Trikuspidalklappe als „Einlassventil“. Ist diese Klappe verschlossen oder nur als Membran angelegt, wird kein sauerstoffarmes Blut durch die rechte Herzseite zur Lunge gepumpt. Neugeborene, die mit einer Trikuspidalatresie auf die Welt kommen, sind nur dann überlebensfähig, wenn eine der folgenden Situationen vorliegt: Der Ductus arteriosus ist noch offen. Diese Verbindung ist Teil des normalen vorgeburtlichen Blutkreislaufs und fügt die Haupt- mit der Lungenschlagader zusammen, sodass eine gewisse Blutmenge der Lunge zugeführt wird. In der Regel schließt sich dieser Verbindungsgang kurz nach der Geburt, doch für ein Neugeborenes mit Trikuspidalatresie kann genau dies lebensbedrohlich sein. Der Arzt wird daher versuchen, den Ductus arteriosus so lange offen zu halten, bis eine Operation möglich ist. Es besteht jeweils ein Loch zwischen den Vorhöfen, ein sogenannter Vorhofseptumdefekt (ASD), und zwischen den Herzkammern, ein sogenannter Ventrikelseptumdefekt (VSD). Aufgrund des ASD kann sauerstoffarmes Blut vom rechten in den linken Vorhof gelangen. Hier passiert es die Mitralklappe und tritt in die linke Herzkammer über. Nun wird ein Großteil des Bluts in die Hauptschlagader (die Aorta) gepumpt. Eine geringe Blutmenge fließt jedoch durch den VSD in die rechte Herzkammer und gelangt von dort, sofern diese nicht verschlossen ist, in die Lungenschlagader und letztlich in die Lunge. truncus Arteriosus communis In der Regel teilt sich bereits während der Entwicklung des fetalen Herzens im Mutterleib ein großer Gefäßstamm, der Truncus arteriosus, in die Hauptschlagader (Aorta) und die Lungenschlagader auf. Die Aorta ist dafür zuständig, sauerstoffreiches Blut aus dem Herzen in den Körper zu leiten. Die Lungenschlagader führt sauerstoffarmes Blut zur Lunge. Erfolgt die Trennung von Aorta und Lungenschlagader nicht, so kommt das Kind mit einem sogenannten persistierenden Truncus arteriosus beziehungsweise mit einem gemeinsamen Arterienstamm zur Welt. Statt zwei Schlagadern mit Pulmonal- und Aortenklappe entspringt nur eine große Schlagader aus dem Herzen, die mit einer einzigen großen „Truncusklappe“ versehen ist. Gleichzeitig fehlt auch ein Stück der Scheidewand zwischen rechter und linker Herzkammer – es besteht ein Ventrikelseptumdefekt (VSD). Somit gelangt in den gemeinsamen arteriellen Gefäßstamm sauerstoffarmes Blut aus der rechten und sauerstoffreiches Blut aus der linken Herzseite. 12 Der Truncus arteriosus communis teilt sich in Aorta und Lungenschlagader, die dieses sogenannte Mischblut jeweils zur Lunge und in den Körper transportieren. Experten unterscheiden drei verschiedene Formen dieses Herzfehlers: Typ 1 Ein einziger Lungenhauptstamm geht direkt oberhalb der Klappe ab. Typ 2 Die zur Lunge führenden Schlagadern entspringen separat, aber nahe beieinander direkt aus dem gemeinsamen Gefäßstamm. Typ 3 Die Lungenschlagadern zweigen separat und räumlich etwas versetzt ab. Wie diese Fehlbildung zu behandeln ist, hängt von der individuellen Ausprägung ab. In der Regel hat ein gemeinsamer Truncus arteriosus zur Folge, dass die Lunge mit Blut überflutet wird, der Körper jedoch nicht ausreichend sauerstoffreiches Blut erhält. ventrikelseptumdefekt Der Fachbegriff für die Herzkammern, die das Blut aus dem Herzen herauspumpen, lautet „Ventrikel“. Als „Septum“ bezeichnen Experten die Scheidewand, welche die rechte und die linke Herzhälfte voneinander trennt. Der Begriff „Defekt“ weist auf einen Fehler hin, in diesem Fall auf ein Loch. Um ein Ventrikelseptumdefekt (VSD) handelt es sich, wenn ein Loch in der Wand zwischen den beiden Herzkammern auftritt. Da auf der linken Herzseite ein höherer Druck herrscht, gelangt ein Teil des für die Hauptschlagader bestimmten Bluts durch die Septumöffnung in die rechte Herzkammer. Dort wird es mit dem sauerstoffarmen Blut vermischt und in die Lunge gepumpt. Im Falle eines kleinen VSD erhöht sich die in die Lunge gepumpte Blutmenge nur geringfügig und das Loch schließt sich meist von selbst. Unter Umständen dauert dieser Prozess lange – teilweise bis die Patienten erwachsen sind. Ein solch kleines Loch beeinträchtigt den Körper jedoch kaum und es führt auch zu keiner Erkrankung. Liegt ein größerer VSD vor oder besteht der Defekt aus mehreren Löchern, fließt sehr viel mehr Blut in die Lungengefäße als normal. Daher kommt es zu einer starken Beanspruchung der rechten Herzkammer, die gegen das zusätzliche Blut anpumpen muss. Zudem fließt die größere Blutmenge mit einem erhöhten Druck in Lungenarterie und Lunge. 13 Zugleich verliert die linke Herzkammer Blut an die rechte Kammer und muss nun noch stärker pumpen, damit genug Blut in die Hauptschlagader gelangt. Nur so ist die Versorgung des Körpers sicherzustellen. Letztlich werden sowohl Herz als auch Lunge übermäßig beansprucht. Mitunter tritt ein VSD in Verbindung mit einem oder mehreren weiteren Herzfehlern auf. In manchen Fällen ist ein VSD sogar notwendig, um den Blutkreislauf aufrechtzuerhalten – etwa bei einer Pulmonalatresie. vorhofseptumdefekt „Vorhöfe“, auch als Atria bezeichnet, sind Herzhohlräume, in denen sich das Blut zunächst sammelt. Darauf lässt sich auch die Abkürzung ASD (Atriumseptumdefekt) zurückführen. „Septum“ bezeichnet die Scheidewand, welche die rechte und linke Herzhälfte voneinander trennt. Der Begriff „Defekt“ weist auf einen Fehler hin, in diesem Fall auf ein Loch. Ein Vorhofseptumdefekt (ASD) oder Vorhofscheidewanddefekt ist somit ein Loch in der Wand zwischen den beiden Vorhöfen. Bei einem ASD herrscht im linken Vorhof ein höherer Blutdruck als im rechten. Aufgrund dieses Druckgefälles tritt Blut durch die Öffnung aus dem linken in den rechten Vorhof über. In der Folge muss das Herz mehr Blut als gewöhnlich aus dem rechten Vorhof in die Lunge pumpen. Wie viel Blut aus dem linken in den rechten Vorhof fließt, hängt von der Größe des Scheidewandlochs und dem Druckunterschied zwischen den Vorhöfen ab: Je mehr Blut das Loch passiert, desto stärker muss das Herz pumpen und umso höher fällt die Überbelastung aus. ASD treten in drei Formen auf: Als häufigste Form gilt der Ostium-secundumDefekt, welcher in einem Loch in der Mitte der Vorhofscheidewand besteht. Bei einem Ostium-primum-Defekt befindet sich das Loch im unteren Teil der Scheidewand. Gleichzeitig ist teilweise auch die Mitralklappe beschädigt. Die seltenste ASD-Form ist der Sinus-venosusDefekt. In diesem Fall liegt das Loch im oberen Bereich der Scheidewand. Oft geht dieser Defekt mit einer Fehlmündung der Lungenvene in den rechten Vorhof einher. 14 implantate für Kinder mit einem angeborenen HerzfeHler Neben operativen Eingriffen gibt es auch medizintechnische Implantate, die Kinder mit einem angeborenen Herzfehler unterstützen. Hier sind die wichtigsten aufgeführt und erklärt. 15 herzschrittmAcher Wenn das Herz nicht schnell genug schlägt (Bradykardie), gibt der Herzschrittmacher über einen oder mehrere Drähte (sogenannte Elektroden) einen kleinen elektrischen Impuls an das Herz ab, sodass dieses zum Schlagen angeregt wird. Stellt der Herzschrittmacher fest, dass das Herz angemessen schlägt, gibt er keinen Impuls ab, sondern befindet sich in einer Art „Stand-by“ (Überwachungsmodus). Wenn das System des Herzens ein Signal auslässt, sendet der Herzschrittmacher ein Signal als Ersatz. Diese Impulse sind winzig, und die meisten Menschen spüren sie überhaupt nicht. Das System hilft dem Herzen dadurch, im Rhythmus zu bleiben. Es speichert jedoch auch eine Reihe von Informationen über das Herz. Der Arzt kann diese Informationen abrufen. Sie herzSchrittMacher und icds unterStützen helfen ihm dabei, das System daS herz bei Seiner arbeit so zu programmieren, dass die Krankheit damit optimal behandelt wird. Bei der Implantation eines Herzschrittmachers setzt der Arzt einen kleinen Schnitt in die obere Brust und sucht eine Vene. Dann wird ein kleiner Stich in die Vene vorgenommen und die Elektroden werden durch die Vene hinunter ins Herz geführt. Danach testet der Arzt die Elektroden, um sich zu versichern, dass sie sich in der besten Position befinden, um das Herz mit Energie zu versorgen. schematische Darstellung der Platzierung des Herzschrittmachers Jetzt macht der Arzt eine „Tasche“, indem er die Haut und das Gewebe darunter von dem Muskel unterhalb des Gewebes trennt. Der Impulsgeber wird an die Elektroden angeschlossen und anschließend in diese Tasche eingesetzt. Je nach Alter oder Größe eines Kindes wird der Herzschrittmacher auch im Bauchraum implantiert. Nachdem das System eingesetzt wurde, näht der Arzt den Schnitt wieder zu. In regelmäßigen Abständen gibt es sogenannte Nachsorgeuntersuchungen, bei denen der behandelnde Arzt das System und die Programmierung überprüft und ggf. anpasst. 16 implAntierbArer kArdioverter-defibrillAtor AAtor ((icd) icd) Ein ICD (engl.: implantable cardioverter-defibrillator) ist ein kleines Implantat, das einem Herzschrittmacher ähnelt. Herzschrittmacher können den Herzschlag beschleunigen, wenn die Herzfrequenz zu niedrig ist. ICDs hingegen sind dazu gedacht, den Herzschlag zu verlangsamen, wenn er zu schnell ist. Bei einem lebensbedrohlich schnellen Herzrhythmus kann ein ICD lebensrettend wirken. Das Herz bildet ein komplexes elektrisches System und erzeugt elektrische Impulse. Dadurch kann es sich in der richtigen Zeitabfolge zusammenziehen (kontrahieren) und entspannen (erschlaffen). Durch den Wechsel aus Kontraktionen und Erschlaffungen wird Blut in den Körper gepumpt. Elektrische Signale können blockiert oder unregelmäßig werden. Das Herz schlägt dann zu schnell (Tachykardie) oder zu langsam (Bradykardie). Damit das Herz richtig arbeiten kann, müssen die Herzkammern koordiniert und mit einer Herzfrequenz von 60 bis 100 Schlägen (in Ruhe) pro Minute schlagen. ICDs dienen der Behandlung lebensbedrohlich schneller Herzrhythmusstörungen (als ventrikuläre Tachykardie bzw. als Kammerflimmern bezeichnet) in den unteren Herzkammern (den Ventrikeln). Ein ICD wird unter der Haut – in der oberen Brust oder im Bauchraum – implantiert und an eine oder zwei Elektroden (dünne, beschichtete Drähte) angeschlossen. Die Elektroden werden im oder am Herzmuskel angelegt. Sobald der ICD Anzeichen von Kammerflimmern erkennt, sendet er einen Elektroschock an den Herzmuskel, um ihn zu defibrillieren (entflimmern) oder um den schnellen Zuckungszyklus zu beenden. schematische Darstellung der Platzierung des IcDs Der Arzt setzt einen kleinen Schnitt und sucht eine Vene. Dann wird ein kleiner Stich in die Vene vorgenommen und die Elektroden werden durch die Vene hinunter ins Herz geführt. Danach testet der Arzt die Elektroden, um sich zu versichern, dass sie sich in der besten Position befinden, um das Herz zu unterstützen. Wenn die Elektroden verlegt sind, schließt sie Ihr Arzt an das Implantat an. Danach macht er eine „Tasche“, indem er die Haut und das Gewebe darunter von dem Muskel unterhalb des Gewebes trennt. Der ICD wird an die Elektroden angeschlossen und anschließend in diese Tasche eingesetzt. Nachdem das System eingesetzt wurde, näht der Arzt den Schnitt wieder zu. In regelmäßigen Abständen gibt es sogenannte Nachsorgeuntersuchungen, bei denen der behandelnde Arzt das System und die Programmierung überprüft und ggf. anpasst. 17 herzklAppen Herzklappen sind kleine, jedoch überaus wichtige Bestandteile des Herzens. Die Herzklappen sorgen dafür, dass das Blut in die richtige Richtung fließt und öffnen bzw. schließen sich rasch und vollständig. Funktionieren Herzklappen nicht mehr richtig, wird der Blutfluss durch das Herz gestört; zu hören ist statt des üblichen Klopfens dann ein eher zischendes Geräusch. Trikuspidalklappe Rechter Vorhof Lungenvenen Linker Vorhof Mitralklappe Aortenklappe Klappenring Pulmonalklappe herzKlappen gibt eS in zWei hauptgruppen: MechaniSche und biologiSche herzKlappen. Manche Kinder werden mit einer erblich bedingten Herzklappenerkrankung geboren. Die Herzklappen können die falsche Größe haben. Herzklappensegel bzw. Herzklappentaschen können die falsche Form aufweisen oder nicht richtig am Gewebering, der die Herzklappe stützt (der sogenannte Herzklappenring oder Anulus), befestigt sein. Diese Defekte lassen sich meist bei der Geburt oder später im Laufe des Lebens korrigieren. Mechanische Herzklappen wurden so entwickelt, dass sie die Funktion der körpereigenen Herzklappen übernehmen können. Im Allgemeinen bestehen sie aus sogenanntem pyrolytischem Carbon. Analog zum Ring des Herzens hat auch die mechanische Klappe einen Ring, der die Klappenflügel hält. Die mechanische Klappe öffnet und schließt sich bei jedem Herzschlag, sodass das Blut wie gewünscht durch das Herz fließt. Mechanische Ersatzklappen können anstelle der Mitral- oder Aortenklappen eingesetzt werden. 18 Biologische Klappenprothesen bestehen aus Gewebe von Schweinen oder von Rindern, das sorgfältig für die Verwendung im menschlichen Herzen vorbereitet wurde. Biologische Klappen können entweder mit oder ohne Gerüst (Stent) eingesetzt werden. Ein Stent ist ein Rahmen, der die neue Klappe stützt, damit sie ihre Form beibehält. Klappen mit Stent lassen sich als Klappenersatz für alle Klappen verwenden. Klappen ohne Stent werden meistens als Aortenklappenersatz verwendet. Beide Arten von Klappen haben Vorteile, der Arzt wird grundsätzlich die Klappe auswählen, die den Bedürfnissen und anatomischen Gegebenheiten am besten entspricht. beispiel einer mechanischen Herzklappe beispiel einer biologischen Herzklappe 19 okkluder Bei Herzfehlern, bei denen es sich um Defekte handelt – zum Beispiel bei dem Ventrikelseptumdefekt, beim persistierenden Foramen ovale oder aber auch bei einem persistierenden Ductus arteriosus –, gibt es die Möglichkeit, diese „Löcher“ mit einem Schirmchen oder auch Okkluder über ein katheterbasiertes Verfahren zu schließen. Ein katheterbasiertes Verfahren ist ein sogenanntes minimalinvasives Verfahren und besteht darin, dass ein kleiner Schnitt, typischerweise an der Leiste, vorgenommen wird. Dann wird ein kleiner Schlauch, auch Katheter oder Schleuse genannt, eingeführt, der durch das Blutgefäß an den Behandlungsort im Herzen geleitet wird. Bei Patienten mit zum Beispiel einem Ventrikelseptumdefekt (VSD) führt der Arzt das Implantat durch den Katheter oder die Schleuse, um den VSD zu erreichen. Wenn sich das Implantat im Loch befindet, überprüft der Arzt die Position sorgfältig mit einem Herzbildgebungsverfahren. oKKluder verSchlieSSen MiniMalinvaSiv „löcher“ iM herzen Wenn er mit der Position zufrieden ist, wird das Implantat freigegeben und bleibt dauerhaft im Loch. Der Katheter oder die Schleuse wird entfernt und das Verfahren ist abgeschlossen. Der Eingriff selbst sollte etwa ein bis zwei Stunden dauern und wird in einem Herzkatheterlabor durchgeführt, in dem viele minimalinvasive, nicht operative Eingriffe durchgeführt werden. Der Arzt kann eine Narkose verabreichen damit während des Eingriffs keine bedeutenden Beschwerden entstehen. okkluder für den Verschluss eines Vorhofseptumdefekts okkluder für den Verschluss eines offenen Ductus arteriosus 20 familienorientierte reHabilitation (for) − die ganze familie ist der patient Wenn ein Kind herzkrank ist, steht die gesamte Familie vor einer großen Herausforderung. Neben Krankenhausaufenthalten und Nebenwirkungen von Medikamenten kann es auch zu Einschränkungen bzw. Verzögerungen in der Entwicklung des Kindes kommen. Die Familie ist einer Reihe von neuen Belastungen ausgesetzt und manche Familienmitglieder erkranken aufgrund dessen. Obwohl Eltern zeitlich eingeschränkt sind, müssen sie zusätzliche Anforderungen meistern und eigene Wünsche und Bedürfnisse zurückstellen. Dies kann für elterliche Beziehungen sehr belastend sein, und die eigene und familiäre Lebensplanung wird ungewiss. Geschwisterkinder müssen häufig auf ihre Eltern verzichten, fühlen sich manchmal allein gelassen und können auch Verhaltensauffälligkeiten entwickeln. Die ganze Familie ist der Patient. 21 Die Familien von herzkranken Kindern können zur Entlastung eine ambulante und stationäre Rehabilitation (eine familienorientierte Rehabilitation, FOR) in Anspruch nehmen. Eine FOR wird über die Krankenkasse mithilfe des Kardiologen beantragt. Für eine FOR kommt man infrage, wenn: die Familie selbst den medizinischen Heilerfolg nicht mehr sichern kann. die Familie dem Patienten keine ausreichende Förderung zukommen lassen kann. es durch die Erkrankung zu einer Überlastung der Familie gekommen ist, die medizinische und psychosoziale Folgen bei den anderen Familienmitgliedern hat. Diese Situation kommt häufig nach Behandlung lebensbedrohlicher Herzfehler, bei Mehrfachbehinderungen oder bei Mehrfachbelastungen innerhalb einer Familie vor. eine „For“ dient der ganzen FaMilie! Die FOR ist Bestandteil des kinderkardiologischen Behandlungsplanes und zielt unter anderem auf die Sicherung des Therapieerfolgs und die psychische und physische Stabilisierung des erkrankten Kindes und seiner Familie ab. Sie ermöglicht die Verbesserung und den Erhalt der Gesundheit der gesamten Familie sowie die Steigerung der Arbeitsfähigkeit der Eltern. Anwendungen, die im Rahmen einer FOR stattfinden, können beispielsweise sein: Physiotherapie Muskel- und Konditionstraining Sportrehabilitative Programme Schulungsprogramme für die Eltern für notwendige Betreuung zu Hause Heilpädagogik zur Krankheitsverarbeitung aufgrund der Operationen Schulunterricht, um durch die Erkrankung bedingte Rückstände aufzuholen In Deutschland gibt es vier Kliniken, die eine FOR für herzkranke Kinder und ihre Familien anbieten. Nachstehend finden Sie die Anschriften dieser Kliniken. KliniK: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Nachsorgeklinik Tannheim gGmbH Gemeindewaldstraße 75 78052 VS-Tannheim 07705 / 920-201 [email protected] www.tannheim.de KliniK: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Rehabilitationsklinik Katharinenhöhe gGmbH Oberkatzensteig 11 78141 Schönwald / Schwarzwald 07723-6503-0 [email protected] www.katharinenhoehe.de KliniK: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Klinik Bad Oexen Oexen 27 32549 Bad Oeynhausen 05731 / 537-0 [email protected] www.badoexen.de KliniK: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Kindernachsorgeklinik Berlin-Brandenburg gGmbH Bussardweg 1, 16321 Bernau 033397/ 45 86 20 [email protected] www.knkbb.de 22 KliniKwegweiser K Kwegweiser In Deutschland gibt es einige Kliniken die sich auf die Behandlung von Kindern mit angeborenen Herzfehlern spezialisiert haben. Hier finden Sie diese Kliniken nach Postleitzahl sortiert. 23 postleitzaHl 0 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Martin-Luther-Universität Halle-Wittenberg Universitätsklinik und Poliklinik für Pädiatrische Kardiologie Professor Dr. R. Grabitz Ernst-Grube-Straße 40 06120 Halle/Saale 0345-557 2611 [email protected] www.medizin.uni-halle.de/Kinderkardiologie postleitzaHl 1 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Charité - Universitätsklinikum der Humboldt-Universität zu Berlin Klinik für Pädiatrie mit Schwerpunkt Kardiologie Professor Dr. F. Berger Augustenburger Platz 1 13353 Berlin KliniK: abteilung: 030 / 450 - 51 60 62 [email protected] www.charite.de/paediatrie leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Deutsches Herzzentrum Berlin Klinik für angeborene Herzfehler Kinderkardiologie Professor Dr. F. Berger Augustenburger Platz 1 13353 Berlin 030 45 93 - 28 00 [email protected] www.dbzb.de/abteilungen/angeborene_herzfehler postleitzaHl 2 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum Hamburg-Eppendorf Klinik und Poliklinik für Kinderkardiologie PD Dr. R. Kozlik-Feldmann Martinistraße 52 20246 Hamburg 040 / 74 10 - 5 37 18 [email protected] www.uke.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum Schleswig-Holstein Klinik für Kinderkardiologie Professor Dr. H.-H. Kramer Schwanenweg 20 24105 Kiel 0431-597 17 28 [email protected] www.kinderherzzentrum-kiel.de KliniK: Klinikum Oldenburg gGmbH Elisabeth Krankenhaus Zentrum für Kinder und Jugendmedizin PD Dr. M. Freund Rahel-Straus-Straße 10 26133 Oldenburg 0441 / 403 24 84 [email protected] www.kinderklinik-oldenburg.de KliniK: abteilung: Klinikum Links der Weser Klinik für strukturelle und angeborene Herzfehler/Kinderkardiologie Dr. med. T.-P. Le Senator-Weßling-Straße 1 28277 Bremen 0421 / 879 - 1311 [email protected] www.klinikum-bremen-ldw.de abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: 24 postleitzaHl 3 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Herz- und Diabeteszentrum NRW Klinik für angeborene Herzfehler/ Kinderkardiologie Univ.-Prof. Dr. D. Kececioglu Georgstraße 11 32545 Bad Oeynhausen 05731 / 97 13 80 od. 13 81 [email protected] www.hdz-nrw.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Kinderherzzentrum der Universitätsklinik Gießen Abteilung für Kinderkardiologie Professor Dr. D. Schranz Feulgenstraße 12 35385 Giessen 0641-9943461 [email protected] www.uniklinikum-giessen.de/kikardio Georg-August-Universität Göttingen Zentrum Kinderheilkunde Abt. Päd. Kardiologie und Intensivmedizin Professor Dr. T. Paul Robert-Koch-Straße 40 37075 Göttingen 0551 / 39 - 62 03 [email protected] www.KinderherzKlinik.de postleitzaHl 4 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum Düsseldorf Klinik für Kinderkardiologie und Pneumologie Professor Dr. F. Pillekamp Moorenstraße 5 40225 Düsseldorf 0211 / 811 76 88 [email protected] www.uni-duesseldorf.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Helios Universitätsklinikum Wuppertal Abt. Kinderkardiologie-Pulmonologie PD Dr. A. Heusch Heusnerstraße 40 42238 Wuppertal 0202 / 896 38 35 [email protected] www.helios-kliniken.de/wuppertal KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Zentrum für Kinder- und Jugendmedizin Klinik für pädiatrische Kardiologie Dr. U. Neudorf Hufelandstraße 55 45122 Essen 0201 / 723 24 52 [email protected] www.uni-essen.de/kinderklinik KliniK: abteilung: Herzzentrum Duisburg Klinik für Kinderkardiologie Angeborene Herzfehler PD Dr. med. O. N. Krogmann Gerrickstraße 21 47137 Duisburg 0203 / 4 51 - 33 01 [email protected] www.kinderherzzentrum.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum Münster Klinik für Pädiatrische Kardiologie Professor Dr. C. Jux Albert-Schweitzer-Campus 1 48149 Münster 0251 8347752 [email protected] www.kinderkardiologie.ukmuenster.de leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: 25 postleitzaHl 5 Universitätsklinikum Bonn Zentrum für Kinderheilkunde Abt. Kinderkardiologie Kinderherzzentrum Bonn Professor Dr. J. Breuer Adenauerallee 119 53113 Bonn 0228 / 287 - 333 50 [email protected] www.kinderkardiologie-bonn.de KliniK: KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsmedizin Mainz Zentrum für Kinder- und Jugendmedizin, Pädiatrische Kardiologie Univ.-Prof. Dr. C. Kampmann Langenbeckstraße 1 55131 Mainz 06131 / 17 27 83 [email protected] www.klinik.uni-mainz.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Herzzentrum der Universität zu Köln Klinik und Poliklinik für Kinderkardiologie Professor Dr. K. Brockmeier Kerpener Str. 62 50924 Köln 0221 / 478 32514 [email protected] www.uniklinik-herzzentrum.de/kinderkardiologie KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: KliniK: abteilung: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Deutsches Kinderherzzentrum (DKHZ) Asklepios Klinik St. Augustin Abt. Kardiologie/angeborene Herzfehler Professor Dr. M. B. Schneider Arnold-Janssen-Straße 29 53757 Sankt Augustin 02241 / 249 650 [email protected] www.dkhz.de leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum der RWTH Aachen Klinik für Kinderkardiologie Zentrum für angeborene Herzfehler Univ. Professor Dr. G.R. Kerst Pauwelsstraße 30 52074 Aachen 0241 / 80 88 981 [email protected] www.ukaachen.de Klinikum der Johann Wolfgang Goethe-Universität Klinik für Kinderheilkunde und Jugendmedizin II Pädiatrische Kardiologie Dr. A. Esmaeili Theodor-Stern-Kai 7 60590 Frankfurt am Main 069 / 6301 - 6497 [email protected] www.kgu.de/index.php?id=145 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum des Saarlandes Klinik für Kinderkardiologie Professor Dr. H. Abdul-Khaliq Kirrberger Straße 66421 Homburg/Saar 06841 / 162 83 06 [email protected] www.uniklinik-saarland.de/kinderkardiologie Westpfalz-Klinikum GmbH Klinik für Kinder- und Jugendmedizin Abteilung für Kinderkardiologie PD Dr. T. Kriebel Hellmut-Hartert-Straße 1 67655 Kaiserslautern 0631 / 203 13 70 [email protected] www.westpfalz-klinikum.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: Universitätsklinikum Heidelberg Klinik f. Päd. Kardiologie/Angeb. Herzfehler Professor Dr. M. Gorenflo Im Neuenheimer Feld 430 69120 Heidelberg 06221 / 56 - 23 48 kinderklinik.kardiologische.ambulanz @med.uni-heidelberg.de www.klinikum.uni-heidelberg.de postleitzaHl 6 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: WebSeite: 26 postleitzaHl 7 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Klinikum Stuttgart Zentrum für angeborene Herzfehler - Pädiatrische Kardiologie, Pulmologie Allergolie & Intesivmedizin Dr. F. Uhlemann Kriegsbergstrasse 62 70174 Stuttgart 0711 278-72441 [email protected] www.klinikum-stuttgart.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitätsklinikum Tübingen Klinik für Kinderheilkunde und Jugendmedizin Professor Dr. M. Hofbeck Hoppe-Seyler-Straße 3 72076 Tübingen 07071 / 29 - 84 75 1 / 80 90 7 [email protected] www.medizin.uni-tuebingen.de/kinder/de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitäts-Herzzentrum Freiburg/Bad Krozingen Klinik für angeborene Herzfehler und Pädiatrische Kardiologie Professor Dr. B. Stiller Mathildenstraße 1 79106 Freiburg 0761 / 270 - 43 230 [email protected] www.ukl.uni-freiburg.de KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Klinikum Augsburg II. Klinik für Kinder und Jugendliche Professor Dr. G. Buheitel Stenglinstraße 2 86156 Augsburg 0821 / 400 34 31 [email protected] www.klinikum-augsburg.de postleitzaHl 8 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Deutsches Herzzentrum München Klinik für Kinderkardiologie und angeborene Herzfehler Professor Dr. P. Ewert Lazarettstraße 36 80636 München 089 / 12 18 30 10 / 30 11 [email protected] www.dhm.mhn.de Universitätsklinikum Ulm Poliklinik für Kinder- und Jugendmedizin Sektion Pädiatrische Kardiologie Professor Dr. C. Apitz Eythstr. 24 89075 Ulm 0731 / 50057127 [email protected] www.uniklinik-ulm.de postleitzaHl 9 KliniK: abteilung: leitung: StraSSe: plz & ort: teleFon: e-Mail: WebSeite: Universitäres Herzzentrum Erlangen Kinderkardiologische Abteilung Professor Dr. S. Dittrich Loschgestraße 15 91054 Erlangen 09131 / 853 - 37 50 [email protected] www.kinderkardiologie.uk-erlangen.de 27 nützlicHe linKs Nachstehend finden Sie eine Reihe von Webseiten, unter denen Sie viele nützliche Informationen zu unterschiedlichen Themen finden können. 28 nützliche links Aktionsbündnis angeborene Herzfehler / Patientenorganisationen www.bvhk.de, www.herzklick.de Bundesverband Herzkranke Kinder e.V. Kinderherzen – Fördergemeinschaft Deutsche Kinderherzzentren e.V. www.kinderherzen.de www.herzkind.de Herzkind e.V. Kinderherzstiftung der Deutschen Herzstiftung e.V. Corience - Nationales Register für angeborene Herzfehler e.V. Bundesvereinigung Jugendliche und Erwachsene mit angeborenem Herzfehler (JEMAH) e.V. www.kinderherzstiftung.de www.corience.org www.jemah.de www.fontanherzen.de Fontanherzen e.V. www.idhk.de Interessensgemeinschaft das herzkranke Kind e.V. Fachgesellschaft Deutsche Gesellschaft für Pädiatrische Kardiologie e.V. (DGPK) www.kinderkardiologie.org ernährung & stillen www.lalecheliga.de La Leche Liga Deutschland e.V. Forschungsinstitut für Kinderernährung Dortmund www.fke-do.de www.dge.de Deutsche Gesellschaft für Ernährung e.V. Kinderbücher zu operationen & Krankenhäusern „Wieso?, Weshalb?, Warum? – Was passiert im Krankenhaus“, A. Erne & M. Kreimeyer-Visse „KUNO im Krankenhaus“, M. Ischar „Doktor Tobis Tierklinik. Ein Tag im Krankenhaus“, S. Rentta „Jetzt bin ich im Krankenhaus”, S. Hämmerle „Conni im Krankenhaus“, L. Schneider „Im Krankenhaus”, C. Roederer „Vom kleinen Drachen – oder – Das Leben hat nicht nur Schokoladenseiten“, U. Elb „Lea Löwenherz“, R. Nagel entwicklungsverzögerungen Zentrum Bayern Familie und Soziales / Bayerisches Landesjugendamt www.elternimnetz.de Stiftung MyHandicap - gemeinnützige GmbH www.myhandicap.de Familienbund der Katholiken in der Diözese Würzburg e.V. www.intakt.info Finanzielle beratung www.profamilia.de pro familia e.V. www.caritas.de Deutscher Caritasverband e.V. 29 30 31 Sofern nicht anders angegeben, sind St. Jude Medical und seine Tochterunternehmen Eigentümer oder Lizenznehmer aller mit ™ gekennzeichneten Marken. ST. JUDE MEDICAL und das Symbol mit den neun Quadraten sind Marken und Dienstleistungsmarken von St. Jude Medical, Inc. und seinen Tochterunternehmen. © 2016 St. Jude Medical, Inc. Alle Rechte vorbehalten. st. Jude medical gmbH Helfmann-Park 7 D-65760 Eschborn Deutschland t +49 6196 77110 | F +49 6196 7711177 service +49 01803 666546 EM-PCG-0816-0005 | Dieses Dokument ist nur zur Verwendung in Deutschland zugelassen. www.sjm.de/herzfuerkinderherzen