Das Kern-Huelle-Modell
Werbung

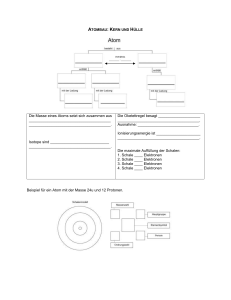
8. Klasse Vom Kern-Hülle-Modell zum Schalenmodell (erweitertes Kern-Hülle-Modell) www.chemiezauber.de Unterrichtsreihe: Ein neues Atommodell muss her Seite im Hefter: ....... Datum: …………… Ein Experiment von Rutherford im Jahre 1911 gab erste ernst zunehmende Aufschlüsse über den Aufbau der Atome. Er beschoss eine Goldfolie (und damit Goldatome) mit positiv geladene Teilchen (so genannten αStrahlen). Beobachtungen: 1) Nur sehr wenige dieser positiven Teilchen wurden abgelenkt. 2) Fast alle positiven Teilchen gehen ungehindert durch die Goldfolie durch. Schlussfolgerungen: zu 1) ............................................................................................................ ............................................................................................................ zu 2) ............................................................................................................ ............................................................................................................ Erst das erweiterte KernHülle-Modell, das Schalenmodell von Niels Bohr aus dem Jahre 1913, lieferte die Möglichkeit chemische Reaktionen zu deuten oder vorherzusagen. Nach dem Schalenmodell umkreisen die negativ geladenen Elektronen auf festgelegten Bahnen den positiven Kern, der zudem noch elektrisch neutrale Neutronen enthält. 1/3 Jede mögliche Bahn kann nur eine bestimmte Menge an Elektronen aufnehmen: Schale max. Anzahl von Elektronen 1. 2. 3. K L M 2 8 18 Jedes Atom versucht eine vollbesetzte Außenschale (Valenzschale) zu erhalten. Um dies zu erreichen, werden bei einer chemischen Reaktion Elektronen gegenseitig ausgetauscht oder gemeinsam benutzt. Es gab jedoch zwei Unstimmigkeiten bei diesem Atommodell: 1. Da sich positive und negative Teilchen gegenseitig anziehen, müssten die Elektronen von den Protonen im Kern angezogen werden und in den Kern stürzen. Überlege, warum sie es nicht tun. 2. Die positiven Protonen im Kern liegen alle dicht beieinander. Da sich gleichnamig geladene Teilchen abstoßen, dürften diese Protonen gar nicht so dicht beieinander liegen. Was könnte die Protonen zusammenhalten? zu 1) ............................................................................................................ ............................................................................................................ zu 2) ............................................................................................................ ............................................................................................................ Zusammenfassung und Ergänzungen: Atome bestehen aus Elementarteilchen: Elementarteilchen Abkürzung Symbol Ladung Masse Aufenthaltsort im Atom Elektron e- einfach negativ fast keine (!) Hülle (groß) Proton p+ einfach positiv 1 u (1 unit) = 1,66 •10 -24g Kern (klein) keine 1 u (1 unit) = 1,66 •10 -24g Kern (klein) Neutron n 2/3 Der Kerndurchmesser und der Durchmesser der Hülle verhalten sich 1 : 10 000. Wenn ein Tennisball den Kern darstellt, dann nimmt die Hülle einen Raum von ca. 700 m Durchmesser ein. Fast die gesamte Masse eines Atoms befindet sich im Atomkern. Wäre der Kern aus Blei, dann hätte die Atomhülle die Masse einer Seifenblase. Sämtliche Atomkerne eines mächtigen Gebäudes fänden in einer Streichholzschachtel Platz, wobei der Inhalt der Schachtel nahezu die gleiche Masse wie das gesamte Gebäude hätte. Ein Element ist ein Stoff, der nur aus einer ganz bestimmten Art von Atomen besteht. So besitzen z.B. alle Aluminium-Atome in einem Aluminiumblech jeweils immer 13 Elektronen und 13 Protonen. Die Anzahl der Elektronen und der Protonen ist bei einem Atom immer gleich, ein Atom ist insgesamt betrachtet elektrisch neutral. Die Protonenzahl, auch Kernladungszahl oder Ordnungszahl genannt, ist eine für jedes Element charakteristische Größe. Die Massenzahl ist die Gesamtzahl der Kernbausteine. Manche Atome haben weniger oder mehr Neutronen als Protonen. Solche Atome des gleichen Elements, die sich nur in der Neutronenzahl und damit in der Atommasse unterscheiden, werden Isotope genannt. Ei n E l em ent ist e i n St o f f , d er a u s A t o m e n m it d er g le ic he n Pr o t o ne nz a h l ( O r d nu ng sz a h l) b e st eht . Beispiel: Das Aluminium-Atom besitzt 13 Protonen und insgesamt 13 Elektronen. Davon befinden sich zwei Elektronen in der innersten 1. Schale, acht Elektronen in der 2.Schale. Bleiben noch drei Elektronen, die in der 3. Schale sind. Ein Aluminium-Atom besitzt also Bei chemischen Reaktionen sind drei Valenzelektronen. in der Regel nur die Elektronen der äußeren Schale beteiligt. Man kennzeichnet die Anzahl dieser Außenelektronen (auch Valenzelektronen genannt) durch Punkte, die um das Elementsymbol angeordnet werden in einer so genannten Valenzstrichformel. Beispiele (Valenzstrichformeln): 3/3