Grundwissen Physik Q12 - MGF
Werbung

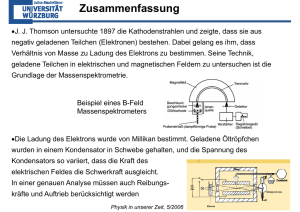
Physik – Jahrgangsstufe 12 – Grundwissen: 12.1 Eigenschaften von Quantenobjekten Überblick B. S. 35 • Teilchencharakter von Photonen o Photoeffekt, Deutung nach Einstein, Auslösearbeit, Grenzfrequenz Energiebilanz des Photoeffekts: In Verbindung mit dem Diagramm (Einsteingerade) ergeben sich folgende Zusammenhänge: ; o Energie und Impuls des Photons Photonen sind Quantenobjekte mit Energie und Impuls. Sie haben Teilchencharakter. Energie des Photons • Masse des Photons Impuls des Photons Wellencharakter von Elektronen Bei Bestrahlung von Kristallen mit Elektronen tritt Interferenz auf. Elektronen haben Wellencharakter. o Zusammenhang zwischen Impuls und Wellenlänge nach de Broglie Quantenobjekten kann eine Wellenlänge zugeordnet werden (de-Broglie-Wellenlänge) o o • Doppelspalt- oder Gitterversuche technische Anwendung, z. B. Prinzip des Elektronenmikroskops Beschreibung des Verhaltens von Quantenobjekten o Wahrscheinlichkeitsaussagen zu Interferenzversuchen mit einzelnen Quantenobjekten Das Verhalten einzelner Quantenobjekte kann in der Regel nicht vorausgesagt werden. Für eine größere Anzahl von Quantenobjekten kann man Wahrscheinlichkeitsaussagen treffen. o Unbestimmtheitsrelation von Heisenberg Quantenobjekte bewegen sich nicht auf Bahnen. Je bestimmter der Ort x eines Quantenobjekts ist, desto unbestimmter ist sein Impuls p. Quantenobjekte sind weder Welle noch Teilchen. Sie haben vielmehr stets gleichzeitig etwas Welliges, etwas Körniges und etwas Stochastisches. Trotzdem gibt es Situationen, in denen als gute Näherung das Teilchenmodell oder das Wellenmodell angewendet werden kann. 12.2 Ein Atommodell der Quantenphysik Überblick B. S. 77,78 Atome haben eine Masse von etwa kg, der Radius liegt in der Grö⇓enordnung m. • Beschreibung eines Elektrons im eindimensionalen Potentialtopf • emittiertes und absorbiertes Licht atomarer Gase, Zusammenhang zwischen Linienspektren und Energiestufen, Energieniveauschema Einem Elektron der Atomhülle lassen sich unterschiedliche Energieniveaus zuordnen (Energieniveauschema). Absorption von Licht ist verbunden mit dem Übergang eines Elektrons auf ein höheres Energieniveau. Emission von Licht ist verbunden mit dem Übergang eines Elektrons auf ein niedrigeres Niveau. Ionisierung erfolgt, wenn ein Hüllenelektron in die Umgebung abgegeben wird. Linienspektren sind ein Beleg für die quantenhafte Emission bzw. Absorption von Licht (Spektroskopie). • Elektron im Potentialtopf mit unendlich hohen Wänden, stehende Wellen und Aufenthaltswahrscheinlichkeiten, diskrete Energiewerte Die verschiedenen energetischen Zustände eines Elektrons lassen sich als verschiedene Formen der Atomhülle darstellen (Orbitale). Ein Orbital beschreibt die Wahrscheinlichkeit, das Elektron bei einer Ortsmessung in einem kleinen Raumbereich nachzuweisen (Aufenthaltswahrscheinlichkeit). • zeitunabhängige, eindimensionale Schrödingergleichung als quantenphysikalische Grundgleichung Die Gestalt der Orbitale und die dazugehörigen Energiewerte des Elektrons lassen sich mit Hilfe der Schrödingergleichung berechnen. • Interpretation der graphischen Lösungen der Schrödingergleichung für den endlich hohen Potentialtopf, Tunneleffekt Im einfachen Modell des unendlich hohen linearen Potenzialtopf haben die Lösungen der Schrödingergleichung die Form von stehenden Wellen bei maximaler Auslenkung. Für das Elektron ergeben sich die Energiewerte • quantenphysikalisches Modell des Wasserstoffatoms Als Lösung für die Schrödingergleichung für das Coulombpotenzial ergeben sich für das Wasserstoffatom die Energieniveaus En • • graphische Veranschaulichung der Lösungen der Schrödingergleichung für das Coulombpotential, dreidimensionale Darstellung der Aufenthaltswahrscheinlichkeiten durch Orbitale Interpretation der Nullstellen von Wellenfunktionen als Knotenflächen stehender Wellen • Ausblick auf Mehrelektronensysteme • Charakterisierung der Elektronenzustände durch Quantenzahlen Die geometrischen Eigenschaften der Orbitale lassen sich durch die Hauptquantenzahl n, die Nebenquantenzahl l und die Magnetquantenzahl m kennzeichnen. Hinzu kommt die Spinquantenzahl s. Das Energieniveau eines Elektrons wird im Wesentlichen durch die Hauptquantenzahl bestimmt. • Pauli-Prinzip In einem Atom können keine zwei Elektronen in allen Quantenzahlen übereinstimmen. • Deutung des Periodensystems der Elemente mithilfe von Quantenzahlen • experimentelle Befunde und Anwendungen zum quantenphysikalischen Atommodell • • Energieaufnahme durch Stoßanregung (Franck-Hertz-Versuch) Röntgenstrahlung (Erzeugung, Spektrum, charakterisitisches Spektrum, Bremsspektrum) • ein Beispiel einer Anwendung in Wissenschaft und Technik (z. B. Einblick in die Absorptions- und Emissionsspektroskopie, auch in der Astronomie, Funktionsprinzip des Lasers) 12.3 Strukturuntersuchungen zum Aufbau der Materie Überblick B. S. 102 • Aufbau der Materie und Teilchenfamilien des Standardmodells o Entdeckung des Atomkerns durch Streuung von Alpha-Teilchen (Rutherford) o Zusammensetzung der Hadronen aus Quarks, Hinweis auf Streuexperimente o Leptonen, Quarks und ihre Antiteilchen Es gibt eine Vielzahl von Teilchen mit unterschiedlichen Eigenschaften und Lebensdauern. Zu fast jedem Teilchen existiert ein Antiteilchen mit gleicher Masse und entgegengesetzter Ladung. o die fundamentalen Wechselwirkungen und ihre Austauschteilchen Die heutigen Kenntnisse über Elementarteilchen und ihre Wechselwirkungen werden im Standardmodell zusammengefasst. Die wirkenden Kräfte werden durch vier fundamentale Wechselwirkungen bestimmt (Austauschteilchen in Klammern): - Elektromagnetische WW (Photonen) - Starke Wechselwirkung (Gluonen) - Schwache Wechselwirkung (W- und Z-Boson) - Gravitation (Graviton? Derzeit noch nicht nachgewiesen) 12.4 Ein einfaches Kernmodell der Quantenphysik Überblick B. S. 118 Atomkerne nehmen nur einen geringen Raum ein. Sie besitzen fast die gesamte Masse des Atoms und enthalten die gesamte positive Ladung des Atoms. • Protonen und Neutronen im Potentialtopf der Kernkraft • Massendefekt und mittlere Bindungsenergie je Nukleon in Abhängigkeit von der Nukleonenzahl, Energiegewinnung aus Atomkernen Die Masse eines Atomkerns ist stets kleiner als die Summe der Massen seiner Bestandteile. Für diesen Massendefekt gilt: Δm = m − (Z ⋅ mP + N ⋅ mN ) Die dem Massendefekt Δm entsprechende freigewordene Energie ist die Bindungsenergie des Atomkerns. Die Division durch die Massenzahl A ergibt die mittlere Bindungsenergie je Nukleon. Energie kann durch Fusion leichter Kerne oder durch Spaltung schwerer Kerne in zwei mittelschwere Kerne freigesetzt werden. • Eigenschaften der Kernkraft und zugehöriges Potentialtopfmodell, Verteilung der Protonen und Neutronen auf die jeweils möglichen Energieniveaus, diskrete Energiewerte von γ-Quanten Die Stabilität des Atomkerns ist das Ergebnis der zwischen den Nukleonen wirkenden Kernkraft (starke Wechselwirkung). Die Nukleonen können nur bestimmte energetische Zustände annehmen. Das lässt sich mit dem Potenzialtopfmodell des Atomkerns beschreiben. Eine Nachweis der diskreten Energieniveaus sind die für ein Nuklid charakteristischen Energien der ausgesandten γ-Quanten. • Stabilität von Atomkernen, Entstehung von α- und β-Strahlung durch Kernumwandlungen Es gibt viel mehr instabile als stabile Nuklide. Je größer die Ordnungszahl der elemente im Periodensystem ist, desto mehr vergrößert sich die Anzahl der Neutronen gegenüber der Protonenzahl im Kern. Das Aussenden von α- und β-Strahlung ist mit Kernumwandlungen verbunden. β--Strahlung : n → p + e − + ν ; β+-Strahlung: p → n + e + + ν α-Strahlung: 2n + 2 p → α − Teilchen (mittlere Bindungsenergie liegt oberhalb der schwerer Kerne, Tunneleffekt durch Coulombpotenzialwall möglich). 12.5 Radioaktivität und Kernreaktionen Überblick B. S. 156 • Radioaktive Strahlung o Unterscheidung der Strahlungsarten durch Durchdringungsvermögen und Ablenkbarkeit durch elektrische und magnetische Felder o natürliche Zerfallsreihen, Nuklidkarte Bei vielen in der Natur vorkommenden Radionukliden sind die entstehenden Folgekerne ebenfalls wieder radioaktiv (Zerfallsreihen). Eine Änderung der Massenzahl tritt nur bei αZerfällen auf. β-Zerfall bewirkt nur eine Änderung der Kernladungszahl. Beim α-Zerfall ändert sich die Massenzahl um –4. Daher sind nur 4 Zerfallsreihen möglich. In einer Nuklidkarte (N-Z-Diagramm) verringert sich beim α-Zerfall die Neutronenzahl und die Protonenzahl um jeweils 2. Beim β- Zerfall nimmt die Protonenzahl um 1 zu oder ab, während die Neutronenzahl um 1 ab- oder zunimmt. Bei γ-Strahlung verändert sich die Anzahl der Protonen und Neutronen nicht. o Abstandsgesetz Z= o const r2 Zerfallsgesetz Anwendung des radioaktiven Zerfalls zur Altersbestimmung 14 C-Methode) N = N 0 ⋅ e − λt ; T1 = 2 o ln 2 λ Strahlenbelastung des Menschen durch natürliche und künstliche Strahlung, Maßnahmen zum Strahlenschutz Eine biologisch wirksame Strahlenbelastung kann durch ionisierende Strahlung (radioaktive Strahlung, Röntgenstrahlung, kurzwelliges UV-Licht, Teilchenstrahlung) hervorgerufen werden. Nulleffekt! AAA: Abstand, Abschirmung, Aufnahme verhindern! • Kernreaktionen, Aspekte der Nutzung der Kernenergie o Energie- und Impulsbilanzen bei Kernreaktionen o Kernspaltung, Kettenreaktion, Prinzip eines Kernreaktors Freigesetzte Energie pro Nukleon: etwa 1 MeV o Kernfusion, Prinzip eines Fusionsreaktors Freigesetzte Energie pro Nukleon: etwa 7 MeV o Entdeckung und Nachweis des Neutrons 9 4 Be+ 24 α →126 C + 01n Freie Neutronen zerfallen mit einer Halbwertszeit von ca. 13 Minuten in ein Proton, ein Elektron und ein Antineutrino. o o Anwendungen in der Medizin: nuklearmedizinische Diagnostik, nuklearmedizinische Therapie Chancen und Risiken der Kernenergietechnik, Sicherheitsvorkehrungen, Entsorgung radioaktiver Materialien Beispielaufgaben: § Musterabitur Bayern, G8 § Duden-Paetec / CC-Buchner: Physik Gymnasium 12, Bayern, S.189ff