Lixisenatid (Lyxumia®)
Werbung
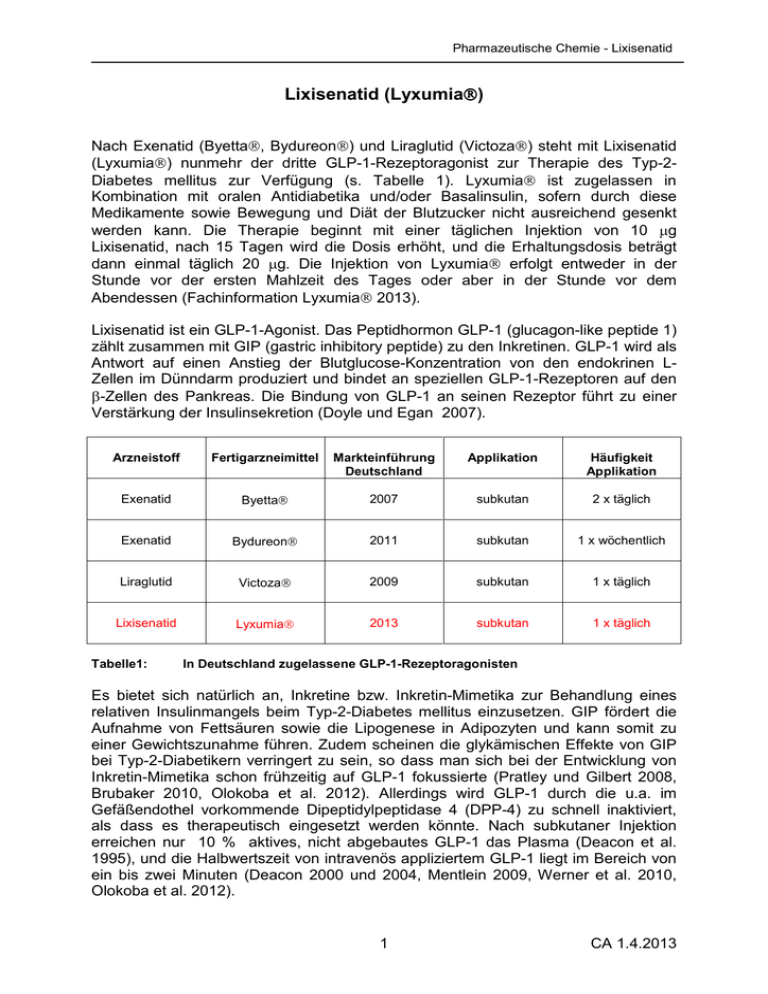
Pharmazeutische Chemie - Lixisenatid Lixisenatid (Lyxumia ) Nach Exenatid (Byetta, Bydureon) und Liraglutid (Victoza) steht mit Lixisenatid (Lyxumia) nunmehr der dritte GLP-1-Rezeptoragonist zur Therapie des Typ-2Diabetes mellitus zur Verfügung (s. Tabelle 1). Lyxumia ist zugelassen in Kombination mit oralen Antidiabetika und/oder Basalinsulin, sofern durch diese Medikamente sowie Bewegung und Diät der Blutzucker nicht ausreichend gesenkt werden kann. Die Therapie beginnt mit einer täglichen Injektion von 10 µg Lixisenatid, nach 15 Tagen wird die Dosis erhöht, und die Erhaltungsdosis beträgt dann einmal täglich 20 µg. Die Injektion von Lyxumia erfolgt entweder in der Stunde vor der ersten Mahlzeit des Tages oder aber in der Stunde vor dem Abendessen (Fachinformation Lyxumia 2013). Lixisenatid ist ein GLP-1-Agonist. Das Peptidhormon GLP-1 (glucagon-like peptide 1) zählt zusammen mit GIP (gastric inhibitory peptide) zu den Inkretinen. GLP-1 wird als Antwort auf einen Anstieg der Blutglucose-Konzentration von den endokrinen LZellen im Dünndarm produziert und bindet an speziellen GLP-1-Rezeptoren auf den β-Zellen des Pankreas. Die Bindung von GLP-1 an seinen Rezeptor führt zu einer Verstärkung der Insulinsekretion (Doyle und Egan 2007). Arzneistoff Fertigarzneimittel Markteinführung Deutschland Applikation Häufigkeit Applikation Exenatid Byetta 2007 subkutan 2 x täglich Exenatid Bydureon 2011 subkutan 1 x wöchentlich Liraglutid Victoza 2009 subkutan 1 x täglich Lixisenatid Lyxumia 2013 subkutan 1 x täglich Tabelle1: In Deutschland zugelassene GLP-1-Rezeptoragonisten Es bietet sich natürlich an, Inkretine bzw. Inkretin-Mimetika zur Behandlung eines relativen Insulinmangels beim Typ-2-Diabetes mellitus einzusetzen. GIP fördert die Aufnahme von Fettsäuren sowie die Lipogenese in Adipozyten und kann somit zu einer Gewichtszunahme führen. Zudem scheinen die glykämischen Effekte von GIP bei Typ-2-Diabetikern verringert zu sein, so dass man sich bei der Entwicklung von Inkretin-Mimetika schon frühzeitig auf GLP-1 fokussierte (Pratley und Gilbert 2008, Brubaker 2010, Olokoba et al. 2012). Allerdings wird GLP-1 durch die u.a. im Gefäßendothel vorkommende Dipeptidylpeptidase 4 (DPP-4) zu schnell inaktiviert, als dass es therapeutisch eingesetzt werden könnte. Nach subkutaner Injektion erreichen nur 10 % aktives, nicht abgebautes GLP-1 das Plasma (Deacon et al. 1995), und die Halbwertszeit von intravenös appliziertem GLP-1 liegt im Bereich von ein bis zwei Minuten (Deacon 2000 und 2004, Mentlein 2009, Werner et al. 2010, Olokoba et al. 2012). 1 CA 1.4.2013 Pharmazeutische Chemie - Lixisenatid Hier haben sich orale DPP-4-Inhibitoren wie Sitagliptin (Januvia, Xelevia), Saxagliptin (Onglyza), Vildagliptin (Galvus) und Linagliptin (Trajenta, s. Neue Arzneistoffe 2011 → Linagliptin) als indirekte Inkretin-Mimetika etabliert. Sie hemmen den GLP-1- sowie den GIP-Abbau, führen zu einem Anstieg der InkretinPlasmakonzentration und verstärken so die Inkretinwirkung (Nicholson und Hall 2011). Eine andere Möglichkeit, die Instabilität des physiologischen GLP-1 zu umgehen, besteht in der Entwicklung direkter Inkretin-Mimetika, d.h. GLP-1-Agonisten, die eine wesentlich höhere Stabilität aufweisen. Das inaktive GLP-1 ist ein Polypeptid bestehend aus 37 Aminosäuren (GLP-1(1-37). Zur Aktivierung werden N-terminal sechs Aminosäuren abgespalten, so dass letztlich zwei pharmakologisch wirksame und gleiche Aktivität aufweisende, aktive GLP-1Strukturen im Plasma vorkommen - das mengenmäßig dominierende Amid GLP-1(736-Amid) sowie GLP-1(7-37) mit 31 Aminosäuren. Bei GLP-1(7-36-Amid) liegt die freie Carbonsäure des carboxyterminalen Arginins maskiert als Carbonsäureamid (CONH2) vor, GLP-1(7-37) trägt zusätzlich ein carboxyterminales Glycin (Abbildungen 2a und 2b) (Holst 2007). Die DPP-4 katalysiert die N-terminale Abspaltung eines Dipeptids aus den aktiven GLP-1-Formen. Die DPP-4 bevorzugt solche Peptide, die an Position 2 des Nterminalen Endes ein Alanin (oder ein Prolin) enthalten, was sowohl bei GLP-1(7-37) als auch bei GLP-1(7-36-Amid) der Fall ist (Abbildung 1) (Mentlein et al. 1993, Havale und Pal 2009). Dipeptidylpeptidase-4 His Ala Glu Gly Thr Phe Thr Ser Asp Val N-Terminus Ser Lys Ala Ala Gln Trp Leu Gly Glu Leu Tyr Ser Arg Gly Arg Gly Glu Phe Ile Ala Val C-Terminus Abbildung 1: Inaktivierung des GLP-1(7-37) durch die DPP-4, Angriff an einem Alanin und Abspaltung eines N-terminalen Dipeptids (nach Havale und Pal 2009) 2 CA 1.4.2013 Pharmazeutische Chemie - Lixisenatid Der erste GLP-1-Agonist, der zugelassen wurde, war Exenatid (Byetta) im Jahr 2007. In 2011 folgte mit dem FAM Bydureon eine Depotform von Exenatid. Exenatid kommt natürlich als Exenidin-4 im Gift von Heloderma suspectum, einer Krustenechse, vor. Allerdings wird Exenatid durch Festphasensynthese mit anschließender Aufreinigung synthetisch gewonnen. Das Polypeptid bestehend aus 39 Aminosäuren zeigt eine 53%-ige Homologie zu GLP-1(7-37). Es besitzt am NTerminus anstelle eines Alanins ein Glycin (Position 8), der Abbau durch die DPP-4 wird dadurch erschwert. Die C-terminale Carbonsäure des abschließenden Serins liegt als Carbonsäureamid vor. Nach i.v.-Applikation wird eine Halbwertszeit von 26 Minuten beobachtet, nach subkutaner Injektion beträgt sie 2,4 Stunden. Das auffälligste Unterscheidungsmerkmal zu GLP-1 ist die zusätzliche, neun Aminosäuren umfassende C-terminale Sequenz. Die Entfernung dieses C-Terminus reduziert die Aktivität drastisch, allerdings scheint diese Sequenz nicht an der Bindung am GLP-1-Rezeptor beteiligt zu sein (Abbildungen 2a und 2b) (Furman 2012, Parkes et al. 2013). Liraglutid (Victoza) war in 2009 der zweite Vertreter aus dieser Arzneistoffklasse, der in Deutschland zugelassen wurde. Es besteht aus 32 Aminosäuren und wird gentechnisch in Saccharomyces cerevisiae hergestellt und ist quasi ein modifiziertes GLP-1 mit 97%iger Homologie zu GLP-1(7-37) (Liraglutid = N26-(Hexadecanoyl-γglutamyl)-[34-arginin]GLP-1-(7-37)-peptid). 36 von 37 Aminosäuren sind beim Liraglutid identisch zum natürlichen Hormon, lediglich an Position 34 ist die Aminosäure Lysin durch Arginin ersetzt. Zusätzlich hat man an der Seitenkette des Lysins an Position 26 ein Glutamin mit einer C16-Fettsäure eingeführt, was zu einer deutlich verlängerten Wirkdauer von Liraglutid führt. Dies kommt dadurch zustande, dass die Fettsäure eine stärkere, reversible Bindung an Plasmaalbumin und damit eine verringerte Absorption und Clearance bedingt. Zusätzlich bildet Liraglutid an der Injektionsstelle Selbstassoziate (Heptamere). Daneben muss aber auch noch erwähnt werden, dass diese strukturellen Modifikationen einen langsameren Abbau durch die DPP-4 hervorrufen. Die Halbwertszeit nach subkutaner Injektion liegt bei 13 Stunden. Nach i.v.-Applikation liegt sie bei 8 Stunden (vgl: natürliches GLP-1: 1-2 Minuten; Exenatid: 26 Minuten) (Abbildungen 2a und 2b) (Rossi und Nicolucci 2009, Bode 2011). 7 37 GLP-1(7-37) H2N-H A E G T F T S D V S S Y L E G Q A A K E F I A W L V K G R G-COOH H2N-H A E G T F T S D V S S Y L E G Q A A K E F I A W L V K G R-CONH2 GLP-1(7-36-Amid) E Liraglutid H2N-H A E G T F T S D V S S Y L E G Q A A K E F I A W L V R G R G-COOH Exenatid H2N-H G E G T F T S D L S KQ M E E E A V R L F I E W L K N G G P S S G A P P P S-CONH2 H2N-H G E G T F T S D L S KQ M E E E A V R L F I E W L K N G G P S S G A P P S K K K K K K-CONH2 Strukturunterschiede GLP-1(7-36-Amid) zu GLP-1(7-37) Abbildung 2a: Strukturunterschiede Lixisenatid zu Exenatid Lixisenatid Strukturunterschiede Exenatid, Liraglutid und Lixisenatid zu GLP-1(7-37) Aminosäuresequenzen der aktiven GLP-1-Formen sowie der bisher zugelassenen GLP-1-Agonisten (Aminosäuren sind mit Einbuchstaben-Code angegeben) (nach Werner et al. 2010). 3 CA 1.4.2013 Pharmazeutische Chemie - Lixisenatid 7 7 His H2N Ala Glu Gly Thr Phe Thr Ser His H2N Asp Ala Glu Thr Gly Phe Thr Asp Ser Val Val Ser Ser Lys Ala Gln Ala Gly Leu Glu Tyr Lys Ser Ala Gly Gln Glu Leu Ser Tyr Glu Glu Phe Ile Ala Trp Leu Val Lys Gly 36 37 Arg Gly Phe 36 Ile COOH Ala 7 His Trp Leu Val Lys Gly Arg Thr Ser CONH2 GLP-1(7-36-Amid) GLP-1(7-37) H2N Ala 7 Gly Glu Thr Gly Phe Thr Ser Asp His H2N Ala Glu Gly Thr Phe Asp Leu Val Glu Ser Arg Val Ala Glu Glu Glu Met Gln Lys Ser Lys Leu Glu Phe Glu Trp Leu Lys Asp Gly Gly Ala Gln Gly Glu Pro Ala Trp Leu Val Arg Leu Tyr Ser 26 Phe 37 Ile Ala 34 Ile 37 Gly Arg Gly COOH Ser Liraglutid H2NOC 45 44 43 Ser Pro Pro Ser Pro Ala Gly Exenatid 7 His H2N Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Arg Val Ala Glu Glu Glu Met Gln Strukturunterschiede Exenatid, Liraglutid und Lixisenatid zu GLP-1(7-37) Lys Leu Phe 37 Glu Ile Trp Leu Lys Asp Gly Gly Pro Ser H2NOC Lys Lys Lys Lys Lys 45 44 43 Lys Ser Pro Strukturunterschiede GLP-1(7-36-Amid) zu GLP-1(7-37) Strukturunterschiede Lixisenatid zu Exenatid Ser Pro Ala Gly Lixisenatid Abbildung 2b: Aminosäuresequenzen der aktiven GLP-1-Formen sowie der bisher zugelassenen GLP-1-Agonisten (Aminosäuren sind mit Dreibuchstaben-Code angegeben) (nach Werner et al. 2010). 4 CA 1.4.2013 Pharmazeutische Chemie - Lixisenatid Der neue GLP-1-Agonist Lixisenatid zeigt große strukturelle Ähnlichkeit zu Exenatid bzw. Exenidin-4 und wird wie Exenatid ebenfalls synthetisch hergestellt. Das Polypeptid besteht aus 44 Aminosäuren, der gesamte N-terminale Anteil beginnend von Histidin-7 bis zu Prolin-43 ist identisch mit Exenatid (Abbildung 2). Die Cterminalen Modifikationen beinhalten den Austausch eines Prolins beim Exenatid durch ein Serin beim Lixisenatid an Position 44 sowie die Verlängerung des CTerminus um sechs Lysine. Die freie Carbonsäure des abschließenden Lysins liegt als Carbonsäureamid vor (Abbildungen 2 a und 2b). Die C-terminalen Modifikationen zusammen mit dem auch beim Exenatid erfolgten N-terminalen Austausch von Alanin an Position 8 des GLP-1 durch ein Glycin erschweren den Abbau durch die DPP-4. Die Halbwertszeit des Lixisenatids beträgt nach wiederholter Applikation ca. 3 Stunden (subkutane Applikation) (Barnett 2011). Lixisenatid wird demzufolge zusammen mit Exenatid als kurzwirksamer GLP-1-Agonist eingestuft im Gegensatz zum langwirksamen GLP-1-Agonisten Liraglutid (Tabelle 2) (Barnett 2011). Tabelle 2: GLP-1-Agonist Halbwertszeit / h (subkutane Applikation) Exenatid 2,4 Liraglutid 13 Lixisenatid 3 Halbwertszeiten der zugelassenen GLP-1-Agonisten Trotz dieser kurzen Halbwertszeit wird Lixisenatid nur einmal täglich appliziert, was mit seiner starken Bindung an den GLP-1-Rezeptor erklärt werden kann. RezeptorBindungsstudien haben gezeigt, dass Lixisenatid ca. viermal stärker an GLP-1Rezeptor bindet als das physiologische GLP-1 (Thorkildsen et al. 2003, Barnett 2011). Literatur: Barnett, A.H. Core Evid 2011, 6,67 Bode, B. Am J Manag Care 2011, 17(2 Suppl), S59 Brubaker, P.L. Endocrinology 2010, 151, 1984 Deacon, C.F. et al. Diabetes 1995, 44, 1126 Deacon, C.F. et al. J Clin Endocrinol Metab 2000, 85, 3575 Deacon, C.F. Horm Metab Res 2004, 36, 761 Doyle, M.E. und Egan, J.M. Pharmacol Ther 2007, 113, 546 Fachinformation Lyxumia 2013 Sanofi-Aventis Groupe Furman, B.L. Toxicon 2012, 59, 464 Havale, S.H. und Pal, M. Bioorg Med Chem 2009, 17, 1783 Holst, J.J. Physiol Rev 2007, 87, 1409 Mentlein, R. et al. Eur J Biochem 1993, 214, 829 Mentlein, R. Best Pract Res Clin Endocrinol Metab 2009, 23, 443 5 CA 1.4.2013 Pharmazeutische Chemie - Lixisenatid Nicholson, G. und Hall, G.M. Br J Anaesth 2011, 107, 65 Olokoba, A.B. et al. Oman Med J 2012, 27, 269 Parkes, D.G. et al. Expert Opin Drug Discov 2013, 8, 219 Pratley, R.E. und Gilbert, M. Rev Diabet Stud 2008, 5, 73 Rossi, M.C. und Nicolucci, A. Acta Biomed 2009, 80, 93 Thorkildsen, C. et al. J Pharmacol Exp Ther 2003, 307, 490 Werner, U. et al. Regul Pept 2010, 164, 58 6 CA 1.4.2013