Typ-2 Diabetes
Werbung

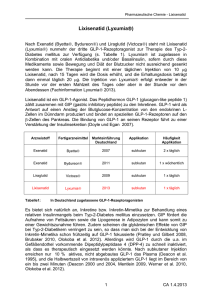
Pharmakotherapie des Diabetes mellitus Typ 2 SS 2010 Diabetes mellitus Typ 1 (juvenil) absoluter Insulinmangel infolge Zerstörung pankreatischer BZellen Katabole Stoffwechsellage, autoimmune Pathogenese Endstadium: Ketoazidose Typ 2 (adoleszent) Insulinresistenz und gestörte Insulinsekretion der B-Zellen Ursachen nicht vollständig geklärt, altersassoziiert, genetische Prädisposition, Adipositas Folgen: Langfristig schwere Schädigung von Blutgefäßen und Nervensystem ? Insulinotrope Maßnahmen Beta-Zellfunktion [%] 100 Insulinotrope Maßnahmen + andere Wirkprinzipien 75 Insulin 50 IGT 25 postpraniale Type2 HyperDiabetes Type2 glyämie Phase1 Diabetes Phase 2 Type2 Diabetes Phase 3 0 -12 -10 -6 -2 0 -2 -6 -10 -14 Years from Diagnosis UKPDS 16, 1995 Glukose i.v. Insulinsekretion Nicht-Diabetiker 2. Phase 1. Phase 0 30 60 90 Minuten Typ2-Diabetiker 2. Phase 0 30 60 90 Minuten Insulinstarre Typ 2 Diabetes Glukoneogenese Insulinresistenz Sulfonylharnstoffe: Wirkungsmechanismus β-Zelle Glut-2 Glukose Glukose-6-P Depolarisation Glykolyse K+ ATP/ADP Ca2+ Insulinspeicher KATP-Kanal Repaglinide-Bindungsstelle ATP R SU Ca2+ K+ Insulin Sekretion ATP-Bindungsstelle Sulfonylharnstoff-Bindungsstelle Ca2+ Sulfonylharnstoffe R1-SO2-NH-C-NH-R2 O -CH2-CH2-CH2-CH3 Tolbutamid Cl Glibenclamid CO-NH-(CH2)2OCH3 H3C H5C2 N-CONHCH2CH2 CH3 O Wirkungsweise: A: Depolarisation → Insulinfreisetzung B: Gluakonsekretion C: Potenzierung der Insulinwirkung Hauptrisiko Hypoglykämie Glimepirid Sulfonylharnstoffe: Indikation Primäre Monotherapie bei Typ-2 Diabetes • nicht ausreichend eingestellter Stoffwechsel (HbA1c > 7%) trotz Ernährungs- und Bewegungstherapie • Normalgewicht (BMI <25-27 kg/m2) Sulfonylharnstoffe: Nebenwirkungen • Hypoglykämien • GI Beschwerden (1-3%) – Übelkeit, Erbrechen, Gelbsucht • Hämatologische Reaktionen (≤ 0.1%) – Leuko-, Thrombozytopenien, Agranulozytosen • Dermatologische Reaktionen (≤ 0.1%) – Pruritus, Erythema nodosum, Erythema multiforme • Antabus Syndrom (Disulfiram-Syndrom) • Gewichtszunahme Nataglinide Repaglinide Glibenklamid O O S N O N H O OH H N H N O N H Cl N H O O O O CH 3 OH O D-Phenylalanin t0,5 tmax Metabolismus Elimination Repaglinide 1h 45 min Leber 98% Galle Nataglinide 1 h 45-60 min Leber 70-80% Niere Leber 50% Niere 50% Galle Glibenklamid 10 h 4h Glinide: Indikation Primäre Monotherapie bei Typ-2 Diabetes • nicht ausreichend eingestellter Stoffwechsel (HbA1c > 7%) trotz Ernährungs- und Bewegungstherapie • Normalgewicht (BMI <25-27 kg/m2) Glinide: Nebenwirkugen weniger Hypoglykämien Gewichtszunahme Fettgewebe Aufnahme von FFS und Speicherung als TG Energiespeicher (beta-Oxidation) Endogenes Organ mit hoher sekretorischer Kapazität - Leptin Tumornekrosisfaktor alpha (TNFα) Interleukin 6 (IL-6) Plasminogenaktivatorinhibitor 1 (PAI1) Heparin-bindender Wachstumsfaktor (HB-EGF) Adiponektin .... peripheres und viscerales Fett haben unterschiedliche Funktionen Abdominelles und Hüft/Oberschenkel-Fett haben unterschiedliche Funktionen Insulinstarre Typ 2 Diabetes Glukoneogenese Insulinresistenz Insulin-Resistenz Insulin Glukose Glut4 Weitere Insulineffekte Signaltransduktion Insulinresistenz Aufnahme von: Glukose Kern Aminosäuren Fettsäuren Mg2+ K+ Glykogensynthese Lipidsynthese Proteinsynthese Glukoneogenese Hypothese zur Genese der Insulinresistenz Positive Energiebilanz Genetische Disposition Bewegungsmangel Verminderte Mitochondrienaktivität großzellig, weiß Adipocytokine TZDs/PPARγγ Gewichtsreduktion Negative Energiebilanz TNFα Leptin IL6 FFS Insulinrezeptor- Insulinresistenz Signaltransduktion Entzündungsreaktionen Adiponectin kleinzellig, braun Skelettmuskel Leber Glitazone Thiazolidindione - “Glitazone” • Substanzen O O CH3 H3C NH O O S CH3 O Et CH3 NH N N O O NH S O N O S HO CH3 Troglitazon Rosiglitazon Pioglitazon • Wirkmechanismus – Aktivierung des Transkriptionsfaktors PPARγ O Peroxisome proliferator-activated receptor gamma PPARγ Kernmembran RA L L Glitazon PPARγγ PPRE 5’ RXR Glukosestoffwechsel Adipogenese Zytokine mRNA Gen Protein 3’ Glitazonwirkung L Glitazon PPARγγ Freie Fettsäuren ↓ TNF-α α↓ Resistin ↓ Insulinsensitivität ↑ Glukoseaufnahme ↑ Glukoseproduktion ↓ Glukoseaufnahme ↑ Pioglitazon Rosiglitazon Verabreichung oral oral Dosierung 30-45 mg 2-8 mg Einnahmefrequenz 1x 1-2x Elimination 55% biliär 45% renal 55% biliär 45% renal t 0,5 5,5hrs 3.6hrs t max 2-4hrs 1,3hrs(nüchtern) 3.5(postprandial) Plasmaeiweißbindung 99% 99% NW Gewichtszunahme Ödeme Infektion der oberen Atemwege (Gewichtszunahme) Insulinstarre Typ 2 Diabetes Glukoneogenese Insulinresistenz Biguanid(e) Metformin Biguanidine METFORMIN Mittel 1. Wahl bei Typ-2 Diabetes mit Übergewicht Keine direkte insulinsekretionssteigernde Wirkung an B-Zellen; ↓ Blutzucker nur bei Diabetikern nicht Stoffwechselgesunden ↓ Insulinresistenz → wirkt nur wenn Insulin vorhanden, keine Hypoglykämie Keine Gewichtszunahme ↓ Glukoseabgabe der Leber (Hemmung der Glukoneogenese) Hemmung der gastrointestinalen Glukoseresorption ↓ VLDL-Triglyceride ↑ HDL-Cholesterin bei Diabetikern, adipösen NichtDiabetikern (antithrombotisch) Biguanidine METFORMIN Kann alleine oder mit Sulfonylharnstoffen oder Insulin gegeben werden Langsam und vollständige Resorption nach oraler Gabe • 50-60% BV • keine Biotransformation/Metabolisierung • unverändert renal ausgeschieden (CAVE Nierenfunktionsstörungen!) • mittlere Plasma HWZ 1,5 – 4,5 h • keine Plasma-Eiweißbindung Dosierung einschleichend: 3x täglich mit Mahlzeit (500-1000 mg) Biguanidine Nebenwirkungen – GI Beschwerden (5-20%, transient) Übelkeit, Erbrechen, Blähungen, Durchfall – Selten megaloblastäre Anämie (Hemmung Vit B12 Resorption) – Lactatazidose (selten, aber in >30% letal, Kontrastmittelinteraktion) Risiko einer Lactazidose: Kontraindikationen – Diabetes Typ-1, diabetisches Koma – schwere Niereninsuffizienz – Lebererkrankungen – Alkoholismus – Schwangerschaft – Kardiopulmonale Insuffizienz – Gewebsanoxie – Ketoazidotische Stoffwechsellage Metformin: ≤ 0.08/1000 Patientenjahre Phenformin: 0.6 / 1000 Patientenjahre Praktisch alle Fälle einer Lactazidose unter Metformin durch Nichtbeachtung von Kontraindikationen, vor allem Niereninsuffizienz mit exzessiver Akkumulation des Wirkstoffes (beim Gesunden HWZ 2 - 5 h; Exkretion unmetabolisiert zu > 90% renal, keine Plasmaproteinbindung) (Bailey 1993) α-Glukosidase-Hemmstoffe CH2OH CH3 CH2OH CH2OH OH O OH O OH OH NH HO OH O OH O OH Acarbose O OH OH Wirkungsweise: Hemmt als Pseudotetrasaccharid enterale αGlukosidasen. Dadurch verzögerte Absorption vieler Kohlehydrate Nebenwirkungen: Flatulenz (20-30%) Diarrhoe (3%) Hypoglykämie-Risiko gering Sulfonylharnstoffe 1. Insulinstarre Repaglinide Nataglinide 5. Resorptionsverzögerung Acarbose Typ 2 Diabetes 2. Glukoneogenese Metformin Glitazone 3. Insulinresistenz Glitazone Metformin? Verringerter Inkretineffekt bei Patienten mit Typ-2-Diabetes Kontrollprobanden (n=8) Patienten mit Typ-2-Diabetes (n=14) Normaler Inkretineffekt 80 0,6 80 Verringerter Inkretineffekt 0,4 0,2 20 0,1 0 0 0 60 120 180 Zeit (min) 60 0,4 0,3 40 0,2 20 0,1 0 0 0 60 120 Zeit (min) Orale Glukosegabe IR = immunreaktiv Nauck M et al. Diabetologia 1986;29:46–52. Copyright © 1986 Springer-Verlag. Vilsbøll T, Holst JJ. Diabetologia 2004;47:357–366 i.v. Glukoseinfusion 180 nmol/l 0,3 40 IR-Insulin (mU/l) 60 0,5 nmol/l IR-Insulin (mU/l) 0,5 0,6 Inkretine Verstärkung der Glukose-induzierten Insulinsekretion Keine Wirkung bei Normoglykämie/keine Hypoglykämie-Gefahr Hemmung der Magenentleerung, Appetit, Nahrungsaufnahme Aktories et al. 10. Auflage Abb 27.3 Typ-2 Diabetes/Inkretinanaloga Inkretine Nahrungsaufnahme Glucose-dependent insulinotropic peptide (GIP) Glukagon-like peptide-1 (GLP-1) His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg amid 7 10 15 20 25 30 35 36 Gastrointestinaltrakt GLP-1(7-36)amid und GIP(1-42) Inkretinaktivität Modifiziert nach Baggio & Drucker Gastroenterology: Vol. 132, 2007 Typ-2 Diabetes/Inkretinanaloga Exenatide (Byetta®) Struktur Glukagon-like peptide-1 (GLP-1) His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg amid 7 10 15 20 25 30 35 36 Proteolytische Inaktivierung (DDP-4) Exenatide His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Pro Ser Ser Gly Ala Pro Pro Pro Ser amid Modifiziert nach Drucker&Nauck, Lancet: Vol. 368, 2006 Exenatide Indikationen, Pharmakokinetik Zusatzmedikation wenn Metformin und/oder Sulfonylharnstoffe nicht ausreichend wirksam sind bei Patienten mit Typ 2-Diabetes Verabreichung s.c. (Pen) 2-mal täglich innerhalb von 60 min vor einer Hauptmahlzeit Beginn mit 2x5µg nach 1 Monat 2x10µg Renale Elimination, HWZ ca. 2,4 h, vorsichtige Dosiseskalation bei mäßiger bis starker Niereninsuffizienz (CLcr < 30-50 ml/min) Exenatide Exenatide (Byetta®) Sehr häufige Nebenwirkungen (≥ 10 %) Gastrointestinale Symptome - Übelkeit (40 - 50 %) - Erbrechen (10-15 %) - Durchfall (10-15%) - verminderter Appetit Kopfschmerzen (10%) Reaktionen an der Injektionstelle (5%) Hypoglykämien in Kombination mit Sulfonylharnstoffen Antikörperbildung (44 %, 6% mit hohem Titer, 3 % mit Wirkverlust) Liraglutid, ein humanes GLP-1 Analogon zur einmal täglichen Gabe Humanes GLP-1 C-16 Fettsäure (Palmitoyls.) 7 9 His Ala Glu Gly Thr Phe Thr Ser Asp Val Enzymatischer Abbau durch DPP-4 7 Liraglutid 9 His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Glu Lys Ala Ala Gln Gly Glu Leu Tyr Ser Glu 36 Phe Ile Ala Trp Leu Val Arg Gly Arg Gly Ser Lys Ala Ala Gln Gly Glu Leu Tyr Ser Glu 36 Phe Ile Ala Trp Leu Val Lys Gly Arg Gly T½=1,5–2,1 min 97% Homologie zu humanem GLP-1; verbesserte PK: Albuminbindung durch Acylierung; Heptamerbildung • Langsame Absorption aus der Subcutis • Resistent gegenüber dem Abbau durch DPP-4 • Lange Plasma-HWZ (T½=13 h) Knudsen et al. J Med Chem 2000;43:1664–9; Degn et al. Diabetes 2004;53:1187–94 Liraglutid: größere Homologie zum humanen GLP-1, weniger Antikörperbildung Prozentsatz der Patienten mit erhöhten Antikörpern Humanes GLP-1 100 Liraglutid 80 97% AminosäurenHomologie zu humanem GLP-1 60 40 Exenatid 53% AminosäurenHomologie zu humanem GLP-1 20 43% 8,6% 0 Liraglutid1 Exenatid + Metformin2 Es gab infolge der Liraglutidantikörper keine Abschwächung der Wirkung 1LEAD1,2,3,4,5 Studiendauer: Liraglutid: 26 Wochen; Exenatid: 30 Wochen. Metaanalyse der Antikörperbildung; Data on file; 2DeFronzo et al. Diabetes Care 2005;28:1092 Liraglutid (Victoza) Wirkungsmechanismus • gentechnisch hergestelltes GLP-1-Analogon mit einer Sequenzhomologie von 97% zum humanen GLP-1 • bindet an den GLP-1-Rezeptor • wird nicht durch DPP-4 abgebaut Dosierung • 1x täglich, subkutan Injektion, unabhängig von den Mahlzeiten, in Abdomen, Oberschenkel oder Oberarm Nebenwirkungen • besonders zu Beginn der Behandlung: Übelkeit und Durchfall, Erbrechen, Verstopfung, abdominale Schmerzen und Dyspepsie. • Kopfschmerzen und Nasopharyngitis waren ebenfalls häufig. Vorteile: weniger antigen als Exenatide längere Halbwertzeit (1mal täglich) bessere Verträglichkeit Gliptine Wirkungsmechanismus: Dipeptidyl-Peptidase-4 (DPP-4) Hemmstoffe Nahrungsaufnahme Gastrointestinaltrakt GLP-1(7-36)amid GIP(1-42) Inkretinaktivität DPP-4 DPP-4 Inhibitor amid Arg Gly Lys Val Leu Trp Ala Ile Phe Glu Lys Ala Ala Gln Gly Glu Leu Tyr Ser Ser Val Asp Ser Thr Phe Thr Gly Glu Ala His 36 35 30 25 20 15 10 7 GLP-1 (9-36)amid Und GIP (3-42) Modifiziert nach Baggio & Drucker Gastroenterology: Vol. 132, 2007 Gliptine Arzneistoff Sitagliptin Vildagliptin Saxagliptin (Januvia®) (Galvus®) Sitagliptin Indikation Diabetes mellitus Typ II Vildagliptin Bewertung Neues Wirkprinzip Sitagliptin Indikationen, Pharmakokinetik Zusatzmedikation, wenn Metformin, Sulfonylharnstoff oder PPARgamma Agonisten und Diät nicht ausreichend wirksam sind bei Patienten (> 18 Jahre) mit Typ 2-Diabetes Verabreichung p.o. 1 x 100 mg unabhängig von den Mahlzeiten 80% renale Elimination, HWZ ca. 12,4 h, bei leichter Niereninsuffizienz (CLcr ≥ 30-50 ml/min) keine Dosisanpassung bei höhergradiger Niereninsuffizienz nicht empfohlen Typ-2 Diabetes Art der Einnahme Jahr der Einführung oder FDA Zulassung Effektivität als Monotherapie, gemessen als Reduktion der Konzentration an glykosyliertem Hämoglobin Parenteral 1921 ≥ 2.5 Pulmonal 2006 1.5 Sulfonylharnstoff Oral 1946 1.5 Biguanide Oral 1957 Oral 1995 1.5 Alpha-Glycosidase Inhibitoren Oral 1995 0.5-0.8 Thiazolidine Oral Medikation Insulin Inhaliertes Insulin Metformin 0.8-1.0 Troglitazon Oral 1997 Rosiglitazon Oral 1999 Pioglitazon Oral 1999 Oral 1997 1.0-1.5 GLP-Analoga Parenteral 2005 0.6 Amylin-Analoga Parenteral 2005 0.6 Oral 2006 0.5-0.9 Glinide DPP-IV Inhibitoren Modifiziert nach N Engl J Med. 2007 May 24;356(21):2219-20 SGLT2-Inhibitoren SGLT2-Inhibitoren Inhibitorendes desSubtyp Subtyp22der dersodium-glucose sodium-glucosetransporter transporterProteins Proteins(SGLT2) (SGLT2) Inhibitoren remogliflozin Theoretical safety concerns about increased glucosuria by SGLT2 inhibtion do not appear to be relevant as patients with familial renal glucosuria by an inherited defective form of SGLT2 have normal kidney function, are not hypoglycemic and have no pathology caused by the transporter defect. Ansatzpunkte der oralen Antidiabetika Glitazone Metformin Glitazone Muskulatur Metformin Glitazone Leber Fettgewebe ↓ Lipolyse ↓ Freie fettsäuren Sulfonylharnstoffe Glinide Inkretinmimetika Pankreas ↑ Insulin ↑Glukoseaufnahme ↑ Glukoseverwertung ↓ Glukoneogenese Ziel: Normoglykämie α-Glukosidase Inhibitoren Metformin Darm SGLT2-Inhibitoren ↓ KH Digestion