Aminosäure
Werbung

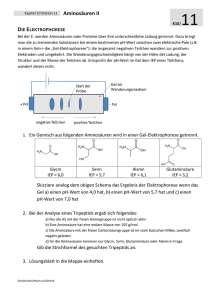
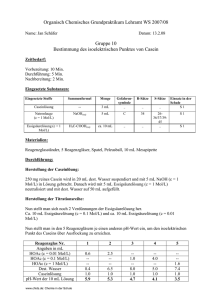
Mittwoch, 22.05.2002 Gruppe 8 Name: Hansjörg Haas Jens Gesche Biochemisches Praktikum Kurstag: Aminosäuren und Proteine Protokoll Aminosäuren spielen im Stoffwechsel eine wichtige Rolle (Bausteine von Peptiden, Proteinen, etc.). Aus diesem Grund ist der Nachweis von Aminosäuren von großer Bedeutung. Ionenaustauschchromatographie In der verwendeten Aminosäure (AS)- Lösung sind statt der acht aufgeführten Aminsäuren nur folgende sechs enthalten: His, Arg, Phe, Ala, Asp, Glu. His und Arg liegen in wässriger Lösung als Kationen, Asp und Glu als Anionen vor, während Phe und Ala nach außen hin elektrisch neutral erscheinen. Im Anionentauscher (Harz Dowex) wird die Carbonylgruppe des Aminosäurerestes der Anionen an positive funktionelle Gruppen des Harzes gebunden. Bei Zugabe einer Säure (z.B. Essigsäure) wird diese protoniert und dadurch vom Harz gelöst. Die Kationen, sowie die elektrisch neutralen Aminosäuren werden hingegen nicht gebunden. Bei der Auftragung der einzelnen Fraktionen auf Kieselgelfolie und anschließender Ninhydrin-Farbreaktion ergab sich folgendes Bild: Für die anschließende Dünnschichtchromatographie wählten wir die Proben W1 und S4 aufgrund der höchsten Farbintensität (=höchster AS-Gehalt). Dünnschichtchromatographie Statt der im Skript erwähnten mit Cellulose beschichteten Glasplatte wurde für die Chromatographie eine Kieselgelfolie verwendet. Um festzustellen ob und welche AS im Harz hängen blieben, werden die zwei Fraktionen zusammen mit reinen AS-Referenzlösungen auf ein DC-Papier aufgetragen und mittels DC analysiert. Seite 1 von 3 Skizze: Auswertung: In der Probe W1 ließen sich im Vergleich mit den aufgetragenen Referenzaminosäuren nachweisen (wie erwartet die elektrisch neutralen, bzw. nach außen hin positiv geladenen AS): Phe, Ala, His und Arg In der Probe S4 ließen sich im Vergleich mit den aufgetragenen Referenzaminosäuren nachweisen (wie erwartet die nach außen hin negativ geladenen AS): Glu und Asp Im unpolaren Laufmittel wird Phe am weitesten mitgetragen, weil es den größten unpolaren (hydrophoben) Rest besitzt. Die hydrophile AS werden weit weniger mitgetragen. Aminosäuren mit nur einer sauren Gruppe (alpha-Carbonylgruppe) werden vom Harz nicht gebunden, da die ebenfalls positiv geladene NH 3 -Gruppe einer Bindung entgegenwirkt. Die AS erscheint nach außen hin neutral (isoelektrischer Punkt). Bestimmung des isoelektrischen Punktes von Casein Ergebnisse: Reagenzglasnummer berechneter ph-Wert gemessener ph-Wert ml 0,001 M 1 2 3 4 5 6 7 8 9 4,48 4,33 4,18 4,03 3,87 3,72 3,57 3,42 3,27 7,52 7,20 6,33 5,35 4,48 4,06 3,76 3,55 3,36 0,6 1,25 2,5 5,0 - - - - - - - - - 1,0 2,0 4,0 8,0 - - - - - - - - - 1,6 8,4 1,0 7,75 1,0 6,5 1,0 4,0 1,0 8,0 1,0 7,0 1,0 5,0 1,0 1,0 1,0 7,4 1,0 - - - + ++ +++ ++ + - 0,380 0,255 0,405 0,290 0,410 0,295 0,420 0,300 0,110 0,085 0,202 0,140 0,370 0,250 0,395 0,280 0,395 0,280 CH 3COOH ml 0,01 M CH 3COOH ml 0,1 M CH 3COOH ml dest. Aqua ml Caseinlösung beobachtete Fällung Extinktion Proteingehalt (mg/ml) Seite 2 von 3 Auswertung: Die berechneten pH-Werte weichen von den tatsächlichen pH-Werten ab, da bei der Berechnung die Zugabe von Casein nicht berücksichtigt wurde. Casein hat einen pH=7 und erhöht dadurch den pH-Wert der Essigsäurelösung. Darüber hinaus besitzt Casein Pufferfunktion. Löslichkeitskurve von Casein 0,35 0,3 Proteingehalt (mg/ml) 0,25 0,2 0,15 0,1 0,05 0 7,52 7,2 6,33 5,35 4,48 4,06 3,76 3,55 3,36 pH-Wert Aus den Werten ergibt sich, dass der isoelektrische Punkt des Casein bei einem pH-Wert von pH 4,5 liegt. Der Proteingehalt im Überstand der Lösung ist bei diesem pH sehr niedrig, da AS am IEP nach außen hin elektrisch neutral und daher im Wasser schlechter löslich sind (beobachtete Fällung). Trennung eine Proteingemisches mit Hilfe der Gelfiltration Im Proteingemisch sind Dextranblau (2 MDa) und oranges BSA (60 kDa) enthalten (daher die grüne Farbe des Gemisches!). Als stationäre Phase fungiert die Sephadex G 25 – Gelsäule. Kleinere Moleküle treten langsamer durch das Gel hindurch, da sie in dessen Poren aufgehalten werden. Für größere Moleküle sind die Poren undurchlässig, wodurch diese schneller durch das Gel hindurchtreten. Beim Durchspülen mit destilliertem Wasser bilden sich zwei deutlich erkennbare: Das BSA mit einem niedrigeren Molekulargewicht bildet bereits im oberen Abschnitt eine orange Farbbanden, während sich das Dextranblau mit dem höheren MG am Auslauf der Säule wiederfindet ( siehe Skizze ). Beim weiteren Durchspülen mit der 0,02M NaClLösung wird zunächst das Dextranblau vollständig ausgewaschen und schließlich auch das BSA, da das NaCl die Protein/Sephadex-Wechselwirkung hemmt. Seite 3 von 3