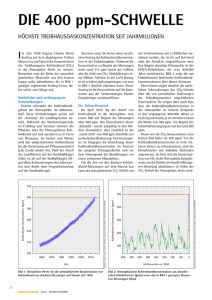
δ [ppm]
Werbung
![δ [ppm]](http://s1.studylibde.com/store/data/006488931_1-fd1b8899bf1aee8a42e2e7a6fcb7ee58-768x994.png)
Kernresonanzspektroskopie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Leibniz‐Institut für Naturstoff‐Forschung und Infektionsbiologie E‐mail: markus.nett@hki‐jena.de NMR = nuclear magnetic resonance Kernmagnetische Resonanz tritt auf, wenn die Kerne (= Nuclei) bestimmter Atomsorten (1) sich in einem statischen Magnetfeld befinden und (2) einem zweiten oszillierenden Magnetfeld ausgesetzt werden. Voraussetzung für kernmagnetische Resonanz ist, dass der betreffende Atomkern einen Kernspin ≠ 0 besitzt. -2- Was versteht man unter Spin? • engl. to spin = kreiseln • Der Spin ist ein gequantelter Drehimpuls. • keine Beschränkung auf ganze Quantenzahlen (I = 0, 1 , 2 1, 3 2 , 2, usw.) • Einzelne Protonen Protonen, Elektronen und Neutronen besitzen einen Spin von 1 . 2 • Die Richtungen, in die der Spin zeigen kann, sind quantisiert. • Spins können positive oder negative Vorzeichen tragen. • Elektronen, Elektronen die sich ein Orbital teilen teilen, unterscheiden sich in ihrer Spinrichtung Spinrichtung. • Zwei oder mehr gepaarte Teilchen mit entgegengerichteten Spins haben keinen nach h außen ß wirksamen ik S Spin. i -3- Was versteht man unter Spin? Der Gesamtspin eines Kerns ergibt sich aus der Summe der Spins der Kernbausteine, d.h. der Protonen und Neutronen (= Nukleonen). Berechnen Sie den Kernspin der folgenden Atomkerne: Anz. Protonen Anz. Neutronen 1 1 0 2 H 1 1 He 2 2 12 6 6 13 6 7 14 7 7 15 7 8 9 10 H 4 C C N N 19 F -4- Kernspin Magnetisches Moment Die Rotation eines geladenen Teilchens induziert ein Magnetfeld. Teilchen und Atomkerne, die einen Spin besitzen, verhalten sich im Magnetfeld als hätten sie ein magnetisches Moment. Beispiel: der Wasserstoffkern Ausrichtung in einem externen Magnetfeld: ≡ Energie -5- Magnetresonanz Ein Übergang zwischen den beiden Energiezuständen ist möglich durch Absorption eines Photons. Die Energie des Photons muss dabei genau der Energiedifferenz zwischen den beiden Zuständen entsprechen: Aufspaltung der beiden Spinzustände eines Kerns in einem äußeren Magnetfeld E h da B folgt: Energie e E h B h = Plancksche Konstante = Resonanzfrequenz = gyromagnetisches Verhältnis Magnetfeldstärke B = Magnetfeldstärke -6- Präzessionsbewegung / Kreiselmodell Kern-Zeeman-Niveaus in Richtung des äußeren Feldes entgegen dem äußeren Feld Präzessionsbewegung Anstoss -7- Prinzip der NMR-Messung (vereinfachte Darstellung) = Relaxation -8- Protonenresonanzspektrum 1 H-NMR-Spektrum von Methanol Ind duktionssp pannung de er Empfän ngerspule Beispiel: Signalfrequenz [Hz] δ [ppm] = Betriebsfrequenz [MHz] δ [ppm] Magnetfeldstärke -9- Chemische Verschiebung abhängig von: • Art der chemischen Bindung • Umgebung des Kerns Durch den Einfluss in der Nähe befindlicher Atome, deren Elektronen selbst Magnetfelder besitzen, kann die Stärke Sä des ä äußeren ß Feldes verringert oder verstärkt ä werden: Abschirmung g • muss durch Verstärkung des äußeren Feldes kompensiert werden • diamagnetische Verschiebung / Hochfeldverschiebung der Kernresonanzsignale zu kleineren δ-Werten Entschirmung • für die Resonanz muss die äußere Feldstärke verkleinert werden • paramagnetische Verschiebung / Tieffeldverschiebung der Kernresonanzsignale zu größeren δ-Werten Werten - 10 - Chemische Verschiebung und Elektronegativität Elektronegativität von X nimmt zu Elektronendichte um HA nimmt ab chemische Verschiebung von HA nimmt zu - 11 - Chemische Verschiebung Beispiel: 1 H-NMR-Spektrum von Methanol CH3 hohes Feld tiefes Feld OH δ [ppm] - 12 - Charakteristische Bereiche 1H chemischer Verschiebungen δ [ppm] [ ] 13 12 11 10 9 8 7 6 5 4 3 2 1 0 13 12 11 10 9 8 7 6 5 4 3 2 1 0 TMS CH3 gesättigt CH2 gesättigt CH gesättigt CH3-C-X CX CH3-C= CH3-C=O CH3-Aryl CH3-S, N HC≡ CH3-OH2C= HC= H-Aromatisch H-Heteroaromatisch R-CHO R-CO2H δ [ppm] - 13 - Magnetische Anisotropie Ringstrom der π-Elektronen + – – + B0 Abschirmung Entschirmung Signalstärke Innerhalb eines 1H-NMR-Spektrums verhalten sich die Flächen der Signale einer Substanz wie die Anzahl der Protonen, die diese Signale verursachen. CH3 OH 3 1 δ [ppm] - 15 - Spin-Spin-Kopplung Aufspaltung der Signale best. Wasserstoffatome in mehrere Linien Beispiel: p 1 H-NMR-Spektrum p von Ethanol - 16 - Signal-Aufspaltungen erster Ordnung Benachbarte Kernspins treten über die Polarisation der Bindungselektronen miteinander in Wechselwirkung (= indirekte Spin-Spin-Wechselwirkung). Beispiel: zwei magnetisch g äquivalente q Kerne A befinden sich in Nachbarschaft zum Kern X X AA b i X wirken bei ik d dreii unterschiedliche t hi dli h M Magnetfelder tf ld Aufspaltung in ein Triplett Intensitäts erhältnis = 1 : 2 : 1 Intensitätsverhältnis - 17 - Aufspaltungsregeln für Kerne mit einem Spin von ½ 1. Isochrone Kerne koppeln nicht miteinander. 2. Bei Kernen, die drei oder weniger Bindungen entfernt sind, ist üblicherweise eine Signalaufspaltung g p g aufgrund g von skalarer Kopplung pp g zu erwarten. 3. Der Abstand zwischen den Resonanzlinien heißt Kopplungskonstante J. 4. Bei Kopplung mit n benachbarten Kernen spaltet das Signal in n+1 Linien auf, deren Intensitäten dem Pascalschen Dreieck entnommen werden können. - 18 - Signal-Aufspaltungen erster Ordnung Multiplizität Bezeichnung Intensitäten 1 Singulett (s) 1 2 Dublett (d) 1:1 3 Triplett (t) 1:2:1 4 Quartett (q) 1:3:3:1 5 Quintett 1:4:6:4:1 6 Sextett 1 : 5 : 10 : 10 : 5 : 1 ... ... ... - 19 - Tipps zur Auswertung von 1H-NMR-Spektren 1. Bestimme die chemische Verschiebung δ aller Signale i. Protonenresonanzen durchnumerieren ii. δ-Werte Werte in einer Tabelle anordnen iii. δ-Werte auf zwei Dezimalstellen genau angeben iv iv. bei Multipletts entspricht das arithmetische Mittel aller Resonanzlinien der chemischen Verschiebung 2. Bestimme die Multiplizitäten und die J-Werte 3. Bestimme die Signalintensitäten 4. Kombiniere die strukturellen Informationen - 20 - Tipps zur Auswertung von 1H-NMR-Spektren – Beispiel 3 2 1 δ [ppm] Signal # δ [ppm] M Intensität 1 11.73 Singulett 1 2 2.38 Quartett 2 3 1 16 1.16 T i l tt Triplett 3 - 21 - Tipps zur Auswertung von 1H-NMR-Spektren – Beispiel Informationen aus Signal 1: integrale Intensität 1 → 1 Proton Singulett → keine Protonen in direkter Nachbarschaft δ = 11.73 ppm → das kann nur das H-Atom einer Säurefunktion sein Informationen aus Signal 2: integrale g Intensität 2 → 2 Protonen Quartett → 3 benachbarte Protonen (z.B. CH3-Gruppe) δ = 2.38 ppm → evtl. CH2-Gruppe Informationen aus Signal 3: integrale Intensität 3 → 3 Protonen Triplett → 2 benachbarte Protonen (z.B. CH2-Gruppe) δ = 1.16 1 16 ppm → evtl. tl CH3-Gruppe G Si Signal l# δ [ppm] [ ] M I t Intensität ität 1 11.73 Singulett 1 2 2 38 2.38 Quartett 2 3 1.16 Triplett 3 Übungsaufgabe 1 Handelt es sich bei dem abgebildeten 1H-NMR-Spektrum um 1-Propanol oder um Isopropanol? Begründen Sie Ihre Entscheidung! δ 3.58 ppm δ 0.94 ppm δ 1.57 ppm δ 2.26 ppm - 23 - Übungsaufgabe 2 Od Ordnen Sie Si d den H H-Atomen At des d Thymols Th l die di jeweils zugehörigen 1H-NMR-Signale zu! TMS X δ [ppm] - 24 - Übungsaufgabe 3 – Signalzuordnung Eugenol TMS X δ [ppm] - 25 - Substituenteneinflüsse Steigt die Elektronendichte infolge induktiver oder mesomerer Effekte an, so führt dies zu einer erhöhten Abschirmung und damit zu einer Hochfeldverschiebung. "+I" ≡ –I < +M (-) (-) (-) "+I" Elektronendonatoren an Doppelbindungen erhöhen die Elektronendichte am β-C-Atom und bewirken damit eine Hochfeldverschiebung (Abschirmung). Elektronenakzeptoren an Doppelbindungen erniedrigen die Elektronendichte am β-C-Atom und bewirken damit eine Tieffeldverschiebung (Entschirmung). - 26 - Inkrement-System zur Abschätzung von 1H-Verschiebungen Spin-Kopplungen Atomkerne koppeln (im Normalfall) über chemische Bindungen. 1 J = skalare Kopplungen 2 J = geminale Kopplungen 3 J = vicinale Kopplungen 4 J = allylische Kopplungen 5 J = homoallylische Kopplungen Fernkopplungen Mit steigendem Bindungsabstand wird die Kopplung i.d.R. schwächer, d.h. der Betrag von J wird kleiner. Daneben hängt die Größe der Kopplung auch von sterischen und elektronischen Faktoren ab. - 28 - Spin-Kopplungen & Kopplungskonstanten Signal-Aufspaltungen höherer Ordnung liegen vor, wenn die Signale der koppelnden 1H-Atome im 1H-NMR-Spektrum nahe beieinander liegen. Aufspaltungen erster Ordnung: Δν /J > 10 • Atome werden mit am Anfang und Ende des Alphabets liegenden Buchstaben bezeichnet, z.B. HA und HX • Die Zahl der Protonen wird durch Indizes gekennzeichnet. Aufspaltungen höherer Ordnung: Δν /J < 10 • Atome werden nur mit am Anfang des Alphabets liegenden Buchstaben bezeichnet, z.B. HA und HB - 30 - Signal-Aufspaltungen höherer Ordnung AB-Systeme bestehen aus Linien, von welchen die äußeren weniger g intensiv sind als die inneren und die symmetrisch angeordnet sind. => Dacheffekt Strichspektren eines AB-Systems bei festgehaltener K Kopplung l JAB und d variablem i bl V Verhältnis hält i Δν/J Δ /J - 31 - 57 29 88 59 4000 3000 2000 1500 1000 500 cm-1 Übungsaufgabe 4 Identifizieren Sie die Verbindung anhand ihrer Spektren! 4.0 3.5 3.0 2.5 2.0 ppm 1.5 1.0 0.5 0.0 Übungsaufgabe 5 Identifizieren Sie die Verbindung anhand ihrer Spektren! Summenformel: C3H7NO2 4000 3000 2000 1500 1000 500 cm-1 Messung in D2O (OH-Gruppen werden nicht detektiert!) δ [ppm] Übungsaufgabe 6 + Übungsaufgabe 7 Eine flüchtige Verbindung, C8H14O, besitzt eine starke IR-Absorptionsbande bei 1717 cm-1. Das 1H-NMRSpektrum zeigt Signale bei δH 1.65 (3H, s), 1.72 (3H, s), 2.15 (3H, s), 2.40 (4H, m) und 5.20 (1H, t) ppm. Ozonolyse der Verbindung liefert u.a. Propanon. Die Umsetzung mit Iod im Alkalischen gibt Iodoform. Welche Rückschlüsse können aus (a) der Summenformel, (b) dem IR-Spektrum, (c) dem 1H-NMRgezogen g werden? ((e)) Machen Sie anhand Ihrer Ergebnisse g Spektrum und ((d)) den chemischen Reaktionen g einen Strukturvorschlag für die flüchtige Verbindung! Die Hydrolyse einer Substanz lieferte eine aromatische Verbindung, C9H10O4, die in wäßrigem NaHCO3 löslich ist. Die Verbindung besitzt im IR-Spektrum Absorptionsbanden bei 2700 (breit), 1690 und 1600 cm-1. Das 1H-NMR-Spektrum H NMR Spektrum zeigt Resonanzen bei δH 3.85 3 85 (6H) (6H), 6.62 6 62 (1H) und 7 7.15 15 ppm (2H) sowie ein breites Signal bei δH 10.20 ppm (1H). Letzteres verschwand, nachdem die Probe mit D2O versetzt wurde. Eine genaue Analyse des Signals bei δH 6.62 ppm ergab, dass es sich um ein schmales Triplett handelt (J = 1.5 Hz), während das Signal bei δH 7.15 ppm als Dublett aufgespalten ist (J = 1.5 Hz). Machen Sie basierend auf den gegebenen Daten einen Strukturvorschlag und erläutern Sie die Signalaufspaltung im 1H-NMRSpektrum! - 34 - Übungsaufgabe 8 + Übungsaufgabe 9 Im Rahmen einer Synthese fiel als Nebenprodukt eine Verbindung mit der Summenformel C7H16O an. Das EI-Massenspektrum der Substanz zeigt zwei deutliche Fragmentionen bei m/z 57 und m/z 45. Signifikante IR-Absorptionsbanden wurden bei 3363 (breit) und 2958 cm-1 detektiert. Das 1H-NMR-Spektrum zeigt Resonanzen bei δH 0.96 (9H, s), 1.19 (3H, d, J = 6.2 Hz), 1.34 (1H, dd, J = 14.4 und 3.4 Hz), 1.42 (1H, dd, J ), 1.91 (1H, ( , br s)) und 3.96 pp ppm ((1H,, m). ) Welche Rückschlüsse können aus (a) ( ) der = 14.4 und 7.6 Hz), Summenformel, (b) dem IR-Spektrum und (c) dem 1H-NMR-Spektrum gezogen werden? (d) Machen Sie einen Strukturvorschlag für die Verbindung! (e) Worauf sind die beiden Fragmentionen zurückzuführen? Durch Wasserdampfdestillation von Anisfrüchten und anschließende Flash-Chromatographie des gewonnenen ätherischen Öls an Kieselgel wurde eine Verbindung mit der Summenformel C10H12O isoliert. Das IR-Spektrum zeigt deutliche Absorptionsbanden bei 1609, 1511 und 840 cm-1. Eine 1H-NMR-Messung liefert Resonanzen bei δH 1.82 (3H, d, J = 6.6 Hz), 3.73 (3H, s), 6.06 (1H, m), 6.32 (1H, d, J = 15.6 Hz), 6.80 (2H d (2H, d, J = 8.6 8 6 Hz) und 7.22 7 22 ppm (2H, (2H d d, J = 8.6 8 6 Hz) Hz). Nach Ozonolyse konnte Acetaldehyd identifiziert werden. Welche Rückschlüsse können aus (a) der Summenformel, (b) dem IR-Spektrum, (c) dem 1H-NMRSpektrum und (d) der chemischen Reaktionen gezogen werden? (e) Machen Sie anhand Ihrer Ergebnisse einen Strukturvorschlag! - 35 - 13C-NMR NMR--Spektroskopie - 36 - Allgemeine Grundlagen geringe natürliche Häufigkeit von 13C (1.1%) γ(13C)) ~ ¼ γ(1H)) Signal-Dispersion aufgrund der heteronuklearen 1H-Kopplung C–C–C–C ~ 96% aller Moleküle sind NMR-insensitiv (I = 0) C–C–C–C ~ 1% C–C–C–C ~ 1% Diese Isotopomere werden beim C–C–C–C ~ 1% „Standard“-13C NMR-Experiment detektiert. C–C–C–C ~ 1% C–C–C–C ~ 0.01% C–C–C–C ~ 0.01% nur mit speziellen Verfahren messbar ...................... C–C–C–C ~ 0.000001% - 37 - Steigerung der Empfindlichkeit von 13C NMR-Messungen Um den Einfluss der Protonen auf die C-Atome auszuschalten, wird ein breites Frequenzband in den Protonenkanal des Spektrometers eingestrahlt. Dazu moduliert man die eingestrahlte i t hlt elektromagnetische l kt ti h S Schwingung h i mitit niederfrequentem i d f t R Rauschen. h Diese Technik nennt man Entkopplung. Das 13C NMR-Spektrum zeigt nur noch einzelne diskrete Linien für jedes magnetisch nicht-äquivalente C-Atom. Das Signal-Rausch-Verhältnis nimmt zu, da nJC,H zusammenfällt. - 38 - Aufnahme von13C NMR-Spektren über 1H-Breitbandentkopplung Breitband-entkoppelt „Standard“-Messung - 39 - 13C NMR vs. 1H NMR-Spektroskopie Besonderheiten von 13C NMR-Spektren üblicherweise keine Kopplungsinformation großer chemischer Verschiebungsbereich (0 – 240 ppm) Signalintensitäten korrelieren i.d.R. nicht mit der Anzahl der äquivalenten Kerne Die 13C chemische Verschiebung g hängt g ab von • dem Hybridisierungsgrad des C-Atoms (sp3, sp2, sp) • Substituenteneffekten • der Elektronendichte - 40 - Einfluss des Hybridisierungsgrades δ sp2 C=C C O C=O C=S C=N ~ 90 – 160 ppm ~ 150 – 220 ppm ~ 180 – 240 ppm ~ 110 – 160 ppm δ sp > C≡C C≡N ~ 50 – 110 ppm ~ 105 – 120 ppm - 41 - > Alkyl δ sp3 ~ 0 – 80 ppm Substituenteneinflüsse • steigende Alkylsubstitution führt zur Entschirmung δ Cquartär > δ Ctertiär > δ Csekundär > δ Cprimär > δ CH4 • elektronegative Substituenten führen zur Entschirmung CH3F 75 ppm CH3Cl 25 ppm CH3Br 10 ppm CH3I - 21 ppm Extrembeispiele: → 'Schweratomeffekt' CF4 119 ppm CI4 -292 ppm (Hochfeldverschiebung) • γ-Effekt Abschirmung des C C-Atoms Atoms in γ-Stellung γ Stellung zu X (X = OH OH, Cl, Cl CO CO,...)) 63 HO α β 33 26 30 23 γ 29 32 - 42 - CH3 14 ppm Einfluss der Elektronendichte Je geringer die Elektronendichte, desto größer die chemische Verschiebung. 156 ppm 128.5 ppm 100 ppm - + - 43 - Charakteristische Bereiche 13C chemischer Verschiebungen - 44 - 13 C NMR-Spektroskopie – Inkrementberechnungen Abschätzung der 13C-chemischen C chemischen Verschiebungen in substituierten Benzolen Berechnung für m-Kresol 13 C NMR-Spektroskopie – Spektrenauswertung • Anzahl der Signale = Anzahl der magnetisch nicht-äquivalenten C-Atome • δ -Werte erlauben Rückschlüsse auf die Art der C-Atome C ((aliphatisch)) ~ 0 – 40 ppm ((CH3 < CH2 < CH < Cquart.) C–N ~ 50 ppm C–O ~ 60 ppm C≡C ~ 65 – 85 ppm C (olefinisch) ~ 100 – 150 ppm C (aromatisch) ~ 110 – 150 ppm C (Ester, Amid, Säure) ~ 160 – 180 ppm y , Keton)) C ((Aldehyd, > 180 pp ppm • Signalgröße kann ein Hinweis auf quarternäre C-Atome sein - 46 - 1H-entkoppeltes 13C 1 NMR-Spektrum von Hex-1-in 6 HC≡C-CH HC≡C CH2-CH CH2-CH CH2-CH CH3 2 - 47 - 4 1 536 Übungsaufgabe 10 Wie viele Signale erwarten Sie in den 13C NMR-Spektren folgender Verbindungen? - 48 - Übungsaufgabe 11 Abgebildet ist das 1H-entkoppelte 13C NMR-Spektrum einer organischen Verbindung (m/z 88). Um was für eine Substanz handelt es sich? 60.4 14.3 171.1 21.0 Übungsaufgabe 12 Nach mehrstündigem Erhitzen eines Gemisches aus Essigsäureanhydrid, Salicylaldehyd (= 2-Hydroxybenzaldehyd) und Natriumacetat wurde eine in Wasser schlecht lösliche V bi d Verbindung mitit h heuartigem ti G Geruch h erhalten. h lt IIm IR IR-Spektrum S kt war eine i d deutliche tli h Absorptionsbande bei 1729 cm-1 zu sehen. LC-ESI-MS lieferte ein Pseudomolekülion mit p zeigte g Signale g bei δH 6.36 ((1H,, d,, J = 9.6 Hz), ), m/z 147 [[M+H]]+. Das 1H-NMR-Spektrum 7.22 (1H, d, J = 8.4 Hz), 7.23 (1H, t, J = 7.7 und 7.4 Hz), 7.46 (1H, d, J = 7.7 Hz), 7.47 (1H, t, J = 8.4 und 7.4 Hz) und 7.70 ppm (1H, d, J = 9.6 Hz). Im 13C-NMR-Spektrum wurden neun Resonanzen registriert: bei 116.7, 116.8, 118.9 124.4, 128.0, 131.8, 143.5, 154.1 und 160.6 ppm. Um was für eine Verbindung handelt es sich? - 50 -