Text 1 Expertengruppe C: Die Atomhülle - Poenitz-net
Werbung

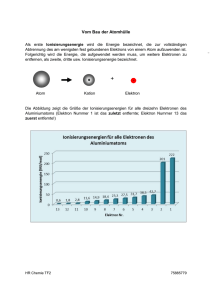
Text 1 Expertengruppe C: Die Atomhülle Aus den Streuversuchen von Ernest Rutherford weiß man, dass die Atome aus einem Kern und einer Hülle bestehen. Der Kern ist extrem klein und positiv geladen. In ihm konzentriert sich nahezu die gesamte Masse des Atoms in Form von Neutronen und den positiv geladenen Protonen. Die Zusammensetzung des Kerns ergab sich aus den Untersuchungen der Radioaktivität, die beim Zerfall großer Atomkerne freigesetzt wird. Die Atomhülle muss die gesamte negative Ladung enthalten, die das Atom zum Ausgleich der positiven Kernladung benötigt. Die Träger dieser negativen Ladungen sind außerdem sehr leicht und lassen sich schon durch bloße Reibung vom Atom lösen. Da dies besonders gut mit Bernstein (und Katzenfell) funktioniert, nennt man diese Teilchen Elektronen nach dem griechischen Namen für Bernstein. Diese Farben angeregter Atome in Flammen oder Gasentladungsröhren (ähnlich den heutigen Leuchtstoffröhren) waren gegen Ende des 19. Jahrhunderts bereits sehr genau untersucht worden. Jedes Atom hat eine typische Flammenfarbe. Mit einem Prisma kann man diese Farben in einzelne Komponenten zerlegen und erhält für jedes Atom ein typisches Spektrum von Einzelfarben ähnlich einem Fingerabdruck. Man hatte sogar eine Formel aufgestellt, mit der sich die Farben bzw. Energiestufen des ausgesandten Lichtes sehr genau vorhersagen ließen. Aber niemand konnte erklären, warum diese Rydberg-Formel funktionierte. Dem jungen dänischen Physiker Niels Bohr gelang diese Erklärung im Jahr 1913 durch die Kombination der Atommodelle von Ernest Rutherford (in dessen Arbeitsgruppe an der Universität Manchester er zuvor einige Zeit gearbeitet hatte) mit der Quantentheorie von Max Planck in Berlin. Im gleichen Jahr gewann er die dänische Fußballmeisterschaft im Tor seines Clubs AB Gladsaxe. Den Nobelpreis erhielt Nils Bohr dann im Jahre 1922. 1. 2. 3. 4. Die Elektronen bewegen sich auf festen Schalen um den Kern. Jede Schale entspricht einer bestimmten Energie. Die Energie der Schalen nimmt nach außen hin zu. Die n-te Schale von innen kann genau 2n2 Elektronen aufnehmen. Für die Kontaktfreudigkeit und Bindungsfähigkeit eines Atoms (kurz: für sein chemische Verhalten) sind die Elektronen in der äußersten Schale entscheidend. Atome mit gleich vielen Außenelektronen verhalten sich chemisch ähnlich und werden im oben teilweise abgebildeten Periodensystem untereinander angeordnet. Am auffälligsten ist diese Verwandschaft bei den Edelgasen ganz rechts. Sie haben eine vollständig besetzte Außenschale, die offenbar besonders stabil ist, denn Sie gehen so gut wie keine Verbindungen mit anderen Atomen ein. Alle anderen Atome versuchen durch Aufnahme oder Abgabe von Elektronen diese besonders stabile Achterschale zu erreichen. Mit dieser Edelgas- oder Oktettregel lassen sich fast alle chemischen Reaktionen erklären. Für größere Atome musste das Bohr-Modell bald um zusätzliche Energiestufen erweitert werden und die Schalen haben sich sich eher als wolkige Aufenthaltsbereiche (Orbitale) mit verschiedensten Formen und Größen erwiesen, aber für große Teile der Chemie ist das Bohr-Modell des Atoms nach wie vor eine völlig ausreichende Erklärungsgrundlage. 1 Text 2 Expertengruppe C: Linienspektren Die spektrale Zerlegung und das Wellenmodell des Lichtes Die Zerlegung des Lichtes in seine einzelnen Farben durch ein Prisma oder ein Gitter lässt sich mit dem Wellenmodell erklären: Man beschreibt Licht als elektromagnetische Welle ähnlich wie Radiowellen oder Röntgenstrahlen. Die Energie einer elektromagnetischen Welle nimmt mit sinkender Wellenlänge zu. Aus diesem Grund ist elektromagnetische Strahlung umso gefährlicher, je kürzerwellig die Strahlung ist! Radiowellen < Infrarot (IR) < rot < gelb < grün< blau < violett < Ultraviolett (UV) < Röntgenstrahlen < - Strahlen langwellig energiearm kurzwellig energiereich Die Linienspektren der Elemente Durchführung: Der Dampf reiner Elemente wird in einem Glaskolben erhitzt. Das dabei entstehende Licht wird durch ein Prisma in seine einzelnen Farben bzw. Wellenlängen zerlegt und auf einem dunklen Schirm sichtbar gemacht. Je kürzer die Wellenlänge, desto stärker ist die Ablenkung. Beobachtung: Der Dampf sendet Licht ganz bestimmter Wellenlänge (bzw. Energie bzw. Farbe) aus, wenn man ihm genügend Energie in Form von Hitze zuführt. Die spektrale Zerlegung des ausgesendeten Lichtes durch das Prisma ergibt ein für jedes Element charakteristisches Linienspektrum. Das einfachste Linienspektrum erhält man vom Wasserstoff. Erklärung: Durch Energiezufuhr (Funken oder Hitze) wird ein Elektron auf eine höher liegende Schale angehoben. Beim Zurückfallen sendet es Licht aus, dessen Energie (bzw. Farbe bzw. Wellenlänge) gerade der Energiedifferenz der beiden Schalen entspricht. Da die Elektronen auch mehrere Schalen überspringen können, gibt es verschiedene Übergangsmöglichkeiten, die jeweils einer Linie im Spektrum entsprechen. Zufuhr von Energie in Form von Wärme Linienspektrum Energie (Farbe) Abgabe von Energie in Form von Licht Energie n = ∞ (Kontinuumsgrenze) n = 4 (N-Schale) n = 3 (M-Schale) n = 2 (L-Schale) n = 1 (K-Schale) K-Schale L-Schale K-Schale L-Schale Kern 2 Text 3 Expertengruppe C: Ionisierungsenergien Ionisierungsenergien Energie Die Ionisierungsenergie ist die Energie, die notwendig ist, um ein Elektron von der äußersten Schale aus ganz aus der Atomhülle zu entfernen. Die Ionisierungsenergie ist also gerade der energetische Abstand der äußersten besetzten Schale zur Kontinuumsgrenze, z.B. beim Na: Ionisierungsenergie n = ∞ (Kontinuumsgrenze) n = 4 (N-Schale) n = 3 (M-Schale) n = 2 (L-Schale) n = 1 (K-Schale) Kern Verlauf der Ionisierungsenergie und Grenzen des Bohrschen Modells Ionisierungsenergien in kJ/mol Erklärung mit dem Schalenmodell Anstieg H-He: wachsende Kernladung, höhere Anziehung Abfall He-Li: neue Schale, die weiter vom Kern entfernt ist; Abschirmung der Kernladung durch die darunter liegende K-Schale Anstieg Li-Ne: wachsende Kernladung Abfall Ne-Na: neue Schale Anstieg Na-Ar: wachsende Kernladung Abfall Ar-K: neue Schale ?! 3 Arbeitsblatt Expertengruppe C: Der Aufbau der Atomhülle Aufgabe 1 Reibe den aufgeblasenen Luftballon mit einem Wolllappen oder einem trockenen Kleidungsstück ab und bringe ihn in die Nähe von kleinen Papierschnipseln, Styroporteilchen oder auch deinen Haaren, sofern sie lang, dünn und trocken sind. Durch die Reibung werden negativ geladene Elektronen von dem Stoff abgerissen und auf den Ballon übertragen. Der negativ geladene Ballon drängt die Elektronen im Papierschnipsel von sich weg und zieht die näher liegenden positiv geladenen Atomkerne an sich. Die Anziehung der näher liegenden positiven Atomkerne ist stärker als die Abstoßung der weiter entfernten Elektronen: Der Papierschnipsel wird daher angezogen. In welchem Bereich eines Atoms vermutest du die Elektronen, wenn sie sich so leicht verschieben und entfernen lassen? Eher innen oder eher außen? ___________________________________________________________________________________________________ Aufgabe 2 Lies den Text 1 zur Atomhülle und beantworte die folgenden Fragen: a) Aus welchen Teilchen besteht die Atomhülle und wie sind diese Teilchen angeordnet? ___________________________________________________________________________________________________ ___________________________________________________________________________________________________ ____________________________________________________________________________________________________ b) Skizziere den Aufbau der Hülle eines Kaliumatoms mit 19 Elektronen in das rechts stehende Kästchen: c) Was besagt die Oktettregel? ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ Aufgabe 3 a) Zeichne jeweils ein Schalenmodell der folgenden Atome: Neon (10 Elektronen) Silicium (14 Elektronen) Bor (5 Elektronen) b) Vervollständige die Tabelle auf der Rückseite: 4 Name Wasserstoff Natrium Sauerstoff Schwefel Stickstoff Argon Calcium Gesamtzahl der Elektronen 1 11 8 16 Elektronen im 1. Niveau Elektronen im 2. Niveau Elektronen im 3. Niveau Elektronen im 4. Niveau 5 0 8 0 0 2 Aufgabe 4 a) Lies den Text 2 zu den Linienspektren und färbe die sichtbaren Bereiche des Spektrums auf S. 2 in der ersten Abbildung in den angegebenen Farben. b) Färbe nun auch die einzelnen Strahlen hinter dem Prisma in der zweiten Abbildung auf S. 2 passend ein. Beachte: Je kürzer die Wellenlänge, desto stärker die Ablenkung. c) Färbe die vier Übergänge auf der Abbildung rechts unten auf S. 2 in den Farben gelb, rot, grün und blau in der passenden Reihenfolge. d) Zeichne in das nebenstehende Schema die Elektronenkonfiguration für das Element Lithium 3Li und drei beliebige Übergänge ein. Nehmen wir an, dass diese Übergänge die Farben Rot, Orange und Gelb erzeugen. Ordne diese Farben deinen Übergängen zu und färbe sie entsprechend ein. Energie (Farbe) Energie n = ∞ (Kontinuumsgrenze) n = 4 (N-Schale) n = 3 (M-Schale) n = 2 (L-Schale) n = 1 (K-Schale) Kern Aufgabe 5 Lies den Text 3 zu den Ionisierungsenergien und beantworte die folgenden Fragen: a) Was versteht man unter der Ionisierungsenergie? ______________________________________________________________________________________________________ b) Warum hat Helium 2He eine viel größere Ionisierungsenergie als Wassersoff 1H? ______________________________________________________________________________________________________ c) Warum fällt die Ionisierungsenergie von 2He zu Lithium 3Li stark ab? ____________________________________________________________________________________________________ d) Warum nimmt die Ionisierungsenergie von 3Li zu Neon 10Ne wieder allmählich zu? ____________________________________________________________________________________________________ e) Warum fällt die Ionisierungsenergie von 10Ne zu Natrium 11Na plötzlich ab? ____________________________________________________________________________________________________ f) Warum nimmt die Ionisierungsenergie von 10Na zu Neon 18Ar wieder langsam zu? ____________________________________________________________________________________________________ g) Warum fällt die Ionisierungsenergie von 18Ar zu Kalium 19K plötzlich ab? ____________________________________________________________________________________________________ h) Wie könnte man sich die kleinen Sprünge z.B. von Beryllium 4Be nach Bor 5B erklären? ____________________________________________________________________________________________________ 5 Lösungen zum Arbeitsblatt Expertengruppe C: Der Aufbau der Atomhülle Aufgabe 1 Reibe den aufgeblasenen Luftballon mit einem Wolllappen oder einem trockenen Kleidungsstück ab und bringe ihn in die Nähe von kleinen Papierschnipseln, Styroporteilchen oder auch deinen Haaren, sofern sie lang, dünn und trocken sind. Durch die Reibung werden negativ geladene Elektronen von dem Stoff abgerissen und auf den Ballon übertragen. Der negativ geladene Ballon drängt die Elektronen im Papierschnipsel von sich weg und zieht die näher liegenden positiv geladenen Atomkerne an sich. Die Anziehung der näher liegenden positiven Atomkerne ist stärker als die Abstoßung der weiter entfernten Elektronen: Der Papierschnipsel wird daher angezogen. In welchem Bereich eines Atoms vermutest du die Elektronen, wenn sie sich so leicht verschieben und entfernen lassen? Eher innen oder eher außen? Eher außen Aufgabe 2 Lies den Text 1 zur Atomhülle und beantworte die folgenden Fragen: a) Aus welchen Teilchen besteht die Atomhülle und wie sind diese Teilchen angeordnet? Die Atomhülle besteht aus Elektronen, die auf Stufen (oder Schalen) mit von innen nach außen wachsender Energie und immer kleinerem Abstand angeordnet sind. Die n-te Stufe von innen kann 2n2 Elektronen aufnehmen. b) Skizziere den Aufbau der Hülle eines Kaliumatoms mit 19 Elektronen in das rechts stehende Kästchen: c) Was besagt die Oktettregel? Die Edelgase mit einer achtfach bzw. bei Helium zweifach besetzten Außenschale sind besonders stabil und gehen kaum Verbindungen mit anderen Atomen ein. Die anderen Atome versuchen durch Aufnahme oder Abgabe ebenfalls diese Edelgaskonfiguration zu erreichen. K L M Aufgabe 3 a) Zeichne jeweils ein Schalenmodell der folgenden Atome: Neon (10 Elektronen) Silicium (14 Elektronen) K K K L Bor (5 Elektronen) L M L b) Vervollständige die Tabelle: 6 Name Wasserstoff Natrium Sauerstoff Schwefel Stickstoff Argon Calcium Gesamtzahl der Elektronen 1 11 8 16 14 18 20 Elektronen im 1. Niveau 1 2 2 2 2 2 2 Aufgabe 4 a) Lies den Text 2 zu den Linienspektren und färbe die sichtbaren Bereiche des Spektrums auf S. 2 in der ersten Abbildung in den angegebenen Farben. b) Färbe nun auch die einzelnen Strahlen hinter dem Prisma in der zweiten Abbildung auf S. 2 passend ein. Beachte: Je kürzer die Wellenlänge, desto stärker die Ablenkung. c) Färbe die vier Übergänge auf der Abbildung rechts unten auf S. 2 in den Farben gelb, rot, grün und blau in der passenden Reihenfolge. d) Zeichne in das nebenstehende Schema die Elektronenkonfiguration für das Element Lithium 3Li und drei beliebige Übergänge ein. Nehmen wir an, dass diese Übergänge die Farben Rot, Orange und Gelb erzeugen. Ordne diese Farben deinen Übergängen zu und färbe sie entsprechend ein. Elektronen im 2. Niveau 0 8 6 8 8 8 8 Elektronen im 3. Niveau 0 1 0 6 5 8 8 Elektronen im 4. Niveau 0 0 0 0 0 0 2 Rot Orange Gelb Energie (Farbe) Energie n = ∞ (Kontinuumsgrenze) n = 4 (N-Schale) n = 3 (M-Schale) n = 2 (L-Schale) n = 1 (K-Schale) Kern Aufgabe 5 Lies den Text 3 zu den Ionisierungsenergien und beantworte die folgenden Fragen: a) Was versteht man unter der Ionisierungsenergie? Die Energie, die erforderlich ist, um das äußerste Elektron ganz aus dem Atom zu entfernen b) Warum hat Helium 2He eine viel größere Ionisierungsenergie als Wassersoff 1H? Wegen der doppelt so großen Ladung bzw. Anziehung des Kerns c) Warum fällt die Ionisierungsenergie von 2He zu Lithium 3Li stark ab? Wegen des Übergangs auf eine größere und weiter vom Kern entfernte Schale d) Warum nimmt die Ionisierungsenergie von 3Li zu Neon 10Ne wieder allmählich zu? Wegen der Zunahme der Kernladung bzw. Anziehung des Kerns bei gleicher Schale e) Warum fällt die Ionisierungsenergie von 10Ne zu Natrium 11Na plötzlich ab? Wegen des Übergangs auf eine größere und weiter vom Kern entfernte Schale f) Warum nimmt die Ionisierungsenergie von 10Na zu Neon 18Ar wieder langsam zu? Wegen der Zunahme der Kernladung bzw. Anziehung des Kerns bei gleicher Schale g) Warum fällt die Ionisierungsenergie von 18Ar zu Kalium 19K plötzlich ab? Offenbar sitzt das 19. Elektron auf einer neuen Schale, obwohl die M-Schale noch nicht voll ist! h) Wie könnte man sich die kleinen Sprünge z.B. von Beryllium 4Be nach Bor 5B erklären? Offenbar gibt es innerhalb der Schalen weitere Unterstufen 7








![Kugelwolkenmodell (KWM) der Atomhülle [c/ A. Schill]](http://s1.studylibde.com/store/data/006026842_2-f7ef645afd4f19b760ad28335b8d24ad-300x300.png)

