24 Der anfällige Wirt 2 Parodontale Mikrobiologie
Werbung
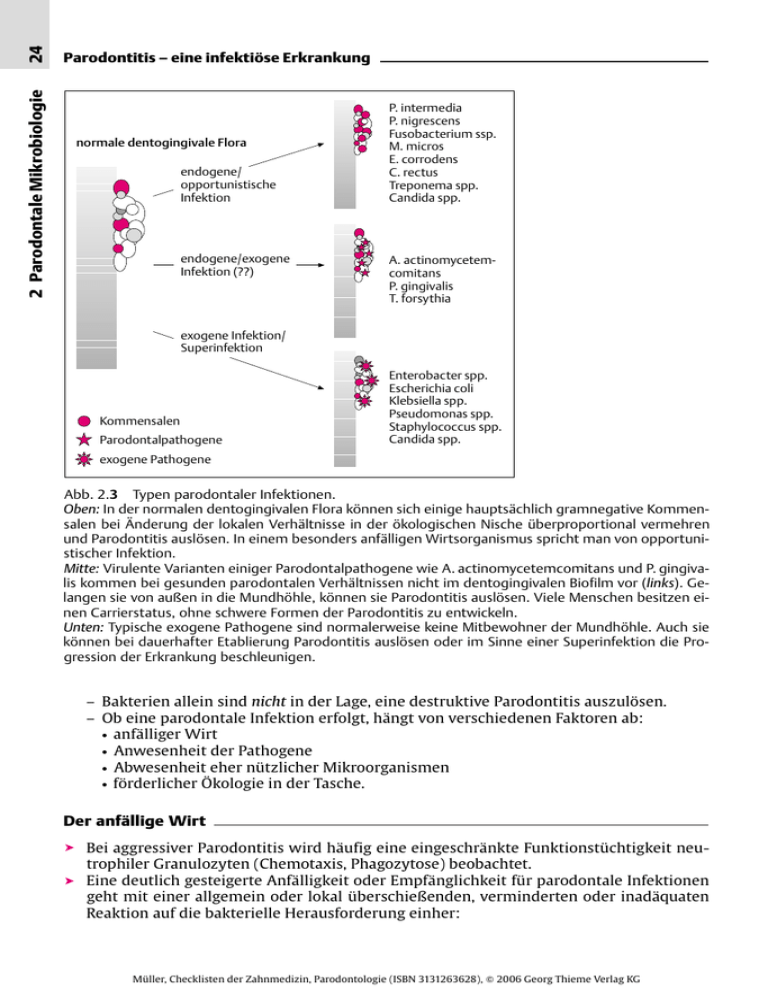
24 2 Parodontale Mikrobiologie Parodontitis – eine infektiöse Erkrankung normale dentogingivale Flora endogene/ opportunistische Infektion endogene/exogene Infektion (??) P. intermedia P. nigrescens Fusobacterium ssp. M. micros E. corrodens C. rectus Treponema spp. Candida spp. A. actinomycetemcomitans P. gingivalis T. forsythia exogene Infektion/ Superinfektion Kommensalen Parodontalpathogene Enterobacter spp. Escherichia coli Klebsiella spp. Pseudomonas spp. Staphylococcus spp. Candida spp. exogene Pathogene Abb. 2.3 Typen parodontaler Infektionen. Oben: In der normalen dentogingivalen Flora können sich einige hauptsächlich gramnegative Kommensalen bei Änderung der lokalen Verhältnisse in der ökologischen Nische überproportional vermehren und Parodontitis auslösen. In einem besonders anfälligen Wirtsorganismus spricht man von opportunistischer Infektion. Mitte: Virulente Varianten einiger Parodontalpathogene wie A. actinomycetemcomitans und P. gingivalis kommen bei gesunden parodontalen Verhältnissen nicht im dentogingivalen Biofilm vor (links). Gelangen sie von außen in die Mundhöhle, können sie Parodontitis auslösen. Viele Menschen besitzen einen Carrierstatus, ohne schwere Formen der Parodontitis zu entwickeln. Unten: Typische exogene Pathogene sind normalerweise keine Mitbewohner der Mundhöhle. Auch sie können bei dauerhafter Etablierung Parodontitis auslösen oder im Sinne einer Superinfektion die Progression der Erkrankung beschleunigen. – Bakterien allein sind nicht in der Lage, eine destruktive Parodontitis auszulösen. – Ob eine parodontale Infektion erfolgt, hängt von verschiedenen Faktoren ab: 앫 anfälliger Wirt 앫 Anwesenheit der Pathogene 앫 Abwesenheit eher nützlicher Mikroorganismen 앫 förderlicher Ökologie in der Tasche. Der anfällige Wirt ➤ Bei aggressiver Parodontitis wird häufig eine eingeschränkte Funktionstüchtigkeit neu- trophiler Granulozyten (Chemotaxis, Phagozytose) beobachtet. ➤ Eine deutlich gesteigerte Anfälligkeit oder Empfänglichkeit für parodontale Infektionen geht mit einer allgemein oder lokal überschießenden, verminderten oder inadäquaten Reaktion auf die bakterielle Herausforderung einher: Müller, Checklisten der Zahnmedizin, Parodontologie (ISBN 3131263628), 䊚 2006 Georg Thieme Verlag KG ➤ ➤ ➤ ➤ – Überschießende Freisetzung von Prostaglandin E2 und Interleukin-1β von Monozyten als Reaktion auf Lipopolysaccharide der Zellwand einiger gramnegativer Bakterien. – Systemische Komponente könnte Ausdruck für einen allgemein zugrunde liegenden Mechanismus sein, der beim betroffenen Individuum ein erhöhtes Risiko für chronische Entzündungen bedingt (hyperreaktiver Makrophagenphänotyp). – In diesem Zusammenhang stehen beobachtete Assoziationen zwischen schweren Formen der Parodontitis und systemischen Erkrankungen oder Zuständen wie: 앫 koronare Herzerkrankung, Koronarinfarkt 앫 ischämischer Apoplex 앫 geringes Geburtsgewicht. Allgemeinerkrankungen wie ein insuffizient eingestellter Diabetes mellitus (Typ I oder Typ II) sowie AIDS erhöhen das Risiko für eine Parodontitis. Hormonelle Auswirkungen von psychischem Stress: – Erhöhte Anfälligkeit für bestimmte entzündliche Parodontalerkrankungen wie die nekrotisierende ulzerative Gingivitis/Parodontitis. – Stress und die mehr oder weniger vorhandenen Möglichkeiten der Stressbewältigung sind ebenfalls mit Parodontitis assoziiert. Genetische Faktoren (siehe unten). Tabakkonsum (siehe unten). Anwesenheit der Pathogene ➤ Auf Pathogene wie A. actinomycetemcomitans, P. gingivalis und T. forsythia reagiert der ➤ ➤ ➤ ➤ infizierte Wirtsorganismus häufig mit der Produktion spezifischer Antikörper: – Als Reaktion auf Antigene gramnegativer Bakterien des subgingivalen Biofilms werden vor allem spezifische Antikörper der Subklasse IgG2 produziert. – Bei lokalisierter aggressiver Parodontitis wurden ähnlich hohe Antikörpertiter gegen A. actinomycetemcomitans beobachtet wie gegen Treponema pallidum bei tertiärer Lues: 0,1 – 1 µg/ml. Protektive Antikörper schützen vor der Entwicklung einer generalisierten Form. Um pathogen zu werden, muss ein Bakterium Virulenzfaktoren aufweisen (Tabelle 2.3): – Adhäsion an den Geweben des Wirtsorganismus – Wachstum und Vermehrung innerhalb der ökologischen Nische – Umgehung der wirtseigenen Abwehrmechanismen – aktive Destruktion des besiedelten Gewebes. Die Expression von Virulenzfaktoren bei ein und derselben Spezies unterliegt starken Schwankungen: – Sie ist z. T. genetisch bedingt. – Oder sie hängt von Wachstumsbedingungen ab. Eine besonders toxische Variante von A. actinomycetemcomitans, die Leukotoxin in größerer Menge freisetzt, wurde bislang nur bei Menschen afrikanischer Herkunft (Afrikanern, Afroamerikanern, Afroindianern) isoliert: – Orale Infektionen mit diesem Klon erhöhen das Risiko einer aggressiven Parodontitis beträchtlich (Abb. 2.4) – Toxische Klone von A. actinomycetemcomitans wurden bei Menschen nordeuropäischer und asiatischer Herkunft bisher nicht beobachtet. Die destruktiven Effekte der verschiedenen Virulenzfaktoren unterschiedlicher Pathogene innerhalb einer parodontalen Tasche addieren sich: – Leukotoxin und Zytotoxin von A. actinomycetemcomitans – Kollagenase – Endotoxin (Lipopolysaccharide) Müller, Checklisten der Zahnmedizin, Parodontologie (ISBN 3131263628), 䊚 2006 Georg Thieme Verlag KG 25 2 Parodontale Mikrobiologie Parodontitis – eine infektiöse Erkrankung 26 2 Parodontale Mikrobiologie Parodontitis – eine infektiöse Erkrankung Tabelle 2.3 Virulenzfaktoren der Parodontalpathogene A. actinomycetemcomitans, P. gingivalis und T. forsythia Bakterienspezies Adhäsion/ Kolonisation A. actinomycetemcomitans 앫 앫 Kapselantigen, Pili, Vesikel Antagonismus zu S. sanguinis u. A. naeslundii 2 Umgehung/Störung der Wirtsabwehr 앫 앫 앫 앫 앫 앫 P. gingivalis 앫 앫 Kapselantigen, Pili, Vesikel Synergismus zu T. forsythia, T. denticola 앫 앫 앫 앫 앫 T. forsythia 앫 Synergismus zu P. gingivalis, T. denticola 앫 Gewebedestruktion Leukotoxin Chemotaxishemmung Fc-bindendes Protein Suppression von Lymphozytenfunktionen Invasion von Epithelzellen in vivo spaltet Immunglobuline 앫 Chemotaxishemmung spaltet Komplement und Immunglobuline Invasion von Epithelzellen in vitro triggert nicht die Expression von E-Selectin auf der Endotheloberfläche hemmt Produktion und Expression von IL-8 und ICAM-1 im Saumepithel 앫 Invasion von Epithelzellen in vivo 앫 앫 앫 앫 앫 앫 앫 앫 앫 앫 앫 앫 앫 앫 앫 Endotoxin Epithelotoxin Kollagenase hemmt Fibroblastenfunktionen induziert Apoptose alkalische u. saure Phosphatasen Endotoxin Kollagenase trypsinartige Aktivität Fibrinolysin Gingipain Phospholipase A alkalische u. saure Phosphatasen Endotoxin trypsinartige Aktivität Produktion von Fettsäuren induziert Apoptose – Faktoren, die das Wachstum und die Proliferation von Fibroblasten hemmen oder Osteoklasten aktivieren – trypsinartige Peptidasen von P. gingivalis, T. forsythia und T. denticola – Fibrinolysin und andere proteolytische Enzyme – saure und alkalische Phosphatasen – toxische Substanzen wie Schwefelwasserstoff, Ammoniak oder Fettsäuren. Abwesenheit nützlicher Mikroorganismen ➤ Bakterien und ihre Metaboliten und Produkte sind generell notwendig und nützlich für die Gesunderhaltung des Parodonts. ➤ Grampositive Bakterien haben sich im Laufe der Evolution besser an die Verhältnisse in- nerhalb der menschlichen Mundhöhle adaptiert und können u. U. bestimmte weniger robuste parodontalpathogene Mikroorganismen in Schach halten (Abb. 2.5). – Antagonistische Mikroorganismen beeinflussen die Möglichkeiten pathogener Bakterien, sich im Bereich der parodontalen Tasche zu etablieren. – Die Identifizierung dieser (nützlichen) Bakterien basiert auf: 앫 dem regelmäßigen Nachweis bei gesunden parodontalen Verhältnissen und nach erfolgreicher Therapie der Parodontitis 앫 ihrem Vorkommen während inaktiver Phasen der Parodontitis. Müller, Checklisten der Zahnmedizin, Parodontologie (ISBN 3131263628), 䊚 2006 Georg Thieme Verlag KG 8,0 kb 4,3 kb 1,3 kb P 3,8 kb P1 P2 glyA ltxC P ltxA ltxB ltxD T2 T1 530 b fehlen bei JP2 Abb. 2.4 Genkarte des Leukotoxingens von A. actinomycetemcomitans. Das membrangebundene Leukotoxin gehört zusammen mit dem Hämolysin von Escherichia coli und dem Leukozidin von Pasteurella haemolytica in die Familie der RTX-Toxine, die Poren in der Zellmembran neutrophiler Granulozyten und Monozyten bilden. Das Operon besteht aus 4 Genen: – ltxC ist für die Aktivierung des primären Produkts von ltxA verantwortlich. – ltxA kodiert das Toxin, – ltxB und ltxC kodieren Proteine für den intrazellulären Transport. Im Vergleich zu nichttoxischen Stämmen fehlen beim hoch toxischen Stamm JP2 530 Basenpaare (0,53 kb) in der Promotorregion des Leukotoxingens. Derartige Stämme produzieren 10- bis 20fach höhere Konzentrationen von Leukotoxin als schwach toxische Stämme. Bei intraoraler Infektion mit diesem Stamm ist das Risiko, aggressive Parodontitis zu entwickeln, stark erhöht (nach Lally et al. 1996). A. actinomycetemcomitans A. actinomycetemcomitans T. denticola A. actinomycetemC. rectus comitans E. corrodens P. gingivalis SchmelzZementGrenze S. mitis S. sanguinis C. sputigena Actinomyces spp. Abb. 2.5 Einfluss parodontal nützlicher Bakterien (z. B. Streptococcus mitis, S. sanguinis II, Capnocytophaga sputigena oder Aktinomyzeten) an der Schmelz-Zement-Grenze (SZG) auf die Etablierung von Parodontalpathogenen (z. B. Porphyromonas gingivalis, Actinobacillus actinomycetemcomitans, Eikenella corrodens, Campylobacter rectus, Treponema denticola). A. actinomycetemcomitans kann z. B. nicht wachsen, wenn S. sanguinis II bereits vorhanden ist (Antagonismus). Hat allerdings C. sputigena bereits Kolonien gebildet, können sich A. actinomycetemcomitans, C. rectus und E. corrodens etablieren (Synergismus). T. denticola hat keine Chance bei Anwesenheit von A. actinomycetemcomitans (adaptiert nach Socransky et al. 1988). Müller, Checklisten der Zahnmedizin, Parodontologie (ISBN 3131263628), 䊚 2006 Georg Thieme Verlag KG 27 2 Parodontale Mikrobiologie Parodontitis – eine infektiöse Erkrankung