Salz: AmBn (fest) mA > mAn+
Werbung
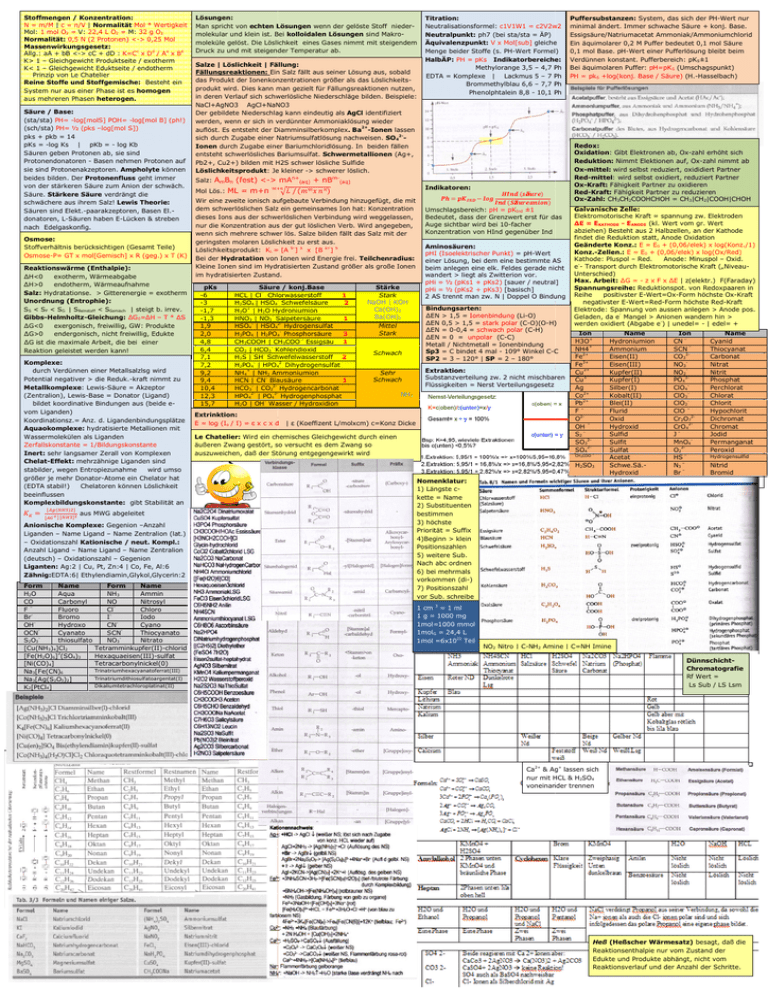
Stoffmengen / Konzentration: N = m/M | c = n/V | Normalität Mol * Wertigkeit Mol: 1 mol O2 = V: 22,4 L O2 = M: 32 g O2 Normalität: 0,5 N (2 Protonen) <-> 0,25 Mol Massenwirkungsgesetz: Allg.: aA + bB <-> cC + dD : K=Cc x Dd / Aa x Bb K> 1 – Gleichgewicht Produktseite / exotherm K< 1 – Gleichgewicht Eduktseite / endotherm Prinzip von Le Chatelier Reine Stoffe und Stoffgemische: Besteht ein System nur aus einer Phase ist es homogen aus mehreren Phasen heterogen. Säure / Base: (sta/sta) PH= -log[molS] POH= -log[mol B] (ph!) (sch/sta) PH= ½ (pks –log[mol S]) pks + pkb = 14 pKs = -log Ks | pKb = - log Kb Säuren geben Protonen ab, sie sind Protonendonatoren - Basen nehmen Protonen auf sie sind Protonenakzeptoren. Ampholyte können beides bilden. Der Protonenfluss geht immer von der stärkeren Säure zum Anion der schwäch. Säure. Stärkere Säure verdrängt die schwächere aus ihrem Salz! Lewis Theorie: Säuren sind Elekt.-paarakzeptoren, Basen El.donatoren, L-Säuren haben E-Lücken & streben nach Edelgaskonfig. Osmose: Stoffverhältnis berücksichtigen (Gesamt Teile) Osmose-P= GT x mol[Gemisch] x R (geg.) x T (K) Reaktionswärme (Enthalpie): ∆H<0 exotherm, Wärmeabgabe ∆H>0 endotherm, Wärmeaufnahme Salz: Hydratationse. > Gitterenergie = exotherm Unordnung (Entrophie): SS < SF < SG | SReinstoff < SGemisch | steigt b. irrev. Gibbs-Helmholtz-Gleichung: ∆G0=∆H – T * ∆S ∆G<0 exergonisch, freiwillig, GW: Produkte ∆G>0 endergonisch, nicht freiwillig, Edukte ∆G ist die maximale Arbeit, die bei einer Reaktion geleistet werden kann! Komplexe: durch Verdünnen einer Metallsalzlsg wird Potential negativer > die Reduk.-kraft nimmt zu Metallkomplexe: Lewis-Säure = Akzeptor (Zentralion), Lewis-Base = Donator (Ligand) bildet koordinative Bindungen aus (beide evom Liganden) Koordinationsz.= Anz. d. Ligandenbindungsplätze Aquaokomplexe: hydratisierte Metallionen mit Wassermolekülen als Liganden Zerfallskonstante = 1/Bildungskonstante Inert: sehr langsamer Zerall von Komplexen Chelat-Effekt: mehrzähnige Liganden sind stabilder, wegen Entropiezunahme wird umso größer je mehr Donator-Atome ein Chelator hat (EDTA stabil!) Chelatoren können Löslichkeit beeinflussen Komplexbildungskonstante: gibt Stabilität an aus MWG abgeleitet Anionische Komplexe: Gegenion –Anzahl Liganden – Name Ligand – Name Zentralion (lat.) – Oxidationszahl Kationische / neut. Kompl.: Anzahl Ligand – Name Ligand – Name Zentralion (deutsch) – Oxidationszahl – Gegenion Liganten: Ag:2 | Cu, Pt, Zn:4 | Co, Fe, Al:6 Zähnig:EDTA:6| Ethylendiamin,Glykol,Glycerin:2 Form Name Form Name H 2O Aqua NH3 Ammin CO Carbonyl NO Nitrosyl F– Fluoro ClChloro Br Bromo I Iodo OHHydroxo CNCyano OCN Cyanato SCN Thiocyanato S2O3 thiosulfato NO3 Nitrato [Cu(NH3)4]Cl2 Tetramminkupfer(II)-chlorid 2 [Fe(H2O)6] (SO4)3 Hexaquaeisen(III)-sulfat [Ni(CO)4] Tetracarbonylnickel(0) Trinatriumhexacyanatoferrat(III) Na3[Fe(CN)6 Trinatriumdithiosulfatoargentat(I) Na3[Ag(S2O3)2] Dikaliumtetrachloroplatinat(II) K2[PtCl4] Lösungen: Man spricht von echten Lösungen wenn der gelöste Stoff niedermolekular und klein ist. Bei kolloidalen Lösungen sind Makromoleküle gelöst. Die Löslichkeit eines Gases nimmt mit steigendem Druck zu und mit steigender Temperatur ab. Salze | Löslichkeit | Fällung: Fällung Fällungsreaktionen: Ein Salz fällt aus seiner Lösung aus, sobald das Produkt der Ionenkonzentrationen größer als das Löslichkeitsprodukt wird. Dies kann man gezielt für Fällungsreaktionen nutzen, in deren Verlauf sich schwerlösliche Niederschläge bilden. Beispiele: NaCl+AgNO3 AgCl+NaNO3 Der gebildete Niederschlag kann eindeutig als AgCl identifiziert werden, wenn er sich in verdünnter Ammoniaklösung wieder auflöst. Es entsteht der Diamminsilberkomplex. Diamminsilberkomplex Ba2+-Ionen lassen sich durch Zugabe einer Natriumsulfatlösung Natriumsulfatlösu nachweisen. SO42-Ionen durch urch Zugabe einer Bariumchloridlösung. In beiden fällen entsteht schwerlösliches Bariumsulfat. Schwermetallionen (Ag+, Pb2+, Cu2+) bilden mit H2S schwer lösliche lös Sulfide Löslichkeitsprodukt:: Je kleiner -> schwerer löslich. Titration: Neutralisationsformel: c1V1W1 = c2V2w2 Neutralpunkt: ph7 (bei sta/sta = ÄP) Äquivalenzpunkt: V x Mol[sub] gleiche Menge beider Stoffe (s. PH-Wert Wert Formel) HalbÄP: PH = pKs Indikatorbereiche: Methylorange 3,5 – 4,7 Ph EDTA = Komplexe | Lackmus 5 – 7 Ph Brommethylblau 6,6 – 7,7 Ph Phenolphtalein 8,8 - 10,1 Ph Salz: AmBn (fest) <-> > mAn+(aq) + nBm-(aq) Mol Lös.: ML = m+n Indikatoren: 0 () / +, - ./ Wir eine zweite ionisch aufgebaute Verbindung hinzugefügt, die mit dem schwerlöslichen Salz ein gemeinsames Ion hat: Konzentration dieses Ions aus der schwerlöslichen Verbindung wird weggelassen, nur die Konzentration aus der gut löslichen Verb. Wird angegeben, wenn sich mehrere schwer lös. Salze bilden bild fällt das Salz mit der geringsten molaren Löslichkeit zu erst aus. Löslichkeitsprodukt: KL = [A b-] a x [B a+] b Bei der Hydratation von Ionen wird Energie frei. Teilchenradius: Kleine Ionen sind im Hydratisierten Zustand größer als große Ionen im hydratisierten Zustand. pKs -6 -3 -1,7 -1,3 1,9 2,0 4,8 6,4 7,1 7,2 9,2 9,4 10,4 12,3 15,7 Säure / konj.Base HCL | Cl- Chlorwasserstoff 1 H2SO4 | HSO4- Schwefelsäure 2 H3O+ | H2O Hydroniumion HNO3 | NO3- Salpetersäure 1 2 HSO4- | HSO42Hydrogensulfat H3PO4 | H2PO4- Phosphorsäure 3 CH3COOH | CH3COO – Essigsäu 1 CO2 | HCO3- Kohlendioxid H2S | SH- Schwefelwasserstoff 2 H2PO4- | HPO42 Dihydrogensulfat NH4+ | NH3 Ammoniumion HCN | CN- Blausäure 1 HCO3- | CO32- Hydrogencarbonat HPO42- | PO43-- Hydrogenphosphat H2O | OH- Wasser / Hydroxidion Extrinktion: E = log (Io / I) = ε x c x d Stärke Stark NaOH | KOH Ca(OH)2 Ba(OH)2 Mittel Stark Schwach Sehr Schwach !ä"#$ %ä"#$&' Umschlagsbereich: pH = pKInd ±1 Bedeutet, dass der Grenzwert erst für das Auge sichtbar wird bei 10-facher Konzentration von HInd gegenüber Ind Aminosäuren: pHI (Isoelektrischer Punkt) = pH-Wert einer Lösung, bei dem eine bestimmte AS beim anlegen eine elk. Feldes gerade nicht wandert > liegt als Zwitterion vor. pHi = ½ (pKs1 + pKs2) [sauer / neutral] pHi = ½ (pKs2 + pKs3) [basisch] 2 AS trennt man zw. N | Doppel O Bindung Bindungsarten: ∆EN > 1,5 = Ionenbindung (Li-O) ∆EN 0,5 > 1,5 = stark polar (C-O)(O-H) H) ∆EN = 0-0,4 = schwach polar (C-H) ∆EN = 0 = unpolar (C-C) Metall / Nichtmetall = Ionenbindung Sp3 = C bindet 4 mal - 109° Winkel C-C C SP2 = 3 – 120° | SP = 2 – 180° Extraktion: Substanzverteilung zw. 2 nicht mischbaren Flüssigkeiten = Nerst Verteilungsgesetz NH3 | ε (Koeffizent L/molxcm) c=Konz Dicke Le Chatelier: Wird ein chemisches Gleichgewicht durch einen äußeren Zwang gestört, so versucht es dem Zwang so auszuweichen, daß der Störung entgegengewirkt wird Puffersubstanzen: System, das sich der PH-Wert nur minimal ändert. Immer schwache Säure + konj. Base. Essigsäure/Natriumacetat Ammoniak/Ammoniumchlorid Ein äquimolarer 0,2 M Puffer bedeutet 0,1 mol Säure 0,1 mol Base. pH-Wert einer Pufferlösung bleibt beim Verdünnen konstant. Pufferbereich: pKS±1 Bei äquimolaren Puffer: pH=pKS (Umschagspunkt) PH = pkS +log(konj. Base / Säure) (H.-Hasselbach) Redox: Oxidation: Gibt Elektronen ab, Ox-zahl erhöht sich Reduktion: Nimmt Elektionen auf, Ox-zahl nimmt ab Ox-mittel: wird selbst reduziert, oxididiert Partner Red-mittel: wird selbst oxidiert, reduziert Partner Ox-Kraft: Fähigkeit Partner zu oxidieren Red-Kraft: Fähigkeit Partner zu reduzieren Ox-Zahl: CH3CH2COOHCHOH = CH3|CH2|COOH|CHOH Galvanische Zelle: Elektromotorische Kraft = spannung zw. Elektroden ∆E = EKATHODE - EANODE (kl. Wert vom gr. Wert abziehen) Besteht aus 2 Halbzellen, an der Kathode findet die Reduktion statt, Anode Oxidation Geänderte Konz.: E = E0 + (0,06/elek) x log(Konz./1) Konz.-Zellen.: E = E0 + (0,06/elek) x log(Ox/Red) Kathode: Pluspol – Red. Anode: Minuspol – Oxid. e-- Transport durch Elektromotorische Kraft („NiveauUnterschied) Max. Arbeit: ∆G = - z x F x ∆E | z(elektr.) F(Faraday) Spannungsreihe: Reduktionspot. von Redoxpaaren in Reihe positivster E-Wert=Ox-Form höchste Ox-Kraft negativster E-Wert=Red-Form höchste Red-Kraft Elektrode: Spannung von aussen anlegen > Anode pos. Geladen, da e Mangel > Anionen wandern hin > werden oxidiert (Abgabe e-) | unedel= - | edel= + Ion H3O+ NH4+ Fe2+ Fe3+ Cu2+ Cu+ Ag Co2+ 2+ Pb – F 2O – OH S2 2SO3 SO42CH3COO – H2SO3 Name Hydroniumion Ammonium Eisen(II) Eisen(III) Kupfer(II) Kupfer(I) Silber(I) Kobalt(II) Blei(II) Flurid Oxid Hydroxid Sulfid Sulfit Sulfat Acetat Schwe.Sä.Hydroxid Ion CN – SCN – CO32NO3NO2PO43ClO4ClO3ClO2 – ClO 2Cr2O7 2CrO4 – J MnO4O22HS – N3 – Br – Name Cyanid Thiocyanat Carbonat Nitrat Nitrit Phosphat Perchlorat Chlorat Chlorit Hypochlorit Dichromat Chromat Jodid Permanganat Peroxid Hydrogensulfid Nitrid Bromid Nomenklatur: 1) Längste ckette = Name 2) Substituenten bestimmen 3) höchste Priorität = Suffix 4)Beginn > klein Positionszahlen 5) weitere Sub. Nach abc ordnen 6) bei mehrmals vorkommen (di-) 7) Positionszahl vor Sub. schreibe 3 1 cm = 1 ml 1 g = 1000 mg 1mol=1000 mmol 1molG = 24,4 L 1mol =6x1023 Teil NO2 Nitro | C-NH2 Amine | C=NH Imine DünnschichtChromatografie Rf Wert = Ls Sub / LS Lsm Ca2+ & Ag g+ lassen sich nur mit HCL & H2SO4 voneinander trennen Heß (Heßscher Wärmesatz) besagt, daß die Reaktionsenthalpie nur vom Zustand der Edukte und Produkte abhängt, nicht vom Reaktionsverlauf und der Anzahl der Schritte. Radikale Substitution SR: Alkan + Cl2 / Br2 (Licht / Wärme) Stoffaustausch Zucker: 6er- Ring: Pyransystem, 5er-Ring: Furansystem Mono: -nose Poly: Pyranosyl & Furanosid Fischer: letzte OH Gruppe rechts > D | links > L OH rechts > im Ring nach unten | OH links > oben Haworth (Ring): erstes C rechts neben O = C1 neu entstanden OH Gruppe oben > beta | unten > alpha, bei L Zuckern umgekehrt! - letzte C vor O > hier war die OH Gruppe die Ring geschlossen hat > bei Fischer rechts: Rest nach oben, wenn links: Rest nach unten Monosacharide: (keine Fructose) über Fehlins- Probe nachweisbar > positiv, auch bei > Polysacharide: über glykosidische Bindung miteinander verknüpft. Chlor-/Bromalkan Elektrophile Addition AE: Alken (Doppelbindung) + HCL, HBr, HI|H++H2O|Br2 Haldonalkan|Alkohohl|1,2 Dibromalkan Stoff Hinzufügen Eliminierung: Reaktion genau umgekehrt Hexose: 6 O-Atome Pentose: 5 O-Atome Atome Cellulose: Poly(Beta-D-Glucopyranose(1,4)Beta-D-Glucopyranose Cellulose Stärke Poly(Alpha-D-Glucopyranose(1,4)Alpha-D-Glucopyranose Stärke: Elektrophile aromatische Substitution SE: Aromat + Br+ (FeBr3 | Br2) (nur Benzol) Aromat + NO2 + (HNO3 | H2SO4) Aromat + HSO3+ (SO3 | H2SO4) Stoffaustausch (meist gegen H) Bindungsmöglichk. 2Sub: Ortho, Meta, Para M/I Effekt: zB: Beim Phenol (OH Gruppe oben am Benzol Ring) nur O|P möglich, somit größere Ladungsdichte > geringe Aktivierungsenergie > erleichtere Interaktion OH Gruppe bestimmt Platz und max. Bindungsmenge Substituent I M Eff. –O− + + O|P –OH, OR, –NH2, –NR2 − + O|P Alkyl + # O|P –F, –Cl, –Br, –I − + O|P –COOH, –CN, –CONH2, –NO2 − − M –NR3+ − # M X + Essigsäureanhydrid Nucleophile Substitution: SN1: Nur abhänig von konz. Des Substrats Energieprofil mit Plateau & stabile Phase, keine Konfig. Änderung | polar protisch (Wasser/Alkohol) | c:Tertiär & Sekundär | Zwischenstufe/-produkt (C-Ion) SN2: Abhänig von konz. Substrat & Substituent, Instabile Phase, Energieprofil unabhänig von LSG-Mittel Konfig. | polar aprotisch | c:Primär(Methyl) & Sekundär Walden Umkehr bei Chiralen Molekühlen + SN2 R/S: 1) H mit Element tauschen, welches „hinten“ ist 2) Ordnungszahl = Priorität (höchste:1 | H=4) 3) bei 2 gleichen Elementen > Rest betrachten und dazu addieren (Doppelbindung x2) 4) von 1 über 2 nach 3 verbinden (4 egal) 5) linksherum: S | rechtsherum: R 6) Gegenteil = Lösung Chiralität: 4 unterschiedliche Substituenten Enatiomere: Spiegelbild > somit Gegenteil Ursprung Chirare Enatiomere: sind nicht Deckungsgleich Acetat + Essigsäure Esterbildung: immer unter H2O Abspaltung Lacton = cyclischer Ester