Aufgabe 3 Lösung Bedeutung der Schmelzwärme von Eis
Werbung

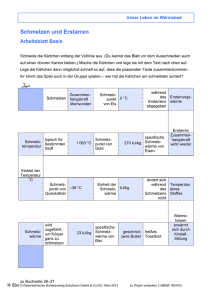
ForscherInnenwerkstatt Physik Graz, 12-2013 Aufgabe 3 Lösung Bedeutung der Schmelzwärme von Eis Diese physikalischen Begriffe benötigt man: Mischtemperatur – spezifische Wärmekapazität – Schmelzwärme - Energieerhaltung 3. Man misst eine Temperatur von ca. 8 -9°C ! Erklärung: Bei diesem Vorgang gibt das kochende Wasser Wärme ab und diese Wärme wird zuerst zum Schmelzen vom Eis (Schnee) verwendet. Erst danach wird das 0°C kalte Wasser bis zur Mischtemperatur erwärmt. Diese niedrige Temperatur ergibt sich deshalb, weil das Eis (Schnee) zum Schmelzen eine sehr große Schmelzwärme benötigt. Für SpezialistInnen: Theoretische Berechnung der Mischungstemperatur von gleichen Mengen Eis (0°C) und kochendem Wasser (100°C): Nach dem Energieerhaltungssatz bleibt die gesamte Wärmeenergie konstant. Das bedeutet, dass vom kochenden Wasser die gleiche Wärmeenergie abgegeben wird wie dem Eis zugeführt wird: Eab = Ezu . Das kochende Wasser gibt diese Energie ab: Eab = c.m.(100 − t m ) , dabei ist c die spezifische Wärmekapazität des Wassers, m ist die Masse und tm ist die Mischtemperatur. Das Eis nimmt zunächst Wärmeenergie zum Schmelzen auf, dabei bleibt die Temperatur bei 0°C . Erst danach wird die restliche Wärmeenergie zum Erwärmen bis zur Mischtemperatur verwendet: E zu = s.m + c.m.(t m − 0) ) , dabei ist s die spezifische Schmelzwärme des Eises. Man setzt die Wärmeenergien gleich c.m.(100 − t m ) = s.m + c.m.(t m − 0) . Da die Massen gleich sind , kürzt man sie heraus c.(100 − t m ) = s + c.(t m − 0) . Danach löst man die Klammern auf und formt die Gleichung um 100.c − s und erhält t m = . 2.c kJ kJ Man setzt die Werte für c = 4,18 sowie für s = 334 ein und kg .K kg findet die theoretische Mischungstemperatur t m ≈ 10°C ! Erklärung: Der größte Teil der abgegebenen Wärmemenge wird zum Schmelzen des Eises verwendet (s hat einen sehr hohen Wert!), der restliche kleine Teil bleibt für die Erwärmung des 0°C kalten Wassers übrig. Bemerkung: Bei unserem Experiment kann die gemessene Temperatur von diesem Wert abweichen und zwar sowohl nach oben als auch nach unten. Denn das Kalorimeter beeinflusst die Messung , weil es je nach seiner Ausgangstemperatur, seiner Masse und seinem Material Wärmeenergie abgibt oder aufnimmt. Bei genauen Experimenten muss dies in der Rechnung berücksichtigt werden. Ein Messergebnis von ca. 8 – 9°C bedeutet, dass das heiße Wasser beim Mischen sich bereits auf einige Grade unter 100°C abgekühlt hat.