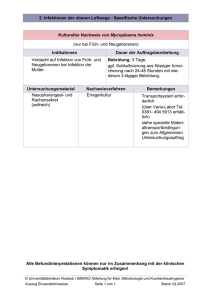
© WVG
Werbung

Berichte & Abstracts Bad-Honnef-Symposium 2010 Infektionen in der Schwangerschaft und neonatale Infektionen 22. bis 23. März 2010, Arbeitnehmer-Zentrum Königswinter Abstracts – Reihenfolge nach Programm Tagungsprogramm: siehe PEG-Mitteilungen, Seite 52 Montag, 22. März Impfen vor und während der Schwangerschaft sowie Konzepte bei unreifen Neugeborenen Markus Knuf, Dr.-Horst-Schmidt-Klinik, Klinik für Kinder und Jugendliche, Ludwig-Erhard-Straße 100, 65199 Wiesbaden, Pädiatrische Infektiologie, Universitätsmedizin Mainz, 55101 Mainz, E-Mail: markus.knuf@hsk-wies­ baden.de Zum Thema „Impfen und Schwanger­ schaft“ gehören die korrekte, zeitge­ rechte Durchführung von Impfungen vor der Schwangerschaft, möglicher­ weise in der Schwangerschaft (strenge Indikationsstellung) sowie die Vakzi­ nation von Angehörigen und Mitarbei­ tern im Gesundheitsdienst. Vor einer Schwangerschaft sollte der Impfpass bei Erstkontakt überprüft werden. Es gilt Impflücken, insbeson­ dere bei Lebendimpfungen mit Rele­ vanz in der Schwangerschaft und für das Neugeborene (Röteln, Windpo­ cken, Masern, Mumps) sowie Totimp­ fungen gegen Erkrankungen, die nach der Entbindung eine Rolle spielen können (z. B. Pertussis) zu schließen. Die ständige Impfkommission (STIKO) stellt bezüglich der Thematik „Imp­ fungen in der Schwangerschaft“ fest: „Nicht dringend indizierte Impfungen sollten während der Schwangerschaft nicht durchgeführt werden. Dies gilt vor allem für Impfungen mit Lebend­ impfstoffen gegen Gelbfieber, Masern, Mumps, Röteln und Varizellen“. Den­ noch kann es notwendig sein während der Schwangerschaft zu impfen. Hierzu gehören eventuell die Auffri­ schung von Routineimpfungen bzw. Indikationsimpfungen (Tetanus, Diph­ therie, Influenza, Pneumokokken), die postexpositionelle Impfung (Tollwut, Tetanus, Hepatitis B, Varizellen, Ma­ sern), gegebenenfalls Reiseimpfungen (Hepatitis A, Hepatitis B, Typhus, Gelbfieber, Japanische Enzephalitis, Tollwut) oder Impfungen bei arbeits­ medizinischer Indikation (Hepatitis B, Influenza, Tollwut). Tabelle 1 gibt die amerikanischen Empfehlungen der CDC zur Verwen­ dung von Totimpfstoffen während der Schwangerschaft wieder. Die Rationale für die Empfehlung der Influenza-Impfung während der Schwangerschaft ist das Fehlen von unerwünschten Nebenwirkungen sowie der schwere Verlauf der Influen­ za in der Schwangerschaft und der po­ tenzielle, postnatale Schutz durch die Impfung für das Kind. Folgende Totimpfstoffe können nach sorgfältiger Abwägung eventuell wäh­ rend der Schwangerschaft gegeben werden: Hepatitis A: Die Sicherheit in der Schwangerschaft ist bislang nicht hinreichend untersucht, das Risiko jedoch „theoretisch sehr niedrig“. Poliomyelitis-Impfung: Bislang sind keine unerwünschten Wirkungen bei Schwangeren oder Neugebore­ nen aufgetreten, aber „theoretisch denkbar“. © WVG Tab. 1. Impfungen mit Totimpfstoffen während der Schwangerschaft (CDC) [CDC 5/2007, Advisory Committee on Immunization Practices (ACIP)] Impfstoff Bei ­Indikation Kl Abwägung Hepatitis A X Hepatitis B Influenza X Empfohlen Polio (IPV) X Pneumokokken X Tetanus/Diphterie X Pneumokokken: Auch hier sind bis­ lang bei der versehentlichen Imp­ fung in der Frühschwangerschaft keine unerwünschten Wirkungen aufgetreten; dennoch ist aus grund­ sätzlichen Erwägungen heraus Vor­ sicht während der Impfung im ers­ ten Trimenon geboten. Lebendimpfungen sind grundsätzlich kontraindiziert während der Schwan­ gerschaft; eine mögliche Alternative ist die passive Immunisierung (sofern verfügbar) mit Hyperimmunglobulin oder mit polyspezifischem Immunglo­ bulin. Tabelle 2 fasst die Zusammenhänge einer versehentlichen Rötelnimpfung Tab. 2. Verlauf nach versehentlicher Rötelnimpfung in der Schwangerschaft [nach Enders, 2005; Bar-Oz, 2005; Namaei, 2008; Minussi, 2008] Land Impfung: ± 3 Monate ~ Konzeption –2 Wochen/ +6 Wochen Konzeption IgM im Nabel­ schnurblut Röteln­ embryopathie 6/222 (3 %) 0/324 USA 324 113 Deutschland 314 188 7/139 (5 %) 0/314 75 25 4/52 (8 %) 1*/75 5 ? 0/5 0/5 94 ? Iran 106 ? 0/106 (0 %) 0/107 Brasilien 171 ? 10/171 (7 %) 0/171 Gesamt 1 089 326 27/695 (3,9 %) 1*/1090 GB Schweden Kanada 0/94 © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 40 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 Berichte & Abstracts Tab. 3. Verlauf nach versehentlicher Varizellenimpfung in der Schwangerschaft [nach Wilson JID, 2008;197:178 f.; Shields, 2001] Exposition Seronegativer insgesamt N Fetale Todesfälle 131 9 (7 %) Kongenitale VZV Kongenitale Fehlbildung 0 3 (2,3 %) Hohes Risiko (0–24 SSW) 82 0 3 (3,7 %) Mittleres Risiko (> 24 SSW bis –4 SSW) 24 0 0 Geringes Risiko (< –4 SSW) 25 0 0 Nach Impfung bei unklarem Serostatus Nach Impfung nach potenziellem VZV-Kontakt 400 55 (14 %) 0 13 (3,3 %) 21 4 (19 %) 0 1 während der (noch nicht bekannten) Schwangerschaft zusammen. Tabelle 3 gibt die Datenlage nach einer versehentlichen Varizellenimpfung in der Schwangerschaft wieder. Bezüglich der Indikationsimpfungen mit einem Lebendimpfstoff in der Schwangerschaft ist die GelbfieberImpfung herauszuheben. Bei der Gelb­ fieber-Erkrankung handelt es sich um eine Erkrankung mit biphasigem Ver­ lauf und etwa 200 000 Fällen pro Jahr. Aktuelle Ausbrüche wurden aus Gui­ nea, dem Sudan, Mali und der Elfen­ beinküste gemeldet. Wegen der hohen Sterblichkeit (bis zu 50 %) müssen Rei­ sende in Endemiegebiete konsequent geimpft werden. Kleinere, retrospektive Studien aus Brasilien, Trinidad und Europa mit re­ trospektivem Design konnten Hinwei­ se dafür geben, dass nach der Gelbfie­ ber-Impfung in der Schwangerschaft keine erhöhte Fehlbildungsrate gegen­ über der Normalbevölkerung auftrat. Management vor der Schwangerschaft Totimpfungen können ohne zeitliche Einschränkung auch vor einer Schwan­ gerschaft verwendet werden. Nach Le­ bendimpfungen sollte vier Wochen lang eine Schwangerschaft verhütet werden. Diese Empfehlung ist vor allem dem Fehlen von Studien geschul­ det und weniger der Tatsache, dass bei­ spielsweise eine Rötelnimpfung bei un­ bekannter Schwangerschaft zu einer Rötelnembryopathie durch den Impf­ stoff führen könnte (Tab. 2). Liegt vor der Schwangerschaft ein Röteln-Titer von 1 : 8 oder 1 : 16 im HHT-HAH-Test vor, so sollten maximal zwei Rötelnimp­ fungen durchgeführt werden. Wenn bereits zwei Impfungen dokumentiert sind, aber Zweifel an der Korrektheit der Impfung bestehen, sollte noch ein­ mal mit Titerkontrolle nachgeimpft werden. Wenn sich auf eine korrekte Impfung kein Titeranstieg einstellt, ist dieses der Beweis für Immunität. In jedem Falle ist es also anzustreben, vor einer Schwangerschaft den Impfschutz zu vervollständigen. Eine Titerkontrol­ le ist nur in Ausnahmefällen angezeigt. Gegen Impftiter-Kontrollen sprechen deren Verwendbarkeit als „Surrogat­ marker für Immunreaktion“, jedoch nicht „Protektion“. Darüber hinaus sind die Testverfahren oftmals nicht standardisiert. Zusammenfassend ist es in jedem Fall besser, einer Impfung von Schwange­ ren die vollständige Immunisierung vor der Schwangerschaft und die Impf­ prävention von Angehörigen und me­ dizinischen Mitarbeitern vorzuziehen. © WVG Malaria in der Schwanger­ schaft – Prävention und Therapie Annette Kapaun, Sektion Klinische Tropenmedizin, Universitätsklinik Heidelberg, INF 324, 69120 Heidelberg, E-Mail: [email protected] Schwangeren sollte grundsätzlich vor Reisen in Malariagebiete abgeraten werden. Sie haben ein höheres Risiko, an einer komplizierten Verlaufsform von P.-falciparum-Malaria zu erkran­ ken, als Nichtschwangere. Komplikati­ onen (schwere hämolytische Anämie, Hypoglykämie, Ikterus, Hyperpyre­ xie, Niereninsuffizienz, Lungenödem) treten häufiger auf und in der Folge erhöhte maternale Letalität und Mor­ bidität, Aborte, Frühgeburten oder Kindstod. Die Sequestration der Plasmodien in der Plazenta führt zur Plazentainsuffi­ zienz, die Malaria-induzierte hämoly­ tische Anämie kann die Minderversor­ gung des Feten verstärken. Schon beim geringsten Verdacht auf Malaria (insbesondere Fieber, Kopfund Gliederschmerzen) bei einer Schwangeren sollte umgehend die Expertise einer tropenmedizinischen Einrichtung eingeholt werden. Wichtige Medikamente, die norma­ lerweise zur Prävention und Therapie der Malaria eingesetzt werden, sind für Schwangere nicht geeignet bzw. es lie­ gen keine ausreichenden Erfahrungen vor. Ist der Aufenthalt in Malariaendemie­ gebieten aus privaten oder beruflichen Gründen unvermeidbar, sollte eine ausführliche Beratung bezüglich Ex­ positionsprophylaxe, medikamentöser Prophylaxe und Therapie rechtzeitig vor Ausreise in einer tropenmedizi­ nischen Einrichtung erfolgen. Präventive Maßnahmen Expositonsprophylaxe (während Dämmerung und Nacht Aufenthalt in moskitosicheren Räumen, unter im­ prägnierten Moskitonetzen und/oder Klimaanlagen benutzen). Bei Aufenthalten im Freien helle, körperbedeckende Kleidung tragen, Repellenzien (wie z. B. DEET) sollten so sparsam wie möglich (nur die un­ vermeidlich nicht kleidungsbedeck­ baren Hautareale) und nicht in hoher Konzentration (< 50 %) aufgetragen werden. Permethrin-Imprägnation der Kleidung ist eine weitere Option. Zusätzlich wird eine kontinuierliche medikamentöse Prophylaxe für Regio­ nen mit mittlerem oder hohem Infek­ tionsrisiko empfohlen. Medikamente zur Prophylaxe Chloroquin und Proguanil: Geeignet, wegen unzureichender Wirksamkeit in multiresistenten Malaria-Gebieten nicht mehr empfohlen. Mefloquin: gute Wirksamkeit, beispiels­ weise in Afrika, jedoch nicht im 1. Tri­ menon, im 2. und 3. Trimenon nur unter sorgfältiger Nutzen-Risiko-Ab­ schätzung Doxycyclin: kontraindiziert Atovaquon/Proguanil: nicht empfohlen Medikamente zur Therapie Die Auswahl des Medikaments ist ab­ hängig von der jeweiligen Resistenz­ © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 41 Berichte & Abstracts lage und von der Schwere der Erkran­ kung (orale oder i. v. Gabe). Chloroquin: Zur oralen Therapie von Malaria tertiana (cave Resistenzen in Ozeanien und Südostasien) und Mala­ ria quartana und bei unkomplizierter P.-falciparum-Malaria aus Gebieten ohne Chloroquin-Resistenz (Haiti/Dom. Republik/Mittelamerika nördlich des Panamakanals) Chinin (oral oder i. v.) plus Clindamycin: zur Therapie von P.-falciparum-Malaria Atovaquon/Proguanil: nicht empfohlen, unzureichende Datenlage Artemisinin-Kombinations-Therapie: nicht empfohlen, unzureichende Datenlage Intermittierende präventive Malariatherapie (IPT) bei Schwangeren (gilt nicht für Reisende und auch nicht für Langzeitaufenthalter) Asymptomatische Schwangere in Ge­ bieten mit hohem Infektionsrisiko werden in regelmäßigen Abständen vorzugsweise mit Kombinationsthera­ pien behandelt, mit dem Ziel, Dauer und Höhe der Parasitenlast zu verrin­ gern. In einigen Studien konnte gezeigt werden, dass die Rate der Malaria-asso­ ziierten Erkrankungen bei Schwange­ ren (z. B. Anämie) und den Neugebore­ nen (z. B. „low birth weight“) gesenkt wurde. Unterschiedliche Kombinationsthera­ pien werden derzeit in verschiedenen Ländern und Studien eingesetzt bzw. getestet. Literatur 1. DTG-Empfehlungen zur Malariaprophylaxe und -therapie, 2009. 2. Guidelines for Malaria Prevention in Travel­ lers from the United Kingdom (2007). 3. Nosten F, et al. Antimalarial Drugs in Preg­ nancy: A Review. Curr Drug Safety 2006;1: 1–15. 4. Malaria in Pregnancy. In: Cook GC (ed.). Man­ son’s Tropical Diseases. 22nd edition. Philadel­ phia: Saunders, 2010:1271–3. 5. Schlagenhauf P, Petersen E. Malaria chemo­ prophylaxis: Strategies for risk groups. Clin Microbiol Rev 2008;21:466–72. Vaginale Infektionsrisiken in der Schwangerschaft Eiko E. Petersen, Sektion Gynäkologische Infektiologie an der Universitäts-Frauenklinik, Hugstetter Straße 55, 79106 Freiburg, E-Mail: [email protected] In den letzten 20 Jahren hat sich unser Wissen über die Zusammensetzung der Vaginalflora und die Bedeutung der verschiedenen Mikroorganismen deutlich verbessert. Nicht nur, dass neue Mikroorganismen hinzugekommen sind, wir unterschei­ den viel genauer zwischen pathogenen Keimen und fakultativ pathogenen Kolonisationskeimen. Nur wenige pa­ thogene Mikroorganismen lösen am kräftigen Vaginalepithel eine Entzün­ dungsreaktion aus (A-Streptokokken, Candida albicans, S. aureus, Tricho­ monaden, Herpes-simplex-Viren). Alle anderen Keime führen in hoher Kon­ zentration zu einer gestörten Vaginal­ flora mit geänderten physikalischen Eigenschaften wie Konsistenz, Geruch, Farbe, was die Patientin in den meis­ ten Fällen auch stört. In der Schwan­ gerschaft jedoch und vor Eingriffen bedeuten sie mehr als ein ästhetisches Problem, sondern können zum Risiko werden. Der gefährlichste Keim in der Vagina für die Mutter ist auch heute noch Streptococcus pyogenes, der Erreger der Puerperalsepsis, wie an Fallbeispie­ len gezeigt wird. Von hohem aktuellem Interesse in der Pädiatrie sind wegen ihrer Häufigkeit die Gruppe-B-Streptokokken-(GBS-)In­ fektionen des Neugeborenen. Hier gibt es klinische Leitlinien und große Anstrengungen, die Zahl der schweren Infektion zu senken. Nach Hochrech­ nungen werden etwa 240 Fälle pro Jahr erwartet, von denen nur 1/3 er­ fasst werden. Die bisherige ScreeningEmpfehlung aller Schwangeren, deren Kosten von ihr selbst getragen werden müssen, und die Antibiotikaprophyla­ xe aller GBS-Positiven unter der Ent­ bindung ist derzeitig eine Möglichkeit, aber keine optimale. Der Spätabort, der oft infektionsbedingt ist, und die mit 7 % häufige Frühgeburt sind bislang ungelöste Probleme in der Geburtshilfe. Die gestörte Vaginal­ flora spielt als einer der Auslöser bzw. Risikofaktoren eine erhebliche Rolle. Dabei scheinen Synergismen zwischen verschiedenen Bakterienarten die In­ fektion zu begünstigen. Proteinasen der Anaerobier degradieren das schüt­ zende Zervixsekret und begünstigen somit (vor allem E. coli) die Aszension und die Auslösung einer Amnionitis. Sobald die Infektion die Fruchthöhle erreicht hat, kommt es zu Wehen und zur Ausstoßung oder Geburt des Kindes. © WVG Die frühzeitige Erkennung von patho­ genen Erregern oder pathologischen Keimzusammensetzungen in der Vagina und die Verbesserung der Va­ ginalflora schon früh in der Schwan­ gerschaft ist die beste Prophylaxe für Mutter und Kind. Hämolysierende Strepto­ kokken bei Neugeborenen Barbara Spellerberg, Institut für Medizinische Mikrobiologie und Hygiene der Universität Ulm, Albert-EinsteinAllee 11, 89081 Ulm, E-Mail: barbara.spellerberg@ uniklinikum-ulm.de Unter den hämolysierenden Strepto­ kokken haben vor allem die Spezies Streptococcus pyogenes (Gruppe-AStreptokokken), Streptococcus aga­ lactiae (Gruppe-B-Streptokokken) und Streptococcus dysgalactiae subspecies equisimilis (Gruppe-C- und -G-Strepto­ kokken) humanpathogene Bedeutung. Schwere invasive Infektionen in der Neugeborenenperiode werden fast ausschließlich durch S. agalactiae ver­ ursacht. Die Erreger werden aus dem Urogenitaltrakt der Mutter unter der Geburt auf die Neugeborenen übertra­ gen und führen in 1 bis 2 % der koloni­ sierten Kinder zu einer invasiven Infek­ tion. Diese manifestiert sich als Sepsis, Pneumonie oder Meningitis, häufig innerhalb der ersten 24 Stunden nach der Geburt. Eine Reihe von Virulenzund Pathogenitätsfaktoren spielen in der Entwicklung invasiver Verläufe eine wichtige Rolle. Neugeborenen­ infektionen können effektiv durch eine peripartale Antibiotikaprophylaxe der Mutter verhindert werden, die nach den nationalen Leitlinien bei allen mit S. agalactiae kolonisierten Schwan­ geren empfohlen wird. Aktuell findet man in Deutschland eine Kolonisie­ rung schwangerer Frauen in ungefähr 16 %. Bei strikter Einhaltung aller Indi­ kationen zur peripartalen Prophylaxe führt das zu einer Antibiotikagabe in bis zu 20 % aller Geburten. Bedrohlich erscheint in diesem Zusammenhang die Entwicklung einer verminderten Empfindlichkeit gegenüber Penicillin, die im Jahre 2008 erstmals beobachtet wurde und deutliche Parallelen zu der Penicillinresistenz von Pneumokok­ ken aufweist. Eine enge Beobachtung dieser Entwicklung ist notwendig, um eine Ausbreitung dieser Stämme recht­ © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 42 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 Berichte & Abstracts zeitig zu erfassen und die empirischen Antibiotikaempfehlungen im Bedarfs­ fall dieser Situation anzupassen. Listeriose in der Schwangerschaft und bei Neugeborenen Herbert Hof, Labor Limbach, Im Breitspiel 15, 69126 Heidelberg Sepsis bei Neugeborenen – Early und Late onset Priv.-Doz. Dr. med. Christoph Härtel, Klinik für Kinderund Jugendmedizin Lübeck, Ratzeburger Allee 160, 23538 Lübeck, E-Mail: [email protected] Die Inzidenz der neonatalen Sepsis, definiert als klinische Infektion inner­ halb der ersten 28 Lebenstage mit Er­ reger-positiver Blutkultur, beträgt zwi­ schen 1 und 10/1 000 Lebendgeborene, wobei für Frühgeborene mit einem Ge­ burtsgewicht < 1 500 Gramm (very-lowbirth-weight, VLBW) ein neonatales Sepsisrisiko von 10 bis 30 % verzeichnet wird. Die Bedeutung der neonatalen Sepsis für Morbidität und Mortalität hat in den letzten zwanzig Jahren vor­ nehmlich deshalb zugenommen, weil durch die Fortschritte in der intensiv­ medizinischen Versorgung, beispiels­ weise durch den Einsatz von antena­ talen Steroiden, die Verabreichung von Surfactant und durch schonendere Beatmungsverfahren, bessere Überle­ benschancen für VLBW-Frühgeborene erreicht wurden, jedoch insbesondere das niedrige Gestationsalter ein hohes Risiko für invasive Infektionen zur Folge hat. Die präsentierten Daten ba­ sieren auf einer multizentrischen, Po­ pulations-bezogenen Studienkohorte VLBW-Frühgeborener, welche die Basis für die Gründung des Deutschen Früh­ geborenennetzwerks GNN (German Neonatal Network) bildete. Insgesamt liegen Datensätze von 2 433 VLBWFrühgeborenen vor (mittleres Gestati­ onsalter ± SD: 28,9 ± 2,7 Wochen; mitt­ leres Geburtsgewicht: 1 077 ± 295 g). 348/2 433 VLBW-Frühgeborene erlitten eine Sepsis. Es werden Risikofaktoren und Erregerspektren von Early- (Le­ bensalter < 72 Stunden) und Late onset vorgestellt und die Bedeutung von zen­ trumsspezifischen Unterschieden hin­ sichtlich Prävention und Inzidenz von Infektionen diskutiert. Listerien sind typische Umweltkeime. Ihr eigentlicher Standort ist die Erde. Von dort gelangen sie mit Staub auf ganz verschiedene Lebensmittel, wo sie sich sekundär vermehren können – sogar bei Kühlschranktemperaturen, so dass beim Verzehr schon beträcht­ liche Keimkonzentrationen vorlie­ gen können. Listeria monocytogenes ist der einzige aus dieser Gruppe von grampositiven Stäbchenbakterien, dem eine humanpathogene Bedeu­ tung zukommt. Die meisten Infekti­ onen entstehen durch Verzehr von Kopfsalat, von Weichkäse (Romadur, Brie, Roquefort, wobei meistens nur die Rinde kontaminiert ist), von Sa­ lami (wobei wiederum die Listerien meistens außen auf der Pelle sitzen) und von geräuchertem Lachs (wobei die Fische selber nicht infiziert sind; vielmehr werden die Listerien bei der Weiterverarbeitung in der Fabrik ein­ getragen). Dagegen sind alle erhitzten Speisen, aber auch Karotten und Äpfel frei von Listerien. Nach oraler Aufnahme können Liste­ rien die Darmwandbarriere überwin­ den und in die Zirkulation gelangen. Da sie sich selbst in Makrophagen und Endothelzellen intrazellulär ver­ mehren können, gelingt es ihnen, in praktisch alle Organe sogar über die Blut-Hirn-Schranke ins ZNS und über die Plazenta hinweg in den Fötus zu gelangen. In Deutschland wie in Europa nimmt die Zahl der registrierten Fälle zu; pro Jahr werden 400 bis 500 Erkrankungen gemeldet, wobei vor allem Alte und Immungeschwächte gefährdet sind. Gelegentlich kommen auch Ausbrü­ che vor. Die Zahl der Infektionen in der ­ Neonatalperiode ist mit etwa 40 pro Jahr recht konstant. Bei Erwachsenen tritt eine Listeriose in Form einer Sepsis und einer Meningi­ tis (eventuell auch einer Enzephalitis) auf. Bei Schwangeren, die ein etwa 12fach höheres Risiko als die Normal­ bevölkerung haben, eine Listeriose zu erleben, ist der Verlauf meist blande; ein grippaler Infekt mit kurzfristigem Fieber ist zumeist die einzige subjektiv © WVG spürbare Manifestation. Je nach Sta­ dium der Schwangerschaft hat eine intrauterine Infektion des Fötus unter­ schiedliche Folgen, nämlich Abort oder Frühgeburt (auffällig ist ein grünliches Fruchtwasser) oder Zeichen dissemi­ nierter Infektion bei Geburt (granulomatosis infantiseptica), die sogenannte Early-Onset-Listeriose. Auch eine Infek­ tion unter der Geburt bei Exposition in den Geburtswegen ist möglich, was dann einige Tage später („late onset“) zu Infektionssymptomen führt. Eine frühzeitige Diagnose durch An­ tikörper- oder Antigennachweis ist nicht möglich, denn nur die Kultur (bzw. PCR-Nachweis) aus Blut der Mut­ ter bzw. Amnionflüssigkeit wären die einzigen Chancen dafür. Erst bei Er­ krankung kann die Ätiologie geklärt werden. Die Prognose für die Mutter ist sehr gut, denn die Infektion heilt für sie ohne Folgen aus. Die Prognose für das Kind ist schlecht; eine Early-Onset-Lis­ teriose hat in 30 bis 50 % einen letalen Ausgang; eine Late-Onset-Infektion lässt sich durch Ampicillin gut behan­ deln. Eine Impfung oder Immunität gibt es nicht; die Vermeidung der Nahrungs­ mittel mit hoher Listerienbelastung ist die einzig sinnvolle Prävention. Toxoplasmose in der Schwangerschaft Priv.-Doz. Dr. med. Ioannis Mylonas, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe – Klinikum Innenstadt, Ludwig-Maximilians-Universität München, Maistraße 11, 80337 München, E-Mail: ioannis.mylona@ med.uni-muenchen.de Wenn eine schwangere Frau erstmals während der Gravidität Kontakt mit Toxoplasma gondii hat, kann der Para­ sit während der akuten Infektionspha­ se auf den Feten übergehen. Im Vorder­ grund steht neben der Problematik der seltenen schweren Erkrankungsfälle vor allem die Langzeitprognose der häufigen Fälle subklinisch infizierter Kinder. In etwa 50 % der Primärinfektionen während einer Schwangerschaft ist mit einem Übertritt des Erregers auf den Feten zu rechnen. Wird die Infektion erst in der letzten Schwangerschafts­ woche erworben, steigt die Übertra­ gungsrate auf etwa 90 %. Die Gefahr für eine schwere Erkrankung des Fetus © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 43 Berichte & Abstracts sinkt dagegen mit dem Gestationsal­ ter. Vor der 16. SSW schädigen Toxo­ plasmaherde den Trophoblasten so offenbar schwer, dass Spontanaborte Folge der Infektion sind. Durch Toxo­ plasmose verursachte Embryopathien sind deshalb quasi nicht zu erwarten. Nur selten treten bei der Mutter die ty­ pischen klinischen Zeichen mit Lymph­ adenitis, Fieber und Kopfschmerzen auf. Die klassische Trias mit Hydroze­ phalus, Chorioretinitis und intraze­ rebralen Verkalkungen tritt nach der Geburt um so eher klinisch in Erschei­ nung, je massiver der postenzephali­ tische Schaden ist. Kardiopulmonale und hepatische Symptome stehen im Vordergrund einer fetalen Infektion. Neue Untersuchungsmethoden wie beispielsweise die PCR und verbesserte Routinetests ermöglichen heute so­ wohl bei Screening-Untersuchungen als auch im schwierigen Einzelfall eine sehr sichere Diagnostik. Indirekt ist der Nachweis einer akuten Infektion durch serologische Methoden möglich. Wurde eine fetale Infektion nachgewie­ sen und bestehen gleichzeitig sonogra­ phische Anzeichen für eine Schädigung des Kindes, muss die Möglichkeit einer Abruptio mit den Eltern besprochen werden. Bei unauffälligem Schwanger­ schaftsverlauf sollten infizierte Kinder intrauterin (über eine Therapie der Mutter) sowie postpartal mindestens bis zum 12. Lebensmonat antibiotisch behandelt werden (4-wöchige Kombi­ nationstherapie mit Pyrimethamin/ Sulfadiazin/Folinsäure/Spiramycin). Gesundheitliche Aufklärung und sero­ logische Überwachung müssen bei der Bekämpfung der pränatalen Toxoplas­ ma-Infektion beachtet werden. Konnatale Toxoplasmose Ingrid Reiter-Owona, Institut für Medizinische Mikrobio­ logie, Immunologie und Parasitologie, Sigmund-FreudStraße 25, 53105 Bonn; E-Mail: [email protected] Die konnatale Toxoplasmose (KT) wird verursacht durch eine pränatale Infek­ tion des Feten mit dem Parasiten To­ xoplasma gondii. Das vorherrschende Krankheitsbild hat sich in den letzten 50 Jahren stark gewandelt: standen früher Fruchttod und schwere gene­ ralisierte Formen mit Beteiligung des Zentralnervensystems (Hydrozepha­ lus, Chorioretinitis, Verkalkungen) im Vordergrund, so werden heute meist subklinische Verlaufsformen beobach­ tet. In West- und Mitteleuropa stellt die okuläre Toxoplasmose die häufigste Manifestation der KT dar. Erste irre­ versible Schädigungen an der Retina entstehen bereits intrauterin, weitere okuläre Läsionen können in jedem Le­ bensalter auftreten und bei bis zu 25 % der Betroffenen zur Erblindung füh­ ren. Krankheitsbild und Häufigkeit der KT werden wesentlich bestimmt vom Zeitpunkt der fetalen Infektion, aber auch vom Parasiten und möglicherwei­ se vom genetischen Hintergrund der Mutter. Eine sichere pränatale Diagnose ermög­ licht auch eine frühzeitige Therapie. Die PCR aus Amnionflüssigkeit bietet hier höchste diagnostische Sensitivität und Spezifität. Die postnatale Diagno­ se stützt sich auf Ergebnisse von kli­ nischen Befunden, serologischen Test­ verfahren und den Erregernachweis. Das Risiko für Kinder, an einer KT zu erkranken, wird mit 6 bis 7 % (mater­ nale Infektion im 1. Trimenon), 24 bis 47 % (Infektion im 2. Trimenon) bzw. 59 bis 81 % (Infektion im 3. Trimenon) an­ gegeben. Die medizinischen Erkennt­ nisse, dass eine möglichst frühzeitige (< 4 Wochen nach maternaler Infekti­ on) Therapie mit Pyrimethamin plus Sulfadiazin die Schwere der KT günstig beeinflusst (intrakraniale Läsionen versus Augenläsionen) und sich bei klinisch manifester KT Spätschäden durch eine postnatale Langzeitthera­ pie vermeiden oder abmildern lassen, müssen durch randomisierte Dop­ pelblindstudien abgesichert werden. Untersucht wird derzeit auch, ob ein Zusammenhang zwischen Serumspie­ gelkonzentration und Effektivität der parasitären Therapie besteht. © WVG Literatur 1. Dunn D, Wallon M, Peyron F, Petersen E, et al. Mother to child transmission of toxoplasmo­ sis: risk estimates for clinical counselling. Lancet 1999;353:1829–33. 2. Bessieres HM, et al. Diagnosis of congenital toxoplasmosis: prenatal and neonatal evalua­ tion of methods used in Toulouse University Hospital and incidence of congenital toxoplas­ mosis. Mem Inst Oswaldo Cruz, Rio de Janeiro 2009;104:389–92. 3. McLeod R, et al. Outcome of treatment for congenital toxoplasmosis, 1981–2004: the National Collaborative Chicago-Based, Con­ genital Toxoplasmosis Study. Clin Infect Dis 2006;42:1383–94. Dienstag, 23. März Chlamydien in der Schwangerschaft Prof. Dr. Klaus Friese, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe – Klinikum Innenstadt und Grosshadern, Ludwig-Maximilians-Universität München, Maistraße 11, 80337 München, E-Mail: klaus.friese@med. uni-muenchen.de Eine urogenitale Infektion mit Chlamy­ dia trachomatis ist die am häufigsten vorkommende sexuell übertragbare Erkrankung in der Welt. Auch ohne klinisch apparente Zervizitis kann eine durch C. trachomatis verursachte Salpingitis entstehen, die vor allem in chronischer oder subklinischer Form zur Schädigung und Vernarbung der Salpingen führen kann. Frauen mit einer anamnestischen Adnexitis/PID haben schwerwiegende gesundheit­ liche und reproduktionsmedizinische Probleme einschließlich Infertilität (etwa 20 %), chronische pelvine Schmer­ zen (etwa 18 %) und extrauterine Gravi­ dität (etwa 6 %). Außer der sexuellen Transmission hat ebenfalls die peripartale Übertra­ gung, die bei 36 bis 60 % der infizierten Mütter zu erwarten ist, eine große Bedeutung hinsichtlich der perina­ talen Morbidität der Neugeborenen. Eine Infektion während der Schwan­ gerschaft kann mit Fehlgeburten und Spontan­aborten, Frühgeburten, einem geringen Geburtsgewicht, vorzeitigem Blasensprung und einer erhöhten pe­ ripartalen Mortalität einhergehen. Unter der Geburt kommt es bei Befall der Cervix uteri bei zwei Drittel der ex­ ponierten Neugeborenen zur Infektion mit Einschlusskörperchenkonjunktivi­ tis, atypischer Pneumonie, Otitis media oder Entzündungen des Nasopharynx. Das routinemäßige Screening auf Chla­ mydia trachomatis ist in den Mutter­ schaftsrichtlinien verankert und sollte bei der ersten Schwangerschaftsvorsor­ geuntersuchung aus dem Urin vorge­ nommen werden. Mittlerweile ist die einzige zugelassene Nachweismethode die Polymerase-Kettenreaktion (PCR). Die Behandlung sollte möglichst un­ mittelbar nach der Diagnosestellung, aus Sicherheitsgründen aber nicht vor Abschluss der 14. SSW begonnen wer­ den. Es wird empfohlen, den Thera­ pieerfolg durch eine Kontrolle drei bis vier Wochen nach Behandlungsende © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 44 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 Berichte & Abstracts sicherzustellen. Die Partnertherapie ist in jedem Falle obligat. Chlamydieninfektionen des Neugeborenen Christian Gille, Abteilung für Neonatologie, Universitätsklinikum Tübingen, Calwer Straße 7, 72076 Tübingen, und Institut für Medizinische Mikrobiologie und Hygiene, Elfriede-Aulhorn-Straße 6, 72076 Tübingen, E-Mail: [email protected] Chlamydia-trachomatis-Infektionen der Geburtswege werden in bis zu 5 % aller Schwangerschaften gefunden. Unter der Geburt wird der Keim in etwa 70 % auf das Neugeborene über­ tragen. Primäre Infektionsorte sind die Konjunktiven und der Nasopharynx, von wo aus der Erreger die unteren Atemwege infizieren und zu protra­ hierten interstitiellen Pneumonien führen kann [2]. Bei exponierten Neu­ geborenen wird die Inzidenz der Chla­ mydien-Konjunktivitis auf 15 %, die In­ zidenz der Chlamydien-Pneumonie auf 7 % geschätzt [3]. Eine systemische Pro­ phylaxe mit Erythromycin nach Expo­ sition wird nicht empfohlen [3]. Auch die prophylaktische Gabe von Augen­ tropfen mit Silbernitrat nach Credé oder alternativ mit Erythromycin oder Povidon-Iod zur Verhinderung der Konjunktivitis ist umstritten, da auch sekundär vom Nasopharynx aus eine erneute Infektion stattfinden kann. Außerdem kann eine diagnostizierte Chlamydien-Konjunktivitis dienlich sein bei der Einschätzung von respira­ torischen Symptomen. Wichtig ist die korrekte Abnahme von Probenmate­ rial mit Gewinnung von Epithelzellen der Konjunktiven und des Nasopha­ rynx. Nukleinsäure-Amplifikationsver­ fahren sind zur Diagnose geeignet [4]. Zur Assoziation von Chlamydien-Infek­ tionen der Mutter und Frühgeburtlich­ keit, vorzeitigem Blasensprung, Hypo­ trophie und perinataler Sterblichkeit liegen widersprüchliche Daten vor [1]. Der pränatalen Diagnose und Therapie einer Chlamydien-Infektion kommt die größte Bedeutung zu. Seit Aufnah­ me eines Chlamydien-Screenings in die Mutterschaftsrichtlinie ist die Inzi­ denz der Neugeborenenerkrankungen zurückgegangen [2]. Literatur 1. Andrews WW, Klebanoff MA, Thom EA, Hauth JC, et al.; National Institute of Child Health and Human Development MaternalFetal Medicine Units Network. Midpregnancy genitourinary tract infection with Chlamydia trachomatis: association with subsequent pre­ term delivery in women with bacterial vagi­ nosis and Trichomonas vaginalis. Am J Obstet Gynecol 2006;194:493–500. 2. Darville T. Chlamydia trachomatis infections in neonates and young children. Semin Ped­ iatr Infect Dis 2005;16:235–44. 3. Rosenman MB, Mahon BE, Downs SM, Klei­ man MB. Oral erythromycin prophylaxis vs. watchful waiting in caring for newborns ex­ posed to Chlamydia trachomatis. Arch Pediatr Adolesc Med 2003;157:565–71. 4. Straube E. Chlamydia spp., Chlamydophila spp. und Simkania spp. In: Neumeister B, Braun R, Kimmig P (editors). Mikrobiologische Diagnostik. Stuttgart: Thieme, 2009:610–9. Herpes-Infektionen in der Schwangerschaft und konnatal Prof. Dr. med. Rüdiger W. Braun, Arzt für Labormedizin, Labor Enders & Partner, Rosenbergstraße 85, 70193 Stuttgart und Hirschlandstraße 97, 73730 Esslingen, E-Mail: [email protected] Im Rahmen der Mutterschaftsrichtli­ nien werden Untersuchungen auf In­ fektionen mit Chlamydia trachomatis, Hepatitis B, HIV und Lues sowie Röteln seit vielen Jahren durchgeführt und empfohlen. Während die epidemiolo­ gische Bedeutung der Röteln und der Hepatitis B bedingt durch die zuneh­ mende Akzeptanz von Impfungen in den letzten Jahren abgenommen hat, ist die Bedeutung von Infektionen mit Herpesviren in der Schwangerschaft, insbesondere mit dem humanen Zy­ tomegalievirus (HCMV), dem Herpessimplex-Virus (HSV) und dem Varizel­ la-Zoster-Virus (VZV) gleich geblieben, bzw. hat sich nur marginal verändert. So schätzt man, dass etwa 2 000 Neu­ geborene pro Jahr von prä- oder peri­ natalen CMV-Infektionen betroffen sind und, trotz der seit einigen Jahren verfügbaren VZV-Impfung, immer noch einige hundert Fälle pränataler Varizelleninfektionen auftreten. Für den verantwortlichen Gynäkologen ergibt sich in Zusammenarbeit mit dem Labor zunächst die Schwierig­ keit, eine in der Schwangerschaft auf­ tretende Primärinfektion sicher zu erkennen und von einem endogenen Rezidiv abzugrenzen. Hierzu haben sich unter anderem Aviditätstests, aber auch weitere Testformate, zum Nach­ weis von Antikörpern gegen einzelne Virusantigene als hilfreich erwiesen. Weiterhin ist zu berücksichtigen, dass, © WVG auch in Abhängigkeit von der Schwan­ gerschaftswoche, nicht jede Infektion auf das Kind übertragen wird. Sofern eine Infektion des Kindes erfolgt, führt diese ebenfalls in Abhängigkeit von der Schwangerschaftswoche und vom Erreger nicht in jedem Fall zu einer kindlichen Schädigung mit den ent­ sprechenden Spätfolgen. Auch hier ist es Aufgabe des Labors, durch die Auswahl entsprechender Nachweisver­ fahren, auch unter Zuhilfenahme von Direktnachweismethoden mit PCR, den Infektionsstatus des Kindes fest­ zustellen. Der Beitrag nimmt Stellung zur Epidemiologie der genannten Her­ pesvirusinfektionen in der Schwanger­ schaft und zum diagnostischen Vorge­ hen bei definierten Fragestellungen. Voraussetzung, um solch schwierige Fälle abklären zu können und für die Patientin und deren Kind ein bestmög­ liches Ergebnis zu erreichen, ist jedoch die enge Kooperation zwischen dem Frauenarzt und dem Labor. Enterovirus und Parechovirusinfektionen bei Neugeborenen Andreas Müller, Universitätsklinikum Bonn, Zentrum für Kinderheilkunde, Abteilung Neonatologie, Spezielle Päd­ iatrische Infektiologie, Adenauerallee 119, 53113 Bonn, E-Mail: [email protected] Die humanen Enteroviren (hEV) gehö­ ren in die Familie der Picornaviridae und werden in der traditionellen Taxo­ nomie in Echoviren, Coxsackie A und B, Polioviren und andere hEV unterschie­ den. In der aktuellen Taxonomie wird nur noch in humane Enteroviren A–D unterteilt. Die humanen Parechoviren (hPeV) gehörten früher zu den Echovi­ ren und werden nun als eigenständiger Genus unter der Familie der Picornavi­ ridae geführt. Eine Vielzahl von hEV, aber auch hPeV wurden als Infektions­ erreger bei Neugeborenen beobachtet. Dabei kann die Infektion antenatal, intrapartal oder postnatal erworben werden. hEV konnten in Fruchtwasser, Nabelschnurblut sowie in abortierten Feten nachgewiesen werden, was eine vertikale Transmission wahrscheinlich macht. Während der Geburt können hEV über mütterliches Blut, Vaginal­ sekret oder Stuhl übertragen werden. Postnatal werden hEV und hPeV vor­ wiegend über Tröpfcheninfektion von engen Kontaktpersonen auf das Neuge­ © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 45 Berichte & Abstracts borene weitergegeben. Ausbrüche und sporadische Übertragungen wurden aus Neugeborenenintensivstationen beschrieben. Das klinische Spektrum der neonatalen hEV- und hPeV-Infekti­ onen ist breit und reicht von unspezi­ fischem Fieber bis zu sepsisähnlichen Krankheitsbildern. Etwa die Hälfte der Neugeborenen zeigen Zeichen einer Hepatitis. Bei einigen Kindern steht eine Myokarditis mit Arrhyth­ mien, dilatativer Kardiomyopathie und Herzinsuffizienz im Vordergrund. Bei Krampfanfällen, fokalen neurolo­ gischen Symptomen und Vigilanzstö­ rungen muss an eine Meningitis und/ oder Enzephalitis gedacht werden. Die Diagnose erfolgt über molekular­ biologische Methoden mit RT-PCR aus Blut, Liquor, Rachensekret oder Stuhl je nach Symptomatik. Zu beachten ist, dass die hPeV nicht von den allgemein verwendeten hEV-RT-PCR-Methoden erfasst werden und deshalb geson­ dert angefordert werden müssen. Die meisten hEV- und hPeV-Infektionen verlaufen gutartig. Risikofaktoren für schwere Krankheitsverläufe sind Früh­ geburtlichkeit, maternale Symptome bei Entbindung, Symptome in der ers­ ten Lebenswoche sowie der Serotyp. Klinische Manifestationen wie sep­ sisähnliche Erkrankung, Myokarditis oder Enzephalitis sind wichtige Pro­ gnosefaktoren und haben eine hohe Morbidität und Mortalität. Die Thera­ pie der hEV- und hPeV-Infektionen ist supportiv, da antivirale Medikamente für den Routineeinsatz nicht zur Verfü­ gung stehen. Klinik, Prävention und Therapie der CMV-Infektion bei Frühgeborenen Rangmar Goelz, Abt. Neonatologie der Universitätsklinik für Kinder- und Jugendmedizin, Calwer Straße 7, 72070 Tübingen, E-Mail: [email protected] Zahlreiche Leitlinien inklusive die WHO empfehlen die Brustmilchfütte­ rung insbesondere auch für Frühgebo­ rene, unabhängig von ihrem Geburts­ gewicht und ihrem Gestationsalter. Allerdings können sich Frühgeborene in den ersten Wochen ihres Lebens durch rohe Muttermilch mit Cyto­ megalievirus infizieren, weil fast alle CMV-IgG-positiven Mütter dieses Virus in der Brustdrüse während der Laktati­ on reaktivieren und in die Brustmilch ausscheiden. In Südwestdeutschland ist ungefähr die Hälfte aller Mütter CMV-positiv, in anderen Ländern und Regionen ist die Prävalenz zum Teil er­ heblich höher. Die Befunde und Symptome der erwor­ benen CMV-Erkrankung bei Frühgebo­ renen, evaluiert in einer Studie durch den Vergleich infizierter und nicht infizierter Frühgeborener, sind Granu­ lozytopenie, Thrombozytopnie, CRPErhöhung auf 10 bis 20 mg/l, seltener Hepatitis mit Cholestase und Pneumo­ nie. Meist ist der Verlauf selbstlimi­ tierend, bei Therapienotwendigkeit ist Ganciclovir i. v. möglich. In einer epidemiologischen Studie konnten wir zeigen, dass 96 % der Trägermüt­ ter das Virus reaktivierten, etwa ein Drittel der Frühgeborenen infizierten sich, wovon die Hälfte symptomatisch wurde. Dies wurde seither in mehre­ ren internatio­nalen Studien bestätigt. In einigen internationalen Berichten wurden schwere und manchmal auch letale Verlaufsformen der CMV-Infekti­ on beschrieben. Die einzige Möglichkeit, diese Infekti­ on zu vermeiden, besteht in der Virus­ inaktivierung durch Hitzebehandlung der Brustmilch. In systematischen Laboruntersuchungen konnten wir zeigen, dass eine ultrakurze Erhit­ zung auf 62 °C von 5 Sekunden Dauer das Virus komplett zerstören kann, während dagegen andere Methoden wie die Gefrier-Auftau-Methode nicht vollständig wirksam waren. Bei der Er­ hitzung auf 62 °C/5 Sekunden können wichtige Inhaltsstoffe der Brustmilch, wie Enzyme, Wachstumsfaktoren und andere bioaktive Substanzen geschont werden. Die meisten dieser Faktoren werden zerstört oder signifikant redu­ ziert, wenn kommerziell erhältliche Holder-Pasteurisierungen angewandt werden (62,5 °C, 30 Minuten Erhit­ zungsdauer). Zum Langzeit-Outcome gibt es im Tübinger Kollektiv keinen Hinweis auf vermehrte Hörstörungen der infi­ zierten Frühgeborenen, ein Einfluss auf die kognitive Entwicklung kann al­ lerdings nicht ausgeschlossen werden. © WVG Literatur 1. Goelz R, Hamprecht K, Vochem M, Masch­ mann J, et al. Breast feeding of very preterm infants of HCMV-seropositive mothers: Re­ 2. 3. 4. 5. 6. 7. view and statement (German, abstract in eng­ lish). Z Geburtsh Neonatol 2004;208:118–21. Hamprecht K, Maschmann J, Vochem M, Dietz K, et al. Epidemiology of transmission of cy­ tomegalovirus from mother to preterm infant by breastfeeding. Lancet 2001;357:513–8. Hamprecht K, Goelz R, Jahn G, Poets CF, et al. Cytomegalovirus transmission to pre­ term infants during lactation. J Clin Virol 2008;41:198–205. Hamprecht K, Goelz R, Maschmann J. Breast milk and cytomegalovirus infection in pre­ term infants. Early Hum Dev 2005;81:989–96. Goelz R, Hihn E, Hamprecht K, Dietz K, et al. Effects of different CMV-heat-inactivationmethods on growth factors in human breast milk. Pediatr Res 2009;65:458–61. Neuberger P, Hamprecht K, Vochem M, Masch­ mann J, et al. Case control study of symptoms and neonatal outcome of human-milk trans­ mitted cytomegalovirus infection in prema­ ture infants. J Pediatr 2006;148:326–31. Hamele M, Flanagan R, Loomis A, Stevens T, et al. Severe morbidity and mortality with breast milk associated cytomegalovirus infec­ tion. Pediatr Infect Dis J 2010;29:84–6. HIV in der Schwangerschaft Anke Reitter, Schwerpunkt für Geburtshilfe und Pränatalmedizin, Klinik für Gynäkologie und Geburtshilfe, Universitätsklinikum Frankfurt, Theodor-Stern-Kai 7, 60596 Frankfurt/Main, E-Mail: [email protected] HIV und Schwangerschaft sind keine Gegensätze mehr. Laut Robert KochInstitut (Jahresbericht 2009) leben in Deutschland 67 000 Menschen mit HIV/AIDS, davon 12 000 Frauen (etwa 16 %). Die Mutter-Kind-Übertragung (MTCT) liegt in der westlichen Welt bei optimaler Transmissionsprophyla­ xe erfreulich niedrig bei 1 bis 2 %. Die Transmission findet fast ausnahmslos kurz vor oder während der Geburt statt. Dabei korreliert die Wahrschein­ lichkeit der HIV-Transmission maßgeb­ lich mit der Viruslast im mütterlichen Blut. Die Betreuung und Behandlung von HIV-positiven Schwangeren steht auf drei Säulen. Nach der medikamentösen Prophylaxe und geplanten Entbindung folgt die postnatale Behandlung des Neugeborenen. Diese Maßnahmen führen zur Reduktion der Transmissi­ on von unbehandelt 25 % auf 1 bis 2 %. Das Ziel der medikamentösen Behand­ lung ist die Reduktion der HI-Viruslast unter die Nachweisgrenze. Dieses Ziel sollte spätestens bis zum Zeitpunkt der Entbindung erreicht sein. Zur Ver­ meidung einer Resistenzentwicklung werden überwiegend Kombinations­ therapien eingesetzt (Highly active an­ tiretroviral treatment, HAART). © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 46 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 Berichte & Abstracts In großen europäischen Studien konn­ te die deutliche Reduktion der HIVTransmission bei Sectio caesarea mit perioperativer Zidovudin-(AZT-)Gabe im Vergleich zur Spontangeburt ge­ zeigt werden. Neuere Daten zeigen, dass bei negativer Viruslast und ef­ fektiver HAART eine Spontangeburt möglich ist und daraus keine erhöhte MTCT resultiert. Risikopatientinnen erhalten jedoch weiterhin die geplante Sectio caesarea. Die Postexpositionsprophylaxe (PEP) des Neugeborenen erfolgt nach jewei­ liger Risikoeinschätzung, diese Ein­ gruppierung entscheidet über die Art und Dauer der PEP. Das Stillen ist ein unabhängiger Risiko­ faktor für die MTCT. Deshalb wird ein primäres Abstillen in der westlichen Welt empfohlen. Zusammenfassung Soweit heute bekannt, wird der natür­ liche Verlauf der HIV-Infektion durch die Schwangerschaft nicht negativ be­ einflusst. Aus unserer Sicht ist die in­ terdisziplinäre Betreuung von HIV-po­ sitiven Schwangeren und ihrer Kinder in Zentren notwendig. Literatur 1. Connor EM, Sperling RS, Gelber R, Kiselev P, et al. Reduction of maternal-infant transmis­ sion of human immunodeficiency virus type 1 with zidovudine treatment. Pediatric AIDS Clinical Trials Group Protocol 076 Study Group. N Engl J Med 1994;331:1173–80. 2. Buchholz B, Beichert M, Marcus U, Grubert T, et al. German-Austrian recommendations for HIV-therapy in pregnancy and in HIV-ex­ posed newborn – update 2005. Eur J Med Res 2006;11:359–76. 3. Volmink J, Siegfried NL, van der Merwe L, Brocklehurst P. Antiretrovirals for reducing the risk of mother-to-child transmission of HIV infection. Cochrane Database Syst Rev 2007;(1):CD003510. 4. Warszawski J, Tubiana R, Chenadec J, Blanche S, et al. Mother-to-child HIV trans­ mission despite antiretroviral therapy in the ANRS French Perinatal Cohort 2008. AIDS 2008;22:289–99. 5. www.apregistry.com 6. www.hiv.net 7. www.rki.de 8. www.aidsinfo.nih.gov Perinatale HIV-Infektion Julia Prusseit, Pädiatrische Infektiologie, Zentrum für Kinderheilkunde des Universitätsklinikums Bonn, Adenauerallee 119, 53113 Bonn, E-Mail: Julia.Prusseit@ ukb.uni-bonn.de Die Hauptursache der HIV-Infektion im Kindesalter ist die Mutter-Kind- Transmission (MKT). Daher kommt der Behandlung und vor allem der Präven­ tion einer perinatalen HIV-Infektion eine besondere Bedeutung zu. Nach Schätzungen von UNAIDS waren Ende 2008 33,4 Millionen Menschen mit HIV infiziert, darunter 2,1 Millionen Kin­ der < 15 Jahre. 2008 wurden weltweit 430 000 Kinder neu mit HIV infiziert. In Deutschland leben zum Vergleich nach Angaben des RKI Ende 2009 etwa 67 000 Menschen mit HIV-Infektion, darunter etwa 200 Kinder. Von 3 000 gemeldeten Neuinfektionen im Jahr 2009 wurde 25 bei Kindern diagnos­ tiziert. Ohne jegliche Vorbeugemaß­ nahmen zur Vermeidung einer MKT von HIV werden bis zu 40 % der Kinder perinatal infiziert. Seit Bekanntwer­ den der ersten MKT von HIV wurden viele Risikofaktoren ermittelt. Hier­ zu zählen beispielsweise ein höheres mütterliches Alter, fortgeschrittene HIV-Erkrankung, konkomitante sexu­ ell übertragbare Erkrankungen (z. B. Hepatitis C), hohe Viruskopien, Virus­ phänotyp sowie Schwangerschafts­ faktoren wie Frühgeburtlichkeit, Am­ nioninfektionssyndrom, vorzeitiger Blasensprung und Wehen. Es zeigte sich, dass eine effiziente Prävention eine gleichzeitige Umsetzung verschie­ dener synergistisch wirkender Strate­ gien bedarf. Unter anderen setzt sich das Präventionsprogramm aus 1. einer allgemeinen Reduktion der HIV-Infek­ tionen von Frauen im gebärfähigen Alter, 2. der Bereitstellung der Medika­ mente für Frauen während und nach der Schwangerschaft für eine risiko­ adaptierte Therapie, 3. primäre Sectio caesarea am wehenfreien Uterus, 4. adäquate postnatale Versorgung des Kindes, 5. risikoadaptierte prophylak­ tische Therapie des Kindes, 6. Stillver­ zicht und 7. einer adäquaten Nachsorge des Kindes zusammen. Unter Einhal­ tung aller Präventionsmaßnahmen kann das Infektionsrisiko des Kindes auf unter 2 % gesenkt werden. Bis zum 3. Lebensmonat kann in der Regel eine perinatale HIV-Infektion ausgeschlos­ sen werden. Wegen der Gabe von po­ tenziell toxischen Medikamenten an die Schwangere und das Neugeborene sollten jedoch alle HIV-exponierten Kinder bis zum Alter von 24 Lebens­ monaten nachuntersucht werden. Die Behandlung der HIV-Infektion in der Schwangerschaft sowie die Verhinde­ © WVG rung einer perinatalen HIV-Übertra­ gung auf das Neugeborene erfordert eine enge Zusammenarbeit zwischen Infektiologen, Geburtsmedizinern und Kinderärzten und sollte spezialisierten Zentren vorbehalten sein. Parvovirus-B19-Infektionen in der Schwangerschaft Susanne Modrow1, Simon Bredl1, Johannes Möst2, Birgit Seelbach-Göbel3 1 Institut für Medizinische Mikrobiologie und Hygiene, Universität Regensburg, Franz-Josef-Strauss-Allee 11, 93053 Regensburg, E-Mail: susanne.modrow@klinik. uni-regensburg.de 2 Mikrobiologisches Labor und Gemeinschaftspraxis für Reisemedizin, Franz-Fischer-Straße 7, 6010 Innsbruck, Österreich 3 Klinik für Frauenheilkunde und Geburtshilfe St. Hedwig, Steinmetzstraße 1–3, 93049 Regensburg Parvovirus-B19-(B19V-)Infektionen fin­ det man bevorzugt bei Kindern, sie ver­ ursachen die Ringelröteln (Erythema infectiosum), ein mit Anämie einher­ gehendes Exanthem. Die Infektionen können neben dieser meist problem­ losen Symptomatik auch schwere Er­ krankungen unterschiedlicher Organe wie Arthritiden und Arthralgien, Hepa­ titiden, Enzephalitiden, Meningitiden und Myokarditiden verursachen. Nach der Infektion bleibt B19V-DNS vermut­ lich lebenslang latent in verschiedenen Geweben des Organismus erhalten. In Deutschland findet man bei Frauen im gebärfähigen Alter eine Seroprä­ valenz von 72 %. Bei seronegativen Schwangeren können akute B19VInfektionen bis einschließlich der 20. Schwangerschaftswoche zu Spon­ tanaborten oder Hydrops fetalis füh­ ren. Die Symptome treten im Fetus mit mehrwöchiger Verzögerung zur Infektion der Schwangeren auf. Beim Hydrops fetalis zerstört B19V nach transplazentarer Übertragung die ery­ throiden Vorläuferzellen in der fetalen Leber. Dies bewirkt eine fetale Anämie, die sich als Hydrops fetalis unterschied­ licher Schweregrade äußern und den Tod des Feten bewirken kann. Bei früh­ zeitiger Erkennung der Anämie durch Dopplersonographie ist die Therapie mittels Bluttransfusion über die Na­ belschnurvene meist erfolgreich, die Kinder sind bei Entbindung gesund. Deswegen ist bei Schwangeren mit un­ bekanntem B19V-Status, die Kontakt mit B19V-infizierten Personen hatten, das Vorliegen einer akuten Infektion © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 47 Berichte & Abstracts labordiagnostisch abzuklären. Akut in­ fizierte Personen sind hoch virämisch und zeigen häufig seronegative Test­ ergebnisse, weil initial niedrige Anti­ körpermengen mit den Viruspartikeln komplexieren; deswegen ist der allei­ nige Antikörpertest nicht ausreichend, es muss der Nachweis der Virus-DNS mittels PCR erfolgen. B19V-IgG-posi­ tive Frauen mit zurückliegender Infek­ tion gelten als immun. In einem Teil der seropositiven Schwangeren findet man bei kontinuierlicher Abnahme der humoralen und zellulären B19Vspezifischen Immunantworten in der Spätschwangerschaft Reaktivierungen der latenten Virusgenome: In diesen Phasen können sowohl B19V-spezi­ fisches IgM wie auch B19V-DNS im Blut nachgewiesen werden. Im Rahmen dieser Reaktivierungen in der Spät­ schwangerschaft waren bislang weder bei der Schwangeren noch beim Kind Symptome zu beobachten. Literatur 1. Modrow S, Gärtner B. Parvovirus B19-Infek­ tion in der Schwangerschaft. Dtsch Ärtzebl 2006;103:A2869–76. 2. Röhrer C, Gärtner B, Sauerbrei A, Böhm S, et al. Seroprevalence of parvovirus B19 in the German population. Epidemiol Infect 2008;136:1564–75. 3. Kuethe F, Lindner J, Matschke K, Wenzel JJ, et al. Prevalence of parvovirus B19 and human bocavirus DNA in the heart of patients with no evidence of dilated cardiomyopathy or myocarditis. Clin Infect Dis 2009;49:1660–6. HPV-Infektionen Gerd Gross, Universitätsklinik und Poliklinik für Dermatologie und Venerologie, Universität Rostock, Strempelstraße 13, 18057 Rostock, E-Mail: gerd.gross@med. uni-rostock.de Die sexuelle Übertragbarkeit von Lowrisk-(LR-) und High-risk-(HR-)HPVs ist in vielen Untersuchungen nachgewiesen worden. Untersuchungen zu HPV-In­ fektionen schwangerer Frauen und zur Übertragung von HPV auf das Kind haben zu widersprüchlichen Ergebnis­ sen geführt. Zahlreiche Studien haben untersucht, ob HPVs „vertikal“ während der Ent­ bindung von der Mutter auf das Kind oder „horizontal“ durch Manipulati­ onen mit infizierten Händen oder über infizierte Gegenstände übertragen werden. Genitalwarzen bei der Schwangeren werden als schwerstes Risiko für die Entstehung juveniler Larynxpapillome beim Kind angesehen. In diesen auch „juvenile-onset recurrent respiratory papillomatosis“ (JORPP) genannten Papillomen werden am häufigsten die HPV-Typen 6 und 11 gefunden, nur sehr selten HPV 16 und HPV 18. Das Risiko für die Entwicklung von JORPP in einem Kind ist allerdings sehr ge­ ring (Inzidenz in den USA 4,3 von 100 000 Kindern). Die Sectio caesarea wird noch immer von einigen Autoren als Schutz vor der vertikalen HPV-Übertragung ange­ sehen. Große Studien widerlegen dies eindeutig. Larynxpapillome können häufig re­ zidivieren und zu bleibenden Stimmund Atemstörungen durch zahlreiche Abtragungen führen. Bei chronischen Verläufen ist vor allem bei HPV-11-po­ sitiven JORPP auch eine maligne Ent­ artung möglich. Zur Senkung der Rezidivrate und als kurative Therapie werden neben der Laserablation adjuvante Thera­ pieformen eingesetzt. Hierzu gehören Immunstimulation mit Interferon alpha, die lokale Applikation von Cido­ fovir, die photodynamische Therapie und andere. Ein neuer hoffnungsvoller Ansatz ist der „Off-Label-Use“ des quadrivalenten prophylaktischen VLP-HPV-6/11/16/18Impfstoffes. Dieser Impfstoff induziert Impfvirus-typspezifische neutralisie­ rende Antikörper. Bei Kindern mit JORPP wird versucht, mit Hilfe dieses Impfstoffes frühzeitige Remissionen oder eine Absenkung der Rezidivrate zu erzielen. Schwangerschaft beträgt die Übertra­ gungsrate bei ausbleibender Therapie bis 100 %. Zu einer Übertragung der Er­ reger auf den Feten kommt es bei aus­ bleibender oder inadäquater Therapie der Syphilis der Schwangeren, unter Umständen auch nach einer adäquaten Therapie durch eine Reinfektion. Die intrauterine Infektion kann eine Fehl- bzw. Totgeburt, die Geburt eines deutlich kranken Neugeborenen, aber in vielen Fällen auch die Geburt eines infizierten, aber klinisch unauffälligen Kindes zur Folge haben. Bei Letzteren kommt es meist in den ersten zwei Le­ bensjahren zu klinischen Symptomen (z. B. Fieber, Hepatosplenomegalie, Hauteffloreszenzen, Lymphknoten­ schwellung, Rhinitis), in manchen Fäl­ len treten die Symptome erst nach Jah­ ren auf (z. B. ZNS-Symptome, Uveitis, Keratitis, Taubheit, Rhagaden, Zahnund Knochenveränderungen). Die Diagnose wird serologisch durch den Nachweis von treponemenspezi­ fischen und lipoidalen Antikörpern gestellt. Die Therapie besteht in der Gabe von Penicillin G intravenös. Bei Benza­ thin-Penicillin kommt es nur zu un­ zureichenden Liquorspiegeln, unter Umständen zum Therapieversagen. Die beste Prophylaxe der konnatalen Syphilis ist die rechtzeitige Erkennung und adäquate Therapie der Syphilis bei der Schwangeren. Konnatale Syphilis Man geht davon aus, dass zwischen 0,3 und 0,4 % der Schwangeren chronische Hepatitis-B-Virusträger sind. Das Ri­ siko einer perinatalen Infektion bei einer HBeAg-positiven Mutter beträgt 90 %, bei einer anti-HBe-positiven Mut­ ter zwischen 15 und 20 %. Es können allerdings bei der Mutter Mutationen im Prä-Core-Bereich des Hepatitis-BVirus aufgetreten sein. Ist dies der Fall, dann besteht das Risiko, dass infizierte Kinder im Alter zwischen 3 und 4 Mo­ naten eine fulminante Hepatitis B ent­ wickeln. Seit Jahren wird die aktive und passive Immunisierung unmit­ telbar nach der Geburt bei Kindern © WVG Michael Borte1, Werner Handrick2 1 Klinik für Kinder- und Jugendmedizin, Klinikum St. Georg gGmbH Leipzig, Akademisches Lehrkrankenhaus der Universität Leipzig, Delitzscher Straße 141, 04129 Leipzig, E-Mail: [email protected] 2 Institut für Medizinische Diagnostik, Ärztliches Labor Dr. F. Berthold & Kollegen, Am Kleistpark 1, 15230 Frankfurt an der Oder, E-Mail: [email protected] Die konnatale Syphilis kommt in Deutschland selten vor. Es handelt sich in den meisten Fällen um transplazen­ tare Infektionen. Die Übertragungsrate ist umso höher, je kürzer die seit der Infektion der Mutter vergangene Zeit­ spanne ist. Bei Infektion während der Konnatale Hepatitis B und C Stefan Wirth, Zentrum für Kinder- und Jugendmedizin, HELIOS Klinikum Wuppertal, Universität Witten-Herdecke, Heusnerstraße 40, 42283 Wuppertal, E-Mail: [email protected] © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 48 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 Berichte & Abstracts HBsAg-positiver Mütter durchgeführt. Damit können zwischen 90 und 95 % der Infektionen erfolgreich verhindert werden. Bei den trotz aktiver und pas­ siver Immunisierung infizierten Kin­ dern ist entweder die Infektion bereits intrauterin erfolgt und ist daher nicht verhinderbar oder es handelt sich um eine seltene Mutation in der a-Determi­ nante des HBsAg des Hepatitis-B-Virus der Mutter. Ein kleiner Teil muss auch als Impfversager registriert werden. Eine diagnostische Verlaufskontrolle empfiehlt sich nach sechs Monaten. Man sollte zunächst das HBsAg und das anti-HBs bestimmen. Auch für die chronische Hepatitis C geht man von einer Häufigkeit von 0,3 bis 0,4 % anti-HCV-positiver werdender Mütter aus. Eine Impfprävention ist bei der chronischen Hepatitis C nicht möglich. Patientinnen, die zusätzlich eine HIV-Infektion haben, sollen durch einen Kaiserschnitt entbunden werden, was bei alleiniger chronischer Hepati­ tis C nicht empfohlen wird. Die perina­ tale Übertragungswahrscheinlichkeit ist aufgrund der relativ geringen Virus­ replikation mit 1 bis 6 % gering. Säug­ linge von Hepatitis-C-erkrankten Müt­ tern können gestillt werden. Postpartal sollten nach drei und sechs Monaten Kontrollen durchgeführt werden, die die HCV-RNS-Bestimmung beinhalten. Die Bestimmung des anti-HCV ist vor dem Alter von 15 bis 18 Monaten nicht sinnvoll, da die Mütter anti-HCV trans­ plazentar übertragen. Kommt es zu einer Infektion, kann die spontane Vi­ ruselimination bis zum Alter von vier Jahren erfolgen und liegt bei etwa 15 bis 20 %, wobei der Genotyp 3 gegen­ über dem Genotyp 1 eine etwas höhere Eliminationsrate zeigt. Eine therapeu­ tische Intervention wird nicht vor dem vollendeten 3. Lebensjahr erfolgen. Recurrent juvenile onset respiratory papillomatosis Andreas H. Groll, Infectious Disease Research Program, Center for Bone Marrow Transplantation and Department of Pediatric Hematology/Oncology, University Children’s Hospital Muenster, Albert-Schweitzer-Straße 33, 48129 Münster, E-Mail: [email protected] Juvenile recurrent respiratory papil­ lomatosis (RRP) is caused by human papillomavirus (HPV) types 6 and 11 which are responsible for more than 90 % of genital condylomata. RRP is characterized by the proliferation of benign squamous papillomas within the aerodigestive tract and has been associated with vertical transmission during vaginal delivery from an infect­ ed mother. While it is likely that the host immune system plays an impor­ tant role in the pathogenesis of HPVinduced lesions, the exact mechanisms and molecular genetic predispositions remain to be elucidated. Juvenile RRP is the most common be­ nign neoplasm of the larynx among children. Reports estimate the inci­ dence of RRP in the United States at 4.3 per 100,000 in this population with 75 % of children being diagnosed before the age of five years. RRP has an unpre­ dictable clinical course, tends to recur and spread throughout the aerodiges­ tive tract, and may undergo malignant conversion. Younger age at diagnosis is associated with more aggressive dis­ ease and the need for more frequent endoscopic surgical procedures and the need for tracheotomy. In RRP, HPV 11 is associated with more aggres­ sive disease than HPV 6 and a higher rate of malignant transformation and death (36 and 24 % vs. 0 % at 20 years in an interferon treated cohort of 42 pa­ tients). Since the vocal fold is usually the first and predominant site of papilloma le­ sions, changes in voice and stridor are the most common initial symptoms. Less common presenting symptoms in­ clude chronic cough, recurrent pneu­ monia, failure to thrive, dyspnea, dys­ phagia, or acute respiratory distress; differential diagnoses include asthma, croup, allergies, vocal nodules, or bronchitis. Extralaryngeal spread of re­ spiratory papillomata has been identi­ fied in approximately 30 % of children with RRP and may include the oral cavity, trachea, bronchi and esopha­ gus. Of note, tracheotomy appears to be the primary cause of extension to the lower airways. Lung involvement has been reported to occur in approxi­ mately 3 % of children; patients may present with recurrent bronchiectasis, pneumonia, and declining pulmonary status. The clinical course is insidious and may progress over years but even­ tually manifests as respiratory failure caused by destruction of lung paren­ chyma; malignant transformation has been reported in 16 %. © WVG When surgical therapy is needed more frequently than four times in 12 months or there is evidence of RRP outside the larynx, adjuvant medical therapy should be considered. Adju­ vant therapies that have been investi­ gated or used include antiviral agents (systemic alpha-interferon, acyclovir, ribavirin; and intralesional and sys­ temic cidofovir), chemotherapeutic agents (methotrexate), photodynamic therapies, dietary supplements, con­ trol of extra-esophageal reflux dis­ ease, and, more recently, inhibition of signal transduction from the epi­ dermal growth factor receptor (EGFR) (13-cis-retinoic acid, celecoxib, small molecules and antibodies) and HPVvaccines. Although several of these modalities have shown promise, none to date has cured RRP, and some may have serious side effects. Because RRP is so difficult to control and can cause severe morbidity and death, better therapies are needed. Perhaps more important, however, given its predomi­ nant mode of transmission, universal or near-universal use of an HPV vac­ cine with activity against HPV 6 and 11 may greatly reduce the global burden of the disease. Konnatale und neonatale Tuberkulose Andreas Müller, Universitätsklinikum Bonn, Zentrum für Kinderheilkunde, Abteilung Neonatologie, Spezielle Päd­ iatrische Infektiologie, Adenauerallee 119, 53113 Bonn, E-Mail: [email protected] Das klinische Bild der Tuberkulose (TBC) in der Schwangerschaft unterscheidet sich nicht von dem nicht schwangerer Individuen. Bei der Übertragung von Mycobacterium tuberculosis von der Mutter auf den Feten bzw. das Neu­ geborene spielt der maternale Fokus der Infektion eine wesentliche Rolle. Die TBC des Neugeborenen kann kon­ natal über folgende Wege übertragen werden: 1. über die infizierte Plazenta via Umbilikalvene und 2. durch Aspi­ ration bzw. Inhalation von infizierten Fruchtwasser. Bei einer tuberkulösen Zervizitis kann das Neugeborene durch direkten Kontakt mit dem Geburts­ kanal während des Geburtsvorgangs infiziert werden. Postnatal erfolgt die Übertragung der Mykobakterien am häufigsten über Tröpfcheninfektion entweder durch Inhalation oder Inges­ © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 49 Berichte & Abstracts tion infektiöser Tröpfchen. Eine eher untergeordnete Rolle spielt die Inge­ stion infizierter Muttermilch oder die Kontamination verletzter Haut oder Schleimhaut. Kriterien für eine konna­ tale TBC sind tuberkulöse Läsionen in der ersten Lebenswoche, ein primärer hepatischer Komplex bzw. eine verkä­ sende Läsion in der Leber oder eine In­ fektion der Plazenta und/oder des ma­ ternalen Genitaltraktes. Die Diagnose der konnatalen und neonatalen TBC ist oft schwierig. Am häufigsten im­ ponieren die Neugeborenen durch ein sepsisartiges Krankheitsbild mit Hepa­ tosplenomegalie. Häufig besteht eine pulmonale Symptomatik, die in voller Ausprägung einem Atemnotsyndrom des Neugeborenen gleichen kann. Bei nicht ausreichendem Ansprechen auf eine empirische Antibiotikatherapie sollte bei diesen Kindern auch eine Tu­ berkulose in die Differenzialdiagnose einbezogen werden. Die Diagnose er­ folgt durch den direkten Nachweis von säurefesten Stäbchenbakterien in Kör­ perflüssigkeiten beispielsweise Magen­ sekret, Trachealsekret, Knochenmark oder Biopsien aus den betroffenen Organen. Bei der Therapie werden die üblichen Medikamente verwendet. Hierbei ist zu beachten, dass keine Stu­ dien zur Pharmakokinetik dieser Medi­ kamente bei früh- und reifgeborenen Kindern existieren. Hauptbestandteil einer Kombinationstherapie ist Isoni­ azid, da dieses Medikament eine gute Gewebsgängigkeit aufweist und im Allgemeinen gut vertragen wird. Bei frühzeitiger Diagnose und effektiver Therapie hat die konnatale und neona­ tale TBC heute eine gute Prognose. Influenza bei jungen Säuglingen Arne Simon, Zentrum für Kinderheilkunde, Adenauerallee 119, 53113 Bonn, E-Mail: [email protected] Die Pandemie durch das neue Grippe­ virus Influenza A H1N1 09 hat erneut die Frage aufgeworfen, welche pädiat­ rischen Patienten besonders gefähr­ det sind, im Verlauf einer Influenza schwerwiegende Komplikationen zu erleiden oder an einer Influenza akut zu versterben [1]. In diesem Referat soll der Frage nach­ gegangen werden, ob Neugeborene und Säuglinge in den ersten sechs Le­ bensmonaten zu diesen Hochrisikopo­ pulationen gehören [2]. Da insbesondere im dritten Trime­ non der Schwangerschaft das Risiko einer Influenza-assoziierten Hospita­ lisierung und Influenza-assoziierter schwerer Komplikationen erhöht ist [3], ergab sich auch im Verlauf der H1N109-Pandemie im Einzelfall die Aufga­ be des peripartalen Managements bei Neugeborenen, deren Mutter kurz vor der Geburt an einer H1N1-09-Influenza erkrankt war. Weitere in diesem Kontext relevante Themen sind die Impfung von Schwangeren (nach STIKO-Empfehlung nicht mit dem Squalen-adjuvantierten Impf­ stoff Pandemrix®) und der daraus resultierende Nestschutz für das Neugeborene, die Impfung von Frühgeborenen oder von Säuglingen vor dem 6. Le­ bensmonat und die Behandlung von Neugeborenen und Säuglingen mit Oseltamivir nach der aufgrund der Pandemie aktualisierten EMA-Zulassung. Neben den international publizierten Daten werden auch Ergebnisse eines eigenen Erfassungsinstruments zur Dokumentation stationär behandelter Influenzapatienten dargestellt. © WVG Literatur 1. Centers for Disease Control and Prevention (CDC). Surveillance for pediatric deaths as­ sociated with 2009 pandemic influenza A (H1N1) virus infection – United States, April– August 2009. MMWR Morb Mortal Wkly Rep 2009;58:941–-7. 2. Bueving HJ, van der Wouden JC, Berger MY, Thomas S. Incidence of influenza and associa­ ted illness in children aged 0–19 years: a syste­ matic review. Rev Med Virol 2005;15:383–91. 3. Jamieson DJ, Honein MA, Rasmussen SA, et al. H1N1 2009 influenza virus infection dur­ ing pregnancy in the USA. Lancet 2009;374: 451–8. Freie Beiträge Management einer alveolären Echinokokkose während der Schwangerschaft Beate Grüner, Kerstin Wahlers, Peter Kern, Sektion Infektiologie und Klinische Immunologie, Klinik für Innere Medizin III, Universitätsklinikum Ulm, AlbertEinstein-Allee 23, 89081 Ulm, E-Mail: beate.gruner@ uniklinik-ulm.de Die alveoläre Echinokokkose bei Echi­ nococcus-multilocularis-Infektion ist die gefährlichste Parasitose Mitteleu­ ropas. Sie manifestiert sich primär in der Leber, ist charakterisiert durch ein invasives, tumorartiges Wachstum und die Letalität ohne Behandlung wird mit > 90 % in zehn Jahren angegeben. Die Erkrankung verläuft meist über Jahre asymptomatisch und wird häufig als Zufallsbefund im Ultraschall entdeckt. Da das Durchschnittsalter bei Erstdia­ gnose etwa 55 Jahre beträgt, besteht naturgemäß eine seltene Koinzidenz von Schwangerschaft und alveolärer Echinokokkose. Wir beschreiben die Erstdiagnose einer alveolären Echinokokkose bei einer 35-jährigen Frau in der 14. SSW. Bei Oberbauchschmerzen erfolgte eine Sonographie mit Nachweis einer Leberraumforderung links, die Echino­ kokken-Serologie war positiv. Bei der Vorstellung ergaben sich fol­ gende Probleme für das weitere Ma­ nagement: 1.Kann die Schwangerschaft ausgetra­ gen werden? 2.Welche Therapiemöglichkeiten be­ stehen (Benzimidazol-Therapie/Ope­ ration/Watch and Wait)? 3.Welcher Entbindungsmodus kommt in Frage? Auf eine Benzimidazol-Therapie wurde bei möglichen teratogenen Effekten verzichtet. Bei in der Bildgebung beste­ hendem Kontakt der Läsion zur Pfort­ ader bestand keine Möglichkeit einer kurativen Resektion. Daher erfolgten regelmäßige sonografische Kontrol­ len und einmalig ein Leber-MRT ohne Nachweis einer Größenprogression. Termingerecht wurde ein gesunder Sohn vaginal entbunden. Nach dem Abstillen erfolgte ein FDG-PET-CT mit Nachweis eines vitalen parasitären Leberherdes. Daraufhin erfolgte die Einleitung einer antihelminthischen © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 50 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 Berichte & Abstracts Therapie mit Eskazole® (Albendazol), welches bislang gut toleriert wird. Im Verlauf soll die Möglichkeit einer kura­ tiven Resektion re-evaluiert werden. Molekulare Charakterisierung von Enterokokken-Isolaten aus einer Neugeborenenstation einer Kinderklinik Guido Werner1, Carola Fleige1, Ingo Klare1, Wolfgang Witte1, Henning Böhme2 1 Robert Koch-Institut Wernigerode, Burgstraße 37, 38855 Wernigerode; E-Mail: [email protected] 2 Kinderklinik Harz-Klinikum Wernigerode-Blankenburg GmbH, Steinbergstr., 38855 Wernigerode Zielstellung Analyse von 18 Enterokokkenisola­ ten von 15 neonaten Patienten, die in einem epidemiologischen Zusammen­ hang standen mit Verdacht auf Multi­ resistenz. Material und Methoden Die Isolate wurden nach primärdia­ gnostischer Analyse an das Robert Koch-Institut Wernigerode für eine weitere Charakterisierung und Typi­ sierung gesandt. Antimikrobielle Re­ sistenzen wurden durch Bestimmung der MHK im Mikrobouillonverdün­ nungstest ermittelt, die Spezies wurde biochemisch bestätigt. Ausgewählte Marker wurden mittels PCR amplifi­ ziert. Verwandtschaft der Isolate wurde mittels MLST (Multi-Locus-Sequenzty­ pisierung) und Makrorestriktionsana­ lyse in der PFGE (Pulsfeld-Gelelektro­ phorese) analysiert. Ergebnisse Neun der eingesandten Isolate waren E. faecalis und die anderen neun E. fae­ cium. Multiresistenzphänotypen lie­ ßen sich nicht bestätigen; 17/18 der Isolate zeigten Empfindlichkeit gegen Aminoglykoside (keine Hochresistenz gegen STR, GEN), Ampicillin und Gly­ kopeptide (VAN, TPL) als den therapeu­ tisch wichtigsten Klassen. Eine Aus­ nahme bildete ein E.-faecium-Isolat mit Ampicillin- und Hochresistenz gegen Streptomycin und Ciprofloxacin. Eine Verwandtschaftsanalyse mittels PFGE zeigte Cluster von 3 bis 4 eng verwand­ ten Isolaten, die jeweils auf nosokomi­ © WVG ale Verbreitung schließen lassen. Zwei E.-faecalis-Isolate ergaben in der MLSTAnalyse den Sequenztyp ST40 und in der PFGE-Analyse Verwandtschaft mit E.-faecalis-ST40-Isolaten aus unter an­ deren auch invasiven Infektionen bei Erwachsenen (Bakteriämie). Das ein­ zige multiresistente E.-faecium-Isolat ergab in der MLST-Analyse Sequenz­ typ ST192 und entspricht somit einem deutschlandweit verbreiteten Epide­ mietyp; in der PFGE-Analyse gruppiert dieses Isolat zusammen mit anderen, multiresistenten E.-faecium-Blutkul­ turisolaten aus adulten Patienten. Fazit Obwohl E. faecalis zu den Erstbesied­ lern bei Neugeborenen zu zählen ist, waren die hier analysierten Isolate zu­ mindest teilweise keine klassischen Be­ siedlungsenterokokken. Eine Verbrei­ tung von E. faecalis und E. faecium, welche eng verwandt mit Isolaten aus septischen Verläufen bei erwachsenen Patienten sind, wenn auch hier nur aus Stuhlproben von Neugeborenen isoliert, sollte besonders beobachtet werden. PEG-Mitteilungen Wolfgang-Stille-Preis ausgeschrieben Der Wissenschaftspreis der Paul-Ehrlich-Gesellschaft für Chemotherapie (PEG) ist jetzt zum sechsten Mal ausge­ schrieben worden. Er wird zur Erinnerung an den Infekti­ ologen und früheren Vorsitzenden der PEG, Professor Dr. Wolfgang Stille (1935–2004), verliehen. Der Wolfgang-Stille-Preis wird alle zwei Jahre für eine he­ rausragende Arbeit auf dem Gebiet der antimikrobiellen Therapie vergeben. Der Preis, der mit 10 000 Euro dotiert ist, wird von der Pfizer Pharma GmbH gestiftet. An der Be­ werbung können sich Wissenschaftler(innen) beteiligen, die zum Zeitpunkt der Bewerbung nicht älter als 45 Jahre sind. Der Preis kann an eine einzelne Person oder eine Ar­ beitsgruppe vergeben werden. Die Preisverleihung erfolgt im Rahmen der 22. Jahresta­ gung der PEG am 8. Oktober 2010 in Bonn. Die Bewerbungs­ kriterien können im Mitgliederbereich der PEG-Website (www.p-e-g.org) in der Rubrik Stipendien/Preise eingesehen werden. Bewerber können ihre Unterlagen bis zum 30. Juni 2010 bei der Geschäftsstelle der PEG einreichen: Paul-Ehrlich-Gesellschaft für Chemotherapie e. V., z. Hd. Herrn Dr. Michael Kresken, Campus Hochschule BonnRhein-Sieg, Von-Liebig-Straße 20, 53359 Rheinbach © Wissenschaftliche Verlagsgesellschaft Stuttgart 2010 Chemotherapie Journal 19. Jahrgang · Heft 2 · 2010 51