Pharma-Kurs Script SS13
Werbung

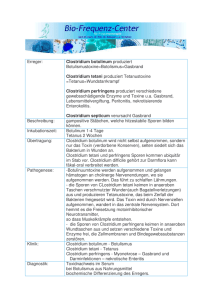
Medizinische Mikrobiologie Pharmazie Kurs K. Zimmermann FLI f. Medizin. Mikrobiologie Methoden zum Nachweis von Mikroorganismen • Mikroskopie – Lichtmikroskopie • Nativpräparate • Färbungen – Übersichtsfärbungen – Differentialfärbungen • • • • • Methylenblau Gram Ziehl-Neelsen – Elektronenmikroskopie Kultur Serologische Methoden Molekularbiologische Methoden Zellkultur Tierversuch Mikroskopischer Nachweis von Mikroorganismen Lichtmikroskopie - Nativpräparate: ungefärbt - Übersichtsfärbungen (ein Farbstoff) Darstellung von Strukturen - Differentialfärbungen (Färbung/Gegenfärbung) Zellwand: Gram-F., Ziehl-Neelsen-F. Kapsel / Sporen / Geißeln Elektronenmikroskopie Ablauf Gramfärbung 1. Lufttrocknen u. Fixieren (Hitze, Ethanol) 2. Färben mit Gentianaviolett Gentianaviolett-PhenolAmmoniumoxalatlösung anschließend spülen (H2O) 3. Beizen (Lugolsche Lösung) Jod-Kaliumjodid-Lösung anschließend spülen (H2O) 4. Entfärben mit 96%igem Alkohol anschließend spülen (H2O) 5. Gegenfärbung mit Fuchsin Fuchsin-Phenolrot-Lösung anschließend spülen (H2O) Vermehrung von Mikroorganismen (Mikroorganismenkultur) Nährmedien / Kulturmedien: zur Kultivierung von Mikroorganismen dienende Substrate, die alle zum Wachstum erforderlichen Nährstoffe enthalten - synthetische Medien ↔ komplexe Medien - feste Medien ↔ flüssige Medien - Universalmedien (Komplett-, Vollmedien) ↔ Spezialmedien Nährmedien zur Kultivierung von Mikroorganismen Nährmedium Charakterisierung Komplexe Medien bestehen aus Nährstoffen deren Inhalte nicht chemisch bestimmt sind, wie zum Beispiel Rindfleisch-Extrakt, Caseinhydrolysat, Hefeextrakt (z.B. Blutagar) Synthetische Medien (def. Medien) beinhalten eine genau bestimmte Anzahl und Menge an Inhaltsstoffen, die chemisch gereinigt werden, um Spuren von anderen Stoffen auszuschließen (z.B. Amies-Medium) Minimalmedien Sonderform der definierten Medien, beinhalten nur die minimal nötigen Stoffe für das Wachstum der zu kultivierenden Mikroorganismen Flüssige Medien Nährbouillon, Nährbrühe (z.B. Fleischwasser) Feste Medien Nährboden (Nährbouillon mit zugesetzten Verfestigungsmitteln, z.B. Gelatine, Agar) Nährmedien zur Kultivierung von Mikroorganismen Agar (Agar-Agar): ● gelierfähiges Polysaccharid, vorwiegend Polygalaktane. Gewinnung hauptsächlich in Ostasien aus verschiedenen Meeres-Rotalgen (Gelidium, Gracilaria). ● Nähragar wird beim Erhitzen ab 95°C flüssig und erst arrt ab 45°C. ● Agar wird von Bakterien nicht abgebaut. Vorteil gegenüber Nährbouillon: auf festen (Agar-)Nährböden können Reinkulturen von Bakterien isoliert werden. Blutagar: zu 100 ml verflüssigtem Nähragar (auf 50°C abgekühlt) 5-10 ml defibriniertes Blut geben, mischen und in Petrischalen ausgiessen. Nährmedien zur Kultivierung von Mikroorganismen Nährmedium Charakterisierung Universalmedien (Komplettmedien) komplexe oder synthetische Nährmedien, auf der eine Vielzahl verschiedener Mikroorganismen wachsen (z.B. Blutagar) Spezialmedien Elektivmedien Medien, die das Wachstum bestimmter Bakterien fördern (z.B Mannit-Kochsalz-Agar zur Anzucht von Staphylococcus aureus) Selektivmedien Spezialmedien, enthalten Hemmstoffe, die nur das Wachstum bestimmter Mikroorganismen zulassen (z.B. Tinsdale-Agar zur Anzucht von Korynebakterien) Differentialmedien (Indikatormedien) Spezialmedien, die eine Unterscheidung verschiedener Mikroorganismen ermöglicht. Sie zeigen bestimmte Stoffwechselleistungen an (z.B. MacConkey-Agar) Nährböden • Grundbestandteile Agar-Agar Seealgen, getrocknete Kolloidsubstanz fester Nährboden = 1-2% Peptone eiweißhaltiges Material, Fleisch, Casein, Sojabohnen, enzymat. Hydrolyse (Polypeptid, Dipeptid, Aminosäure) völlig löslich in H2O pH 5-7 Fleischextrakt Hefeextrakt mageres Rindfleisch autolysierte Hefe (Vit. B-Komplex) • Spezielle Nährsubstrate Serum 10% Blut 5-10% Schaf defibriniert Kochblut (hohe Ansprüche) 5-10 min 75-80°C MacConkey-Agar = Selektivnährboden (kein Blut) Eiernährboden ( Malachitgrün + Ei-emulsion) Differenzierung grampositiver Kokken Katalase positiv Staphylokokken negativ Streptokokken Koagulase positiv St. aureus Hämolyse negativ α KNS VS β (γ) anhämol.Str. (ß)HS Katalase-Reaktion Das eisenporphyrinhaltige Enzym Katalase wird von den meisten oxidasepositiven aeroben und fakutativ anaeroben Spezies - mit der wichtigsten Ausnahme STREPTOKOKKEN gebildet. Es wandelt im Energiestoffwechsel gebildetes Wasserstoffperoxid in Wasser und molekularen Sauerstoff um. Koagulase-Reaktion Freie Koagulase (extrazelluläres Enzym) bindet an Prothrombin und aktiviert die Entstehung von Fibrin aus Fibrinogen. Clumping Faktor (zellwandgebundenes Protein) = Fibrinogenrezeptor Differenzierung von Staphylococus aureus und Koagulase-negativen Staphylokokken (KNS) durch die Koagulase-Reaktion gebildetes Fibringerinnsel in einem Reagenzglas Koagulase-Reaktion Latexpartikel sind mit Fibrinogen und IgG beladen Fibrinausfällung durch Koagulase und Clumping factor Protein A von Staph. aureus bindet an den Fc Teil von Immunglobulinen, welche dann nicht mehr an den Fc-Rezeptor von Phagozyten binden Ausserdem sind die Latexpartikel mit spezifischen Antikörpern gegen die Kapselpolysaccharide von Staph. aureus beladen. Durch diese Mehrfachbeladung besteht die Möglichkeit, alle Stämme zu erfassen. Oxidase-Reaktion • Nachweis von Cytochromen aus der Atmungskette, die Sauerstoff als terminalen Elektronenakzeptor im Energiestoffwechsel verwenden • Cytochrome ermöglichen den Eintritt von atmosphärischen Sauerstoff in den Zellstoffwechsel, indem sie durch molekularen Sauerstoff oxydiert werden • in der Zelle erfolgt die enzymatische Reduktion der Cytochrome • künstliche Substrate (N,N-Dimethyl-1,4-diaminobenzol) bewirken die Reduktion des Cytochromoxidase-Systems (d.h. sie werden oxydiert) • Substrate in Abhängigkeit vom Reduktions-/Oxidationszustand farblos bzw. gefärbt Gramnegative Stäbchen: Bsp Enterobakterien: biochemische Reaktionen Kohlenhydratspaltung Abbau von Kohlenhydraten (Glucose, Lactose, Rhamnose) Säure (18 – 24 h) Indikator: Bromthymolblau Farbumschlag blaugrün (negativ) zu gelb/orange (positiv) Citrat-Abbau C-Quelle: Citrat, N-Quelle: Ammoniumsalz (Grundlage für Energie- + Baustoffwechsel) Alkalisierung Indikator: Bromthymolblau Farbumschlag grün (negativ) zu blau (positiv) H2S-Bildung - aus Eiweißkörpern bzw. S-haltigen Aminosäuren (insbes. Cystein) - aus S-haltigen, (an)organischen Zusätzen [(Thio-)Sulfaten, Sulfiten, Cystein] Indikator: Metallsalz (insbes. Ferrochlorid + Bleiacetat) Sulfid (schwarzer Niederschlag) Urease-Nachweis / Indol-Bildung Indikator: Phenolrot (durch Säurebildung aus Glucose-Abbau gelb = negativ) - Urease: Harnstoff Ammoniak + CO2 positiv (rotviolett) - Indol: Eiweißabbau (Tryptophan) Indol (Nachweis mit Kovacs Reagenz, roter Ring) - Beweglichkeit: Wachstum außerhalb des Impfstichs (wolkenartige Trübung) im Agar Ornithin-Dekarboxylierung L-Ornithin (L-Lysin u.a) [pH niedrig] Amine + CO2 (pH-Anstieg) Indikator: Bromkresolpurpur Farbumschlag von farblos/gelblich (negativ) zu violett (positiv) Mikroflora im Menschen Standort Keimzahl (pro ml o. g) anaerobe Bakterien aerobe Bakterien Sproßpilze Zungenoberfläche 108 – 109 (Speichel) 108 107 102 Zahnoberfläche 1010 - 1011 1011 108 102 (Plaquesubstanz) Zahnfleischtasche 1012 - 1013 1012 108 102 Magen 104 – 105 104 104 103 oberer Dünndarm 104 – 105 104 103 102 unterer Dünndarm 107 – 108 107 105 103 Dickdarm 1011 – 1012 1011 108 103 Mikroflora im Menschen Standort Aerobier Anaerobier grampositiv gramnegativ grampositiv gramnegativ Zungenoberfläche Str. salivarius Str. mitis Str. sanguis Micrococcus, Staphylococcus Corynebacterium Neisseria Vibrio Haemophilus Enterobacteriaceae Candida u.a. Peptococcus Peptostreptococcus Propionibacterium Actinomyces Veillonella Prev. melaninogenica Prev. oralis Wangenschleimhaut Str. sanguis Str. salivarius Str. mitis Zahnoberfläche Str. mutans Str. sanguis Neisseria Hämophilus Mycoplasma Protozoa (Entamoeba gingivalis Trichomonas tenax) Peptostreptococcus Actinomyces Nocardia Lactobacillus Veillonella Fusobacterium Leptotrichia Prev. oralis Bact. corrodens Propionibacterium Sulcus gingivalis Str. sanguis Str. mitis S. epidermidis Micrococcus Mycoplasma Entamoeba gingivalis Trichomonas tenax Desinfektion heißt, einen Gegenstand in den Zustand versetzen, in dem er nicht mehr infizieren kann Wirksamkeit abhängig von: • Temperatur • Einwirkungszeit • Konzentration und Art des Wirkstoffes • weitere Faktoren: inkorporierte MO (Ausscheidungen, Blut) schlecht o. nicht erreichbar Desinfektionsverfahren Physikalisch UV-Strahlen Filtration Heißwasser 75 - 95°C 10 - 30 min thermische Methoden strömender Dampf 100°C 10 - 30 min Niederdruckdampf 105°C, Unterdruck 1 - 15 min Chemisch Alkohole / Aldehyde / Phenole und Derivate / Metalle / Halogene / Oberflächenaktive Substanzen / Oxidantien Chemothermisch Kombination von feuchter Hitze (60°C) und chemischen Desinfektionsmitteln bei thermolabilen Werkstoffen Wirksamkeit von Dekontaminationsmaßnahmen Reinigung: mechanische Entfernung Reduktion der Keimzahl (2-3 log-Stufen = 99 – 99,9 %) Antiseptik: Inaktivierung von MO auf lebendem Gewebe Desinfektion: Reduktion der Keimzahl (5 log-Stufen = 99,999 %) Inaktivierung krankheitserrregender MO Entkeimungsfiltration: Abtrennung lebender und toter MO, nicht aller Viren Sterilisation: Inaktivierung aller MO inklusive aller Sporen und Viren Keimzahlreduktion mind. 6 log-Stufen Sporenbildende Bakterien grampositive Stäbchen aerob: anaerob: Bacillus Clostridium Bakteriensporen stoffwechselinaktive Dauerformen hohe Umweltresistenz Artspezifische Sporenform und –lokalisation Sporenbildung (Sporogenese) durch Nährstoff-Mangel induziert Sporenkeimung: Aktivierung, Keimung, Auswachsen Bacillus: aerobe sporenbildende Stäbchen Bedeutung: Toxinbildner (Lebensmittel, Bioterrorismus), Antibiotikaproduzent, Bioindikator (Phenylketonurienachweis, Sterilisatoren), Proteasebildner (Waschmittel) Bacillus subtilis Bacillus cereus Clostridium: anaerobe sporenbildende Stäbchen verschiedene Spezies verursachen Krankheiten durch die Produktion von potenten Protein-Ektotoxinen Wichtige Humanpathogene Spezies: A) Clostridium botulinum B) Clostridium tetani C) Clostridium perfringens D) Clostridium difficile Auswertung Sporenbildner Spezies Wachstum Makromorphologie (Blutagar) Mikromorphologie flache trockene Kolonien, unregelmäßiger Rand ovale zentrale bis subterminale Spore terminale runde Spore (Trommelschläger) aerob anaerob Bacillus subtilis + Clostridium tetani + durchsichtig, flach, stumpfe Oberfläche, unregelmäßiger Rand mit Ausläufern Clostridium perfringens + flach, matt glänzend, unregelmäßiger große grampositive Rand, Doppelzonenhämolyse Stäbchen mit abgerundeten Enden Clostridium difficile + Weißlich, flache Kolonien mit unregelmäßigem Rand (Geruch nach Stalldung) Clostridium botulinum + schlanke Stäbchen z.T. mit ovaler subterminaler Spore subterminale ovale Spore (Tennisschläger) Wichtige Erreger von Humanmykosen (Auswahl) Erreger Reservoir Dermatophyten Mykose/häufige Lokalisation Dermatophytose Haut, Haare, Nägel Trichophyton spp. Microsporum spp. Epidermophyton Mensch, Tier, Erdboden Hefen Candida Mensch, Tier, Nahrungsmittel Candidose Haut, Schleimhaut, andere Organe Cryptococcus Vogelkot Cryptococcose/ZNS Schimmelpilze ubiquitär Aspergillose Lunge und andere Organe Mucormykose Verletzungsmykosen Pflanzen, Erdboden Primäre Systemmykosen Aspergillus spp. Zygomyceten (Mucor u.a.) Dematiaceae Dimorphe Pilze (außereuropäische Mykosen zB. Histoplasma Dermatophyten Keratinophile Pilze, Einteilung ungeschlechtliche FortpflanzungsOrgane (Mikro-und Makrokonidien) geophil zoophil anthropophil Erde Mensch, Kontamination selten Infektion Tier Mensch, intensiver Fellkontakt Mensch Mensch oder indirekt Pathogenese: Sporen Keratinozyten Auskeimen zu Hyphen fungistatische Lipide und Proteine können Eindringen verhindern Infektion gesteigerte Desquamation (Schuppung) Hyperkeratose Klinik Tinea = Sammelbegriff für oberflächliche Dermatomykose unabhängig von Spezies T.pedis (Fuß) T.capitis (Kopf) T.inguinalis (in der Leistenbeuge) T.corporis (Körper) T.barbae (Bart) Therapie: lokale Applikation (Salben) Azole ausgedehnte Dermatosen (Haut, Nagel, Haare) systemische Therapie Griseofulvin, Itraconazol 6 Monate (Finger) 12 Monate (Fuß) Labordiagnostik Virus-assoziierter Erkrankungen direkter Virusnachweis mit Virusvermehrung Zellkultur Brutei Versuchstier ohne Virusvermehrung Mikroskopie (Einschluß-K.) Elektronenmikroskopie Antigen virale Nukleinsäure indirekter Virusnachweis Immunantwort des Wirtes virus-spezifische Antikörper Methoden zum Virusnachweis HA HHT ELISA IBL FAT CPE NAT Hämagglutination Hämagglutinationshemmung Enzymimmunoassay Immunoblot Fluoreszenzantikörpertechnik zytopath.Effekt in der Zellkultur Nukleinsäurenachweis RT-PCR, n-PCR Real-time PCR Sequenzierung Nukleotid-alignment direkt indirekt x x x x x x x x x x Polymerasekettenreaktion Nukleinsäureextraktion aus Probe Cave: RNA-Viren Reverse Transcription in c-DNA Amplifikation DNA, Primer, dNTP,Taq-Polymerase Denaturing der Ziel-DNA Einzelstränge Temperatursenkung Anlagerung der Primer = Start der Neusynthese Temperaturanstieg Sythese-Stop erneute Denaturierung X-Zyklen (25 – 50 Kettenreaktion) Cave: Störfaktoren Heparin, Proteinasen, Harnstoff, Phenol, Paraffin, Salze Detection der Amplifikate a) Längenscreening im Gel Ethidiumbromid klassische PCR b) Fluoreszenzsignale messen markierte Oligonukleotide Real-time PCR Real-time PCR nach TaqManTM Prinzip Amplifikation in einem Reaktionsgefäß Detektion Basis: 5‘Exonuklease-Aktivität der AmpliTaqDNA-Polymerase spezielle fluorogene Sonde = Oligonukleotid markiert mit Reporter-Farbstoff (5‘Ende) Quencher-Farbstoff (3‘Ende) Zellbiologische Verfahren Virusisolierung Versuchstier embryoniertes Hühnerei Zellkultur (monolayer) a) primär (aus Organen angezüchtet, diploid) b) diploid = Zell-Stamm (2.-50. Passage, begrenzte Lebensdauer) c) Zell-Linie = permanent (unbegrenzte Passagenzahl, tri-, tetra-, polyploid, oft tumorbildend) Antikörper-Nachweise Neutralisationstest Hämagglutinations-Hemmtest Komplementbindungs-Reaktion Immunfluoreszenztest ELISA Immunoblot Quantitativ Serumtitration Titer Einpunktverfahren(ELISA) ELISA (Enzyme linked immuno sorbent assay) Detektions-Antikörper (Enzym-markiert) Enzym setzt farbloses Substrat um nachzuweisende Komponente aus Patientenmaterial (AK / Ag) adsorbierter Nachweisparameter (Ag / AK) es entsteht ein lösliches farbiges Produkt OD-Messung Beurteilung von Antikörperbestimmung Akute Infektion Cave: IgM Antikörper Nachweis in einer Probe persistierende Virusinfektionen bei Aktivierung erneut IgM-Bildung möglich Intrauterine Infektion IgM im Serum des Embryo ab 19.SSW selbständige IgM Bildung keine Placentapassage NT und HHT Differenzierung: Antikörperanstieg 4-fach in zwei Proben, Abstand 14 Tage akute Phase, postakute Phase Western-Blot = Immunoblot Auftrennung der Virusproteine Molekulargewicht Nitrozellulose Patientenantikörper enzymgekoppelter Anti-Human IgG Antikörper farbloses Substrat Umwandlung in unlöslichen farbigen Niederschlag