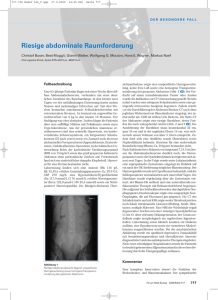
Fluoreszenzzytologie der Harnblase
Werbung

Urologe [A] 2001 · 40: 217–221 © Springer-Verlag 2001 Originalien S.Tauber · B. Liedl · P. Schneede · F. Ließmann · R.Waidelich · A. Hofstetter Urologische Klinik und Poliklinik,LMU München Fluoreszenzzytologie der Harnblase Zusammenfassung Die 5-Aminolävulinsäure-induzierte Fluoreszenzendoskopie empfiehlt sich als exzellente Methode zum Nachweis schwer erkennbarer Karzinome und des Carcinoma in situ der Harnblase.Aufbauend auf den tumorassoziierten Fluoreszenzeigenschaften von Protoporphyrin IX sollte der Wert einer fluoreszenzmikroskopischen Beurteilung zytologischer Präparate evaluiert werden.Eine Untersuchung an 27 Patienten mit Verdacht auf ein Urothelkarzinom ergab in der Fluoreszenzendoskopie und in der Fluoreszenzmikroskopie eine exakte Übereinstimmung des Fluoreszenzverhaltens tumorsuspekter Urothelzellen und Zellgruppen. Somit konnten wir in der Pilotstudie mit der Fluoreszenzmikroskopie Blasentumoren unterschiedlicher Differenzierungsgrade mit hoher Sensitivität diagnostizieren. In diesem Verfahren sehen wir eine sinnvolle Ergänzung der Standardzytologie, da sich insbesondere die Beurteilung von hochdifferenzierten Blasentumoren und flachen prämalignen Läsionen ausschließlich in der Fluoreszenzzytologie als unproblematisch erwies. Schlüsselwörter Zytologie · Photodynamische Diagnostik · Fluoreszenz · Urothelkarzinom M it einer Inzidenz von 17–19 Neuerkrankungen/Jahr, bezogen auf 100.000 Menschen, ist das Harnblasenkarzinom der zweithäufigste Tumor des Urogenitaltrakts, wobei die Tendenz steigend ist. Mit 95% der Blasentumoren stellen Urothelkarzinome die größte Gruppe dar. Seltener finden sich Plattenepithelkarzinome, Adenokarzinome, Sarkome und Metastasen anderer Primärtumoren. Die Standardmethode der Blasentumordiagnostik ist die Zystoskopie. Hierdurch lassen sich insbesondere die exophytischen und soliden Tumoren gut erkennen. Flache Schleimhautveränderungen, wie das Carcinoma in situ, werden dagegen häufiger übersehen. Zur Erfassung dieser problematischen Tumoren werden die Zytologie, unterschiedliche immunologische Labortestverfahren und die durch 5-Aminolävulinsäure-induzierte Fluoreszenzendoskopie (AFE) ergänzend eingesetzt [6, 7]. Für die Standardzytologie wird zur Erkennung von hoch-, mittel- und entdifferenzierten Urothelkarzinomen eine Sensitivität von 50%, 65–80% bzw. 85–90% angegeben [5, 12, 14]. Die zytologische Beurteilung hochdifferenzierter Tumoren wird durch Harnwegsinfektionen, Harnsteinleiden und andere Störfaktoren erschwert, wodurch sich die niedrige Sensitivität und Spezifität der Standardzytologie erklärt. Die derzeit angebotenen Tumormarker zum Karzinomnachweis aus dem Urin, z. B. der Bard- oder der NMP22-Test, haben mit einer Sensitivität von etwa 56% und einer Spezifität von etwa 67% bei der Diagnostik unterschiedlich differenzierter Blasentumoren bislang enttäuscht [10, 16]. Insofern sind diese Labortestverfahren keine sinnvolle und anerkannte Ergänzung der Zystoskopie und Zytologie. Unabhängig vom Differenzierungsgrad der Blasentumoren werden dagegen bei der AFE-Tumoren mit einer Sensitivität von 97% erkannt [7], (Tabelle 1) Die bislang mit keiner anderen Methode erreichte Sensitivität bei der Diagnostik von Urothelkarzinomen war die Grundlage für die Entwicklung einer fluoreszenzgestützten Zytologie. Methodik Für die endoskopische Fluoreszenzdiagnostik zum Nachweis von Urothelkarzinomen der Harnblase wurde den Patienten etwa 1–2 h vor der Zystoskopie mittels sterilem Einmalkatheter 50 ml 3%ige, mit Natriummonohydrogenphosphat-gepufferte (1,4%) 5-Aminolävulinsäure (5-ALA) in die entleerte Blase instilliert. Wir verwendeten das sterile Lyophilisat der Fa. medac (Hamburg). Fluoreszenzendoskopie Das Prinzip der Fluoreszenzendoskopie (AFE) beruht darauf, dass die 5-Aminolävulinsäure im Hämzellstoffwechsel in Protoporphyrin IX umgewandelt wird. Dieses gibt bei einer Fluoreszenzanre- Dr. S.Tauber Urologische Klinik und Poliklinik, LMU München, Marchioninistraße 15, 81377 München Der Urologe [A] 3•2001 | 217 Urologe [A] 2001 · 40: 217–221 © Springer-Verlag 2001 Originalien S.Tauber · B. Liedl · P. Schneede F. Ließmann · R.Waidelich · A. Hofstetter Fluorescencezytology of the urinary bladder Abstract 5-aminolevulinic acid induced fluorescence cystoscopy is invaluable for diagnosing urinary bladder carcinoma and its precursors. Because neoplastic cells of the urinary bladder possess striking fluorescent properties due to protoporphyrin IX, we initiated a study to evaluate the use of fluorescence microscopy in urinary sediments.In 27 patients suspected of having bladder carcinomas, we instilled 5-aminolevulinic acid into their urinary bladders before transurethral therapy and compared thereafter our studies of standard cytological sediments with those made under fluorescence microscopy. The results of fluorescence cystoscopy and those using urinary sediments for neoplastic cells under fluorescence microscopy correlated extremely well.In this pilot study using fluorescence microscopy, we found that we could diagnose with precision urinary neoplasms of different grades of differentiation.Accordingly, we regard fluorescence microscopy as a valuable complement for standard urinary cytology, especially since with fluorescence microscopy we can readily recognize fluorescing cells of highly differentiated urinary tumors and flat premalignant dysplasias. Keywords Cytological sediments · Photodetection · fluorescence · Transitional cell carcinoma Abb.1 Zytologische Präparate mit entdifferenzierten Tumorzellen der Harnblase bei 100-facher Vergrößerung. Das Bild zeigt den Befund bei Fluoreszenzanregung gung mit energiereichem, blauviolettem Licht mit einer Wellenlänge um 400 nm (D-LIGHT, Fa. Karl Storz, Tuttlingen) eine charakteristische Rotfluoreszenz mit einer Wellenlänge um 630–700 nm ab. Die Fluoreszenz kann mit dem bloßen Auge unter Verwendung eines gelben Langpassfilters, welcher in das Okular der Beobachtungsoptik des Standardzystoskopes eingebaut ist, optisch erkannt werden [1, 8]. Vor der endoskopischen Tumorbehandlung wurde den Patienten zur Standard- und Fluoreszenzzytologie jeweils etwa 100 ml Spülflüssigkeit abgenommen. Die Spülflüssigkeit wurde aufgrund der höheren Aussagefähigkeit für die Zytologie dem Spontanurin als Material vorgezogen. Die für die Fluoreszenzzytologie vorgesehene Spüllösung wurde in einem lichtgeschützten Gefäß gekühlt asserviert. Innerhalb von 2 h wurde diese Lösung 5 min lang bei 1500 U/min zentrifugiert. Das hierdurch gewonnene Sediment wurde resuspendiert und im Fluo- reszenzmikroskop (Axiolab, Fa. Zeiss) untersucht. Analog zur AFE verwendeten wir ein blauviolettes Anregungslicht von 390–430 nm Wellenlänge. Das von der AFE bekannte Ausbleichphänomen [1] der Fluoreszenz war bei der Fluoreszenzzytologie entsprechend nachweisbar. Um eine reproduzierbare Beurteilung der zytologischen Präparate im Fluoreszenzmikroskop zu ermöglichen, wurden diese fotodokumentiert. Analoge Bildausschnitte wurden unter Weißlicht und Fluoreszenzbedingungen bei 100- bis 400facher Vergrößerung analysiert. Das in der Fluoreszenzzytologie gewonnene Bildmaterial wurde nach zytologischer Bewertung mit der parallel angefertigten Standardzytologie verglichen. Die zytologische Beurteilung erfolgte verblindet durch einen erfahrenen Zytologen. In dieser Pilotstudie wurden die zytologischen Präparate von insgesamt 27 Patienten 1–7 h nach 5-ALA-Instillation untersucht. Tabelle 1 Sensitivität und Spezifität in der Diagnostik von Urothelkarzinomen (in %) Methode Sensitivität G1 Zytologie [5, 12, 14] Bard [10] NMP-22 [16] AFE [7, 17] G2–3 50 17 Spezifität Cis 65–80 37 100 Gesamt 85–90 56 46 97 78–95 67 75 65a a Ohne Berücksichtigung molekulargenetischer Veränderungen, Fluoreszenzquantifizierung und Autofluoreszenz, mit >90%. 218 | Der Urologe [A] 3•2001 Abb.2 Zytologische Präparate mit entdifferenzierten Tumorzellen der Harnblase bei 100-facher Vergrößerung. Das Bild zeigt den gleichen Ausschnitt wie Abb. 1 bei Weißlicht Abb.3 Entdifferenzierte Tumorzellen bei 400facher Vergrößerung bei Fluoreszenzanregung Abb.4 Entdifferenzierte Tumorzellen bei 400facher Vergrößerung unter Weißlicht Ergebnisse Bei allen 17 Patienten mit einem durch die transurethrale Resektion histologisch gesicherten Urothelkarzinom der Harnblase fand sich in der 5-ALA-induzierten Fluoreszenzzystoskopie und -zytologie eine positive Fluoreszenz. Dabei handelte es sich 6-mal um ein hochdifferenziertes, 4-mal um ein mittelgradig differenziertes, 5-mal um ein entdifferenziertes Urothelkarzinom und 2-mal um ein Carcinoma in situ. Bei 10 Patienten ohne Tumornachweis konnte keine Fluoreszenz nachgewiesen werden. Sowohl in der Übersichtsvergrößerung (100fach) als auch bei stärkeren Vergrößerungen (400fach) beobachteten wir bei der Fluoreszenzdiagnostik die typische, aus der AFZ bekannte Rotfluoreszenz des Protoporphyrin IX, die sich auf mikroskopisch suspekte Urothelzellen mit prominenten, entrundeten Zellkernen begrenzte (Abb. 1, 2). Dabei fluoreszierte der Bereich des Zellkernes nicht (Abb. 3, 4). Es fanden sich Malignitätskriterien mit vergrößerten, polymorphen Zellen mit großen Zellkernen, wodurch das Kern/Plasma-Verhältnis zugunsten des Zellkerns verschoben ist. Weitere typisch tumorsuspekte Zellveränderungen, wie Zellkerne mit hohem Chromatingehalt, prominente Nukleoli und eine erhöhte mitotische Aktivität, zeigten sich bei den entsprechenden zytologischen Präparaten nach der Standardfärbung (Abb. 5, 6). In Verbänden gelagerte Urothelzellen waren bereits als fluoreszierende Schwebteilchen in der Spülflüssigkeit bei 10facher Vergrößerung erkennbar.In keinem Fall war bei einem histologisch gesicherten Tumor oder bei positiver Standardzytologie ein negatives Ergebnis in der Fluoreszenzzytologie nachzuweisen. Andererseits wurde bei den 17 histologisch nachgewiesenen Tumoren mit positiver Fluoreszenzzytologie in 3 Fällen ein negatives Ergebnis in der Standardzytologie gefunden. Unauffällige Urothelzellen erschienen aufgrund ihrer Autofluoreszenz grünlich. Ebenso grünlich leuchteten suspekte Urothelzellen aus Spontanurin oder Spülurin ohne vorangegangene 5-ALA-Instillation oder nach bereits erfolgter Ausbleichung. Erythrozyten sowie Leukozyten zeigten keine Rotfluoreszenz. Das von der AFE bekannte Ausbleichen der Fluoreszenz wird in der Fluoreszenzzytologie unter der lichtintensiven Mikroskopbeleuchtung bereits innerhalb von Sekunden bis hin zu wenigen Minuten beobachtet. Protoporphyrin IX wird dabei unter Lichteinfluss chemisch umgesetzt, sodass die Tetrapyrrolringe aufbrechen und das delokalisierte Π-ElektronenSystem, das zu den starken Fluoreszenzbanden führt, zusammenbricht [1], (Abb. 7, 8). Zur Dokumentation und reproduzierbaren Beurteilung der Befunde fotografierten wir die nicht ausgeblichenen Präparate. Der Urologe [A] 3•2001 | 219 Originalien Abb.5 Entdifferenzierte Tumorzellen des gleichen Patienten wie in Abb. 3 und 4, gefärbt nach Papanicolaou bei 100facher Vergrößerung in der Standardzytologie Abb.6 Entdifferenzierte Tumorzellen des gleichen Patienten wie in Abb. 3 und 4, gefärbt nach Papanicolaou bei 400facher Vergrößerung in der Standardzytologie Abb.7 Entdifferenzierte Tumorzellen bei 400facher Vergrößerung Diskussion Mit der Fluoreszenzzytologie lässt sich bei Urothelkarzinomen der Harnblase mikroskopisch die typische Rotfluoreszenz des Protoporphyrin IX nachweisen, die man aus der Fluoreszenzdiagnostik nach Applikation von 5-ALA in die Harnblase kennt. 220 | Der Urologe [A] 3•2001 Tumorzellen akkumulieren Protoporphyrin IX wesentlich stärker als Normalzellen. Dies wird durch eine gesteigerte Gewebepenetration und eine verstärkte Aufnahme von 5-ALA in die Zelle, eine gesteigerte Aktivität von Plasmaenzymen, eine erniedrigte Ferrochelataseaktivität, eine veränderte intrazelluläre Umverteilung und Ausschleusung von Protoporphyrin IX und die erhöhte Proliferationsrate von Karzinomzellen erklärt [1, 2, 3, 4, 9, 11, 15]. Protoporphyrin-IX-Moleküle absorbieren am besten Licht um 400 nm, d. h. „violettblaue“ Photonen. Ein Teil der aufgenommenen Energie wird in Form von „neu entstandenen“ Photonen geringerer Energie und somit größerer Wellenlänge abgegeben. Protoporphyrin IX emittiert typischerweise mit einer Fluoreszenz von 636–705 nm „rote“ Photonen. Dieses Fluoreszenzverhalten fanden wir in unseren Untersuchungen bei allen Patienten, bei denen wir histologisch ein Urothelkarzinom der Blase, unabhängig vom Differenzierungsgrad, nachweisen konnten und bei denen die AFE positiv war. Da die Hämbiosynthese an Mitochondrien gekoppelt ist, ließ sich in der Fluoreszenzzytologie kaum Fluoreszenz im Bereich der Zellkerne nachweisen. Das Ausbleichphänomen der suspekten Zellen und Zellgruppen unter der lichtstarken Mikroskopbeleuchtung macht eine zügige Bearbeitung oder eine Fotodokumentation notwendig. Die untersuchten Patienten zeigten ein übereinstimmendes Fluoreszenzverhalten bei endoskopischer Beurteilung der Harnblase und bei der Fluoreszenzzytologie. Harnblasenkarzinome werden aufgrund der Fluoreszenz bei der AFE mit einer Gesamtsensitivität von ca. 97% erkannt [7, 17]. Da dem Fluoreszenzverhalten des makroskopisch erkennbaren Blasentumors und der zytologisch betrachteten Einzeltumorzelle der gleiche zelluläre Fluoreszenzmechanismus zugrunde liegt, bestand die Hoffnung, die ausgezeichnete Gesamtsensitivität auf die Fluoreszenzbeurteilung von zytologischen Präparaten zu übertragen. Unsere ersten Untersuchungsergebnisse zeigen, dass zwischen der AFE und der Fluoreszenzzytologie in dieser Hinsicht eine Analogie besteht. Durch die sensitive Erkennung nahezu aller Blasentumoren wäre damit die Fluoreszenzzytologie der Standardzytologie sogar überlegen. Die simple, farbbedingte und objektive Fluoreszenzbeurteilung der Zellen macht das Verfahren darüber hinaus unabhängig von der Erfahrung des Untersuchers. Abb.8 Entdifferenzierte Tumorzellen bei 400facher Vergrößerung. Effekte der Fluoreszenzausbleichung nach ca. 30 s intensiver Mikroskopbeleuchtung Fazit für die Praxis Hochdifferenzierte Urotheltumoren werden bei der Standardzytologie bekanntlich nur in 50% richtig diagnostiziert [5, 14]. Bei 17 erkannten Urothelkarzinomen in der Fluoreszenzzytologie gegenüber 14 Urothelkarzinomen, die durch die Standardzytologie erkannt wurden, zeigte sich die Überlegenheit der Fluoreszenzzytologie. Aufgrund der beschriebenen Vorteile gegenüber der Standardzytologie sehen wir für die Fluoreszenzzytologie folgende sinnvolle Einsatzgebiete und Ergänzungen zur Standardzytologie: ◗ Sichere und schnelle Beurteilung, insbe- sondere hochdifferenzierter Urothelkarzinome und flacher maligner Läsionen. ◗ Einführung automatisierter, untersucherunabhängiger Bewertung von zytologischen Präparaten (z. B. durch Durchflusszytometrie). ◗ Differenzierung von Urothelkarzinomen des oberen und unteren Harntrakts. Hier wäre die Standardzytologie positiv, bei negativer Fluoreszenzzytologie, außer bei vesikoureteralem Reflux oder Ureterschienung. Zur weiteren Beurteilung dieses Verfahrens korrelieren wir unsere Befunde der Fluoreszenzzytologie, der AFE und der Urinzytologie in einer randomisierten Studie. Literatur 1. Baumgartner R, Kriegmair M, Hofstetter A (1999) Fluoreszenzdiagnostik des Harnblasenkarzinoms mit 5-Aminolävulinsäure.Grundlagen und Ergebnisse.Endo-Press,Tuttlingen 2. Datta S, Loh C, MacRobert A,Whatley S, Matthewa P (1998) Quantitative studies of the kinetics of 5-aminolaevulinic acid –induced fluorescence in bladder transitional cell carcinoma.Br J Cancer 78: 1113–1118 3. Jichlinski P, Forrer M, Mizeret J et al.(1997) Clinical evaluation of a method for detecting superficial surgical transitional cell carcinoma of the bladder by light induced fluorescence of protoporphyrin IX following the topical application of 5-aminolevulinic acid: Preliminory results.Laser Surg Med 20: 402–408 4. Kennedy J, Pottier R, Pross D (1990) Photodynamic therapie with endogenous protoporphyrin IX: basic principles and present clinical experimence.J Photochem Photobiol 6: 143–148 5. Koss LG, Deitch D, Ramanathan AB, Sherman AB (1985) Diagnostic value of cytology of voided urine.Acta Cytol (Baltimore) 29: 810 6. Kriegmair M, Baumgartner R, Knüchel R, Stepp H, Hofstädter F, Hofstetter A (1994) Fluorescence photodetection of neoplastic urothelial lesions following intravesical instillation of 5-minolevulinic acid.Urology 44: 836–841 7. Kriegmair M, Baumgartner R, Knüchel R, Ehsan A, Steinbach P, Lumper W, Hofstädter F, Hofstetter A (1994) Photodynamische Diagnose urothelialer Neoplasien nach intravesikaler Instillation von 5-Aminolävulinsäure.Urologe A 33: 270–275 8. Kriegmair M, Baumgartner R, Knüchl R, Stepp H, Hofstädter F, Hofstetter A (1996) Detection of early bladder cancer by 5-aminolevulinic acid induced porphyrin fluorescence. J Urol 155: 105–110 9. Kriegmair M, Stepp H, Steinbach P et al.(1995) Fluorescence cystoscopy following intravesical instillation of 5-aminolevulinic acid: a new procedure with high sensitivity for detection of hardly visible urothelial neoplasias.Urol Int 55: 190–196 10. Mahnert B,Tauber S, Kriegmair M et al.(1999) BTA-Trak- A useful diagnostic tool in urinary Bladder cancer? Anticancer Research 19: 2615–2620 11. Malik Z, Lugaci H (1987) Destruction of erythro-leukaemic cells by photoactivation of endogenous porphyrins.Br J Cancer 56: 589–595 12. Murphy WM, Emerson LD, Chandler RW, Moinuddin SM, Soloway MS (1986) Flow cytomertry versus urinary cytology in the evaluation of patients with bladder cancer. J Urol 136: 815 13. Rübben H, Jocham D (1991) Therapie des oberflächlichen Blasenkarzinoms.Urologe A 30: 2–9 14. Rübben H, Rathert P, Roth S, Hofstädter F, Giani G,Terhost B, Friedrichs R (1989) Exfoliative Urinzytologie.Harnwegstumorregister, 4.Aufl.Fort- und Weiterbildungskommission der Deutschen Urologen Arbeitskreis Onkologie, Sektion Urinzytologie 15. Steinbach P, Kriegmair M, Baumgartner R, Hofstädter F, Knüchel R (1994) Intravesical instillation of aminolevulinic acid (ALA): The fluorescent metabolite is limited to urothelial cells.Urology 44: 676–681 16. Tauber S, Kriegmair M, Schmeller N, Hofstetter A, Stieber P, Mahnert B (1998) Die Bedeutung des quantitativen NMP-22Tests in der Nachsorge von Blasentumoren. Der Urologe A 37: 14 17. Zaak D, Hofstetter A, Baumgartner R et al. (1999) Die 5-Aminolävulinsäure-induzierte Fluoreszenzendoskopie des oberflächlichen Harnblasenkarzinoms.Urologe B 39: 113–120 Der Urologe [A] 3•2001 | 221