Afamelanotid
Werbung
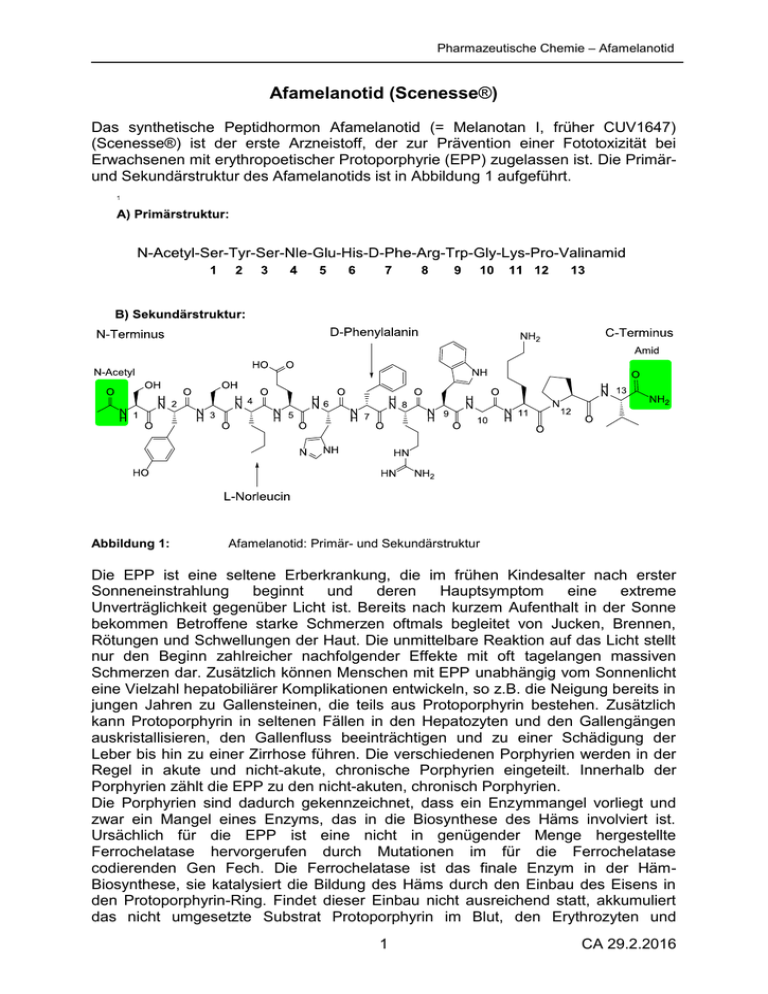
Pharmazeutische Chemie – Afamelanotid Afamelanotid (Scenesse®) Das synthetische Peptidhormon Afamelanotid (= Melanotan I, früher CUV1647) (Scenesse®) ist der erste Arzneistoff, der zur Prävention einer Fototoxizität bei Erwachsenen mit erythropoetischer Protoporphyrie (EPP) zugelassen ist. Die Primärund Sekundärstruktur des Afamelanotids ist in Abbildung 1 aufgeführt. Abbildung 1: Afamelanotid: Primär- und Sekundärstruktur Die EPP ist eine seltene Erberkrankung, die im frühen Kindesalter nach erster Sonneneinstrahlung beginnt und deren Hauptsymptom eine extreme Unverträglichkeit gegenüber Licht ist. Bereits nach kurzem Aufenthalt in der Sonne bekommen Betroffene starke Schmerzen oftmals begleitet von Jucken, Brennen, Rötungen und Schwellungen der Haut. Die unmittelbare Reaktion auf das Licht stellt nur den Beginn zahlreicher nachfolgender Effekte mit oft tagelangen massiven Schmerzen dar. Zusätzlich können Menschen mit EPP unabhängig vom Sonnenlicht eine Vielzahl hepatobiliärer Komplikationen entwickeln, so z.B. die Neigung bereits in jungen Jahren zu Gallensteinen, die teils aus Protoporphyrin bestehen. Zusätzlich kann Protoporphyrin in seltenen Fällen in den Hepatozyten und den Gallengängen auskristallisieren, den Gallenfluss beeinträchtigen und zu einer Schädigung der Leber bis hin zu einer Zirrhose führen. Die verschiedenen Porphyrien werden in der Regel in akute und nicht-akute, chronische Porphyrien eingeteilt. Innerhalb der Porphyrien zählt die EPP zu den nicht-akuten, chronisch Porphyrien. Die Porphyrien sind dadurch gekennzeichnet, dass ein Enzymmangel vorliegt und zwar ein Mangel eines Enzyms, das in die Biosynthese des Häms involviert ist. Ursächlich für die EPP ist eine nicht in genügender Menge hergestellte Ferrochelatase hervorgerufen durch Mutationen im für die Ferrochelatase codierenden Gen Fech. Die Ferrochelatase ist das finale Enzym in der HämBiosynthese, sie katalysiert die Bildung des Häms durch den Einbau des Eisens in den Protoporphyrin-Ring. Findet dieser Einbau nicht ausreichend statt, akkumuliert das nicht umgesetzte Substrat Protoporphyrin im Blut, den Erythrozyten und 1 CA 29.2.2016 Pharmazeutische Chemie – Afamelanotid Geweben und führt zur oben ausgeführten schmerzhaften Fotosensitivität (Lecha et al. 2010, Casanova-Gonzalez et al. 2010, Besur et al. 2014). Afamelanotid (Scenesse®) ist nun als erste Substanz zur Prävention der Fototoxizität bei EPP in Form eines Implantats als „controlled-release“-Formulierung (stäbchenförmig, Länge 1,7cm und Durchmesser 1,5mm) im Handel. Das Implantat enthält 16mg Afamelanotid und wird von einem geschulten Arzt subkutan appliziert. Alle zwei Monate wird ein Implantat eingesetzt, vor der voraussichtlichen Sonneneinstrahlung sowie bei verstärkter Sonneneinstrahlung (z.B. vom Frühjahr bis zum Frühherbst. Es werden dabei aber - je nach Dauer des erforderlichen Schutzes nur drei Implantate pro Jahr empfohlen. Maximal sollten nur vier Implantate pro Jahr eingesetzt werden. Die Gesamtbehandlungsdauer liegt im Ermessen des behandelnden Arztes, jedoch liegen keine klinischen Daten für einen Behandlungszeitraum von über zwei Jahren vor. Die Pharmakokinetik des Afamelanotids ist noch nicht vollständig untersucht, z.B. liegen keine Daten über pharmakologisch wirksame bzw. unwirksame Metaboliten vor. In einer Studie aus dem Jahr 1997 wurde für Afamelanotid nach subkutaner Injektion eine Halbwertszeit von 0,07 bis 0,79 Stunden ermittelt (Ugwu et al. 1997). Nach subkutanem Einbringen des Implantats wird innerhalb der ersten 48 Stunden der größte Teil des Wirkstoffes freigesetzt, an Tag 5 nach Implantateinsetzung sind mehr als 90% des Afamelanotids freigesetzt. Die Plasmaspiegel bleiben einige Tage konstant, wobei die Plasmakonzentration ab Tag 10 in den meisten Studien unterhalb der Quantifizierungsgrenze lag. (Minder 2010, Fachinformation Scenesse® 2016). Die mit Scenesse® behandelten Patienten sollten unbedingt ihre routinemäßigen Sonnenschutzmaßnahmen beibehalten. Bereits pigmentierte Hautareale können durch Afamelanotid dunkler werden. Alle sechs Monate sollte die Haut am gesamten Körper unter einer Afamelanotid-Therapie untersucht werden, um Pigmentläsionen und Hautanomalien zu überwachen (Fachinformation Scenesse® 2016). Afamelanotid als synthetisches Analogon des endogenen α-Melanozytenstimulierenden Hormons (α-MSH) ist kein neuer Arzneistoff, sondern schon seit den 1980er Jahren bekannt (Sawyer et al. 1980). Das Peptidhormon α-MSH zählt neben β-MSH und -MSH zu den Melanotropinen (Melanozyten-stimulierende Hormone), die die fünf Melanocortin-Rezeptoren aktivieren (MC1R bis MC5R). α-MSH bindet nichtselektiv mit verschiedenen Affinitäten an die Rezeptoren MC1R, MC3R, MC4R und MC5R (De Luca et al 1993). Für den fotoprotektiven Effekt und die Auswirkungen auf die Pigmentierung ist die Aktivierung des MC1-Rezeptors durch αMSH verantwortlich. In den Keratinozyten der Haut wird α-MSH gebildet, es wirkt parakrin als Agonist an MC1-Rezeptoren auf Melanozyten, was über verschiedene Reaktionen ohne zusätzlich nötige UV-Strahlung zur Produktion des braunschwarzen, fotoprotektiven Hautpigments Eumelanin in der Epidermis führt. Melanin in der Form des Eumelanins absorbiert und zerstreut UV- und sichtbares Licht, wirkt dabei als Filter und wirkt als Radikalfänger für freie Radikale und reaktive Sauerstoffspezies (Langendonk et al. 2015). Die Primärstruktur des α-MSH ist in Abbildung 2 angegeben. α-MSH ist ein Tridecapeptid. Das N-terminale Serin1 ist N-acetyliert, die Carboxyl-Gruppe des Cterminalen Valins13 liegt als Carbonsäureamid (Valinamid) vor. Ansonsten liegen nur physiologische Aminosäuren mit klassischen Peptidbindungen vor, was den leichten Angriff und Abbau durch Peptidasen und damit die sehr kurze Halbwertszeit des αMSH erklärt. Afamelanotid als synthetisches α-MSH-Analogon ist ebenfalls ein Tridecapeptid mit demnach 13 Aminosäuren. Allerdings wurden zwei Aminosäuren 2 CA 29.2.2016 Pharmazeutische Chemie – Afamelanotid des endogenen α-MSH ausgetauscht (s. Abbildung 1 und 2). Anstelle des Methionins an Position 4 des α-MSH liegt beim Afamelanotid an Position ein nichtphysiologisches L-Norleucin (Nle) vor. Das physiologische L-Phenylalanin an Position 7 des α-MSH ist durch das nichtphysiologische D-Phenylalanin ersetzt. Dementsprechend wird Afamelanotid in einer Kurzform auch als Nle 4-D-Phe7-α-MSH bezeichnet. Abbildung 2: Vergleich der Primärstrukturen des endogenen α-MSH sowie seinen synthetischen, metabolisch stabileren Analogons Afamelanotid Afamelanotid ist wie das natürliche α-MSH ein Melanocortin-Rezeptor-Agonist. Allerdings bindet Afamelanotid vorwiegend nur an den MC1-Rezeptor auf den Melanozyten und besitzt eine längere Bindungsdauer als das natürliche α-MSH, was u.a. darauf zurückgeführt werden kann, dass es im Plasma aufgrund seiner zwei nichtphysiologischen Aminosäuren L-Norleucin und D-Phenylalanin langsamer durch Peptidasen abgebaut wird und so eine längere Halbwertszeit besitzt (Halbwertszeit etwa 30 Minuten) (Sawyer et al. 1980, Fabrikant et al. 2013, Fachinformation Scenesse® 2016). Somit ist der Wirkmechanismus des Afamelanotids identisch zum natürlichen α-MSH, was die Aktivierung des MC1-Rezeptors und die nachfolgende von der Sonneneinstrahlung unabhängige Bildung des Eumelanins betrifft (Langendonk et al. 2015, Minder Schneider-Yin 2015) Literatur: Besur, S. et al. Metabolites 2015, 4, 977 Casanova-Gonzalez, M.J. et al. World J Gastroenterol 2010, 16, 4526 De Luca, M. et al. J Cell Sci 1993, 105, 1079 Fabrikant, J. et al. J Drugs Dermatol 2013, 12, 775 Fachinformation Scenesse® 2016, Clinuvel (UK) Limited Langendonk, J.G. et al. N Engl J Med 2015, 373, 48 Lecha, M. et al. Orphanet J Rare Dis 2009, 4, 19 Minder, E.I. Expert Opin Investug Drugs 2010, 19, 1591 Minder, E.I. und Schneider-Yin, X. Expert Rev Clin Pharmacol 2015, 8, 43 Sawyer, T.K. et al. Proc Natl Acad Sci USA 1980, 77, 5754 Ugwu, S.O. et al. Biopharm Drug Dispos 1997, 18, 259 3 CA 29.2.2016











