ATOME – TEILCHEN DES UNIVERSUMS
Werbung

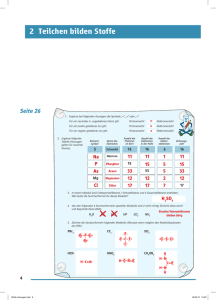
ATOME – TEILCHEN DES UNIVERSUMS Ionen mit Elektronenmangel. Sind weniger negativ geladene Elektronen als positiv geladene Protonen vorhanden, überwiegt die positive Ladung. Positiv geladene Ionen nennt man Kationen. 1 Elektron wird abgegeben Hinweise zur Ermittlung der Protonenund Elektronenzahl von Ionen 1. Die Protonenzahl entspricht der Ordnungszahl des Elements. Diese bleibt bei chemischen Reaktionen immer gleich. Elektron Proton Neutron Li+-Ion mit 3 Protonen und nur 2 Elektronen Li-Atom mit 3 Protonen und 3 Elektronen Abb. 20 Skizze eines Kations mit Elektronenmangel In der folgenden Tabelle sind wichtige Ionen aufgelistet. F— 9 Protonen 10 Elektronen Elektronenüberschuss Anion O2— 8 Protonen 10 Elektronen Elektronenüberschuss Anion Mg2+ 12 Protonen 10 Elektronen Elektronenmangel Kation kein Elektron Kation H+ 1 Proton In der Natur kommen Ionen überall vor. Meist bilden Ionen Salze, wie zum Beispiel Kochsalz, das aus Natrium-Kationen und Chlorid-Anionen besteht. Da Salze oft wasserlöslich sind, findet man viele davon auch im Wasser. Elektronenmangel Abb. 21 Beispiele für wichtige Kationen und Anionen Um sich die Ladung von Kationen und Anionen merken zu können, findest du am Kapitelende drei Merkhilfen. 2. Die Elektronenzahl ergibt sich aus der Ladungszahl: Minus bedeutet einen Überschuss negativer Ladungen: mehr Elektronen als Protonen. Plus bedeutet einen Überschuss positiver Ladungen: weniger Elektronen als Protonen. Merke: Die Protonenzahl ändert sich bei chemischen Reaktionen nie! 1) Von Kohlenstoff gibt es drei Isotope. Erkläre, wodurch sie sich unterscheiden. 2) Erkläre den Unterschied zwischen einem Kation und einem Anion. 3) Vom Sauerstoff gibt es auch ein Sauerstoff-Ion. Erkläre, wodurch sich das Sauerstoff-Atom vom Sauerstoff-Ion unterscheidet. 4) Nenne die Anzahl der Protonen, Elektronen und Neutronen von Chlor-37 und Kalium-40. Nimm das Periodensystem zu Hilfe. 5) Nenne die Anzahl der Protonen und Elektronen von N3–, K+, Fe2+ und C4–. Nimm das Periodensystem zu Hilfe. Auf den Punkt gebracht! Summary Ändert sich die Protonenzahl im Kern, erhält man ein anderes Element. By changing the number of protons in the nucleus, you get another element. Ändert sich die Neutronenzahl im Kern, erhält man ein Isotop. Isotope eines Elements haben die gleichen chemischen Eigenschaften. Viele Isotope zerfallen in ein anderes Element und geben dabei radioaktive Strahlung ab. By changing the number of neutrons in the nucleus, you get an isotope. Isotopes of an element have the same chemical characteristics. Many isotopes collapse into other elements and emit radioactive radiation. Ändert sich die Elektronenzahl in der Atomhülle, erhält man ein Ion. Ionen sind bei Elektronenmangel positiv (Kationen) und bei Elektronenüberschuss negativ (Anionen) geladen. By changing the number of electrons in the atom, you get an ion. Ions are positively charged when electrons are missing (cations) and negatively charged when there is an electron excess (anions). 15