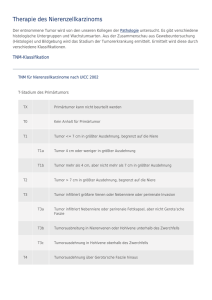
ANLEITUNGUrothelHelpap02.2011
Werbung

UROTHELAnleitungen01.2011 3F/C2(Qualitätskommission) 24/10/2011 HE/Wi --------------------------------------------------------------------------------------------------------------------------------------- Konsultationsfassung zur öffentlichen Diskussion bis 11.11.2011 Anleitungen zur pathologisch-anatomischen Diagnostik von Tumoren des Nierenbeckens, des Ureters und der Harnblase des Bundesverbandes Deutscher Pathologen und der Deutschen Gesellschaft für Pathologie 2. Auflage 2 Vorwort Auch diese zweite Auflage der Anleitungen zur pathologisch- anatomischen Diagnostik von Tumoren des Nierenbeckens, des Ureters und der Harnblase“ orientiert sich an den Klassifikationen von WHO [Mostofi et al. 1999, Eble et al. 2004] und UICC [2002, 2010] sowie an im Literaturverzeichnis erwähnten Publikationen und Protokollen, unter anderem solchen, die in Abstimmung zwischen der Deutschen Krebsgesellschaft, der Deutschen Gesellschaft für Pathologie und der Deutschen Gesellschaft für Urologie publiziert wurden [Böhle et al. 1998, Sinn et al 2002, Deutsche Krebsgesellschaft 2004], aber auch an den vom „College of American Pathologists [CAP]“ herausgegebenen Protokollen [Hammond et al. 1996 und 2000]: Reporting on Cancer Specimens und den Monographien von D.C. Allen [Allen 2000 und 2006, Allen und Cameron 2004] und dem Manual of Surgical Pathology [Lester 2006]. Diese Anleitungen sollen kein starres Korsett vorgeben, sondern nur eine Orientierung über notwendige und sinnvolle Untersuchungen und das zu erzielende Ergebnis bieten. Die „Anleitungen“ liegen zwangsläufig bisher alle – soweit sie die pathologisch-anatomische Diagnostik betreffen -, auf einer niedrigen Evidenzstufe, da sie weder einem systematischen Review entsprechen, noch auf Ergebnissen validierender Kohortenstudien beruhen. Es handelt sich demnach um „Expertenmeinungen“ (Evidenzstufe 5). -2- 3 Die Biopsie und vor allem die transurethrale Resektion aus der Harnblase stellen, neben der Urinzytologie, die erste diagnostische Maßnahme beim Urothelkarzinom der Harnblase dar. Die Anleitung gibt Pathologen wie Urologen eine Hilfestellung für die optimale Registrierung, Bearbeitung und Befunderhebung von Zytologien, Biopsien, transurethralen Resektionen sowie Zyst(o)-(Prostat-)ektomiepräparaten. In der Anleitung werden für die einzelnen Untersuchungsmaterialien jeweils folgende Themen abgehandelt: Materialentnahme und Materialbehandlung Informationen für den Pathologen Makroskopische Beschreibung Makropräparation („Zuschneiden“) mit Entnahme von Gewebe zur histologischen Untersuchung Mikroskopische Bearbeitung (z. B. Schnittebenen, Färbungen) Mikroskopische Begutachtung (einschließlich Kriterien der Klassifikation) Dokumentation Angefügt sind Allgemeine Erläuterungen (die für alle Untersuchungsmaterialien gelten) und Spezielle Erläuterungen für die einzelnen Untersuchungsmaterialien. Dabei werden insbesondere die Anwendung von Tumorklassifikationen, morphologische Hintergründe, mögliche Unklarheiten und die Verwendung von Formblättern behandelt. DIE HERAUSGEBER -3- 4 A. UNTERSUCHUNGSMATERIAL Zytologisches Material oder Gewebe von Tumoren des Nierenbeckens, des Ureters und der Harnblase kommt in den folgenden Formen zur pathomorphologischen Untersuchung: 1. Sog. Provokation-Urin 2. Spülflüssigkeiten aus Nierenbecken, Ureter und Harnblase 3. Biopsien im Rahmen der präoperativen Diagnostik 3. Schnellschnittuntersuchungen (intraoperative mikroskopische Untersuchung) 4. Zystektomiepräparate 5. Nephrektomie- und Ureterektomien (bzw. Segmententfernungen) B. VORGEHEN BEI DEN EINZELNEN UNTERSUCHUNGSMATERIALIEN B.1 Urin sowie Spülflüssigkeiten aus Nierenbecken, Ureter und Harnblase B.1.1 Indikationen, Treffsicherheit, Materialentnahme und Materialbehandlung Indikationen [Rathert und Roth 1995] Abklärung einer Hämaturie Kontrolle nach operativer Therapie Kontrolle während intravesikaler Chemo(immun)therapie Kontrolle nach Phenacetin-Abusus Arbeitsmedizinische Vorsorge-Untersuchungen bei aromatischen Nitro- oder Aminverbindungen ausgesetzten Industriearbeitern V.a. vesicoenterale Fisteln oder penetrierend wachsende extraurologische Tumoren Zystoskopischer Verdacht auf Carcinoma in situ der Harnblase Treffsicherheit Die Sensitivität der Urinzytologie ist abhängig vom Malignitätsgrad, dem Stadium des Tumors sowie der Zahl und dem Volumen der untersuchten Proben. Sie beträgt im Literaturmittel 76,4%, ihre Spezifität 93,5%. Die Treffsicherheit steigt um gut 10%, wenn drei Proben untersucht werden. Das Carcinoma in situ der Hanblase kann durch die Urinzytologie bei bis zu 90% der Patienten nachgewiesen werden. Gut differenzierte Tumoren entgehen in mehr als 62,8% der zytologischen Diagnostik [Jochims 2002]. Materialentnahme (siehe spezielle Erläuterungen B.1.1.) -4- 5 Beim klinischen Verdacht auf einen Tumor im Bereich der Nierenbecken, der Ureteren oder der Harnblase kann sog. Provokations-Urin auf Tumorzellen untersucht werden. Zusätzlich kann gezielt Spülflüssigkeit aus den verdächtigen Abschnitten des Harntraktes gewonnen werden, z. B. aus dem linken Ureter oder dem linken Nierenbecken. Materialbehandlung Die zytologische Untersuchung von Urin oder Spülflüssigkeiten aus den ableitenden Harnwegen wird an Alkohol-fixierten Sedimentausstrichen oder ZytozentrifugationsPräparaten durchgeführt. Daneben existieren auch andere Präparationsverfahren für Urothelzellen (z.B. Stempeltechnik: siehe Erläuterungen B.1.1). Empfehlenswert ist eine Färbung nach Papanicolaou (aber auch andere sind anwendbar, z. B. Giemsa-Färbung) B.1.2 Information des Pathologen Der Kliniker sollte Materialart, dessen Herkunft (Lokalisation), Art der Fixation, relevante Vorerkrankungen und Therapien sowie seine Fragestellung auf dem Einsendungsschein mittteilen (siehe allgemeine Erläuterungen 2) B.1.3 Makroskopische Beschreibung Menge, Fixation und Aussehen der erhaltenen Flüssigkeit (z. B. 50 ml, in Saccomanno´s fixiert, klar, gelb, trüb, blutig, etc.) müssen vom Assistenzpersonal notiert werden. B.1.4 Makropräparation Ggf. sofortige Nachfixation, Anfertigen von Sediment-Ausstrichen und/oder Zytozentrifugationspräparaten. (siehe spezielle Erläuterungen B.1.5) Ggf. ist die Anfertigung eines Zytoblocks zu empfehlen. B.1.5 Mikroskopische Begutachtung Aussagen zur Art, Herkunft und Repräsentativität des Materials Beschreibung des zytomorphologischen Befundes -5- 6 Diagnostische Kategorien laut Nomenklatur der Deutschen Gesellschaften für Pathologie und für Zytologie für die extragenitale Zytodiagnostik (Böcking und Freudenberg, 1998): Negativ, zweifelhaft, dringender Verdacht oder sicher positiv auf bösartige Zellen. Klartext-Diagnose anfügen, ggf. mit Tumortyp, Malignitätsgrad und Vorliegen einer Entzündung (z. B. das Zellbild entspricht einem Urothelkarzinom Grad 3) B.2 Prätherapeutische Diagnostik B.2.1 Indikationen, Materialentnahme und Materialbehandlung (siehe spezielle Erläuterungen B.2.1.) Indikationen Die Indikationen für Untersuchungen bei der prätherapeutischen (histopathologischen) Diagnostik und bei der Untersuchung des Operationpräparates unterscheiden sich beim Urothelkarzinom der Harnblase (des Nierenbeckens und des Ureters) von anderen Organtumoren, da es 1. (bislang) keine Screeningmethode auf mikroskopischer Grundlage gibt (Ausnahme zytologisches Screening bestimmter Risikogruppen) und 2. die diagnostische Resektion beim nicht invasiven papillären Urothelkarzinom gleichzeitig meist den kurativen Eingriff darstellt. Eine prätherapeutische Diagnostik gibt es beim Harnblasenkarzinom nur bei primär inoperablen Karzinomen, bei denen bioptisch (oder zytologisch, siehe B.1) das Urothelkarzinom gesichert werden muss, bevor über die Art der palliativen Therapie entschieden wird. Nicht aus der Harnblase stammende Tumoren (Prostata, Rektum, gynäkologische Tumoren, Metastasen von Karzinomen des Magens, von kleinzelligen Lungenkarzinomen oder maligne Lymphome) müssen ausgeschlossen werden. Materialentnahme (mikroskopische Untersuchungen bei transurethraler Resektion) Zur histopathologischen Untersuchung können eingesandt werden: 1. Tumor (bzw. Tumoren) 2. Tumorgrund 3. Seitliche Tumorränder (evtl. 1-4 Proben) 4. Zusätzliche Biopsien aus eventuell vorhandenen suspekten Schleimhautarealen (nachgewiesen z. B. durch Chromoendoskopie bzw. photodynamische Diagnostik) (siehe spezielle Erläuterungen B.2.1) 5. Eventuell Biopsien aus zystoskopisch normaler Schleimhaut (Mapping) (siehe Abbildung 1) -6- 7 Materialbehandlung Alle Präparate müssen einzeln nummeriert fixiert werden (in 4% gepuffertem Formalin). Im Einsendungsantrag muss zu den einzelnen nummerierten Präparaten die Herkunft eindeutig ersichtlich sein. Zur Information des Pathologen empfiehlt sich ein Formblatt wie in Abbildung 1 dargestellt. B.2.2 Information des Pathologen (siehe allgemeine Erläuterungen 2) B.2.3 Makroskopische Beschreibung Anzahl und Gewicht, Oberfläche (papilläre Strukturen) der TUR oder Biopsien. Detrusorstrukturen erkennbar? (siehe spezielle Erläuterungen B.2.3; Abbildung 2) B.2.4 Makropräparation (siehe spezielle Erläuterungen B.2.4) Das Tumormaterial sollte gewogen und komplett eingebettet werden, ggf. Ausrichtung nach Detrusorstrukturen. Bei palliativen Resektionen mit Befall des Detrusors erübrigt sich eine komplette Aufarbeitung. B.2.5 Mikroskopische Bearbeitung (siehe spezielle Erläuterungen B.2.5) Proben aus dem Tumor, der in nur 1 oder 2 Kapseln untersucht wird, Proben aus dem Tumorgrund, den seitlichen Tumorrändern und Biopsien aus suspekten und zystoskopischen unauffälligen Schleimhautarealen sollen prinzipiell in Stufen bearbeitet werden (mindestens 3-5 Schnittstufen). Es sollte Restmaterial für eventuelle immunhistologische Untersuchungen aufbewahrt werden. HE-Schnitte reichen in über 90% der Fälle für die Diagnose. B.2.6 Pathohistologische Begutachtung und Dokumentation Die Aussagen des pathohistologischen Gutachtens, die in jedem Fall zu treffen sind (sogenanntes Minimalprogramm), sind in Abbildung 3 dargestellt. Zusätzlich sind zu dokumentieren: -7- 8 Es sollte unbedingt neben dem Grading entsprechend der WHO-Klassifikation von 2004 auch das Grading entsprechend der WHO-Klassifikation von 1973 angegeben werden (siehe Abb. 3 und spezielle Erläuterung) Kommentar, wenn Tumordiagnose an nicht orthograd getroffenen Gewebeproben Carcinoma in situ (CIS) vorhanden: ja oder nein Carcinoma in situ in Brunnschen Epithelnestern sollte erwähnt werden Tumorausdehnung innerhalb der prostatischen Urethra muss gesondert untersucht und erwähnt werden Muskulatur (Detrusor) vorhanden: ja oder nein Zusätzliche Angaben (fakultativ) Anzahl der positiven Biopsien Immer klinisch angegebene Lokalisation berücksichtigen, vor allem bei Mapping Infiltration der Muscularis mukosae , wenn nachweisbar Blutgefäßinvasion (V1 = mikroskopische Veneninvasion) Lymphgefäßinvasion (L-Klassifikation) Andere relevante Befunde: z. B. Ausmaß der Entzündung Repräsentativität des Materials nein, kein morphologisches Korrelat für einen suspekten Zystoskopiebefund ja, ausreichendes morphologisches Korrelat für einen suspekten Zystoskopiebefund fraglich Nachweis von potentiellen präkanzerösen Läsionen Dysplasie Ausdehnung der Läsion, Nachresektion Tumornachweis Grading (s.o.) Tumorausdehnung: Anzahl tumortragender Partikel und Größenangabe Histologischer Tumortyp [WHO 2004] TNM-Klassifikation 2010: Ta, mindestens T1, mindestens T2 Muskulatur (Muscularis propria) vorhanden: ja oder nein Unklare Befunde -8- 9 Abklärung durch Immunhistochemie ggf. konsiliarische Mitbegutachtung Für die Bearbeitung von Biopsien aus Nierenbecken und Ureter im Rahmen der prätherapeutischen Diagnostik gelten gleiche Bestimmungen. B.3 Schnellschnittuntersuchung (intraoperative mikroskopische Diagnostik) Indikationen zur Schnellschnittuntersuchung sind zurückhaltend zu stellen. Eine Schnellschnittuntersuchung kann indiziert sein, wenn vom histologischen Tumortyp das weitere operative Vorgehen abhängt, z. B. Ureterresektion bei Urothelkarzinomen des Nierenbeckens. Bei der Ureterresektion werden der proximale und der distale Resektionsrand untersucht. Durch den intraoperativen Schnellschnitt werden bei der radikalen oder partiellen Zystektomie metastasenverdächtige Lymphknoten untersucht. Obligat ist die Untersuchung der Ureteren und des urethralen Resektionsrandes nach radikaler Zystektomie bei fehlender präoperativer Biopsie der prostatischen Harnröhre. Bei der partiellen Zystektomie werden obligat die seitlichen Resektionsränder untersucht. B.4 Untersuchung von Zystektomiepräparaten B.4.1 Materialbehandlung Wenn möglich, wird das Präparat uneröffnet in frischem Zustand unter Schnellschnittbedingungen übersandt. Bei Postversand wird die Harnblase an der Vorderwand mit einem Y-Schnitt eröffnet und auf einer Korkplatte (o.ä.) mit Nadeln aufgespannt, Fixation in Formalin, dabei ausreichende Menge von Formalin (4% gepuffert). Keine weiteren Einschnitte. B.4.2 Information des Pathologen (Siehe allgemeine Erläuterungen 2) B.4.3 Makroskopische Beschreibung Die makroskopische Beschreibung umfasst: -9- 10 übersandtes Material: totale oder partielle Zystektomie, mitentfernte andere Organe, Maßangaben einschließlich Länge der entfernten Ureteren und Urethraanteile Versand in frischem oder fixiertem Zustand Tumorzahl und Lokalisation Größte Tumorausdehnung Makroskopischer Tumortyp Beziehung zu Ureterostien und Blasenausgang Minimale Entfernung zu Resektionsflächen: bei radikaler Zystektomie: urethral, Ureter rechts, Ureter links; bei partieller Zystektomie: seitliche Resektionsränder Mitentfernte Lymphknoten, gesondert eingesandte Lymphknoten B.4.4 Makropräparation (Zuschneiden) Prüfung des Zystektomiepräparates auf Vollständigkeit mit Abpräparation von Prostata, Samenblasen und Ductus deferens-Stümpfen Bei der Frau Abpräparation von Uterus und Adnexe Makroskopische Begutachtung nach ausreichender Fixation (18 – 36 Stunden) Inspektion von rechter und linker Seitenwand, Vorderwand, Hinterwand, insbesondere Region der Uretermündungen, Blasendach und Trigonum Maximale Wandstärke der Harnblase ausmessen, evtl. Farbmarkierung der pelvinen Oberfläche im Tumorbereich Gewebeblöcke vom Übergang des Blasenhalses bis in die prostatische Urethra in Längsrichtung einbetten Mapping der unauffälligen Harnblasenabschnitte aus der Nachbarschaft des Tumors Jede Lokalisation suspekter Areale dokumentieren Bei aufgespanntem Zystektomiepräparat evtl. Fotographie des Präparates mit Eintragung aller makroskopischer Befunde ähnlich wie bei der Suche nach Frühkarzinomen des Magens Bei der Frau Präparation des Überganges zu Uterusvorderwand und Vaginalvorderwand Präparation von Lymphknoten des perivesikalen Fettgewebes (bzw. Bifurkation der Aa. iliacae communes) Alle makroskopisch erkennbaren Lymphknoten sollten präpariert und eingebettet werden [UICC 2003] Eingebettet werden: 1. Ein Paraffinblock pro cm2 Tumor -10- 11 2. Urethrale Resektionsfläche sowie Resektionsflächen der Ureteren, bei partieller Zystektomie seitliche Resektionsflächen 1. Etwaige durch den Urologen markierte und makroskopisch auf Tumor verdächtige Stellen an der pelvinen Oberfläche des Präparates (lokal nicht radikal) 2. Beide Ureterostien 3. Trigonum 4. Rechte und linke Seitenwand, Hinterwand, Vorderwand 5. Blasendach 6. Alle tumorösen und ulzerösen Areale jeweils mit gesamter Wand, um die Tiefenausdehnung des Tumors exakt feststellen zu können 7. Beim Mann Tuschemarkierung der Prostataaußenfläche. Aufarbeitung des Apex und von je 3 Blöcken aus rechtem und linkem Prostatalappen (zum Ausschluss einer intraprostatischen Ausbreitung des Urothelkarzinoms bzw. zum Ausschluss eines gleichzeitig bestehenden Prostatakarzinoms), intraprostatische Harnröhre; vollständige Aufarbeitung der Prostata entsprechend der Leitlinien zum Prostatakarzinom muss bei Diagnose eines Prostatakarzinoms im zweiten Aufarbeitungsschritt noch möglich sein! 8. Sämtliche Lymphknoten getrennt nach Stationen (Lymphknoten mit > 5 mm Dicke werden äquatorial halbiert bzw. in bis 5 mm dicke Scheiben lamelliert und einzeln eingebettet, kleinere Lymphknoten einer Station können jeweils ungeteilt zusammen in einer Kapsel eingebettet werden. Die Größe der metastatischen Lymphknoten ist zu dokumentieren. Eine Untersuchung von mindestens 8 Lymphknoten ist für die pN-Klassifikation notwendig [UICC 2003]. Kapselüberschreitendes Wachstum der Metastasen ist zu dokumentieren. B.4.5 Mikroskopische Bearbeitung Stufenschnitte sind nicht notwendig, HE Färbung. B.4.6 Pathohistologische Begutachtung und Dokumentation Die erforderlichen Aussagen, die mit einem Minimalprogramm erbracht werden müssen, sind in Abbildung 5 zusammengefasst. Bei Vorliegen mehrerer synchroner Karzinome wird bei der TNM/pTNM-Klassifikation der am weitesten fortgeschrittene Tumor berücksichtigt und der T/pT-Kategorie entweder (m) (für multipel) oder die Zahl der synchronen Karzinome in Klammern zugesetzt. Dabei werden papilläre Karzinome (invasiv und nicht-invasiv) und nicht-papilläre invasive Karzinome -11- 12 gezählt. Das Vorkommen zusätzlicher in-situ-Karzinome wird durch den Zusatz “is“ angezeigt. Fakultativ kann das Vorkommen ausschließlich von Mikrometastasen (< 0,2 cm) durch den Zusatz von (mi) zu pN oder pM angegeben werden. Isolierte (disseminierte) Tumorzellen in Lymphknoten oder z. B. Knochenmarksbiopsien werden mit „(i)“ gekennzeichnet. Das Präfix „y“ wird der pTNM-Formel voran gesetzt, wenn eine präoperative Radio- und/oder Chemotherapie voraus gegangen ist im Sinne einer neoadjuvanten Therapie. B.4.7 Optionale, aber nicht obligate Untersuchungen Derzeit sind immunhistologische Untersuchungen zur Klassifikation von Urothelkarzinomen im Allgemeinen nicht erforderlich. Werden zusätzliche zytologisch-histologische und immunhistochemische Parameter untersucht, soll das Ergebnis dokumentiert werden. Gegebenenfalls soll die histopathologische Responsebeurteilung nach präoperativer Radiound/oder Chemotherapie vorgenommen werden (siehe A.5 und B.1.6). Mit verschiedenen immunzytochemischen Markern (z.B. Lewis-X Antigen, ImmunoCyt: IM 344, LDQ 10, 19A211) kann die Sensitivität der Urinzytologie bis auf 94% angehoben werden. Dies geht aber meistens zu Lasten der Spezifität, die dann bis auf 80% absinken kann. Dennoch haben diese Verfahren in der Nachsorge therapierter Urothelkarzinome zur Rezidiv-Diagnostik einen Stellenwert (Vermeidung von Zystoskopien bei negativem Befund) [Planz et al. 2001, Lodde et al. 2004, Tetu et al. 2004]. Während der DNA-Durchflusszytometrie wegen zu geringer Sensitivität kein Stellenwert zukommt, kann die DNA-Bildzytometrie durch Ablärung zytomorphologisch verdächtiger Zellen die Sensitivität der Urinzytologie auf 87% anheben (Spezifität 100%] [Planz et al. 2001]. Dieselbe Indikation hat die chromosomale Fluoreszenz-in-situ Hybridisierung (FISH), mit deren Hilfe die Sensitivität auf 81% angehoben werden kann (Spezifität 96%] [Bubendorf et al. 2001, Dalquen et al. 2002, Halling et al. 2000, Sauter et al. 1993, 1997, 2002]. Mutationsanalysen für p53 und p63 werden in Hinblick auf ihre prädiktive Wertigkeit evaluiert [Helpap et al. 2003, Moch et al. 1993,1994, Schmitz-Dräger et al. 2000, Wagner et al. 1995]. B.5 Nierenbecken- und Ureterkarzinome -12- 13 Da bei Nierenbeckentumoren in der Regel auch die Ureteren mitentfernt werden, wird die Makroskopie zusammen beschrieben. B.5.1 Materialbehandlung Wenn möglich wird das Präparat uneröffnet in frischem Zustand unter Schnellschnittbedingungen übersandt. Bei Postversand wird das Resektat in ausreichender Menge von 4% gepuffertem Formalin fixiert (3 Teile Formalin zu 1 Teil Gewebe). Keine weiteren Einschnitte. B.5.2 Information des Pathologen (siehe allgemeine Erläuterungen 2) B.5.3 Makroskopische Beschreibung Beschreibung der Ureterpräparate mit minimalem und maximalem Durchmesser sowie Länge Dokumentation der Tumoren des Nierenbeckens und ihrer Beziehung zum peripelvinen Fettgewebe sowie zum Nierenparenchym Dokumentation der Abtragungsebene des Hilusfettgewebes B.5.4 Makropräparation (Zuschneiden) Tumoren des Nierenbeckens werden in ihrer Beziehung zum peripelvinen Fettgewebe, zum Nierenparenchym und zur Abtragungsebene des Hilusfettgewebes beschrieben und entnommen. Zusätzlich werden die Abtragungsebene des Ureters eingebettet und 1 - 2 Blöcke aus makroskopisch tumorfreier Nierenbeckenschleimhaut und 1 Block aus dem tumorfernen Nierengewebe untersucht. Bei einem Ureterpräparat werden zunächst die Absetzungsränder abgetrennt und getrennt eingebettet. Danach erfolgt bei makroskopisch erkennbarer tumoröser Auftreibung des Ureters das Lamellieren dieses Abschnittes soweit, bis kein Tumorgewebe kranial und kaudal dieser Läsion mehr erkennbar ist. Die verbliebenen Segmente werden in Längsrichtung eröffnet. Neben dem komplett einzubettenden Tumor wird pro 2 cm Länge des Präparates ein Paraffinblock hergestellt. Hängt eine Niere an, wird der Übergang zum Nierenbecken gesondert gekennzeichnet. Auf die Beziehung eines Uretertumors zur äußeren Präparatezirkumferenz ist zu achten und ggf. Gewebe für die Beurteilung der Resektionsfreiheit einzubetten. -13- 14 B.5.5 Mikroskopische Bearbeitung Stufenschnitte sind nicht notwendig, HE Färbung. B.5.6 Pathohistologische Begutachtung und Dokumentation Operationspräparat komplett/Traumatisierung (wo?)/ggf. Zust. n. TUR Größe und Sitz des Tumors, Multifokalität Einbruch in Blut- oder Lymphgefäße, Perineuralscheideninfiltration Histologischer Tumortyp [Eble et al. 2004] Histologischer Malignitätsgrad [Eble et al. 2004, entsprechend WHO-Klassifikation 2004 und WHO-Klassifikation 1973, fakultativ: nach Helpap 2002] lokale Tumorausbreitung (T/pT-Kategorie; siehe Erläuterungen zur TNM-Klassifikation) Andere relevante Befunde - Carcinoma in situ - Entzündung - Prämaligne Läsionen - urotheliale Dysplasien - evtl. immunhistochemische Abklärung weitere Befunde Lymphknotenstatus: Anzahl der Lymphknoten, Anzahl und Größe evtl. Metastasen -14- 15 ALLGEMEINE ERLÄUTERUNGEN 1. Allgemeine Erläuterungen zur Materialbehandlung Operativ entferntes Gewebe ist unversehrt an das Institut für Pathologie zu übersenden. Eine Gewebeentnahme, z. B. für molekularpathologische Untersuchungen, muss durch den Pathologen erfolgen. Dabei ist zu berücksichtigen, dass notwendige Klassifikationen eines Tumors (besonders R- und TNM-Klassifikation) nicht beeinträchtigt werden dürfen. H. Höfler [1995] hat in einer Stellungnahme zur Einrichtung von „Tumor/Gewebebanken“ festgestellt: „Die Entnahme von Normal- und Tumorgewebe aus frischen Operationspräparaten soll nur durch makroskopisch geschulte Pathologen erfolgen, die auch Erfahrungen mit der Erstellung von pathohistologischen Befunden haben, optimalerweise von dem das Präparat befundenden Pathologen selbst“. Die Asservierung von Tumorgewebe zu nicht-diagnostischen Zwecken setzt in jedem Fall eine präoperative Aufklärung mit schriftlicher Einwilligung des Patienten voraus [Höfler 2004, Stellungnahme des nationalen Ethikrates 17. März 2004]. 2. Allgemeine Erläuterungen zur Information des Pathologen Informationen an den Pathologen sind am besten (fakultativ) unter Verwendung eines Formblattes (Abbildung 1) zu übermitteln: Patientendaten (Name, Identifikationsnummer), Geburtsdatum, Geschlecht, verantwortlicher Arzt (Name, Telefonnummer), Tag der Entnahme, Indikation, Lokalisationsangabe (Trigonum, Vorderwand, Hinterwand, Seitenwand, Urethra), klinische Angaben (Anamnese, Verdachtsdiagnose, bei Männern: PSA-Serologie, T-Kategorie, ggf. Vorbefunde). -15- 16 Abbildung 1. Information des Pathologen bei transurethraler Resektion [modifiziert nach Böhle et al. 1998] Patientendaten ........................................................... Operateur ................................ O Erstmanifestation O Rezidivtumor Angaben bei Rezidivtumor Ersttumor Datum der Diagnose Monat _________________ Jahr _________________ Grading (WHO 1973) Grading (WHO 2004) T O G1 O PUN PMP O Ta O Tis O G2 O G3 O Low grade O High grade O T1 O T2 O T2aO T2b Vorangegangene endovesikale Therapie O Nein O Ja Vorangegangene Radiotherapie O Nein O Ja Vorangegangene Chemotherapie (endoluminal) O Nein O Ja Vorangegangene Radiochemotherapie O Nein O Ja Angaben zum jetzigen Tumor Verdachtsdiagnose ............................................................................................ T-Kategorie nach klinischer Beurteilung ............................................................ PSA-Serologie ................................................................................ Lokalisation Seitenangabe 1 2 3 4 Blasenhals O O O O Trigonum O O O O Seitenwand O O O O Vorderwand O O O O Hinterwand O O O O Fundus O O O O Urachus O O O O Rechts O O O O Links O O O O Zentral O O O O -16- 17 Fortsetzung Abbildung 1 Lokalisation in Divertikel Makroskopischer Typ O O O O Flach O O O O Papillär O O O O Ulzerös O O O O Verdacht auf Invasion von Nachbarorganen O Nein O Ja Klinisch Fernmetastasen O Nein O Ja Klinische R-Klassifikation (nur bei Zystektomie mit Prostatektomie) Makroskopischer Residualtumor O Nein O Ja Wenn ja: Lokalisation des Residualtumors O Lokoregionär O Fernmetastasen, Lokalisation der Fernmetastasen............... Mikroskopische Bestätigung des Residualtumors? O Nein O Ja .................................................... …………………………………………………………. Datum Unterschrift 3. Allgemeine Erläuterungen zur histologischen Typenbestimmung Grundsätzlich gilt für das Typing von Harnblasentumoren, dass immer dann, wenn neben nicht urothelial differenziertem Karzinomgewebe Anteile eines invasiven oder in situ Urothelkarzinoms nachweisbar sind, dieser Tumor als Urothelkarzinom mit entsprechender „metaplastischer“ Karzinomkomponente klassifiziert werden sollte. Tabelle 1 zeigt einen Überblick über die WHO Klassifikation. -17- 18 Tabelle 1. WHO-Klassifikation Tumoren der Harnblase [Eble et al. 2004] Urotheliale Tumoren Invasives Urothelkarzinom 8120/3 Mit plattenepithelialer Differenzierung Glanduläre Neoplasien Adenokarzinom 8140/3 Mit glandulärer Differenzierung Intestinal Mit trophoblastärer Differenzierung Muzinös 8480/3 In Nestern Siegelringzellig 8490/3 Klarzellig 8310/3 Mikrozystisch Mikropapillär 8131/3 Lymphoepitheliom-ähnlich 8082/3 Villöses Adenom 8261/0 Lymphom-ähnlich Neuroendokrine Tumoren Plasmozytoid Kleinzelliges Karzinom 8041/3 Sarkomatoid 8122/3 Karzinoid 8240/3 Riesenzellig 8031/3 Paragangliom 8680/1 Undifferenziert 8020/3 Nicht-invasives Urothelkarzinom Melanozytäre Tumoren Urotheliales Karzinom in situ 8120/2 Malignes Melanom Nicht -invasives papilläres 8130/23 Naevus 8130/21 Mesenchymale Tumoren 8720/3 Urothelkarzinom, high grade Nicht-invasives papilläres Urothelkarzinom, low grade Rhabdomyosarkom 8900/3 Nicht-invasiver papillärer urothelialer 8130/1 Leiomyosarkom 8890/3 Tumor mit niedrig malignem Potential Angiosarkom 9120/3 8120/0 Osteosarkom 9180/3 8120/0 Malignes fibröses Histiozytom 8830/3 Urothelpapillom Urothelpapillom, invertierter Typ Plattenepitheliale Neoplasien Leiomyom 8890/0 Hämangiom 9120/0 Andere Plattenepithelkarzinom 8070/3 Verruköses Karzinom 8051/3 Hämatopoietische Tumoren und Lymphome Plattenepithelpapillom 8052/0 Malignes Lymphom Plasmozytom 9731/3 Verschiedenartige Tumoren Karzinom der Sken’schen, Cowper’schen und Littre’schen Drüsen Metastasen und direkt infiltrierende Tumoren von anderen Organen -18- 19 Invasives Wachstum des Urothelkarzinoms Die Festlegung, ob ein invasives Wachstum vorliegt, gehört zu den schwierigsten Entscheidungen in der urologischen Pathologie [Lopez-Beltran und Cheng 2003]. Die Gründe liegen zum einen in der Art und Qualität der entnommenen Probe, zum anderen in den Besonderheiten des Wachstumsverhaltens urothelialer Tumoren. Neben Kauterisierungsartefakten erschweren eine tangentiale Schnittführung durch das Tumorgewebe die Beurteilung und insbesondere die Identifizierung eines invasiven Wachstums. Grundsätzlich gilt, dass ein invasives Urothelkarzinom wesentlich häufiger bei einem schlecht differenzierten Karzinom zu erwarten ist als bei einem hoch- bis mäßig differenzierten Karzinom. Der Begriff der Mikroinvasion ist beim Urothelkarzinom nicht verbindlich definiert. Während Farrow et al. [1982] eine Definition von < 5 mm als Invasionstiefe angaben, halten Amin et al. [1997] eine Definition für mikroinvasives Wachstum von weniger als 2 mm für angemessen. Vergleich der WHO-Klassifikationen von 1973 [Mostofi et al. 1973] und 2004 [Eble et al. 2004] --------------------------------------------------------------------------------------------------------------------------- WHO 1973 Papillom WHO 2004 Papillom PUNLMP Grad 1 Low grade Grad 2 Low grade (70%) High grade (30%) Grad 3 High grade --------------------------------------------------------------------------------------------------------------------------- Sonstige Tumoren Zystadenom 8440/0 Nephroblastom (Wilmstumor) 8960/3 Rhabdoidtumor 8963/3 Keimzelltumoren Dottersacktumor 9071/3 Seminom 9061/3 Embryonales Karzinom und Teratom 9081/3 Choriokarzinom 9100/3 Klarzelliges Adenokarzinom 8310/3 Neuere Arbeiten definieren für die Abschätzung des Progressionsrisikos bei T1-Karzinomen > 1,5 mm oder > 1 Gesichtsfeld bei 400-facher Vergrößerung als mögliche Unterschei- -19- 20 dungskriterien von minimal bzw. ausgedehnt invasiven Urothelkarzinomen [Cheng et al. 1999, van der Aa et al. 2005, Bertz et al. 2011]. ------------------------------------------------------------------------------------------------------------------------Erläuterungen zu den neuroendokrinen Tumoren Kleinzellige Karzinome zählen zu den malignen neuroendokrinen Tumoren und leiten sich vom Urothel her. Histopathologisch sind die kleinzelligen Karzinome identisch mit denen der Lunge. Die Prognose ist schlecht, die durchschnittliche Überlebenszeit beträgt weniger als ein Jahr. Das Paragangliom der Harnblase leitet sich von den paraganglionären Zellen der Harnblasenwand ab. Es ist histologisch identisch mit Paragangliomen anderer Lokalisation. 4. Allgemeine Erläuterungen zum Grading Grading der Urothelkarzinome Das Grading urothelialer Tumoren ist seit Jahrzehnten einem kontinuierlichen Wandel unterworfen und hat auch mit dem im Jahr 2004 veröffentlichen neuen WHO-Vorschlag noch keine dauerhaft akzeptierte Form gefunden. Insbesondere die Einführung der neuen Kategorie des „papillären urothelialen Tumors mit niedrig malignem Potenzial“ ist umstritten, da hiermit eine 5. Kategorie bei den papillären Tumoren abgegrenzt wird. Morphologisch fällt nach den WHO-Kriterien ein Teil der ehemaligen Ta, G1-Tumoren in diese Kategorie. In verschiedenen Studien wird diese Tumorkategorie in 5 – 10% der nicht-invasiven papillären Tumoren diagnostiziert. Das Grading der Urothelkarzinome betrifft nur die papillären nichtinvasiven und invasiven Karzinome. Die WHO Klassifikation 2004 unterscheidet Papillome, papilläre urotheliale Neoplasien von niedrig malignem Potenzial (PUNLMP) sowie papilläre nicht invasive Urothelkarzinome vom low und high grade Typ. Die G1-Karzinome der alten WHO Klassifikation werden dabei teilweise dem PUNLMP zugerechnet. In der low grade Gruppe sind ebenfalls G1- und ein Teil von G2-Karzinomen zusammengefasst. Die high grade Gruppe schließt den anderen schlechter differenzierten Teil der G2- und die G3-Karzinome ein. Die Unterteilung der Grading Gruppe 2 entspricht dem Gradingssystem von Malmström et al. [1987]. Die Diskussion über die verschiedenen Gradingsysteme ist immer noch im Fluss [Bostwick und Mikuz 2002, Bush und Algaba 2002, Cheng und Bostwick 2000, Cheng et al. 2000, Epstein et al 1998, Helpap 2002]. Eine endgültige Aussage über die klinische Bedeutung und Sinnhaftigkeit des WHO-Gradings von 2004 ist zurzeit noch nicht möglich. Da die zurzeit in der Klinik verwendeten Nonogramme zur Risikostratifizierung auf dem Grading nach WHO 1973 beruhen [Sylvester et al. 2005], sollten die Grading-Systeme von 1973 und 2004 parallel angegeben werden. -20- 21 Papilläre urotheliale Neoplasie mit niedrig malignem Potenzial (PUNLMP) Papilläre Urotheltumoren mit niedrig malignem Potenzial stellen eine Gruppe von papillären Urotheltumoren dar, in die sicher ein Teil der früheren Ta, G1-Tumoren (nach der WHO Klassifikation von 1973) hineinfällt. Diese Tumoren haben ein minimales Progressionsrisiko, entwickeln aber relativ häufig Rezidive. Der Nachweis eines invasiven Wachstums schließt bei der Primärdiagnose diese Tumorentität aus. Liegt eine papilläre urotheliale Neubildung mit den Charakteristika eines Tumors mit niedrig malignem Potenzial vor, aber besteht zugleich eine invasive Komponente, ist die Diagnose eines hochdifferenzierten papillären Urothelkarzinoms zu stellen. Das Risiko nachfolgend Tumoren mit gleichartigem histologischem Bild oder papilläre Urothelkarzinome zu entwickeln, ist erhöht. Beim Grading von Urotheltumoren müssen folgende Prinzipien beachtet werden: 1. Streng genommen gilt das Grading nur für papilläre nicht invasive Tumoren. 2. Bei invasiven Karzinomen sollte unbedingt ein Grading nach WHO 1973 erfolgen (G2 oder G3). Invasive hoch differenzierte Urothelkarzinome (G1) sollten mit äußerster Zurückhaltung diagnostiziert und die Invasivität der Läsion verifiziert werden. 3. Es sollten nur orthograd getroffene Schleimhautabschnitte zum Grading verwendet werden. 4. Maßgeblich für das Grading ist der am schlechtesten differenzierte Tumoranteil. 5. Das urotheliale Carcinoma in situ ist immer ein schlecht differenziertes nicht invasives Karzinom und identisch mit der schweren Dysplasie. 5. Allgemeine Erläuterungen zum Regressionsgrading Bestrahlungen, BCG- oder Chemotherapien hinterlassen am Stroma nach chirurgischer Entfernung von urothelialen Neoplasien zytologische und histologische Folgen wie epitheloide und riesenzellige Granulome, lymphozytäre Infiltrate (BCG) oder Stromasklerosierung und Gefäßobliteration (Bestrahlungen). Im atypischen Urothel sind Kernpyknosen, vermehrt Apoptosen, Schwund von prätherapeutisch prominenten Nukleolen und Mitosen, Absinken molekularbiologischen bzw. Faktoren Fehlen wie des p53, MIB-1-Proliferationsindex, etc. nachweisbar. Ein Abfall von numerisches Regressionsgrading wie bei Prostatakarzinomen wird nicht durchgeführt. 6. Allgemeine Erläuterungen zur anatomischen Ausbreitung vor Therapie/pTNMKlassifikation -21- 22 Für Karzinome des Nierenbeckens, des Ureters und der Harnblase wird die anatomische Ausbreitung vor Therapie durch die TNM/pTNM-Klassifikation [7. Auflage, UICC 2010, UICC 2003, UICC 2005] beschrieben. TNM-Klassifikation von Tumoren des Nierenbeckens (ICD-O C65) und des Ureters (ICD-O C66) T/pT-Klassifikation (p)TX Primärtumor kann nicht beurteilt werden (p)T0 Kein Anhalt für Primärtumor (p)Ta Nichtinvasives papilläres Karzinom (p)Tis Carcinoma in situ (p)T1 Tumor infiltriert subepitheliales Bindegewebe (p)T2 Tumor infiltriert Muskularis (p)T3 Nierenbecken: Tumor infiltriert durch die Muskulatur in das peripelvine Fettgewebe oder Nierenparenchym Ureter: Tumor infiltriert durch die Muskulatur in das periureterale Fettgewebe (p)T4 Tumor infiltriert Nachbarorgane oder durch die Niere in das perirenale Fettgewebe Erfordernisse für pT pTa, pTis, pT1, pT2 oder pT3 Histopathologische Untersuchung des Primärtumors ohne makroskopischen Tumornachweis an den Resektionsrändern (mit oder ohne mikroskopisch tumorfreien Resektionsrändern). pT4 Histologischer Nachweis der Invasion von perirenalem Fettgewebe oder benachbarter Organe (zu denen auch das Peritoneum parietale zählt) N/pN-Klassifikation (p)NX Regionäre Lymphknoten können nicht beurteilt werden (p)N0 Keine regionären Lymphknotenmetastasen (p)N1 Metastase(n) in solitärem Lymphknoten, 2 cm oder weniger in größter Ausdehnung (p)N2 Metastase(n) in solitärem Lymphknoten, mehr als 2 cm, aber nicht mehr als 5 cm in größter Ausdehnung, oder in multiplen Lymphknoten, keine mehr als 5 cm in größter Ausdehnung -22- 23 (p)N3 Metastase(n) in Lymphknoten, mehr als 5 cm in größter Ausdehnung Erfordernisse für pN pN0 Histologische Untersuchung von mindestens 8 tumorfreien Lymphknoten pN1 Histologische Bestätigung von Metastase(n) in einem regionären Lymphknoten pN2 Histologische Bestätigung von Metastase(n) in einem solitären Lymphknoten, mehr als 2 cm, aber nicht mehr als 5 cm in größter Ausdehnung, oder histologische Bestätigung von Metastasen in multiplen Lymphknoten, keine mehr als 5 cm in größter Ausdehnung pN3 Histologische Bestätigung von Metastase(n) in Lymphknoten, mehr als 5 cm in größter Ausdehnung pM-Klassifikation (p)M0 Keine Fernmetastasen (nur bei Obduktionsfällen) (p)M1 Fernmetastasen Erfordernisse für pM1 Mikroskopischer (histologischer oder zytologischer) Nachweis von Fernmetastasen -23- 24 Schema zur TNM/pTNM-Klassifikation von Nierenbecken und Harnleiter, 7. Auflage (UICC 2010) TNM pTNM Primärtumor kann nicht beurteilt werden O TX O pTX Kein Anhalt für Primärtumor O T0 O pT0 Nichtinvasives papilläres Karzinom O Ta O pTa Carcinoma in situ (“flat tumour”) O Tis O pTis Tumor infiltriert subepitheliales Bindegewebe O T1 O pT1 Tumor infiltriert Muskularis O T2 O pT2 Nierenbecken: Tumor infiltriert durch die Muskulatur in das O T3 O pT3 O T3 O pT3 O T4 O pT4 Regionäre Lymphknoten können nicht beurteilt werden O NX O pNX Keine regionären Lymphknotenmetastasen O N0 O pN0 Metastase(n) in solitärem Lymphknoten, 2 cm oder weniger in O N1 O pN1 O N2 O pN2 O N3 O pN3 Primärtumor peripelvine Fettgewebe oder Nierenparenchym Ureter: Tumor infiltriert durch die Muskulatur in das periureterale Fettgewebe Tumor infiltriert Nachbarorgane oder durch die Niere in das perirenale Fettgewebe Regionäre Lymphknoten größter Ausdehnung Metastase(n) in solitärem Lymphknoten, mehr als 2 cm, aber nicht mehr als 5 cm in größter Ausdehnung, oder in multiplen Lymphknoten, keine mehr als 5 cm in größter Ausdehnung Metastase(n) in Lymphknoten, mehr als 5 cm in größter Ausdehnung Fernmetastasen Keine Fernmetastasen O M0 Fernmetastasen O M1 O pM1 -24- 25 Klinische Stadiengruppierung T M0 M1 N0 N1, N2, N3 Ta 0a - - Tis 0is - - T1 I IV IV T2 II IV IV T3 III IV IV T4 IV IV IV Erläuterungen Wenn T0 oder TX - sofern M1: Stadium IV - sofern M0N1-3: Stadium IV - sofern T4N0M0: Stadium IV - sonst: Stadium unbestimmt Wenn M0 - sofern T1N0: Stadium I - sofern T4N0: Stadium IV - sofern N1, 2, 3: Stadium IV - sonst: Stadium unbestimmt Wenn NX - sofern M1: Stadium IV - sofern TaM0 oder TaM0: Stadium 0a - sofern TisM0 oder TisM0: Stadium 0is - sofern T1M0 oder T1M0: Stadium I - sofern T4: Stadium IV - sonst: Stadium unbestimmt -25- 26 Definitive Stadiengruppierung Für die definitive Stadiengruppierung sind bezüglich Primärtumor und regionäre Lymphknoten pT und pN maßgebend. Nur wenn pTX bzw. pNX vorliegt, wird die klinische T-bzw. N-Kategorie für die definitive Stadiengruppierung herangezogen. Bei Unterschieden zwischen der klinisch festgestellten M-Kategorie und der pathologischen pM-Kategorie ist im Einzelfall jeweils unter Berücksichtigung der Gesamtsituation festzulegen, welche Kategorie für die Gesamtbeurteilung (Gesamt-M) bei der Stadiengruppierung maßgeblich ist. Definitive Stadiengruppierung T Gesamt-M0 Gesamt-M1 pN0 pN1-3 pTa 0a - - pTis 0is - - pT1 I IV IV pT2 II IV IV pT3 III IV IV pT4 IV IV IV Erläuterungen Wenn pTX und TX oder pTX und T0 oder pT0: - sofern Gesamt-M1: Stadium IV - sofern pN1-3: Stadium IV - sonst: Stadium unbestimmt Wenn Gesamt-M0 - sofern pTapN0: Stadium 0a - sofern pTispN0: Stadium 0is - sofern pT4: Stadium IV - sofern pN1-3: Stadium IV - sonst: Stadium unbestimmt Wenn pNX und NX - sofern pTapN0: Stadium 0a -26- 27 - sofern pTispN0: Stadium 0is - sofern Gesamt-M1: Stadium IV - sofern pT4Gesamt-M0: Stadium IV - sonst: Stadium unbestimmt TNM-Klassifikation von Tumoren der Harnblase (ICD-O C67) T/pT-Klassifikation (p)TX Primärtumor kann nicht beurteilt werden (p)T0 Kein Anhalt für Primärtumor (p)Ta Nichtinvasives papilläres Karzinom (p)Tis Carcinoma in situ („flat tumour“) (p)T1 Tumor infiltriert subepitheliales Bindegewebe (p)T2 Tumor infiltriert Muskulatur (p)T3 (p)T2a Tumor infiltriert oberflächliche Muskulatur (innere Hälfte) (p)T2b Tumor infiltriert tiefe Muskulatur (äußere Hälfte) Tumor infiltriert perivesikales Fettgewebe (p)T3a Mikroskopisch (p)T3b Makroskopisch (extravesikaler Tumor) (p)T4 Tumor infiltriert Prostata oder Uterus oder Vagina oder Becken- oder Bauchwand (p)T4a Tumor infiltriert Prostata oder Uterus oder Vagina (p)T4b Tumor infiltriert Becken- oder Bauchwand Erfordernisse für pT pTa, pTis, pT1, pT2 oder pT3 Histopathologische Untersuchung eines partiellen oder totalen Zystektomiepräparates ohne makroskopischen Tumornachweis an den Resektionsrändern (mit oder ohne mikroskopischen Tumornachweis). Problematisch ist die Klassifikation von Blasentumoren nach einer transurethralen Resektion. Die Bedingungen für eine Klassifikation nach pT können nur im Falle einer kompletten Tumorresektion als erfüllt angesehen werden. Das bedeutet, dass jegliches makroskopisch sichtbares Tumorgewebe aus der danach makroskopisch tumorfreien benachbarten -27- 28 Blasenwand (tief und lateral) entfernt werden muss. Wenn diese zusätzlich entfernten und separat eingesandten Gewebeproben histologisch tumorfrei sind, kann eine komplette Resektion angenommen werden. Nur bei solchen Patienten können die Kategorien pTaNXM0 oder pT1NXM0 als „pathologisch“ (p) angesehen werden. pT4 Histologischer Nachweis der Invasion von jedem der folgenden: Prostata, Uterus, Vagina, Beckenwand, Bauchwand, Dünndarm, Samenblasen, Peritoneum. N/pN-Klassifikation (p)NX Regionäre Lymphknoten können nicht beurteilt werden (p)N0 Keine regionären Lymphknotenmetastasen (p)N1 Metastase(n) in solitärem Lymphknoten, 2 cm oder weniger in größter Ausdehnung (p)N2 Metastase(n) in solitärem Lymphknoten, mehr als 2 cm, aber nicht mehr als 5 cm in größter Ausdehnung, oder in multiplen Lymphknpoten, keine mehr als 5 cm in größter Ausdehnung (p)N3 Metastase(n) in Lymphknoten, mehr als 5 cm in größter Ausdehnung Erfordernisse für pN pN0 Histologische Untersuchung von mindestens 8 tumorfreien Lymphknoten pN1 Histologische Bestätigung von Metastase(n) in einem regionären Lymphknoten pN2 Histologische Bestätigung von Metastase(n) in einem solitären Lymphknoten, mehr als 2 cm, aber nicht mehr als 5 cm in größter Ausdehnung, oder histologische Bestätigung von Metastasen in multiplen Lymphknoten, keine mehr als 5 cm in größter Ausdehnung pN3 Histologische Bestätigung von Metastase(n) in Lymphknoten, mehr als 5 cm in größter Ausdehnung pM-Klassifikation (p)M0 Keine Fernmetastasen (p)M1 Fernmetastasen Erfordernisse für pM1 Mikroskopischer (histologischer oder zytologischer) Nachweis von Fernmetastasen. -28- 29 Schema zur TNM/pTNM-Klassifikation von Harnblase, 7. Auflage [UICC 2010] Primärtumor TNM pTNM Primärtumor kann nicht beurteilt werden O TX O pTX Kein Anhalt für Primärtumor O T0 O pT0 Nichtinvasives papilläres Karzinom O Ta O pTa Carcinoma in situ („flat tumour“) O Tis O pTis Tumor infiltriert subepitheliales Bindegewebe O T1 O pT1 Tumor infiltriert Muskularis O T2 O pT2 Tumor infiltriert oberflächliche Muskulatur (innere Hälfte) O T2a O pT2a Tumor infiltriert tiefe Muskulatur (äußere Hälfte) O T2b O pT2b Tumor infiltriert perivesikales Fettgewebe O T3 O pT3 Mikroskopisch O T3a O pT3a Makroskopisch (extravesikaler Tumor) O T3b O pT3b Becken- oder Bauchwand O T4 O pT4 Tumor infiltriert Prostata oder Uterus oder Vagina O T4a O T4a Tumor infiltriert Becken- oder Bauchwand O T4b O pT4b Regionäre Lymphknoten können nicht beurteilt werden O NX O pNX Keine regionären Lymphknotenmetastasen O N0 O pN0 Metastase(n) in solitärem Lymphknoten, 2 cm oder weniger in O N1 O pN1 O N2 O pN2 O N3 O pN3 Tumor infiltriert Prostata oder Uterus oder Vagina oder Regionäre Lymphknoten größter Ausdehnung Metastase(n) in solitärem Lymphknoten, mehr als 2 cm, aber nicht mehr als 5 cm in größter Ausdehnung, oder in multiplen Lymphknoten, keine mehr als 5 cm in größter Ausdehnung Metastase(n) in Lymphknoten, mehr als 5 cm in größter Ausdehnung Fernmetastasen Keine Fernmetastasen O M0 Fernmetastasen O M1 O pM1 -29- 30 Klinische Stadiengruppierung T M0 M1 N0 N1, N2, N3 Ta 0a - - Tis 0is - - T1 I IV IV T2 II IV IV T3 III IV IV T4 IV IV IV Erläuterungen Wenn T0 oder TX - sofern M1: Stadium IV - sofern M0N1-3: Stadium IV - sofern T4N0M0: Stadium IV - sonst: Stadium unbestimmt Wenn M0 - sofern TaN0: Stadium 0a - sofern TisN0: Stadium 0is - sofern T1N0: Stadium I - sofern T4aN0: Stadium III - sofern T4bN0: Stadium IV - sofern N1, 2, 3: Stadium IV - sonst: Stadium unbestimmt Wenn NX - sofern M1: Stadium IV - sofern TaM0 oder TaM0: Stadium 0a - sofern TisM0 oder TisM0: Stadium 0is - sofern T1M0 oder T1M0: Stadium I - sofern T4aN0: Stadium III - sofern T4bN0: Stadium IV - sonst: Stadium unbestimmt -30- 31 Definitive Stadiengruppierung Für die definitive Stadiengruppierung sind bezüglich Primärtumor und regionäre Lymphknoten pT und pN maßgebend. Nur wenn pTX bzw. pNX vorliegt, wird die klinische Tbzw. N-Kategorie für die definitive Stadiengruppierung herangezogen. Bei Unterschieden zwischen der klinisch festgestellten M-Kategorie und der pathologischen pM-Kategorie ist im Einzelfall jeweils unter Berücksichtigung der Gesamtsituation festzulegen, welche Kategorie für die Gesamtbeurteilung (Gesamt-M) bei der Stadiengruppierung maßgeblich ist. Definitive Stadiengruppierung T Gesamt-M0 Gesamt-M1 pN0 pN1-3 pTa 0a - - pTis 0is - - pT1 I IV IV pT2 II IV IV pT3 III IV IV pT4 IV IV IV Erläuterungen Wenn pTX und TX oder pTX und T0 oder pT0: - sofern Gesamt-M1: Stadium IV - sofern pN1-3: Stadium IV - sonst: Stadium unbestimmt Wenn Gesamt-M0 - sofern pTapN0: Stadium 0a - sofern pTispN0: Stadium 0is - sofern pT4: Stadium IV - sofern pN1-3: Stadium IV - sonst: Stadium unbestimmt Wenn pNX und NX - sofern pTaGesamt-M0: Stadium 0a -31- 32 - sofern pTisGesamt-M0: Stadium 0is - sofern pT1Gesamt-M0: Stadium I - sofern Gesamt-M1: Stadium IV - sofern pT4Gesamt-M0: Stadium IV - sonst: Stadium unbestimmt pT: Die Kategorie Ta sollte nur vergeben werden, wenn ausreichend Grund- und Randbiopsien vorliegen (siehe Seite .). Bei unklarer Situation ist der Befund bei bioptischem Material mit der Beifügung „mindestens“ zu versehen. Die Kategorie T1 wird in den aktuellen TNM-Klassifikationen nicht unterteilt. In der Literatur wird jedoch auch eine Unterteilung in (p)T1a und (p)T1b vorgenommen. Hier entspricht die Kategorie (p)T1a der Infiltration bis einschließlich in die Muscularis mucosae und die Kategorie (p)T1b einer Tumorinfiltration jenseits der Muscularis mucosae bis zur Muscularis propria. Alternativ kann auch eine semiquantitative oder morphometrische Analyse mit dem diskriminierenden Wert von 1,5 mm angewendet werden [Cheng et al., 1999]. Ein weiterer Vorschlag ist die Quantifizierung des invasiven Anteils in < 1HPF und > 1 HPF [van de Aa et al.2005, Bertz et al. 2011]. Welche Methode bei der Unterteilung der Stadien angewandt wird, sollte unbedingt mit dem Urologen abgesprochen werden. Eine direkte Infiltration des distalen Ureters wird über die Tiefe der Invasion in angrenzende Organe klassifiziert. Einige Harnblasenkarzinome zeigen eine assoziierte in situ Komponente mit Ausbreitung in Prostatagänge oder Drüsen der Prostata ohne direkte Infiltration in die Prostata. Diese Karzinome werden nicht T4 verschlüsselt, sondern sollten entweder mit der Vorsilbe „is“ , z. B. T2(is), durch die Vorsilbe „is pu“ (Ausbreitung in die prostatische Harnröhre), „is pd“ (Ausbreitung in Prostatadrüsen), z. B. T2 (is pu) oder T2 (is pd) dokumentiert werden. Eine Infiltration eines Harnblasenkarzinoms in die prostatische Harnröhre entspricht einer Invasion in die Prostata und wird somit mit T4 klassifiziert. Die Infiltration der Samenblasen sollte mit T4a verschlüsselt werden. Eine Infiltration der Lamina muscularis mucosae ist nicht gleichzusetzen mit einer Infiltration der Muskularis, die sich auf die Lamina muscularis propria bezieht. Auch entspricht eine Infiltration ins Fettgewebe nicht immer einer extravesikalen Ausbreitung, da Fettgewebe in allen Schichten der Harnblase vorkommen kann. Neben den Beckenlymphknoten zählen auch die inguinalen Lymphknoten zu den regionären Lymphknoten der Urethra, wobei die Seitenlokalisation für die pN Klassifikation ohne Belang ist. Seit der TNM-Klassifikation von 1997 existiert eine eigene Klassifikation bei Tumoren der Harnröhre für Urothelkarzinome der Prostata bzw. der prostatischen Urethra. Die direkte Ausbreitung eines Karzinoms in der Harnblase im Bereich der Ostien wird klassifiziert durch die Tiefe der größten Invasion in eines der involvierten Nachbarorgane. Bei mehreren synchronen Tumoren des Nierenbeckens und des Ureters wird der Tumor mit der höchsten T-Kategorie klassifiziert und die Anzahl der Tumoren angegeben, z. B. T2 (m) oder T3 (2). -32- 33 Bei synchronen Tumoren des Nierenbeckens und der Harnblase erfolgt die Klassifikation unabhängig und getrennt für beide Tumoren. Die Prognose von T3 Karzinomen des Ureters ist schlechter als die des Nierenbeckens und entspricht T4-Karzinomen des Nierenbeckens, weshalb Ureter und Nierenbecken separat analysiert werden sollten Bei multifokalen Tumoren von Nierenbecken und Harnleiter mit Ta- und Tis-Tumoren sollte Tis klassifiziert werden. -33- 34 SPEZIELLE ERLÄUTERUNGEN Spezielle Erläuterungen zu B.1. Zytologie Die rein zytomorphologische Untersuchung von Urin besitzt eine hohe Spezifität, jedoch weist sie bei hochdifferenzierten papillären Neoplasien des Urothels eine geringe Sensitivität auf [Bastacky et al. 1999, Jensen und Cohen 2004, Malik und Murphy 1999]. ProvokationsUrin weist den großen Vorteil auf, dass dessen Untersuchung einfach durchführbar ist und ohne weiteres wiederholt werden kann. Gezielt entnommene Spülflüssigkeiten oder Katheter-Urin enthalten mehr und besser erhaltene Urothelien als Spontanurin (vor allem bei Frauen). Dabei abgerissene, papillär erscheinende, regelrechte Urothelverbände bergen die Gefahr falsch positiver Tumordiagnosen. Essentiell für die zytologische Diagnostik von Urin oder Spülflüssigkeiten ist, dass seitens der Kliniker eine Information erfolgt, auf welche Art und Weise und an welcher Stelle des Harntraktes das zu untersuchende Material gewonnen wurde [Jensen und Cohen 2004]. Erläuterungen zu B.1.1 Materialentnahme Morgen-Urin ist für zytologische Untersuchungen ungeeignet, da er meist nur noch autolytische Urothelien enthält. Sog. Provokations-Urin, der nach dem Trinken von viel Flüssigkeit gelassen werden kann, eignet sich am besten für die Zytodiagnostik des Urothels. Gezielte Spülungen der Nierenbecken, der Ureteren oder der Harnblase erfolgen mit isotoner Kochsalzlösung. Diese Flüssigkeiten müssen unmittelbar nach ihrer Gewinnung weiterverarbeitet werden. Das heißt, dass die enthaltenen Zellen sofort einer alkoholischen Fixation zugeführt werden müssen, da sie ansonsten schnell autolytisch werden. Nativ oder durch Katheterspülung gewonnener Urin sollte im Volumenverhältnis 1:1 in 50 70% Alkohollösung erfolgen, da dadurch der Erhaltungszustand von zellulären Bestandteilen, insbesondere von DNA, RNA und Proteinen,besser ist [Jensen und Cohen 2004]. Begleitende Makrohämaturie, Harnwegsinfektionen, Harnsteinleiden, etc. schränken die Spezifität durch falsch-positive Ergebnisse ein [Jensen and Cohen 2004, Stella et al. 2000]. Erläuterungen zu B.1.1 Materialbehandlung Ziel ist eine sofortige Fixation der enthaltenen Zellen, entweder -34- 35 durch Zentrifugation des gesamten Volumens für 5 Minuten bei 500 g und anschließende Fixation des Sediments in 20ml Saccomannos Fixativ für mindestens 20 Minuten (empfehlenswert, kann auch durch den Einsender erfolgen), oder durch Mischen des Urins mit demselben Volumen 96%igen Alhohols (weniger empfehlenswert) von dem neuerlichen Sediment (5 Minuten bei 500 g) können entweder zwei Ausstriche (bei deutlich sichtbarem Sediment), oder Zytozentrifugations-Präparate (bei kaum sichtbarem Sediment) hergestellt werden (z.B. Rontina von Hettich) [Für Details siehe: A. Böcking et al. 2005]. Möglich ist auch eine alkoholische Sprayfixation von Sedimentausstrichen oder Zytozentrifugaten unfixierter Zellen. Stempeltechniken erlauben Abdrücke von an Filtern haftenden Zellen direkt auf Objektträger. Die am häufigsten angewandte und empfehlenswerteste Färbung ist die nach Papanicolaou [Jensen und Cohen 2004, Papanicolaou und Marshall 1945]. Diese existiert auch als Schnellfärbung für eine intraoperative zytologische Schnelldiagnostik. Erläuterungen zu B.1.5 Mikroskopische Bearbeitung Neue Techniken wie z.B. immunzytochemische Untersuchung oder FISH (Urovysion) können zusätzlich zur zytologischen Diagnostik angewandt werden. Ein neuer Test zum Nachweis von Zellen papillärer Urothelkarzinome ist NMP22, der, in verschiedenen Studien geprüft, eine deutlich höhere Sensitivität aufweist als die konventionelle Zytologie bei gleicher Spezifität [Moonen et al. 2005, Ponsky et al. 2001, Poulakis et al. 2001]. Daneben gibt es eine Reihe von anderen Techniken, die hier nicht näher erläutert werden sollen. Erläuterungen zu B.1.6 Mikroskopische Begutachtung Für die urinzytologische Befundung ist die Differenzierung von Urothelneoplasien in zwei große Gruppen hilfreich. Tumoren, die aus mikroskopisch weitgehend normal erscheinendem Urothel bestehen, sind von solchen zu unterscheiden, die von einem zytomorphologisch deutlich als maligne erkenntlichen Urothel bedeckt werden. Flache urotheliale Neoplasien zeigen in der Regel an der Oberfläche stark atypisches Urothel, während papilläre Karzinome oft nur leichte bis mäßige bis schwere Zellatypien aufweisen. -35- 36 An Hand dieser abgeschilferten, stark atypischen Urothelien sind die zytologischen Diagnosen von hochmalignen invasiven Karzinomen, schweren Dysplasien bzw. in situ Karzinomen zu stellen. Die Sensitivität und Spezifität liegt bei über 95% [Rübben et al. 1989]. Papillome und niedrig maligne Urothelkarzinome sind dagegen schwer oder gar nicht exakt zytologisch zu erkennen und werden oft als suspekte Urothelien mit dem Verdacht auf Malignität diagnostiziert. Nach präoperativer BCG- oder Chemo- bzw. Strahlentherapie wird oft der Verdacht auf Tumorzellen geäußert. In diesen Fällen ist unbedingt ein Kontakt zwischen Urologen und Pathologen zu suchen [Helpap et al. 1994, Griesser 2002]. Differentialdiagnostische Raritäten sind plattenepitheliale Differenzierungen bzw. Metaplasien in Urothelkarzinomen (5%), drüsige (2%) und kleinzellige neuroendokrine Differenzierungen. Ferner sind Zellen in die Harnblase eingebrochener Karzinome, z. B. aus dem Dickdarm, Prostata oder Uterus zu beachten. Zytologische Merkmale maligner Urothelzellen – geringe Kernatypien – [nach Griesser 2002] Geringe Hyperchromasie der Zellkerne Gering vergröbertes, gleichmäßig verteiltes Chromatin Geringe Verschiebung der Kernplasmarelation Im Spontanurin gesteigerter Urothelzellgehalt -36- 37 Zytologische Merkmale maligner Urothelzellen –mäßige bis starke Kernatypien – [nach Griesser 2002] Mittlere bis starke Hyperchromasie der Zellkerne Scholliges, unregelmäßig verteiltes Chromatin Mittlere bis starke Kernpleomorphie Stark verschobene Kernplasmarelation Nukleolen in einigen bis vielen Tumorzellen Im Spontanurin gesteigerter Gehalt atypischer Zellen Bedeutung der vergleichenden Betrachtung zystoskopischer und zytologischer Befunde [nach Griesser 2002] Zystoskopie Zytologie Interpretation Papillärer Tumor Keine atypischen - Papillom Zellen - PUNLMP - Papillärer Tumor papilläres Karzinom, low.grade (G1) Suspekter/positiver papilläresKarzinom Befund - moderate grade (G2) Hochmalignes papilläres Karzinom, high-grade, ggf. mit Cis Kein Tumor Suspekter/positiver - Carcinoma in situ (Cis) Befund - Karzinom in Ureter/Nierenbecken Erläuterungen zu B.2 Erläuterungen zu B.2.1 Aus den transurethralen Biopsien ergibt sich neben der Malignitätsdiagnose die Indikation zur weiteren Behandlung, abhängig von dem Grading, der Invasionstiefe und dem Vorhandensein weiterer Läsionen, z. B. in zusätzlichen Biopsien -37- 38 aus eventuell vorhandenen suspekten Schleimhautarealen, die durch die Chromoendoskopie (photodynamische Diagnostik) oder andere Methoden besser sichtbar gemacht werden können. Diese Techniken verbessern die Sensitivität in der Detektion sehr kleiner papillärer Tumoren oder flacher urothelialer Läsionen [Durek und Jocham 2003, Riedl et al. 2001, Schmidbauer et al. 2004, Zaak et al. 2001]. Flache Urothelläsionen Dazu gehören die flache Urothelhyperplasie, reaktive Atypie, urotheliale Atypie unbekannter Signifikanz, Dysplasie und das Carcinoma in situ - Die reaktive (entzündliche) urotheliale Atypie kann bei akuten oder chronischen Entzündungen gleich welcher Ursache auftreten. - Eine urotheliale Atypie unbekannter/unklarer biologischer Signifikanz könnte theoretisch diagnostiziert werden, wenn das Maß reaktiver zytologischer Alterationen überschritten wird, so dass eine Dysplasie nicht ausgeschlossen werden kann. Die Gefahr dieser rein deskriptiven Kategorie ist, dass sie zum „waste basket“ für Läsionen wird, bei denen der Pathologe zögert, sich auf eine Festlegung zwischen reaktiver Atypie und Dysplasie festzulegen. Klinische Konsequenz dieser Diagnose ist, dass eine zeitnahe zystoskopische Kontrolle nach 3 bis 6 Monaten (bevorzugt mit photodynamischer Diagnostik) sowie urinzytologische Untersuchungen erfolgen, um ein Carcinoma in situ auszuschließen. - Die urotheliale Dysplasie (niedriggradige intraurotheliale Neoplasie) ist in ihrer Wertigkeit als präneoplastische Läsion einzustufen. Hierfür spricht ihr vorwiegendes Auftreten in Harnblasen mit malignen urothelialen Tumoren, während sie in tumorfreien Blasen relativ selten anzutreffen ist. Die Häufigkeitsangaben zur Urotheldysplasie schwanken zwischen 22-86% und erreichen bei invasiven Karzinomen z.T. 100%. Wenngleich es molekularpathologische Hinweise gibt, dass die urotheliale Dysplasie der Vorläufer von wenigstens einem Teil der Urothelkarzinome ist, ist ihr biologisches Potential noch weitgehend ungeklärt. Es scheint, als ob bei bekanntem Urothelkarzinom das Auftreten von Dysplasien das Rezidivrisiko und die Gefahr des Progresses erhöht. Jedoch entwickelten auch bei primär isolierter Dysplasie fast 20% der Patienten im weiteren Verlauf ein Carcinoma in situ oder ein invasives Karzinom. - Das Carcinoma in situ des Urothels (hochgradige intraurotheliale Neoplasie) umfasst nach der neuen Definition auch den größten Teil der Fälle, die früher als mittelschwere Dysplasie eingestuft wurden sowie praktisch alle Fälle der früheren schweren Dysplasie. Typisch für das Carcinoma in situ ist, dass nicht zwingend ein kompletter Schichtungsverlust vorliegen muss. Mehr als 90% der Carcinoma in situ finden sich bei Patienten mit papillären Karzinomen bzw. mit invasiven Karzinomen. Nur 10% werden primär diagnostiziert bzw. entstehen de novo. Klinische -38- 39 Verlaufsstudien haben gezeigt, dass bis zu 80% der Cis der Harnblase einen Progress zu einem invasiven Karzinom entwickeln (T1G3). Erläuterungen zu B.2.2 Informationen an den Pathologen können am besten unter Verwendung eines Formblattes übermittelt werden (Abbildung 1) Erläuterungen zu B.2.3 Makroskopischer Befund Bei Biopsien werden die Anzahl und die Größe der Biopsien registriert. Bei mehr als drei Proben in einem Gefäß werden die kleinste und die größte Biopsie ausgemessen. Falls eine papilläre Oberfläche erkennbar ist, wird diese vermerkt. Gewebsspäne einer TUR der Blase werden immer gewogen und sollten komplett eingebettet werden. Bei inkompletter Einbettung richtet sich das weitere Vorgehen nach dem histologischen Befund. Es sollte im Befund immer angegeben werden, wieviel Prozent der gesamten Späne untersucht wurden. Von jedem Block werden zunächst 2 Stufen hergestellt. Erläuterungen zu B.2.4 Mikroskopischer Befund Findet sich bei inkomplett eingebetten Spänen histologisch ein Tumor ohne Invasion oder fehlt die Muscularis propria, empfiehlt es sich, die verbliebenen Späne vollständig einzubetten (Abbildung 2). Fehlt auch nach vollständiger Einbettung des Gewebes die Muskulatur,muß dies in der Begutachtung insbesondere bei invasiven Tumoren ausdrücklich erwähnt werden! Eine Ausdehnung eines Carcinoma in situ in von Brunn´sche Epithelnester ist zu dokumentieren, da dies als Kontraindikation für eine topische Therapie diskutiert wird. Das genaue Ausmaß der Beteiligung der prostatischen Urethra (Oberflächlichenepithel vs. prostatische Gänge vs. Stromainvasion) ist aus therapeutischen und prognostischen Gründen zu dokumentieren. -39- 40 Abbildung 2. Aufarbeitungsrichtlinien für TUR-Späne der Harnblase Ko mmenta r [k1 ]: Aufarbeitungsrichtlinien für TUR Späne der Harnblase Gewicht der TUR - Späne <6g Immer komplette Einbettung >6g Detrusorinvasion + palliative Resektion + pTis +, pTa +, pT1 -Detrusorinvasion -- Inkomplett möglich Rest Komplett Kein Detrusornachweis Rest Komplett Erläuterungen zu B.2.6. Dokumentation Die pathologisch-anatomischen Befunde sind zweckmäßigerweise unter Verwendung eines Formblattes zu dokumentieren (Abbildung 3). -40- 41 Abbildung 3. Pathohistologisches Gutachten bei Harnblasenkarzinomen/ transurethrale Resektion – Minimalprogramm [modifiziert nach Böhle et al. 1998] bei multiplen Tumoren ist der am weitesten fortgeschrittene Tumor zu dokumentieren! Patientendaten 1. Zahl der Tumoren .............................. E-Nr. ................................................................. 2. Angaben zur R-Klassifikation F = Tumorfrei T = Tumorbefall X = Nicht untersucht a) Befunde an Resektionsflächen Tumorgrund O O O Seitliche Randproben O O O b) Falls verbindliche Aussagen über die klinische R-Klassifikation vorliegen: Definitive R-Klassifikation O 0 = Kein Residualtumor, 1 = Nur mikroskopischer Residualtumor (R1), 2= Makroskopischer Residualtumor, mikroskopisch nicht bestätigt (R2a), 3 = Makroskopischer Residualtumor, auch mikroskopisch bestätigt (R2b) Falls Residualtumor, Lokalisation Lokoregionär Fernmetastasen N = Nein O O J = Ja O O 3. T-Klassifikation O Ta O Tis O T1 O T2 O T2a O T2b O T3a O T3b Muskulatur im Resektat enthalten O Nein O Ja Trennung der Proben in äußere und innere Muskulatur O Nein O Ja 4. Histologischer Typ (WHO) O Urothelkarzinom in situ O Nicht invasives papilläres Urothelkarzinom, low grade O Nicht invasives papilläres Urothelkarzinom, high grade O Invasives Urothelkarzinom O Sonstige____________________________________ 5. Histologischer Differenzierungsgrad Grading (WHO 1973) O G1O G2 O G3 O GX Grading (WHO 2004) O PUNLMP 6. Klinisch angegebene Lokalisation 7. Gefäßinvasion Lymphgefäßinvasion Veneninvasion O Low grade 8120/2 8130/21 8130/23 8120/3 O High grade C 67 ............................................. O Ja O Nein O Nicht untersucht O Unbekannt O Ja, makroskopisch (V2) O Ja, mikroskopisch (V1) O Nein O Nicht untersucht O Unbekannt 8. Zusätzliche Angaben Carcinoma in situ in Brunn’schen Epithelnestern Infiltration der Muscularis mucosae 9. Assoziierte Harnblasenveränderungen O Dysplasie O Ja O Nein O Nicht untersucht O Unbekannt O Carcinoma in situ O Ausmaß der Entzündung ....................................................................... .................................................... …………………………………………………………. Datum Unterschrift -41- Abbildung 4. Diagnostik von nicht-invasiven papillären Urothelneoplasien Bei mittlerer Vergrößerung bietet der Tumor den Eindruck eines überwiegenden Musters von: Ordnung von Unordnung von architektonischen und architektonischen zytologischen Parametern und zytologischen Parametern PUNLMP oder nicht-invasives Papilläres Urothelkarzinom, low grade Leicht erkennbare Variabilität von Architektonischen und Zytologischen Parametern Nein Ja PUNLMP Nicht-invasives, papilläres nicht-invasives, papilläres Urothelkarzinom, low grade Urothelkarzinom, high grade Erläuterungen zu B.2.6. Kein Tumornachweis Sampling error? Zystitis zystica, granulomatöse chronische Zystitis TUR-Granulome, Atypien mit unklarer Bedeutung, glanduläre Metaplasien, myofibroblastäre Proliferationen, postoperativer Spindelzellknoten, fibröser Polyp Metaplasien und viele andere (s. TUR) Die transurethrale Resektion erlaubt nur die Unterscheidung zwischen Ta, T1 und T2. Die endgültige pT-Klassifikation kann nur an der Zystektomie erfolgen. Eine Infiltration der Lamina muscularis mucosae ist nicht gleichzusetzen mit einer Infiltration der Muskularis, die sich auf die Lamina muscularis propria bezieht. Bei Harnblasenbiopsien, die keine urotheliale Bedeckung aufweisen und keine tumorösen Infiltrate im Stroma enthalten, sollte bei der Aussage zur Dignität nur die Formulierung „Kein Nachweis eines invasiven Karzinoms“ gewählt werden, da ein Carcinoma in situ (vom „denuding Typ“) nicht ausgeschlossen werden kann. Eine Aussage wie „Kein Anhalt für Malignität“ würde hier zu weit gehen. 43 Abbildung 6. Flußdiagramm zur Entwicklung von low und high grade Karzinomen der Harnblase [modifiziert nach WHO 2004] putative modell of bladder cancer development hyperplasia non-invasive stable pTa G 1/2low-grad genetically stable normal normal urothelium dysplasia unstable G 2/3 CIS high-grad invasive pT1 genetically unstable pTa pt 2 - 4 Unterteilung von T1 In der WHO Klassifikation [2004] und vorangegangener Literatur werden bei den T1Tumoren der Harnblase unterschieden 1. zwischen einer Infiltration der Lamina propia oberhalb der Muscularis mucosae, 2. einer Infiltration der Lamina muscularis mucosae und 3. einer Infiltration über die Muscularis mucosae hinaus. Die Kategorien werden mit T1a, 1b und 1c bezeichnet [Angulo et al. 1995, 1997, Eble et al. 2004, Helpap 2002]. Hilfreich bei der Abgrenzung T1a und T1b ist der Nachweis des Palisading des atypischen Urothels. Bei Infiltration der Lamina muscularis mucosae ist das Palisading aufgehoben und die Zytokerationexpression 34ßE12 ist nicht mehr nur auf die basale Urothelschicht beschränkt, sondern wird diffus. Die Rezidivrate nimmt ab (p)T1b zu [Helpap und Köllermann 1999, 2000a, 2000b, Helpap 2002] Alternativ ist auch eine morphometrische Analyse mit dem diskriminierenden Wert von 1.5 ((p)T1a/1b) oder die semiquantitative Abschätzung des Ausmaßes der -43- 44 Tumorinfiltration (< 1 HPF od. > 1 HPF) anzuwenden [Cheng et al. 1999, van de Aa et al.2011, Bertz et al. 2011)]. Wenn das zu untersuchende Material keine Muskulatur enthält, sollte T1 angewandt werden. Jedoch muss der Kliniker darüber benachrichtigt und eine Rebiopsie empfohlen werden. Eine Unterscheidung zwischen T2a und T2b im TUR-Material kann nur erfolgen, wenn im eingesandten Material eine klare Trennung zwischen äußerer und innerer Muskulatur vorliegt, ansonsten erfolgt T2. Erläuterungen zu B.4 Erläuterungen zu B.4.1 Materialbehandlung Alternativ kann die nicht eröffnete Harnblase mit Formalin aufgefüllt werden, ehe sie im Ganzen fixiert wird. Erläuterungen zu B.4.4 Makropräparation (Zuschneiden) Da ein Urothelkarzinom auch per continuitatem durch die Harnblasenwand oder über das perivesikale Fettgewebe in die Prostata einwachsen kann („echtes“ pT4a), was mit einer noch schlechteren Prognose verbunden ist, sollte zur Abklärung des Ausbreitungsweges eines Urothelkarzinoms in die Prostata die Urethra median und beidseits paramedian in Längsrichtung (möglichst Großflächenschnitte) zugeschnitten werden. Bei der radikalen (Zysto-)Prostatektomie muss ganz bewusst auch das Urothel der prostatischen Urethra angesehen werden. Erläuterungen zu B. 4.6 Die Dokumentation sollte am besten anhand eines Formblattes erfolgen (Abbildung 5). -44- 45 Abbildung 5. Pathohistologisches Gutachten bei Harnblasenkarzinomen /Zystektomie/Ureterektomie/Nephroureterektomie - Minimal-programm [modifiziert nach Böhle et al. 1998] Name des Patienten: ................................................... Geb.-Datum................................ Eingangsnummer: ............................................... Einsender................................... Eingangsdatum ............................................... Ausgangsdatum......................... Untersuchungsmaterial: O T=totale Zystektomie O U = Ureterektomie O P=partielle Zystektomie O N = Nephreureterektomie A = Andere (Klartext).......................................................................................................................... 1. Lokalisation des Primärtumors CO O Harnblase O Ureter rechts O Ureter links O Nierenbecken rechts O Nierenbecken links Nähere Angaben bei Harnblasenkarzinom Tumorbefallen Tumorfrei Blasenhals O O Trigonum O O Seitenwand rechts O O Seitenwand links O O Vorderwand O O Hinterwand O O Fundus O O Ureterostium rechts O O Ureterostium links O O Urachus O O Divertikel O O / 2. Histologischer Tumortyp Invasives Urothelkarzinom 8120/3 Plattenepithelkarzinom 8070/3 Plattenepithelialer Differenzierung Verruköses Karzinom 8051/3 Glandulärer Differenzierung Plattenepithelpapillom 8052/0 Adenokarzinom 8140/3 Trophoblastärer Differenzierung Mikropapillär 8131/3 Lymphoepithelial-ähnlich 8082/3 Lymphom-ähnlich Muzinös 8480/3 Siegelringzellig 8490/3 Sarkomatoid 8122/3 Klarzellig 8310/3 Riesenzellig 8031/3 Villöses Adenom 8261/0 Undifferenziert 8020/3 Fortsetzung Abbildung 5 -45- 46 Neuroendokriner Tumor: Nicht-invasives Urothelkarzinom Kleinzelliges Karzinom 8041/3 Urotheliales Karzinom in situ 8120/2 Karzinoid 8240/3 Papilläres Urothelkarzinom 8130/21 Paraganglion 8680/1 8130/23 Andere…………………………………… low grade Papilläres Urothelkarzinom high grade Papilläre Urothelneoplasie mit 8130/1 niedrig malignem Potenzial Urothelpapillom 8120/0 Urothelpapillom, 8120/0 invertierter Typ 3. Histopathologisches Grading O G1 O G2 O G3 O L=low grade (G1, G2) O GX O H=high grade (G2, G3,) 4. Lymphgefäß-, Blutgefäß- und perineurale Infiltration OLO OL1 OVO OV1 O PnO OPn1 5. pTNM-Klassifikation y (y)|__| pT|__|__| is m pT is m pN pM pN|__| pM|__| Anzahl untersuchter regionärer Lymphknoten |__|__| Anzahl befallener regionärer Lymphknoten |__|__| Zahl der Fernmetastasen |__|__| Lokalisation mikroskopisch bestätigter Fernmetastasen (Klartext)......................................................................... -46- 47 Fortsetzung Abbildung 5 5. Daten zur R-Klassifikation Befunde an den Resektionslinien F=Tumor- N=Nichtinva- I=Invasiver Y=Nicht frei siver Tumor Tumor untersucht Ureter rechts O O O O Ureter links O O O O Urethra O O O O Perivesikal O O O O Harnblase seitlich O O O O Perivesikal O O O O Periureteral O O O O Ureteral O O O O Totale Zystektomie Partielle Zystektomie Falls verbindliche Aussagen zur R-Klassifikation vorliegen: Definitive R-Klassifikation R O Kein Residualtumor (R0) O Mikroskopischer nichtinvasiver Residualtumor (R1is) O Mikroskopischer invasiver Residualtumor (R1) O Makroskopischer Residualtumor (R2) Falls Residualtumor, Lokalisation N = Nein Lokoregionär J = Ja O Fernmetastasen O O 6. Örtliche Tumorzelldissemination O Nein O Ja 7. Assoziiertierte Harnblasenveränderungen Dysplasie Carcinoma in situ O Ja O Nein O Ja O Nein .................................................... ................................................................................... Datum Unterschrift -47- 48 Konventionelle morphologische Prognosefaktoren Als etablierte morphologische Prognosefaktoren gelten das Staging und das Grading. Da 80% der Blasenkarzinome bei Erstdiagnose in der Kategorie Ta, Tis oder T1 sind, ist eine weitere prognostische Stratifizierung letzterer Tumorkategorie von besonderer Bedeutung. Dabei ist zu bedenken, dass in den bei Erstdiagnose vorliegenden TUR-Spänen in durchschnittlich 50% ein Understaging des Karzinoms im Vergleich zum definitiven Befund am Zystektomiepräparat vorliegt. Das histologische Grading in TUR-Spänen der Harnblase korreliert signifikant mit dem definitiven Staging des Zystektomiepräparates. Staging der muskelinvasiven Tumoren In der Kategorie pT2 scheint, einer Reihe von Untersuchungen zurfolge, die prognostische Relevanz eines weiteren Substaging nach dem Ausmaß der Tiefeninvasion in die Muscularis propria (pT2a und pT2b) gering zu sein. Wertvoller ist möglicherweise die Klassifikation nach dem größten Tumordurchmesser, wobei ein Tumordurchmesser von mehr als 3 cm eine diskriminierende Größe darstellt. So beträgt das metastasenfreie und krebsspezifische Überleben für muskelinvasive Tumoren < 3 cm 100% bzw. 94% im Gegensatz zu 68% und 73% für derartige Tumoren mit einem Durchmesser ≥ 3 cm. Ein weiteres prognostisch potenziell relevantes Kriterium ist das Wachstumsmuster. Ein infiltratives Wachstumsmuster ist mit einer schlechteren Prognose assoziiert als noduläre oder trabekuläre Muster. Grading Der Differenzierungsgrad des Urothelkarzinoms ist ein wichtiger Prognosefaktor für die Rezidiventstehung wie für die Progression. Die Problematik liegt in einer unzureichenden Stratifizierung der im klinischen Verhalten heterogenen großen Gruppe der G2-Tumoren der WHO Klassifikation. Multizentrizität Das primäre Carcinoma in situ ist selten, tritt meist multifokal auf und ist mit einem invasiven Urothelkarzinom assoziiert. 80% der Cis gehen in invasive Karzinome über (T1G3-Karzinome) [Köllermann und Helpap 2001]. Multizentrizität von Urothelkarzinomen geht im Vergleich zu unizentrischen Tumoren mit einer erhöhten Rezidiv – und Progressionsrate einher. Lymph- und Blutgefäßinvasion Eine Lymph- und/oder Blutgefäßinvasion lässt sich bei sorgfältiger Suche unter Anlegung strenger Kriterien in 10-12% von z.T. papillären T1-Tumoren nachweisen, wobei die Häufigkeit mit dem Malignitätsgrad zunimmt. Angioinvasive T1-Karzinome verhalten sich prognostisch schlechter als solche ohne Gefäßinvasion. Im Gegensatz zu muskelinvasiven Karzinomen erwies sich der Status der Angioinvasion bei T1-Tumoren als unabhängiger prognostischer Marker. -48- 49 Erläuterungen zu B.5. Erläuterungen zu B.5.4 Makropräparation (Zuschneiden) Urothelkarzinome des Nierenbeckens sind in der Regel nicht invasiv. Wenn ja, dann zeigen sie eine Invasion des Nierenparenchyms über das Hohlraumsystem (bei der Einbettung berücksichtigen) und eine Invasion des hilären Fettgewebes einschließlich Lymphgefäße. -49- 50 Literatur Aa van der MN, van Leenders GJ, Steyerberg EW, van Rhijn BW, Jobsis AC, Zwarthoff EC, and van der Kwast TH (2005). A new system for substaging pT1 papillary bladder cancer: a prognostic evaluation. Hum Pathol 36: 981-986. Allen DC (2000) Histopathology Reporting.Guidelines for Surgical Cancer. Springer, Berlin Heidelberg New York, pp. 271-289 Allen DC (2006) Histopathology Reporting.Guidelines for Surgical Cancer. 2nd edition. Springer, Berlin Heidelberg New York, pp. 301-324 Allen DC, Cameron RI (2004) Histopathology Specimens. Clinical, Pathological and Laboratory Aspects. Springer, Berlin Heidelberg New York, pp. 285-310 Amin MB, Gomez RH, Young RH (1997) Urothelial transitional cell carcinoma with endophytic growth patterns: A discussion of patterns of invasion and problems associated with Assessement of invasion in 18 cases. Am J Surg Pathol 21: 1057-1068 Amin MB, Murphy WM, Reuter VE et al. (1996) Controveries in the pathology of transitional cell carcinoma of the urinary bladder. In. Rosen PP, Fechner RE (eds.): Reviews in Pathology, Chicago, ASCP Press, pp. 1-38 Angulo JC, Lopez JI, Grignon DJ, Sanchez-Chapado M (1995) Muscularis mucosa differentiates two populations with different prognosis in stage T1 bladder. J Urol 128: 813-815 Angulo JC, Lopez JI (1997) Re: The importance of the depth on invasion in stage T1 bladder carcinoma: a prospective cohort study (letter) J Urol 158: 1922–1923 Bastacky S, Ibrahim S, Wilczynski SP, Murphy WM (1999) The accuracy of urinary cytology in daily practice. Cancer (Cytopathol) 87: 118-128 Bertz S, Denzinger S, Wieland WF, Stoehr R, Hofstaedter F, Hartmann A (2011) Substaging by estimating size of invasive tumour can improve risk stratification in pT1 urothelial bladder cancer – evaluation of a large hospital-based single-centre series. Histopathology, in press Böcking A, Freudenberg N (1998) Standardisierte Befunderstellung in der extragenitalen Zytologie. Pathologe 19: 235-258 Böcking A, Grote HJ, Buckstegge B, Knops K, Steinmetzger B (2005) Labormethoden der Cytopathologie, Grundkurs: Routine-Verfahren, Akademie für Fortbildung in der Morphologie e.V., Düsseldorf Böhle A, Block Th, Jakse G, Otto Th, Hofstädter F (1998) Harnblasenkarzinom. In: Qualitätssicherung in der Onkologie. Diagnostische und therapeutische Standards in der urologischen Onkologie. Weißbach L, Miller K (Hrsg.) Zuckschwerdt, München Bern Wien New York, S. 30-64 Bostwick DG, Ramnani D, Cheng L (1999) Diagnosis and grading of bladder cancer and associated lesions. Urol Clin North Am 26: 493–507 Bostwick DG, Mikuz E (2002) Urothelial papillary (exophytic) neoplasms. Committee No. 1 (Majority opinion), Ancona international consultation. Virchows Arch 441: 109–116 Broussard IN, Tan PH, Epstein JI (2004) Atypia in inverted urothelial papillomas: pathology and prognostic significance. Hum Pathol 35: 1499-1504 Bubendorf L, Grilli B, Sauter G, Mihatsch MJ, Gasser TC, Dalquen P (2001) Multiprobe FISH for enhanced detection of bladder cancer in voided urine specimens and bladder washings. Am J Clin Pathol 116: 79-86 -50- 51 Buchumensky V, Klein A, Zemer R. et al. (1998) Cytokeratin 20: a new marker for early detection of bladder carcinoma? J Urol 160: 1971-1974. Bush C, Algaba F (2002) The WHO/ISUP 1998 and WHO 1999 systems for malignancy grading of bladder cancer. Scientific foundation and translation to one another emprivious systems.Committee No1 (Minority opinion), Ancona international consultation. Virchows Arch 441: 105-108 Cheng L, Weaver AL,Neumann RM, Scherer BG, Bostwick DG (1999) Substaging of T1 bladder carcinoma based on the depth of invasion as measured by micrometer. Cancer 86: 1035-1043 Cheng L, Bostwick D G (2000) World Health Organization and International Society of Urological Pathology Classification and Two Number Grading System of Bladder Tumors. Cancer 88: 1513-1516 Cheng L, Darson M, Cheville JC, Neumann RM, Zincke H, Nehru A, Bostwick DG (1999) Urothelial papilloma of the bladder. Clinical and biologic implications. Cancer 1986: 2098-2101 Cheng L, Neumann RM , Nehra A, Spotts BE , Weaver AL, Bostwick DG (2000) Cancer heterogeneity and ist biologic implications in the grading of urothelial carcinoma. Cancer 88: 1663-1670 Cheng L, Neumann RM, Weaver AL, Spotts BE, and Bostwick DG (1999) Predicting cancer progression in patients with stage T1 bladder carcinoma. J Clin Oncol. 17:3182-3187. Dalquen P, Kleiber B, Grilli B, Herzog M, Bubendorg L, Oberholzer M (2002) DNA image cytometry and fluorescence in situ hybridization for noninvasive detection of urothelial tumors in voided urine. Cancer Cytopathol 96: 374.379 Deutsche Krebsgesellschaft (Hrsg.) (2004) Kurzgefasste interdisziplinäre Leitlinien 2004. 4. Aufl. (Informationszentrum für Standards in der Onkologie, ISTO) Zuckschwerdt, München Wien New York Durek C, Jocham D (2003) New strategies in photodynamic diagnosis of bladder cancer. Med Laser Appl 18: 41-46 Eble JN, Sauter G, Epstein JI, Sesterhenn IA (2004) Pathology and Genetics.Tumours of the urinary system and male genital organs. WHO Classification of Tumours. IARC press, Lyon Epstein JI, Amin MB, Reuter V, Mostofi FK (1998) The World Health Organisation/ Interational Society of Urological Pathology Consensus Classification of urothelial (transitional cell) neoplasms of the urinary bladder. Am J Surg Pathol 22: 1435 – 1448 Farrow GM, Utz DC (1982). Observations on microinvasive transitional transitional cell carcinoma of the urinary bladder. Clin Oncol 1: 609-614. Frimberger D, Knuechel R, Hofstetter A (2001) Endoscopic detection of transitional cell carcinoma with 5-aminolevulinic acid - results of 1012 fluorescence endoscopies. Urology 57: 690-694 Griesser H (2002) Exfoliativzytologie der ableitenden Harnwege. Cyto-Info 3: 79-85 Grossmann HB, Messing E, Soloway M, Tomera K, Katz G, Berger Y, Shen Y (2005) Detection of bladder cancer using a point-of-care proteomic assay. JAMA 293: 2466-2467, 2005 Halling KC, King W, Sokolona IA, Meyer RG, Burkhardt HM, Cheville IC, Sebo TY, Ramakumar S, Stewart CS, Pankratz S, O’Kane DJ, Seelig SA, Lieber M, Jenkins RB (2000) A comparison of cytology and fluorescence in situ hybridization for the detection of urothelial carcinoma. J Urol 164: 1768-1775 Hammond MEH, Henson DE (1996) for members of the cancer committee, College of American pathologists and the task force on the examination of specimens removed from patients with bladder -51- 52 cancer. Practice protocol for the examination of specimens removed from patients with carcinoma of the urinary bladder, ureter, renal pelvis and urethra. Arch Pathol Lab Med 120: 1103 - 1110 Hammond MEH, Henson DE (2000) Updated protocol for the examination of specimens from patients with urinary bladder, ureter, renal pelvis. In: Compton CC, Henson DE, Hammond MEH, Schramm JE (eds.) Reporting on Cancer Specimens.Protocols and Case Summaries. College of Am Pathologists Helpap B, Oehler U, Göhrt R (1994) Diagnostische Bedeutung der Urinzytologie. TW Urol Nephrol 6: 104-110 Helpap B, Köllermann J (1999) Proliferative pattern of exophytic and superficialiy invasive and noninvasive low-grade urotheliale carcinomas. Hum Pathol 30: 145 – 150 Helpap B, Köllermann J (2000a) Assessment of basal cell status and proliferative patterns in flat and papillary urotheliale lesions. A contribution to the new WHO-Classification of urothelial tumors of the urinary bladder. Hum Pathol 31: 745 – 750 Helpap B, Köllermann J (2000b) Neuerungen in der histologischen WHO-Klassifikation urothelialer Harnblasentumoren und abnormer flacher Urothelläsionen. Pathologe 21: 211-217 Helpap B (2002) The new WHO-Classification of urothelial carcinomas of the urinary bladder. Verh Dtsch Ges Pathol 86: 57-66 Helpap B, Schmitz-Dräger BJ, Hamilton PW, Muzzonigro G, Galosi AB, Kurth KH, Lubaroff D, Waters DJ, Droller MJ (2003) Molecular pathology of non-invasive urothelial carcinomas (part I) Virchows Arch 442: 309-316 Höfler H (1995) Einrichtung von „Tumor/Gewebebanken“. In: Klöppel G (Redaktion) Stellungnahmen (1994 – 1995) der Deutschen Gesellschaft für Pathologie. Pathologe 16: 150-156 Höfler H (2004) Empfehlungen zur Organ-/Gewebeentnahme und Gewebeasservierung für Forschung und Lehre. Pathologe 25: 259-261 Jensen CS, Cohen MB (2004) Urinary Tract Cytology. In: Atkinson BF (ed.) Atlas of Diagnostic Cytopathology. Saunders, pp. 231-271 Jiminez RE, Gheiler E, Oskanian P, Tiguert R, Sakr W, Wood DP, Pontes JE, Grignon DJ (2000) Grading the invasice component of urothelial carcinoma of the bladder and its relationship with progression – free survival. Am J Surg Pathol 24: 980-987 Jocham D, Staehler G, Chaussy C, Unsold E, Hammer C, Lohrs U, Gorisch W (2003) Integral dyelaser irradiation of photosensitized bladder tumors with the aid of a light-scattering medium. Prog Clin Biol Res 170: 249-56 Jochims E (2002) Treffsicherheit der konventionellen Urinzytologie bei Karzinomen der ableitenden Harnwege. Med. Diss. RWTH Aachen Junker K, Werner W, Mueller C, Ebert W, Schubert J, Claussen U (1999) Interphase cytogenetic diagnosis of bladder cancer on cells from urine and bladder washings. Int J Oncol 14: 309-313 Köllermann J, Helpap B, (2001) High risk superficial bladder carcinoma pT1G3: Significance of its diagnosis on transurethral speicimens. Urol integr Internat 6: 24-30 Lester SC (2006) Manual of Surgical Pathology.2nd edition. Elsevier, pp. 397-406 Lodde M, Mian C, NegrinG, Vittadelo F, Comploj E, Palermo S, Staffler A, Brössner C, Pycha A (2004) Effect of intravesical instillation on performance of uCYT test. Urology 63: 878 - 881 -52- 53 Lopez-Beltran A, Cheng L (2003) Stage pT1 bladder carcinoma: diagnostic criteria, pitfalls and prognostic significance. Pathology 35: 484-491 Malik SN, Murphy WM (1999) Monitoring patients for bladder neoplasms: What can be expected of urinary cytology consultations in clinical practice. Urology 54: 62-66 Malmstöm P-U, Busch C, Norlen BJ (1987) Recurrence, progression and survival in bladder cancer. Scand J Urol Nephrol 21: 185 -195 Moch H, Sauer G, Moore D, Mihatsch MJ, Gudat F, Waldman F (1993) p53 and erbB-2 protein overexpression are associated with early invasion and metastasis in bladder cancer. Virchows Arch 423: 329-334 Moch H, Sauter G , Mihatsch MJ, Gudat F, Epper R, Waldman FM (1994) p53 but not erbB-2 expression is associated with rapid tumor proliferation in urinary bladder cancer. Hum Pathol 25: 1346-1351 Moonen PM, Kiemeney LA, Witjes JA (2005) Urinary NMP22 bladder check test in the diagnosis of superficial bladder cancer. Eur Urol 48: 951-956 Mostofi FK, Sobin LH, Torlini H (1973) Histological typing of urinary bladder tumours. WHO Geneva No. 10 Mostofi FK, Davis CJ, Sesterhenn IA (1999) Histological Typing of urinary bladder tumours.WHO, 2. Auflage, Springer, Berlin Heidelberg New York Nationaler Ethikrat (2004) Biobanken für die Forschung http://www. ethikrat.org/stellungnahmen/ stellungnahmen. Html Obermann EC, Junker K, Stoehr R, Dietmaier W, Zaak D, Schubert GE, Hofstädter F, Knüchel R, Hartmann A (2003) Frequent genetic alterations in flat urothelial hyperplasias and concomitant papillary bladder cancer as detedted by CGH, LOH, and FISH analyses. J Pathol 199: 59-57 Papanicolaou GN, Marshall VF (1945) Urine sediment smears as a diagnostic procedure in cancer of the urinary tract. SCiene 101: 519 Planz B, Synek C, Deix T, Böcking A, Marberger M (2001) Diagnosis of bladder cancer with urinary cytology, immuncytology and DNA image cytometry. Anal Cell Pathol 3: 103-109 Ponsky LE, Sharma S, Pandragi L, Kedia S, Nelson D, Agarwal A, Zippe CD (2001) Screening and monitoring for bladder cancer refining the use of NMP 22. J Urol 166: 75-78 Poulakis V, Witzsch U, de Vries R, Altmannsberger HM, Manyak MJ, Brecht E (2001) A comparison of urinary nuclear matrix protein-22 and bladder tumour antigen tests with voided urinary cytology in detecting and following bladder cancer: the prognostic value of falsepositive results. BJU Int 88: 692-701 Rathert P, Roth S (1995) Urinzytologie – Praxis und Atlas. 3. Auflage, Springer Verlag Berlin, Heidelberg, New-York Riedl CR, Daniltchenko D, Koenig F, Simak R, Loening SA, Pflueger H (2001) Fluorescenceendoscopy with 5-aminolevulinic acid reduces early recurrence rate in superficial bladder cancer. J Urol 165: 1121-1123 Rübben H, Rathert P, Roth S, Hofstädter F, Giani G, Terhorst B, Friedrichs R (1989) Exfoliative Urinzytologie, 4.Aufl. Harnwegstumorregister.Fort- und Weiterbildungskommission der Deutschen Urologen, Arbeitskreis Onkologie, Sekt. Urinzytologie, Essen. -53- 54 Sauter G, Mihatsch MJ (1998) Pussycats and baby tigers: non-invasive (pTa) and minimally invasive (pT1) bladder carcinomas are not the same. J Pathol 185: 339-341 Sauter G, Moch H, Gudat F, Mihatsch MJ, Haley J, Meecker T, Waldman F (1993) Demonstration of gene amplification in urinary bladder cancer by fluorescent in situ hybridization (FISH). Verh Dtsch Ges Pathol 77: 247-251 Sauter G, Gasser TC, Moch H, Richter U, Bubendorf L, Mihatsch MJ (1997) DNA alterations in urinary bladder cancer detected by flow cytometry and FISH. Urol Res 25 Suppl 1: 37-43 Sauter G, Simon R, Bubendorf L, Mihatsch MJ (2002) Molekulare Genetik der Progression des Urothelkarzinoms. Verh Dtsch Ges Pathol 86: 49-56 Schmidbauer J, Witjes F, Schmeller N, Donat R, Susani M, Marberger M et al (2004) Improved detection od urothelial carcinoma in situ with hexaminolevulinate fluorescence cystoscopy. J Urol 171: 135-138 Schmitz-Däger BJ, Goebell P, Ebert T, Fradet Y (2000) p53 immunohistochemistry as a prognostic marker in bladder cancer: playground for urologic scientists? Eur Urol 38: 691-700 Sinn HP, Hermanek P, Wagner G, Wittekind Ch, (2002ff) Organspezifische Tumordokumentation. 3. Aufl. Empfehlungen zur Dokumentationsinhalten für Studien. Internetfassung („OTD-Internet“). http://otd.imi.uni-erlangen.de Sobin LH, Gospodarowicz MK, Wittekind C (eds.) (2010) TNM Classification of Malignant Tumours, Seventh Edition. Oxford: Blackwell Publishing Ltd. [Deutsche Übersetzung: UICC (2010) TNM Klassifikation maligner Tumoren 7. Auflage Wittekind Ch, Meyer H-J Hrsg. Wiley-Blackwell, Weinheim] Stella F, Battistelli S, Marcheggiani F (2000) Urothelial cell changes due to busulfan and cyclophosphamide treatment in bone marrow transplantation. Acta Cytol 34: 885-890 Tetu B, Tiguert R, Harel, Fradet Y (2004) ImmunoCyt/uCyt+™ improves the sensitivity of urine cytology in patients followed for urothelial carcinoma. Mod Pathol online, 24 September 1-7 UICC (2003) TNM Supplement. A commentary on uniform use. 3d ed. Wittekind Ch, Greene FL, Henson DE HutterRVP, Sobin LH (Eds) Wiley-Liss, New York UICC (2005) TNM-Atlas. 5. Auflage. Illustrierter Leitfaden zur TNM/pTNM-Klassifikation maligner Tumoren. Wittekind Ch, Klimpfinger M, Sobin LH (Hrsg.) Springer, Berlin Heidelberg New York Wagner U, Sauter G, Moch H, Novotna H, Epper R, Mihatsch MJ, Waldman FM (1995) Patterns of p53, erbB-2, and EGF-R expression in premalignant lesions of the urinary bladder. Hum Pathol 26:970-978 Zaak D, Kriegmair M, Steep H, Baumgartner R, Oberneder R, Schneede P, Corvin S, Frimberger D, Knüchel R, Hofstetter A (2001) Endoscopic detection of transitional cell carcinoma with 5-aminolevulinic acid: results of 1012 fluorescence endoscopies Urol 57: 690-694 -54- 55 Zippe C, Pandrangi L, Potts JM, Kursh E, Novick A, Agarwal A (1999) NMP22: a sensitive cost-effective test in patients at risk for bladder cancer. Anticancer Res 19: 2621-2623 -55- 56 Verfasser Prof. Dr. med. B. Helpap (Singen) Prof. Dr. med. A. Hartmann (Erlangen) Im Auftrag des Berufsverbandes der Deutschen Pathologen und der Deutschen Gesellschaft für Pathologie Unter beratender Mitwirkung von Prof. Dr. med. F. Hofstädter (Regensburg) Prof. Dr. med. Ch. Wittekind (Leipzig) Fassung vom: Dezember 2011 Revision geplant: Januar 2014 Adresse der Autoren Prof. Dr. med. B. Helpap Institut für Pathologie Hegau-Bodensee-Hochrhein-Kliniken Postfach 72o 78207 Singen Prof. Dr. med. A. Hartmann Pathologisches Institut der FAU Krankenhausstrasse 12 91054 ERLANGEN Ch. Wittekind 25/10/2011 -56-