Vom Aufbau der Materie
Werbung

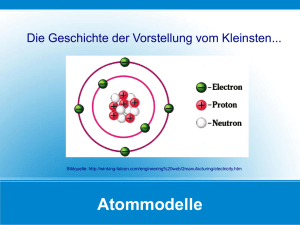
Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 17 Vom Aufbau der Materie Chemie 001-112_Korrektur.qxd 16.04.2009 18 11:07 Uhr Seite 18 Einige chemische Elemente ... Reinstoffe wie Wasser, Alkohol, Kochsalz oder Zucker sind mit physikalischen Methoden nicht weiter trennbar. Durch chemische Vorgänge – chemische Reaktionen – können Reinstoffe jedoch in kleinere Bausteine zerlegt werden. Das zeigen die folgenden beiden Versuche. V Zuckerkohle VERSUCH Du brauchst: Zucker, Reagenzgläser, Reagenzglashalter, Holzspan, Brenner Fülle ein Reagenzglas etwa zur Hälfte mit Zucker. Erhitze über der Brennerflamme, bis Dämpfe entweichen. Versuche die Dämpfe zu entzünden. Um welchen Stoff könnte es sich bei dem schwarzen Rückstand im Reagenzglas handeln? V Da brennt der Span VERSUCH Du brauchst: Reagenzglas, Reagenzglashalter, Brenner, Spatel, Holzspan, Kaliumpermanganat Gib einen Spatel Kaliumpermanganat in das Reagenzglas und erhitze. Sobald es „knistert“, tauchst du einen glimmenden Holzspan in das Reagenzglas. Beobachte den Holzspan und versuche eine Begründung deiner Beobachtung. In den beiden Versuchen werden die Reinstoffe Zucker und Kaliumpermanganat durch chemische Reaktionen in andere Stoffe zerlegt. Der schwarze Rückstand im ersten Versuch ist Kohlenstoff. Im zweiten Versuch wird beim Erhitzen aus dem Kaliumpermanganat ein Gas freigesetzt, das den glimmenden Holzspan entflammt. Das freigesetzte Gas ist Sauerstoff. Kohlenstoff und Sauerstoff können auch durch chemische Reaktionen nicht mehr in kleinere Bausteine zerlegt werden: Kohlenstoff und Sauerstoff sind Beispiele für chemische Elemente. M Chemische Elemente können durch chemische Reaktionen nicht weiter zerlegt werden. MERKE! In den folgenden Experimenten lernst du weitere chemische Elemente kennen. V Brennendes Metall VERSUCH Du brauchst: Magnesiumband, Tiegelzange, feuerfeste Unterlage, Brenner Schütze deine Augen mit der Schutzbrille und schaue nicht direkt in die grelle Flamme des brennenden Magnesiumbands! Halte ein etwa 5 cm langes Magnesiumband an einem Ende mit der Tiegelzange und entzünde das Magnesium in der Flamme des Brenners. Magnesium ist ein metallisches Element und wird z. B. bei der Herstellung von Wunderkerzen verwendet. Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 19 ... und deren Symbolschreibweise V 19 Flammenfärbungen VERSUCH Du brauchst: Natriumchlorid, Lithiumchlorid, Kupferchlorid, Magnesiastäbchen, Spatel, Blatt Papier, kleines Becherglas, destilliertes Wasser, Brenner 1. Bereite dir auf dem Blatt Papier mit dem Spatel eine kleine Menge Natriumchlorid, Lithiumchlorid und Kupferchlorid vor. Beschrifte die Stoffe auf dem Blatt Papier. Befeuchte das Magnesiastäbchen mit destilliertem Wasser und tauche es zunächst in Natriumchlorid. Halte das Stäbchen nun in die nicht leuchtende Brennerflamme (was mit „nicht leuchtender“ Flamme gemeint ist, erklärt dir dein Lehrer oder deine Lehrerin). Ergänze die Flammenfärbung in der Tabelle. 2. Wiederhole den Versuch mit Lithiumchlorid und Kupferchlorid. Flammenfärbungen: Natrium (links) und Kupfer Stoff Flammenfärbung Natriumchlorid Lithiumchlorid Kupferchlorid • Aus dem Physikunterricht der 3. Klasse weißt du, dass die Bausteine des Natriumchlorids Natrium-Ionen und ChloridIonen sind. Natrium und Chlor sind chemische Elemente. Aus welchen Elementen werden wohl Lithiumchlorid und Kupferchlorid bestehen? • Welche Elemente bewirken im vorangegangenen Versuch die Flammenfärbungen? Manche Elemente können mithilfe der Flammenfärbung nachgewiesen werden: Natrium färbt die Flamme gelb, Kupfer grün, Lithium rot. Feuerwerke erhalten ihre Farbenpracht durch die „Flammenfarben“ der Elemente. Für die Namen der Elemente schreibt man Symbole. In der Tabelle siehst du einige Beispiele. M MERKE! Element Lateinischer Name Symbol Wasserstoff Hydrogenium H Helium Helium He Kohlenstoff Carboneum C Chlor Chlorum Cl Eisen Ferrum Fe Für jedes chemische Element gibt es ein Symbol. Alle derzeit bekannten chemischen Elemente findet man im Periodensystem der Elemente. Anmerkung: Das Periodensystem der Elemente ist auf S. 110. Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 20 20 Atommodelle ... Aus dem Physikunterricht weißt du: Alle Stoffe bestehen aus Teilchen. M MERKE! Die Bausteine eines Elements sind gleichartige Teilchen, die Atome. Aus dem Physikunterricht der 3. Klasse kennst du folgendes Atommodell: M MERKE! Das Atom besteht aus einem sehr kleinen positiv geladenen Atomkern, der von einer negativ geladenen Atomhülle umgeben ist. Die Bausteine des Atomkerns sind positiv geladene Protonen und elektrisch neutrale Neutronen. Die Teilchen der Atomhülle sind negativ geladene Elektronen. Bei elektrisch neutralen Atomen ist die Anzahl der Protonen gleich mit der Anzahl der Elektronen. Der dänische Physiker Niels Bohr (1885-1962) entwickelte die Vorstellung, dass die Elektronen auf Bahnen um den Atomkern kreisen – wie die Planeten um die Sonne. Dieses Atommodell musste später jedoch aufgegeben werden. Einer der Gründe: Für ein Teilchen mit sehr kleiner Masse – wie ein Elektron – ist es aus physikalischen Gründen nicht möglich, den Aufenthaltsort genau zu bestimmen. Man kann nur den Raumbereich angeben, in dem sich ein Elektron mit großer Wahrscheinlichkeit aufhält. Dieser Raumbereich wird Orbital genannt. Der österreichische Nobelpreisträger Erwin Schrödinger (18871961) verbesserte das Modell von Niels Bohr. Stark vereinfacht kann man dieses Modell der Atomhülle folgendermaßen beschreiben: Elektronen halten sich in bestimmten Energieräumen um den Kern auf. Diese Energieräume kann man sich als „Schalen“ vorstellen, die Sphären genannt werden. Es gibt höchstens 7 Sphären. Die Sphären unterscheiden sich durch ihre Abstände vom Atomkern und ihren „Energieinhalt“. Innerhalb der Sphären halten sich die Elektronen in Orbitalen auf. In jedem Orbital gibt es maximal 2 Elektronen. In jeder Sphäre ist nur eine bestimmte Anzahl von Orbitalen möglich. Beispiel: In der 1. Sphäre gibt es nur ein Orbital (mit maximal 2 Elektronen). In der 2. Sphäre existieren bis zu 4 Orbitalen. Die 2. Sphäre ist deswegen mit 8 Elektronen voll besetzt. Kochsalz (links) ist kein Element. Es besteht aus Natrium-Ionen und Chlorid-Ionen. Eisen ist ein Element. Es besteht nur aus Eisenatomen. Jeder Kohlenstoffatomkern hat 6 Protonen. Jeder Chloratomkern hat 17 Protonen. Die Atomkerne eines Elements können jedoch unterschiedlich viele Neutronen haben. Stelle dir den Atomkern auf 6 mm vergrößert in der Achse des Riesenrads im Wiener Prater vor. Die Atomhülle hätte dann ungefähr den Durchmesser des Riesenrads (~60 m). Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 21 ... und Periodensystem der Elemente 21 Mit diesem Modell der Atomhülle kann man die Ordnung im Periodensystem der Elemente verstehen. Die Darstellung unten zeigt die ersten 18 Elemente des Periodensystems. Das vollständige Periodensystem findest du auf Seite 110. Die Abbildung zeigt dir, dass die Elemente nach steigender Protonenzahl – der Ordnungszahl – gereiht sind. Wann beginnt man aber mit einer neuen Zeile, d. h. einer neuen Periode? Helium (He) hat 2 Protonen im Atomkern, daher auch 2 Elektronen in der Atomhülle. Für beide Elektronen ist in dem einzigen Orbital der 1. Sphäre Platz. Mit 2 Elektronen ist die 1. Sphäre voll besetzt. Lithium (Li) hat 3 Elektronen in der Atomhülle (Begründe!). Zwei Elektronen sind in der 1. Sphäre, das dritte Elektron muss sich in einem Orbital der 2. Sphäre aufhalten. Mit einer neuen Sphäre beginnt im Periodensystem eine neue Periode. Lithium ist somit das erste Element der 2. Periode. Das letzte Element der 2. Periode ist das Edelgas Neon (Ne). Zwei Elektronen dieses Elements sind in der 1. Sphäre, die restliche 8 Elektronen in den 4 Orbitalen der 2. Sphäre. Die 2. Sphäre kann somit keine weiteren Elektronen mehr aufnehmen. Der so genannte Edelgaszustand ist erreicht. • Warum ist das Element Natrium (Na) das erste Element der 3. Periode? Die Elektronen der jeweils äußersten Sphäre nennt man Außenelektronen. Sie haben für den Aufbau der Stoffe aus Atomen eine besondere Bedeutung. Mehr über die Bedeutung der Außenelektronen erfährst du auf den folgenden Seiten. Atome mit gleicher Anzahl von Außenelektronen haben oft ähnliche chemische Eigenschaften. Sie stehen im Periodensystem in einer so genannten Gruppe untereinander. In der Darstellung oben findest du nur die Gruppen 1 und 2 sowie 13 bis 18. Diese Gruppen heißen Hauptgruppen. • Wie viele Außenelektronen haben die Elemente der 1. Gruppe (17. Gruppe)? • Wie viele Außenelektronen haben (mit Ausnahme von Helium) die Elemente der 18. Gruppe? Die Gruppen 3 bis 12 heißen Nebengruppen. Die Verteilung der Elektronen der Nebengruppenelemente auf die Sphären und Orbitale ist schwieriger zu verstehen. In einem weiterführenden Chemieunterricht wirst du davon hören. M MERKE! Im Periodensystem sind die Elemente • nach steigender Zahl von Protonen im Atomkern, • nach der Zahl der Sphären nebeneinander in Perioden und • nach der Zahl der Außenelektronen untereinander in Gruppen geordnet. Chemie 001-112_Korrektur.qxd 22 16.04.2009 11:07 Uhr Seite 22 Arten chemischer Verbindungen – Die Metallbindung Die Atome eines Elements oder die Atome verschiedener Elemente können sich miteinander verbinden. Solche Verbindungen heißen chemische Verbindungen. M MERKE! Die Ursache aller chemischen Verbindungen sind anziehende elektrische Kräfte. Für das Auftreten dieser elektrischen Kräfte gibt es zwei Gründe: 1. Die Atome geben Außenelektronen ab oder nehmen Außenelektronen auf. 2. Atomhüllen überlappen einander. Natrium ist ein Metall. Es gibt sein einziges Außenelektron leicht ab. Der Aufbau der Atomkerne bleibt in chemischen Verbindungen unverändert. Das Periodensystem der Elemente zeigt dir: Die Elemente werden eingeteilt in Metalle, Halbmetalle, Nichtmetalle und Edelgase. Die Atome von Edelgasen gehen nur sehr schwer chemische Verbindungen ein, weil ihre äußerste Sphäre mit 8 Elektronen voll besetzt ist. Sie können daher weder zusätzliche Elektronen aufnehmen, noch „wollen“ sie Elektronen abgeben. Man sagt: Edelgase sind reaktionsträge. Chlor ist ein Nichtmetall. Es kann in seine äußere Sphäre noch ein Elektron aufnehmen. Die meisten Stoffe des Alltags sind Verbindungen von: • Metallen mit Metallen: Diese Bindungsart heißt Metallbindung. • Metallen mit Nichtmetallen: Diese Bindungsart heißt Ionenbindung. • Nichtmetallen mit Nichtmetallen: Diese Bindungsart heißt Elektronenpaar- oder Atombindung. Die Metallbindung Metallatome haben im Allgemeinen wenige Außenelektronen. Diese Außenelektronen geben sie leicht ab. Nach der Elektronenabgabe bleiben positiv geladene Metall-Ionen zurück. Diese Ionen sind regelmäßig in einem Metallgitter angeordnet. Die abgegebenen Außenelektronen sind frei beweglich wie die Teilchen eines Gases. Zwischen diesem negativ geladenen „Elektronengas“ und den positiv geladenen Metall-Ionen wirken elektrische Anziehungskräfte gegen die abstoßenden Kräfte zwischen den positiv geladenen Metall-Ionen. Mit diesem Modell kann man z. B. die Stromleitung in Metallen und die gute Verformbarkeit von Metallen erklären. M MERKE! Die Metallbindung entsteht durch elektrische Anziehungskräfte zwischen positiv geladenen Metall-Ionen und einem negativ geladenen „Elektronengas“. Die Elektronen des Elektronengases sind frei beweglich. Metallbindung: Positive MetallIonen und negatives „Elektronengas“ sorgen für Zusammenhalt. Beim Verformen eines Metalls wird mit den Ionen auch das „Elektronengas“ bewegt. Deswegen bleiben die elektrischen Anziehungskräfte erhalten. Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 23 Die Ionenbindung Die Ionenbindung Die Bausteine des Kochsalzes sind die Elemente Natrium und Chlor. Aus dem Periodensystem erkennst du: Natrium ist ein Metall. Chlor ist ein Nichtmetall. Das neutrale Natriumatom gibt sein einziges Außenelektron leicht ab. Das neutrale Chloratom hat 7 Außenelektronen und kann daher noch ein Elektron in ein Orbital seiner äußersten Sphäre aufnehmen. Bei der chemischen Verbindung dieser beiden Elemente „wechselt“ daher je ein Elektron von einem Natriumatom zu einem Chloratom. Nach dieser chemischen Reaktion hat jedes Natriumatom weiterhin 11 Protonen (mit positiver Ladung) im Atomkern, aber nur noch 10 Elektronen (mit negativer Ladung) in der Atomhülle. Das Atom ist nun positiv geladen und heißt positiv geladenes Natrium-Ion. Das Chloratom ist nach der Reaktion negativ geladen und heißt negativ geladenes Chlorid-Ion. Begründe die negative Ladung! 23 Modell eines Kochsalzkristalls: NaCl Die positiv geladenen Natrium-Ionen und die negativ geladenen Chlorid-Ionen sind in einem so genannten Ionengitter durch elektrische Anziehungskräfte aneinander gebunden. Diese Art der Bindung heißt Ionenbindung. Kochsalz heißt in der Fachsprache des Chemikers Natriumchlorid. Die Formel lautet NaCl. Diese Formel drückt aus, dass in einem Kochsalzkristall die Anzahl der positiv geladenen Natrium-Ionen gleich ist mit der Anzahl der negativ geladenen Chlorid-Ionen. Außer NaCl gibt es noch viele andere Salze. Alle Salze entstehen durch Ionenbindungen. Im Physikunterricht der 3. Klasse hast du beim Verkupfern durch Elektrolyse vielleicht das Salz Kupferchlorid verwendet. Jedes Atom des Metalls Kupfer gibt relativ leicht seine beiden Außenelektronen ab. Jedes Atom des Nichtmetalls Chlor kann jedoch nur ein Elektron aufnehmen. Wenn sich Kupferatome mit Chloratomen verbinden, kann daher jedes Kupferatom jeweils zwei Chloratome mit Elektronen „versorgen“. In einem Kupferchloridkristall sind somit doppelt so viele negativ geladene Chlorid-Ionen wie positiv geladene Kupfer-Ionen. In der Formel für Kupferchlorid wird dieses Ionenverhältnis durch folgende Verhältnisformel ausgedrückt: CuCl 2 CuCl 2, ein Salz zum Verkupfern Mit dem Modell der Ionenbindung kann man z. B. die folgenden Eigenschaften der Salze begründen: • Salze sind Isolatoren, weil die Ionen im Ionengitter aneinander gebunden sind. Frei bewegliche elektrische Ladungen fehlen. • Salze sind hart, weil die Ionenbindungen sehr fest sind. • Salze sind spröde, weil nach mechanischer Krafteinwirkung die abstoßenden elektrischen Kräfte zwischen gleich geladenen Ionen wirksam werden. M MERKE! Die Ionenbindung entsteht durch elektrische Anziehungskräfte zwischen positiv geladenen MetallIonen und negativ geladenen Nichtmetall-Ionen. Die Ionen sind in einem Ionengitter an feste Plätze gebunden. Durch Ionenbindungen entstehen Salze. Chemie 001-112_Korrektur.qxd 24 16.04.2009 11:07 Uhr Seite 24 Die Elektronenpaarbindung (Atombindung) Die Elektronenpaarbindung (Atombindung) Die Ursache für die Verbindung der Atome von Nichtmetallen sind Elektronenpaare. Einige Beispiele für das Modell der Elektronenpaarbindung: Wie entstehen Wasserstoffmoleküle? Die Atomhülle des Wasserstoffatoms hat in seiner einzigen Sphäre nur ein Elektron (Begründe!). Ein zweites Elektron könnte noch in das Orbital dieser Sphäre aufgenommen werden. Bei Annäherung zweier Wasserstoffatome überlappen sich deren Atomhüllen. Im Überlappungsgebiet halten sich häufig die Elektronen beider Atome auf. Dieses Elektronenpaar wirkt wegen seiner negativen elektrischen Ladung gegen die abstoßenden elektrischen Kräfte der beiden positiv geladenen Atomkerne und bindet die beiden Atome aneinander. Die beiden Wasserstoffatome (2 H) verbinden sich zu einem elektrisch neutralen Wasserstoffmolekül (H2). M MERKE! Zwei Wasserstoffatome (oben) und die „Elektronenformel“ eines Wasserstoffmoleküls (H2) 2 H bedeutet: zwei nicht gebundene Wasserstoffatome H2 bedeutet: ein Molekül Wasserstoff aus zwei miteinander verbundenen Wasserstoffatomen Weil die Bindung durch ein Elektronenpaar bewirkt wird, spricht man von einer Einfachbindung zwischen den beiden Atomen. Begründe, warum Wasserstoffmoleküle elektrisch neutral sind! Wie entsteht ein Wassermolekül? Zwei Wasserstoffatome bilden mit einem Sauerstoffatom je ein Elektronenpaar. Dadurch sind die 4 Orbitale der zweiten Sphäre des Sauerstoffatoms mit 8 Elektronen voll besetzt. Außerdem sind auch im Orbital jedes Wasserstoffatoms zwei Elektronen. Auch hier kommt die Bindung durch jeweils ein bindendes Elektronenpaar zustande. Zwischen den beiden Wasserstoffatomen und dem Sauerstoffatom bestehen daher Einfachbindungen. Das kleinste Wasserteilchen ist ein elektrisch neutrales Molekül mit der Formel H2O. Wie entsteht ein Kohlenstoffdioxidmolekül? Ein Kohlenstoffatom verbindet sich mit zwei Sauerstoffatomen zu Kohlenstoffdioxid (CO2). Das Kohlenstoffatom ist jeweils durch eine Doppelbindung mit den Sauerstoffatomen verbunden. Wie entsteht ein Stickstoffmolekül? In der äußeren (zweiten) Sphäre eines Stickstoffatoms sind 5 Elektronen (Begründe!). Drei Elektronen haben in dieser Sphäre noch Platz. Durch Überlappen der Atomhüllen verbinden sich daher zwei Stickstoffatome mit drei bindenden Elektronenpaaren. Mit dieser Dreifachbindung entsteht ein elektrisch neutrales Stickstoffmolekül mit der Formel N2. (Siehe Abbildung S. 25) M MERKE! Die „Elektronenformel“ eines Wassermoleküls (H2O) Die „Elektronenformel“ eines Moleküls Kohlenstoffdioxid (CO2) Bei der Elektronenpaarbindung (Atombindung) werden die Atome von Nichtmetallen durch gemeinsame Elektronenpaare aneinander gebunden. Die Teilchen, die bei dieser Verbindung entstehen, heißen Moleküle. Moleküle sind elektrisch neutral. Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 25 Summenformeln, Strukturformeln und Raummodelle 25 Wenn man Elektronenpaare symbolhaft durch Striche darstellt, erhält man die so genannte Strukturformel des Moleküls. An der Strukturformel erkennt man den „Bauplan“ des Moleküls. An der Summenformel erkennt man hingegen nur, aus wie vielen und welchen Atomen das Molekül besteht. Durch Raummodelle kann man Moleküle besonders anschaulich darstellen. Wasserstoffmolekül: „Elektronenformel“, Strukturformel und Summenformel Stickstoffmolekül: „Elektronenformel“, Strukturformel und Summenformel Wassermolekül: „Elektronenformel“, Strukturformel und Summenformel Chemiker verwenden oft komplizierte Raummodelle zum Verständnis der Stoffe. Luft, Wasser und Kunststoffe sind Beispiele für Stoffe, die von Molekülen aufgebaut werden. • Die Luft besteht vor allem aus Stickstoffmolekülen (N2) und Sauerstoffmolekülen (O2). Zwischen diesen kleinen, leichten Molekülen wirken kaum Anziehungskräfte. Die Moleküle können sich frei bewegen. Daher ist die Luft (unter „normalen“ Bedingungen) ein Gasgemenge. • Auch Wassermoleküle sind leicht. Die Abbildung zeigt aber, dass die „Wasserstoffseite“ des Moleküls im Vergleich zur „Sauerstoffseite“ positiv geladen ist. Man sagt: Das Wassermolekül ist ein Dipolmolekül. Deswegen wirken zwischen den Wassermolekülen anziehende elektrische Kräfte – es bilden sich so genannte Wasserstoffbrücken. Am Erstarrungspunkt (0 °C) sind die Kräfte so groß, dass Wasser fest wird. Raummodell des Wassermoleküls • Die Molekülgrößen und die Molekülmassen von Kunststoffen können außerordentlich groß sein. Zwischen solchen „Riesenmolekülen“ wirken auch große Anziehungskräfte. Die Moleküle sind daher nicht frei beweglich und deswegen ist der Stoff fest. • Begründe: Stoffe, die aus Molekülen bestehen, sind gute elektrische Isolatoren. • Was könnte die Ursache für die elektrische Leitfähigkeit von Leitungswasser sein? • Es gibt auch elektrisch leitende Kunststoffe. Informiere dich über die Verwendungsmöglichkeiten solcher Kunststoffe! M MERKE! Wasserstoffbrücken zwischen Wassermolekülen erklären die besonderen Eigenschaften des Wassers. Summenformel: Die Summe der Atome in einem Molekül ist erkennbar. Strukturformel: Der Aufbau des Moleküls ist erkennbar. Elektronenpaare werden durch Striche dargestellt. Chemie 001-112_Korrektur.qxd 16.04.2009 11:07 Uhr Seite 26 26 i Informationen und Aufgaben Atommodelle INFO Griechische Philosophen machten sich vor etwa 2500 Jahren Gedanken darüber, woraus die Welt aufgebaut ist. Der griechische Philosoph Demokrit (geboren 460 v. Chr., gestorben zwischen 380 und 370 v. Chr.) nahm als kleinste Bausteine der Materie verschiedene unteilbare Teilchen an, die er „atomos“ (= unteilbar) nannte. An der Schwelle vom 19. zum 20. Jahrhundert fanden Forscher heraus, dass die Atome aus noch kleineren Teilchen bestehen, die elektrisch geladen sind. Der Neuseeländer Sir Ernest Rutherford (1871-1937) stellte fest, dass jedes Atom einen winzig kleinen positiv geladenen Atomkern besitzt, der von negativ geladenen Elektronen umgeben ist. Der Däne Niels Bohr entwickelte das Modell seines Lehrers Sir Ernest Rutherford weiter und ordnete den Elektronen jedes Elements bestimmte Aufenthaltsbereiche rund um den Kern zu – ähnlich den Schalen einer Zwiebel. Durch dieses so genannte „Bohr’sche Atommodell“ konnten die bisherigen Entdeckungen – auch die Anordnung der Elemente im Periodensystem – erklärt werden. Der österreichische Physiker und Nobelpreisträger Erwin Schrödinger verbesserte das Modell von Niels Bohr. In einer Gleichung formulierte er die Wahrscheinlichkeit des Aufenthalts der Elektronen in so genannten „Elektronenwolken“, die als Orbitale bezeichnet werden. Inzwischen wurden auch Quarks und Gluonen (englisch: to glue = kleben) entdeckt. Wahrscheinlich werden noch weitere Atommodelle entwickelt werden. Es gibt mehrere Möglichkeiten, einen physikalischen oder chemischen Sachverhalt zu beschreiben. Jedes Modell ist „nur“ ein Modell, das man aber verwenden kann, wenn es an die jeweilige Situation der Wirklichkeit nahe genug herankommt, ohne dabei zu kompliziert zu sein. A AUFGABE 5 A AUFGABE 6 A AUFGABE 7 Der österreichische Nobelpreisträger Erwin Schrödinger (1887-1961) Im Periodensystem der Elemente (S. 110) findest du alle derzeit bekannten chemischen Elemente. Von welchen Elementen hast du im Alltag schon gehört? Wozu werden sie verwendet? Wo kommen sie vor? Zur Herstellung von Schleifpapier (Schmirgelpapier) und Trennscheiben wird das sehr harte Salz Korund (Al2O3) verwendet. Was kannst du aus der Verhältnisformel über den Aufbau dieses Salzes aussagen? Wiederhole aus dem Physikunterricht der 3. Klasse: • Warum leiten Metalle den elektrischen Strom? • Warum leitet eine Kochsalzlösung den elektrischen Strom, festes Kochsalz hingegen nicht? Korund (Aluminiumoxid) ist ein Salz für Trennscheiben.