Vom Elektrolytbad zum faradayschen Gesetz
Werbung

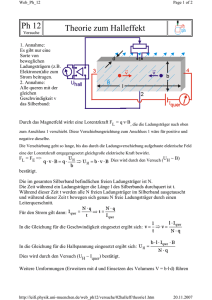
Gelernt ist gelernt G iG GRUNDLAGEN Vom Elektrolytbad zum faradayschen Gesetz Helmuth Biechl Batterie Amperemeter Dieser Beitrag versucht anschaulich zu erklären, was man unter elektrischem Strom versteht. Neben der Betrachtung der Verhältnisse in einem Elektrolyt wird auch auf die Beweglichkeit von Ladungsträgern und die Driftge- I Anode + A – U + – Elektrolyt schwindigkeit sowie auf die Kraft im elektrischen Feld eingegangen. Der Beitrag endet mit Erklärungen zum fara- Na+ + – Cl– vp vn dayschen Gesetz. Der Begriff Strom stammt eigentlich aus der Mechanik, genauer gesagt aus der Hydraulik und Pneumatik, wo aus Atomen oder Molekülen aufgebaute Flüssigkeiten z. B. durch ein Rohr fließen oder strömen. In der Elektrizitätslehre orientierte man sich bei der Definition des elektrischen Stromes an diesen physikalischen Vorgängen. Hier handelt es sich um Ladungen, die durch eine bestimmte Fläche fließen, z. B. durch die Querschnittsfläche eines Leiters. Welche Arten von Ladungsträgern kennen wir? In erster Linie sind es die Elektronen in Metallen, die sich leicht verschieben lassen – wie wir bereits wissen. Das heißt, eine bestimmte Teilchenanzahl N mit der Ladung q tritt in einer bestimmten Zeit Δt durch die Fläche A. Damit lautet die Definition für den elektrischen Strom: (1) Nehmen wir nun an, als bewegliche Ladungsträger kommen ausschließlich Elektronen vor. Bei einer Stromstärke in Höhe von I = 1 A treten dann in einer Zeitspanne von Δt = 1 s gemäß Gl. (1) N Elektronen durch eine gedachte Fläche A: Bei den beweglichen Ladungsträgern kann es sich aber auch um Ionen handeln, die sich in einer Flüssigkeit bewegen. Gibt man z. B. Kochsalz (NaCl) in Wasser, zerfällt es in Na+-Ionen und Cl–-Ionen. Diejenigen Ionen, die zum Pluspol (Anode) wandern, nennt man Anionen, diejenigen, die sich in Richtung Minuspol bewegen, heißen Kationen. Bild 1 zeigt einen Versuch, bei dem durch Anlegen einer elektrischen Spannung an die beiden, in den Elektrolyt getauchten Elektroden ein elektrischer Strom fließt. Die Bewegung der Ionen erzeugt diesen Strom. Die Na+-Ionen wandern nach rechts und die Cl–-Ionen nach links. An der Kathode erhalten die Na+-Ionen jeweils ein Elektron, d. h., die Elektrode gibt ein Elektron an das Na+-Ion ab. Damit wird dieses neutralisiert und lagert sich an der Elektrode ab. Im Laufe der Zeit überzieht sich die Kathode mit einer Natriumschicht. Man nennt diesen Vorgang »galvanisieren«. Das Cl–-Ion hingegen gibt an der Anode ein Elektron ab Prof. Dr.-Ing. Helmuth Biechl, Labor für Elektrische Antriebe und Mechatronik, Fachhochschule Kempten de 6/2006 Na Bild 1: Stromfluss durch Ionenbewegung in einem Elektrolyt und wird dort ebenfalls neutralisiert. Es steigt dann als Chlorgas an die Oberfläche der Flüssigkeit. Ähnliche Vorgänge wie bei diesem Experiment laufen im Inneren einer Batterie ab. Man kann sie sich als eine Art »Elektronenpumpe« vorstellen, die die Elektronen von der einen Seite (Anode) zur anderen Seite (Kathode) transportiert. Mit steigender Batteriespannung U wächst nicht nur die auf die Ladungsträger wirkende Kraft, sondern auch die Geschwindigkeit, mit der sich die Ionen in der Flüssigkeit bewegen. Der Vorgang in Bild 1 hält so lange an, bis alle Ionen neutralisiert sind. Damit der Stromfluss nicht zum Erliegen kommt – schließlich ist er ja an Ladungsträger gebunden – muss man dann neues Kochsalz in die Flüssigkeit geben. Beweglichkeit der Ladungsträger Am Beispiel »Elektrolyt« kann man gut erkennen, warum man von elektrischem Strom spricht. Es handelt sich dabei um nichts anderes als um bewegte Ladungen. Dass sich Ladungen in der Flüssigkeit bzw. im Metall bewegen, liegt an der Kraft F, die auf die Ladungsträger wirkt. Die Kraft F wird von der elektrischen Feldstärke E gemäß folgender Gleichung erzeugt: F = q·E Vom Elektrolyt zur Batterie Kathode Cl (2) Die Elektrodenanordnung (Geometrie, Abstand) beeinflusst das von der Batteriespannung U hervorgerufene elektrische Feld E. Die Ladungen driften mit konstanter Geschwindigkeit v durch das Metall bzw. durch die Flüssigkeit. Es gilt: v ~ E. Dieser proportionale Zusammenhang (dafür steht das Zeichen ~ in der Gleichung) sagt Folgendes aus: Steigt die elektrische Feldstärke E und damit die Kraft F, driften die Ladungsträger schneller, d. h., ihre Geschwindigkeit v steigt ebenfalls. Sowohl die Flüssigkeit als auch das Metall setzen den Ladungsträgern einen gewissen Reibungswiderstand entgegen. Bei geringem Widerstand steigt die so genannte Beweglichkeit b der Ladungsträger (umgekehrte Proportionalität). Es gilt: vp = bp · E vn = bn · E Dabei ist vp die Geschwindigkeit der positiven Ladungsträger und bp deren Beweglichkeit. vn und bn beziehen sich auf die negativen Ladungsträger. 99 Gelernt ist gelernt G iG GRUNDLAGEN EINE MODERNE ANWENDUNG I Der umgekehrte Vorgang des Galvanisierens heißt Elektrolyse. Hierbei lagert sich also kein Stoff an die Elektrode an, sondern die in einem Elektrolyten befindliche Elektrode löst sich durch den Stromfluss auf. Auch diesem Vorgang liegt Gl. (3) zu Grunde. Schauen wir uns dazu ein ganz aktuelles Beispiel an: Die koreanische Fa. Samsung brachte im vergangenen Herbst eine Waschmaschine mit patentiertem »Silver Nano Health«-System auf den Markt. Hierbei werden Silberionen (Ar = 107,8682; zi = 1) beim Waschund Spülzyklus durch Elektrolyse freigesetzt (dadurch werden Bakterien und Pilze schon bei niedrigen Waschtemperaturen abgetötet). Es heißt, die beiden aus hochreinem Silber bestehenden Plättchen wiegen insgesamt 15 g und reichen für 3000 Waschzyklen. Pro Waschgang werden also 5 mg freigesetzt, wobei ein Strom im mABereich fließt (ein genauerer Wert ließ sich nicht in Erfahrung bringen; wir gehen hier von 50 mA aus). Nun können wir mit Gl. (3) berechnen, wie lange der Vorgang dauert (bei höherem Strom funktioniert es noch schneller): Schalter + Batterie U Glühlampe – Bild 2: Einfacher Stromkreis bestehend aus Batterie, Leitern, Schalter und Glühlampe Wie wir wissen, gibt es in Metallen nur negative Ladungsträger, die Elektronen. Bei üblichen Stromstärken bewegen sich die Elektronen sehr langsam im metallischen Leiter. Die Geschwindigkeit beträgt dort meist weniger als 1 mm/s. Die Elektronen kriechen sozusagen durch das Metall. Nun kann man sich fragen, weshalb in einem Stromkreis wie in Bild 2 dargestellt, die Wirkung dennoch sofort einsetzt, d. h. ohne Verzögerung. Das liegt daran, dass sich beim Schließen des Schalters alle Elektronen gleichmäßig in Bewegung setzen, d. h. ohne Verzögerung – sozusagen wie die Waggons einer Eisenbahn, die sich auch alle gleichzeitig in Bewegung setzen, wenn die Lokomotive anfährt. Mit dem Schließen des Schalters in Bild 2 werden die Elektronen in der Glühwendel der Lampe sofort bewegt, und die Glühwendel beginnt unmittelbar sich zu erwärmen und anschließend zu leuchten. Die ersten Experimente und Untersuchungen diesbezüglich gehen auf Michael Faraday zurück. Das nach ihm benannte faradaysche Gesetz erlaubt es, Berechnungen in der Galvanik durchzuführen. Es lautet: Das faradaysche Gesetz Wir wollen nun nochmals auf das Elektrolytbad zurückkommen, mit dem man – wie bereits beschrieben – durch Galvanisieren metallische Überzüge herstellen kann (z. B. verzinken). MICHAEL FARADAY Michael Faraday wurde am 22. September 1791 als Sohn eines Goldschmieds in einem Vorort von London geboren. Entsprechend seiner Herkunft und den wirtschaftlichen Verhältnissen der Familie erhielt er nur eine sehr bescheidene Schulbildung und lernte auf der damaligen Elementarschule lediglich Lesen, Schreiben und Rechnen. Mit 13 Jahren kam er zu einem Buchbinder in die Lehre und nutzte hierbei die Gelegenheit, die Michael Faraday ihm zugänglichen wissenschaftlichen (1791 – 1867) Bücher zu lesen. Besonders angetan hatte es ihm die Elektrizitätslehre. Er ließ es jedoch mit dem Lesen allein nicht bewenden, sondern versuchte, die beschriebenen Experimente zuhause mit einfachen Mitteln nachzuvollziehen. Auf diese Weise erwarb er sich – sozusagen im Selbststudium – grundlegende naturwissenschaftliche Kenntnisse, die er durch den Besuch öffentlicher Vorträge der Royal Institution of Great Britain noch erweiterte. 1813 bewarb er sich als Assistent bei dem seinerzeit berühmten Chemiker Davy, bekam diese Stelle und beschäftigte sich anschließend mit chemischen Untersuchungen verschiedener Art. 1821 wurde er Oberinspektor der Royal Institution, 1824 Mitglied der Royal Society, 1825 Direktor des Laboratoriums der Royal Society und 1827 sogar Professor für Chemie. Neben seinen chemischen Forschungen führte er auch ab etwa 1820 umfangreiche physikalische Experimente und Untersuchungen durch. 100 (3) cF = Faraday-Konstante ( zi ) = Ladungszahl des Ions, auch als Wertigkeit bezeichnet (z. B. 1 bei Cl– oder 2 bei Cu++) Ar = relatives Atomgewicht (gibt an, um welchen Faktor ein Element schwerer ist als ein Wasserstoffatom, lässt sich dem Periodensystem der chemischen Elemente entnehmen) Δm = Masse, die sich beim Galvanisieren ablagert Betrachten wir hierzu ein Beispiel: Wir wollen einen leitfähigen Gegenstand mit einer Kupferschicht überziehen. Diese Kupferschicht soll eine Gesamtmasse von Δm = 1,2 g annehmen. Welchen Strom muss man fließen lasen, wenn der Überzug nach Δt = 2 h fertig sein soll (Kupfer: Ar = 63,6; zi = 2)? Wir setzen mit Gl. (3) an: Wir müssen also 2 Stunden lang einen Strom von I = 0,5 A fließen lassen, so dass die Kathode einen Kupferüberzug mit einer Masse von Δm = 1,2 g erhält. Als Salz, das man zum Verkupfern in das Wasserbad gibt, so dass ein entsprechender Elektrolyt entsteht, lässt sich z. B. Kupfersulfat (CuSO4) verwenden. ■ de 6/2006