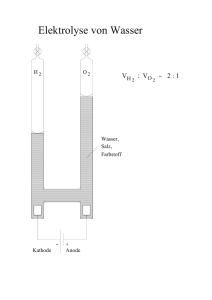
Experimentalvorlesung Allgemeine und Anorganische Chemie
Werbung

1 Experimentalvorlesung Allgemeine und Anorganische Chemie WS 16/17 1 Die Begriffe “Chemie” und “Stoff” Die Chemie ist die Lehre von den Stoffen und Stoffänderungen, die Physik - ihre Schwesterwissenschaft die Lehre von den Zuständen und Zustandsänderungen. Ein Stoff ist ein durch spezifische, d.h. masseund gestaltungsunabhängige Eigenschaften charakterisiertes System. Ein Stoff hat physikalische Eigenschaften (z. B. Dichte; Glanz und elektrische Leitfähigkeit von Fe) und chemische Eigenschaften (z. B. Rosten von Fe). Ein chemischer Vorgang ist mit einer Umwandlung verknüpft (chemische Reaktion); es entsteht ein neuer Stoff mit neuen charakteristischen Eigenschaften. Versuche: a) Hält man einen “Platindraht” in eine nichtleuchtende Gasflamme, so beginnt er zu glühen. Zieht man ihn wieder aus der Flamme heraus, so kühlt er sich ab, und im abgekühlten Zustand ist an ihm keine Änderung gegenüber dem Ausgangszustand zu bemerken ( physikalischer Vorgang). b) Hält man aber einen “Magnesiumdraht” in die Flamme, so verbrennt dieser mit glänzender Lichterscheinung zu einem weißen Pulver (“Magnesiumoxid”), das von dem ursprünglichen Magnesium vollkommen verschieden ist ( chemischer Vorgang). Mg + 1 O2 2 MgO + Licht und Wärme c) Eine Porzellanschale enthält ein Gemisch der beiden Stoffe Schwefel (gelbes Pulver) und Eisen (Späne). Mit einem Permanentmagneten können die Fe-Späne vom S-Pulver getrennt werden. Erhitzt man ein Gemisch aus Fe-Spänen und S-Pulver, so reagiert es unter Aufglühen. Aus dem abgekühlten braunschwarzen Reaktionskuchen lässt sich das Eisen nicht mehr mit einem Magneten aufnehmen. Es hat seine stoffliche Existenz verändert. Eisen und Schwefel haben sich zu einem neuen Stoff, der Verbindung Eisen(II)-sulfid, verbunden: Fe + 1 S8 8 FeS + Energie 2 2 Einteilung und Trennung von Stoffen Klassifizierung der Stoffe: Materie Trennung Heterogene Gemische (veränderliche Zusammensetzung) Homogene Stoffe mit physikalischen Methoden Trennung Homogene Gemische (Lösungen, veränderliche Zusammensetzung) Reine Stoffe mit physikalischen Methoden (feste Zusammensetzung) Trennung Verbindungen mit chemischen Methoden Elemente Ein heterogenes Gemisch besteht erkennbar aus unterschiedlichen Phasen. Im heterogenen Gemisch Granit erkennt man farblose Quarz-, schwarze Glimmer- und rosafarbene Feldspatkristalle. Ein homogenes Gemisch erscheint durch und durch einheitlich, es bildet eine Phase, zum Beispiel Luft, eine Traubenzuckerlösung oder eine Kupfer-Zink-Legierung (Messing); flüssige und feste homogene Gemische nennt man Lösungen. Reine Stoffe sind Verbindungen (Kohlendioxid - CO2, Wasser - H2O, Glucose - C6H12O6, Methan - CH4) und Elemente [Helium - He, (Di)Wasserstoff - H2, (Di)Sauerstoff-O2, (Cycloocta)Schwefel - S8, weißer Phosphor - P4]. Heterogene und homogene Gemische können mit Hilfe physikalischer Methoden getrennt werden, während zur Trennung der in Verbindungen enthaltenen Elemente chemische Methoden notwendig sind. Die Zerlegung erfolgt in der durch die Pfeile angegebenen Reihenfolge. 3 Man unterscheidet folgende heterogene Gemische, zu deren Trennung man die unterschiedlichen physikalischen Eigenschaften der verschiedenen Phasen nutzt: Aggregatzustand der Phasen Bezeichnung Beispiele Verfahren zur Phasentrennung (1) fest + fest Gemenge Sand + Kochsalz Granit Sortieren, Sieben, Flotation Scheidung nach Dichte, elektromagnetische Trennung, Extraktion (2) fest + flüssig Suspension Malerfarbe, Schlamm, Butter Sedimentieren + Dekantieren, Zentrifugieren, Filtrieren (3) flüssig + flüssig Emulsion Milch Zentrifugieren (4) fest + gasförmig Aerosol Rauch Sedimentieren, Filtrieren elektromagnetische Trennung (5) flüssig + gasförmig Aerosol Nebel, Schaum Sedimentieren Gase sind immer vollständig mischbar und bilden deswegen stets ein Einphasensystem. Auch ein chemisch einheitlicher Stoff kann ein Mehrphasensystem bilden (Eis, flüssiges H2O, Dampf). Unter einem dispersen System (Mehrkomponentensystem) versteht man ganz allgemein ein aus zwei oder mehreren Phasen bestehendes System, bei welchem die eine Phase (disperse Phase, dispergierter Stoff) in der anderen (Dispersionsmittel) fein verteilt (=dispergiert) ist. Je nach dem Zerteilungsgrad (Dispersionsgrad) der dispersen Phase unterscheidet man grobdisperse, feindisperse (kolloiddisperse) und molekulardisperse Systeme. Disperses System Teilchendurchmesser der dispersen Phase Beispiele grobdispers > 10000 Å Suspension, Emulsion kolloiddispers 100 – 1000 Å leimartige Lösungen molekulardispers < 10 Å echte Lösungen (Zuckerlösung) Blut Butter Milch Schlagsahne Nebel Dispersionsmittel Wasser Fett Wasser Sahne Luft Dispergierter Stoff Blutkörperchen Wasser Öl Luft Wasser 4 Folgende homogene Gemische (Einphasensysteme, Lösungen) werden unterschieden: (1) fest/fest Legierungen (2) fest/flüssig Zuckerlösung (3) flüssig/flüssig Wein, Benzin (4) fest/gasförmig PdHn (5) flüssig/gasförmig Luft in H2O (6) gasförmig/gasförmig Luft (Messing: Cu + Zn; Bronze: Cu + Sn; Amalgam: Hg + Metall) („Palladiumschwamm“ mit atomarem Wasserstoff) Die Zerlegung von heterogenen in homogene Systeme, und von Lösungen in reine Stoffe erfolgt durch sogenannte physikalische Grundoperationen. Besonders wichtig sind: - Filtration (Versuch: Trennung einer Aufschlämmung von Sand in Wasser); hier erfolgt die Trennung aufgrund unterschiedlicher Teilchengröße (unterschiedlichen Dispersionsgrades). - Flotation; Trennung auf der Basis unterschiedlicher Dichten. - Destillation; Trennung aufgrund unterschiedlicher Flüchtigkeit; unterschiedliche Siedepunkte (Versuch: Destillation einer wässrigen Methylenblaulösung). - Extraktion; Trennung aufgrund unterschiedlicher Löslichkeit in zwei nicht miteinander mischbaren Phasen (Versuch: Ausschütteln von Iod aus einer wässrigen Iod/Iod-Kalium-Lösung mit Ether). - Sublimation; Trennung von Feststoffen aufgrund unterschiedlicher Flüchtigkeit; unterschiedliche Sublimationspunkte (Versuch: Sublimation von Iod). - Adsorptionschromatographie; Bezeichnung für ein Trennverfahren als Methode der Chromatographie, das auf dem Prinzip der unterschiedlichen Adsorption der zu trennenden Verbindungen an der stationären Phase (dem Adsorbens) beruht. Die mobile Phase (Lösungsmittel, seltener Gas) konkurriert mit dem Adsorbat um die aktiven Zentren der Adsorbentien. Auf einem ähnlichen Prinzip beruht die Affinitäts-, auf einem anderen die Verteilungschromatographie und deren Spezialfall die Papierchromatographie. Versuch: Papierchromatographische Trennung der Blattfarbstoffe (gelbgrünes Chlorophyll b, blaugrünes Chlorophyll a, Xanthophylle (ein oder mehrere Zonen), oranges Carotin). Die Zerlegung von Verbindungen in Elemente erfolgt auf chemischem Wege, z. B. durch Zersetzung mittels hoher Temperaturen (Thermolyse), des Lichtes (Photolyse) oder des elektrischen Stromes(Elektrolyse): Versuche: a) Thermolyse von Quecksilber(II)-oxid HgO > 400°C T_ Hg + 1 O2 2 Nachweis durch Spanprobe 5 b) Photolyse von Silberbromid AgBr Licht (h . ) Ag + 1 Br2 2 grau c) Elektrolyse von Wasser (zur Erhöhung der Leitfähigkeit mit verdünnter Schwefelsäure angesäuert) im Hofmannschen Zersetzungsapparat Kathode: 2H+ + 2e- Anode: 2OH- 1O 2 2 H2O H2 H2 + H2O + 2e+ 1 O2 2 3 Die chemische Reaktionsgleichung, Energie- und Massebilanz, Stöchiometrie Einer der ältesten von Menschen durchgeführten chemischen Prozesse ist die Verbrennung, die Vereinigung eines brennbaren Stoffes mit Sauerstoff zu einem neuen Stoff, einem Oxid (Verbrennung von Mg zu MgO). Bei einer Verbrennung, und ebenso bei anderen chemischen Reaktionen gehen weder wägbare Mengen Materie verloren, noch werden wägbare Mengen neuer Materie erzeugt. Dem trägt man dadurch Rechnung, dass man eine chemische Reaktionsgleichung “stöchiometrisch korrekt”, d. h. so formuliert, dass links und rechts des die Reaktionsrichtung anzeigenden Pfeils jede Elementsorte gleich oft auftritt. Diese Formulierung gewährleistet, dass die Masse der Ausgangsverbindungen (Edukte) gleich der der Endprodukte (Produkte) ist. C + O2 HgO CO2 (1) Hg + 1 O2 2 (2) Die Edukte stehen auf der linken Seite der Gleichung , die Produkte auf der rechten Seite, zwischen ihnen steht der Reaktionspfeil, der mit dem Wort „ergibt“ oder „reagieren zu“ zu lesen ist. Die Gleichung 2H2 + O2 2H2O (3) sagt aus, dass zwei Moleküle Wasserstoff (H2) und ein Molekül Sauerstoff (O2) miteinander reagieren, wobei zwei Moleküle Wasser (H2O) entstehen. Die Zahlen vor den Formeln, die Stöchiometriezahlen, zeigen die Zahl der beteiligten Moleküle an. Multipliziert man die Gleichung mit der Avogadro-Zahl ZA (oder molare Teilchenzahl) (ZA = 6,022 . 1023 = 1 mol Teilchen ), so sind es 2 ZA Moleküle H2, die sich mit ZA Molekülen O2 zu 2 ZA Molekülen H2O umsetzen, d. h. 2 mol H2 und 1 mol O2 ergeben 2 mol H2O. Die quantitative Aussage einer Reaktionsgleichung wird immer auf Molmengen bezogen. Im Verlaufe einer chemischen Reaktion wird von den beteiligten Stoffen Energie freigesetzt oder aufgenommen, zu jeder Stoffumsetzung gehört auch eine Energieumsetzung. Die freigesetzte oder aufgenommene Energie kann in verschiedenen Formen in Erscheinung treten: als Licht, als elektrische Energie, als mechanische Energie und vor allem als Wärme. 6 Die Reaktionen (1) und (3) liefern Energie (Energie wird frei = exothermer Prozess), die Reaktion (2) verbraucht Energie (Energie wird hineingesteckt = endothermer Prozess). Die bei einer chemischen Reaktion bei konstantem Druck aufgenommene oder abgegebene Energie wird als Reaktionsenthalpie H bezeichnet. Die Reaktionsenthalpie H kann man als Differenz von Enthalpien (Wärmeinhalten) H2 und H1 der Produkte und Edukte auffassen: H = H2 - H1 Bei einer exothermen Reaktion haben die Produkte einen geringeren Wärmeinhalt als die Reaktanden, bei einer endothermen Reaktion ist es umgekehrt. Die Enthalpien chemischer Substanzen hängen von der Temperatur, dem Druck und dem Aggregatzustand ab. Durch Konvention werden die für chemische Reaktionen angegebenen H-Werte auf Bedingungen bei 25o C und Norm-Atmosphärendruck (101,3 kPa) bezogen; abweichende Bedingungen müssen spezifiziert werden. Der Wert für H wird neben die Reaktionsgleichung geschrieben und bezieht sich auf die in der Gleichung aufgeführten Stoffmengen in Mol. Wenn 1 mol H2 mit einem halben mol O2 unter Bildung von Wasser reagiert, wird die Wärmemenge von 286 kJ freigesetzt: Der Aggregatzustand aller beteiligten Substanzen muss angegeben werden: (g) für gasförmig, (s) für (solidus), (l) für flüssig (liqidus) und (aq) für Lösungen in Wasser (aqua). 3.1 Stoffmenge, Konzentration, Anteil, Äquivalent a) Stoffmenge n Die SI-Einheit der Stoffmenge n(X) ist das Mol (Einheitszeichen: mol). Ein Mol ist die Stoffmenge einer Substanz, in der so viele Teilchen enthalten sind wie Atome in 12 g des Kohlenstoffnuklids 12C. Die Teilchen können Atome, Moleküle, Ionen oder Elektronen sein. Die Teilchenzahl, die ein Mol eines jeden Stoffes enthält, beträgt NA = 6.022 . 1023 mol-1. Sie wird als Avogadrosche Konstante bezeichnet. Beispiele: n (Na) = 12 mol n (CO2) = 3 mol Die Stoffmenge von Na beträgt 12 mol. Die Stoffmenge von CO2 beträgt 3 mol. Der Chemiker rechnet vorzugsweise mit der Stoffmenge und nicht mit der Masse. Der Vorteil ist, dass gleiche Stoffmengen verschiedener Stoffe die gleiche Teilchenzahl enthalten. Bei chemischen Reaktionen ist die Teilchenzahl wichtig. b) Atommasse mA Die Atommasse ist die Masse eines Atoms. Beispiel: mA (12C) = 1.993 10-26 kg 7 c) Relative Atommasse Ar Die relative Atommasse ist eine dimensionslose Zahl die gleich dem Verhältnis der mittleren Masse je Atom eines Elements zu 1/12 der Masse eines 12C-Atoms ist. Ar = mittlere Masse je Atom eines Elementes in kg 1,6605402 . 10-27 kg d) Molare Atommasse und molare Molekülmasse M ( Molare Masse oder auch Molmasse) Die Masse von 1 mol Atomen (1 mol Molekülen) ist die molare Atommasse (molare Molekülmasse). Die relative Atommasse Ar und die relative Molekülmasse Mr eines Stoffes in g ist gerade die Masse von 1 mol Atomen bzw. 1 mol Molekülen. Beispiele: Ar(Na) = 22,99 M(Na) = 22,99 g . mol-1 Mr(CO2) = 44,01 M(CO2) = 44,01 g . mol-1 Die molare Masse M eines Stoffes X ist der Quotient aus der Masse m(X) und der Stoffmenge n(X) dieses Stoffes. M(X) = m(X) n(X) [g/mol] e) Stoffmengenkonzentration c(X) Die Stoffmengenkonzentration c(X) (oder einfacher Konzentration) ist die Stoffmenge n(X), die in einem Volumen V vorhanden ist. c(X) = n(X) V [mol/l] Die Stoffmengenkonzentration kann für flüssige und feste Lösungen sowie für Gasmischungen benutzt werden. Beispiel: c(HCl) = 0,1 mol/l In einem Liter einer HCl-Lösung sind 0,1 mol gasförmiger Chlorwasserstoff gelöst. Alte Schreibweisen und Bezeichnungen: 0,1 M HCl-Lösung 0,1 molare Salzsäure Molarität für Stoffmengenkonzentration f) Molalität b Die Molalität b ist der Quotient aus der Stoffmenge n(x) und der Masse m des Lösungsmittels. b(X) = n(X) m [mol/kg] 8 Beispiel: b(NaOH) = 0,1 mol/kg In der NaOH-Lösung ist 0,1 mol NaOH in 1 kg Wasser gelöst. Alte Bezeichnung: 0,1 molale Natronlauge g) Massenanteil w(X) Der Massenanteil w(X) eines Stoffes X in einer Substanzportion ist die Masse m(X) des Stoffes bezogen auf die Gesamtmasse. w(X) = Beispiel: m(X) m . 100% Eine verdünnte Schwefelsäure hat den Massenanteil w(H2SO4) = 9 % · 100 g der verdünnten Schwefelsäure enthalten 9 g H2SO4 und 91 g H2O. Alte Bezeichnungen: Masseprozent (Gewichtsprozent) h) Stoffmengenanteil x(X) Der Stoffmengenanteil (Molenbruch) x(X) eines Stoffes X in einer Substanzportion ist die Stoffmenge n(X) des Stoffes bezogen auf die Gesamtstoffmenge: x(X) = n(X) n i) Äquivalentkonzentration Für quantitative Analysen auf der Basis von Säure-Base- und Redoxtitrationen ist der Begriff des Äquivalentteilchens zweckmäßig , das abgekürzt einfach Äquivalent genannt wird. Bei Säure-Base-Reaktionen liefert oder bindet ein Äquivalent ein Proton. Bei mehrwertigen Säuren und Basen ist damit ein Äquivalent der Bruchteil z*1 eines Teilchens X (z* = Wertigkeit der Säure bzw. der Base). Beispiele: 1 1 1 2 H2SO4, 3 H3PO4, 2 Ba(OH)2 ,, 1 H2SO4 (aq) + NaOH (aq) 2 1 Na SO (aq) + H O ,, 2 4 2 2 Ein Äquivalent Schwefelsäure kann ein Äquivalent Natriumhydroxid neutralisieren. Bei Redoxreaktionen nimmt ein Äquivalent (Redoxäquivalent) ein Elektron auf oder gibt es ab. 9 Beispiel: 1 KMnO , 1 H O 4 2 2 2 5 +VII ,, 1 MnO4- + 5 -I H2O2 + 3 H+ 5 +II 0 1 1 O + 4 H O ,, 2+ Mn + 5 5 2 2 2 Ein Äquivalent Permanganationen kann ein Äquivalent Wasserstoffperoxid oxidieren. Bei Multiplikation der Redoxgleichung mit 10 verschwinden die gebrochenen Zahlen: 2MnO4- + 5H2O2 + 6H+ 2Mn2+ + 5O2 + 8H2O Eine KMnO4-Lösung mit der Stoffmengenkonzentration c(KMnO4) = 1 mol/l besitzt 5 mol Redoxäquivalente, da ein mol KMnO4 5 mol Elektronen aufnehmen kann (das Permanganation ist hierbei „fünfwertiges“ Oxidationsmittel, z* = 5) Äquivalentkonzentration = z* · Stoffmengenkonzentration c( 1 ) = z*(X) z* Beispiel: c( 1 H2SO4) = 2 . c(H2SO4) 2 c ( 1 KMnO4) = 5 . c(KMnO4) 5 Molare Masse von Äquivalenten: M( 1 X) z* = M(X) z* [g/mol] M( 1 H2SO4) = 2 98 g/mol M( 1 KMnO4) = 5 158,034 g/mol = 31,607 g/mol 5 2 = 49 g/mol Alte Begriffe, Bezeichnungen und Schreibweisen: Normalität für Äquivalentkonzentration 0,2 normale KMnO4-Lösung 0,2 N KMnO4-Lösung 4 Der Aufbau der Atome: Elementarteilchen und Rutherfordsches Atommodell Am Ende des 18. Jhr. waren die folgenden grundlegenden Gesetze chemischer Reaktionen bekannt: a) Gesetz von der Erhaltung der Masse 10 Bei allen chemischen Umsetzungen bleibt die Gesamtmasse der Reaktionsteilnehmer erhalten. mProdukte = mEdukte Aufgrund des Massen-Energie-Äquivalenz-Gesetzes: E = m · c2 von Einstein weiß man heute, dass das vorstehende Gesetz nur ein Grenzfall des allgemeinen Prinzips von der Erhaltung der Energie ist. b) Erste chemische Grundgesetz, das Gesetz von den konstanten Proportionen: Zwei oder mehrere Elemente treten in einer Verbindung stets in einem konstanten Massenverhältnis zusammen. Beispiel: c) Quecksilber(II)-oxid, HgO 1 g Sauerstoff verbindet sich immer mit 12,5 g Quecksilber. Das zweite chemische Grundgesetz, das Gesetz von den multiplen Proportionen: Bilden zwei Elemente mehrere Verbindungen miteinander, so stehen die Massenverhältnisse, die die Elemente in den einzelnen Verbindungen miteinander bilden, im Verhältnis kleiner ganzer Zahlen. Beispiel: HgO Hg2O 1 . 12,5 g Hg 2 . 12,5 g Hg verbinden sich mit 1 g O verbinden sich mit 1 g O Diese Gesetze wurden 1805 durch Dalton mit der Atomhypothese gedeutet: 1) Jede Materie ist aus kleinsten, nicht weiter zerlegbaren Teilchen aufgebaut, die Atome genannt werden (atomos (altgriech.): unteilbar). 2) Alle Atome eines chemischen Elements sind untereinander gleich. 3) Atome verschiedener Elemente unterscheiden sich durch ihre Masse und Größe. 4) Bei chemischen Reaktionen verbinden sich die Atome verschiedener Elemente in kleinen, ganzzahligen Verhältnissen zu Verbindungen, die entweder aus kleinen Einheiten - den Molekülen - oder ausgedehnten Verbänden wie bei den Salzen bestehen. Die Existenz von Atomen ist heute ein gesicherter Tatbestand. Auf der Oberfläche eines Stoffes können Atome durch die Scanning Tunnelmikroskopie (STM) sichtbar gemacht werden. In der zweiten Hälfte des 19. Jhr. führten die Entdeckung der Ionisation verdünnter Gase im elektrischen Feld, wobei positiv geladene Teilchen (Kanalstrahlen) und negativ geladene Teilchen sehr kleiner Masse (Kathodenstrahlen) entstehen, sowie vor allem die Entdeckung der Radioaktivität zur Annahme, dass Atome entgegen der Hypothese von Dalton nicht unteilbar sind. Das Elektron J.J. Thomson untersuchte Kathodenstrahlen, Strahlen die ausgesandt werden, wenn eine große Potentialdifferenz (große Spannung) zwischen zwei Elektroden (Metallkontakten) in einer evakuierten Glasröhre angelegt wird. Thomson zeigte, dass die Kathodenstrahlen ein Strom negativ geladener Teilchen sind. Sie kamen aus dem Inneren der Atome, wodurch die negativ geladene Elektrode entstand, die Kathode genannt wurde. Thomson fand, dass die geladenen Teilchen immer die gleichen waren, 11 unabhängig davon, welches Metall als Kathode benutzt wurde. Er schlussfolgerte daraus, dass die negativ geladenen Teilchen Bestandteil aller Atome sind und nannte sie Elektronen* (Symbol: e-). Aus der Ablenkung der Kathodenstrahlen (Elektronenstrahlen) in elektrischen und magnetischen Feldern bestimmte Thomson den Wert für qe/me, das Verhältnis der Größe der Elektronenladung qe zu seiner Masse me : qe/me = - 1,7588 . 108 C/g R. A. Millikan führte Versuche durch, die es ihm gestatteten die Ladung des Elektrons zu bestimmen. qe = - 1,6022 . 10-19 C = -e e = Elementarladung (kleinste beobachtete elektrische Ladung, elektrisches Elementarquantum) Alle auftretenden Ladungsmengen können immer nur ein ganzzahliges Vielfaches der Elementarladung sein. me = 9,1094 . 10-28 g * Die Bezeichnungen „Elektron“, „Elektrizität“ usw. stammen daher, dass Bernstein - griech. Elektron-, wie schon im Altertum bekannt war, nach Reiben mit einem Fell leichte Körper (z. B. HolundermarkKügelchen) anzieht, also nach unseren heutigen Erkenntnissen „elektrisch“ aufgeladen ist. Das Proton Wenn sich in einer Kathodenstrahlröhre ein Gas befindet, werden durch die Kathodenstrahlen (Elektronenstrahlen) Elektronen aus den Gasatomen herausgeschossen. Die dabei gebildeten positiv geladenen Ionen werden zur negativen Elektrode (Kathode) beschleunigt und können hinter ihr, wenn sie Kanäle enthält, als sogenannte Kanalstrahlen nachgewiesen werden. Kathodenstrahl + + + + - + - Anode (+) Kanalstrahlen Kathode (-) zum Vakuum 12 Wenn verschiedene Gase in der Entladungsröhre eingesetzt werden, so entstehen verschiedene Arten von positiven Ionen. Das positive Ion mit der kleinsten jemals beobachteten Masse (und somit mit dem größten q/m-Wert) entsteht bei der Verwendung von Wasserstoff. Dieses kleinste positive Ion wird Proton genannt. Es ist Bestandteil aller Atome. Seine Ladung hat den gleichen Betrag wie die des Elektrons, seine Masse ist 1836 mal größer als die des Elektrons. qp/mp = 9,5791 · 104 C · g qp = 1,6022 · 10-19 C = e mp = 1,6726 · 10-24 g Das Neutron Da Atome elektrisch neutral sind, muss ein Atom gleich viele Elektronen wie Protonen enthalten. Die tatsächlichen Massen der Atome (ausgenommen 1H) sind größer als die Summe der Massen der darin enthaltenen Protonen und Elektronen. Es muss also noch zusätzliche ungeladene Teilchen geben. Solche Teilchen sind wegen ihrer fehlenden Ladung schwer nachweisbar. I. Chadwick konnte 1932 aus Messwerten von Kernprozessen, bei denen Neutronen entstehen, die Masse des Neutrons ermitteln: 9 Be 4 12C + 1 n 6 0 + 4 He 2 mn = 1,6749 . 10-24 g ne - utrom (lat.) = keines von beiden (weder positiv noch negativ geladen) Neben Elektron, Proton und Neutron kennt man gegenwärtig einige Hundert Elementarteilchen, die jedoch für das Verständnis der Chemie ohne Bedeutung sind. Vergleich der Eigenschaften subatomarer Teilchen Elementarteilchen Elektron Proton Neutron Symbol e p n Masse in kg 9,1094 · 10-31 1,6726 · 10-27 1,6749 · 10-27 Masse in u* 5,4859 · 10-4 1,0072 1,0086 Ladung -e +e keine Ladung, neutral Natürliche Radioaktivität 1896 Becquerel Radioaktivität von Uranpechblende Radioaktiver Zerfall - spontane Kernumwandlung instabiler Atomkerne, die sich durch Ausstoßung von Elementarteilchen oder kleinen Kernbruchstücken in andere Atomkerne umwandeln. Drei Arten radioaktiver Strahlung werden von den natürlichen radioaktiven Atomkernen ausgesandt: 13 -Strahlung: Sie besteht aus -Teilchen (Atomkern, der aus 2 Neutronen und 2 Protonen besteht = positiver Heliumkern 4 He2+ ) 2 -Strahlung: Sie besteht aus -Teilchen (Elektronen) -Strahlung: Sehr energiereiche (harte) elektromagnetische Strahlung. Reichweite und Durchdringungsfähigkeit der Strahlungen nehmen in der Reihenfolge < < stark zu. Massenzahl Ladung des Ions 4 2+ 2 He Protonenzahl Elementsymbol Massenzahl = Protonenzahl + Neutronenzahl = Nukleonenzahl nucleus (lat.) = Kern Protonenzahl = Kernladungszahl = Ordnungszahl im PSE= Elektronenzahl (bei ungeladenem Atom) Nuklide - eine durch Protonenzahl und Neutronenzahl charakterisierte Atomsorte Kernprozesse können mit Hilfe von Kernreaktionsgleichungen formuliert werden. Die Summe der Nukleonenzahlen und der Kernladungen muss auf beiden Seiten der Gleichung übereinstimmen (Ionenladungen werden nicht beachtet). -Zerfall: 226 Ra 88 222 Rn + 86 4 He 2 Radon -Teilchen Tochterelement rückt im Vergleich zum Mutterelement zwei Stellen im PSE nach links Radium -Zerfall: 14C 6 14 N 7 + 0e-1 + 0 - ( 1 n 0 e 0 1 p + 0 e- + 0- ) -1 0 e 1 -Teilchen Antineutrino Tochterelement rückt im Vergleich zum Mutterelement eine Stelle im PSE nach rechts “Kohlenstoff-Uhr” Das -strahlende Kohlenstoffnuklid 146 C wird für die Altersbestimmung kohlenstoffhaltiger historischer und prähistorischer Organismen verwendet. Unter der Einwirkung der kosmischen Strahlung, die in der 1 H + 14C ) oberen Atmosphäre, Stickstoff in Kohlenstoff umzuwandeln vermag ( 14 N + 1 n 7 0 1 6 14 hat sich in der Atmosphäre im Laufe der Jahrmillionen eine Gleichgewichtskonzentration von 14CO2 eingestellt. Sie entspricht 16 14C-Atom-Zerfällen je g Kohlenstoff pro Minute, ist also außerordentlich gering. Analoges gilt für die Pflanzen, die bei der Assimilation, und für die Tiere, die über die Pflanzen die Gleichgewichtskonzentration von 14C in sich aufnehmen und sie während ihrer Lebenszeit infolge des dauernden Ausgleichs mit der Umwelt konstant halten. Sobald aber ein lebender Organismus stirbt, vermag er keinen neuen radioaktiven Kohlenstoff mehr zu inkorporieren. Damit sinkt die 14C-Aktivität nach Ablauf von 5730 Jahren auf die Hälfte (Halbwertszeit, Zerfall von 8 14C-Atomen je g C pro Min.), nach Ablauf von 11460 Jahren auf ein Viertel (Zerfall von 4 14C-Atomen je g C pro Min.) usw. Umgekehrt kann man somit aus dem Maß der in einem abgestorbenen Organismus (z. B. der Holzplanke eines alten Schiffes, den Knochenresten eines prähistorischen Tieres) je Gramm C noch vorhandenen 14CAktivität mit Hilfe der Halbwertszeit von 14C zurückrechnen, zu welchem Zeitpunkt er noch volle Aktivität besaß, d. h. wann er gestorben ist. Auf diese Weise ist eine experimentelle Überprüfung geschichtlicher und vorgeschichtlicher Zeitangaben (Altersbestimmungen zwischen 400 und 30000 Jahren mit einer Fehlergrenze von durchschnittlich 5 %) möglich. Das Rutherfordsche Atommodell 1911 berichtete Rutherford über Experimente zur Untersuchung des Atomaufbaus mit Hilfe der Strahlen. Ein Strahl von -Teilchen (226Ra-Quelle) wurde auf eine 0,004 mm dicke Folie aus Gold gerichtet. - Die Mehrzahl der -Teilchen flog geradlinig durch die Folie hindurch. - Einige -Teilchen, jedes Hunderttausende, wurden seitwärts abgelenkt und noch weniger auf die Strahlenquelle zurückgeworfen. Wenn die Atome elastische Bälle wären, müsste aber jedes -Teilchen abgelenkt oder reflektiert werden. Dieses Ergebnis lässt sich nur so erklären, dass der größte Teil der Masse des Atoms auf einen kleinen Raum konzentriert ist und der größte Teil des Atomvolumens fast leer ist. Das Atom besteht aus einem Atomkern und einer Atomhülle. Atomkern -mehr als 99,9 % oder Gesamtmasse des Atoms - ~ 1 fm ( 1 fm = 10-15 m) - enthält gesamte positive Ladung als Vielfaches von e Kernladungszahl (charakteristisch für jedes Element) Atomhülle - ~100-400 pm (1 pm = 10-12 m) - Elektronen nehmen fast das gesamte Volumen des Atoms ein - Träger der optischen, magnetischen und chemischen Eigenschaften des Atoms - Zusammenhalt durch starke Kernkraft m Meter mm Milli10-3 µm Mikro10-6 nm Nano10-9 pm Piko10-12 fm Femto10-15 100 pm = 0,1 nm = 10-10 m = 10-8 cm = 1Å (Angström) Chemische Elemente, Isotope Ein chemisches Element besteht aus Atomen mit gleicher Protonenzahl (Kernladungszahl), die Neutronenzahl kann unterschiedlich sein. Nuklide mit gleicher Protonenzahl, aber verschiedener Neutronenzahl heißen Isotope. 15 Reinelemente bestehen in ihrem natürlichen Vorkommen aus einer Nuklidsorte (9Be-Beryllium, 19F-Fluor, 23 Na-Natrium). Mischelemente bestehen aus Isotopen (C: 12C, 13C, 14C; N: 14N, 15N; O: 16O, 17O, 18O). Isotope werden mit dem Massenspektrometer nachgewiesen. Nach dem Verdampfen der Probe werden die gasförmigen Teilchen ionisiert und im elektrischen Feld beschleunigt. Durch Ablenkung in einem elektrischen und anschließend in einem magnetischen Feld erreicht man, dass nur Teilchen mit gleicher spezifischer Ladung (Quotient aus Ladung und Masse) an eine bestimmte Stelle gelangen und dort z. B. photographisch nachgewiesen werden können. Die Teilchen werden also nach ihrer Masse getrennt, man erhält ein Massenspektrum. Aufbauprinzip eines Massenspektrometers Sample Electron gun Pump Ion detector c b a Mass spectrum High Ion voltage beam Electromagnet Die Atommasse eines Elements („mittlere Masse je Atom“) erhält man aus den Atommassen der Isotope unter Berücksichtigung der natürlichen Isotopenhäufigkeit. Die Atommasse eines Elements in u ist nahezu ganzzahlig, wenn die Häufigkeit eines Isotops sehr überwiegt. 16 Beispiele: Isotope Atommasse in u Atomzahlanteil in % Wasserstoff H 1 H H 3 H 1,0078 2,0141 99,985 0,015 Spuren Bor B 10 10,01294 11,00931 19,78 80,22 2 B B 11 mittlere Atommasse in u 1,00794 10,811 Der Zahlwert der mittleren Atommasse in u ist gleich der relativen Atommasse Ar. Massendefekt Die Masse eines jeden aus Protonen und Neutronen zusammengesetzten Atomkerns ist kleiner als die Summe der Massen seiner Bestandteile. Massendefekt bei der Bildung des Heliumkerns ( 42 He2+ ): wirkliche 2 x mp = 2 x 1,007277 u 2 x mn = 2 x 1,008665 u 4,0319 u m = 4,0015 u m = 0,030 u Der Massenverlust m wird als Massendefekt bezeichnet. Er tritt bei allen Nukliden auf. Der Massendefekt kann durch das Einsteinsche Gesetz der Äquivalenz von Masse und Energie gedeutet werden: E = m · c2 c = Lichtgeschwindigkeit im leeren Raum = 2,99793 · 108 m . s-1 Das Gesetz sagt, dass Masse in Energie umwandelbar ist und umgekehrt. 0,03 u entspricht einer Energie von 28,3 MeV. Bei der Vereinigung von Neutronen und Protonen zu einem Kern wird Kernbindungsenergie frei. Der Energieabnahme des Kerns äquivalent ist eine Massenabnahme. Die Kernbindungsenergie des He-Kerns beträgt 28,3 MeV, der äquivalente Massendefekt 0,03 u. Dividiert man die Gesamtbindungsenergie durch die Anzahl der Kernbausteine, so erhält man eine durchschnittliche Kernbindungsenergie pro Nukleon. Für 4 2+ beträgt sie 28,3 MeV/4 = 7,1 MeV. 2 He 17 Die Kernbindungsenergie/Nukleon (= Gesamtkernbindungsenergie/Nukleonzahl) ist ein vergleichendes Maß für die Stabilität von Atomkernen. Die Abbildung zeigt die Kernbindungsenergie pro Nukleon mit zunehmender Nukleonenzahl. Kerne mit der Nukleonenzahl um 60 (Fe, Ni, Co) sind besonders stabile Kerne: Der Massenverlust und die Bindungsenergie pro Nukleon für die Bindung von Atomkernen aus Elektronen, Protonen und Neutronen. Kernfusion ist ein Prozess bei dem zwei sehr leichte Kerne zu einem größeren Kern verschmolzen werden. Kernspaltung ist ein Prozess, bei dem ein schwerer Kern in zwei Kerne mittlerer Masse gespalten wird. - In beiden Fällen werden Nuklide mit höherer Bindungsenergie pro Nukleon gebildet. Es entstehen stabilere Kerne und sehr große Energiemengen werden freigesetzt (siehe Punkt Kernchemie). 5 Wasserstoff Element Nr. 1 (= Ordnungszahl im Periodensystem der Elemente), Elementsymbol H, abgeleitet von Hydrogen [= Wasserbildner, hydor (gr.) = Wasser; gennan (gr.) = erzeugen] 18 Wasserstoff ist ein Mischelement (polynuklides Element). Das häufigste Isotop 1H besitzt einen Atomkern ohne Neutronen. Damit besitzt Wasserstoff das einfachste gebaute Atom (Atomkern mit einem Proton, Atomhülle mit einem Elektron). Isotope Relative Häufigkeit 1 1 2 1,5 · 10-4 3 10-18 H (leichter Wasserstoff) H (auch D Deuterium) H (auch T Tritium) Tritium ist radioaktiv (schwacher -Strahler). Wasserstoff ist das kosmisch häufigste Element (91 Atom -%). Man nimmt an, dass bei der Entstehung des Weltalls durch einen “Urknall” primär neben kleineren Mengen Helium ausschließlich Wasserstoff gebildet wurde, der sich dann in der Folgezeit durch kernchemische Reaktionen teilweise in die übrigen Elemente umwandelte. So gehen die unendlich vielseitigen Erscheinungsformen der belebten und unbelebten Natur letztlich auf Wasserstoff zurück (“Am Anfang war der Wasserstoff”). Die Sonne besteht zu 70% aus Wasserstoff (+28% He und 2% andere Stoffe). Sie ist eine riesige Kugel aus heißem Gas (Oberfläche etwa 5500°C), die von innen durch Kernenergie aufgeheizt wird. In ihrem Zentrum beträgt die Temperatur 15 Millionen °C. Bei dieser Temperatur reagieren die Gaspartikel der Sonne miteinander und Wasserstoff wird in Helium und Energie umgewandelt. Kernfusion in der Sonne: 4 11 H+ 4 2 He2+ + 2 01e+ + 2 00 ve + 26,72 MeV Positron Neutrino Je Mol 42 He werden 2580 Millionen kJ entwickelt. Eine kontrollierte Wasserstoffverschmelzung zu Helium, wie sie auf der Sonne stattfindet, ist auf der Erde im Laboratorium noch nicht geglückt. Die Sonne (UV-Aufnahme) 19 In der Erdkruste ist jedes sechste Atom ein H-Atom. Wasserstoff kommt auf der Erde außer im organischen Material und den fossilen Brennstoffen (Kohle, Erdöl, Erdgas: CH4, H2S) im Wesentlichen als freies Wasser (Ozeane) und gebundenes Wasser (Kristallwasser: Gips - CaSO4 · 2H2O, Carnallit - KMgCl3 · 6H2O) und in Hydroxiden vor (z. B. AlO(OH) als Hauptbestandteil von Bauxit). Aufbau der Erdkugel Die stabile Vorkommensform des elementaren Wasserstoffs ist der Diwasserstoff. Im Diwasserstoff sind zwei H-Atome, die je ein Elektron besitzen zu einem Molekül mit einem bindenden Elektronenpaar verknüpft. . . H + H atomarer Wasserstoff H H molekularer Wasserstoff H = -436,2 kJ/mol 20 Da Wasserstoff (H2) unter allen Stoffen die kleinste Molekülmasse besitzt, zeigt er außergewöhnliche physikalische Eigenschaften. a) H2 hat unter allen Elementen die kleinste Dichte [ (H2) = 0,089 · 10-3 g/ml; (H2-flüssig) auch nur 0,07 g/ml; vergl. (Luft) = 1,29 · 10-3 g/ml und (CO2) = 1,98 · 10-3 g/ml] Versuch: H2-Ballon schwebt über gasförmigen CO2 b) H2 hat ferner das am stärksten ausgeprägte Diffusionsvermögen (Versuch: Diffusion von H2 und Luft durch die poröse Wand einer Tonzelle); die Geschwindigkeiten, mit denen zwei Gase 1 und 2 durch eine poröse Wand diffundieren [diffundere (lat.) = ausbreiten, sich zerstreuen] sind umgekehrt proportional zu den Quadratwurzeln aus ihren Molmassen (Grahamsches Gesetz): v1 : v2 = M2 : M1. Vergleicht man z.B. die Diffusionsgeschwindigkeit von Wasserstoff (H2) und Sauerstoff (O2), so ergibt sich v(H2) : v(O2) = 32 : 2 : 16 = 4; d.h. Wasserstoff diffundiert viermal so schnell durch poröse Wände wie Sauerstoff. c) Die Schallgeschwindigkeit (c) ist in H2 am größten: N2 c (m/s) 349 M (g/mol) 28 He 1007 4 H2 1309 2 Die Atom- bzw. Molekülmasse bestimmt die Dichte eines Gases und ist somit über die Schallgeschwindigkeit auch die Frequenz der schwingenden Luftsäule. Nach dem Einatmen von Wasserstoff, hat man infolge der großen Schallgeschwindigkeit in Wasserstoff eine sehr hohe Stimme (Versuch). Emissionsspektrum von Wasserstoff Bringt man Wasserstoff unter vermindertem Druck in eine mit Elektroden versehene Glasröhre (GeislerRöhre,) und setzt ihn der Entladung eines Induktoriums aus, so beobachtet man ein rotviolettes Leuchten angeregter Wasserstoffatome (H*): a) Bildung angeregter (energiereicher) H-Atome (H*) durch Bombardierung von Diwasserstoff mit Elektronen im 10-20eV Energiebereich b) Angeregte H-Atome geben Energie ab (emittieren elektromagnetische Strahlung). Zerlegt man das emittierte Licht durch ein Prisma, so beobachtet man im sichtbaren Spektralgebiet vier getrennte Linien, die als H, H, H, H bezeichnet werden. H = 656,6 nm (rot), H = 486,3 nm (grünlichblau), H = 434,2 nm (violett), H = 410,3 nm (violett) Gewinnung a) elektrochemisch aus Wasser (s. S. 5 c) H2O H2 1 + 2 O2 (Nachweis von H2 durch die Knallgasprobe, von O2 durch die Glimmspanprobe) 21 b) Reduktion von Wasserstoffionen H+ (aus Säure) mit unedlen Metall (Labor) Kippscher Gasentwickler: c) Zn + 2H3O+ H2 + Zn2+ + 2H2O Wasserdampf wird mit dem Nichtmetall Kohlenstoff (in Form von Koks) reduziert 800 - 1000 °C H2O(g) + C CO + H2 H = 131 kJ/mol "Wassergas" oder "Synthesegas" Die Abtrennung des Kohlenmonoxids aus Wassergas erfolgt in der Technik mit weiterem Wasserdampf. Kohlenmonoxid wird mit Wasser unter Neubildung von Wasserstoff zu Kohlendioxid oxidiert („Kohlenoxid-Konvertierung“): H2O(g) + CO H2 + CO2 H = -41,2 kJ/mol Kohlendioxid lässt sich im Unterschied von CO unter Druck leicht mit Wasser oder Methanol herauswaschen, durch Tiefkühlung abtrennen oder durch Basen chemisch binden. d) Steam-Reforming-Verfahren (wichtigstes Verfahren) Methan aus Erdgasen oder leichte Erdölfraktionen (niedere Kohlenwasserstoffe) werden bei Temperaturen zwischen 700 und 830o C und bei Drücken bis 40 bar mit H2O-Dampf in Gegenwart von Ni-Katalysatoren umgesetzt: CH4 + H2O 3H2 + CO H = +206 kJ/mol Verwendung a) Synthesegas 54 % Ammoniaksynthese (Haber-Bosch-Verfahren) 3H2 + N2 38 % 2NH3 H = -92,28 kJ/mol Petrochemie -Hydrocracking (thermisch mit H2 “zerbrechen”) C12H26 + H2 C4H10 + C8H18 Symbol ““ steht für Wärmezufuhr Erhöhung der Ausbeute an Oktanen (Hauptbestandteile des Benzins) 22 -Hydrotreating (mit H2 “behandeln”) C 8H16 + H2 C8H18 ungesättigte Kohlenwasserstoffe 6% gesättigte Kohlenwasserstoffe Fischer-Tropsch-Synthesen z.B. Methanol CO + 2H2 Magarinehärtung, ungesättigte Fetsäuren + H2 b) gesättigte Fettsäuren Reduktionsmittel in der Metallurgie für die Herstellung von sehr reinen Metallen: Fe2O3 + H2 c) CH3OH 2Fe + 3H2O Energieträger der Zukunft -Brennstoffzelle -kontrollierte Kernfusion Chemische Eigenschaften a) Thermisches Verhalten von Diwasserstoff und atomarem Wasserstoff Bei der Bildung von Diwasserstoff aus atomarem Wasserstoff wird sehr viel Reaktionswärme frei, d. h. für die homolytische Spaltung von H2 zu atomarem Wasserstoff, also die umgekehrte Reaktion muss die Energie von 436,22 KJ pro mol H2-Moleküle aufgewendet werden: H . H H . + H H = 436,22 kJ/mol Diese Energie ist recht groß. Für die thermische Spaltung von H 2 sind deshalb recht hohe Temperaturen notwendig: T [Kelvin] 300 3000 6000 % Spaltung 10-34 7,85 99,3 Auf der Sonnenoberfläche (~5500°C) wird Diwasserstoff gespalten und im Sonnenmantel (~10 5 Kelvin) atomarer Wasserstoff ionisiert: H H + + e- Im Sonnenkern (107 Kelvin) verschmelzen die Protonen zu Heliumkernen (s. S. 18) unter Freisetzung von Kernenergie. 23 „Langmuir-Fackel“ In der Langmuir-Fackel verwendet man die bei der Rückbildung von H2-Molekülen aus Atomen freiwerdende Rekombinationswärme zum Schweißen und Schmelzen hochschmelzender Metalle [Wolfram, (Smp. 3410 °C) Tantal (Smp. 3000 °C]. Die maximale Temperatur der Langmuir-Fackel (4000 °C) ist um rund 1000 °C höher als die des Knallgasgebläses (s. unten). In der Langmuir-Fackel wird ein H2-Strom durch einen Lichtbogen (7000 °C) geleitet, wodurch ein Strom von heißen atomaren Wasserstoff erzeugt wird, der unmittelbar auf die zu schmelzende Metalloberfläche gerichtet wird. Eine Weiterentwicklung der Langmuir-Fackel ist der „Plasma-Brenner“, bei dem Gase durch ein 20 MHz-Hochfrequenzfeld in Atomionen und Elektronen gespalten werden, die sich am Brennerausgang in sehr starker exothermer Reaktion wieder zu normalen Gasmolekülen vereinigen und dabei Temperaturen von 15000-19000 °C erzeugen. Wasserstoff „in statu nascendi“ (im Augenblick des Entstehens) Bei der chemischen und elektrochemischen Darstellung des molekularen Wasserstoffs aus Wasser oder Säuren entsteht der Wasserstoff im ersten Augenblick atomar oder wenigstens in einem angeregten, energiereicheren Zustand Hnasc. Zn + 2H+ Zn2+ + 2Hnasc. Wasserstoff „in statu nascendi“ ist deshalb viel reaktionsfreudiger als gewöhnlicher molekularer Wasserstoff. Versuche:) a) in eine mit Schwefelsäure angesäuerte Kaliumpermanganat-Lösung wird molekularer Wasserstoff (aus Kippschem Gasentwickler oder Vorratsflache) eingeleitet: MnO4- + H2 + keine Reaktion Permanganat violett b) in die schwefelsaure KMnO4 -Lösung werden Zink-Granalien gegeben: b) Redoxverhalten Die wichtigste chemische Eigenschaft des Wasserstoffs ist seine Brennbarkeit. Entzündet man Wasserstoff an der Luft, so verbrennt er mit fahler, bläulicher, heißer Flamme zu Wasser: 24 Ein Gemisch aus H2 und O2 reagiert bei Raumtemperatur nicht (metastabiles Gemisch), da der molekulare Wasserstoff infolge seiner hohen Dissoziationsenergie recht reaktionsträge ist. Durch einen Zündfunken (600 °C) oder einen Katalysator (z. B. feinverteiltes Palladium oder Platin, diese Metalle lösen H 2 chemisch als atomaren Wasserstoff) kommt die Reaktion in Gang (wird aktiviert). Die freigesetzte Wärmeenergie bewirkt, dass sich die Umsetzung schließlich von der erhitzten Stelle ausgehend unter starker Temperatursteigerung explosionsartig durch das ganze Gemisch hindurch fortsetzt („Knallgasexplosion“). Versuch: Mit Knallgas gefüllte Seifenblasen werden mit einem Glimmspan entzündet. Mischt man Wasserstoff erst im Moment des Entzündens den zur Verbrennung notwendigen Sauerstoff bei, so wird eine Explosion vermieden, da sich dann die Verbrennung wegen des Fehlens eines zündfähigen Gasgemisches nicht ausbreiten kann. Man bedient sich dieser Art der gefahrlosen H2Verbrennung zur Erzeugung hoher Temperaturen im Knallgasgebläse. Bei diesem Gebläse werden die beiden Gase H2 und O2 mittels eines „Daniellschen Hahns“ getrennt voneinander einer gemeinsamen Austrittsöffnung zugeführt, an der das entströmende Gasgemisch entzündet wird. Die Temperatur der Knallgasflamme kann bis 3000 °C betragen, so dass sich in dieser Flamme hochschmelzende Stoffe wie Platin (Smp. 1772 °C), Aluminiumoxid (Smp. 2050 °C) oder Quarz (Smp. 1550 °C) leicht schmelzen lassen. Technisch wird das Knallgasgebläse in großem Umfang zum autogenen Schweißen und Scheiden von Metallen angewendet. In der Brennstoffzelle kommt es zu einer „kalten Verbrennung“ von Wasserstoff. Die chemische Energie der Verbrennung wird direkt in elektrische Energie umgewandelt. Die Knallgasreaktion ist nach dem Reaktionsmechanismus eine Radikalreaktion mit verzweigter Reaktionskette (mehrere Kettenträger). Radikal: ein Teilchen mit ungerader Elektronenzahl oder bei gerader Elektronenzahl mit ungepaarten Elektronen Auch bei der Reaktion von Chlor mit Wasserstoff steigert sich die Reaktionsgeschwindigkeit aufgrund der freigesetzten Wärme bis zur Explosion. H2(g) + Cl2(g) 2HCl(g) H = - 184 kJ/mol Gemische aus Cl2 und H2 nennt man Chlorknallgasgemische. Wie die Reaktion von H2 und O2, muss auch die Reaktion von H2 und Cl2 aktiviert werden. Durch die Aktivierung werden Cl2-Moleküle in Cl-Atome gespalten. Diese initiierende (aktivierende) Reaktion erfordert einen hohen Energiebetrag (243 kJ/mol) und ist für die Reaktion von H2 mit Cl2 die Aktivierungsbarriere, die überwunden werden muss. 25 H2 + 2Cl Energie Ea= Aktivierungsenergie (-barriere) Ea H2 + Cl2 H H = Reaktionsenthalpie 2HCl Reaktionsachse Die energetisch eigentlich begünstigte Reaktion von H2 und Cl2 zu HCl ist somit durch eine Aktivierungsbarriere gehemmt (metastabiles Gemisch). Die zur Cl 2-Spaltung erforderliche Energie kann zum Beispiel in Form energiereichen, blauen Lichtes zugeführt werden. Der explosionsartige Ablauf dieser Chlorknallgasreaktion wird durch einen Radikalkettenmechanismus mit verzweigter Kette (nur ein Kettenträger [Chlorradikale]) bewerkstelligt. Da die Energie E eines Lichtquants (Photons) der Frequenz durch die Planck-Beziehung E = h · gegeben ist, kann hieraus durch Multiplikation mit NA die Energie eines Mols Photonen berechnet werden. E = h · · NA h = Plancksche-Konstante = 6,62608 · 10-34 J · s c λ E NA h c λ h c NA 6,62 10-34 J s 3 108 m s -1 6,023 1023 mol-1 E 243,5 103 J mol-1 4,912 10-7 m 491nm 26 Licht der Wellenlänge (nm) Farbe E (kJ/mol Photonen) 700 600 550 450 400 Rot Gelb Grün Blau Violett 179,7 199,2 217,1 265,7 298,7 Erst blaues Licht ist also hinreichend energiereich, um die Cl2-Spaltung photochemisch einzuleiten und damit die Reaktion von Cl2 mit H2 auszulösen. Für die Spaltung von Wasserstoff reicht die Energie des sichtbaren Lichtes nicht aus (H2 2H· H = 436 kJ/mol). Wasserstoffverbindungen Wasserstoff bildet mit fast allen Elementen Verbindungen, mehr als irgendein anderes Element. Nach der vorherrschenden Bindungsart können drei Gruppen von H-Verbindungen unterschieden werden: a) Kovalente H-Verbindungen (Molekulare) - mit Nichtmetallen und Halbmetallen, im Allgemeinen flüchtig (meist Gase oder Flüssigkeiten) - Halogenwasserstoffe, H2O, H2S, NH3, Phosphane, Kohlenwasserstoffe, Silane, Borane b) Salzartige H-Verbindungen (Hydride) -werden von stark elektropositiven Metallen (Alkali- und Erdalkalimetalle) gebildet, kristallisieren in Ionengittern - NaH Natriumhydrid [ Ionengitter aus Na+ und H- (Hydridion)] c) Metallartige H-Verbindungen Den metallartigen H-Verbindungen, zu denen die Übergangsmetallhydride zählen, liegen typische Metallstrukturen zugrunde, in welche atomarer Wasserstoff eingelagert ist (Wasserstoff„Einlagerungsverbindungen“). Die H-Atome besetzen Tetraederlücken oder Oktaederlücken des Metallgitters. z. B.: PdH0,8, VH0,05 27 Unterschiedliche Klassen binärer H-Verbindungen und ihre Verteilung im PSE 18 1 2 13 14 15 16 17 3 4 5 6 7 8 9 10 11 12 Saline Molecular Metallic Uncharacterized or unknown 6 Der Aufbau der Atome: Das Bohrsche Atommodell Angeregte Atome emittieren Energie in Form elektromagnetischer Strahlung. Jedes Element sendet ein charakteristisches Linienspektrum (Emissionsspektrum) aus. Man kann daher die Elemente durch Analyse ihres Spektrums identifizieren (Spektralanalyse). Atomemissionsspektrum Wenn ein Atom aus einem Zustand höherer in einem Zustand niederer Energie übergeht, verliert es Energie in Form eines Photons. Ein großer Energieverlust ist verknüpft mit einer hohen Frequenz (oder kurzen Wellenlänge) der emittierten Strahlung. 28 Das Linienspektrum der H-Atome besteht aus mehreren Serien, die nach ihren Entdeckern Lyman(Ultravioletter-Bereich), Balmer-(Ultravioletter und sichtbarer Bereich), Paschen- (Infraroter Bereich), Brackett- (IR) und Pfund-Serie genannt werden. Die auf Seite 20 hervorgehobenen vier Emissionslinien im sichtbaren Bereich gehören zur Balmer-Serie. Balmer-Serie des Wasserstoffs H H H H Seriengrenze kontinierliches Spektrum 700 600 500 400 300 nm 1 = R 8 Die Spektrallinien des H-Spektrums lassen sich durch eine einfache Gleichung beschreiben: 1 n2 1 m2 ist die Wellenlänge irgendeiner Linie, m und n sind ganze positive Zahlen, wobei m größer als n ist. R ist die Rydberg-Konstante = 109678 cm-1. Das Linienspektrum des Wasserstoffs lässt sich nur erklären, wenn man annimmt, dass das einzelne Elektron in der Atomhülle nur ganz bestimmte Energiewerte annehmen kann. Die Beschreibung der Atomhülle muss durch ein Energieniveaumodell erfolgen. Diesen Schritt vollzog Niels Bohr. Seine Theorie basiert auf folgenden Postulaten: 1. Postulat a) Das Elektron kann sich auf Kreisbahnen (orbits) um den positiven Atomkern bewegen. Es strahlt dabei keine Energie ab. b) Es sind nur solche Bahnen vom Radius r „erlaubt“ („stationäre Elektronenzustände Energieniveaus“), für die der Drehimpuls m · v · r des Elektrons (m = Masse, v = Geschwindigkeit, r = Radius der Umlaufbahn) gleich h/2 (h = Plancksches Wirkungsquantum) oder einem ganzen Vielfachen davon ist („Impulsquantelung“ des Bohrschen Atommodells). 29 me v r = n h 2 n ist ein ganze Zahl (1, 2, 3, ..., ), sie wird Quantenzahl genannt Das Elektron kann nicht beliebige Energiewerte annehmen, sondern es gibt nur ganz bestimmte Energiezustände, die durch die Quantenzahl n festgelegt sind (Energie des Elektrons ist quantisiert). Jede Kreisbahn entspricht einem bestimmten Energiewert (Quantenzustand) für das Elektron. Die Radien der möglichen Kreisbahnen für das Elektron im H-Atom werden mit folgender Gleichung berechnet: Das Elektron darf sich also nicht in beliebigen Abständen vom Kern aufhalten, sondern nur auf Elektronenbahnen mit den Abständen 1 · 0,053 nm (1. Bahn), 4 · 0,053 nm (2. Bahn), 9 · 0,053 nm (3.Bahn) usw.. 2. Postulat Das Elektron kann zwischen den Bahnen wechseln, beim Bahnwechsel wird Energie quantenhaft absorbiert (Sprünge auf äußere Bahnen - weiter vom Kern entfernt) oder emittiert (Sprünge von äußeren auf innere Bahnen) charakteristische Emissionslinien. Wenn sich das Elektron auf der innersten Bahn befindet und die geringste Energie hat, befindet es sich im Grundzustand. Durch Zufuhr von Energie kann das Elektron auf eine äußere Bahn springen und einen höheren Energiezustand annehmen (angeregter Zustand). Die kernnächste Schale, die der Quantenbedingung für den Bahndrehimpuls n = 1 entspricht, ist die KSchale. Die Bezeichnung der darauf folgenden Schalen (n = 2, 3, 4....) folgt dem Alphabet (L, M, N ....). Das Emissionsspektrum wird so zum Abbild der verschieden möglichen Energiezustände des Atoms und damit zu einem Abbild der Struktur der Elektronenhülle. 30 Das Zustandekommen der verschiedenen Serien des Wasserstoffspektrums zeigt die Abbildung: Lyman-Serie (ultraviolett) Balmer-Serie (sichtbar) H H H H Paschen-Serie (infrarot) n=1 n=2 n=3 n=4 n=5 Brackett-Serie Pfund-Serie n=6 Das Elektron bewegt sich auf einer durch die natürliche Zahl n (Hauptquantenzahl) gekennzeichneten Kreisbahn um das Proton. Beim Übergang von einer Kreisbahn mit größerem Radius und höherer Energie wird ein Lichtquant oder Photon ausgesandt. Übergänge, die auf der gleichen Kreisbahn enden, bilden eine Serie, z. B. gehören zu der Balmer-Serie Übergänge von Kreisbahnen mit n>2 auf die Kreisbahn mit n=2. 7 Atombau und Periodensystem Mit Hilfe des Bohrschen Atommodells kann nur das Emissionsspektrum des Wasserstoffs erklärt werden. Eine allgemeine Deutung für die Atomspektren aller Elemente ist nicht möglich. Zur Interpretation dieser Atomspektren muss man annehmen, dass die durch n charakterisierten Kreisbahnen noch in l Unterbahnen aufgespalten sind. Die Zahl n heißt auch Hauptquantenzahl, sie beschreibt die Hauptenergieniveaus. Ein Hauptenergieniveau ist unterteilt in l Unterenergieniveaus, wobei l die Werte von 0 bis n-1 annehmen kann. Die Unterniveaus l für ein bestimmtes n werden durch Buchstabensymbole gekennzeichnet, die auf dem Aussehen der Spektren beruhen, an denen diese Niveaus beteiligt waren: s (l = 0) „scharf“, p (l = 1) „prinzipal“, d (l = 2) „diffus“, f (l = 3) „fundamental“. Im Magnetfeld kommt es zu einer weiteren Aufspaltung der Unterniveaus, welche durch die Magnetquantenzahl m charakterisiert wird. Die Magnetquantenzahl kann die Werte von +l bis -l annehmen. 31 Energie Unter n = 1 erhält man so das 1s-Niveau (l = 0 [= s-Unterniveau mit m = 0]). Unter n = 2 erhält man zusätzlich zum 2s-Niveau (l = 0, m = 0) das 2p-Niveau (l = 1 [= p-Unterniveau]), das im Magnetfeld in die “magnetischen” Unterniveaus 2p (m = 1), 2p (m = 0) und 2p (m = -1) aufspaltet. In Abwesenheit eines Magnetfeldes haben 2p (m = 1), 2p (m = 0) und 2p (m = -1) die gleiche Energie (man spricht dann von drei entarteten Energieniveaus). Unter dem Hauptenergieniveau n=3 erhält man neben dem 3s-Unterniveau, den drei 3p-Unterniveaus (l = 1, m = +1, 0 und -1) noch fünf 3d-Unterniveaus (l = 2 [= d-Unterniveaus]) mit m = +2, +1, 0, -1 und -2. Ab n = 4 sind noch sieben f-Unterniveaus (l = 3 [= f-Unterniveau]) m = +3, +2, +1, 0, -1, -2 und -3 zu berücksichtigen. Auf einem Hauptenergieniveau nimmt die Energie der Unterniveaus in folgender Reihe zu s < p < d < f. Da mit zunehmender Hauptquantenzahl die energetischen Abstände zwischen den Hauptniveaus kleiner werden, kommt es ab dem 3. Hauptniveau zu Überschneidungen der höheren Unterniveaus mit den energetisch niederen Unterniveaus des nächsten Hauptniveaus. So liegt z. B. das 3d-Unterniveau energetisch höher als das 4s-Unterniveau. 8s 7p 7s 6p 5d 5p 4d 4p 3d 6d 6s 5s 4s 5f 4f 3p 3s 2p 2s 1s s- p- d- f- Elektronen Relative Energien der 1s- bis 8s- Energieniveaus (nicht maßstabgetreu) Ausgehend von diesem Energieniveauschema und unter Berücksichtigung der magnetischen Energieniveaus, sowie des Spinzustandes der Elektronen [das Elektron besitzt einen Spin (Eigendrehimpuls)] der entsprechend der Spinquantenzahl s = + 1/2 oder -1/2 betragen kann (graphische Darstellung bzw. ) kann man die Elektronenhülle der Elemente aufbauen. Der Aufbau der Elektronenhüllen der Atome vollzieht sich nun so, dass beginnend mit dem Wasserstoff, Elektron für Elektron in die Energieniveaus eingefüllt wird. Hierfür gelten drei Energieminimierungsprinzipien (= Aufbau-Regeln): 1. Aufbau-Prinzip: Die Elektronen belegen stets zuerst die energieärmsten zur Verfügung stehenden Niveaus. 32 2. Pauli-Prinzip (Ausschließungsprinzip): Zwei Elektronen in einem Mehrelektronensystem müssen sich in mindestens einer der vier Quantenzahlen (n = Hauptquantenzahl, l = Nebenquantenzahl, m = „magnetische“ Quantenzahl, s = Spinquantenzahl) unterscheiden, d. h. ein Energieniveau kann mit maximal zwei Elektronen besetzt werden (z. B. zwei Elektronen („1’’ + „2’’) auf dem 1s-Niveau - Elektron „1’’: n = 1, l = 0, m = 0, s = + 21 ( ) , Elektron „2’’: n = 1, l = 0, m = 0, s = - 21 ( ) , die Elektronen besitzen einen entgegengesetzten Spin): 1s Spin von Elektronen (Eigendrehimpuls) a) Zwei Elektronen sind gepaart, wenn sie einen entgegengesetzten Spin besitzen (im Uhrzeigersinn, entgegen dem Uhrzeigersinn). b) Zwei Elektronen besitzen einen parallelen Spin, wenn ihre Spins in die gleiche Richtung orientiert sind. 3. Hundsche-Regel (Prinzip der größtmöglichen Multiplizität): Nach der Hund-Regel verteilen sich Elektronen auf entartete magnetische Niveaus (d.h. energiegleiche) so, dass eine maximale Zahl von “ungepaarten” Elektronen mit parallelem Spin resultiert. Drei Elektronen (1, 2 und 3) verteilen sich auf die drei entarten 2p-Niveau so, dass jedes magnetische Unterniveau einfach besetzt wird. E s (1) = 1/2 s (2) = 1/2 s (3) = 1/2 33 Gesamtspinquantenzahl S = s (1) + s (2) +s (3) 1 + 1 + 1 = 3 2 2 2 2 . 3 Multiplizität = 2S + 1 = 2 2 + 1 = 4 Elektronenkonfiguration: Verteilung der Elektronen eines Atoms auf die Energieniveaus im Grundzustand. Valenzelektronenkonfiguration: Verteilung der Elektronen auf die Energieniveaus der äußeren Schale. Unter der Beachtung der drei “Aufbauregeln” und der relativen Energie der Energieniveaus (vgl. Abb. Seite 31) können die Elektronenkonfigurationen aller Elemente generiert werden. Elektronenkonfiguration der ersten zehn Elemente Für die ersten zehn Elemente des Periodensystems ergibt sich folgende Verteilung der Elektronen im Grundzustand: Energieniveau 1s 2s 2p Konfigurationsbezeichnung 2p 2p 1H 1s 1 2 He 1s 2 3 Li 1s 2 2s 1 4 Be 2 1s 2s 5B 1s 2 2s 2 2p 1 6C 1s 2 2s 2 2p 2 7N 1s 2 2s 2 2p 3 8O 1s 2 2s 2 2p 4 9F 1s 2 2s 2 2p 5 10 Ne 1s 2 2s 2 2p 6 1s-Elemente 2s-Elemente 2 2p-Elemente H - Ein H-Atom besitzt nur ein Elektron, das im Grundzustand das 1s-Niveau besetzen muss. He - Im Heliumatom kann sich das 2. Elektron ebenfalls noch im 1s-Niveau aufhalten, wenn sein Spin dem des ersten entgegengesetzt ist (Pauli-Prinzip). Li - Zwei Elektronen füllen das ls-Niveau; das dritte Elektron im Li muss nach dem Aufbau-Prinzip das nächsthöhere Energieniveau, nämlich das 2s-Niveau, besetzen. Be, B - Das vierte Elektron im Be füllt das 2s-Niveau, und das fünfte Elektron im B muss daher in einem der energetisch höher liegenden 2p-Unterniveaus eingebaut werden. C, N - Beim sechsten Element, besetzen die beiden 2p-Elektronen mit gleicher Spinrichtung zwei verschiedene (entartete magnetische p-Unterniveaus), und beim siebten Element, N, sind die drei 2pElektronen über alle 2p-Niveaus verteilt und nicht etwa zwei Elektronen in einem 2p-Orbital unter Spinkopplung (Hund-Regel der max. Multiplizität). 34 Ab dem Element O beginnt die Besetzung der 2p-Niveaus mit zwei Elektronen. Beim Neon ist die n = 2-Schale mit acht Elektronen vollständig besetzt. Beim weiteren Auffüllen mit Elektronen ist es ermüdend, die abgeschlossenen oder vollen Schalen immer wieder neu zu zeichnen. Als Kurzschreibweise für Elektronenkonfigurationen kann man die inneren Elektronen mit dem chemischen Symbol des vorausgehenden Edelgases, in eckige Klammern gesetzt, bezeichnen. Der Aufbau der 3. Periode verläuft in genau derselben Weise, wie der Aufbau der 2. Periode. [Ne] 3s1 und 12Mg : [Ne] 3s2 p1 bis 18 3s-Elemente 11Na: 3p-Elemente 13 Al : [Ne] 3s2 Ar : [Ne] 3s2 p6 Vor der Besetzung der fünf 3d-Unterniveaus erfolgt die Auffüllung des 4s-Niveaus. : [Ar] 3d04s1 4s-Elemente 19K 3d-Elemente 21 Sc : [Ar] 3d14s2 und 20 Ca : [Ar] 3d04s2 bis 26 Fe : [Ar] 3d64s2 22Ti : [Ar] 3d24s2 27 Co : [Ar] 3d74s2 23V : [Ar] 3d34s2 28 Ni : [Ar] 3d84s2 29 Cu : [Ar] 3d104s1 30 Zn : [Ar] 3d104s2 24Cr : [Ar] 3d54s1 25Mn : [Ar] 3d54s2 besitzt im Grundzustand die Elektronenkonfiguration [Ar] 3d54s1 anstelle von [Ar] 3d44s2. Auf diese Weise entsteht ein halbbesetztes (d5) d-Niveau, das sich durch eine besondere Stabilität auszeichnet. Die Elektronenkonfiguration [Ar]3d44s2 ist der erste angeregte Zustand des Cr-Atoms. Aus ähnlichen Gründen besitzt 29Cu im Grundzustand ein vollbesetztes (d10) d-Niveau anstelle von d9. 24Cr 21Sc bis 30Zn: 3d-Elemente, 1. Reihe der Übergangsmetalle 36 Kr : [Ar] 3d104s24p6 und 38 Sr : [Kr] 5s2 bis 48Cd : [Kr] 4d105s2 - halbbesetztes d-Niveau: 42Mo : [Kr] 4d55s1 - und vollbesetztes d-Niveau: 46Pd : [Kr] 4d105s0 47Ag : [Kr] 4d105s1 4p-Elemente 31Ga : [Ar] 3d104s24p1 bis In der fünften Periode wiederholt sich dasselbe Muster. 5s-Elemente 37Rb : [Kr] 5s1 4d-Elemente, 2. Reihe der Übergangsmetalle 39Y : [Kr] 4d15s2 35 5p-Elemente 49In : [Kr] 4d105s2p1 bis 54Xe : [Kr] 4d105s2p6 und 56Ba : [Xe] 6s2 In der sechsten Periode wird das 4f-Niveau gefüllt. 6s-Elemente 55Cs : [Xe] 6s1 57La : [Xe]5d16s2 Das erste Elektron nach Ba wird in das 5d-Niveau im La eingefüllt und füllt nicht das 4f-Niveau auf. Das Lanthan ist deshalb eher ein Übergangsmetall als ein inneres Übergangsmetall. 4f-Elemente, Lanthanoide, Seltene Erden Ce : [Xe]4f15d16s2 halbbesetztes f-Niveau (f7) bis Lu : [Xe]4f145d16s2 - Gd : [Xe] 4f 7 5d16s2 Da die aufeinander folgenden Elektronen in die tiefer liegenden 4f-Niveaus eingebaut werden, ändern sich die chemischen Eigenschaften noch weniger als bei den Übergangsmetallen ( Innere Übergangsmetalle). 5d-Elemente, 3. Reihe der Übergangsmetalle 6p-Elemente 72Hf : [Xe]4f14 5d26s2 bis 80Hg : [Xe]4f14 5d106s2 81Tl : [Xe]4f14 5d106s2p1 bis 86Rn : [Xe]4f14 5d106s2p6 und 88Ra : [Rn]7s2 bis 103Lr : [Rn]5f146d17s2 Siebente und letzte Periode: : [Rn]7s1 1 2 89Ac : [Rn]6d 7s 7s-Elemente 87Fr 5f-Elemente, Actinoide 90Th : [Rn]6d27s2 Bei den Actinoiden treten vom idealisierten Besetzungsschema (erst f- dann d-Besetzung) mehr Abweichungen auf, als bei den Lanthanoiden. Die ersten Actinoidenelemente zeigen infolgedessen eine größere Vielfalt von chemischen Eigenschaften als die Lanthanoide. Transactinoide : [Rn]5f146d27s2 bis 112Cn : [Rn]5f146d107s2p1 Ununtrium bis 118Uuo 6d–Elemente 104Rf 7p–Elemente 113Uut : [Rn]5f146d107s2 Copernicium : [Rn]5f146d107s2p6 Ununoctium 36 Die Reihenfolge, in der die verschiedenen durch n und l gekennzeichneten Niveaus besetzt werden, lässt sich durch folgendes Schema versinnbildlichen: Bei Inspektion der Elektronenverteilung in der äußeren Schale der Elemente findet man, dass sich die Valenzelektronenkonfiguration periodisch wiederholt. Schreibt man die Elemente mit gleicher Valenzelektronenkonfiguration untereinander, erhält man die Langform des Periodensystems, das aus sieben Perioden besteht und von links nach rechts in 4 Blöcke (s-, f-, d- und p-Block) unterteilt werden kann. Elemente mit gleicher Valenzelektronenkonfiguration (=ähnlichen chemischen Eigenschaften) werden in 18 Gruppen zusammengefasst. 37 Die vier Element-Blöcke: s-Block-Elemente Diese Elemente sind durch die Valenzelektronenkonfigurationen ns1 und ns2 charakterisiert. Sie bilden die 1. und 2. Gruppe der Hauptgruppenelemente mit den Alkali- und den Erdalkalimetallen. f-Block-Elemente Bei diesen Elementen werden die sehr tief liegenden (n-2) f-Niveaus aufgefüllt. Sie existieren nur für (n2)>3, d.h. in den Perioden 6 und 7. Diese Elemente, die eine praktisch identische Konfiguration (n-1) d1 ns2 in den beiden äußeren Schalen aufweisen und damit formal zur dritten Nebengruppe gerechnet werden können, besitzen äußerst ähnliche chemische Eigenschaften (Innere Übergangsmetalle). d-Block Elemente Bei diesen Elementen werden die weniger tief liegenden (n-1) d-Niveaus besetzt. Sie existieren nur für (n-1) >2, d.h. für Periode 4 und höher. Auch als Block der Nebengruppen bezeichnet (Nebengruppenelemente). Die erste Periode der Nebengruppen-Elemente geht von 21Sc(3d14s2) bis 10 2 30Zn(3d 4s ). Jedes dieser zehn Elemente steht am Kopf einer Familie verwandter Elemente (z. B. Chrom-Familie, sechste Nebengruppe). Alle Elemente in den Nebengruppen sind Metalle. Soweit die Atome im Grundzustand unvollständig gefüllte d-Niveaus haben, d.h. von d1 bis d9 werden sie als Übergangsmetalle bezeichnet. p-Block-Elemente Bei diesen Elementen werden die drei np-Niveaus besetzt, wobei die dritte bis achte Hauptgruppe mit den Nichtmetallen und den auf die Übergangsmetalle folgenden Metallen gebildet wird. Die p-BlockElemente zeichnen sich durch eine große Vielfalt verschiedenster chemischer Eigenschaften aus (Nichtmetalle, Halbmetalle, Metalle). Die Kenntnisse über die Elektronenstruktur der Mehrelektronenatome versetzen uns in die Lage, die periodischen Änderungen bestimmter Kenngrößen der Atome, insbesondere ihre Ausdehnung (Radius) und die mit der Entfernung oder der Addition eines Elektrons verbundenen Energien, in Abhängigkeit von der Ordnungszahl zu verstehen. 7.1 Trends im Periodensystem der Elemente (PSE) Die physikalischen und chemischen Eigenschaften der Elemente ändern sich in den einzelnen Perioden und Gruppen mit steigender Ordnungszahl weitgehend gleichsinnig. Daher kann man aus der Stellung eines Elementes im PSE grundsätzliche Eigenschaften ablesen. Von den Eigenschaften, die sich periodisch ändern, seien als wichtigste genannt: Atom- und Ionenradien, Ionisierungsenergien, Elektronenaffinität, Elektronegativitätswert, Metall- und Nichtmetallcharakter. a) Atomradien Neben Anzahl und Art der Valenzelektronen bestimmen vor allem die Radien der Atome die Eigenschaften der Elemente. Elemente bei denen Valenzelektronen und Atomradius übereinstimmen, besitzen nahezu gleiche Eigenschaften. Die Atomradien nehmen innerhalb einer Gruppe des PSE von oben nach unten zu, da jeweils eine neue Elektronenschale hinzukommt. Innerhalb einer Periode der Hauptgruppenelemente nehmen die Atomradien von links nach rechts ab, da die hinzukommenden Elektronen in dieselbe Schale eingebaut werden und die Anziehung zwischen Kern und Hülle zunimmt. 38 Atomradien der Hauptgruppenelemente Period Group 1 2 2 Li 157 Be 112 3 Na 191 13 14 15 16 17 18 Ne B 88 C 77 N 74 O 66 F 64 Mg 160 Al 143 Si 118 P 110 S 104 Cl 99 Ar Ca 197 Ga 153 Ge 122 As 121 Se 117 Br 114 Kr 4 K 235 Rb 250 Sr 215 In 167 Sn 158 Sb 141 Te 137 I 133 Xe 5 Ba 224 Po 167 At Rn 6 Cs 272 Tl 171 Pb 175 Bi 182 Ionic radius pm 251-300 201-250 151-200 101-150 51-100 Innerhalb der Periode kommt von Atom zu Atom je ein Elektron zur gleichen Schale hinzu, bei gleichzeitiger Erhöhung der Kernladung. Elektronen in der gleichen Schale bewirken kaum eine Abschirmung der Kernladung. Die zunehmende Kernladung bewirkt eine Schrumpfung der Elektronenwolke innerhalb der Periode. Periodische Veränderung der Atomradien der Elemente 39 b) Radien der Ionen der Hauptgruppenelemente Ionenradien nehmen in einer Gruppe zu und in der Periode ab. Ionenradien der Ionen der Hauptgruppenelemente Group Period 1 2 13 Li+ Be2+ Be3+ 2 58 27 3 Na+ 102 4 K+ 138 5 6 15 16 17 N3- O2- F- 12 171 140 133 Mg2+ 72 Al3+ Si 53 P3212 S2184 Ca2+ 100 Ga3+ Ge 62 As3222 Sr2+ In3+ Sb 149 116 72 Cs+ 170 Ba2+ 136 Tl3+ 88 Rb+ 14 C Sn Pb Bi 18 Ne Ionic radius ppm Cl181 Ar 201-250 Se2198 Br196 Kr 151-200 Te2- I- Xe 221 220 Po At 101-150 51-100 Rn 1-50 Kationen sind kleiner als die Atome aus denen sie gebildet wurden und Anionen größer. Die relative Größe von Kationen, Anionen und neutralen Atomen 40 c) Erste Ionisierungsenergie (1.IE) und Metallcharakter Aufzuwendende Energie, um einem neutralen, gasförmigen Atom im Grundzustand, das am schwächsten gebundene Elektron zu entreißen: A(g) A+(g) + e- HIE = + kJ/mola) Na+(g) + e- HIE = +496 kJ/mol A = Atom Na(g) a) Da das Atom gegen die Anziehungskraft des Atomkerns entfernt werden muss, ist beim Ionisierungsprozess in jedem Fall Energie zuzuführen. Für alle Metalle ist eine relativ niedrige HIE (< 1000 kJ/mol) charakteristisch. Bei chemischen Reaktionen verlieren sie leicht Elektronen und werden zu positiv geladenen Ionen. Nichtmetalle haben dagegen relative hohe HIE (> 1000 kJ/mol). Mit steigendem Atomradius nimmt die IE ab und der Metallcharakter zu. Der Metallcharakter nimmt also in einer Hauptgruppe zu und in den Perioden der Hauptgruppenelemente ab. Den „größten“ Metallcharakter besitzen die schweren Alkalimetalle. Erste Ionisierungsenergie der Hauptgruppenelemente 18 H 1 2 Period 3 4 5 6 2 Group 13 1301 14 15 He 16 17 2370 Li Be B C N O F Ne 519 900 799 1090 1400 1310 1680 2080 Na Mg Al Si P S Cl Ar 494 736 577 786 1011 1000 1255 1520 K Ca Ga Ge As Se Br Kr 418 590 577 784 947 941 1140 1350 Rb Sr In Sn Sb Te I Xe 402 548 556 707 834 870 1008 1170 Cs Ba Tl Pb Bi Po At Rn 376 502 590 716 703 812 1037 1036 Ionization energy kJ·mol-1 2001-2500 1501-2000 1001-1500 501-1000 1-500 41 d) Elektronenaffinität (EA) Energie, die bei der Aufnahme eines Elektrons durch ein Atom im Gaszustand umgesetzt wird: A(g) + e- HEA = - oder + kJ/mol A-(g) Im Unterschied zur Ionisierung von Atomen, die stets ein endothermer Vorgang ist, kann die Aufnahme von Elektronen je nach Element sowohl exotherm als auch endotherm sein. F(g) + e- Ne(g) + e- F-(g) HEA = -328 kJ/mol Ne-(g) HEA = +29 kJ/mol Die Aufnahme von Elektronen durch kleine Atome mit fast voller Valenzschale (6.HG.: ns2 np4 und 7.HG.: ns2 np5) ist exotherm. In den Perioden ist das Atom mit der größten Tendenz zur Elektronenaufnahme (negativste EA) dasjenige der 7. HG. (F, Cl, Br, und I). Diesen Elementen fehlt gerade ein Elektron, um die Edelgaskonfiguration ns2 np6 zu erreichen. Elektronenaffinitäten der Hauptgruppenelemente H 18 -73 He 1 2 13 14 15 Li Be B C -27 -122 N +7 -60 0 Na Mg Al Si P -53 0 -43 -134 -72 16 O -141 +844 S -200 +532 17 >0 F Ne -328 >0 Electron affinity kJ·mol-1 Cl Ar -349 >0 >400 200-300 K Ca Ga Ge As Se Br Kr -48 -2 -29 -116 -78 -195 -325 >0 Rb Sr In Sn Sb Te I Xe -47 -5 -29 -116 -103 -190 -295 >0 Cs Ba Tl Pb Bi Po At Rn -46 -14 -19 -35 -91 -174 -270 >0 100-200 0-100 <0 f) Elektronegativität Dimensionslose Vergleichszahl, welche die Fähigkeit eines Elementes charakterisiert, Elektronen einer kovalenten Bindung anzuziehen (höchste Elektronegativität Fluor = 4,0, kleinste Elektronegativität Cäsium = 0,79). Die Nichtmetalle der 4. bis 7. HG. (C, N, P, O, S, Se Halogene) besitzen hohe Elektronegativitätswerte ( = 2,2-4,0). 42 Elektronegativitäten der Hauptgruppenelemente H He 2,2 Li Be B C N O F 1,0 1,6 2,0 2,6 3,0 3,4 4,0 Na Mg Al Si P S Cl 0,93 1,3 1,6 1,9 2,2 2,6 3,2 K Ca Ga Ge As Se Br 0,82 1,3 1,6 2,0 2,2 2,6 3,0 Rb Sr In Sn Sb Te I 0,82 0,95 1,8 2,0 2,1 2,1 2,7 Cs Ba Tl Pb Bi Po At 0,79 0,89 2,0 2,3 2,0 2,0 s Ne Ar Kr Electronegativity 4,03,0-3,9 2,0-2,9 Xe 1,0-1,9 Rn 0-0,99 p 8 Sauerstoff (I) und Luft Luft ist ein Gasgemisch, das sich im trocknen Zustand im Wesentlichen aus Stickstoff (Volumenanteil 78,08 %), Sauerstoff (20,95 %), dem Edelgas Argon (0,934 %) und Kohlendioxid (0,035 %) zusammensetzt. Mittlere Zusammensetzung trockener Luft in der Troposphäre Stickstoff Sauerstoff 78,08 20,95 Argon Neon Helium Krypton Xenon 0,934 0,0018 0,0005 0,0001 0,000009 Kohlenstoffdioxid Methan Distickstoffmonoxid Kohlenstoffmonoxid Wasserstoff Ozon 0,035 0,00017 0,00003 0,00002 0,00005 0,000001 wechselnde Anteile H2O (bis zu 4%) 43 Der Siedepunkt von Luft liegt bei -194,5 °C (O2 = -183 °C, N2 = -196 °C). Flüssige Luft reichert sich beim Stehen in offenen Gefäßen mit Sauerstoff an! Dabei nimmt sie immer deutlicher eine blaue Farbe an. Dies kommt daher, dass der farblose Stickstoff schneller absiedet als der bläuliche Sauerstoff. Flüssiger Sauerstoff ist stark verbrennungsfördernd; viele Stoffe verbrennen in fl. O2 explosionsartig. Flüssiger Sauerstoff ist blass blau. (Das Gas ist farblos.) Flüssiger Stickstoff wird für Arbeiten bei sehr tiefer Temperatur und zur Aufbewahrung biologischer Proben verwendet. Beim Abkühlen auf die Temperatur des flüssigen Stickstoffs erfahren die Stoffe Eigenschaftsänderungen. Versuche: Farbe: Taucht man ein mit Schwefel gefülltes Reagenzglas in flüssige Luft, so wird der gelbe Schwefel weiß wie Kreide. Elastizität: Ein in flüssige Luft getauchter Gummiball wird glashart und zerspringt in Splitter, wenn man ihn auf den Boden fallen lässt. Aggregatzustände: Wird eine Rose oder eine Tomate in flüssige Luft getaucht, so gefriert augenblicklich das Wasser in den Zellen; das Gewebe wird dadurch so spröde, dass man es im Mörser zu Pulver zerreiben kann. „Leidenfrostsches Phänomen“: Trotz der tiefen Temperatur kann man flüssige Luft gefahrlos über die Hände gießen, ohne dabei das Gefühl von Kälte zu haben, da sich zwischen der warmen Haut und der kalten Flüssigkeit sofort eine schützende dünne Dampfhaut bildet, welche die Kälte nur schlecht leitet (Vorsicht, Ringe abnehmen, da sonst schlimme Erfrierungen erfolgen!). 44 8.1 Sauerstoff (I) O (Oxygen), Element der 6. HG. (16. Gruppe des PSE), typisches Nichtmetall Sauerstoff ist ein starkes Oxidationsmittel. Es besitzt eine große Elektronegativität ( = 3,5). Vorkommen: a) elementarer als diatomares Molekül O2 (Disauerstoff oder Sauerstoff) in der Atmosphäre als triatomares Molekül O3 ( Ozon) ebenfalls in der Atmosphäre b) gebunden als Oxid Oxosalz Verbindungen in der Biosphäre ionische (O2-): Fe3O4 (Magnetit) Silikate: NaSiO3 (Natriumsilicat) Carbonate: CaCO3 (Calciumcarbonat) Sulfate: BaSO4 (Bariumsulfat) Zucker: C6H12O6 (Glucose) Aminosäuren: kovalente: H2O in den Gesteinen ist tausendmal mehr Sauerstoff gebunden als im Wasser der Weltmeere (Alanin) Erdhülle (Massenanteile): O 48,9 % , Si 26,3 % , Al 7,7 % , Fe 4,7 % , Ca 3,4 % weit verbreitete Alumosilicat-Mineralien (Feldspäte, Zeolithe und Talke) 45 Die häufigsten Elemente auf der Erde Ca 3,4% Fe 4,7% Sonstige 9,0% O 48,9% Al 7,7% Si 26,3% Drei natürlich vorkommende Isotope: 16O (99,762%),17O (0,038%), 18O (0,2%) Löslichkeit in Wasser: Lö slichk eit inVo l.-% In Wasser ist Stickstoff nur etwa halb so gut löslich wie Sauerstoff von gleichem Druck. 1 l Wasser von 0 °C löst 23,2 cm3 Stickstoff bzw. 49,1 cm3 Sauerstoff. Die aus Wasser ausgetriebene Luft ist somit sauerstoffreicher (O2 : N2 = 1 : 2) als die atmosphärische (O2 : N2 = 1 : 4) und enthält, bezogen auf den Stickstoff, zweimal mehr Sauerstoff als die letztere. Dieser größere prozentuale Sauerstoffgehalt ist von Wichtigkeit für die Atmung der Fische im Wasser. Die Wasserlöslichkeit von Sauerstoff nimmt mit steigender Temperatur ab, ein für alle Wasserlebewesen wichtiger Vorgang. Bei 20 °C lösen sich maximal 3,03 Vol.% Sauerstoff im Wasser (8 mg/L). 5 N o rm a le r L uftdruc k 4 Minimalbedarf der meisten Meeresbewohner 3 2 1 0 0 50 W a s s e rte m pe ra tur in ° C 100 46 „Henry-Daltonsches Gesetz“: Die Löslichkeit eines Gases ist bei gegebener Temperatur proportional seinem Druck. Erhöht man also den Druck eines Gases - z.B. von Sauerstoff - aufs Vierfache, so steigt auch seine Löslichkeit - z.B. in Wasser - aufs Vierfache. Chemische Eigenschaften: Sauerstoff bildet mit allen Elementen (außer den Edelgasen He, Ne, Ar und Kr) isolierbare OVerbindungen. Bei Raumtemperatur verhält sich normaler gasförmiger Sauerstoff ( Triplett-Sauerstoff) ausgesprochen reaktionsträge. Bei höheren Temperaturen („nach Zündung“) kommt es zu stark exothermen Oxidationsreaktionen (Verbrennungen). Flüssiger Sauerstoff reagiert schon bei Raumtemperatur explosionsartig mit vielen Stoffen. Versuche: Verbrennen von rotem Phosphor (Prot) in Luft (Nachweis, dass Luft zu ~ 1/5 aus O2 besteht): Verbrennen von Schwefel und Fe-Spänen in O2: Zum Unterschied von Umsetzungen des gasförmigen Sauerstoffs verlaufen viele Oxidationsreaktionen von in Wasser gelösten Sauerstoff mehr oder minder ungehemmt. So oxidiert sich im luftgesättigten, Eisen(II) Eisen(III). 4Fe2+ + O2 + 2H2O fahlgrün 4[Fe(OH)]2+ gelb Gewinnung: a) großtechnisch durch fraktionierende Destillation verflüssigter Luft (Linde-Verfahren): 47 Schema der Luftverflüssigung nach Linde: Komprimierte Luft Expandierte Luft GegenstromWärmeaustauscher Kühler Luft Drosselventil Verdichter Flüssige Luft Angesaugte Luft wird im Verdichter auf ca. 200 bar komprimiert, dann im Kühler vorgekühlt und mittels des Drosselventils wieder entspannt und dabei abgekühlt. Mit dieser abgekühlten Luft wird im Gegenstrom-Wärmeaustauscher die nachkommende verdichtete Luft vorgekühlt. Die Temperatur sinkt immer mehr, bis schließlich bei der Entspannung flüssige Luft entsteht. Bei Druckerniedrigung um 1 bar sinkt die Temperatur um etwa 1/4 °C. Die Abkühlung des Gases beim Linde-Verfahren beruht auf dem Joule-Thomson-Effekt. Wenn sich ein komprimiertes Gas ausdehnt, so kühlt es sich ab. Bei der Ausdehnung muss Arbeit geleistet werden, um die Anziehungskräfte zwischen den Gasteilchen zu überwinden. Die Energie dazu wird der inneren Energie des Gases entnommen, die kinetische Energie und damit die Temperatur nehmen daher ab. Nur bei Gasen, die sich ideal verhalten, sind zwischen den Gasteilchen keine Anziehungskräfte wirksam. Luft verhält sich bei Normalbedingungen ideal, nicht aber im komprimierten Zustand. Joule-Thomson-Effekt: Der bei der Expansion der meisten Gase auftretende Abkühlungseffekt. b) durch Elektrolyse von Kalilauge: c) im Labor durch katalytische Zersetzung von Wasserstoffperoxid mit Braunstein (Mangandioxid): d) im Labor durch thermische Zersetzung von Kaliumchlorat in Gegenwart von Mangandioxid als Katalysator: Die nichtkatalysierte thermische Zersetzung von KClO3 erfolgt erst oberhalb von 400 °C [Smp.(KClO3) = 368 °C]. 48 Katalyse: Bezeichnung für die Beeinflussung der Geschwindigkeit einer chemischen Reaktion durch die Gegenwart eines Stoffes, der die Reaktion scheinbar unverändert übersteht. Der Katalysator tritt in der BruttoReaktionsgleichung nicht auf: (Kat.) A +B AB E A+ B AB E amit Kat. A + B + Kat. E aohne Kat. Kat. Kat. A +B AB AB + Kat. Potentielle Energie (E) entlang der Reaktionskoordinate bei unkatalysierter bzw. katalysierter Reaktion der Teilchen A und B zu AB. Ea = Aktivierungsenergie; Kat. - Katalysator. Eine Reaktion, welche thermodynamisch nicht möglich ist, kann durch einen Katalysator nicht ausgelöst werden, er kann lediglich die Reaktionsgeschwindigkeit oder besser die Geschwindigkeit, mit der sich ein chemisches Gleichgewicht einstellt, beeinflussen. Der Katalysator verändert den Mechanismus der Reaktion durch die Bildung energieärmerer aktivierter Zwischenstufen. Durch die Veränderung der Energie des Systems entlang der Reaktionskoordinate resultiert eine niedrigere over-all Aktivierungsenergie als bei der nicht-katalysierten Reaktion und die Reaktionsgeschwindigkeit der Reaktion wird erhöht. Beispiel: Zerfall von H2O2: Für den Zerfall in wässeriger Lösung beträgt die scheinbare Aktivierungsenergie 75,4 kJ/mol, jedoch in Gegenwart von feinverteiltem Platin nur 49 kJ/mol und in Gegenwart von Katalase nur 23 kJ/mol. 49 Wirkung der Katalyse Verwendung: - - über 60 % in der Roheisen und Stahlerzeugung [in das geschmolzene Roheisen wird zur oxidativen Entfernung von Verunreinigungen O2 (7-10 bar) eingeblasen] Schweißtechnik, z. B. Verbrennen von Acetylen 2C2H2 + 5O2 4CO2 + 2H2O H = -2596 kJ/mol Physiologisches: Sauerstoff ist - abgesehen von einigen Bakterienarten (“Anaerobier”) - für alle Organismen lebensnotwendig. Der Mensch veratmet täglich 900 g O2. O2 wird vom Hämoglobin (dem roten Farbstoff der Erythrocyten) aufgenommen, über die Blutbahn zum Gewebe transportiert, dort von Myoglobin (dem roten Farbstoff im Muskelfleisch) übernommen und zu der mit Energiegewinn verknüpften Oxidation organischen Substrates (z.B. Glucose) verwendet. Atem-Gasgemische mit O2-Partialdrückena) < 0,08 bar führen beim Menschen zur Bewusstlosigkeit und schließlich zur Erstickung. O2-Partialdrücke > 0,6 bar wirken für den Menschen toxisch (Bildung des schädlichen Hyperoxidradikals O2-, das nicht rasch genug abgebaut werden kann). a) In einer Mischung aus idealen Gasen übt jede einzelne Komponente einen Druck aus, der als Partialdruck bezeichnet wird. Der Gesamtdruck des Gasgemisches ist gleich der Summe der Partialdrücke der Komponenten. 50 Z.B. zwei Komponenten A und B: pGesamt = pA + pB pA = nA nA + nB pGesamt nA, nB = Stoffmengen von A und B Evolution der Erdatmosphäre: In geologischen Zeiträumen betrachtet war die Zusammensetzung der Erdatmosphäre niemals stabil und wird es auch in der vorhersehbaren Zukunft nicht sein. Das liegt vor allem daran, dass biologische Prozesse seit 4 Milliarden Jahren die Zusammensetzung der Atmosphäre weitgehend verändert haben. Umgekehrt wurde auch die Evolution der Lebensformen durch die sich ändernde Zusammensetzung der Atmosphäre beeinflusst. Atmosphäre mit Wolken Die Uratmosphäre vor 4,4 Milliarden Jahren enthielt große Mengen H2O-Dampf, N2, CH4, NH3 und SO2, Salzsäure kam ebenfalls vor, O2 jedoch fehlte. Atmosphärischer Sauerstoff lag - wenn überhaupt - nur in äußerst geringen Konzentrationen vor. Das geht aus dem Oxidationszustand des Eisens (vorwiegend Fe2+) in Sedimentgesteinen mit einem Alter von 3,7 Milliarden Jahren hervor; Minerale wie Pyrit (FeS2) wären von gasförmigem Sauerstoff oxidiert worden. Nachdem sich vor etwa vier Milliarden Jahren die glutflüssige Erde genügend abgekühlt hatte, konnte der H2O-Dampf der Atmosphäre kondensieren und Ozeane bilden. Durch die Entstehung der Meere konnte sich das in der Uratmosphäre in hohen Konzentrationen vorhandene CO2 zu einem beträchtlichen Teil in den Ozeanen lösen. Das Meerwasser enthielt Metallionen - neben Na+-Ionen insbesondere Ca2+- und Fe2+-Ionen -, die bei der Verwitterung (ohne Sauerstoffeinfluss) aus Gesteinen herausgelöst worden waren. Das gelöste CO2 konnte mit den darin gelösten Ionen, insbesondere den Ca2+-Ionen, reagieren und Carbonate bilden, die dann auf dem Meeresboden große Kalksteinlager bildeten. 51 Vor etwa 4 Milliarden Jahren entstanden im wässerigen (aquatischen) Milieu die ersten einzelligen Lebewesen ohne Zellkern, die zunächst die allgegenwärtigen Kohlenstoff-, Schwefel- und Stickstoffverbindungen sowie Metallionen (Fe2+-Ionen) für ihren Energiehaushalt nutzten. Sie hatten einen anaeroben (sauerstoffunabhängigen) Stoffwechsel. Schon kleine Mengen freien Sauerstoffs waren Gift für sie, da sie noch keine Enzyme entwickelt hatten, die die schädlichen Oxidationsprodukte des Stoffwechsels in unschädliche umwandeln konnten. Vor drei bis vier Milliarden Jahren traten Blaualgen (Cyanobakterien) mit einer anderen Form des Stoffwechsels auf. Sie konnten das Licht durch die sogenannte Photosynthese zur Bildung organischer Verbindungen nutzen. Ihnen gelang es, das reichlich vorhandene Kohlenstoffdioxid als Nährstoff zu erschließen und mit Hilfe von Lichtenergie in z. B. Kohlenhydrate umzuwandeln, wobei Sauerstoff als Nebenprodukt freigesetzt wird. Der bei der Photosynthese in das Meer entlassene Sauerstoff oxidierte zunächst Eisen(II)-Salze zu schwerlöslichem Eisen(III)-oxid, das sich als eisenreicher Schlamm absetzte. Nur ein geringer Anteil des Sauerstoffs gelangte in die Atmosphäre. Vor ca. 1-2 Milliarden Jahren war der Fe2+-Ionen-Vorrat der Meere weitgehend verbraucht. Freier Sauerstoff begann sich im Meerwasser und in der Atmosphäre anzureichern, da sauerstoffbindende Prozesse im Wasser nur noch in untergeordnetem Maße stattfanden. 52 Aus dem - chemisch gesehenen - reduzierenden Milieu entstand allmählich eine sauerstoffhaltige, oxidierende Umwelt. Gleichzeitig bildete sich durch Photolyse des Sauerstoffs in der Atmosphäre eine Ozonschicht aus (s. S. 54), die die Erdoberfläche vor energiereicher UVStrahlung schützte und damit eine Entwicklung von Lebensformen an Land ermöglichte. Wechsel von einer vorwiegend reduzierenden zu einer vorwiegend oxidierenden Atmosphäre Vor annähernd 0,5-1 Milliarde Jahren entstanden pflanzliche Organismen, die einen Verdunstungsschutz hatten und dadurch breite das Raum-, Licht- und Nährstoffangebot der Uferzonen und des Landes nutzen konnten. Infolge erhöhter Photosyntheseraten kam es zu einem weiteren Anstieg des atmosphärischen Sauerstoffgehaltes. Heute beträgt die Gesamtmenge an freiem Sauerstoff etwa 1,3 · 1015 t. Der überwiegende Teil des insgesamt biologisch produzierten Sauerstoffs (ca. 6 · 1015 t) liegt in der Erdkruste in gebundener Form vor, hauptsächlich in Metalloxiden, Sulfaten, Silikaten und Carbonaten. Durch Wechselwirkungen zwischen Atmosphäre, Lithosphäre und Biosphäre bleibt der atmosphärische Sauerstoffgehalt heute weitgehend konstant. 53 Ozon (O3) -zweite allotrope Modifikation des Sauerstoffs; energie- und sauerstoffreicher als O2 und damit wesentlich reaktiver, „Träger des atomaren Sauerstoffs“ -ozein (gr.) = riechen, starkes Gift für alle Lebewesen -Sdp.: -119,9 °C, dunkelblaue Flüssigkeit Die Erscheinung, dass Elemente in verschiedenen Molekülgrößen existieren bezeichnet man als Allotropie Ozon ist ein blaues Gas, das zu einer tiefblauen explosiven Flüssigkeit kondensiert -gewinkeltes Molekül: O O 128 pm O O-O-Bindungsabstand entspricht einem Bindungsgrad von 1,5 117° Mindestens zwei Lewis-Formeln (mesomere Grenzstrukturen) müssen zur Resonanz gebracht werden, um den Bindungszustand im O3-Molekül richtig wiederzugeben: O O O O O = Formalladungen O 54 Darstellung: Ozon wird ganz allgemein durch Einwirkung von O-Atomen auf O2-Moleküle dargestellt: O + O2 O3 H = -106 kJ/mol Die verschiedenen Bildungsweisen unterscheiden sich dabei in der Art und Weise der Erzeugung von O-Atomen. Am gebräuchlichsten ist die Bildung von O-Atomen aus molekularem Sauerstoff O2: 1 2 O2 O H = 249 kJ/mol (1) O + O2 O3 H = -106 kJ/mol (2) O3 H = 143 kJ/mol (3) 1 1 2 O2 Ganz allgemein wird die Reaktionsenthalpie für die Bildung einer Verbindung aus den Elementen in deren stabilster Form als Bildungsenthalpie (HB) bezeichnet. Da bei der Bildung von Ozon aus Sauerstoff eine Enthalpie von 143 kJ/mol verbraucht wird (= endotherme Reaktion), wird Ozon als „endotherme Verbindung“ bezeichnet. „Endotherme Verbindungen“ sind thermodynamisch instabil, ihr Zerfall ist unter bestimmten Bedingungen (z. B. tiefe Temperaturen, kleine Konzentrationen) gehemmt (kinetisch gehemmt); sie werden als metastabile Verbindungen bezeichnet. Metastabile Verbindungen sind im Allgemeinen reaktiver als thermodynamisch stabile Verbindungen. Die für die O3-Bildung benötigten O-Atome erhält man am besten bei niederen Temperaturen durch Zufuhr von elektrischer, optischer (s.u. energiereiche Sonnenstrahlung in der Stratosphäre) oder chemischer Energie. Im „Siemensschen Ozonisator“ erfolgt die Zufuhr von elektrischer Energie in einem Hochspannungsfeld. Versuche: Luft wird durch einen „Siemensschen Ozonisator“ geleitet und das den Ozonisator verlassende Gasgemisch auf O3-Reaktivität geprüft: a) Beim Einleiten in eine neutrale Kaliumiodid-Lösung wird - unter gleichzeitigem Auftreten einer (bei anderen Oxidationsmitteln wie Cl2 nicht eintretenden) alkalischen Reaktion - Iod gebildet: -I 0 2I- + O3 + H2O 0 -II 0 I2 + 2OH- + O2 Die Lösung wird gelb (Bildung des braunen Triiodidions I3-) und bei Gegenwart von Phenolphthalein (pH-Indikator) rot. Die charakteristische Eigenschaft des Ozons ist sein starkes Oxidationsvermögen: O3 O2 + O. Ozon ist eines der stärksten bekannten Oxidationsmittel. Es wirkt dabei meistens nur mit einem der drei O-Atome oxidierend und ist damit gewissermaßen ein Träger atomaren Sauerstoffs. O2 + 3H2O O3 + 2H3O+ + 2e- E° = 2,07V 55 Es bildet mit einigen Metallen Ozonide, oxidiert fast alle Metalle zu ihrer höchsten Oxidationsstufe, Sulfide zu Sulfaten, Ammoniak zu Salpetersäure, Kohle schon bei gewöhnlicher Temperatur zu Kohlenstoffdioxid. b) Auch organische Stoffe werden von Ozon kräftig oxidiert (gebleicht). Man darf daher z.B. Ozon nicht durch Gummischläuche leiten, da diese in wenigen Augenblicken zerfressen werden (Schlifffette entflammen). Versuch: Gummi eines aufgeblasenen Luftballons wird zerstört. Mit ungesättigten organischen Verbindungen reagiert O3 unter Ozonolyse. Diese Ozonisierungsreaktion macht Ozon zu einem präparativ und analytisch (zum Nachweis von Doppelbindungen) sehr nützlichen Reagenz im chemischen Laboratorium. Verwendung: Ozon wird technisch z.B. zur Luftverbesserung und -desinfektion, zur Sterilisation von Lebensmitteln (O3-Bildung durch Bestrahlung) und zur Entkeimung von Trinkwasser und Schwimmbadwasser verwendet. Ozon in der Atmosphäre - 90 % in der Stratosphäre als „Ozonschicht“ - in der Troposphäre als Spurengas (Treibhauseffekt, siehe Abschnitt Kohlenstoffdioxid) - erdbodennahe Luftschicht (oxidiert Luftverunreinigungen, zu hohe Ozonkonzentrationen – gesundheitsbeeinträchtigende Wirkungen möglich) 1)In der Stratosphäre 56 Als Folge der O2-Produktion auf der Erde entstand auch die Ozonschicht in der Stratosphäre, die die Erdoberfläche vor energiereicher UV-Strahlung schützte und damit eine Entwicklung von Lebensformen an Land ermöglichte. („Die Ozonschicht ist die beste Strategie des Lebens“). In der Stratosphäre (12-50 km Höhe) existiert neben den Luftbestandteilen Stickstoff N2 und Sauerstoff O2 auch Ozon O3. Die sogenannte Ozonschicht hat ein Konzentrationsmaximum in ca. 25 km Höhe. Die Gesamtmenge des atmosphärischen Ozons ist klein. Würde es bei Standardbedingungen die Erdoberfläche bedecken, dann wäre die Ozonschicht nur etwa 3,5 mm dick. In der Stratosphäre kommt es zur Bildung und zum Zerfall von Ozon, was insgesamt zu einer Gleichgewichtskonzentration an Ozon führt. Schichtung der Atmosphäre mit Temperaturprofil Exosphäre Thermosphäre Stratosphäre Troposphäre a) Bildung Durch energiereiche Sonnenstrahlung (kurzwellige UV-Strahlung, < 242 nm = 499 kJ/mol, vgl. S. 26) wird molekularer Sauerstoff photochemisch in O-Atome gespalten. Die O-Atome reagieren mit O2-Molekülen zu Ozon unter Wärmeabgabe: O2 O + O2 3O2 Photonenaufnahme h v (< 242 nm) Wärmeabgabe Stoßpartner Ozonbildung Wärmeabgabe 2O O3 2O3 b) Zerfall Das gebildete Ozon absorbiert seinerseits längerwellige UV-Strahlung der Sonne ( <310 nm) unter Zerfall des Ozons in Sauerstoffatome, die ihrerseits unter Wärmeabgabe mit Ozon reagieren: 57 O3 O + O3 2O3 Photonenaufnahme h v (< 310 nm) Wärmeabgabe Stoßpartner Ozonzerfall Wärmeabgabe O2 + O 2O2 3O2 Auf dem Wege der Bildung und des Zerfalls von Ozon im Zuge einer Wechselwirkung des Sonnenlichtes mit Luftsauerstoff wird energiereiche Sonnenstrahlung in Wärme umgewandelt. Dem Umsatzmaximum entspricht ein Temperaturmaximum der Atmosphäre von 20-30 °C in ca. 50 km Höhe (vergl. Abb. S. 56). Durch die Bildung und den Zerfall des Ozons sowie durch einige weitere atmosphärische Prozesse wird die harte (kurzwellige) Ultraviolettstrahlung im Wellenlängenbereich < 175 nm bis zur Mesopause ( 90 km Höhe) sowie die Strahlung im Bereich 175 - 290 nm bis zur Tropopause ( 10 km Höhe) vollständig und die Strahlung im Bereich 290 - 340 nm bis zur Erdoberfläche teilweise absorbiert (s. Abb. unten), während der überwiegende Anteil der weichen UV-Strahlung (340 - 400 nm) und des gesamten sichtbaren Lichts (400 - 800 nm) ungehindert durch die Erdatmosphäre wandern kann. Eindringtiefe schädlicher Strahlung bei Absorption durch Gase in der Atmosphäre Die Infrarotstrahlung (Wärmestrahlung, Bereich > 800 nm) wird andererseits größtenteils durch den Wasserdampf, das Kohlenstoffdioxid und einigen anderen natürlichen anthropogenen Quellgasen absorbiert (vgl. hierzu Kohlenstoff - Kohlenstoffdioxid - Treibhauseffekt). Die gemessene Ozonkonzentration in der Stratosphäre ist etwa eine Größenordnung kleiner als die nach obigem Mechanismus berechnete. Ursache dafür sind natürlich entstandene Spurengase wie CH4, H2O, N2O (Distickstoffoxid) und CH3Cl (Chloroform), die zum Ozonabbau beitragen. Z.B. N2O: Durch UV-Strahlung ( < 320 nm) wird N2O gespalten, die entstandenen O-Atome reagieren mit N2O zu NO-Radikalen (Stickstoffmonoxid). 58 N2O h .v N2O + O N2 + O 2NO Die NO-Radikale zerstören in einem katalytischen Reaktionszyklus Ozonmoleküle. Reaktionsbilanz: NO + O3 NO2 + O2 NO2 + O NO + O2 O + O3 Reaktionskette 2O2 Nicht nur natürlich entstandenes N2O, sondern auch N2O anthropogenen Ursprungs (durch Menschen verursacht, Hauptquelle Stickstoffdüngung) gelangt in die Atmosphäre. Anthropogene Spurengase, vor allem Fluorchlorkohlenwasserstoffe (FCKW), verursachen auch den Abbau der Ozonschicht („Ozonloch“ im Oktober über dem antarktischen Kontinent). Die FCKW sind chemisch inert (kinetisch stabil), sie wandern daher unverändert durch die Troposphäre und erreichen in ca. 10 Jahren die Stratosphäre. Sie werden dort in Höhen ab 20 km durch UV-Strahlung ( < 220 nm) unter Bildung von Cl-Atomen gespalten. CF3Cl h · CF3 + Cl Jedes Cl-Atom kann katalytisch im Mittel 104 O3-Atome zerstören. Reaktionsbilanz: Cl + O3 ClO + O ClO + O2 Cl + O2 O3 + O 2O2 Reaktionskette 59 Aufstieg in die Stratosphäre, Reaktion und Auswaschung von FCKW kurzwelliges UV-Licht 30 Cl + ClO x Ozon-Abbau 20 Photolyse der FCKW Höhe [km] HCl 10 0 Stratosphäre Troposphäre + CH4 + H2O Diffusionsengpass Ausregnen von HCl Emission der FCKW (Insgesamt ist der Ozonabbau durch FCKW, besonders über der Antarktis, viel komplizierter). Stickstoffoxide (NOx) werden durch den Luftverkehr (Überschallflugzeuge) direkt in die Stratosphäre emittiert und führen ebenfalls zum Abbau des Ozons (Mechanismus s. Abbau von Ozon durch N2O NO als reaktives Radikal). Die alarmierenden Nachrichten über die Vergrößerung des Ozonlochs führten bis 1999 zu einer Verringerung der FCKW-Produktion um 50 %. 2) In der erdbodennahen Luftschicht In der erdbodennahen Luftschicht entstehen Stickstoffoxide durch biologische Prozesse im Boden, aus Vulkanen und durch Blitze. Nadelwälder und natürliche Gärprozesse setzen Kohlenwasserstoffe frei. Aus diesen natürlich entstandenen Vorläuferstufen bildet sich Ozon. In Europa ist die natürliche Ozonkonzentration – je nach Region – mit etwa 20 bis 60 µg/m3 Luft anzusetzen. Drei Voraussetzungen werden üblicherweise für hohe Ozonkonzentrationen genannt: a) die Gegenwart von Stickstoffoxiden (z. B. Verbrennungsmotoren) b) starke Sonneneinstrahlung bei sommerlicher Hitze c) die Gegenwart von Kohlenwasserstoffen (z. B. Verbrennungsmotoren) Das aus Motoren zunächst entweichende farblose Stickstoffmonoxid NO wird während seines Transportes durch die Luft zu braunem Stickstoffdioxid, NO2, oxidiert, das in einer Folgereaktion unmittelbar an der Ozonbildung beteiligt ist. 1 NO + 2 O2 NO2 Sommerlicht aus dem UV-Bereich (320 nm < < 420 nm) führt zur Photolyse der NO2-Moleküle: 60 NO2 h.v O + NO (1) Das dabei entstehende Sauerstoffatom kann dann äußerst rasch mit einem Sauerstoffmolekül zu einem Ozonmolekül O3 kombinieren: O + O2 O3 (2) Das in der Reaktion (1) gleichzeitig entstandene NO wirkt allerdings ozonabbauend, NO + O3 NO2 + O2 (3) so dass sich ein photostationärer Zustand mit relativ geringem Ozongehalt einstellt. Eine echte Nettoproduktion von Ozon erfolgt erst dann, wenn das ozonabbauende NO auf einem anderen Weg als nach (3) zu ozonbildendem NO2 oxidiert wird. Diesen Part übernehmen die Kohlenwasserstoffe. Sie reagieren zunächst mit den in der Luft in ausreichender Zahl vorhandenen Hydroxyl-Radikalen (über 500 000 pro cm3) zu Peroxoradikalen ROO, die dann NO in NO2 umwandeln: RH + HO . + O2 ROO . + H2O NO + ROO . RO . + NO2 So entsteht ein Kreislauf, der bei jedem Umlauf zusätzliches Ozon produziert. Die Bildung hoher Ozonkonzentrationen in Bodennähe spielt vor allem während der Sommermonate an der windabgewandten Seite von Ballungszentren in den späten Nachmittags- und Abendstunden eine wichtige Rolle. Ab einer Ozonkonzentratrationen von 180 µg/m3 wir die Bevölkerung unterrichtet. Die Einführung von Abgaskatalysatoren (siehe Abschnitt Stickstoffmonoxid) hat die Ozonkonzentration in Ballungszentren deutlich verringert. In Berlin wurden im Jahr 1989 an 25 Tagen Ozonkonzentrationen über 180 µg/m3 Luft gemessen, 1999 nur noch an 3 Tagen. 9 Der Aufbau der Atome (Das Orbitalmodell) 1. Unbestimmtheitsbeziehung (Heisenberg, 1927) Sie besagt, das es unmöglich ist, den Impuls und den Aufenthaltsort eines Elektrons gleichzeitig zu bestimmen. Das Produkt aus der Unbestimmtheit des Ortes x und der Unbestimmtheit des Impulses x (m · v) wird stets gleich oder größer als das durch 4 dividierte Plancksche Wirkungsquantum. . . x (m v) > h 4 Bei genau bekannter Geschwindigkeit ist der Aufenthaltsort des Elektrons im Atom vollkommen unbestimmt. 61 Bei makroskopischen Körpern ist die Masse so groß, dass Geschwindigkeit und Ort scharfe Werte haben (Grenzfall der klassischen Mechanik). Im Bohrschen Atommodell stellt man sich das Elektron als Teilchen vor, das sich auf seiner Bahn von Punkt zu Punkt mit einer bestimmten Geschwindigkeit bewegt. Nach der Unbestimmtheitsrelation ist dieses Bild falsch. Zu einem bestimmten Zeitpunkt kann dem Elektron kein bestimmter Ort zugeordnet werden, es ist im gesamten Raum des Atoms anzutreffen. Daher müssen wir uns vorstellen, dass das Elektron an einem bestimmten Ort des Atoms nur mit einer gewissen Wahrscheinlichkeit anzutreffen ist. Dieser Beschreibung des Elektrons entspricht die Vorstellung einer über das Atom verteilten Elektronenwolke. Die Gestalt der Elektronenwolke gibt den Raum an, in dem sich das Elektron mit größter Wahrscheinlichkeit aufhält. Die Elektronenwolke des Elektrons des H-Atoms im Grundzustand besitzt Kugelsymmetrie. Die Ladungswolke hat nach außen keine scharfe Begrenzung. Üblicherweise wählt man eine Grenzfläche, die eine Kugel umschließt, in der zu 90 % das Elektron anzutreffen ist. 62 Verschiedene Darstellungen des Elektrons im H-Atom im Grundzustand (1s) Elektron electron cloud Bohrsches H-Atom mit einer Elektronenbahn Probability Dreidimensionale Elektronenwolke Innerhalb der Kugel hält sich das Elektron zu 90% auf 2) Wellencharakter von Elektronen Die Versuche mit Kathodenstrahlen (S. 11) zeigten, dass Elektronen sich wie Teilchen verhalten (besitzen Teilchencharakter). 1927 zeigten Davisson und Germer, dass eine Aluminiumfolie einen Elektronenstrahl auf genau dieselbe Weise beugt wie sie einen Röntgenstrahl (energiereiche elektromagnetische Strahlung) beugt und das die Wellenlänge eines Elektronenstrahls durch die de Broglie-Beziehung richtig wiedergegeben wird. 63 Wellencharakter von Elektronen b a Die Beugung der Wellen durch eine AI-Folie a) Röntgenstrahlen = 71 pm = 50 pm b) Elektronen der Energie von 600 eV Die Ähnlichkeit dieser beiden Beugungsbilder ist Welleneigenschaften (Wellencharakter) von Elektronen. ein überzeugender Beweis für die Die de Broglie-Beziehung (1924) Nach de Broglie kann nicht nur ein mit Lichtgeschwindigkeit c fliegendes Photon, sondern auch jedem anderen fliegendem Teilchen eine Wellenlänge zugeordnet werden: = h m·v m = Masse, v = Geschwindigkeit des Teilchen, m · v = Impuls. Jedes bewegte Objekt kann als Welle aufgefasst werden. Bei gewöhnlichen Objekten sind die zugehörigen Wellenlängen so extrem klein, dass die Welleneigenschaften nicht nachweisbar sind. Bei Teilchen mit sehr kleinen Massen, wie z.B. Elektronen oder Neutronen ist dies jedoch anders, ihre Wellenlängen können experimentell bestimmt werden. Elektronen sind keine Wellen, und sie sind auch keine Teilchen. Je nach den experimentellen Bedingungen können Elektronen sowohl Welleneigenschaften zeigen als sich auch wie kleine Partikel verhalten. Welleneigenschaften und Partikeleigenschaften sind komplementäre Beschreibungen des Elektronenverhaltens. Nach de Broglie muss es im Atom Elektronenwellen geben. Das Elektron befindet sich aber nur dann in einem stabilen Zustand, wenn die Elektronenwelle zeitlich unveränderlich ist. Eine zeitlich unveränderliche Welle ist eine stehende Welle. Eine nicht stehende Elektronenwelle würde sich durch Interferenz zerstören, sie ist instabil. Elektronenwolken sind dreidimensionale schwingende Schwingungszustände dreidimensional stehende Wellen sind. Systeme, deren mögliche 64 Die Welleneigenschaften des Elektrons können mit einer von Schrödinger aufgestellten Wellengleichung beschrieben werden. Durch Lösen der Schrödinger-Gleichung erhält man für das Elektron im Wasserstoffatom eine begrenzte Zahl erlaubter Schwindungszustände, die dazu gehörenden räumlichen Ladungsverteilungen und Energien . Diese erlaubten Zustände sind durch drei Quantenzahlen festgelegt. Diese Quantenzahlen ergeben sich bei der Lösung der Schrödinger-Gleichung und müssen nicht wie beim Bohrschen Atommodell willkürlich postuliert werden. Eine vierte Quantenzahl ist erforderlich, um die spezifischen Eigenschaften eines Elektrons zu berücksichtigen, die beobachtet werden, wenn es sich im Magnetfeld befindet. Die durch die drei Quantenzahlen n, l und ml charakterisierten Quantenzustände werden als Atomorbitale (AO) bezeichnet. N, l und ml werden daher Orbitalquantenzahlen genannt. Die AO unterscheiden sich hinsichtlich der Größe, Gestalt und räumlichen Orientierung der Ladungswolken. Diese Eigenschaften werden durch die Quantenzahlen bestimmt. Bedeutung der Quantenzahlen im Orbitalmodell: Hauptquantenzahl n = 1, 2, 3 ....-charakterisiert das Hauptenergieniveau auf dem sich das Orbital befindet Reihe zunehmender Energie: 1s < 2s < 3s < 4s ... Nebenquantenzahl l = 0, 1, 2 ....n-1 -charakterisiert das energetische Unterniveau, bestimmt die Form des Orbitals Orbitalgestaltsquantenzahl l=0 s - Orbital kugelförmig l=1 p - Orbital hantelförmig l=2 d - Orbital rosettenförmig l=3 f - Orbital keine allein gültige Form der Darstellung Reihe zunehmender Energie: 4s < 4p < 4d < 4 f Magnetische Quantenzahl ml = -l....0....+l - bestimmt die Ausrichtung der Orbitale im Koordinatensystem, gekennzeichnet durch die Indizes x, y und z (p-Orbitale) bzw. xy, xz, yz, z2 und x2-y2 (d-Orbitale) - Orbitalrichtungsquantenzahl Spinquantanzahl s = + 1 , - 1 2 2 - definiert den Spin eines Elektrons (seinen Eigendrehimpuls), ein Orbital kann mit maximal zwei Elektronen besetzt werden 65 Gestalt, räumliche Orientierung und Vorzeichen der Orbitallappen der s,p- und d-Orbitale z z y y x y x py px z z y x pz dxy z z y y y x x dxz z y x dyz y x s z z y x x dx2-y2 dz2 s-Orbitale sind kugelsymmetrisch. Sie haben keine räumliche Vorzugsrichtung. drei p-Orbitale: Jedes Orbital ist hinsichtlich einer Drehung um eine der Hauptachsen des Koordinatensystems x, y oder z zylindrisch symmetrisch = px, py und pz. Jedes p-Orbital besitzt zwei Lappen, die von einer Knotenebene der Elektronendichte null getrennt werden. Das Vorzeichen der Wellenfunktion ist in einem Lappen positiv, während es im anderen Lappen negativ ist. fünf d-Orbitale: - drei: dxy, dyz, dxz besitzen dieselbe Gestalt, unterscheiden sich nur durch die Orientierung, jedes Orbital besitzt vier Elektronendichtelappen, die die Winkel zwischen den kartesischen Achsen in der durch die Indices gekennzeichneten Ebene halbieren - dx2 - y2 -Orbital, ebenfalls vier Elektronendichtelappen, die sich entlang der x-Achse und der y-Achse erstrecken - dz2 - Orbital zwei Lappen entlang der z-Achse, dazu noch ein kleiner Ring in der xy-Ebene s-Orbitale (1s, 2s ...), p-Orbitale (2p, 3p...) und d-Orbitale (3d, 4d....) werden mit zunehmender Hauptquantenzahl größer (die Orbitale werden „ausladender und diffuser“).

![107 Gasmodell [tra]](http://s1.studylibde.com/store/data/002039772_1-a1f33a6084247b8640496fab9e8a74ec-300x300.png)