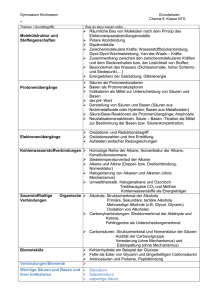
Chemie Zusammenfassung 4 - FSMB
Werbung
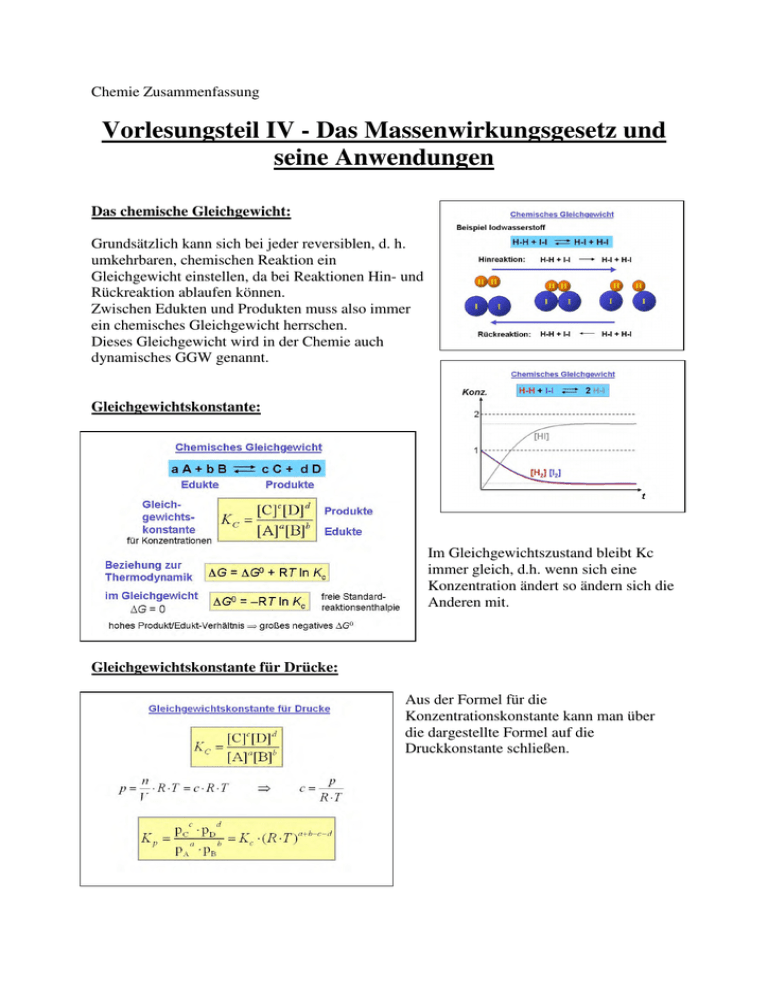
Chemie Zusammenfassung Vorlesungsteil IV - Das Massenwirkungsgesetz und seine Anwendungen Das chemische Gleichgewicht: Grundsätzlich kann sich bei jeder reversiblen, d. h. umkehrbaren, chemischen Reaktion ein Gleichgewicht einstellen, da bei Reaktionen Hin- und Rückreaktion ablaufen können. Zwischen Edukten und Produkten muss also immer ein chemisches Gleichgewicht herrschen. Dieses Gleichgewicht wird in der Chemie auch dynamisches GGW genannt. Gleichgewichtskonstante: Im Gleichgewichtszustand bleibt Kc immer gleich, d.h. wenn sich eine Konzentration ändert so ändern sich die Anderen mit. Gleichgewichtskonstante für Drücke: Aus der Formel für die Konzentrationskonstante kann man über die dargestellte Formel auf die Druckkonstante schließen. Thermodynamik Prinzip des kleinsten Zwangs: Beispiele: Ostwaldsche Verdünnungsgesetz Das Ostwaldsche Verdünnungsgesetz beschreibt den Dissoziationsgrad, von schwachen Elektrolyten also den Anteil der freien Teilchen in einer Lösung mit Hilfe des Massenwirkungsgesetzes. Gemäß dieser Beziehung nimmt der Dissoziationsgrad α mit abnehmender Konzentration (steigender Verdünnung) zu. Dissoziation: Zerlegung einer chemischen Verbindung in 2 oder mehrere Atome, Moleküle oder Ionen Dissoziationsgrad α : (Welcher Anteil des ursprünglichen AB ist dissoziiert) α = [A]/c0 = [B]/c0 wobei c0 die Konzentration des Stoffes AB entspricht, wenn α = 1 ist, also keine Dissoziation stattfindet (leicht bestimmbar, z.B. über die Einwage von AB) - [A] = α * c0 (Gl. II) - [AB] = (1-α) * c0 (Gl. III) einsetzen von Gl. II und Gl. III in Gl. I ergibt Kc = (α²/(1−α)) * c0 Haber-Bosch-Verfahren: Das Haber-Bosch-Verfahren dient zur synthetischen Herstellung von Ammoniak aus den Elementen Stickstoff und Wasserstoff. Katalysator: Stoff, der die Reaktionsgeschwindigkeit einer chemischen Reaktion beeinflusst, ohne dabei selbst verbraucht zu werden. Dies geschieht durch Herabsetzung der Aktivierungsenergie. Hydratisierung: Unter Hydratisierung versteht man eine chemische Reaktion, bei welcher Wasser an ein Substrat addiert wird. Der Begriff ist nicht zu verwechseln mit der Hydratation, welche die Anlagerung von Wasser an Ionen oder im Kristallgitter (Kristallwasser) beschreibt, und der Hydrierung, welche die Addition von Wasserstoff an ein Substrat bedeutet. Fällungsreaktion: Fällungsreaktionen nennt man chemische Reaktionen, bei denen die Edukte im Lösungsmittel gelöst vorliegen und mindestens ein Produkt in diesem Lösungsmittel un- oder schwerlöslich ist. Das Produkt mit schlechter Löslichkeit fällt aus, die Ausfällung wird allgemein Niederschlag genannt. In Reaktionsgleichungen wird das Ausfallen eines Stoffes mit einem ↓ oder einem (s) für solid hinter der Summenformel des Stoffs gekennzeichnet. Säure/Basen: Brönsted: Definition Säure/Base nach Brönsted: Säuren sind Stoffe die Protonen abspalten können, Basen sind Stoffe, die Protonen aufnehmen können. Säure-/Basekonstate KS und KB: Um von der normalen GGWkonstante auf die Ks oder Kb Konstante zu kommen muss man einfach die Konzentration von Wasser im Nenner weglassen. Die Konstanten besagen in welchem Maße ein Stoff mit Wasser unter Protolyse reagiert. Protolyse: Proton wird zwischen zwei Reaktionspartnern übertragen. Je kleiner der pKs/pKb-Wert ist, desto stärker ist die Säure/Base. Je stärker die Säure/Base, desto mehr ist die Reaktion auf die rechte/linke Seite verschoben. Mehrbasige Säuren und Basen: Bei mehrbasigen Säuren und Basen können die Säure-/Basenkonstanten multipliziert bzw. die pKs/pKb Werte addiert werden um die Gesamtkonstante bzw den gesamt pKs/pKb Wert zu erlangen. Autoprotolyse des Wassers: Reines Wasser unterliegt einer sogenannten Autoprotolyse. Hierbei entstehen Oxoniumionen H3O+ und Hydroxidionen (OH−). H2O kann sowohl als Protonendonator (als Säure) oder als Protonenakzeptor (als Base) reagieren. Man spricht daher auch hier von einem Ampholyten. Die Summe von pKs und pKb Wert im wässrigen Medium ergibt immer 14. Beispiele für Säuren: pH-Wert Berechnung: Der pH-Wert ist ein Maß für die Stärke der sauren bzw. basischen Wirkung einer wässrigen Lösung. Puffersysteme: Definition: Puffersysteme sind Lösungen, die eine schwache Säure (Base) und ihre korrespondierende Base (Säure) enthalten. Aufgabe: Puffersysteme halten den pH Wert von Lösungen auch bei Zugabe von Säuren und Basen annähernd konstant. Lux/Flood-Säuren und –Basen: Lewis - Säuren/Basen: Bei einer SäureBase-Reaktion nach diesem Konzept werden daher immer kovalente Bindungen gebildet. HSAB-Konzept (Principle of Hard and Soft Acids and Bases): Nach dem HSAB-Konzept kann man Säuren/Basen in harte und weiche Säuren/Basen einteilen. Innerhalb dieses Konzepts wird zwischen harten und weichen Säuren/Basen unterschieden. • • „Hart“ beschreibt dabei Teilchen (Atome, Ionen und Moleküle), die eine hohe Ladungsdichte aufweisen, also eine hohe Ladung und einen kleinen Radius (großes „Ladungs/Radien-Verhältnis“). „Weich“ bezeichnet dagegen Teilchen mit geringer Ladungsdichte, also solche mit geringer Ladung und großem Radius (kleines „Ladungs/Radien-Verhältnis“). Hart Weich Kleine Ionenradien Große Ionenradien Hohe Ladungen Geringe Ladungen Geringe Polarisierbarkeit Große Polarisierbarkeit REDOX-Chemie: Eine Redoxreaktion ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. Bei einer solchen Elektronenübertragungs-Reaktion finden also eine Elektronenabgabe (Oxidation) durch einen Stoff sowie eine Elektronenaufnahme statt (Reduktion). Redoxreaktionen sind von grundlegender Bedeutung in der Chemie: Jeder Stoffwechsel- und Verbrennungsvorgang, viele technische Produktionsprozesse und viele Nachweisreaktionen basieren auf solchen ElektronenübertragungsReaktionen. Okidation Reduktion Aufnahme von Sauerstoff Abgabe von Sauerstoff Abgabe von Elektronen Aufnahme von Elektronen Oxidationsstufen: Entsprechend der ‚Edelgasregel‘ ist die für ein Element maximal erreichbare (höchste positive) Oxidationszahl identisch mit der Gruppennummer des Elements im PSE. Die minimale (höchste negative) Oxidationszahl ergibt sich ebenfalls aus der ‚Edelgasregel‘. Oxidationszahl wird erhöht Oxidationszahl wird erniedrigt Aufstellen von Redox- und Stoffgleichungen: 1. Aufstellen der Oxidations- und Reduktionsteilgleichungen 2. Redoxgesamtgleichung über Elektronenbilanz (unter Berücksichtigung der Reaktionsbedingungen) 3. Stoff-Gleichung mit Stoffbilanz Spezialfälle: Komproportionierung: Disproportionierung: Bei der Komproportionierung wird durch gleichzeitige Reduktion und Oxidation aus einer höheren und einer niedrigeren Oxidationsstufe zweier Atome des gleichen Elementes eine mittlere Oxidationsstufe gebildet. Bei der chemischen Reaktion der Disproportionierung, tritt ein Element gleichzeitig als Oxidationsmittel und als Reduktionsmittel auf, so dass es vorher in einer mittleren Oxidationsstufe, nachher teils in einer positiveren und teils in einer negativeren Oxidationsstufe vorliegt. Richtung und Elektromotorische Kraft anhand der Galvanischen Zelle: Eine galvanische Zelle, ist eine Vorrichtung zur spontanen Umwandlung von chemischer in elektrische Energie. Sie wird in Batterien und Akkumulatoren verwendet. Die Funktion der galvanischen Zelle beruht auf einer Redoxreaktion. Reduktion und Oxidation laufen räumlich getrennt in je einer Halbzelle ab. Daniell Element: Das Daniell-Element ist eine galvanische Zelle, die aus einer Zink- und einer KupferHalbzelle besteht. Zink hat ein geringeres Standardpotential als Kupfer, d.h. Zink ist unedler als Kupfer und die Lösungstension von Zink ist größer. Deshalb gehen am Zinkstab verhältnismäßig viele Zinkionen in Lösung, während sich am Kupferstab nur relativ wenige Kupferionen ablösen und ihre Elektronen im Metall zurücklassen. In der Zinkelektrode (hier: Anode) werden also (wie im Schaubild sichtbar) mehr Elektronen zurückgelassen, weswegen sie negativer geladen ist als der Kupferstab, was den Aufbau einer Spannung bedeutet. ∆E = Eox + Ered ∆E = EMK = 1.10 V Die überschüssigen Elektronen im oxidierenden Zink wandern über einen Leiter vom Zink zum Kupfer. Dabei lässt sich (bei Standardbedingungen) eine Spannung von 1,10 Volt messen. Diese ist die Elektromotorische Kraft, die sich aus dem Redoxpotenzial von Kupfer (E0(Cu) = + 0,34 V) und dem von Zink (E0(Zn) = -0,76 V) zusammensetzt. Elektromotorische Kraft: Unter elektromotorischer Kraft (Symbol ∆E) versteht man die Potentialdifferenz, die zwischen den beiden Elektroden einer elektrochemischen Zelle besteht, sie wird in Volt ausgedrückt. Redoxpotenzial: Maß für Bereitschaft Elektronen aufzunehmen (als Oxidationsmittel zu wirken) Elektrochemische Spannungsreihe: Die Elektrochemische Spannungsreihe ist eine Auflistung von RedoxPaaren nach ihrem Standardelektrodenpotential. Die einzelnen Redoxpaare werden entweder nach aufsteigendem oder absteigendem Standardelektrodenpotential geordnet. Jede RedoxReaktion kann man so durch zwei Paare beschreiben und aus der elektrochemischen Spannungsreihe die Richtung von Reaktionen voraussagen. Thermodynamik von Redoxreaktionen: Die Nernst’sche-Gleichung beschreibt die Konzentrations-abhängigkeit des Elektrodenpotentials eines Redox-Paares. Mit E=Elektrodenpotential Eo=Standardelektr.potential z=Anzahl versch. Elektronen K=Konzentration Elektrochemische Spannungsquellen: Primärelement(Batterie): Brennstoffzelle: Eine Brennstoffzelle ist eine galvanisch Zelle, die die chemische Reaktionsenergie eines kontinuierlich zugeführten Brennstoffes und eines Oxidationsmittels in elektrische Energie wandelt. Sekundärelement(Akku): Korrosion: Schutz vor Korrosion durch: - Nichtmetallische Schichten: Phosphatieren, Oxidieren (Passiv) Lacke,Auskleidungen (organ.) Zementeinbettung, Keramiküberzug (anorg.) - Metallische Überzüge: Elektrolytische Abscheidung Schmelztauchen Schutzschichten (edel/unedel): edel (durch Zink) unedel (durch Zinn)