chemie für ingenieure
Werbung
NTB
Druckdatum: 31.03.13
MWC I
CHEMIE FÜR INGENIEURE
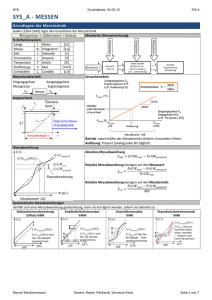
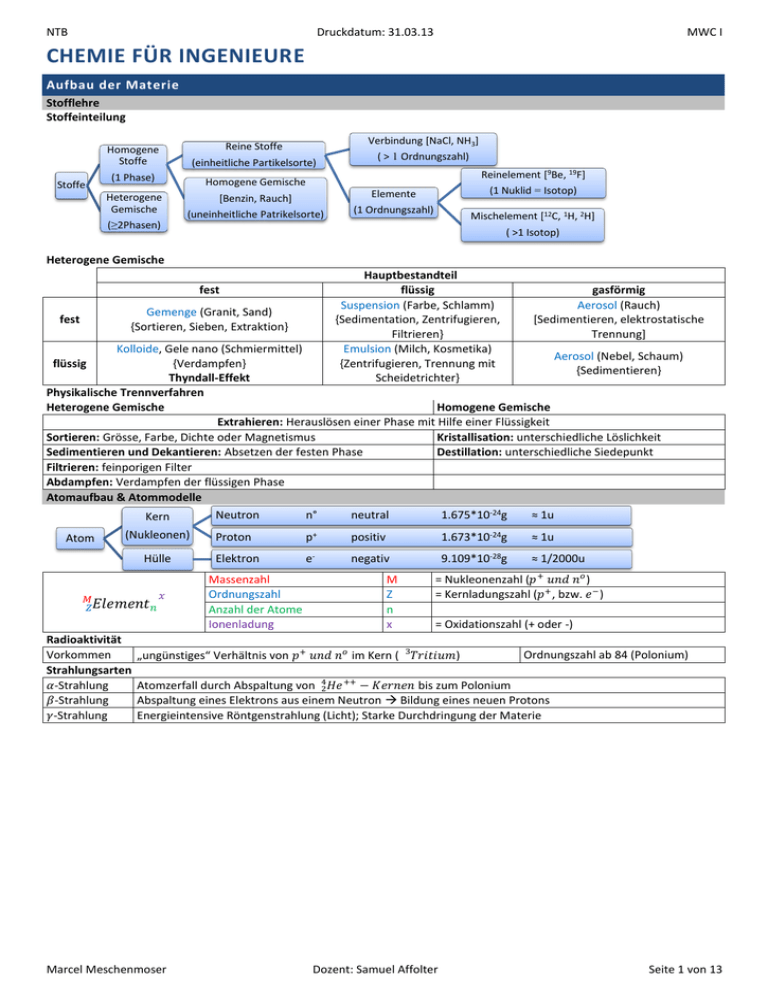
Aufbau der Materie
Stofflehre
Stoffeinteilung
Stoffe
Verbindung [NaCl, NH3]
Reine Stoffe
Homogene
Stoffe
(einheitliche Partikelsorte)
(1 Phase)
Homogene Gemische
Heterogene
Gemische
[Benzin, Rauch]
Elemente
(uneinheitliche Patrikelsorte)
(1 Ordnungszahl)
(≥2Phasen)
( > 1 Ordnungszahl)
Reinelement [9Be, 19F]
(1 Nuklid = Isotop)
Mischelement [12C, 1H, 2H]
( >1 Isotop)
Heterogene Gemische
Hauptbestandteil
flüssig
Suspension (Farbe, Schlamm)
{Sedimentation, Zentrifugieren,
Filtrieren}
Emulsion (Milch, Kosmetika)
{Zentrifugieren, Trennung mit
Scheidetrichter}
fest
fest
Gemenge (Granit, Sand)
{Sortieren, Sieben, Extraktion}
gasförmig
Aerosol (Rauch)
[Sedimentieren, elektrostatische
Trennung]
Kolloide, Gele nano (Schmiermittel)
Aerosol (Nebel, Schaum)
{Verdampfen}
{Sedimentieren}
Thyndall-Effekt
Physikalische Trennverfahren
Heterogene Gemische
Homogene Gemische
Extrahieren: Herauslösen einer Phase mit Hilfe einer Flüssigkeit
Sortieren: Grösse, Farbe, Dichte oder Magnetismus
Kristallisation: unterschiedliche Löslichkeit
Sedimentieren und Dekantieren: Absetzen der festen Phase
Destillation: unterschiedliche Siedepunkt
Filtrieren: feinporigen Filter
Abdampfen: Verdampfen der flüssigen Phase
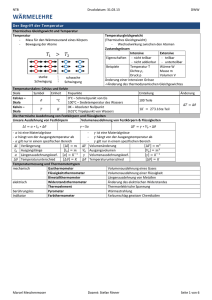
Atomaufbau & Atommodelle
flüssig
Kern
Atom
(Nukleonen)
Hülle
Neutron
n°
neutral
1.675*10-24g
≈ 1u
Proton
p+
positiv
1.673*10-24g
≈ 1u
Elektron
e-
negativ
9.109*10-28g
≈ 1/2000u
Massenzahl
Ordnungszahl
Anzahl der Atome
Ionenladung
Radioaktivität
Vorkommen
Strahlungsarten
-Strahlung
-Strahlung
-Strahlung
„ungünstiges“ Verhältnis von
M
Z
n
x
= Nukleonenzahl (
= Kernladungszahl (
)
, bzw.
)
= Oxidationszahl (+ oder -)
im Kern (
)
Ordnungszahl ab 84 (Polonium)
Atomzerfall durch Abspaltung von
bis zum Polonium
Abspaltung eines Elektrons aus einem Neutron Bildung eines neuen Protons
Energieintensive Röntgenstrahlung (Licht); Starke Durchdringung der Materie
Marcel Meschenmoser
Dozent: Samuel Affolter
Seite 1 von 13
NTB
Bohr‘sches Atommodell
max. Elektronenzahl
Schale
(Energiestufe)
Formel:
Druckdatum: 31.03.13
Orbitale
(je 2 )
Q
2
1s
P
8
1s, 3p
O
18
1s, 3p, 5d
N
32
M
50
L
72
K
98
MWC I
Bohr‘sches
Atommodell
1s, 3p, 5d, 7f
Q
P
O
N
M
L
K
Energiestufenmodell
(Beispiel Na)
p p p d d d d
s
●
M
p
p
p
● ● ● ● ● ●
s
● ●
L
s
●
1 2 3 4 5 6 7
●
K
/ / / / / / / / (+) / / / / / / / Kern
Wellenmechanisches Atommodell
Hybridisierung von C-Atomen
(„Mischen von Orbitalen“)
vorher
nachher
Regeln:
Energieprinzip: Jedes Elektron versucht den energieärmsten Zustand einzunehmen.
Pauli-Prinzip: In einem Atom können zwei
in ihren Quantenzahlen n, l, m und s nie völlig übereinstimmen.
Hund’sche Regel: Jede Orbitalsorte mit definierter Quantenzahlkombination n, l, n strebt zuerst die Halbbesetzung mit
parallelem Spin (s=s+1/2) an.
Elektronenkonfiguration (bestimmt Eigenschaftsbild)
3 = Schalennummer
Na
s = Orbitaltyp
1 = Anzahl
Marcel Meschenmoser
Dozent: Samuel Affolter
Seite 2 von 13
NTB
Druckdatum: 31.03.13
MWC I
PSE (Periodensystem der Elemente)
Massendefekt (Die Masse des Kern ist geringer als die Masse seiner Kernbausteine.)
Beim Zusammenschluss von
zu einem Kern wird
ein kleiner Teil in Energie verwandelt.
Nutzung:
Leichte Kerne verschmelzen (Kernfusion):
Sonne, Fusionsreaktor, Wasserstoffbombe
Schwere Kerne spalten (Kernspaltung):
Kernkraftwerke, Atombombe
Oktettregel – Edelgasregel
Das Bestreben, eine Elektronenkonfiguration mit 8
Elektronen in der äusserten Schale einzunehmen.
Stoffmenge [mol]
Relative Atommasse
Stoffmenge
(unit)
molare Masse
1u = 1.66*10
-24
g
aus PSE
Masse
Avogadro-Konstante
Chemische Bindung
Beispiel
Stoff
Elektronen
Van der Waals-Kräfte
Elektronenverschiebung
Ethanol
26
gleich
3.5 -
2.5
Ladungsverteilung
Polarität
Dipol-/Dipol-Kräfte
Aktive und passive Stellen
H-Brücken
Siedepunkt
Marcel Meschenmoser
Dimethyleter
26
gleich
3.5 +
2.1
+
unsymmetrisch
polar
ja
1 aktive; 2 passive
3
höher
+
+
2.5 2.5
unsymmetrisch
polar
ja
0 aktive; 2 passive
0
tiefer
Dozent: Samuel Affolter
Seite 3 von 13
NTB
Druckdatum: 31.03.13
MWC I
Chemische Bindungen
Elemente
Beispiele
Metallbindung
Metall-Metall
Metalle (Legierungen)
Elektronengas-Modell
Ionenbindung
Metall – Nichtmetall
Salze
Kristallgitter
Kovalente Bindung = Atombindung= paarbindung
Nichtmetall-Nichtmetall
Moleküle (
Lewis-Strichformel
Molekül-Orbital-Theorie
Modell
Tetraedermodell
Struktur
Einfach-Doppel-Dreifach-Bindungen
Bausteine
Gitterkräfte
Atomrumpf
normal
Legierungen
Anionen + Kationen
elektrostatische Anziehung
stark
Metall + NMe Kation +
Anion
+
+
elektrostatische Kraft
Energie-
Bindungskräfte
Van der Walls-Kräfte
(schwach)
liegen immer vor
Ladungen
elektr. Feldkonstante im
Vakuum:
mehr , m oder A
mehr V.d.W
Moleküle
Nebenbindungen
schwach
Dipol-Dipol-Kräfte
(mittel)
1. Molekülanordnung
2. EN mit - und
(höhere EN = -)
3. D./D.-Kräfte
unpolar:
polar:
Wasserstoffbrücken
(stark)
1. aktive Stellen
(H an N, O, F)
2. passive Stellen
( paare bei N, O, F)
wenn D.D. vorhanden
Eigenschaften
Konstante:
Löslichkeit
(Aufbrechen des
Gitters)
elektrische
Leitfähigkeit
keine
2 Kriterien:
Lösungsmittel = starker Dipol,
min. 1 Ionenart einfach geladen ->Coulomb
im flüssigen Zustand leitfähig
eher schlechter elektr. Leiter
hart, spröde bei Schlag
(da sich + zu + begibt -> Abstossung)
Dichte
gut, frei bewegliche
< bei Erwärmung (Schwing.)
gut
besser je weniger
hoch
Siedepunkt
relativ hoch
hoher Schmelzpunkt
Verformbarkeit
Marcel Meschenmoser
Dozent: Samuel Affolter
10kJ/mol
20kJ/mol
50kJ/mol
sofern Nebenbindungen vorhanden:
Mischbarkeit: (Regel: Ähnliches mischt sich mit Ähnlichem
2xunpolar oder 2x polar = gut, unpolar mit polar = schlecht
Nichtleiter
kaum elektr. Leiter
sehr weich
weich
sehr hart
niedr. Schmelzpunkt
niedr. Schmelzpunkt
sehr hoher Schmelzpunkt
Seite 4 von 13
NTB
Druckdatum: 31.03.13
MWC I
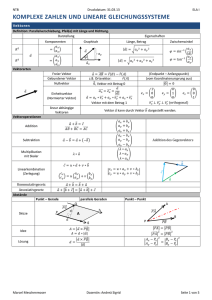
Chemische Formeln
Oxidation
Begriff
Abspaltung von Elektronen aus Molekülen; Chemische Reaktion mit Sauerstoff zu Verbindungen
Regeln
Hauptgruppe entspricht meist der Oxidationszahl
Elemente, Verbindungen immer = 0
Wasserstoff +1,-1
Elektronegativere Atom ist negativ geladen
Elemente aus der Mitte einer Verbindung werden durch Bilanzieren ermittelt
Nomenklatur
anorganische Salze
Moleküle
Kationen:
Anionen:
Wasserstoffverb. (Anionen)
Kohlenstoffmonoxid
bei Übergangsmetalle
(einige) mehratomig (-id)
mit Nichtmetallen
Kohlenstoffdioxid
Oxidationszahl eingeben
Hydroxid-Ion
Hydrogenfluorid
Schwefeldioxid
Ausnahme:
Cyanid-Ion
Hydrogenchlorid
Schwefeltrioxid
Rhodanid-Ion
Hydrogencyanid
Ammonium
Sauerstoffsäuren
Sauerstoffhaltige-verb.
z.B.
Kupfer(I)-Ion
1=mono
(kleine Oxidz. -at/grosse -it)
Kohlensäure
Kupfer(II)-Ion
2=di
Salpetersäure
Eisen(III)-Ion
Carbonat-Ion
3=tri
Phosphorsäure
Anionen:
Nitrat-Ion
4=tetra
Schwefelsäure
einatomig (-id)
Nitrit-Ion
5=penta
Perchlorsäure
Nitrid-Ion
Phosphat-Ion
6=hexa
Essigsäure
Oxid-Ion
Sulfat-Ion
7=hepta
Salze
Sulfid-Ion
Acetat-Ion
8=octa
Natriumchlorid
Fluorid-Ion
Perchlorat-Ion
9=nona
Magnesiumoxid
Chlorid-Ion
10=deka
Lithiumhydroxid
Bromid-Ion
Kalziumchlorid
Iodid-Ion
Stöchiometrie
Ausgangsstoffe (Edukte)
reagieren zu
g
fl, l
f, s
aq
Endstoffe (Produkte)
Es gehen keine Atome und Masse „verloren“.
Koeffizienten müssen ganzzahlig sein.
Aggregatzustände der Materie
Wärme
(Energie)
verdampfen
kondensieren
grosser Abstand
fast keine Anziehung
verteilt sich im Raum
Gasgleichung
sublimieren
resublimieren
Flüssigkeit
erstarren
schmelzen
Feststoff
sehr kleiner Abstand
regelmässig
schwer teilbar
schwer verformbar
Lösung:
Homogene Mischung von Stoffen in einem Lösungsmittel
Löslichkeit abhängig von Wechselwirkungen
Marcel Meschenmoser
p Druck
V Volumen
R Gaskonst
Gas
kleiner Abstand
geringe Anziehung
leicht teilbar
leicht verformbar
gasförmiger Stoff
flüssiger Stoff (liquid)
Festkörper (solid)
in Wasser gelöster Stoff (aquatisiert)
Viskosität: Mass für die Dickflüssigkeit
Stoffmengenkonzentration
amorphe
Struktur:
nicht regelmässig
Profil:
isotrop
Beispiel:
Glas
Masseanteil
Dozent: Samuel Affolter
Stoffmenge
Volumen
Flüssigkristalline
regelmässig
antisotrop
Kunststoffe
Masse von X
Gesamtmasse
Seite 5 von 13
NTB
Druckdatum: 31.03.13
MWC I
Chemische Reaktionen
Thermodynamik
Elemente
Freie Enthalpie,
Triebkraft einer Reaktion
Enthalpie, Wärmehaushalt
Energie, System Umwelt
Entropie, Unordnung,
mehr Teilchen, mehr Ordnung
Verbindungen
Phasenübergänge
Tabelle
Tabelle
Tabelle
wird grösser
Wärme
T
Freie Enthalpie
Temperatur
Edukt
Aktivierungsenergie
Aktivierungsenergie
Produkt
Edukt
negativ
positiv
Produkt
t
t
spontan ablaufender Prozess
nach überwinden von
ablaufend
Berechnung
Marcel Meschenmoser
Reaktion erreicht
Gleichgewicht
durch dauernde Energiezufuhr
durch dauernde Energiezufuhr
laufend
laufend
läuft ab
läuft nicht ab
exotherm
System gibt Energie ab
mehr Ordnung,
kleinere Unordnung
entropiegesteuert
endotherm
System nimmt Energie auf
weniger Ordnung,
grössere Unordnung
enthalpiegesteuert
Dozent: Samuel Affolter
Seite 6 von 13
NTB
Kinetik
Reaktionsgeschwindigkeit v
0. Ordnung
Druckdatum: 31.03.13
MWC I
1. Ordnung
2. Ordnung
1.Typ
t
2.Typ
t
Reduktion auf 1. Ordnung
Abbau des Alkohols im Blut
Zerfall radioaktiver Isotopen
Additionen, Kondensationen
Aktivierungsenergie
Funktion
Aufbrechen von chem. Verbindungen; Bildung von Zwischenprodukten
nachhelfen
Aktivierungsenergie
selbstablaufend
Geschwindigkeitskonstante
Aktivierungsfaktor
universelle Gaskonstante
T
Reaktionstemperatur
pro
doppelte Geschwindigkeit
Katalyse
Katalysator
Inhibitor/Stabilisator
beschleunigen die Reaktion, vermindert die Aktivierungsenergie,
verzögert die Reaktion
werden nicht verbraucht, verändert chem. Gleichgewicht nicht
erhöht die Aktivierungsenergie
heterogene Katalyse
homogene Katalyse
min. 2-phasige Lösungen
einphasige Lösungen
Autoabgaskatalysator, Polymerisation
Alkoholabbau im Körper
Chemisches Gleichgewicht (reversible(=umkehrbar) Reaktionen)
Gleichgewicht
Ein chemisches Gleichgewicht stellt sich ein! Dauer ist abhängig von:
Reaktionsgeschwindigkeit
Gleichgewichtskonstante
Konzentrationen
und
Temperatur T und Druck p
Änderungen
Hinreaktion
Änderung
Gleichgewicht verschiebt sich zu
exotherm
Temperaturerhöhung
-> Edukte
mehr Gasteilchen (Volumenteile)
Druckerhöhung
-> Edukte
Massenwirkungsgesetz MWG
allgemeine Reaktion
Konzentration von Feststoffen = 1
für Lösungen
Gleichgewichtskonstante
Gleichgewichtskonstante
Konzentration
für Gasmischungen
Koeffizienten
Partialdruck
Zusammenhang von
und
Marcel Meschenmoser
K bleibt
K variiert
Dozent: Samuel Affolter
Konzentration
Temperatur, Druck
Seite 7 von 13
NTB
Druckdatum: 31.03.13
MWC I
Chemie wässriger Lösungen
Lösevermögen von Wasser gegenüber Salzen
1.
2.
Aufbrechen des Kristallgitters
Wechselwirkung
Löslichkeitsprodukt
Lösungswärme
=
+ Hydratationsenthalpie
Gitterenergie
von Salzen
Massekonzentration
pro L
Löslichkeit
Komplexverbindungen
2-
OH
Zn
OH
OH
OH
Zentralatom, -ion
Zn
meist Metall, positiv geladen
Liganden
OH
meist Nichtmetall, negativ geladen
Koordinationsstruktur
tetraedrisch
geometrische Umgebung
Koordinationszahl
6
Anzahl verbundene Atome/Ionen
Anlagerungskomplexe (Komplexe mit starke zwischenmolekulare Kräfte)
1. Hydratisierung
2. Ligandaustausch
Chelatliganden (können sich an mehreren Koordinationsstellen anbinden)
z.B.
(Ethylendiamin-tetraacetat); Hämoglobin (roter Blutfarbstoff)
Eigenschaften: verdrängt einfach gebundener Ligand vollständig, extrem stabil
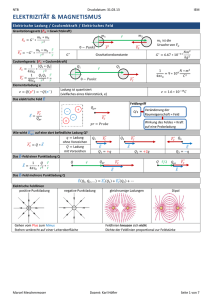
Säuren und Basen
Säuren
Basen
Protonendonatoren, polare H-X-Bindung
Protonenakzeptoren, freie Elektronenpaare
Ampholyt: sowohl Säure als auch Base z.B. Wasser
Stäre von Säuren und Basen
Säurenstärke
keine Säure
schwache Säure
starke Säure
Basenstärke
starke Base
Säuren
sauer
schwache Base
Neutralpunkt
neutral
keine Base
Laugen, Basen
basisch, alkalisch
pH-Wert
0
1
7
14
1
Ampholyt Wasser
Marcel Meschenmoser
Dozent: Samuel Affolter
Seite 8 von 13
NTB
pH-Titration (Tröpfchen für Tröpfchen)
Druckdatum: 31.03.13
MWC I
Wendepunkt: Rasanter Sprung bei pH 7
Puffer
Säure/Base Lösung, die der pH Wert kaum verändert.
z.B. Hahnenwasser, Körperflüssigkeiten
Redox-Reaktionen
Vorgang
Oxidation
Reduktion
Frühere Definition
Aufnahme von Sauerstoff
Abgabe von Sauerstoff
Heutige Definition
Elektronen-Abgabe
Elektronen-Aufnahme
Beispiele
Redoxvorgang = gekoppelte Oxidation und Reduktion (= Elektronenübertragungsreaktionen)
Redox-Paar
Reduktionsmittel
Oxidationsmittel
Oxidation
Reduktion
Redoxreaktion
Oxidationszahlen
(EN-negativeres Ion bezieht
Ladungserhalt, Masseerhalt
Einzeichnen
Reduktion
)
Oxidation
Sprengstoffe
Eigenschaften
rasch zersetzen
Wärme freigeben
erhebliche Gasmengen produzieren
Brennstoff und Sauerstoff zusammen
Formale Trennung in Halbreaktionen
Magnesium verbrennt mit einer
weissen Flamme
reale
arabische Ziffern
zugeordnete
römische Ziffern
Gleiche Ladung und Masse auf beiden Seiten der Reaktion
Oxidationsmittel:
(läuft Reduktion)
Reduktionsmittel:
(läuft Oxidation)
Brennstoffquelle
Sauerstoffquelle
Explosion
Zündquelle
Sprengstoffe
Ammoniumnitrat
Nitroglyzerin
Trinitrotoluol (TNT)
Schwarzpulver
Marcel Meschenmoser
Kaliumnitrat
Schwefel,
Kohle
Temperaturentwicklung gering
Mischung mit ca. 10% Heizöl
flüssig
extrem reibungs- und schlagempfindlich
Festkörper
handhabungssicher, stossunempfindlich
hohe Zündempfindlichkeit
günstig
Dozent: Samuel Affolter
Seite 9 von 13
NTB
Druckdatum: 31.03.13
MWC I
Unedle und edle Metalle
Ein Metall ist umso edler, je schwerer das Metall seine
abgibt, je leichter seine Kationen
aufnehmen
Daniell-Element
hochohmiges
Kurzgeschlossene Zelle
Spannungsmeter
Reaktion läuft unkontrolliert ab.
Anode
Kathode
Unedleres Metall
Edleres Metall
Minuspol
Pluspol
Anode
Kathode
Ort der Oxidation
Ort der Reduktion
Pluspol
Minuspol
PRIMO
Pluspol =
Reduktion
Keine Reaktion
I…
Da hochohmiges
Minuspol =
Spannungsmeter
Oxidation
Ionenbrücke
Oxidation
Reduktion
Redoxreaktion
freie Enthalpie
Anzahl übertragener
Faraday-Konstante
Potentialdifferenz bei Standartbedingungen
Reaktionsquotient der Redoxreaktion
Elektrolyse (Erzwungene Redox-Reaktion)
Gleichstromquelle „Elektronenpumpe“
Ort der
Oxidation
Anode
Kathode
Ort der
Reduktion
KNAP
Kathode =
Negativ
Anode =
Positiv
Oxidation
Reduktion
Redoxreaktion
Marcel Meschenmoser
Dozent: Samuel Affolter
Seite 10 von 13
NTB
Druckdatum: 31.03.13
Galvanisieren (Abscheidung von Metallen auf leitfähigen Oberflächen)
Gleichstromquelle
„Elektronenpumpe“
Kupferanode
Metallelektrode
Anode
Kathode
Ort der Oxidation
Ort der Reduktion
MWC I
Ladungsmenge
Abgeschiedene Stoffmenge des Metalls in M
Zahl der verschobenen Elektronen
Chemische Reaktionen
Auflösungsreaktion
Reaktionstypen
Löslichkeit
Fällungsreaktion
Komplexbildungsreaktion
Komplexe
Ligandaustausch
Säure-Base-Reaktionen (Proton-Übertragung)
Redox-Reaktion (Elektronen-Übertragung
Korrosion
Definition
Reaktion eines metallischen Werkstoffes mit seiner Umgebung, meist elektrochemisch
Bedingungen
Kontaktierung verschiedener edler Metalle mit unterschiedlichem Potential
lokal unterschiedliche Konzentrationen von metall-kontaktierenden Stoffen, z.B. Sauerstoff
Lokalelemente
Dabei bilden sich in meist wässerigen Lösungen sog. Lokalelemente, kurgeschlossene Zellen, deren Elektrodenoberflächen sehr
klein sind.
Batterien
Marcel Meschenmoser
Dozent: Samuel Affolter
Seite 11 von 13
NTB
Druckdatum: 31.03.13
MWC I
Organische Chemie
Chemie der Kohlenstoffverbindungen, nur Nichtmetalle
Eigenschaften
geringe Wärmebeständigkeit schwache kovalente Bindungen
Flüchtigkeit / Geruch, tiefer Schmelz- und Siedepunkt zwischenmolekulare Kräfte klein
Brennbarkeit
Gruppen
Funktionelle Gruppen
Methan Ethan Propan Butan
Alkane
Benzin, Heizöl
Cyclische Alkane
Pentan
… -an
Cyclo-…
gute zwischenmolekularen Wechselwirkungen
…-en
Nachweis von C-Doppelbindungen mit
…-in
kein C=C-Doppelbindungscharakter
Alkine
Ethylen
PE, PP
Acetylen
Aromaten
Benzol, Tuluol
Halogenierte
Kohlenwasserstoffe
Chloroform
FCKW
PVC, PTFE
Ether
Diethyleter
Alkohole
(wasserlöslich)
Ethanol
H-Brücken
Reaktivität gegenüber Oxidationsmittel
Aldehyde
Riechstoffe:
z.B. Zimtaldehyd
Ausgangsstoff für Phenol-Formaldehyd-Harte PF
Monomer von Polyoxymethylen POM
Alkene
Ketone
(Carbonyle)
Carbonsäuren
(wasserlöslich)
instabil:
ursprünglich wirksam gegen Insekten
langsam biologisch abbaubar, zerstören Stratosphäre
Substitutionsreaktion: Austausch eines H-Atoms
Aceton
Methyl-Ethyl-Keton
Cyclohexanon
Ameisensäure,
Essigsäure,
Zitronensäure
Bedeutung als Lösungsmittel
schwache Säuren
Ester
Essigsäure-ethylester
Veresterung: Kondensation, Herstellung von KS
Amine
(wasserlöslich)
Ammoniak
Methylamin
1.6-Diaminohexan
Fisch-Geschmack
Basen, können Protonen aufnehmen
es müssen nicht unbedingt H am N sein
assymetrische C-Atome
chiral
Aminosäuren
ZwitterIon:
Amide
Polyamid, Proteine
Isocyanate
Nitrile
Polyacrylnitril
Marcel Meschenmoser
Herstellung von synthetischen Polyamiden
Ausbildung von Proteine
Ausgangsstoff für Polyurethan
Dozent: Samuel Affolter
Seite 12 von 13
NTB
Modelle
Molekülformel
Summenformel
Druckdatum: 31.03.13
Konstitutionsformel
Strukturformel
Valenzstrichformel
H H H H
H C C
C C H
MWC I
Strukturformel räumlich
Keilstrichformel
HH HH
H
C
C
C
H
C
H H H H
Kurzschreibweise
C als Punkt
ohne H
HH HH
Isomere
Konformations-Isomere
Konstitutions-Isomere
1-Buten
HH
H
C
H
C
C
H HH
2-Buten
H HH
H
C
C
C
H
C
HH H
H
C
Sesselform
Wanneform
Konfigurations-Isomere
cis-trans Isomere
cis-2-Buten
trans-2-Buten
Chiralität (optische Aktivität)
=Molekül, das mit seinem Spiegelbild nicht zur Deckung gebracht werden kann.
C-Atom mit 4 unterschiedlichen Substitutionen
Reaktionstypen
Addition
Substitution
Elimination
Kondensation
2 Stoffe reagieren zu einem neuen Stoff
Austausch eines Substituenten
Abspaltung eines Moleküls
2 Stoffe reagieren unter Bildung eines leichtflüssigen
Stoffes, meist Wasser
Marcel Meschenmoser
Dozent: Samuel Affolter
Seite 13 von 13