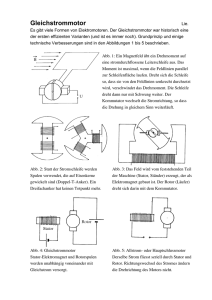
Untersuchungen über den Laichfischbestand
Werbung

Untersuchungen über den Laichfischbestand und die Reproduktion der Finte (Alosa fallax fallax, Lacépède, 1803) in der Unterweser Diplomarbeit vorgelegt von: Sandra Schulze Universität Bremen - Fachbereich 2: Biologie/Chemie 1. Gutachter: Dr. Michael Schirmer 2. Gutachterin: Prof. Dr. Juliane Filser Bremen, Mai 2005 Danksagung Danksagung Mein besonderer Dank gilt Michael Schirmer für die Betreuung dieser Arbeit. Das Thema der Arbeit hätte nicht besser sein können. Für die Begutachtung der Arbeit sowie für wertvolle Veranstaltungen (Israel-Exkursion, Projekt) während des Studiums danke ich Juliane Filser. Ganz herzlich möchte ich mich bei Ulrich Willig bedanken, der neben der Bereitstellung seines Kutters „Margrit“ sehr viel Engagement und Interesse für einen so unwirtschaftlichen Fisch gezeigt hat. Ohne ihn wäre eine derartige Datenfülle nicht zustande gekommen. Ebensolcher Dank gebührt Rüdiger Droste und den Mitgliedern der Arbeitsgruppe Aquatische Ökologie für die tatkräftige Unterstützung bei den Probenahmen sowie für konstruktive Kritik und Anregungen. Danke, dass Ihr euch nicht abschrecken ließt mit mir bei Wind und Wellen und des nachts auf der Weser herumzuschippern. Danken möchte ich der GPV, Bremen und dem Senator für Bau, Umwelt und Verkehr für die finanzielle Unterstützung des Projektes über die Betroffenheit der Fischart „Finte“ (Alosa fallax, Lacépède) durch die Baumaßnahmen zum Wesertunnel der A 281 im Einschwimm/Absenkverfahren. Ferner danke ich den Stahlwerken Bremen für die Bereitstellung von Messdaten und die Möglichmachung sowie die Begleitung von Larvenfängen in den Rückspülbecken des Werkes. Dank gebührt auch Werner Wosniok für die Unterstützung bei statistischen Fragen. Besonderer Dank gilt Jürgen Meyerdirks und Lutz Meyer für die Mühen der Korrekturlesungen und für wertvolle Anregungen und Hilfen. Für den moralischen Beistand und die Ablenkung danke ich meinen Freunden und vor allem Lars für die nie enden wollende Unterstützung während der gesamten Zeit. Der größte Dank gebührt jedoch meinen Eltern, die mich während meines Studiums in vielerlei Hinsicht und nicht nur finanziell unterstützten. Inhaltsverzeichnis Inhaltsverzeichnis Abbildungsverzeichnis ......................................................................................................... I Tabellenverzeichnis .............................................................................................................. III Abkürzungsverzeichnis ........................................................................................................ IV 1 Einleitung ......................................................................................................................... 1 2 Einführung ......................................................................................................................... 3 2.1 Die Finte ................................................................................................................. 3 2.1.1 Taxonomie .................................................................................................. 4 2.1.2 Gefährdungskategorien und Schutzstatus .................................................. 4 2.1.3 Beschreibung und Kennzeichen ................................................................. 5 2.1.4 Vorkommen und Verbreitung von Alosa fallax und deren Unterarten ...... 6 2.1.5 Lebensraum und Lebensweise ................................................................... 8 2.1.6 Lebenszyklus (Reproduktion, Ontogenie) .................................................. 9 2.1.7 Nahrung ...................................................................................................... 12 2.1.8 Brisanz und Aktualität: Warum ist dieser Fisch so interessant geworden? . 13 2.2 Das Untersuchungsgebiet ...................................................................................... 14 2.2.1 Die Unterweser ........................................................................................... 14 2.2.2 Historische Nachweise der Finte in der Weser .......................................... 16 2.2.3 Gefährdung und Bestandsentwicklung von Finte und Alse in der Weser .. 16 3 Material und Methoden ................................................................................................... 19 3.1 Methodisches Vorgehen ........................................................................................ 19 3.2 Hamenfänge ........................................................................................................... 20 3.3 Auswertung und Bearbeitung der Hamenfänge ..................................................... 21 3.3.1 Längen- und Gewichtsbestimmung ............................................................ 22 3.3.2 Anzahl der Kiemenreusendornen .............................................................. 22 3.3.3 Anzahl der Punkte ...................................................................................... 22 3.3.4 Geschlechtsbestimmung ............................................................................ 22 3.3.5 Ermittlung der Laichreife ........................................................................... 23 3.3.6 Mageninhaltsuntersuchungen ..................................................................... 23 3.3.7 Auswertung der einjährigen Finten ........................................................... 24 3.3.8 Auswertung des Beifangs .......................................................................... 24 3.4 Durchführung der Lauschfahrten .......................................................................... 24 Inhaltsverzeichnis 3.5 Eier- und Larvenfänge ........................................................................................... 25 3.6 Weitere Methoden ................................................................................................. 26 3.7 Abiotische Parameter ............................................................................................. 27 3.8 Mathematische und statistische Auswertung der Daten ........................................ 27 4 Ergebnisse ......................................................................................................................... 28 4.1 Fangauswertung nach Fangzahlen ......................................................................... 28 4.2 Fangauswertung anhand der populationsbiologischen Daten ................................ 34 4.2.1 Länge und Gewicht .................................................................................... 35 4.2.2 Kiemenreusendornen ................................................................................. 37 4.2.3 Punkte ......................................................................................................... 39 4.2.4 Geschlecht .................................................................................................. 39 4.2.5 Laichreife ................................................................................................... 39 4.2.6 Mageninhalt ............................................................................................... 41 4.2.7 Einjährige Finten ........................................................................................ 43 4.2.8 Zusammensetzung des Beifangs ................................................................ 44 4.3 Laichverhältnisse und Reproduktion ..................................................................... 46 4.3.1 Laichgebiet ................................................................................................ 48 4.3.2 Laichzeit .................................................................................................... 48 4.3.3 Laichtemperatur ......................................................................................... 49 4.3.4 Laichverhalten ........................................................................................... 49 4.4 Eier- und Larvenfänge ........................................................................................... 50 5 Diskussion ......................................................................................................................... 52 5.1 Fangauswertung nach Fangzahlen ......................................................................... 52 5.2 Fangauswertung anhand der populationsbiologischen Daten ............................... 57 5.2.1 Länge und Gewicht .................................................................................... 57 5.2.2 Kiemenreusendornen ................................................................................. 60 5.2.3 Punkte ........................................................................................................ 64 5.2.4 Geschlecht ................................................................................................. 65 5.2.5 Laichreife ................................................................................................... 66 5.2.6 Mageninhalt ............................................................................................... 66 5.2.7 Einjährige Finten ........................................................................................ 69 5.2.8 Zusammensetzung des Beifangs ................................................................ 71 5.3 Laichverhältnisse und Reproduktion ..................................................................... 73 5.3.1 Laichgebiet ................................................................................................ 73 Inhaltsverzeichnis 5.3.2 Laichzeit .................................................................................................... 75 5.3.3 Laichtemperatur ......................................................................................... 76 5.3.4 Laichverhalten ........................................................................................... 76 5.4 Eier- und Larvenfänge ........................................................................................... 79 5.4.1 Eierfänge .................................................................................................... 79 5.4.2 Larvenfänge ............................................................................................... 79 5.5 Methodendiskussion .............................................................................................. 82 5.6 Ausblick ................................................................................................................. 84 6 Zusammenfassung ............................................................................................................ 85 7 Literaturverzeichnis .......................................................................................................... 87 8 Glossar .............................................................................................................................. 108 9 Anhang (auf CD-Rom) ..................................................................................................... 111 A1 Erste Fintenbeschreibung (GESNER 1563) ............................................................. 111 A2 Weitere Literatur .................................................................................................... 113 A3 Unterschiede Finte/ Alse ........................................................................................ 114 A4 Probenahmeplan ..................................................................................................... 122 A5 Abiotik ................................................................................................................... 123 A6 Rohdaten der adulten Finten .................................................................................. 125 A7 Rohdaten der einjährigen Finten ........................................................................... 139 A8 Beifang ................................................................................................................... 146 A9 Larvenfänge ........................................................................................................... 165 A10 Statistik ................................................................................................................... 167 Abbildungsverzeichnis I Abbildungsverzeichnis Abb. 1: Die Finte; oben laichreifes Weibchen, unten Männchen ….................................................. 3 Abb. 2: Verbreitung von Alosa fallax fallax (Dreieck), Alosa fallax nilotica (Kreis) und Alosa alosa (Stern) in Europa (verändert nach LELEK 1987) ......................................................... 6 Abb. 3: Meldungen von 3 Taz-Artikeln: Ein Fisch namens Finte (TAZ NORD BREMEN 2003), Vorsicht, Finte! (TAZ BREMEN 2004), Finte torpediert Windkraft (TAZ NORD 2004) ......... 13 Abb. 4: Übersichtskarte der Unterweser ........................................................................................... 14 Abb. 5: Fangnetz mit Angabe der einzelnen Maschenweiten in mm (links), Kutter „Margrit“ (rechts) ...................................................................................................... 20 Abb. 6: Angewandte Fanggeräte: Dredge (links), Kescher (rechts) .................................................. 26 Abb. 7: Anzahl der pro Hol im Hamen gefangenen adulten (> 25 cm) und einjährigen Finten in Farge (UW-km 28/29) in der Zeit vom 27.04. bis zum 21.07.2004 (aus SCHULZE & SCHIRMER 2005) ................................................................................................................... 28 Abb. 8: Verteilung der adulten Finten in den Flut- und Ebbehols in der Zeit vom 29.04. bis zum 17.06.2004 ............................................................................................................... 31 Abb. 9: Anzahl der gefangenen adulten Finten (n = 480) an den einzelnen Stationen mit Angabe der UW-km ............................................................................................................. 32 Abb. 10: Anzahl der in allen Stationen gefangenen Laichfische (Balken) und Entwicklung der Wassertemperatur (Punkte) in der Unterweser im Zeitraum 29.04. - 01.07.2004 ................ 33 Abb. 11: Anzahl der in allen Stationen gefangenen Laichfische (Balken) und Entwicklung der Abflussmengen (Punkte) in der Unterweser im Zeitraum 29.04. - 01.07.2004 …................ 33 Abb. 12: Längenhäufigkeitsverteilung (TL) der gefangenen adulten Finten (♂♂ n = 187, weiße Balken; ♀♀ n = 293, schwarze Balken) .................................................................... 35 Abb. 13: Gewichtshäufigkeitsverteilung der gefangenen adulten Finten (♂♂ n = 184, weiße Balken; ♀♀ n = 293, schwarze Balken) .................................................................... 35 Abb. 14: Längen-Gewichts-Regression für Männchen (blau) und Weibchen (rot), Potenzfunktion: y = cxb ......................................................................................................... 36 Abb. 15: Häufigkeit der Anzahl von Kiemenreusendornen bei einjährigen Finten (AG 1+, Längen von 10 - 22 cm, n = 63) und Tieren > 25 cm (AG 2+ und älter, Längen von 27 - 50 cm, n = 389) .............................................................................................................. 37 Abb. 16: Zusammenhang zwischen Länge und Anzahl der Kiemenreusendornen bei einjährigen Finten (links) und Tieren > 25 cm (rechts), lineare Regression ......…................................. 38 Abb. 17: Anzahl der im Hamen gefangenen Weibchen und Männchen in der Zeit vom 06.05. bis zum 17.06.2004 in Farge (UW-km 28/29) und Blumenthal (UW-km 20,5) .................. 39 Abbildungsverzeichnis II Abb. 18: Laichreife der in Farge (schwarz-weiß), Rechtenfleth (rot) und Blumenthal (grün) gefangenen Laichfische (n = 480) in der Zeit vom 06.05. bis zum 17.06.2004 ................... 40 Abb. 19: Füllungsgrad des Magens von 443 untersuchten adulten Finten (links), Fotos: rechts oben Magen leer, rechts unten Magen gefüllt (26.05.2004, Farge UW-km 29) .................. 41 Abb. 20: Zusammenhang zwischen Laichreife und Füllungsgrad des Magens bei adulten Finten (n=443), Legende: weiß: leerer Magen, gestreift: gefüllter Magen, schwarz: sehr voller Magen ................................................................................................................................... 42 Abb. 21: Längenhäufigkeitsverteilung (TL) der einjährigen (AG 1+, n = 379, weiße Balken) und der adulten Finten (AG 2+ und älter, n = 480, schwarze Balken) ............................................. 43 Abb. 22: Mittelwerte der Totallängen (grau) und des Gewichts (schwarz) der einjährigen Finten in der Zeit vom 11.06. bis zum 13.08.2004 (n = 449) .......................................................... 44 Abb. 23: Eierfang von Alosa fallax (23.05.2004, Blumenthal) …........................................................ 48 Abb. 24: Eine frisch geschlüpfte Fintenlarve (5 mm) aus den Erbrütungsversuchen …...................... 50 Abb. 25: Unterschiedliche Fanggewichte der adulten Finten in den Ebbe- und Fluthols. Links: Eine Kiste mit 27,68 kg, 06.05.2004, Ebbe, Farge UW-km 28; rechts: Zwei Kisten mit 66,02 kg, 07.05.2004, Flut, Farge UW-km 29) ............................. 53 Abb. 26: Oben Männchen, unten Weibchen (Farge, UW-km 29, 26.05.2004) .................................. 57 Abb. 27: Linkes Bild: Kiemenbogen einer Alse (links) und einer Finte (rechts) (verändert nach HASS 1965). Rechtes Bild: Kiemenbogen einer weiblichen Finte (links) und einer männlichen Finte (rechts) aus der Unterweser vom 12.05.2004 …...................................... 61 Abb. 28: Finte mit nur 1 schwarzen Punkt (links) und mit 16 schwarzen Punkten (rechts) hinter dem Kiemendeckel …................................................................................................. 64 Abb. 29: Variierender Mageninhalt von Finten. Linkes Foto: Stintlarven und Crustaceen, Farge 11.06.2004; Rechtes Foto: Heringe, Farge 26.05.2004 ....................................................... 68 Abb. 30: Lebenszyklus der Finten in der Unterweser, verändert nach APRAHAMIAN et al. 1998 ..... 70 Abb. 31: Beifang (hauptsächlich Hering und Finte) vom 26.05.2004, Farge (UW-km 29) ............... 72 Abb. 32: Beifang (Kaulbarsch, Stint (Jungfische), Hering, Flunder, 1+ Finte) vom 29.07.2004, Rechtenfleth (UW-km 46) ................................................................................................... 72 Abb. 33: Nachweis von adulten und einjährigen Finten, die Verbreitung von Finteneiern, der einzige Fund der Fintenlarve sowie das Gebiet der beobachteten Laichaktivität in der Unterweser für das Jahr 2004 .............................................................................................. 73 Abb. 34: Laichgebiet der Finten in der Unterweser (links Farge UW-km 28/29, rechts Farge UW-km 28/29 U-Boot-Bunker) ........................................................................................... 74 Abb. 35: Laichende Finten aus BAGLINIÈRE & ELIE 2000 in: APRAHAMIAN et al. 2003 ................... 78 Tabellenverzeichnis III Tabellenverzeichnis Tab. 1: Probenahmeplan ................................................................................................................... 19 Tab. 2: Anzahl der untersuchten Individuen (n) der einzelnen Parameter ....................................... 22 Tab. 3: Anzahl der im Hamen gefangenen adulten und einjährigen Finten an den verschiedenen Stationen (UW-km 20,5-46) im Untersuchungszeitraum 29.04. - 13.08.2004, Abkürzungen: Lfd. Nr.: Laufende Fangnummer; Fang Nr.: Ausgewerteter Fang .............. 29 Tab. 4: Biomasse der adulten Finten im Zeitraum 06.05. - 11.06.2004 zwischen UW-km 20,5 und 46, Abkürzungen: Lfd.Nr.: Laufende Fangnummer; Fang Nr.: Ausgewerteter Fang ............................................................................................. 30 Tab. 5: Anzahl und prozentuale Häufigkeit (pj) der gefangenen Männchen und Weibchen in den Ebbe- und Fluthols im Zeitraum 06.05. - 17.06.2004 .................................................. 31 Tab. 6: Übersicht über vier der untersuchten populationsbiologischen Parameter bei adulten und einjährigen Finten …............................................................................................................. 34 Tab. 7: Mageninhalt der untersuchten adulten Fische (n = 443), eingeteilt in 7 verschiedene Kategorien ........................................................................................................................... 42 Tab. 8: Totallängen von einjährigen Finten im Zeitraum vom 11.06. - 13.08.2004, n: Anzahl der untersuchten Individuen, x : Mittelwert, s: Standardabweichung .................................. 43 Tab. 9: Nachgewiesene Arten in den Hamenfängen, mit Angabe der Gefährdungskategorien (für Niedersachsen (Nds) und Bremen (B): GAUMERT & KÄMMEREIT 1993; für deutsche Küstengewässer (D): FRICKE et al. 1998) und des Schutzstatus (FFH-RL, www.bfn.de); 1=Vom Aussterben bedroht, 2=Stark gefährdet, 3=Gefährdet, 4=Potentiell gefährdet, 5=Nicht gefährdet, F=Fremdfischart ............................................. 45 Tab. 10: Ergebnisse der Lauschfahrten und Kontrollgänge in der Zeit vom 07.05. bis zum 01.06.2004 im Bereich von UW-km 9 - 30. Abkürzungen: *UW-km: in diesem UWAbschnitt wurde die Laichaktivität an dem angegebenen Tag beobachtet; ** wo: Wetter-Online (Lufttemperaturen Höchstwerte); ***He: Messstation Hemelingen; ****St.: Stahlwerke Bremen (Tagesmittelwert); *****tg: tagsüber gemessen, Oberflächenwasser .............................................................................................................. 46 Tab. 11: Nachgewiesene Finteneier in der Zeit vom 19.05. bis zum 08.06.2004 im Bereich von UW-km 8 - 28 .............................................................................................................. 47 Tab. 12: Abiotische Parameter zur beobachteten Laichzeit, (Sauerstoffgehalt, pH-Wert und el. Leitfähigkeit von den Stahlwerken Bremen, Oberwasserabflussmengen von www.bafg.de/php/weser.htm) ............................................................................................. 49 Tab. 13: Anzahl der Kiemenreusendornen der Finte aus verschiedenen Flusssystemen (verändert nach HASS 1965, QUIGNARD & DOUCHEMENT 1991a, APRAHAMIAN et al. 2003 und HILLMAN 2003) ................................................................... 62 Abkürzungsverzeichnis Abkürzungsverzeichnis: • AG: Altersgruppe • BFA für Fischerei: Bundesforschungsanstalt für Fischerei • BfG: Bundesanstalt für Gewässerkunde • Fang Nr.: Ausgewerteter Fang • FFH-RL: Fauna-Flora-Habitat-Richtlinie • Krd.: Kiemenreusendornen • Lfd. Nr.: Laufende Fangnummer • n: Anzahl der untersuchten Individuen • mdl. Mitt.: mündliche Mitteilung • pj: prozentuale Häufigkeit • s: Standardabweichung • schr. Mitt.: schriftliche Mitteilung • TL: Totallänge • UW: Unterweser • UW-km: Unterweserkilometer • 0+ Gruppe: jünger als ein Jahr, von Geburt bis zu einem Jahr • 1+ Gruppe: einjährige Tiere • x : Mittelwert IV Einleitung 1 1 Einleitung Während der ersten Hälfte des 20. Jahrhunderts gehörte die anadrome Wanderfischart Finte (Alosa fallax, Lacépède, 1803) zu den am stärksten wirtschaftlich genutzten Fischen in Europa (MANYUKAS 1989). Historische Belege und Statistiken des Staatlichen Fischereiamtes in Bremerhaven zeigen, dass die Finte früher auch in der Weser ein häufig gefangener Fisch war (HÄPKE 1878; VON DEM BORNE 1882; LOHMEYER 1906; EHRENBAUM 1921). Die Weserfischer erinnern sich an die sogenannte Finten-Fischerei vor 60 Jahren, in der mit großen Zugnetzen Tonnen von Finten an Land gezogen wurden. Die Bestände sind seitdem stark zurückgegangen und tauchen in den Fangstatistiken ab 1960 nicht mehr auf (SCHUCHARDT et al. 1985; BUSCH et al. 1988). Die Finte geriet weitestgehend in Vergessenheit. Ein paar Zufallsfunde in den Jahren danach lassen jedoch die Vermutung zu, dass Finten bei ihrer frühjährlichen Laichwanderung weiterhin vereinzelt die Weser aufsuchten (SCHEFFEL 1989; SCHEFFEL & SCHIRMER 1991, 1997; SPRENGEL 1997). Der Bestand scheint sich jedoch in den letzten Jahren zu erholen, was durch Aussagen von Berufsfischern gestützt wird. Demnach wandern die Finten seit etwa 10 Jahren wieder vermehrt in die Weser ein. Als europaweit geschützte Art (FFH, Anhang II) zählt die Finte zu den „Arten von gemeinschaftlichem Interesse“, für die nach geltendem EU-Recht im Rahmen des europäischen Schutzgebietssystems NATURA 2000 besondere Schutzgebiete ausgewiesen werden müssen (EU 1992). Die Laichplätze und Aufwuchsgebiete der Larven sind in den Ästuaren zu finden, welche durch anthropogene Nutzungen vielfach stark verformt sind. Dabei entstehen Konflikte bei Ausweisungen von FFH-Schutzgebieten und im Rahmen der Eingriffsregelung. Über den aktuellen Fintenbestand in der Weser ist im Vergleich zur Elbe nur wenig bekannt und bedingt durch den Mangel an populationsdynamischen Daten ist es zur Zeit nicht möglich, den Fintenbestand abzuschätzen und entsprechend den Vorgaben der FFH-Richtlinie gezielt zu schützen. Außerdem können keine Aussagen zum Wander- und Laichverhalten sowie über die Umweltansprüche der Art in der Weser getroffen werden. Einleitung 2 Ziel der Untersuchung Ziel der im Frühjahr/ Sommer 2004 vor dem Hintergrund des geplanten Baus eines Wesertunnels bei Seehausen durchgeführten Untersuchung war es daher, den derzeitigen Status der Finte in der Weser zu ermitteln (Vorkommen und Verbreitung, Wanderverhalten, Laichaktivität und Populationscharakteristik). Im einzelnen sollten folgende Fragestellungen bearbeitet werden: • In welchem zeitlichen und räumlichen Rahmen besiedeln die Finten die Weser? • Wie weit ziehen Finten bei ihrer anadromen Laichwanderung die Weser hinauf? • Nutzt die Finte die Weser als Laichgebiet und wenn ja, unter welchen Bedingungen? • Sind Laichgebiet, Laichzeit und Laichtemperatur zu ermitteln? Lässt sich das Laichverhalten charakterisieren? • Ist die Reproduktion erfolgreich? • Welche Populationscharakteristik weist die Finte in der Weser auf? Die Daten der Arbeit stammen weitestgehend aus den Untersuchungen im Rahmen eines durch die GPV Bremen und dem Senator für Bau, Umwelt und Verkehr geförderten Gutachtens über die Betroffenheit der Fischart „Finte“ (Alosa fallax, LACÉPÈDE) durch die Baumaßnahmen zum Wesertunnel der A 281 im Einschwimm-/Absenkverfahren. Einführung 2 3 Einführung 2.1 Die Finte Der gültige wissenschaftliche Name der Finte lautet Alosa fallax fallax (LACÉPÈDE, 1803), die im weiteren Text nur noch als Finte bzw. Alosa fallax bezeichnet wird. Die erste wissenschaftliche Beschreibung erfolgte 1563 durch GESNER. Die von der Herzog August Bibliothek in Wolfenbüttel abfotografierten Seiten befinden sich im Anhang (A1). In England wird die Finte „Twaite shad“ und in Frankreich „Alose feinte“ genannt (Dänemark: Stavsild, Holland: Fint, Norwegen: Stamsild, Schweden: Staksill) (BAUCH 1966). In der Vergangenheit und zum Teil noch heute trägt sie eine Reihe an Volksnamen, wie z.B. Maifisch, Elf, Elchen, Elben, Taparre, Lachstaparre, Staffhering oder Stümhering, Bode, Boje, Baihde (MOHR 1941), Perpel (BAUCH 1966), Perlep (DE HAAS & KNORR 1990) oder kleiner Maifisch (EHRENBAUM 1921). Da leider in diesem Rahmen nicht auf alle Aspekte dieses Fisches (Abb. 1) näher eingegangen werden kann, soll die Tabelle im Anhang A2 einen Überblick über wichtige Literaturangaben zu verschiedenen Themen geben. Abb. 1: Die Finte; oben laichreifes Weibchen, unten Männchen. Einführung 4 2.1.1 Taxonomie Stamm: Chordata Unterstamm: Vertebrata Überklasse: Gnathostomata Klasse: Osteichthyes Unterklasse: Actinopterygii (Strahlenflosser) Abteilung: Teleostei Unterabteilung: Clupeomorpha Ordnung: Clupeiformes (Heringsfische) Unterordnung: Clupeoidei Familie: Clupeidae (Heringe) Unterfamilie: Alosinae Genus: Alosa Die Finte (Alosa fallax) bildet nach FRICKE (2003, 2004) mit der Alse (Maifisch, Alosa alosa) einen Artkomplex. Beide gehören zur Heringsfamilie (Clupeidae) bzw. zur Unterfamilie Alosinae. Angesichts der morphologischen und meristischen Merkmale sowie aufgrund der Unterschiede im Verhalten werden sie jedoch in dieser Arbeit als zwei eigenständige Arten geführt. Wichtige Unterscheidungsmerkmale sind ausführlich in der Tabelle A3 im Anhang dargestellt, wobei das wichtigste Merkmal die Anzahl der Kiemenreusendornen auf dem ersten Kiemenbogen ist (HASS 1965; BEECK 2003; DOHERTY et al. 2004). Es gab vor allem früher Probleme mit der Verwechslung der beiden Arten. Fallax (lateinisch) bedeutet „täuschend“, welches sich auf die täuschende Ähnlichkeit zum sehr nah verwandten Maifisch bezieht. Besonders bei historischen Quellen ist darauf zu achten, welche Art tatsächlich gemeint ist. In dieser Arbeit wird für die Art Alosa alosa der Name Alse gewählt. Der Name Maifisch wird als Sammelbegriff für beide Arten benutzt sowie wenn aus der Literatur nicht eindeutig hervor geht, welche Art gemeint ist. 2.1.2 Gefährdungskategorien und Schutzstatus In Deutschland wird die Finte in den Roten Listen der in Binnengewässern und Küstengewässern lebenden Rundmäuler und Fische als stark gefährdet eingestuft (BLESS et al. 1998; FRICKE et al. 1998 (Bearbeitungsstand 1994)). In der deutschen Ostsee gilt sie nach FRICKE et al. (1996) sogar als ausgestorben oder verschollen. In Niedersachsen wird sie ebenfalls als stark gefährdet eingestuft, während sie in Bremen als „vom Aussterben bedroht“ gilt. Der hohe Gefährdungsgrad spiegelt sich auch in den Roten Listen der übrigen Bundesländer im ehemaligen Verbreitungsgebiet wider (Hamburg, Nord- Einführung 5 rhein-Westfalen, Mecklenburg-Vorpommern, Hessen). Lediglich in Schleswig-Holstein werden die Bestände als derzeit nicht gefährdet eingestuft (GAUMERT & KÄMMEREIT 1993; STEINMANN & BLESS 2004). Die Finte ist durch die Fauna-Flora-Habitat-Richtlinie der EU (FFH-RL, Anhang II, V) (EU 1992; www.bfn.de) sowie durch die Berner Konvention (vom 19.09.1979, ab 1982 in Kraft getreten): Anhang III (www.conventions.coe.int) geschützt. 2.1.3 Beschreibung und Kennzeichen Der Körper der Finte ist seitlich zusammengedrückt, am Rücken glänzend blau (QUIGNARD & DOUCHEMENT 1991a), teilweise mit tiefgelbem Schein (WHEELER 1975), seitlich und am Bauch silbrig weiß. Der gesamte Körper hat einen metallischen Glanz (QUIGNARD & DOUCHEMENT 1991a). Alle Flossen (Rücken-, Schwanz-, After-, Bauch- und Brustflossen) sind gliederstrahlig und ohne Stacheln. Es ist keine Seitenlinie vorhanden. Der Kiemendeckel ist radiär gestreift, Mundspalte mäßig weit, Oberkiefer bis zum Hinterrand des Auges reichend, Unterkiefer kaum vorragend (MOHR 1941). Es ist eine deutliche mittlere Kerbe im Oberkiefer vorhanden, jedoch keine Zähne auf dem Pflugscharbein (MAITLAND 1983). Hinter dem Kiemendeckel sind 6 bis 10 schwarze, runde Flecken auf den Körperseiten zu erkennen (MUUS & NIELSEN 1999). Diese Zahl kann stark schwanken. Manche Flecken sind undeutlich bzw. sehen verwaschen aus (LADIGES & VOGT 1979; www.pivi.de). Die Augen sind mit unbeweglichen Fettlidern abgedeckt (GERSTMEIER & ROMIG 2003). Der Körper ist bedeckt mit Cycloidschuppen. Die Schuppen sind mittelgroß, dünn und leicht zu entfernen. Sie haben eine runde bis ovale Form und neigen zu einem sechsseitigen Umriss (MOHR 1941). Die Kielschuppen sind auf ganzer Bauchkantenlänge zu finden (DE HAAS & KNORR 1990), sie sind scharf und kräftig (EHRENBAUM 1936). Der Kopf ist ohne Schuppen (LADIGES & VOGT 1979). Die Finten erreichen Längen bis zu 52 cm und werden bis zu 1 kg schwer (MOHR 1941). Wie bereits im vorhergehenden Kapitel angedeutet, eignet sich zur Unterscheidung der beiden Arten Finte und Alse am Besten die Zahl der Kiemenreusendornen auf dem ersten Kiemenbogen. Die Anzahl der Kiemenreusendornen bei Finten liegt bei 35 - 60 (QUIGNARD & DOUCHEMENT 1991a), bei Alsen beträgt die Zahl 90 - 155 (QUIGNARD & DOUCHEMENT 1991b). Genaue Angaben hierzu sowie weitere meristische und morphologische Kennzeichen sowie andere Merkmale im Vergleich zur nah verwandten Alse sind ausführlich in der Tabelle A3 im Anhang zusammengestellt. Die Unterschiede im Verhalten der beiden Arten werden ebenfalls in der genannten Tabelle beschrieben. Da die Angaben in der Literatur zum Teil sehr stark schwanken, werden möglichst viele Angaben für den Vergleich dargestellt. Einführung 6 2.1.4 Vorkommen und Verbreitung von Alosa fallax und deren Unterarten Die Finte hat mit ihren Unterarten (s.u.) eine sehr weite Verbreitung in Europa. Sie kommt entlang der Küsten des Nordostatlantiks und des Mittelmeeres vor, von der Ostsee bis zur Küste von Marokko, einschließlich der Südwestküste Islands, der Britischen Inseln und Irlands (LELEK 1987; WHITEHEAD 1984) (Abb. 2). Abb. 2: Verbreitung von Alosa fallax fallax (Dreieck), Alosa fallax nilotica (Kreis) und Alosa alosa (Stern) in Europa (verändert nach LELEK 1987; WHITEHEAD 1984). Nach QUIGNARD & KARTAS (1977) existieren vier anadrom wandernde Formen im Nordostatlantik und im Mittelmeergebiet: Alosa fallax fallax (Lacépède, 1803): Nordostatlantik (Skandinavien bis Marokko) Alosa fallax rhodanensis (Roule, 1924): westliches Mittelmeergebiet Alosa fallax nilotica (Geoffrey Saint-Hilaire, 1808): östliches Mittelmeergebiet Alosa fallax algeriensis (Regan, 1916): Nordafrikanische Küste. Neben diesen anadromen Formen sind auch nicht wandernde Formen bekannt, die permanent im Süßwasser leben: Dies sind zum einen Alosa fallax lacustris (Fatio, 1890), welche in fünf italienischen Seen vorkommt (Como, Garda, Iseo, Lugano, Maggiore) und zum anderen Alosa fallax killarnensis, welche im Lough Leane, Killarney (Irland) zum ersten Mal von Regan 1911 nachgewiesen wurde. Alosa fallax killarnensis entwickelte sich ursprünglich aus einer Gruppe aufsteigender Finten (Alosa fallax), die entweder freiwillig oder gezwungenermaßen im See blieben. In den italienischen Seen verhielt es sich ähnlich, doch wurde im Gegensatz zur Population im Lough Leane der Bestand immer wieder durch aufsteigende Finten Einführung 7 aufgefrischt (O’MAOILEIDIGH et al. 1988; REGAN 1916; TREWAVAS 1938). Alosa fallax killarnensis kommt neben dem Lough Leane auch im Muckross Lake vor (GRIFFITHS 1997). Aufgrund fehlender Daten lässt sich kein vollständiges und zuverlässiges Verbreitungsbild im Meer und in den einzelnen Flüssen erstellen. Nach APRAHAMIAN et al. (1998) ist die Finte in 14 von 15 EU-Staaten heimisch, ihr werden jedoch in den einzelnen Ländern unterschiedliche Gefährdungskategorien zugeordnet, sodass sie in 4 Ländern sogar als ausgestorben gilt. In den skandinavischen Ländern ist die Finte nicht sehr verbreitet und tritt dort wahrscheinlich nur als Gast auf (QUIGNARD & DOUCHEMENT 1991a). Lediglich für Schweden gibt es einige unsichere Hinweise auf eine Laichpopulation (APRAHAMIAN et al. 2003). Für Dänemark gibt es Nachweise im Limfjorden, Nissum und die Ringköbing Fjorde. Einige Individuen wandern wahrscheinlich noch in folgende Flüsse ein: Flynder, Stora und Skerjn (QUIGNARD & DOUCHEMENT 1991a). In der nördlichen Ostsee ist die Finte während des vorletzten Jahrhunderts selten geworden, im südlichen Teil kam sie dem entgegen häufiger vor (QUIGNARD & DOUCHEMENT 1991a). In den 60er und 70er Jahren des letzten Jahrhunderts wurde dieser Trend bestätigt (PĘCZALSKA 1973). Von MOHR (1941) wurde für die westlichen Ostseeküsten ein regelmäßiges Vorkommen beschrieben (Neustädter Bucht, Trave, Eckernförder und Kieler Bucht). An den östlichen deutschen Ostseeküsten spielte die dort Perpel genannte Finte fischereilich gesehen eine gewisse Rolle. Ende der 90er Jahre schien die Finte in der Ostsee weitgehend verschwunden zu sein (WIKTOR 1989; WINKLER 1991). Seit 10 Jahren sollen die Bestände in der Ostsee wieder zunehmen (WINKLER et al. 2000) und seit 2003 gibt es wieder Nachweise im Oderhaffgebiet (STEINMANN & THIEL 2005). In der Nordsee bzw. in der Deutschen Bucht wurden seit 1978 in 2524 GOV- und Kabeljauhopserfängen insgesamt 6052 Finten gefangen (KLOPPMANN et al. 2003a,b). Von STELZENMÜLLER & ZAUKE (2003) bzw. STELZENMÜLLER et al. (2004) wurden aus diesen Daten beson- ders hohe Fangwahrscheinlichkeiten für die küstennahen Gebiete bzw. für die äußeren Flussmündungen von Ems, Weser und Elbe berechnet. Nachweise gibt es vor allem für die Elbe (HASS 1965, 1968; MÖLLER & DIEKWISCH 1991; THIEL et al. 1996a,b), Weser (SCHEFFEL 1989; SCHEFFEL & SCHIRMER 1991, 1997; SPRENGEL 1997) und Ems (LOHMEYER 1909; GROENEWOLD 2003; L. MEYER, mdl. Mitt. 2005). Für Deutschland gibt es weiterhin Nachweise für das Rheinsystem, in dem sie allerdings sehr selten geworden sind (LOZÁN et al. 1996; BARTL & TROSCHEL 1997; BAUMGÄRTNER 2002a; DE GROOT 2002). Einführung 8 In Schottland gibt es nur wenige Belege (SWEETMAN et al. 1996), doch in Irland und in Südengland ist die Finte vertreten. Dort wandert sie in eine Reihe von Flüssen ein und wird oft entlang der Küsten gefangen (QUIGNARD & DOUCHEMENT 1991a; für Irland: QUIGLEY & FLANNERY 1996; DOHERTY et al. 2004). Laut dem britischen Umweltamt laicht die Finte nur in vier Flüssen: Severn, Wye, Usk und Tywi. Aus der Themse ist sie dagegen verschwunden (APRAHAMIAN et al. 1998; www.environment-agency.gov.uk). In Irland gibt es reproduzierende Fintenbestände in vier Flüssen: Suir, Nore, Barrow, and Munster Blackwater (BRACKEN & KENNEDY 1967; APRAHAMIAN & APRAHAMIAN 1990). Darüber hinaus gibt es Belege für den Fang von Finten im Ästuar des Flusses Slaney von FAHY (1982) und weitere Funde aus Dundalk und Dingle Bucht, Fluss Nanny, Ästuar Ilen und Slaney (BRACKEN & KENNEDY 1967). Bereits vor 1950 ist die Finte in Belgien in den Flüssen Meuse und Escaut verschwunden sowie in Frankreich in der Seine, Aulne und Vilaine (QUIGNARD & DOUCHEMENT 1991a). Auch nach BERVOETS et al. (1990) sind Finte und Alse in den belgischen Flüssen nicht mehr anzutreffen. In der Aa, Loire, Garonne, Dordogne und Adour ist die Finte in Frankreich noch vertreten. Auf der Iberischen Halbinsel kommt Finte und Alse in denselben Flüssen vor: Minho (portugiesisch) oder Mino (spanisch), sowie Lima, Douro, Tajo, Sado und Guadiana (QUIGNARD & DOUCHEMENT 1991a). Die verwandte amerikanische Art Alosa sapidissima (Wilson) kommt entlang der nordamerikanischen Atlantikküste von Kanada bis Florida vor (WHEELER 1975; LIMBURG 2001). Diese Zusammenstellung erhebt nicht den Anspruch auf Vollständigkeit und Aktualität, sondern soll nur einen Einblick in die Vielfältigkeit und weite Verbreitung der Art zeigen. Für die Verbreitung der Unterarten siehe QUIGNARD & DOUCHEMENT (1991a-f) und APRAHAMIAN et al. (2003). 2.1.5 Lebensraum und Lebensweise Die Finte ist eine anadrome Wanderfischart und verbringt den größten Teil ihres Lebens im Meer. Zum Laichen wandert sie als Schwarmfisch in die Flüsse ein (MOHR 1941; APRAHAMIAN et al. 1998). Als euryhaline Fischart ist die Finte in der Lage, ihren Wasserhaushalt den stark voneinander abweichenden Bedingungen im Süß- und Salzwasser anzupassen (SCHEFFEL 1989; www.wissenschaft-online.de/3220). Einführung 9 Über Verhalten und genaue Aufenthaltsorte im Meer ist nur sehr wenig bekannt (APRAHAMIAN et al. 1998). Es wird angenommen, dass Finten als Schwarmfische in den küstennahen Gebieten die höheren und mittleren Wasserschichten aufsuchen (EHRENBAUM 1921; MOHR 1941). Durch neuere Ergebnisse wird bestätigt, dass sich die Finten mit hoher Wahrscheinlichkeit in den küstennahen Gebieten aufhalten (KLOPPMANN et al. 2003b; STELZENMÜLLER & ZAUKE 2003). Die in der Literatur angegebenen Tiefen reichen von 10 - 110 m, mit einer Präferenz von 10 - 20 m (TAVERNY & ELIE 2000; MAITLAND & HATTON-ELLIS 2003) oder aber 200 bis 300 m laut QUIGNARD & DOUCHEMENT (1991a). Demgegenüber sollen sich Finten zumindest zeitweise in größeren Tiefen aufhalten, wie es von der verwandten Art, der Sardelle (Engraulis encrasicholus), bekannt ist. Die meistens stark ausgeprägten Fettlider der Finte könnten ebenfalls als morphologische Anpassung an das Leben in größeren Meerestiefen angesehen werden (EHRENBAUM 1921; MOHR 1941). Auch wenn über den marinen Aufenthalt wenig bekannt ist, ist zu vermuten, dass die Habitatwahl insbesondere durch das Nahrungsangebot gesteuert wird. Demgegenüber stellen die Ästuare der großen Ströme wichtige Teillebensräume dar, zum einen als Sammelort für die Adulten vor dem Laichaufstieg in die Flüsse und zum anderen als Aufwuchsgebiet für die Juvenilen. Während der Wanderungen im Fluss können die meisten adulten Finten im Hauptstrom nachgewiesen werden. In den Randgebieten wurden geringere Abundanzen festgestellt (THIEL et al. 1996a). Nach WURMBACH (1936) erfolgt die Wanderung hauptsächlich in der Strommitte. In der Elbe präferieren juvenile Finten tiefes Wasser, halten sich möglichst weit entfernt vom Ufer auf und meiden Hafengebiete (GERKENS & THIEL 2001). 2.1.6 Lebenszyklus (Reproduktion, Ontogenie) Zu Beginn der Laichzeit (ab April) versammeln sich die adulten Finten in der Nähe der äußeren Ästuare der Flüsse. Die Wanderzeit liegt zwischen Mitte April und Mitte Juni; die Hauptwanderung findet jedoch im Mai statt. Bei einer Wassertemperatur von 10 - 12°C lässt sich die höchste Wanderungsrate feststellen (APRAHAMIAN 1988). In der Elbe wies KÖHLER (1981) ein gehäuftes Auftreten der Finte ab Temperaturen von 11 - 12°C nach. Mit Hilfe der Tide gelangen die Fische in die Flüsse (BRACKEN & KENNEDY 1967). Die ersten Ankömmlinge sind meistens Männchen. In den später eintreffenden Gruppen ist das Verhältnis Männchen/ Weibchen in etwa gleich (QUIGNARD & DOUCHEMENT 1991a). Einführung 10 Die Laichsubstrate sind von Fluss zu Fluss sehr unterschiedlich. In irischen Flüssen z.B. findet das Ablaichen über steinigem Untergrund statt (BRACKEN & KENNEDY 1967), wohingegen in der Garonne über schlammigem Boden in der Nähe der Ufer abgelaicht wird. In den meisten Flüssen ist das Substrat jedoch sandig und kiesig (QUIGNARD & DOUCHEMENT 1991a). Die Laichtemperatur wird für verschiedene Flüsse wie folgt angegeben: 12,7°C (HASS 1968) bzw. 16,4°C (EHRENBAUM 1894) in der Elbe, 15 - 16°C in Nordeuropa (SVETOVIDOV 1963), 16 - 17°C in einem Ostseezufluss (MANYUKAS 1989), 17 - 18°C in der Seine (ROULE 1925) und 18 - 20°C im Rhein (REDEKE 1939). Es gibt Hinweise auf eine positive Korrelation zwischen der Wassertemperatur und der Laichaktivität der Finten. CLARIDGE & GARDNER (1978) wiesen in dem Jahr mit niedrigeren Wassertemperaturen geringere Anzahlen an Finten nach. Dies ist möglicherweise auf eine reduzierte Laichaktivität und/oder auf das spätere Sterben der jungen Finten zurückzuführen. Auch EHRENBAUM (1921) beschreibt einen Zusammenhang zwischen der Wassertemperatur und dem Laichgeschäft. Zum einen scheint die Entwicklung der Geschlechtsorgane von der Temperatur abhängig zu sein und zum anderen benötigen die Eier für die optimale Entwicklung eine Temperatur zwischen 15 und 25°C. Temperaturen unter oder über diesen erwiesen sich als schädlich. Die Hauptlaichzeit liegt im Mai bis Juni (EHRENBAUM 1894; APRAHAMIAN & APRAHAMIAN 2001). Nähere Angaben zur Laichzeit finden sich im Anhang (Tab. A3). Die Gattung Alosa wird als pelagophiler Laicher klassifiziert (BALON 1964, 1975). Während des nächtlichen Laichvorgangs wird von lauten Geräuschen (Plätschern) berichtet (SCHWOLERT 1891; EHRENBAUM 1894; MOHR 1941). Die nicht klebrigen Eier der Finte werden im Ästuar ins freie Wasser (Brackwasser oder Süßwasser) abgelegt (BALON 1975; QUIGNARD & DOUCHEMENT 1991a). Die Alse wandert dagegen die Flüsse weiter hinauf und laicht in der Regel oberhalb der Gezeitenzone (DE GROOT 2002). Durch Wasseraufnahme und Ausbildung eines großen perivitellinen Raumes quellen die 1,6 mm großen Eier sehr schnell bis zu 4,6 mm auf (MOHR 1941). Die Schwimmfähigkeit der Eier ist auf den großen perivitellinen Raum, den wässrigen Dotter sowie auf die kleinen enthaltenen Öl-Kügelchen oder Filamente zurückzuführen (BALON 1975). Das Ei erscheint nach der Befruchtung als große wasserhelle Kugel. In ihr ruht die etwas hellgelb gefärbte Dotterkugel (MOHR 1941). Sie sind nur wenig schwerer als Wasser und bleiben so in der Bodenwasserschicht schwebend. In der Elbe können sie, abhängig von den Konditionen im Fluss, eine Einführung 11 Höhe vom Boden aus von 2,5 bis 9,5 m in der Wassersäule erreichen. Der größte Teil befindet sich jedoch in der Wasserschicht von 0 bis 2,5 m über dem Grund (HASS 1968). Durch Strömung und Tidenbewegung findet eine Verdriftung der Eier statt. So können sie in der Elbe vom Hauptlaichgebiet jeweils in beide Flussrichtungen ca. 20 - 30 km weiter verdriften (HASS 1968). Die Inkubationszeit ist sehr kurz, bereits nach 3 - 5 Tagen schlüpfen die Larven (0+ Gruppe) aus ihren Eiern, wobei die Temperatur höher als 17 - 18°C sein sollte (ANONYMUS 2005a). Die Inkubation und das Ausschlüpfen aus den Eiern variieren mit der Temperatur (EHRENBAUM 1894; APRAHAMIAN et al. 2001). Die adulten Tiere ziehen nach dem Ablaichen wieder ins Meer (APRAHAMIAN et al. 1998; QUIGNARD & DOUCHEMENT 1991a). Für die einzelnen Stadien der Larvalentwicklung sowie deren Wachstum wird auf EHRENBAUM (1894) verwiesen: Die frisch geschlüpfte Larve ist 4,25 mm groß; nach ca. einer Woche ist bei 8 - 9 mm nur noch ein Rest des Dottersackes vorhanden. Bereits nach ca. 2 Monaten werden sie bei 33 - 47 mm als Jungfische bezeichnet. Im Herbst sind die Jungfische auf 7 - 8 cm herangewachsen. Die geschlüpften Larven halten sich für unbestimmte Zeit im Fluss auf, bevor sie allmählich seewärts wandern. Nach CLARIDGE & GARDNER (1978) ist dies temperaturbedingt. Ab einer Temperatur von 9°C werden im Fluss keine juvenilen Finten mehr nachgewiesen. Es gibt Hinweise darauf, dass die juvenilen Finten in ihrem ersten Jahr im Ästuar überwintern (BRACKEN & KENNEDY 1967; CLARIDGE & GARDNER 1978). Die Wanderung ins offene Meer findet eventuell erst während oder gegen Ende des zweiten Winters statt. Die Jungfische erreichen gegen Ende des ersten Jahres Längen von 10 - 18 cm (WURMBACH 1936) und werden dann in die 1+ Gruppe eingeteilt. Die Fische kehren erst nach Erreichen der Geschlechtsreife zurück, um in den Flüssen zu laichen (BRACKEN & KENNEDY 1967). Es gibt aufgrund von unterschiedlichen meristischen, äußeren Kennzeichen zwischen Populationen verschiedener Flüsse Hinweise auf ein Heimkehrverhalten in die Geburtsflüsse (QUIGNARD & DOUCHEMENT 1991a; APRAHAMIAN et al. 1998, 2003), besonders für die verwandte amerikanische Art Alosa sapidissima (WATERS et al. 2000; WALDMAN 2001). Finten laichen mehrfach in ihrem Leben (Iteroparie) (HASS 1965; APRAHAMIAN et al. 1998, 2001; HILLMAN 2003; MAITLAND & HATTON-ELLIS 2003). Der größte Teil der Alsen hingegen laicht in der Regel nur einmal in ihrem Leben (Semelparie) (BAGLINIÈRE et al. 2001; HILLMAN 2003). Einführung 12 2.1.7 Nahrung Aus vielen Literaturangaben geht hervor, dass die adulten Finten während ihres Laichaufstiegs in die Flüsse keine Nahrung zu sich nehmen (BRACKEN & KENNEDY 1967; CLARIDGE & GARDNER 1978; WHEELER 1978; MAITLAND & HATTON-ELLIS 2003). Einige Autoren wie z.B. APRAHAMIAN (1989) vertreten die Ansicht, dass die Finten erst nach dem Ablaichen wieder Nahrung zu sich nehmen. Zu den wichtigsten Nahrungsorganismen gehören Mysidaceen (Neomysis integer), Gammariden (Gammarus zaddachi), Garnelen (Crangon crangon) und gelegentlich Vertreter aus der Gruppe der Fische (Flunder: Platichthys flesus L., Sprotte: Sprattus sprattus L.). Ergänzt werden diese Angaben durch ASSIS et al. (1992): Bevorzugte Nahrungsorganismen sind demnach verschiedene Fischarten, erst in zweiter Präferenz dagegen Makroinvertebraten wie Neomysis integer, Crangon crangon, verschiedene Isopodenund Insektenlarven sowie Detritus. Im Meer ernähren sich adulte Finten von Fischen und Crustaceen (QUIGNARD & DOUCHEMENT 1991a). Die zur 0+ Gruppe gehörenden Individuen ernähren sich im Süßwasser vorzugsweise von Insektenlarven, später im äußeren Ästuar nehmen sie auch Copepoden, Mysidaceen und Gammariden zu sich. Die Nahrung der 1+ Gruppe setzt sich aus folgenden Bestandteilen zusammen: Gammariden, Copepoden, Fischeier, Mysidaceen und kleine Fische (APRAHAMIAN 1989). Die Arbeit von OESMANN & THIEL (2001) weist jahreszeitliche und tägliche Schwankungen in der Nahrungsaufnahme juveniler Finten in der Elbe auf. Copepoden, Mysidaceen (Neomysis integer, Mesodopsis slabberi) und Fische (Sprattus sprattus, Osmerus eperlanus und Pomatoschistus spec.) wurden als Hauptnahungsbestandteile identifiziert. Cladoceren werden je nach Verfügbarkeit aufgenommen, wohingegen jegliche andere Nahrung eher gemieden wird. Zusammenfassend lässt sich sagen, dass die Nahrungsaufnahme von der Beuteverfügbarkeit abhängt. Aus diesem Grund sind die oben beschriebenen unterschiedlichen Präferenzen der Nahrungsorganismen der einzelnen Autoren zu erklären. Einführung 13 2.1.8 Brisanz und Aktualität: Warum ist dieser Fisch so interessant geworden? Wanderfische wie die Alse und die Finte gelten heute in ganz Europa als hochgradig gefährdet. Durch die FFH-RL und die Berner Konvention ist die Finte, die vorher rechtlich nur ein fischereiliches Nutzungsgut war, zu einem Schutzgut geworden (FRICKE 2004). Dies ist nun besonders bei baulichen oder anderen Eingriffen in die Lebensräume dieser Art zu berücksichtigen. Verschiedene Meldungen aus Tageszeitungen (von Ende 2003 bis Mitte 2004) zeigen die Brisanz und Aktualität des Themas (Abb. 3): Abb. 3: Meldungen von 3 Taz-Artikeln: Ein Fisch namens Finte (TAZ NORD BREMEN 2003), Vorsicht, Finte! (TAZ BREMEN 2004), Finte torpediert Windkraft (TAZ NORD 2004). Darüber hinaus wurde im Jahr 2004 der Maifisch (Alse) vom Verband Deutscher Sportfischer e.V. (VDSF) zum Fisch des Jahres gewählt (DÜVER 2003). In anderen europäischen Ländern (ausgenommen Frankreich) ist die Finte deutlich seltener als in Deutschland. Nach FRICKE (2004) hat Deutschland daher zusammen mit Frankreich eine globale Verantwortung für diese Art und muss besondere Anstrengungen für ihren Schutz unternehmen. In Großbritannien und in Frankreich wurden für Alse und Finte bereits mehrere FFH-Schutzgebiete ausgewiesen sowie Schutz- und Entwicklungsziele formuliert, die auch für andere Staaten als vorbildlich gelten können (Großbritannien: HILLMAN et al. 2003; Frankreich: ANONYMUS 2005a). In Deutschland muss nun über den Vorschlag von Schutzgebieten hinaus, ebenfalls Schutz- und Entwicklungsziele erarbeitet werden (FRICKE 2004). Dabei sind für jedes Gebiet derartige Ziele zu formulieren und an die EU weiterzugeben. Einführung 14 2.2 Das Untersuchungsgebiet 2.2.1 Die Unterweser Die Weser ist vom Zusammenfluss ihrer beider Quellflüsse Werra und Fulda ca. 480 km lang. Sie lässt sich in Ober-, Mittel- und Unterweser unterteilen und mündet in der durch das Wattenmeer verlaufenden Außenweser in der Nordsee. Die Unterweser (UW) ist mit 68 km Länge der tidebeeinflusste Teil der Weser und stellt das Untersuchungsgebiet dar (Abb. 4). Sie gliedert sich in einen limnischen und einen brackigen Teil, wobei die Brackwassergrenze je nach Tidezyklus und Oberwasserablauf um den UW-km 50 pendelt (ARGE WESER 1993; SCHIRMER 1996). Die Weser führt oberhalb der Huntemündung (UW-km 35) in der Regel Süßwasser mit anthropogen leicht erhöhtem Salzgehalt durch Einleitungen in Werra, Ober- und Mittelweser (SCHRÖDER et al. 1983; SCHIRMER & SCHULZE 2005). Die Weser weist etwa einen Salzgehalt von 1,5 ‰ und bei Bremerhaven 5 bis 18 ‰ auf (SCHIRMER 1991). Die Außenweser erreicht nach 60 km die Seegrenze. Unter- und Außenweser bilden zusammen das Weserästuar (ARGE WESER 1993; SCHIRMER 1996). Abb. 4: Übersichtskarte der Unterweser. Nach der Definition von FAIRBRIDGE (1980) umfasst das Ästuar den gesamten unter Tideeinfluss stehenden Bereich eines ins Meer mündenden Flusses und lässt sich demnach in drei Abschnitte gliedern: Einen marinen Teil mit freier Verbindung zum Meer, eine brackige Vermischungszone und einen tidebeeinflussten Süßwasserbereich. Der als Unterweser bezeichnete Abschnitt beginnt beim Weserwehr in Bremen-Hemelingen und endet bei der Geestemün- Einführung 15 dung in Bremerhaven. Die Unterweserkilometrierung erfolgt historisch bedingt erst 4,5 km flussabwärts bei der Wilhelm-Kaisen-Brücke mit UW-km 0 (ARGE WESER 2001). Die noch geltende Solltiefe beträgt 9 m unter Seekartennull (SCHIRMER 1994). Der mittlere Tidehub in Farge liegt bei 3,8 m (in Vegesack 4,0 m und am Weserwehr 4,1 m). Dieser starke Tidehub bedingt hohe Strömungsgeschwindigkeiten, die bis zu 100 cm/s erreichen. Die Flusssedimente sind überwiegend sandig (Mittel- und Grobsand), lediglich an strömungsgeschützten Stellen und im Bereich von Querschnittserweiterungen (z.B. Wendeplätze, Huntemündung) lagern sich organikreiche, schlammige Sedimente ab (SCHIRMER & SCHULZE 2005). Die Gewässergüte der Weser wird mit II - III („kritisch belastet“) eingestuft (FGG WESER 2003). Fließgewässer werden aufgrund ihrer Fischlebensgemeinschaften und sogenannter Leitfischarten in Fischregionen unterteilt. Von der Quelle bis zur Mündung ins Meer werden die Obere und untere Forellen-, Äschen-, Barben-, Brassen- und Kaulbarsch-/Flunderregion unterschieden (THIENEMANN 1925; LILLELUND 1963; SCHÖNBORN 1992). Die Leitfischarten dominieren im Idealfall biomassemäßig und halten sich aufgrund ihrer besonderen Ansprüche (z.B. Strömungsgeschwindigkeit, Wassertemperatur, Sauerstoffgehalt) bevorzugt in bestimmten Abschnitten des Flusses auf. Ihnen beigeordnet sind Begleitfischarten, die häufig, aber nicht immer, zusammen mit den Leitfischarten vorkommen. Fischbiologisch lässt sich die Unterweser der Kaulbarsch-/Flunderregion zuordnen. Typische Begleitarten sind Stint, Aal, Dreistachliger Stichling und Finte (BAUCH 1955; ARGE ELBE 1995). Der Beginn der Kaulbarsch-/Flunderregion wird am Wehr in Hemelingen angenommen, beginnt aber wohl tatsächlich erst in seiner charakteristischen Ausprägung im Brackwasserbereich. In der Regel kommen bis in diesen Bereich, zwar mit abnehmendem Anteil an der Gesamtpopulation, Vertreter der Brassenregion vor (BUSCH et al. 1982). In der stromauf liegenden Brassenregion kommen neben der Leitfischart u.a. die Arten Rotauge, Ukelei, Flussbarsch und Zander vor (FRENZ 2003). In der Vergangenheit wurde die Unterweser stark durch den Menschen geprägt und musste ihren natürlichen Charakter weitgehend einbüßen. Der Ausbau zur Schifffahrtsstrasse und die damit verbundenen Umschlagseinrichtungen sowie die Ansiedlung großer Industriebetriebe führten zu einer starken Belastung des Flusses. Weitere Belastungen sind das Einleiten von Abwässern aus Kläranlagen, Gewerbe- und Industriebetrieben und Kraftwerken (BUSCH et al. 1989; ARGE WESER 1993). Durch den Ausbau zum Schifffahrtsweg ist die Unterweser zu einem tiefen, schmalen Kanal geworden (SCHUCHARDT et al. 1989). Sie gilt als einer der am stärksten ausgebauten Flussunterläufe weltweit (CLAUS et al. 1995). Die vielfältigen anthro- Einführung 16 pogen bedingten Veränderungen des Flusslaufes sowie die Belastungen haben auch starken Einfluss auf die Fischfauna ausgeübt, die sich in Anzahl und Zusammensetzung deutlich von der historischen Fischfauna unterscheidet. 2.2.2 Historische Nachweise der Finte in der Weser Nach VON DEM BORNE (1882) waren Alse und Finte zur Wanderzeit häufig gefangene Fische und traten besonders in der Unterweser oft massenhaft auf. Der Maifischfang auf der Weser wurde von den Fischern mit vielfältigen Methoden ausgeübt. Tausende von Metern wurden mit Netzen entlang der Strände abgesperrt oder es wurde mit Treibnetzen vom Boot aus den Fischen nachgegangen (ANONYMUS 1898). In der Weser wurde früher sogar ein spezielles reusenartiges Fanggerät zum Fang von Maifischen eingesetzt: „Maifischkorb“ oder „Maifischwehr“ (MOHR 1941; SCHNAKENBECK 1953; NOLTE 1976; SCHUCHARDT et al. 1984). Laut HÄPKE (1878) stieg die Alse im April, Mai und Juni bis Hameln auf, was auch von VON DEM BORNE (1882), LOHMEYER (1909) und NOLTE (1976) bestätigt wird. In der Leine soll sie bis Neustadt am Rübenberge (WITTMACK 1875) gewandert sein. Nach MARSHALL (1895) stieg der Maifisch bis in die Werra und Fulda auf. Vorkommen der Finte wurden in den damals verschickten Fragebögen (HÄPKE 1878) zur Bestandsaufnahme der verbreiteten Fische nur von drei Fischspezialisten bzw. von einem Tierarzt benannt. Demnach kam sie in der mittleren Weser bis Hameln vor, sowie im Gebiet der Weser und Hunte des Großherzogtums Oldenburg. In den Gewässern des Bremer Gebietes Weser, Wümme und Ochtum waren beide Maifischarten ebenfalls bekannt. Nach Ansichten des Autors wird sie an anderen Orten übersehen. Nach heutigem Kenntnisstand ist es durchaus möglich, dass nur die Alse die Weser so weit flussaufwärts wanderte und die Finte bereits nach kürzerer Wanderdistanz in den Unterläufen der Flüsse blieb. In HÄPKE’S Werk (1878) werden einige Autoren genannt, die das Vorkommen der Finte in der Weser anzweifeln, während andere Autoren sie dagegen als beständigen Gast ansehen. 2.2.3 Gefährdung und Bestandsentwicklung von Finte und Alse in der Weser Der Ausbau der Weser hat gravierende Auswirkungen auf die Fischbestände gezeigt, wodurch auch die früher so blühende Flussfischerei stark eingeschränkt wurde bzw. lokal aufgegeben werden mußte (BUSCH et al. 1982, 1984). Nach SCHUCHARDT et al. (1985) wird der Rückgang des Alsenbestandes in die Zeit bis 1920 datiert. Bereits 1900 wurde in der Fischereizeitung über den mäßigen Maifischfang berichtet Einführung 17 (ANONYMUS 1900). Der Rückgang dieser Art ist hauptsächlich auf den Bau der Wehre, die den Laichaufstieg verhindern, zurückzuführen (LELEK 1976; SCHUCHARDT et al. 1985). Hierbei sei besonders das Wehr in Hemelingen (seit 1912) erwähnt, welches auch den Aufstieg von Lachs, Stör und anderen Fischarten nahezu vollständig verhinderte. Die Nachfrage nach Fischen stieg durch das zu dieser Zeit auftretende Bevölkerungswachstum und durch den Staueffekt vor den Wehren konnten die Fische noch einfacher aus dem Fluss gefischt werden. Aus den Fangstatistiken des Staatl. Fischereiamtes Bremerhaven geht hervor, dass die Fänge der Alse ab 1940 drastisch zurückgingen. Zu dieser Zeit wurden Alse und Finte zusammen unter Maifisch geführt. Trotzdem ist sicher, dass der Bestandsrückgang der Alse in dieser Zeit erfolgte. Die Beeinflussung durch Verschmutzung zu dieser Zeit ist eher punktuell anzusehen. In der Zeit von 1920 - 1945 tauchte die Finte unter den genutzten Arten in den Fangstatistiken auf (SCHUCHARDT et al. 1985). Die hohen Fangzahlen in diesen Jahren wird von BUSCH et al. (1982) auf die Verbesserung der Effektivität der Fangmethoden sowie auf die Intensivierung der Fischerei zurückgeführt. Für die Zeit von 1945 bis 1955 fehlen Fangdaten. Die Artenzusammensetzung wird jedoch als gleich angenommen. Ab 1955 wurden eine Reihe von Veränderungen und Eingriffe in dem Ökosystem durchgeführt: der Ausbau der Weser bis auf 8,7 m, eine starke Zunahme des Schiffverkehrs, Ansiedlung neuer Industriebetriebe, eine sprunghafte Erhöhung des Salzgehaltes, ein Zuwachs der Einwohnerzahl sowie eine Zunahme der Belastung des Flusses durch eingeleitete Abwässer. In dieser Phase ging der Bestand der Finte drastisch zurück, ab 1960 wird diese Art nicht mehr in der Fangstatistik geführt (SCHUCHARDT et al. 1985). Die Ursache könnte im Sauerstoffmangel des Wassers, hervorgerufen durch eingeleitete Abwässer und Abwärme, liegen (NOLTE 1976; SCHIRMER et al. 1983). Dieser Verdacht erhärtet sich auch dadurch, dass die früheren Laichplätze der Finte in dem Flussabschnitt zwischen Brake und Bremen lagen, der am meisten durch die Abwässer der Städte Bremen und Delmenhorst belastet war (NOLTE 1976). Der 8,7 m-Ausbau der Weser wird nicht als Ursache für das Zurückgehen der Finte angenommen, da die vorangegangenen Ausbauten die Weser weit mehr veränderten. Der Finte ist es, wie den Arten Stint und Kaulbarsch, möglich auch nach den Ausbauten in der kanalisierten Unterweser zu laichen (SCHUCHARDT et al. 1985). Die Fänge der Finte sanken von 96.000 kg im Jahr 1938 auf 38.000 kg im Jahr 1950 bis auf nur noch 1000 kg im Jahre 1960 (NOLTE 1968). Im Rhein endete die Fischerei auf Alsen im Jahr 1910. Die Fischerei auf Finten, die erst danach für den kommerziellen Fang interessant wurde, endete dagegen erst 1966. Die Gründe hierfür sind nicht nur die Fischerei, sondern auch die Flussvertiefungen mit all ihren Konse- Einführung 18 quenzen und vor allem die Wasserverschmutzung (eventuell Verschlammung oder toxische Substanzen) (DE GROOT 1990, 2002). In der Elbe ist Vergleichbares zu beobachten. Dort konnte eine elbabwärts gerichtete Verlagerung des Laichgebietes festgestellt werden, welches auf die zunehmende Belastung des Wassers zurückgeführt wurde (WILKENS & KÖHLER 1977). Eine verbesserte Wasserqualität der Elbe seit 1990 (PETERMEIER et al. 1996) konnte sich wiederum in einer stromaufwärts gerichteten Verlagerung des Hauptlaichgebietes auswirken (THIEL et al. 1996a). Im Vergleich zu HASS (1968) ergab sich eine 20 km elbaufwärts gerichtete Verlagerung des Hauptlaichgebietes. Durch eine geringere Wasserverschmutzung ist es den Fischen wieder möglich weiter flussaufwärts zu wandern. Heute liegen die Laichgebiete der Finte wieder dort, wo sie schon um 1900 lagen und von EHRENBAUM (1894) und MOHR (1941) beschrieben wurden (THIEL et al. 2000; GERKENS & THIEL 2001). Für die Alse hingegen führten schon die ersten Ausbaumaßnahmen von 1818 - 1825 in der Elbe zu einem deutlichen Rückgang und lassen nach LOZÁN (1990) den Schluss zu, dass die Alse dort schon Anfang des 20ten Jahrhunderts ausgestorben war und zu dieser Zeit mit der Finte verwechselt wurde. Auch in der Themse ist die Finte eher durch die Verschlechterung der Wasserqualität als durch den Bau der Wehre zurückgegangen. Es wird noch von großen Mengen an Finten nach dem Bau der Wehre (1811 - 1815) berichtet (APRAHAMIAN & APRAHAMIAN 1990). Die Finte wird von MANYUKAS (1989) und MAITLAND & HATTON-ELLIS (2003) gegenüber Wasserverschmutzung als sehr empfindlich eingestuft und BLESS (1979) berichtet, dass die Larven des Maifisches keine ausgebildeten Respirationsorgane haben und somit an einen hohen Sauerstoffgehalt gebunden sind. Die Sauerstoffverhältnisse in der Weser haben sich seit der Inbetriebnahme von wirksameren Kläranlagen mit biologischen Reinigungsstufen sehr verbessert. Die früher durch die Einleitungen von Abwässern verursachten Sauerstofflöcher bleiben nun weitgehend aus (KÜHLE et al. 1989; SCHIRMER 1991) und der Sauerstoffgehalt stellt für die Fische keinen kritischen Faktor mehr dar (BUSCH et al. 1988). Hinzu kommt der Rückgang der Salzfracht aus den neuen Bundesländern seit 1990 (FREIE HANSESTADT BREMEN 1995). Vermutlich infolge der verbesserten Wasserqualität (FREIE HANSESTADT BREMEN 1995; WA UNTERWESERBERICHT 1999) wandern die Finten nach Aussagen der Berufsfischer ULRICH WILLIG und WOLFGANG WINKELS seit etwa 10 Jahren wieder vermehrt in die Weser zum Laichen ein. Dies deckt sich auch mit den Pressemitteilungen der Bundesforschungsanstalt für Fischerei (Hamburg), in denen berichtet wird, dass die Finte seit 1990 wieder häufiger in der Deutschen Bucht anzutreffen ist (www.bfa.fish.de; KLOPPMANN et al. 2003a). Material und Methoden 3 19 Material und Methoden 3.1 Methodisches Vorgehen Die gesamte Probenahme zur Erfassung der Finten, ihrer Eier, Larven und Jungfische fand in der Zeit vom 29. April bis zum 13. August 2004 statt. Das Untersuchungsgebiet reichte von UW-km 7 bis 57. Aufgrund der bis dahin herrschenden Unkenntnis über die Population wurden verschiedene Methoden eingesetzt, die räumlich und zeitlich breit angelegt waren (Tab. 1, für genauere Angaben siehe A4 im Anhang). Da die Probenahmen teilweise eng verknüpft mit dem in der Einleitung genannten Gutachten standen, waren mehrere Personen an den Arbeiten beteiligt, die hier genannt werden sollen: Rüdiger Droste, Uwe Haesloop, einige Mitglieder der Arbeitsgruppe Aquatische Ökologie sowie Lars Jaquet und weitere Freunde. Zum Fang von einjährigen und adulten Finten (Altersklasse 1+ bzw. 2+ und älter) wurden in Zusammenarbeit mit einem Berufsfischer Hamenfänge durchgeführt. Mit Hilfe nächtlicher Lauschfahrten auf der Weser wurde das Laichgebiet der Finte näher identifiziert sowie mittels Eier- und Larvenfängen (Altersklasse 0+) die erfolgreiche Reproduktion überprüft. Tab. 1: Probenahmeplan. Methode Datum UW-km 29.04.04-13.08.04 20,5-46 Treibnetz 17.05.04 9-12 Reusen 17.05.04-11.06.04 11 Befragungen 29.04.04-13.08.04 9-29 07.05.04-01.06.04 9-30 Kescher 19.05.04-08.06.04 12-28 Dredge 31.05.04-08.06.04 8-25,5 Hamen 12.05.04-13.08.04 20,5-46 Kescher 11.05.04-29.07.04 9-57 Dredge 05.06.04-08.06.04 8-25,5 Larvennetz 28.06.04-08.07.04 7-53,5 Adulte und Einjährige Hamen Lauschfahrten Kontrollgänge- und Ausfahrten Eier Larven Material und Methoden 20 3.2 Hamenfänge Zur Bestandserhebung der adulten und einjährigen Finten kam der Kutter „Margrit“ des Besitzers Ulrich Willig, Bremerhaven zum Einsatz (Abb. 5). Es handelt sich um einen sogenannten Anker- bzw. Steerthamen, der von Bord des verankerten Kutters eingesetzt wird. Der Hamen wird quer zum Tidenstrom ausgesetzt und das Netz wird durch die Strömung fängig gehalten. Der Hamen ist damit ein feststehendes Fanggerät, welches den Vorteil hat, dass die Fische durch die Strömung in das Netz hineingetrieben werden, ohne dass sich das Schiff selber fortbewegen muss. Ein Ober- und ein Unterbaum halten das Netz offen, wobei der Oberbaum meist an der Wasseroberfläche und der schwerere abgesenkte Unterbaum das Netz straff spannen, so dass seitliche senkrechte Obstantelbäume nicht mehr nötig sind (SCHNAKENBECK 1953; MÖLLER 1988). Es wurde mit einem Hamen von 153 m2 Öffnungsfläche gefischt (17 m Breite und 9 m Höhe). Während der Befischung befand sich der Oberbaum an der Wasseroberfläche. Die Gesamtlänge des Netzes betrug 54 m und wies in verschiedenen Bahnen unterschiedliche Maschenweiten auf, die sich zum Steert hin von 50 mm auf 6 mm verjüngt (Abb. 5). Abb. 5: Fangnetz mit Angabe der einzelnen Maschenweiten in mm (links), Kutter „Margrit“ (rechts). Die Ausfahrten mit dem Hamenkutter fanden in unregelmäßigen Abständen im Zeitraum vom 29.04. bis 13.08.2004 statt, wobei maximal eine Woche zwischen den einzelnen Auswertungen lag. Meistens fanden mehrere Auswertungen pro Woche statt (A4 im Anhang). In der Regel wurde das Netz spätestens eine Stunde nach Tidenwechsel ausgesetzt und eine Stunde vor Tidenwechsel, jedoch immer vor Stauwasser, eingeholt. Die mittlere Fangdauer Material und Methoden 21 betrug etwa drei Stunden. Die Hamenfänge wurden an fünf Stationen der Unterweser mit unterschiedlichem Fangaufwand durchgeführt (insgesamt 49 Hols, Lfd. Nr.). Die am weitesten flussauf liegende Station war Blumenthal (UW-km 20,5; mit 3 Hols), darauf folgen Farge (UW-km 28/29; mit 35 Hols), Harriersand (UW-km 35; 2 Hols), Sandstedt (UW-km 44; 1 Hol) und Rechtenfleth (UW-km 46; 8 Hols). Die Wahl der Tidephase, die Fangzeit und der genaue Fangplatz lag in den meisten Fällen im Ermessen des Fischers. Da meteorologische und hydrographische Faktoren (z.B. Windstärkeund -richtung, Strömungsgeschwindigkeit und -richtung, Oberwasserabflussmengen) berücksichtigt werden mussten, konnte nicht immer exakt am gleichen Ort gefischt werden. Bei allen Stationen handelt es sich jedoch um traditionelle Fangplätze, die vom Fischer schon seit Jahren aufgesucht werden und nur geringfügig variieren. Im Fall des Hauptfangortes Farge wurde bis auf wenige Ausnahmen über die Ebbphase am Ostufer (UW-km 28) und während der Flutphase am Westufer (UW-km 29) gefischt. Grundsätzlich wurde nie mitten im Strom, sondern außerhalb des Fahrwassers, ca. 50 m vom Ufer entfernt, gefischt. Die Fänge fanden bis auf wenige Ausnahmen tagsüber statt. Anhand der Auswertung der Hamenfänge kann die Einwanderung der laichbereiten Finten frühzeitig erkannt werden sowie die Abwanderung der abgelaichten Tiere erfasst werden. Die Hamenfischerei diente so als Signalgeber. Durch die Beobachtung der Entwicklung der Fintenzahlen in den Fängen konnte frühzeitig und gezielt der Zeitpunkt des Beginns der Lauschfahrten sowie der Eier- und Larvenfänge festgelegt werden. 3.3 Auswertung und Bearbeitung der Hamenfänge Insgesamt konnten 49 Hols (Lfd. Nr.) berücksichtigt werden, wovon 27 Hols (Fang Nr.) vollständig ausgewertet wurden. Für nicht vollständig ausgewertete Hols ist nur Zahlenmaterial der gefangenen Finten vorhanden. Die Einteilung in adulte und einjährige Finten wurde nach folgenden Gesichtspunkten durchgeführt: Alle gefangenen Tiere, die > 25 cm und deutlich einem Geschlecht zuzuordnen waren, wurden als adult bezeichnet. Zur Untersuchung gelangten demnach 480 adulte Finten, welche gleich an Bord des Kutters ausgewertet wurden. Aus organisatorischen Gründen konnten nicht bei allen Individuen jeweils auch alle 7 populationsbiologische Parameter (Länge, Gewicht, Anzahl der Kiemenreusendornen, Anzahl der Punkte, Geschlecht, Laichreife, Mageninhalt) aufgenommen werden. Die genaue Anzahl der untersuchten Individuen (n) für jeden einzelnen Parameter sind in Tab. 2 angegeben. Von den einjährigen Finten (1+ Gruppe) wurden ca. 500 Tiere gemessen und gewogen. Bei ca. 60 Tieren wurden außerdem die Kiemenreusendornen gezählt. Material und Methoden 22 Tab. 2: Anzahl der untersuchten Individuen (n) der einzelnen Parameter. Länge Gewicht Kiemenreusendornen Punkte Geschlecht Laichzustand Mageninhalt Adulte 480 477 389 440 480 480 443 Einjährige 958 454 63 3.3.1 Längen- und Gewichtsbestimmung Alle untersuchten Tiere (n = 480) wurden längenvermessen (Totallänge, vom Kopf bis zum Ende der unteren Hälfte der Schwanzflosse). Die Längenmessung erfolgte auf 1 cm below. Mit Hilfe der Längenmessung können eventuell Hinweise auf die Altersstruktur abgeleitet werden. Die Finten wurden mit einer Küchenwaage grammgenau gewogen. Es wurde das Feuchtgewicht von 477 Tieren bestimmt. 3.3.2 Anzahl der Kiemenreusendornen Für die Auswertung des Merkmals „Kiemenreusendornen“ wurden Daten von 389 adulten Finten zugrunde gelegt. Die Zählung der Reusenfortsätze erfolgte am herauspräparierten ersten Kiemenbogen; in den meisten Fällen an der rechten Seite. Es wurden alle Kiemenreusenfortsätze berücksichtigt. 3.3.3 Anzahl der Punkte Bei 440 Finten wurden nach Beseitigung der Schuppen die schwarzen Flecke hinter dem Kiemendeckel gezählt. Die Schuppenentfernung erfolgte, da unter ihnen in den meisten Fällen noch weitere Flecke sichtbar wurden. 3.3.4 Geschlechtsbestimmung Von allen untersuchten Finten (n = 480) wurde das Geschlecht bestimmt. Das Geschlecht einer Finte ist aufgrund des vorliegenden Sexualdimorphismus in den meisten Fällen schon äußerlich erkennbar. Die Weibchen sind meistens die größeren Tiere. Zusätzlich sind die Weibchen oft an den runderen, dicken Bäuchen erkennbar, die aufgrund der Vergrößerung der Ovarien bei vollreifen Weibchen fast den gesamten Bauchraum ausfüllen. Erkennbar ist das Geschlecht außerdem während der Laichzeit, da die Geschlechtsprodukte bei den vollreifen (fließenden) Finten schon auf schwachen Druck hin austreten. Zusätzlich wurde zur Sicherheit die Bauchhöhle geöffnet, damit die Geschlechtsorgane erkennbar waren. Anhand der Go- Material und Methoden 23 naden, also der männlichen Hoden (Testis) oder weiblichen Eierstöcke (Ovarien) konnte die Geschlechtsbestimmung eindeutig erfolgen. 3.3.5 Ermittlung der Laichreife Die Entwicklung der Geschlechtsorgane ist ein kontinuierlicher Prozess. Um den Anteil geschlechtsreifer Tiere zu einem bestimmten Zeitpunkt besser einschätzen zu können, ist es jedoch sinnvoll die Entwicklung in Stadien einzuteilen. Dabei wurde geprüft, ob bei Druck auf die Leibeshöhle der einzelnen Fische (n = 480) die Laichprodukte (Milch oder Rogen) aus der Geschlechtsöffnung flossen. Die Laichreife wurde dann in folgende drei Kategorien eingeteilt: • „nicht fließend“ • „fließend“ • „abgelaicht“. Zur Einschätzung des Reifegrades wurden zusätzlich makroskopische Kriterien genutzt. Besonders bei den vollreifen bzw. bereits abgelaichten Finten sind auffällige äußerliche Merkmale zu erkennen. Dazu gehören bei den Männchen die weiße Färbung der Testis mit zum Teil erkennbaren rötlichen Flecken (Blutergüsse), die weichliche Konsistenz der Testis und der extrem aufgeweitete Spermakanal. In diesem Stadium fließt das Sperma frei und tritt bereits bei schwachem Druck aus. Bei den laichreifen Weibchen erfüllen die Ovarien fast den gesamten Bauchraum und engen dadurch die anderen Organe stark ein. Die Ovarien sind zum Teil durchsichtig und transparente Eier sind zu erkennen. Die transparenten Eier fließen bei schwachem Druck aus. 3.3.6 Mageninhaltsuntersuchungen Für die Untersuchung des Mageninhaltes wurden 443 Tiere herangezogen. Der Magen der adulten Tiere wurde geöffnet und der Füllungsgrad sowie der Inhalt des Magens in verschiedene Kategorien eingeteilt. Der Füllungsgrad des Magens wurde eingeteilt in „leer“ oder „gefüllt“. In Ausnahmen, wenn der Magen außergewöhnlich voll war, wurde auch dies vermerkt („sehr voll“). Der Inhalt des Magens teilte sich in folgende Kategorien: • „leer“ • „unbestimmbarer Nahrungsbrei“ • „Nahrungsbrei aus Fischlarven“ • „Nahrungsbrei aus Stintlarven“ • „frische Fischlarven“ Material und Methoden • „Nahrungsbrei aus Fischlarven und Crustaceen“ • „Nahrungsbrei aus Crustaceen“. 24 Bei der Kategorie „Nahrungsbrei aus Fischlarven“ wurden die einzelnen Arten soweit möglich näher determiniert. Eine genaue Analyse der Crustaceen fand nicht statt. Es ist davon auszugehen, dass es sich hierbei hauptsächlich um die Art Neomysis integer handelte. Kleinere Organismen wurden hier nicht berücksichtigt. Zusätzlich wurde notiert, wenn in den Mägen frische, unverdaute Tiere zu finden waren oder Nematoden auftraten. 3.3.7 Auswertung der einjährigen Finten Zur Auswertung der Längen-Gewichts-Beziehung wurden Daten von ca. 500 einjährigen Finten aufgenommen. Hierfür wurden 464 einjährige Finten nach der oben beschriebenen Methode vermessen und 454 Tiere gewogen. Um das Wachstum der einjährigen Finten festzustellen wurden zusätzliche Fische vermessen (insgesamt 958). Die Kiemenreusendornen der einjährigen Finten sind sehr viel kleiner, als die der adulten Tiere. Aus diesem Grund wurden die Kiemenreusendornen von 63 Tieren herauspräpariert, in 70 %igem Ethanol konserviert und später im Labor unter dem Binokular ausgezählt. 3.3.8 Auswertung des Beifangs Die Auswertung des Beifangs erfolgte halbqualitativ. Der Beifang wurde stichprobenartig auf Artniveau bestimmt. Dabei erfolgte teilweise eine Längenmessung (Totallänge, auf 1 cm below). Auf die Ergebnisse des Beifangs wird in vorliegender Arbeit nicht ausführlich eingegangen. Sie werden für den Lebensraum Unterweser als Nebenarten der Finte genannt, jedoch nicht weiter bewertet. 3.4 Durchführung der Lauschfahrten Es ist nach Literaturangaben bekannt und wird von Weserfischern bestätigt, dass sich die Finten nachts zum Laichgeschäft versammeln und geräuschvoll unter der Wasseroberfläche ablaichen (EHRENBAUM 1894; MOHR 1941). Um Laichaktivität direkt zu beobachten sowie die Laichplätze näher zu charakterisieren, wurden nächtliche Lauschfahrten auf der Weser oder Kontrollgänge am Weserufer zwischen UW-km 9 und 30 durchgeführt. Diese Ausfahrten fanden in der Zeit vom 07.05. bis zum 01.06.2004 statt. Die Untersuchungen begannen zu einem Zeitpunkt, als in den Hols des Hamenkutters höhere Anzahlen an adulten Finten verzeichnet wurden. Bei den Lauschfahrten wurden jeweils die Parameter Uhrzeit, UW-km, Mondphase, Tidephase, Witterungsverhältnisse (Wind) sowie Luft- und Wassertemperatur notiert. Material und Methoden 25 3.5 Eier- und Larvenfänge Die relativ großen Eier der Finte (in aufgequollenem Zustand: 4,3 - 4,6 mm (EHRENBAUM 1894; KYLE & EHRENBAUM 1929a) sind gut von Eiern anderer Fische zu unterscheiden. Sie sind nicht klebrig und verdriften passiv mit der Gezeitenströmung (HASS 1968). Um Hinweise auf die räumliche Verteilung der Eier sowie die Dauer der Fortpflanzungsperiode in der Unterweser zu erhalten, wurde ab dem ersten beobachteten Laichtermin in der Zeit vom 19.05. bis zum 08.06.2004 nach Fintenlaich gesucht. Das Untersuchungsgebiet hierfür erstreckte sich zwischen UW-km 8 und 28. Für den Fang der Eier kamen zwei langstielige Kescher und eine Dredge zum Einsatz (Abb. 6). Die Kescher hatten eine Maschenweite von 1 bzw. 2 mm (Ringdurchmesser 31 cm). Sie wurden entweder vom Boot, vom Anleger oder vom Ufer aus für 1 - 2 Minuten in die Strömung gehalten. Die einzelnen Beprobungen fanden jeweils in unbestimmten Wassertiefen statt, jedoch immer von der Wasseroberfläche bis maximal 2 m Tiefe. Mit der Dredge wurden auch bodennahe Wasserschichten erfasst. Die Dredge ist ein aus einem Stahlrahmen bestehendes Fanggerät mit einer Einströmöffnung von 50 cm mal 20 cm. An diesem ist ein Tragnetz mit grober Maschenweite befestigt, welches einen Fangnetzbeutel mit einer Maschenweite von 0,5 cm trägt. Die Dredge wurde vom Boot aus in unbestimmte Wassertiefen abgesenkt und etwa 20 m durch den Wasserkörper gezogen. Die Eier wurden gezählt bzw. bei großen Mengen wurde die Anzahl geschätzt. Einige Belegexemplare wurden in 70 %igem Ethanol konserviert, andere wurden im Aquarium erbrütet und zum Schlupf gebracht. Der Larvennachweis fand in der Zeit vom 11.05. bis zum 13.08.2004 zwischen UW-km 7 und 57 statt. Für den Fang der Larven wurden ebenfalls verschiedene Methoden angewandt: Die Probenahme erfolgte unter Einsatz der oben genannten Kescher, welche auch vom Boot, vom Ufer und vom Anleger aus geführt wurden. Zusätzlich wurde eine Ringwade benutzt. Diese war 20 m lang, 2 m tief und wies eine Maschenweite von 1 mm auf. Sie wurde vom Boot aus kreisförmig ausgelegt, am unteren Ende mit einer am Netz befestigten Leine zusammengezogen, an Bord geholt und ausgewertet. Zusätzlich wurden diejenigen Fischlarven näher untersucht, die sich im Hamensteert (6 mm) verfangen hatten. Die Larven wurden in 70 %igem Ethanol konserviert und später in repräsentativen Unterproben unter dem Binokular (SZH 10 Research Stereo von OLYMPUS) weitestgehend bis zum Artniveau bestimmt. Dabei wurde besonders auf die Identifizierung von Fintenlarven geachtet. Um die Anzahl der Myomere (Muskelbänder) besser zu erkennen, wurden die Larven für 2 - 3 Sekunden in eine Färbelösung (Toluid- und Methylenblau im Verhältnis 2:1) getaucht. Die Bestimmung erfolgte anhand folgender Literatur: EHRENBAUM Material und Methoden 26 (1894, 1964); HASS (1969); RUSSELL (1976); DOYLE (1977); HARDY (1978a,b); JONES et al. (1978); DIEKWISCH (1987); FRICKE (1987); HALBEISEN (1988); SCHEFFEL (1989); KLINKHARDT (1996); PINDER (2001); www.larvalbase.org. Abb. 6: Angewandte Fanggeräte: Dredge (links), Kescher (rechts). 3.6 Weitere Methoden Es war nicht möglich mit dem Hamenfischer weiter flussaufwärts als UW-km 20,5 (Blumenthal) zu fischen, da ab dort die gesamte Breite des Flusses zum Fahrwasser gehört und folglich dort nicht gefischt werden darf. Um dennoch Daten zur Laichwanderung zu gewinnen bzw. das Verbreitungsbild der Finte in der Unterweser abzurunden, wurden weitere Methoden angewandt: Reusen, Treibnetz und Befragungen von Fischern. Ab dem 17.05.2004 wurden für ca. einen Monat bei UW-km 11 zwei Reusen ausgebracht, die in unregelmäßigen Abständen kontrolliert wurden. Es handelte sich um Doppelreusen mit einer Gesamtlänge von 13 m, zwei Reusenkörper á 4 m mit Leitnetz von 5 m, Reusenhöhe 1 m, Ring 60 cm, Maschenweite von erster Kehle bis zum Steert von 17, 14 auf 11 mm sich verjüngend. Mit einem 50 m langen Treibnetz wurde am 17.05.2004 zwischen UW-km 9 - 12 ebenfalls nach adulten Finten gesucht. Aufgrund des Bootsverkehrs konnte die Beprobung nur in Ufernähe stattfinden. Zusätzlich fanden während der gesamten Probenahmezeit Befragungen der angelnden Sportfischer sowie der Reusen stellenden Fischer statt. Der Larvenfang wurde an zwei Tagen im Juli 2004 auf die Stahlwerke Bremen ausgedehnt. Dabei wurde einmal bei Flut und einmal bei Ebbe in verschiedenen Rückspülbecken der Einlaufrechen und Brunnen des Wasserkreislaufes der Stahlwerke Bremen nach Larven gekeschert. Material und Methoden 27 3.7 Abiotische Parameter Für die Beschreibung der abiotischen Bedingungen wurden verschiedene Methoden und Quellen genutzt: • Temperatur (°C), Sauerstoffgehalt und -sättigung (mg/l, %), pH-Wert und elektrische Leitfähigkeit (µS/cm, mS/cm) wurden mit Hilfe einer Multisonde (WTW MultiLine P4) vor Ort gemessen; • Ergänzend wurden für die Probenahmetage die genannten Parameter der Messstation Hemelingen aus dem Internet erfasst (http://www.umwelt.bremen.de); • Von den Stahlwerken Bremen wurden Messreihen der Parameter Temperatur (°C), Sauerstoffgehalt und -sättigung (mg/l, %), pH-Wert und el. Leitfähigkeit (micS/cm) zur Verfügung gestellt; • Die Lufttemperaturen sowie Windgeschwindigkeit und -richtung wurden an den Probenahmetagen von Wetter-online abgerufen (http://www.wetteronline.de); • Die Daten der Abflussmengen wurden der folgenden Internetadresse der Bundesanstalt für Gewässerkunde entnommen: http://www.bafg.de/php/weser.htm. (Pegelstation Intschede). Um fehlerhafte Messdaten zu vermeiden (Messgerätfehler (Eichungen), unterschiedliche Probenahmezeiten, nur oberflächennahes Wasser gemessen) werden die Tagesdurchschnittswerte der Stahlwerke für diese Arbeit benutzt. Diese Messungen erfolgen regelmäßig im 5 Minuten Takt, in einer Wassertiefe von 9 m. Für die Auswertung der Fänge spielen die abiotischen Faktoren in dieser Arbeit nur eine untergeordnete Rolle. Die Parameter werden bei der Beschreibung der im Untersuchungsjahr vorherrschenden Bedingungen während des Laichgeschehens genutzt. Auf die Parameter (Wassertemperatur und Oberwasserabfluss) wird hinsichtlich des Fintenfanges etwas näher eingegangen. 3.8 Mathematische und statistische Auswertung der Daten Die Ergebnisse wurden tabellarisch und graphisch mit Hilfe von MS Excel 2000 und Grapher 2.0 dargestellt. Für die statistische Auswertung wurde das Programm SPSS 10.0 benutzt, sowie folgende Literatur: LOZÁN & KAUSCH (2004), SACHS (1992) und ZÖFEL (1992). Ergebnisse 4 28 Ergebnisse 4.1 Fangauswertung nach Fangzahlen In der Zeit vom 29. April bis zum 13. August 2004 konnten zwischen UW-km 46 und 20,5 in 49 Hamenfängen 918 zum Laichen aufsteigende Finten identifiziert werden (Tab. 3). Dabei wurden durchschnittlich 26,23 Finten pro Hol erfasst. Jedoch lässt sich ein deutliches Abundanzmaximum im Mai 2004 erkennen (Abb. 7). An der Station Farge traten nach Abwanderung der adulten Tiere die einjährigen Finten zahlreich in Erscheinung (Tab. 3, Abb. 7). Sie konnten bis zum 21.07.2004 in Farge und noch bis zum 13.08.2004 weiter flussabwärts (UWkm 35 - 46) nachgewiesen werden. Später kamen sie auch dort seltener vor. Abb. 7: Anzahl der pro Hol im Hamen gefangenen adulten (> 25 cm) und einjährigen Finten in Farge (UW-km 28/29) in der Zeit vom 27.04. bis zum 21.07.2004 (aus SCHULZE & SCHIRMER 2005). Ergebnisse 29 Tab. 3: Anzahl der im Hamen gefangenen adulten und einjährigen Finten an den verschiedenen Stationen (UW-km 20,5-46) im Untersuchungszeitraum 29.04. - 13.08.2004, Abkürzungen: Lfd. Nr.: Laufende Fangnummer; Fang Nr.: Ausgewerteter Fang. Lfd. Nr. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 Fang Nr. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Datum Station, UW-km Tidephase Anzahl Adulte Anzahl Einjährige 29.04.04 06.05.04 07.05.04 11.05.04 12.05.04 12.05.04 13.05.04 13.05.04 17./18.05.04 18.05.04 18.05.04 19.05.04 20.05.04 20.05.04 26.05.04 26.05.04 02.06.04 02.06.04 03.06.04 03.06.04 04.06.04 04.06.04 08.06.04 08.06.04 09.06.04 09.06.04 09.06.04 10.06.04 10.06.04 11.06.04 15.06.04 16.06.04 16.06.04 17.06.04 17.06.04 24.06.04 24.06.04 30.06.04 01.07.04 08.07.04 16.07.04 21.07.04 21./22.07.04 22.07.04 22.07.04 29.07.04 04.08.04 05.08.04 13.08.04 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Rechtenfleth, 46 Rechtenfleth, 46 Farge, 29 Blumenthal, 20,5 Blumenthal, 20,5 Blumenthal, 20,5 Farge, 28 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Rechtenfleth, 46 Rechtenfleth, 46 Farge, 29 Farge, 28 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Farge, 28 Farge, 28 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Farge, 28 Farge, 29 Rechtenfleth, 46 Rechtenfleth, 46 Sandstedt, 44 Rechtenfleth, 46 Harriersand, 35 Harriersand, 35 Rechtenfleth, 46 Flut Ebbe Flut Ebbe Flut Ebbe Ebbe Flut Flut Flut Ebbe Flut Ebbe Flut Flut Ebbe Flut Ebbe Flut Ebbe Flut Ebbe Ebbe Flut Flut Ebbe Flut Flut Flut Flut Ebbe Flut Ebbe Ebbe Flut Flut Ebbe Ebbe Flut Ebbe Ebbe Flut Flut Ebbe Flut Ebbe Ebbe Ebbe Flut 12 40 123 8 36 4 12 46 96 14 23 37 65 166 30 5 19 7 22 5 16 9 24 28 37 12 8 4 1 2 2 0 2 0 1 0 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 ca. 50 0 0 0 7 0 0 0 0 ca. 300 0 127 30 ca. 300 30 93 2 250 186 3 237 23 11 28 Ergebnisse 30 Biomasse Neben den Anzahlen der Finten wurde auch deren Gesamtbiomasse bestimmt. Die Angaben beziehen sich jedoch nur auf adulte Finten. Im Verlauf der Untersuchung konnten 287,52 kg Finten gefangen werden (Tab. 4). Dies entspricht einer mittleren Gesamtbiomasse pro Hol von 17,97 kg. Getrennt für Ebbe- und Flutfänge ergeben sich durchschnittlich 10,23 kg pro Hol während der Ebbphase und 21,49 kg pro Hol während der Flutphase. Tab. 4: Biomasse der adulten Finten im Zeitraum 06.05. - 11.06.2004 zwischen UW-km 20,5 und 46, Abkürzungen: Lfd.Nr.: Laufende Fangnummer; Fang Nr.: Ausgewerteter Fang. Lfd. Nr. Fang Nr. 2 3 4 5 6 8 9 10 11 12 15 16 27 28 29 30 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Station, UW-km Datum 06.05.04 07.05.04 11.05.04 12.05.04 12.05.04 13.05.04 17./18.05.04 18.05.04 18.05.04 19.05.04 26.05.04 26.05.04 09.06.04 10.06.04 10.06.04 11.06.04 Farge, 28 Farge, 29 Farge, 28 Farge, 29 Farge, 28 Rechtenfleth, 46 Farge, 29 Blumenthal, 20,5 Blumenthal, 20,5 Blumenthal, 20,5 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Farge, 29 Summe Tidephase Ebbe Flut Ebbe Flut Ebbe Flut Flut Flut Ebbe Flut Flut Ebbe Flut Flut Flut Flut Finten [kg] 27,68 66,02 3,98 22,13 2,21 28,30 67,56 7,09 14,27 23,33 15,19 3,00 3,85 1,43 0,34 1,14 287,52 Ebbe- und Flutfänge Von den insgesamt 49 Fängen fanden 26 Hols bei ablaufendem Wasser (Ebbe) und 23 Hols bei auflaufendem Wasser (Flut) statt (Tab. 3). In 31 Fängen, die für diese Auswertung verwertbar sind, wurden 14 Hols während der Ebbphase und 17 Hols während der Flutphase durchgeführt, wobei 907 Finten erbeutet wurden (Abb. 8). Davon sind 218 Tiere (24 %) den Ebbefängen und 689 (76 %) den Flutfängen zuzuordnen. Der Einheitsfang während der Flutphasen betrug 40,53 Finten pro Hol, während bei Ebbphasen nur 15,57 Finten/Hol gefangen wurden. Daraus ergibt sich ein höchst signifikanter Unterschied zwischen den Ebbe- und Flutfängen (da χ2 = 244,58 > χ2(1/0,1%) = 6,64 ist). Ergebnisse 31 Anzahl adulter Finten 180 Flut Ebbe 150 120 90 60 30 0 28. Apr. 5. Mai. 12. Mai. 19. 26. Mai. Mai. Datum 2. Jun. 9. Jun. 16. Jun. Abb. 8: Verteilung der adulten Finten in den Flut- und Ebbehols in der Zeit vom 29.04. bis zum 17.06.2004. Außerdem wurden in den Ebbe- und Flutfängen signifikant mehr Weibchen als Männchen nachgewiesen (da χ2 = 6,12 > χ2(1/5%)= 3,84 ist) (Tab. 5). Dies entspricht jedoch der Verteilung des Gesamtfanges (vgl. Kapitel 4.2.4). Tab. 5: Anzahl und prozentuale Häufigkeit (pj) der gefangenen Männchen und Weibchen in den Ebbe- und Fluthols im Zeitraum 06.05. - 17.06.2004. Datum Ebbe 06.05.2004 11.05.2004 12.05.2004 18.05.2004 26.05.2004 16.06.2004 Flut 07.05.2004 12.05.2004 13.05.2004 17./18.05.2004 18.05.2004 19.05.2004 26.05.2004 09.06.2004 10.06.2004 11.06.2004 17.06.2004 Anzahl Männchen pj [%] Anzahl Weibchen pj [%] 4 5 3 6 2 2 10 62,5 75 26,09 40 100 36 3 1 17 3 0 90 37,5 25 73,91 60 0 67 19 20 3 6 17 21 6 4 1 1 54,47 52,78 43,48 3,125 42,86 45,95 70 75 80 50 100 56 17 26 93 8 20 9 2 1 1 0 45,53 47,22 56,52 86,88 57,14 54,05 30 25 20 50 0 Ergebnisse 32 Stationen Dem Fangort Farge (UW-km 28/29) kommt bei der Auswertung eine besondere Bedeutung zu, da 71 % aller Hols von dort stammt. Von den 27 ausgewerteten Fängen wurden 17 (63 %) in Farge durchgeführt. Von den 480 untersuchten Fischen stammen 360 Fische (75 %) von der Station Farge (UWkm 28/29), wobei 11,3 % bei UW-km 28 und 63,8 % bei UW-km 29 gefangen wurden. 15,4 % der untersuchten Fische stammen aus Blumenthal (UW-km 20,5) und nur 9,6 % aus Rechtenfleth (UW-km 46) (Abb. 9). Die Stationen Sandstedt und Harriersand sind bei dieser Auswertung zu vernachlässigen, da dort keine adulten Finten gefangen wurden. Anzahl adulter Finten 350 280 210 140 70 0 20,5 28 UW-km 29 46 Abb. 9: Anzahl der gefangenen adulten Finten (n = 480) an den einzelnen Stationen mit Angabe der UW-km. Laichwanderung Mittels der Hamenfänge konnten die adulten Finten bis UW-km 20,5 nachgewiesen werden. Ein zusätzlicher Reusenfang bei Vegesack (UW-km 18) zeigt die maximal nachgewiesene Ausbreitung des Laichfischbestandes. In den Reusenfängen weiter flussaufwärts (UW-km 11) sowie bei den Treibnetzbefischungen (UW-km 9 - 12) konnten dagegen keine Finten erbeutet werden. Zur Hauptprobenahmezeit (Mai - Juni 2004) wurden in der Unterweser Wassertemperaturen zwischen 12,5 und 20,5°C gemessen. In dieser Zeit wurden auch die meisten Finten gefangen (Abb. 10). Die Abbildung zeigt unter welchen Temperaturverhältnissen adulte Finten im Jahr 2004 gefangen wurden. An den Tagen, an denen Flut- und Ebbfänge stattgefunden haben, wurden hier nur die Flutfänge aufgenommen. Leichte Zunahmen in der Anzahl der adulten Finten lassen sich am 07.05.04 sowie am 20.05.04 erkennen, wenn die Wassertemperatur auf 15°C angestiegen ist. Zwischen diesen Fangtagen gingen die Fangzahlen und die Wassertemperatur leicht zurück. Ergebnisse 33 25 160 120 15 80 10 40 0 29. Apr. 5 Temperatur [°C] Anzahl Finten 20 0 13. Mai. 27. Mai. 10. Jun. Datum 24. Jun. Abb. 10: Anzahl der in allen Stationen gefangenen Laichfische (Balken) und Entwicklung der Wassertemperatur (Punkte) in der Unterweser im Zeitraum 29.04. - 01.07.2004. Die Abflussmengen zur Hauptprobenahme schwankten zwischen 148 und 749 m3/s (Abb. 11). Mitte Mai ist ein leichter Rückgang der gefangenen Laichfische zu verzeichnen, der mit einem Anstieg des Abflusses und einem Rückgang der Wassertemperatur einhergeht (Abb. 10 200 800 160 640 120 480 80 320 40 160 0 29. Apr. Abfluss [m³/s] Anzahl Finten und 11). 0 13. Mai. 27. Mai. 10. Jun. Datum 24. Jun. Abb. 11: Anzahl der in allen Stationen gefangenen Laichfische (Balken) und Entwicklung der Abflussmengen (Punkte) in der Unterweser im Zeitraum 29.04. - 01.07.2004. Die Temperaturdaten stammen von den Messreihen der Stahlwerke Bremen und die Daten der Abflussmengen wurden der Pegelstation Intschede (www.bafg.de/php/weser.htm) entnommen. Eine ausführliche Tabelle der abiotischen Parameter für den Untersuchungszeitraum befindet sich im Anhang A5. Ergebnisse 34 4.2 Fangauswertung anhand der populationsbiologischen Daten Die Rohdaten der Fangauswertung anhand der populationsbiologischen Parameter sind im Anhang A6 (adulte Finten) und A7 (einjährige Finten) zu finden. Die Tabelle 6 dient der Übersicht über vier der ermittelten Parameter. Tab. 6: Übersicht über vier der untersuchten populationsbiologischen Parameter bei adulten und einjährigen Finten. x (s) (♀♂) Adulte n Min-Max (♀♂) Länge [cm] 480 27-50 477 0,17-1,17 389 35-44 Punkte 440 1-18 Einjährige n Min-Max x (s) Länge [cm] 958 9-21 15,67 (2,04) Gewicht [g] 454 4,0-92,0 33,81 (12,73) Kiemenreusendornen 63 29-39 34,54 (2,07) Gewicht [kg] Kiemenreusendornen 41,25 (4,00) 0,60 (0,20) 39,89 (1,68) 4,24 (2,55) n Min-Max (♀♀) 293 37-50 293 0,40-1,17 256 36-44 273 1-16 x (s) (♀♀) 43,65 (2,53) 0,73 (0,14) 40,30 (1,53) 4,31 (2,54) n Min-Max (♂♂) 187 27-42 184 0,17-0,64 133 35-43 167 1-18 x (s) (♂♂) 37,48 (2,78) 0,40 (0,09) 39,11 (1,68) 4,12 (2,57) Ergebnisse 35 4.2.1 Länge und Gewicht Für Länge und Gewicht der Tiere ergab sich ein hochsignifikanter Unterschied zwischen den Geschlechtern (Mann-Whitney-U-Test, p < 0,001). Die Totallänge der Weibchen lag zwischen 37 und 50 cm (Mittelwert ( x ): 43,65 cm, Standardabweichung (s): 2,53). Die Männchen waren deutlich kleiner, sie erreichten Längen von 27 bis 42 cm ( x : 37,48 cm, s: 2,78) (Abb. 12). Für die 293 gefangenen geschlechtsreifen Weibchen variierte das Gewicht zwischen 0,4 und 1,17 kg, der Mittelwert betrug 0,73 kg (s: 0,14). Das Gewicht der 184 Männchen lag zwischen 0,17 und 0,64 kg, im Mittel waren sie 0,4 kg schwer (s: 8,69) (Abb. 13). 18 Häufigkeit [%] 15 12 9 6 3 0 27 29 31 33 35 37 39 41 43 45 47 49 Länge [cm] Abb. 12: Längenhäufigkeitsverteilung (TL) der gefangenen adulten Finten (♂♂ n = 187, weiße Balken; ♀♀ n = 293, schwarze Balken). Häufigkeit [%] 16 12 8 4 0 1,15-1,17 1,06-1,08 0,97-0,99 0,88-0,90 0,79-0,81 0,70-0,72 0,61-0,63 0,52-0,54 0,43-0,45 0,34-0,36 0,25-0,27 0,16-0,18 Gewicht [kg] Abb. 13: Gewichtshäufigkeitsverteilung der gefangenen adulten Finten (♂♂ n = 184, weiße Balken; ♀♀ n = 293, schwarze Balken). Ergebnisse 36 Aus der Längenhäufigkeitsverteilung der adulten Finten lassen sich keine Altersstrukturen erkennen. Aus diesem Grund wurden alle adulten Finten (> 25 cm) in die Altersgruppe (AG) 2+ und älter eingeordnet. Für die Längen-Gewichts-Relation wurde eine Kurvenanpassung in SPSS 10.0 durchgeführt. Wie zu erwarten war, ergab die Potenzfunktion die beste Regression und beschreibt damit die Punkteschar besser als eine Gerade. Für die Weibchen und Männchen zusammen ergab die Potenzfunktion y = b0 * (tb1) einen r2-Wert von 0,875 (dagegen ergab die lineare Funktion y = b0 + (b1 * t) nur ein r2 von 0,830). Nach Geschlechtern getrennt betrachtet ergaben sich r2Werte für die Weibchen von 0,64 und für die Männchen von 0,80 (Abb. 14) (lineare Regression: Weibchen 0,61; Männchen 0,76). Für die Ergebnisse der linearen Regression siehe Anhang A10-3 und A10-4. 1,4 2,6384 y = 3E-05x 2 R = 0,6403 Gewicht [kg] 1,2 1 0,8 0,6 2,7084 y = 2E-05x 2 R = 0,8018 0,4 0,2 0 20 25 30 35 40 45 50 55 Länge [cm] Abb. 14: Längen-Gewichts-Regression für Männchen (blau) und Weibchen (rot), Potenzfunktion: y = cxb. Ergebnisse 37 4.2.2 Kiemenreusendornen Untersucht wurden sowohl adulte als auch einjährige Finten, um zu prüfen, ob bei der Finte die Anzahl der Kiemenreusendornen (Krd.) mit zunehmender Körperlänge ansteigt. Die Anzahl der Krd. der adulten Tiere (> 25 cm, n = 389) variierte zwischen 35 und 44, wobei der Mittelwert bei 39,89 lag (s: 1,68). Die einjährigen Finten (Längen von 10 - 22 cm, n = 63) wiesen eindeutig weniger Krd. auf: 29 - 39 ( x : 34,54, s: 2,07 (Abb. 15). Daraus ergibt sich ein hochsignifikanter Unterschied in der Anzahl der Krd. zwischen der AG 1+ und der AG 2+ und älter (Mann-Whitney-U-Test, p < 0,001). 25 einjährige > 25 cm Häufigkeit [%] 20 15 10 5 0 29 31 32 33 34 35 36 37 38 39 40 41 42 43 44 Anzahl der Kiemenreusendornen Abb. 15: Häufigkeit der Anzahl von Kiemenreusendornen bei einjährigen Finten (AG 1+, Längen von 10 - 22 cm, n = 63) und Tieren > 25 cm (AG 2+ und älter, Längen von 27 - 50 cm, n = 389). Mit zunehmender Länge während der Individualentwicklung steigt die Anzahl der Krd. (Abb. 16). Der Unterschied zeigt sich in den Steigungen der Regressionsgeraden. Die Steigung der Gerade, welche die Beziehung zwischen Länge und Anzahl der Krd. bei den einjährigen Finten beschreibt, variiert zwischen 0,433 und 0,625 (Standardfehler miteinbezogen) und ist somit größer als die Steigung, welche die gleiche Beziehung bei den adulten Finten beschreibt (0,124 und 0,204). Ergebnisse 38 Kiemenreusendornen 50 40 30 y = 0,5285x + 26,201 2 R = 0,6676 20 y = 0,1636x + 33,106 2 R = 0,1483 10 0 0 10 20 30 Länge [cm] 40 50 60 Abb. 16: Zusammenhang zwischen Länge und Anzahl der Kiemenreusendornen bei einjährigen Finten (links) und Tieren > 25 cm (rechts), lineare Regression. Ergebnisse 39 4.2.3 Punkte Die Anzahl der Punkte schwankte bei den 440 untersuchten adulten Tieren zwischen 1 und 17 ( x : 4,24; s: 2,56). Es ergaben sich keine signifikanten Beziehungen zwischen der Anzahl der Punkte und den Parametern Länge und Geschlecht. 4.2.4 Geschlecht Insgesamt wurden deutlich mehr Weibchen als Männchen gefangen. Unter den 480 untersuchten Finten waren 293 Weibchen (61 %) und 187 Männchen (39 %) vertreten. Im Auftreten der Geschlechter in den Hamenfängen lässt sich keine besondere Geschlechterverteilung erkennen (Abb. 17). Auffällig ist lediglich, dass im Fang am 17.05.2004 97 % Weibchen und nur 3 % Männchen zu verzeichnen waren. Gegen Ende der Laichzeit waren, zwar in geringen Anzahlen, mehr Männchen als Weibchen vertreten. 100 Weibchen Männchen Anzahl Finten 80 60 40 20 0 6. Mai. 13. Mai. 20. Mai. 27. Mai. Datum 3. Jun. 10. Jun. 17. Jun. Abb. 17: Anzahl der im Hamen gefangenen Weibchen und Männchen in der Zeit vom 06.05. bis zum 17.06.2004 in Farge (UW-km 28/29) und Blumenthal (UW-km 20,5). 4.2.5 Laichreife Die Laichreife wurde bei allen untersuchten Tieren (n = 480) bestimmt. Betrachtet man alle Fangorte zusammen, dann befanden sich 51,3 % in einem nicht fließenden Zustand, 46,9 % wiesen fließende Geschlechtsprodukte auf und nur 1,9 % der Fische hatte bereits abgelaicht. Für die Station Farge lässt sich über die Zeit eine Entwicklung der Laichprodukte erkennen (Abb. 18). Anfänglich waren noch relativ wenige Fische laichbereit, was sich im Laufe der Zeit änderte. Am Ende der Untersuchung wurden nur noch wenige, dafür aber bereits abge- Ergebnisse 40 laichte Fische, gefangen. Unter diesen neun abgelaichten Finten waren acht Männchen und nur ein Weibchen zu finden. Der Fang in Rechtenfleth (UW-km 46) zeigt, dass die einwandernden Fische weiter flussabwärts noch nicht laichbereit waren, zu einer Zeit, in der in Farge (UW-km 28/29) einen Tag vorher nur Fische mit fließenden Laichprodukten gefangen wurden. Vergleicht man hingegen die gefangenen Fische des weiter flussauf liegenden Fangortes Blumenthal (UW-km 20,5) mit den gefangenen Fischen in Farge (UW-km 28/29), lässt sich eine ähnlich erreichte Laichreife feststellen. 140 nicht fließend Anzahl Finten 120 fließend abgelaicht 100 80 60 40 20 0 6. Mai. 13. Mai. 20. Mai. 27. Mai. Datum 3. Jun. 10. Jun. 17. Jun. Abb. 18: Laichreife der in Farge (schwarz-weiß), Rechtenfleth (rot) und Blumenthal (grün) gefangenen Laichfische (n = 480) in der Zeit vom 06.05. bis zum 17.06.2004. Anhand der ermittelten Laichreife lassen sich Rückschlüsse auf die Laichzeit der Finte im Untersuchungsjahr 2004 ziehen. Danach ergibt sich für den Bereich Farge eine Laichzeit von Anfang/ Mitte Mai bis Mitte Juni. Aufgrund näherer Untersuchungen der Ovarien konnte außerdem nachgewiesen werden, dass die Eier im Ovar ein unterschiedliches Reifestadium zur gleichen Zeit aufwiesen (durchsichtige reife Eier in der Nähe der Geschlechtsöffnung und im Vergleich dazu kleinere in einem weniger weit entwickelten Stadium). Ergebnisse 41 4.2.6 Mageninhalt Nur 18 % der untersuchten Mägen (n = 443) waren leer, demzufolge waren 82 % der Mägen gefüllt, wovon 12 % sogar sehr voll waren (Abb. 19). leer 18% gefüllt sehr voll 12% 70% Abb. 19: Füllungsgrad des Magens von 443 untersuchten adulten Finten (links), Fotos: rechts oben Magen leer, rechts unten Magen gefüllt (26.05.2004, Farge UW-km 29). Bei 33 % der untersuchten Mägen konnte aufgrund des Verdauungsprozesses keine differenzierte Bestimmung des Inhaltes erfolgen (Kategorie „unbestimmbarer Nahrungsbrei“) (Tab. 7). In den anderen Fällen konnte der Mageninhalt problemlos in die genannten Kategorien eingeteilt werden. Daraus ergaben sich zwei „Nährtiergruppen“: Pisces und Crustaceen. Insgesamt wurde ein hoher Anteil an Fischen vorgefunden, was auf eine vorwiegend piscivore Ernährung schließen lässt. Dabei konnten folgende Fischarten nachgewiesen werden: Stint, Hering, Grundel, Plattfisch (höchst wahrscheinlich Flunder), Flunder und ein juveniler Cyprinide (wahrscheinlich Güster oder Brasse). Die Crustaceen wurden nicht näher bestimmt. Es ist aber davon auszugehen, dass es sich überwiegend um die Art Neomysis integer (Schwebegarnelen - Mysidacea) handelte, da diese Art in der Unterweser und im Probenahmezeitraum weit verbreitet ist. Ergebnisse 42 Tab. 7: Mageninhalt der untersuchten adulten Fische (n = 443), eingeteilt in 7 verschiedene Kategorien. Kategorie Anzahl % leer frische Fischlarven unbestimmbarer Nahrungsbrei 13 3 147 33 79 18 Nahrungsbrei aus Fischlarven Stintlarven Fischlarven und Crustaceen Crustaceen 36 8 86 19 47 11 35 8 Von den insgesamt 443 Tieren wiesen 32 Fische Nematoden im Magen auf. Weiterhin konnte ein Zusammenhang zwischen der Laichreife der Tiere und dem Füllungsgrad des Magens der untersuchten Tiere festgestellt werden. Es lässt sich der Trend erkennen, dass die Mägen mit zunehmender Laichreife („fließend“, „abgelaicht“) wesentlich voller sind (Abb. 20). Es wurden keine abgelaichten Tiere mit leerem Magen gefunden, wobei zu beachten ist, dass sich von 480 untersuchten Tiere nur neun im abgelaichten Zustand befanden. 100% Füllungsgrad 80% 60% 40% 20% 0% nicht fließend fließend abgelaicht Laichzustand Abb. 20: Zusammenhang zwischen Laichreife und Füllungsgrad des Magens bei adulten Finten (n=443), Legende: weiß: leerer Magen, gestreift: gefüllter Magen, schwarz: sehr voller Magen. Ergebnisse 43 4.2.7 Einjährige Finten Die einjährigen bzw. vorjährigen Finten (AG 1+) tauchten ab dem 09.06.2004 in den Hamenfängen auf (Abb. 7). Zu diesem Zeitpunkt hatten die adulten Tiere bereits zum größten Teil abgelaicht und konnten nur noch in geringen Mengen in den Fängen nachgewiesen werden. Alle Fische wiesen mindestens einen schwarzen Punkt hinter dem Kiemendeckel auf; einige hatten sogar schon mehrere Punkte. Auf Grundlage der Längenhäufigkeitsverteilung lassen sich eindeutig zwei Altersgruppen (1+ sowie 2+ und älter) trennen (Abb. 21). 120 Anzahl Finten 100 80 60 40 20 0 9 14 19 24 29 34 39 44 49 Länge [cm] Abb. 21: Längenhäufigkeitsverteilung (TL) der einjährigen (AG 1+, n = 379, weiße Balken) und der adulten Finten (AG 2+ und älter, n = 480, schwarze Balken). Die Fische erreichten im Monat Juni 2004 Totallängen von 10 bis 17 cm, im Juli 2004 von 9 bis 21 cm und im August 2004 Totallängen von 12 bis 21 cm (Tab. 8 und Abb. 22). Tab. 8: Totallängen von einjährigen Finten im Zeitraum vom 11.06. - 13.08.2004, n: Anzahl der untersuchten Individuen, x : Mittelwert, s: Standardabweichung. Datum n Spannweite [cm] x s 11.06.2004 17.06.2004 24.06.2004 16.07.2004 22.07.2004 29.07.2004 04.08.2004 05.08.2004 13.08.2004 7 246 127 93 186 237 23 11 28 10-15 10-20 10-17 13-19 12-21 9-21 13-19 12-21 14-20 13,57 14,36 13,85 16,2 16,66 16,84 16,26 15,73 17,07 1,68 1,60 1,34 1,20 1,81 1,71 1,51 2,38 1,39 44 45 18 40 17 16 35 15 30 14 25 13 20 Länge [cm] Gewicht [g] Ergebnisse 12 15 11 10 10 10. 17. 24. 1. Jun. Jun. Jun. Jul. 8. 15. Jul. Jul. Datum 22. Jul. 29. 5. 12. Jul. Aug. Aug. Abb. 22: Mittelwerte der Totallängen (grau) und des Gewichts (schwarz) der einjährigen Finten in der Zeit vom 11.06. bis zum 13.08.2004 (n = 449). 4.2.8 Zusammensetzung des Beifangs In den Hamenfängen konnten 20 Arten nachgewiesen werden (Tab. 9). Die Rohdaten (z.T. mit Längenangaben) befinden sich im Anhang A8. Typische Begleitarten für den gesamten Untersuchungszeitraum für den Hauptfangort Farge waren Aal, Brassen, Flunder, Stint, Zander, Aland und Güster. Dazu konnten saisonale und räumliche Unterschiede festgestellt werden. Saisonal bedingt war das Auftreten von wandernden Arten (z.B. Fluss- und Meerneunauge, Hering und Grundel). Je weiter stromab die Beprobungen stattfanden, desto mehr Kaulbarsche und Flundern konnten gefangen werden. Arten wie Brassen, Güster und Aland nahmen dort zahlenmäßig stark ab. Besonders erwähnenswert ist das Massenauftreten junger Heringe (Länge ca. 5 cm) ab dem 26.05.2004 in Farge, die dort noch bis zum 21.07.2004 nachgewiesen werden konnten. Von Sportfischern wird berichtet, dass die jungen Heringe sogar bis Blumenthal (UW-km 20,5) ziehen. In diesem Flussabschnitt führt die Unterweser bereits Süßwasser. Ergebnisse 45 Tab. 9: Nachgewiesene Arten in den Hamenfängen, mit Angabe der Gefährdungskategorien (für Niedersachsen (Nds) und Bremen (B): GAUMERT & KÄMMEREIT 1993; für deutsche Küstengewässer (D): FRICKE et al. 1998) und des Schutzstatus (FFH-RL, www.bfn.de); 1=Vom Aussterben bedroht, 2=Stark gefährdet, 3=Gefährdet, 4=Potentiell gefährdet, 5=Nicht gefährdet, F=Fremdfischart. Gefährdungskategorie / Schutzstatus Limnische Arten D Nds B Aland (Leuciscus idus) Barbe (Barbus barbus) Brassen (Abramis brama) Flussbarsch (Perca fluviatilis) Güster (Blicca bjoerkna) Karpfen (Cyprinus carpio) Kaulbarsch (Gymnocephalus cernuus) Plötze (Rutilus rutilus) Zander (Sander lucioperca) 3 2 5 2 5 5 5 5 5 4 5 2 5 5 5 5 5 5 3 3 5 5 5 5 2 5 2 1 2 4 F 1 5 1 1 2 3 F Euryhaline Arten Aal (Anguilla anguilla) Dreistachliger Stichling (Gasterosteus aculeatus) Finte (Alosa fallax) Flunder (Platichthys flesus) Flussneunauge (Lampetra fluviatilis) Meerneunauge (Petromyzon marinus) Meerforelle (Salmo trutta trutta) Stint (Osmerus eperlanus) Micropogonias undulatus Marine Arten Grundel (Pomatoschistus spec.) Hering (Clupea harengus) 2 2 2 2 - FFHAnhang V II, V II, V II Ergebnisse 46 4.3 Laichverhältnisse und Reproduktion Während der nächtlichen Lauschfahrten und Kontrollgänge konnte eine Vorstellung davon gewonnen werden, zu welcher Zeit, unter welchen Umständen und in welchem Gebiet die Finten laichen. Laichvorgänge konnten an drei Tagen im Mai 2004 in einem Gebiet zwischen UW-km 22,5 und 29 beobachtet werden (Tab. 10). Ergänzend dazu lässt sich mit Hilfe der Eierfänge (Abb. 23) das Laichgebiet und der Laichzeitraum näher bestimmen. Finteneier konnten bei den Beprobungen vom 19.05. bis zum 08.06.2004 zwischen UW-km 11 und 28 gefangen werden (Tab. 11). Bei den anschließenden Larvenfängen konnte dagegen kein Fintenlaich mehr nachgewiesen werden. Tab. 10: Ergebnisse der Lauschfahrten und Kontrollgänge in der Zeit vom 07.05. bis zum 01.06.2004 im Bereich von UW-km 9 - 30. Abkürzungen: *UW-km: in diesem UW-Abschnitt wurde die Laichaktivität an dem angegebenen Tag beobachtet; ** wo: Wetter-Online (Lufttemperaturen Höchstwerte); ***He: Messstation Hemelingen; ****St.: Stahlwerke Bremen (Tagesmittelwert); *****tg: tagsüber gemessen, Oberflächenwasser. Datum UW- Wie lange Mondphase km* unterwegs? (Uhrzeit) Wetter TideLufttemphase peratur (Uhrzeit) am Tag [°C] Wassertemperatur [°C] Laichaktivität 07.05.04 9-13 21.00-01.30 NW: 00.19 16 (wo**) 16 (He***) 15,91 (St****) nein 16.05.04 NW: 21.00 18 (wo) 13 (He) 13,55 (St) nein 28 3 Tage nach bedeckt, kein Vollmond Regen tagsüber 3 Tage vor warm, abends 22.00-01.00 Neumond windstill 18.05.04 9-11 23.00-02.00 1 Tag vor Neumond absolut windstill NW: 22.45 19 (wo) 18.05.04 22.00-23.00 1 Tag vor Neumond absolut windstill NW: 22.11 19 (wo) 19.05.04 9-11 22.00-00.00 Neumond erst windig, dann ruhiger NW: 23.35 22,5 (wo) 2922.00-01.00 25,5 Neumond erst windig, dann ruhiger NW: 23.00 22,5 (wo) 19.05.04 28 20.05.04 22,5 23.00-23.30 20.05.04 20.05.04 2000.00-00.30 18,5 14 00.30-01.00 22,523.00-01.00 18,5 25,500.00-02.45 01.06.04 30 21.05.04 1 Tag nach Neumond 1 Tag nach Neumond 1 Tag nach Neumond 2 Tage nach Neumond 2 Tage vor Vollmond kalt windstill NW: 23.45 NW: 23.55 NW: 00.00 NW: 00.15 HW: 02.16 17 (wo) 17 (wo) 17 (wo) 14 (wo) 20,5 (wo) 13 (He) 15,2 (tg*****) 14,72 (St) 13 (He) 15,2 (tg) 14,72 (St) 13 (He) 15,3 (tg) 15,33 (St) 13 (He) 15,3 (tg) 15,33 (St) 14 (He) 15,88 (St) 14 (He) 15,88 (St) 14 (He) 15,88 (St) 14 (He) 16,12 (St) 17 (He) 16,67 (St) nein ja nein ja ja nein nein nein nein Ergebnisse 47 Tab. 11: Nachgewiesene Finteneier in der Zeit vom 19.05. bis zum 08.06.2004 im Bereich von UW-km 8 - 28. Datum UW-km Tidephase Methode Ort Anzahl 19.05.04 23.05.04 km 28 km 28 km 27,5 km 27 km 22 km 22 km 18 km 16 km 12,5 km 20,5 km 19,5 km 18,5 km 17 Flut Flut Flut Flut Flut Flut Flut Ebbe Ebbe Flut Flut Flut Flut Kescher Kescher Kescher Kescher Kescher Kescher Kescher Kescher Kescher Kescher Kescher Kescher Kescher 1 5 2 2 50 3 3 1 1 - km 15 km 14 km 13 km 12 km 12 km 13 km 14 km 15 km 14 km 14 km 13 km 13 km 12 km 12 km 11 km 11 km 10 km 10 km 9 km 9 km 8 km 8 km 21 km 21 km 25,5 km 25,5 km 22 km 22 km 22 km 18 Flut Flut Flut Flut Ebbe Ebbe Ebbe Ebbe Flut Flut Flut Flut Flut Flut Flut Flut Flut Flut Stau Stau Ebbe Ebbe Ebbe Ebbe Ebbe Ebbe Flut Flut Flut Flut Kescher Kescher Kescher Kescher Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Dredge Kescher Dredge Kescher Dredge Kescher Kescher Strom Ufer Ufer Ufer Ufer Anleger Anleger Ufer Anleger Ufer Strom Strom Strom, Ufer Strom Strom Strom Strom 27.05.04 31.05.04 05.06.04 08.06.04 Ufernah Strom Ufernah Strom Ufernah Strom Ufernah Strom Ufernah Strom Ufernah Strom Ufernah Strom Ufernah Strom Anleger Anleger Anleger Anleger Ufer Anleger 1 3 1 1 2 1 1 1 1 5 8 1 1 1 1 1 Ergebnisse 48 Abb. 23: Eierfang von Alosa fallax (23.05.2004, Blumenthal). 4.3.1 Laichgebiet Das Hauptlaichgebiet der Finte liegt im tidebeeinflussten limnischen Flussabschnitt zwischen Farge und Blumenthal (UW-km 22,5 - 29). Dafür spricht zum einen, dass sich dort laichreife Finten in großen Mengen über einen langen Zeitraum hinweg aufgehalten haben (Abb. 18). Zum anderen konnten in diesem Gebiet in der Zeit vom 18.05. bis zum 20.05.2004 direkt Laichaktivitäten beobachtet werden. Zudem wurde die höchste Eidichte in diesem Gebiet dokumentiert (Tab. 11). Da die Laichwanderung bis einschließlich Vegesack (UW-km 18) festgestellt werden konnte, ist anzunehmen, dass sich das Laichgebiet noch weiter stromauf erstreckt, als das bereits genannte Gebiet. Bei den durchgeführten Lauschfahrten bzw. Gängen konnten jedoch selbst in den Nächten, in denen Laichaktivitäten stattfanden, keine Laichgeräusche in Gebieten weiter flussaufwärts als UW-km 22,5 nachgewiesen werden (Tab. 10). Finteneier wurden zwischen UW-km 11 und 28 gefunden. Im Hauptlaichgebiet ließen sich deutlich mehr Eier nachweisen, als weiter flussaufwärts. Oberhalb der Lesummündung konnten nur noch vereinzelt Eier aufgefunden werden. 4.3.2 Laichzeit Durch die Reife der Geschlechtsprodukte der Finten lässt sich der Laichzeitraum für den Ort Farge von Anfang Mai bis Anfang Juni festlegen (Abb. 18). Ab Anfang/ Mitte Juni konnten nur noch wenige Tiere in den Fängen nachgewiesen werden, wovon die meisten schon deutlich abgelaicht hatten. Finteneier konnten vom 19.05. bis zum 08.06.2004 im Untersuchungs- Ergebnisse 49 gebiet nachgewiesen werden und belegen den oben genannten Laichzeitraum. Die Hauptlaichzeit konnte aufgrund eigener Beobachtungen auf den Zeitraum 18.05. - 20.05.2004 festgelegt werden (zur Neumondphase). 4.3.3 Laichtemperatur Die Wassertemperatur zur Zeit der beobachteten Laichaktivitäten in der Zeit vom 18.05. bis 20.05.2004 lag bei ca. 15°C (14,7 - 15,9°C). 4.3.4 Laichverhalten Das Laichen fand ausschließlich nachts zwischen 22.00 und 01.00 Uhr statt. An den drei Laichterminen konnte das Laichen etwa zum Wechsel zwischen den Tidephasen (von Ebbe zu Flut) beobachtet werden. Auffällig ist, dass der Laichvorgang während Neumond stattfand (Tab. 10). Das Laichgeschehen fand in der Strommitte an der Wasseroberfläche statt. Es drehten sich jeweils einzelne Tiere laut plätschernd schnell im Kreis und gaben dabei ihre Laichprodukte ins Wasser ab. Die einzelnen Kreise hatten einen Durchmesser von ca. 1 m. Zeitweise konnten mehrere Fische gleichzeitig über den Fluss verteilt beobachtet werden (bis zu 5 aktive Fische). Die einzelnen Drehungen dauerten nur einige Sekunden an. Das gesamte Laichgeschehen erstreckte sich jedoch über mehrere Stunden. Anfänglich ließen sich die Tiere durch den Schiffsverkehr stören. Nach der Durchfahrt eines Schiffes konnten die Laichaktivitäten einige Zeit nicht mehr beobachtet werden. Erst nach einiger Zeit setzten die Finten ihr Laichen weiter fort. Nach einiger Zeit ließen sie sich jedoch selbst vom Schiffsverkehr nicht mehr hindern und nahmen ihre Laichaktivitäten nach einem durchgefahrenen Schiff schnell wieder auf. An den drei beobachteten Laichtagen konnten neben der Laichtemperatur folgende abiotische Parameter gemessen werden (Tab. 12): Tab. 12: Abiotische Parameter zur beobachteten Laichzeit, (Sauerstoffgehalt, pH-Wert und el. Leitfähigkeit von den Stahlwerken Bremen, Oberwasserabflussmengen von www.bafg.de/php/weser.htm). Datum Sauerstoffgehalt [mg/l] pH-Wert el. Leitfähigkeit [micS/cm] Abfluss [m3/s] 18.05.2004 19.05.2004 20.05.2004 10,77 10,56 10,44 7,76 7,78 7,82 1274,44 1248,27 1224,25 349,54 323,50 299,24 Ergebnisse 50 4.4 Eier- und Larvenfänge Die Eierfänge dienten neben der Überprüfung der erfolgreichen Reproduktion der Ermittlung des Laichgebietes und des Laichzeitraumes der Finten. Die Eier konnten nicht nur am Boden, sondern mit vergleichbarem Erfolg auch an der Wasseroberfläche gefangen werden. Die Eier konnten in der Zeit zwischen dem 19.05. und dem 08.06.2004 zwischen UW-km 11 und 28 nachgewiesen werden (Tab. 11). Zur Frage, ob sich die Eier häufiger im Strom oder ufernah fangen ließen, lassen sich keine eindeutigen Aussagen treffen. Speziell für den 05.06.2004 deuten die Fangergebnisse mittels Dredge an, dass sich eventuell mehr Eier im Strom als ufernah befanden. Die Erbrütungsversuche im Aquarium waren insofern erfolgreich, als dass einige Larven aus den Eiern schlüpften (Abb. 24), dann aber nach einigen Tagen verstarben. Abb. 24: Eine frisch geschlüpfte Fintenlarve (5 mm) aus den Erbrütungsversuchen. Ziel der Larvenfänge war ebenfalls über den Nachweis von Fintenlarven die erfolgreiche Reproduktion zu überprüfen und vermutliche Laichplätze näher einzugrenzen. Es konnte jedoch nur eine einzige Fintenlarve von 1,8 cm Länge bei einer Kescherbeprobung in Farge (UW-km 25,5, Ebbe) am 08.06.2004 nachgewiesen werden. Es wurden zwar regelmäßig die Larven der typischen Fischfauna der Unterweser gefangen, jedoch nur eine einzige Fintenlarve. Zu den nachgewiesenen Arten der Fischlarven und Jungfische gehören: • Finte (Alosa fallax): UW-km 25,5; Zeitraum 08.06.2004 • Stint (Osmerus eperlanus): UW-km 7,5 - 54; Zeitraum 11.05. - 13.08.2004 • Hering (Clupea harengus): UW-km 20,5 - 57; Zeitraum 18.05. - 13.08.2004 • Sprotte (Sprattus sprattus): UW-km 40 - 57; Zeitraum 29.06. - 29.07.2004 • Grundel (Pomatoschistus spec.): UW-km 11,5 - 57; Zeitraum 23.06. - 05.08.2004 • Flunder (Platichthys flesus): UW-km 9 - 54; Zeitraum 11.05. - 13.08.2004 Ergebnisse • 51 Dreistachliger Stichling (Gasterosteus aculeatus): UW-km 13 - 53,5; Zeitraum 03.06. 13.08.2004 • Cyprinidae indet.: UW-km 9 - 28; Zeitraum 17.05. - 29.07.2004 • Percidae indet. (Zander, Barsch): UW-km 9 - 54; Zeitraum 11.05. - 29.07.2004 Eine genaue Auflistung der nachgewiesenen Arten ist im Anhang A9 zu finden. Diskussion 5 52 Diskussion 5.1 Fangauswertung nach Fangzahlen In 2004 konnten in der Unterweser in 49 Hamenfängen insgesamt 918 adulte Finten gefangen werden. Die Fänge in der Weser sind in etwa vergleichbar mit denen in der Elbe. In der Elbe wird die Finte neben Stint, Flunder und Aal sogar zu den Massenfischarten gezählt. Die Finte stellt in Hamenfängen in der Elbe 15 % der Fischbiomasse (MÖLLER 1991, 1993). Ähnliches kann anhand der in der Laichzeit gefangenen Finten auch von der Unterweser behauptet werden. Im tidebeeinflussten Bereich des Süßwassers stellten die Finten in manchen Hamenfängen ebenfalls einen Großteil der Gesamtbiomasse (~ 40 %). Diese Einschätzung beruht jedoch nur auf subjektivem Empfinden, da für das Gewicht des Beifangs keine Zahlen vorliegen. Die mittlere Gesamtbiomasse der Finten pro Hol über den gesamten Untersuchungszeitraum betrug 17,97 kg. Im Vergleich dazu wurden in Hamenfängen in der Elbe in den Jahren zwischen 1984 und 1986 pro Fangstunde durchschnittlich 2,65 kg Finten gefangen (MÖLLER 1991). Übertragen auf die Fangdauer in der Unterweser (3 Std.) würden demnach ca. 9 kg pro Hol in der Elbe gegenüber 17,97 kg pro Hol in der Unterweser gefangen werden. Dabei ist zu beachten, dass die Fänge von MÖLLER (1991) Durchschnittsfänge über die Jahre sind und die hier ermittelte mittlere Gesamtbiomasse lediglich aus dem Einwanderungszeitraum der Finten stammt. Neuere Daten von THIEL et al. (1996a) belegen keine bedeutenden Veränderungen hinsichtlich der Größe des Laichfischbestandes zwischen den Jahren 1985 und 1994. Auch wenn anhand der Hamenfänge 2004 sowie nach Einschätzung der Berufsfischer von einer Bestandserholung der Finte in der Unterweser auszugehen ist, sind die Fangzahlen im Vergleich zu den Fängen vor rund 100 Jahren jedoch sehr klein (U. WILLIG, mdl. Mitt. 2004; s. Kap. 2.2.2 und 2.2.3) Gleiches gilt auch für die Elbe (EHRENBAUM 1936; THIEL et al. 1996a). Zu erwarten war, dass das Abundanzmaximum der adulten Finten im Mai lag. Der Monat Mai („Maifisch“) wird in der Literatur übereinstimmend als der Monat angegeben, in dem die meisten Fische während ihrer Laichwanderung in den Flüssen gefangen werden (KÜHL 1976; APRAHAMIAN 1988; HILLMAN 2003). Diskussion 53 Die einjährigen Finten wurden dagegen in den Hamenfängen ab dem 09.06.2004 vorgefunden, als die adulten Finten bereits zum größten Teil abgelaicht hatten und schon abgewandert waren. Sie konnten dann in hohen Abundanzen ab Mitte Juni bis Ende Juli nachgewiesen werden. Auch nach APRAHAMIAN (1988) wandern die Juvenilen der AG 1+ wieder in das Ästuar ein, wo sie erst Ende Juni bis Ende August zu fangen sind. Das saisonale Massenauftreten juveniler Finten in der Unterweser konnte jedoch für die Vorjahre nicht bestätigt werden (U. WILLIG, mdl. Mitt. 2004). Ebbe- und Flutfänge Der Befund, dass 76 % der gefangenen Fische aus den Flutfängen und nur 24 % aus den Ebbfängen stammen (Abb. 25), ist nicht definitiv zu klären. Allgemein wird vermutet, dass die sich im äußeren Ästuar sammelnden Finten die Fluttide nutzen, um möglichst mühelos in die Flüsse zu gelangen (BRACKEN & KENNEDY 1967; APRAHAMIAM 1988). Folglich wäre anzunehmen, dass die Tiere zur Abwanderung die Ebbtide nutzen, welches jedoch nicht nachgewiesen werden konnte. Die abgelaichten Fische wurden kaum erfasst, obwohl zu den Zeiten in denen die Abwanderung zu erwarten gewesen wäre, auch Fänge während der Ebbphase durchgeführt wurden. Erklärbar sind die unterschiedlichen Prozentzahlen pro Hol der Flut- und Ebbefänge eventuell dadurch, dass eine Synchronisation der Fische zur Einwanderung stattfindet, die jedoch zur Abwanderung nicht mehr erforderlich ist. Es ist davon auszugehen, dass die einzelnen Fische nach dem Laichgeschäft erschöpft sind und sich daher nicht mehr sammeln, sondern vereinzelt zurück ins Meer ziehen. Abb. 25: Unterschiedliche Fanggewichte der adulten Finten in den Ebbe- und Fluthols. Links: Eine Kiste mit 27,68 kg, 06.05.2004, Ebbe, Farge UW-km 28; rechts: Zwei Kisten mit 66,02 kg, 07.05.2004, Flut, Farge UW-km 29). Diskussion 54 Bei den Untersuchungen von APRAHAMIAN (1988) wurden bei Ebbfängen in Ufernähe drei bis vier mal mehr Fische gefangen als zur Fluttide. Der Autor erklärt das dadurch, dass die Finten die Fluttide im Hauptstrom nutzen, während sie sich bei Ebbe in den Uferbereichen aufhalten, wo die Strömung geringer ist. Der Grund dafür liegt in der Energieersparnis der Fische. Da jedoch keine abgelaichten Finten in den ufernahen Ebbfängen nachgewiesen werden konnten, nimmt der Autor an, dass diese Fische im Hauptstrom mit der Ebbtide flussabwärts gelangen. Die Hamenfänge in vorliegender Untersuchung fanden zwar in Ufernähe statt (ca. 50 m davon entfernt), jedoch sind die Habitatcharakteristika (Tiefe, Strömungsgeschwindigkeit) an Fangstellen und Strommitte weitgehend identisch. Demnach fanden alle Fänge der vorliegenden Untersuchung an dem Hauptstrom vergleichbaren Habitaten statt. Dort konnten die Finten im Hamen in hohen Anzahlen zur Fluttide gefangen werden. Die Frage, warum nur so wenig abgelaichte Tiere gefangen wurden, bleibt jedoch weiterhin offen. Nicht auszuschließen ist, dass ein gewisser Prozentsatz an Tieren nach dem Ablaichen gestorben sein könnte (vgl. QUIGNARD & DOUCHEMENT 1991a). Ähnliche Beobachtungen liegen auch für Alosa sapidissima vor. In sogenannten „erfolgreichen“ Populationen überleben nur ca. 30 % (GLEBE & LEGGETT 1981). Anzumerken ist hierbei jedoch, dass Alosa sapidissima wahrscheinlich der Alse (Alosa alosa) näher steht als der Finte und für die Alsen ebenfalls bekannt ist, dass der größte Teil des Laichfischbestands nach dem Laichen abstirbt. Allerdings ist es recht unwahrscheinlich, dass aus diesem Grund nur so wenig abwandernde Finten erfasst wurden, zumal hätten die toten Fische zumindest teilweise bei Ebbstrom in den Hamen eingespült werden müssen. Hinzu kommt die Tatsache, dass Finten gewöhnlich mehrmals in ihrem Leben laichen und demnach nicht schon nach dem ersten Laichvorgang sterben. Laichwanderung Die Laichwanderung der Finte in der Unterweser fand von Ende April bis Mitte Juni 2004 statt. Besonders im Monat Mai konnten viele laichbereite Tiere nachgewiesen werden. Der erste nennenswerte Fang (12 Finten) konnte am 29.04.2004 in Farge verzeichnet werden. Vor diesem Termin wurden nur vereinzelt Finten gefangen (U. WILLIG, mdl. Mitt. 2004). Die Ergebnisse stimmen mit den Angaben von APRAHAMIAN (1988) überein, der für die Laichwanderung eine Zeitspanne zwischen Mitte April und Mitte Juni, mit einer verstärkten Wanderung im Monat Mai, angibt. Die Synchronisation der Laichwanderung hängt wahrscheinlich von verschiedenen Faktoren ab. Der tatsächliche Zeitraum des jährlichen Laichaufstiegs wird wesentlich von diesen Faktoren bestimmt. Zu Beginn beeinflussen neben dem Körperfettgehalt bzw. der Gonadenreifung Diskussion 55 (endogener Faktor) die exogenen Faktoren wie Tageslänge und Lichtstärke die Aggregation im äußeren Ästuar. Das wesentlichste Triggersignal für die eigentliche Laichwanderung in die Flüsse ist dann mit großer Wahrscheinlichkeit die Wassertemperatur. Als letzten Faktor sind die Tidephasen zu nennen, mit der die Finten dann in die Flüsse gelangen. Auch nach APRAHAMIAN et al. (2001) ist die Laichwanderung temperaturabhängig. Zur Hauptwanderung liegen Wassertemperaturen von 10,6 bis 12,3°C (APRAHAMIAN 1988), 12°C (CLARIDGE & GARDNER 1978) oder 13,8 bis 17,7°C (HILLMAN 2003) vor. Für die Alsen werden ähnliche Temperaturen angegeben: 11°C (BOISNEAU et al. 1985) und 16°C (BELAUD et al. 1985). In der vorliegenden Untersuchung wurden zur Hauptprobenahme (Mai - Juni 2004) in der Unterweser Wassertemperaturen zwischen 12,5 und 20,5°C gemessen. Da wie oben bereits festgestellt, die Laichwanderung temperaturabhängig ist, könnte auch in der hier vorliegenden Untersuchung ein Zusammenhang zwischen der Anzahl der gefangenen Finten und der Wassertemperatur vorliegen. Da mit steigender Temperatur die Gonadenreifung zunimmt, steigt auch die Wanderungsrate der Finten und folglich werden sie in den Hamenfängen erfasst. Auch GUILLARD & COLON (2000) wiesen eine positive Korrelation zwischen der Anzahl der erfassten Finten und der ansteigenden Wassertemperatur nach. Der Rückgang der Fangzahlen im Hamen Anfang/ Mitte Mai ist eventuell auf die niedrigeren Wassertemperaturen oder auch auf die höheren Oberwasserabflussmengen zurückzuführen, die parallel zu den zurückgehenden Wassertemperaturen in dieser Zeit gemessen wurden. Die Abhängigkeit der Fangergebnisse an Laichfischen vom Oberwasserabfluss (negative Korrelation mit steigendem Abfluss) wird durch die langjährigen Erfahrungen der Berufsfischer bestätigt (U. WILLIG, mdl. Mitt. 2004). Seinen Aussagen zufolge werden die Finten von den großen Mengen an Süßwasser „zurückgedrängt“. Es ist denkbar, dass der Flutstrom durch die ansteigenden Abflussmengen schwächer wird. Da die Finten die Fluttide für ihren Laichaufstieg nutzen, ist es bei hohen Abflussmengen möglich, dass die Finten dadurch in geringeren Anzahlen nachzuweisen sind. Die hohen Abflussmengen können jedoch auch bedeuten, dass die Fische einige Zeit brauchen, um sich an den sich ändernden Salzgehalt anzupassen (Osmoregulation) und sich bei hohen Abflussmengen mit der Tide in Bereiche mit höherem Salzgehalt „zurückfallen“ lassen. Nach WITTMACK (1875) wurde bei Elsfleth (etwa UW-km 30) beobachtet, dass die Alsen nur dann in großer Anzahl vorkamen, wenn die Unterweser wenig Oberwasser führte, welches die hier genannten Vermutungen unterstützt. Diskussion 56 Wie viel Zeit die Tiere bei ihrer Wanderung vom äußeren Ästuar bis zu ihrem Laichplatz benötigen, kann hier nur abgeschätzt werden. Der erste Fang von adulten Finten im Laichgebiet konnte gegen Ende April verzeichnet werden. Nach Aussagen des Berufsfischers U. Willig konnten die Finten ca. eine bis zwei Wochen vor diesem Termin in hohen Abundanzen weiter stromab (etwa UW-km 50) nachgewiesen werden. Folglich würden die Tiere für eine Wanderstrecke von ca. 20 km in einer Woche täglich 3 km zurücklegen. Vom äußeren Ästuar würden die Finten demnach etwa 10 bis 14 Tage benötigen bis sie in nennenswerten Zahlen an ihrem Laichplatz angekommen sind. Nach COSTELLO et al. (2002) wandern die Tiere etwa 5 km pro Tag stromauf zu ihren Laichplätzen. Alsen sollen dagegen täglich ca. 20 km zurücklegen (BAUMGÄRTNER 2002b). MÖLLER (1991) berichtet ebenfalls von schnellschwimmenden Finten. Eine Laboruntersuchung zur Schwimmfähigkeit von Finten zeigt, dass sie maximal bis zu 2,5 ms-1 schwimmen können, wobei sie bei lang anhaltenden Schwimmphasen von ca. 200 Minuten nur noch Geschwindigkeiten von ca. 0,5 ms-1 durchhalten (CLOUGH et al. 2004). Diese Schwimmgeschwindigkeit lässt sich jedoch nicht unbedingt auf die Laichwanderung übertragen, bei der die Finten hauptsächlich die Tide nutzen, um in die Flüsse zu gelangen und sich außerdem auch langsam an den sich ändernden Salzgehalt anpassen müssen. Der Laichaufstieg endet vermutlich bei Vegesack (UW-km 18). Die Finten wandern dagegen offensichtlich derzeit nicht bis zum Weserwehr (Bremen-Hemelingen). Diese Einschätzung wird durch Aussagen des Bremer Amtsfischers gestützt, der im Jahr 2004 keine Finten in den Reusen am Weserwehr bzw. im dortigen Fischpass nachweisen konnte (R. DROSTE, mdl. Mitt. 2005). Sein Vorgänger Amtsfischer B. Boomgarden, konnte dagegen mehrfach einzelne „Maifische“ am Weserwehr fangen (ca. einen Fisch in 5 Jahren). Der letzte „Maifischfang“ im Fischpass fand 1955 statt. Dabei wurden 90 Exemplare ohne sichere Artbestimmung gefangen; hierbei könnte es sich auch um Finten gehandelt haben. Diskussion 57 5.2 Fangauswertung anhand der populationsbiologischen Daten 5.2.1 Länge und Gewicht Die maximal festgestellten Längen und Gewichte der adulten Finten (Laichfische) entsprechen weitgehend den Vergleichswerten in der Literatur. Die in dieser Untersuchung maximal nachgewiesene Länge (TL) lag bei 42 cm (♂♂) bzw. 50 cm (♀♀). HILLMAN (2003) wies 44,6 cm für Männchen und 52,0 cm für Weibchen nach. Das in vorliegender Untersuchung maximal ermittelte Gewicht betrug bei Männchen 0,64 kg und bei Weibchen 1,17 kg. Diese Werte entsprechen ebenfalls den Ergebnissen von HILLMAN (2003) von 0,7 kg (♂♂) bzw. 1,45 kg (♀♀). Der geschlechtsspezifische Unterschied in der Länge (Abb. 26) findet sich zahlreich in der Literatur bestätigt (FLORIN 1949; HASS 1965; QUIGNARD & DOUCHEMENT 1991a; APRAHAMIAN et al. 2003; DOHERTY et al. 2004; ANONYMUS 2005a). Nach CLARIDGE & GARDNER (1978) sind die Weibchen ab dem 4. Lebensjahr signifikant größer als die Männchen. Abb. 26: Oben Männchen, unten Weibchen (Farge, UW-km 29, 26.05.2004). Altersklasseneinteilung nach Fischlängen Anhand der Längenhäufigkeitsverteilung lassen sich in erster Näherung Hinweise auf die Alterszusammensetzung der gefangenen Fische ableiten. In der Literatur wird häufig der Versuch unternommen, anhand von Tabellen oder Grafiken diese Beziehung zu beschreiben, jedoch beziehen sich die Angaben nicht immer auf die Totallänge, sondern oft ist nur die Standardlänge angegeben. Diese Daten lassen sich nur schwer direkt vergleichen. Diskussion 58 Anhand der Körperlänge und der vorhandenen Gonaden ließen sich adulte Fische sehr gut von der Altersgruppe (AG) 1+ trennen. Die vorjährigen Finten (AG 1+) erreichten demnach Längen zwischen 9 und 21 cm. Die adulten Tiere wiesen Längen ab 27 cm bis zu 50 cm auf. Finten zwischen 22 - 26 cm wurden in den Hamenfängen nicht erfasst. Aufgrund des Lebenszyklus der Finte ist anzunehmen, dass sich die Altersklasse 2+ größtenteils im Meer aufhält und die Finten erst nach Erreichen der Geschlechtsreife in die Flüsse zum Laichen zurückkehren. Aus diesem Grund wurde diese AG nur äußerst selten erfasst und ist der oben genannten Größenklasse (22 - 26 cm) zuzuordnen. Bestätigt wird dies durch die Längenangaben von MAITLAND & HATTON-ELLIS (2003), die für 2 Jahre alte Finten Längen zwischen 20 - 25 cm und für 3 Jahre alte Finten 25 - 30 cm angeben. Auch in der Elbe erreichen die Finten in ihrem 2. Lebensjahr eine mittlere TL von etwa 20 cm (THIEL et al. 1996a). Demnach wären die in vorliegender Untersuchung gefangenen Finten > 25 cm in die AG 3+ einzuordnen. Die Angaben über das Erreichen der Geschlechtsreife variiert in der Literatur. Generell können Finten bereits im Alter von 2 Jahren geschlechtsreif werden (APRAHAMIAN et al. 2001). Größtenteils laichen Weibchen jedoch erstmalig im Alter von 4 - 5 Jahren, Männchen mit 3 - 4 Jahren (HASS 1965; APRAHAMIAN et al. 1998, 2003). Da alle in vorliegender Untersuchung untersuchten Finten > 25 cm auch geschlechtsreif waren, können sie der AG 2+ und älter zugeordnet werden, wobei jedoch die meisten Fische erneut in die AG 3+ eingeordnet werden müssen. Bei Hamenbefischungen in der inneren Außenweser im Januar 2005 wurden Finten mit Längen von 16 - 21 cm nachgewiesen (HAESLOOP 2005). Diese Fische entsprechen den in dieser Untersuchung gefangenen einjährigen Finten, die im August 2004 Längen von 12 bis 21 cm aufwiesen. Aufgrund des Jahresbeginns (2005) müssen die von HAESLOOP (2005) gefangenen Finten bereits in die AG 2+ eingeordnet werden. Diese Daten belegen außerdem, dass im Winter nur wenig bis gar kein Wachstum stattfindet und erst im nächsten Frühjahr wieder einsetzt. Die Fische weisen demnach ähnliche Größen von Herbst bis Anfang Frühling auf (EHRENBAUM 1894; CLARIDGE & GARDNER 1978). Gleiches wird auch vom Stint beschrieben, bei dem sich eine sommerliche Wachstumsphase von April bis September mit einer Verlangsamung des Wachstums bis praktisch zum Stillstand von Oktober bis März abwechselt (LILLELUND 1961). Auch die folgenden Vergleiche mit verschiedenen Literaturangaben bestätigen die oben aufgestellte Altersgruppenzuordnung. Wenn man den Alters-Längenangaben von HILLMAN (2003) folgt, waren die hier gefangenen Weibchen 2 - 9 Jahre alt, die Männchen 2 - 6 Jahre Diskussion 59 alt. Bei Vergleichen mit Elbfinten waren die hier gefangenen Männchen dagegen 3 - 5 Jahre, die Weibchen 4 - 6 Jahre alt (JENKINS 1902) bzw. alle gefangenen adulten Tiere 3 - 7 Jahre alt (HASS 1965). Zusammenfassend lässt sich sagen, dass die in vorliegender Untersuchung im Bereich der limnischen Unterweser gefangenen Laichfische in die Altersklasse 2+ und älter eingeordnet werden können. Vor dem Hintergrund der bekannten Biologie und aufgrund von Literaturvergleichen ist jedoch anzunehmen, dass die meisten gefangenen Tiere eher in die Altersklasse 3+ einzuordnen sind. Genauere Aussagen zum Alter hätte die Untersuchung der Otolithen oder eine Schuppenuntersuchung liefern können. Da die Otolithen mit dem Alter der Fische an Größe zunehmen, entwickeln sich sogenannte „Jahresringe“, die einen Rückschluss auf das Fischalter zulassen. Ähnliche „Jahresringe“ sind auch auf den Schuppen erkennbar. Längen-Gewichts-Relation Die relativ große Streuung des Gewichts bei gleicher Totallänge liegt an den unterschiedlichen Gewichten der Geschlechtsprodukte. Je nach Laichreife sind die Gonaden unterschiedlich entwickelt und damit auch unterschiedlich schwer. Außerdem ist bekannt, dass mit zunehmender Länge (Alter) die Fruchtbarkeit der Tiere ansteigt (Anzahl der Eier im Ovar) (HASS 1965; MANYUKAS 1989; APRAHAMIAN et al. 2003). Ein Literaturvergleich der r2-Werte lässt sich mit der Untersuchung von HILLMAN (2003) herstellen. Der in der vorliegenden Untersuchung ermittelte r2-Wert beträgt 0,875 (♀♀ und ♂♂), während HILLMAN (2003) einen Wert von 0,8128 angibt. Für Weibchen und Männchen getrennt betrachtet ergab sich bei dieser Untersuchung ein höherer r2-Wert für die Männchen (0,8018) als für die Weibchen (0,6403). Bei der Untersuchung von HILLMAN (2003) verhält es sich genau anders herum. Dabei ist anzumerken, dass bei HILLMAN’S Arbeit nur 5 Männchen und 54 Weibchen betrachtet wurden, während in dieser Untersuchung 184 Männchen und 293 Weibchen untersucht wurden. Diskussion 60 5.2.2 Kiemenreusendornen Die Anzahl der Kiemenreusendornen (Krd.) auf dem ersten Kiemenbogen der adulten Finten variierte zwischen 35 und 44. Vergleichbar sind die hier ermittelten Anzahlen am Besten mit denen von BERG (1962): 35 - 42, LADIGES & VOGT (1979): 35 - 45, DUNCKER & LADIGES (1960): 35 - 45, CLARIDGE & GARDNER (1978): 38 - 47 (Fluss Severn), HILLMAN (2003): 35 46 (Großbritannien) und mit den Elbfinten von HASS (1965): 35 - 44. Die einjährigen Finten wiesen naturgemäß weniger Krd. auf, da die Anzahl der Krd. mit dem Alter zunimmt. Aus diesem Grund sollte die Anzahl der Krd. nur bei adulten Finten als Bestimmungsmerkmal genutzt werden. Gleiches gilt für Vergleiche von Populationen unterschiedlicher Flüsse. Zusammenhang zwischen Anzahl der Kiemenreusendornen und Körperlänge Die Zahl der Krd. des 1. Kiemenbogens steigt mit zunehmender Körperlänge an. Die Steigung der Regressionsgerade ist bei der AG 1+ größer, als bei der AG 2+ und älter. Aus dieser Steigung ergibt sich, dass die Zahl der Krd. um so weniger von der Zunahme der Körperlänge abhängt, je älter der Fisch wird. Bei Tieren > 25 cm ist also eine Erhöhung der Anzahl der Krd. nur noch in geringem Maße zu erwarten. Auch bei den Untersuchungen von HILLMAN (2003) ergab sich bei Finten zwischen 35 und 55 cm kein Zusammenhang zwischen der Anzahl der Krd. und der zunehmenden Körperlänge der Fische. Der ermittelte r2-Wert bei HILLMAN (2003) ist sogar noch geringer als in dieser Untersuchung (HILLMAN: 0,0016, diese Untersuchung: 0,1483). Artunterscheidung zwischen Alse und Finte Die Möglichkeit der Hybridisation von Alse und Finte existiert und wurde z.B. in der Loire beobachtet (BOISNEAU et al. 1985; STEMMER 2003). Auch HOEK (1900) mutmaßt über eine Kreuzung der beiden Arten im Rhein. Die Artzugehörigkeit kann dabei eindeutig über die Anzahl der Krd. ermittelt werden. Alle im Rahmen dieser Untersuchung gefangenen Tiere wiesen Kiemenreusendornenanzahlen zwischen 35 und 44 auf und gehörten damit eindeutig der Art Alosa fallax an. In der Weser konnten weder Alsen (Alosa alosa) (85 - 130 Krd.; WHITEHEAD 1984) noch Hybriden zwischen den beiden Arten (60 - 90 Krd.; BOISNEAU et al. 1985) konnten nachgewiesen werden (Abb. 27). Diskussion 61 Abb. 27: Linkes Bild: Kiemenbogen einer Alse (links) und einer Finte (rechts) (verändert nach HASS 1965). Rechtes Bild: Kiemenbogen einer weiblichen Finte (links) und einer männlichen Finte (rechts) aus der Unterweser vom 12.05.2004. In der Elbe konnten bei den umfangreichen Untersuchungen von MÖLLER (1984) ebenfalls keine Alsen nachgewiesen werden. Es wird überhaupt angezweifelt, ob diese Art jemals in der Elbe vertreten war. „...ergibt sich, dass die Alse zwar bis gegen Ende des letzten Jahrhunderts (19. Jahrhundert) noch vereinzelt als Irrgast die Elbe aufwärts gestiegen, ein Fang derselben in der Niederelbe aber schon seit über 300 Jahren zweifelhaft und seit der Gründung des Hamburger Museums (1843) bestimmt nicht mehr vorgekommen ist“ (DUNCKER & LADIGES 1960). Nach MÖLLER (1984) dürften gegenteilige Behauptungen auf einer Verwechslung mit der Finte beruhen. Für die Alse, die zwischenzeitlich seit mindestens einem Jahrzehnt nicht mehr nachgewiesen wurde, gibt es jedoch in neuerer Zeit wieder Einzelfunde. Diese belegen, dass sie in den deutschen Flüssen noch nicht völlig ausgestorben ist. Es ist jedoch anzunehmen, dass es sich hierbei bisher nur um Irrgäste handelt, da noch keine reproduzierende Population nachgewiesen werden konnte. Im Einzugsgebiet der Elbe gab es für das Jahr 2001 (Ende Juni) einen Fund aus der Havel (www.mlur.brandenburg.de; KLOPPMANN et al. 2003a; STEINMANN et al. 2005). Für die Leine konnte im Jahr 2004 eine Alse nachgewiesen werden (HA-ZEITUNG 2004; L. MEYER, mdl. Mitt. 2005). Im Rhein wurden in den Jahren 2000 - 2002 im Fischpass an der Staustufe in Iffezheim insgesamt neun Alsen registriert (BAUMGÄRTNER 2002a; BEECK 2003; DEGEL 2003). Ob es sich dabei um eine eigenständige Rhein-Population handelt oder nur um Irrläufer aus französischen Populationen ist fraglich. Von der Universität Köln (Dr. Peter Beeck) wird derzeit die Wiederansiedlung der Alse im Rhein geprüft (BEECK 2003; P. BEECK, schr. Mitt. 2004). Kommerzielle Fänge der Alse gibt es noch in Frankreich im Gewässersystem der Gironde mit ihren Zuflüssen Garonne und Dordogne (BAGLINIÈRE et al. 2001; LAMBERT et al. 2001). Diskussion 62 Ob sich mit den aktuellen Nachweisen eine Bestandserholung andeutet, erscheint fraglich und bleibt zukünftigen Beobachtungen vorbehalten. Für die Weser gibt es anhand dieser Untersuchung bzw. neben dem Einzelfund aus der Leine keine weiteren Hinweise, dass die Alse die Weser wiederbesiedelt. Populationsfrage Die durchschnittliche Anzahl der Krd. bei adulten Finten aus verschiedenen Flusssystemen unterscheidet sich (Tab. 13) und ist demnach ein geeignetes Merkmal zur Abgrenzung von einzelnen Populationen, insbesondere zwischen Populationen aus der Nordsee und dem Atlantik. Tab. 13: Anzahl der Kiemenreusendornen der Finte aus verschiedenen Flusssystemen (verändert nach HASS 1965, QUIGNARD & DOUCHEMENT 1991a, APRAHAMIAN et al. 2003 und HILLMAN 2003). Fluss, Land (Autor) Kiemenreusendornen ( x ) Zahl der untersuchten Fische Elbe, Deutschland (HASS 1965) Weser, Deutschland (diese Untersuchung) Großbritannien (HILLMAN 2003) Rhein, Niederlande (HOEK 1899) Tejo, Portugal (ALEXANDRINO 1996) Guadiana, Portugal (EIRAS 1980) Sebou, Marokko (SABATIÉ 1993) Guadiana, Portugal (ALEXANDRINO 1996) Loukos, Marokko (SABATIÉ 1993) Charente, Frankreich (VÉRON 1999) Barrow, Irland (DOHERTY & MC CARTHY 2002) Douro, Portugal (EIRAS 1980) Garonne, Frankreich (DOUCHEMENT 1981) Loire, Frankreich (DOUCHEMENT 1981) Mondego, Portugal (ALEXANDRINO 1996) Adour, Frankreich (DOUCHEMENT 1981) Lima, Portugal (ALEXANDRINO 1996) 39,76 39,89 40,15 40,67 41,23 41,66 41,77 41,91 41,97 42,00 42,10 42,17 42,44 44,96 46,41 47,51 52,63 208 389 65 15 104 89 231 140 39 Generell weisen nördliche Populationen weniger Krd. auf als südliche Populationen (Tab. 13). Die mittlere Anzahl der Krd. in der Weser ist somit niedriger als in vielen anderen Flüssen. Am Besten vergleichbar ist die Anzahl mit Flüssen in Deutschland, in den Niederlanden und Großbritanniens. Zudem lassen sich unter Einschränkungen Unterschiede zwischen Populationen, aus den Nordseezuflüssen und aus den Zuflüssen des Atlantiks erkennen. Hierbei ist allerdings zu beachten, dass die Anzahl der untersuchten Individuen in den einzelnen Un- Diskussion 63 tersuchungen stark schwankt. Bei Alsen kann die mittlere Anzahl der Krd. sogar innerhalb eines Flusses unterschiedlich sein, was die hohe Variabilität in diesem Merkmal belegt (APRAHAMIAN et al. 2003; BEECK 2003). Da die Anzahl der Krd. mit der Körperlänge bzw. auch dem Alter ansteigt, sollte außerdem immer eine ausreichend hohe Anzahl an Finten untersucht werden. Auch in vorliegender Untersuchung konnte bereits ein geringer Unterschied in der mittleren Anzahl der Krd. aufgrund des vorhandenen Sexualdimorphismus festgestellt werden (♂♂: 40,30; ♀♀: 39,11). Die Frage, ob die in der Weser gefangenen Finten als selbständiger Bestand aufzufassen sind, oder ob sie mit benachbarten Populationen (Elbe, Ems) an der Küste in einem Austausch stehen, bleibt offen. Die Mittelwerte der Krd. der in der Weser gefangenen Finten und der „Elbfinten“ sind nahezu identisch. Nach FRICKE (2004) sollte derzeit davon ausgegangen werden, dass die Fintenpopulation in den Flüssen Rhein, Ems, Weser, Elbe sowie in der westlichen Ostsee weitgehend voneinander isoliert sind. Eine DNA-Analyse auf dem Populationsniveau, die eine endgültige Klärung liefern könnte ist derzeit in Planung (R. FRICKE, Staatl. Mus. für Naturkunde, schr. Mitt. 2005). Diskussion 64 5.2.3 Punkte In der älteren Literatur wurde zur Artdiagnose vielfach das Merkmal unterschiedlicher Fleckung hinter dem Kiemendeckel verwendet. Demnach sollen Alsen meist nur einen oder zwei Flecken aufweisen, während Finten mehr als zwei Punkte besitzen sollen (MARSHALL 1895; NOLTE 1976). Zudem wird in der Literatur meistens nicht erwähnt in welchem Zustand (beschuppt oder unbeschuppt) die Flecken gezählt wurden. In vorliegender Untersuchung konnte festgestellt werden, dass nach Beseitigung der Schuppen meist noch mehrere schwarze Punkte sichtbar wurden. In manchen Fällen bleibt jedoch selbst nach der Beseitigung der Schuppen nur ein Fleck zurück und belegt damit die Unzuverlässigkeit dieses Merkmals zur Artbestimmung, welches auch in der Literatur bestätigt wird (EHRENBAUM 1921; HASS 1965; FRICKE 2004). Bei den untersuchten Finten aus der Weser konnten 1 - 17 schwarze Flecken nachgewiesen werden ( x : 4,24, n = 440). Die Ergebnisse entsprechen den Befunden der Untersuchung von HILLMAN (2003), bei der Flecken zwischen 1 - 15 ( x : 4,47, n = 95) gezählt wurden. Zusammenfassend lässt sich sagen, dass die Fleckung charakteristisch für die Gattung Alosa ist, doch ist ihre Zahl und Deutlichkeit sehr variabel und nicht zur Artunterscheidung geeignet (Abb. 28). Abb. 28: Finte mit nur 1 schwarzen Punkt (links) und mit 16 schwarzen Punkten (rechts) hinter dem Kiemendeckel. Diskussion 65 5.2.4 Geschlecht Geschlechterverteilung Während der gesamten Probenahme überwogen die Weibchen in den Fängen. Ein Erklärungsansatz wäre die von STERNER (1918), EHRENBAUM (1921) und SCHNAKENBECK (1928) beschriebene Eigentümlichkeit des Maifischfangs: Tagsüber werden mehr Rogner als Milchner gefangen. Die hier durchgeführten Hamenfänge wurden auch meistens tagsüber durchgeführt, sodass sich eventuell dadurch erklären lässt, warum 61 % der gefangenen Fische Weibchen waren. Dem entgegenzustellen ist das Fangergebnis Nr. 7 (Nachtfang, 17./18.05.2004), in dem von 96 gefangenen Fischen 93 Weibchen waren. Bei den Untersuchungen von HASS (1965) verhielt es sich umgekehrt. Dort wurden über die gesamte Laichzeit mehr Männchen, als Weibchen gefangen, welches der Autor darauf zurückführt, dass sich die Männchen über die gesamte Laichzeit hinweg im Fluss aufhalten, wohingegen die Weibchen bald nach dem Laichen wieder abwandern. Andererseits zählen die Finten zu den Portionslaichern, und demnach müssten sich auch die Weibchen längere Zeit am Laichort aufhalten (s.u.). Trotzdem muss davon ausgegangen werden, dass während der Laichzeit durch Zu- und Abwanderung mit einer kontinuierlichen Veränderung des Geschlechterverhältnisses des Laichfischbestandes im Laichgebiet gerechnet werden muss. Übrigens wird von Stinten ein ähnliches Bild über die sexuelle Zusammensetzung der Laichschwärme aufgestellt (LILLELUND 1961). Ein weiterer Erklärungsansatz wäre, dass die Weibchen während der Laichzeit aktiver sind und so öfter im Netz gefangen werden, was jedoch für pelagische, nicht strukturgebundene Fische als wenig wahrscheinlich erscheint. Auftreten der Geschlechter Im Auftreten der Geschlechter zeigten sich keine deutlichen Strukturen. Der Literatur zufolge beginnen die Männchen eine oder zwei Wochen vor den Weibchen mit der Laichwanderung (CLARIDGE & GARDNER 1978; MAITLAND & HATTON-ELLIS 2003). Dem stehen die Aussagen von EHRENBAUM (1921), SCHNAKENBECK (1928) und MOHR (1941) gegenüber, dass zu Beginn der Laichzeit mehr Rogner auftreten, dann jedoch zunehmend die Milchner überwiegen. Gegen Ende der Laichzeit sollen nur noch Milchner gefangen werden. Den Ergebnissen dieser Untersuchung zufolge kann letzteres unter Umständen übereinstimmen, da zum Ende der Laichzeit, zwar in geringen Mengen, mehr Männchen als Weibchen nachgewiesen wurden. Diskussion 66 5.2.5 Laichreife In den einzelnen Fängen konnten jeweils verschiedene Stadien der Laichreife bei den Finten nachgewiesen werden, was darauf beruht, dass die einzelnen Individuen eine unterschiedliche Entwicklungsgeschwindigkeit und Wandergeschwindigkeit aufweisen. Anhand von zwei Beispielfängen kann außerdem die Annahme gestützt werden, dass während der Laichwanderung die Geschlechtsprodukte bis zur Laichreife weiter heran reifen. Im Fang vom 12.05.2004 (Farge) waren alle gefangenen Finten in einem „fließenden Zustand“, hingegen waren in einem Fang einen Tag später weiter flussabwärts (Rechtenfleth) nur 4 % in diesem Zustand. 96 % der gefangenen Tiere war noch nicht laichbereit. Darüber hinaus wiesen die Eier der Ovarien der einzelnen Tiere eine unterschiedliche Entwicklung zur gleichen Zeit auf. Dies wurde bereits von JENKINS (1902) und von MANYUKAS (1989) festgestellt. Die Autoren fanden jeweils große und kleine Eier in den untersuchten Ovarien. Die Eizellen weisen im Ovar unterschiedliche Reifungsstadien zur gleichen Zeit auf, was bedeutet, dass die Finten während der Laichzeit mehrfach laichen (PINA et al. 2003) und auch OLNEY et al. (2001) zeigen, dass Alosa sapidissima schubweise über einen Zeitraum von Tagen oder Wochen laicht und somit zu den Portionslaichern gezählt werden kann. Daraus lässt sich ableiten, dass auch die Finten in der Weser über einen Zeitraum mehrfach laichen. 5.2.6 Mageninhalt Mageninhalt Die Ergebnisse der Mageninhaltsuntersuchungen waren sehr überraschend, da sie im Gegensatz zu den Literaturangaben stehen. Finten sollen demnach während ihrer Laichwanderung keine Nahrung aufnehmen (CLARIDGE & GARDNER 1978; WHEELER 1978; STEINBERG 1992; MAITLAND & HATTON-ELLIS 2003). Auch für die verwandte Art Alosa sapidissima wird dies von LEIM (1925) und CHITTENDEN (1976) angegeben. Von ATKINSON (1951) wird jedoch bezweifelt, dass Alosa sapidissima während ihres Aufenthaltes im Süßwasser keine Nahrung zu sich nimmt, sondern der Autor ist sich sicher, dass die Fische Nahrung aufnehmen würden, wenn welche vorhanden ist. Auch in vorliegender Untersuchung konnte gezeigt werden, dass die Finten aus der Unterweser während der Laichwanderung Nahrung zu sich nehmen, da tatsächlich nur insgesamt 18 % der 443 untersuchten Mägen leer war. Auszuschließen ist auch, dass die Finten den Inhalt der Mägen vom Meer oder äußeren Ästuar mitgebracht haben, da die vorgefundenen Nahrungspartikel zum Teil noch sehr frisch und Diskussion 67 kaum verdaut waren. Zum anderen konnten in den allermeisten Fällen die Organismen aus den Fintenmägen zeitgleich auch in den Hamenfängen nachgewiesenen werden. Vorstellbar ist, dass sich die Finten während der Laichwanderung nicht aktiv ernähren bzw. nicht auf „Raubzug“ gehen, sondern Organismen aufnehmen, die in unmittelbarer Nähe vorhanden sind. Ähnliches wird von LEIM (1925) für Alosa sapidissima angegeben. Die Hauptnahrungsbestandteile der Finte in der Unterweser sind Fischlarven, besonders Stint und Hering, sowie Crustaceen (Neomysis integer). Es ist nicht auszuschließen, dass die Finten auch kleinere Nahrungsorganismen aufgenommen haben, die mit bloßem Auge im Nahrungsbrei nicht erkennbar waren und deshalb hier nicht berücksichtigt werden konnten. Nach HILLMAN (2003) zählen Fische und besonders die Sprotte zu den am häufigsten nachgewiesenen Nahrungsorganismen bei im Meer gefangenen Finten. Untersucht wurde ebenfalls ein Exemplar aus dem ästuarinen Bereich: Neben Fischen enthielt der Magen auch Mysidaceen. HOEK (1900) gibt an, dass Finten entweder nichts oder Reste von Fischen, Hydroidpolypen, Mysidaceen oder Corophium im Magen hatten. Er beschreibt auch die unterschiedliche Nahrungsaufnahme von Alse und Finte, welches in der Beschaffenheit und Anzahl der Krd. begründet liegt. Da die Alsen zahlreichere und wesentlich feinere, enger zusammenstehende Krd. besitzen als die Finten, ernähren sie sich hauptsächlich von Plankton. Dies ist der Finte mit den vergleichbar wenigen, groben und knochigen Krd. nicht möglich. Die Aussagen werden von EHRENBAUM (1936) bestätigt: Alsen sollen sich demnach im Brackwasser von Copepoden, Neomysis und von Corophium ernähren, während sie die Ernährung im Süßwasser einstellen. Die Finten sollen hingegen in höherem Maße Fische (Heringe, Sandaal) aufnehmen. Laut APRAHAMIAN (1989) nehmen die adulten Finten nach dem Laichen folgende Organismen zu sich: Mysidaceen, Gammariden, Garnelen und gelegentlich auch einige Fische. Zu den Nahrungsorganismen im Ästuar (Portugal) zählen hauptsächlich Fische, Mysidaceen und Garnelen (ASSIS et al. 1992). Die Ernährungsweise muss jedoch für jeden Fluss und jeden Bereich im Ästuar sowie jeden Untersuchungszeitraum differenziert betrachtet werden. Man kann davon ausgehen, dass die Nahrungswahl der Fische in erster Linie von der Verfügbarkeit und vom Energiegehalt abhängt. Daher ist es sehr gut möglich, dass sich die Finten stärker piscivor ernähren, wenn ausreichend Fische zur Verfügung stehen. Die Literaturangaben, wonach Finten kleinere Organismen präferieren sollen, können zum Teil darauf beruhen, dass keine anderen Nahrungs- Diskussion 68 quellen vorhanden waren. Die verstärkte Annahme von piscivorer Ernährungsweise im Meer kann ihre Ursache im reichen Fischangebot haben. Es ist möglich, dass im Untersuchungszeitraum der vorliegenden Untersuchung viele Fischlarven (Stinte und später Heringe) vorhanden waren, die dann auch bevorzugt aufgenommen wurden. Die räumlich/ zeitliche Variabilität der Nahrungsverfügbarkeit ist sehr hoch (Abb. 29). Daher konnten auch an manchen Tagen viele Stintlarven als Nahungspartikel gefunden werden. Gleiches gilt auch für die Aufnahme der jungen Heringe (Abb. 29). Diese konnten gleichzeitig mit dem Auftreten in den Hamenfängen auch in den Mägen der Finten nachgewiesen werden. Abb. 29: Variierender Mageninhalt von Finten. Linkes Foto: Stintlarven und Crustaceen, Farge 11.06.2004; Rechtes Foto: Heringe, Farge 26.05.2004. Zusammenhang Magenfüllungsgrad und Laichreife Der Zusammenhang zwischen der Nahrungsaufnahme und der Laichreife bei adulten Finten findet sich auch in der Literatur. Bei APRAHAMIAN (1989) wird zwischen „pre-spawning“, „partially-spawning“ und „post-spawning“ unterschieden. Die Individuen der Kategorie „prespawning“ nehmen nach APRAHAMIAN (1989) nur wenig Nahrung auf. 48,3 % der von ihm untersuchten Tiere (n = 60) wiesen einen leeren Magen auf. Die Prozentangaben für leere Mägen an Stationen im Süßwasser lagen sogar noch höher: zwischen 60,0 % und 69,4 %. Erst die Tiere der „post-spawning“ Gruppe ernährten sich wieder aktiv. Diese Angaben decken sich zum Teil mit denen vorliegender Untersuchung, wenn die folgenden Zustände einander zugeordnet werden: „pre-spawning“ = „nicht fließend“, „partially-spawning“ = „fließend“ und „post-spawning“ = „abgelaicht“. Der niedrige Prozentsatz von Tieren mit leeren Mägen bleibt aber widersprüchlich. Im Jahr 2004 nahmen die untersuchten Finten bei ihrer Laichwanderung in der Unterweser mehr Nahrung auf als in den oben genannten Untersuchungen beschrieben wurde. Die Prozentangaben Diskussion 69 für leere Mägen auch bei nicht fließenden (20,9 %) und fließenden (15,2 %) Tieren sind wesentlich geringer als bei APRAHAMIAN (1989) (s.o.). Der Mageninhalt hätte korrekterweise immer zur gleichen Zeit untersucht werden müssen, da die Tiere eventuell zu unterschiedlichen Zeiten unterschiedlich viel Nahrung zu sich nehmen (vgl. OESMANN & THIEL 2001). Dies wurde bei dieser Arbeit nicht berücksichtigt. Hauptsächlich sollte herausgefunden werden, ob Finten während ihrer Laichwanderung überhaupt Nahrung zu sich nehmen. Die Verweigerung der Nahrungsaufnahme wie an anderer Stelle beschrieben, konnte jedoch hier deutlich nicht belegt werden. 5.2.7 Einjährige Finten In 2004 wanderten die einjährigen Finten aus dem äußeren Ästuar bzw. aus der Nordsee in die Unterweser bis ins Süßwasser ein. Das massenhafte, unerwartete Auftreten dieser AG konnte vom Hamenfischer U. Willig für die Vorjahre dagegen nicht bestätigt werden. Es ist demnach nicht klar, ob Finten dieser AG tatsächlich jedes Jahr Wanderungen in die Unterweser unternehmen. Dabei stellt sich die Frage, warum die Fische solche weiten Wanderungen vom Meer oder äußeren Ästuar bis in limnischen Bereiche der Unterweser unternehmen, wobei sie, wie allgemein angenommen wird im Meer aufwachsen und erst zum Laichen in die Flüsse zurückkehren sollen. Man muss davon ausgehen, dass die Umstellung der Osmoregulation vom Salzzum Süßwasser erhebliche Strapazen für die Fische bedeutet. Die adulten Tiere gehen diese Strapazen ein, um im Fluss zu laichen, aber welche Gründe haben die einjährigen, noch nicht geschlechtsreifen Finten diese Wanderungen durchzuführen? Eine Erklärung dafür wäre die Nahrungssuche. Zur Fangzeit und auch im selbigen Fanggebiet traten die Schwebegarnelen (Neomysis integer) sehr zahlreich in Erscheinung. Diese konnten stichprobenartig auch in den Mägen der einjährigen Finten nachgewiesen werden. Ob die Nahrungssuche der einzige Grund für die Wanderung ist, bleibt dennoch offen. Nach APRAHAMIAN (1988) kehrt ein Teil der einjährigen Finten im Frühjahr ins Ästuar zurück, um dann erneut im späten Sommer bis frühen Herbst seewärts zu wandern, jedoch konnten in vorliegender Untersuchung die einjährigen Fische sogar im tidebeeinflussten Süßwasser nachgewiesen werden. Der von APRAHAMIAN et al. (1998) aufgestellte schematische Lebenszyklus der Finte kann prinzipiell auch für die Weserfinten angewandt werden. Der Lebenszyklus wurde jedoch anhand der in dieser Untersuchung gefundenen Daten angepasst (Abb. 30). Diskussion 70 Abb. 30: Lebenszyklus der Finten in der Unterweser, verändert nach APRAHAMIAN et al. 1998. Neben den üblichen Größen traten unter den Vorjährigen einige Finten auf, die Ende Juli 2004 nur 9 cm lang waren. Es stellt sich damit die Frage, ob es sich bei diesen Fischen ebenfalls um einjährige Fische (AG 1+) handelt oder ob dies bereits schnellwüchsige Fische aus dem Jahr 2004 (AG 0+) sind, die demnach nach 2 ½ Monaten bereits auf 9 cm herangewachsen sein müssten. Laut Literatur erscheint es allerdings als sehr unwahrscheinlich, dass es sich hierbei um Fische aus der AG 0+ handeln könnte. Zum einen lag die beobachtete Laichzeit Mitte Mai 2004, und zum anderen dürften die Finten nach Literaturangaben nach ca. 2 - 3 Monaten nur etwa 3 - 6 cm lang sein und erst nach 5 - 6 Monaten Längen von ca. 9 cm erreichen (EHRENBAUM 1894). Nach APRAHAMIAN et al. (1988) erreichen die Juvenilen sogar erst nach 6 Monaten 5 cm und nach einem Jahr 10 bis 15 cm. KÖHLER (1981) fand Jungfinten von Ende August bis Ende September, welche eine Länge von 3 - 5 cm aufwiesen. Im Oktober und November erreichten sie Längen von 6 - 8 cm. Nach den Ergebnissen dieser Untersuchung kann man davon ausgehen, dass das Wachstum der Finten in der Weser relativ schnell verläuft. Im Sommer 2004 wiesen die einjährigen Finten bereits Längen von 9 - 21 cm auf. Es ist jedoch anzunehmen, dass die kleineren, von den mittleren durchschnittlichen Längen abweichenden Finten eher langsam wüchsige Fische der AG 1+ sind, als schnellwüchsige aus dem Jahr 2004 (AG 0+). Diskussion 71 5.2.8 Zusammensetzung des Beifangs Die hier ermittelte Artenzusammensetzung des Beifangs ist relativ typisch für die Unterweser und den Untersuchungszeitraum (SCHIRMER 1991; SCHUCHARDT et al. 1993; SCHEFFEL & SCHIRMER 1997; HAESLOOP 2004a). Es kommen neben den Süßwasserfischen auch marine und euryhaline Fischarten vor. Auch die räumlichen und saisonalen Unterschiede im Auftreten einiger Fischarten sind bekannt und beruhen z.B. auf Laichwanderungen (u.a. Fluss- und Meerneunauge) oder auf die unterschiedliche Wasserführung der Unterweser (Süßwasser (mehr Brassen - Brackwasser, mehr Kaulbarsche) (Abb. 31, 32). Eine scharfe Abgrenzung zwischen den Lebensräumen und den Arten gibt es nicht. Das Begleitartenspektrum der Finte in der Weser ist nur schwer vergleichbar mit Literaturangaben, da die Flüsse sehr unterschiedlich sind. CHANGEAUX & PONT (1995) geben z.B. folgende Arten an: Aal, Schwarzer Zwergwels, Rotfeder, Ukelei, Zander, Flussbarsch, Plötze, Döbel und Schleie. Zu den Besonderheiten der Weser zählen in jedem Fall die jungen Heringe, die bis ins tidebeeinflusste Süßwasser nachzuweisen waren (bis UW-km 28) und im Gegensatz zur allgemeinen Lehrmeinung für die Fischer zum regulären Fangbild der Unterweser gehören (Abb. 31). Daher scheint die Wanderung kein Einzelfall zu sein, da die Fischer jedes Jahr fest mit dem Auftreten der von ihnen so genannten „Spitzen“ rechnen, um sie, neben der Stintbrut, als Köder für ihre Aalkörbe zu nutzen. Nach Literaturangaben führen die Heringe Wanderungen in küstennahen Gebieten auch in der Deutschen Bucht durch, jedoch wird nicht explizit erwähnt, dass diese Wanderungen bis ins Süßwasser reichen können (TEROFAL 1974; KLINKHARDT 1996). Von KLINKHARDT (1996) wird angegeben, dass die Heringe einen Salzgehalt unter 2 ‰ meiden. Für die Unterelbe wird von SCHNAKENBECK (1928) berichtet, dass die jugendlichen Heringe mit dem Hamen zu fangen sind und nach THIEL et al. (1995) kommen die Heringe in Gebieten mit einem Salzgehalt von nur 1 - 3 ‰ vor. Für die Unterweser gibt es Hinweise, dass vereinzelt Heringe vorkommen (SCHUCHARDT et al. 1993; SCHEFFEL & SCHIRMER 1997), jedoch gilt das Auftreten im Süßwasser als ungewöhnlich. Hingegen ist in der Literatur häufig zu finden, dass die Heringe auch bereits im jungen Alter ein Schwarmverhalten aufweisen (WHEELER 1978; GALLEGO & HEATH 1994). Die Heringe laichen zu unterschiedlichen Jahreszeiten (DE HAAS & KNORR 1990) im Frühjahr, Sommer, Herbst und Winter (JONES 1968). Bei den hier nachgewiesenen juvenilen Heringen könnte es sich demnach um die Brut der Herbst- bzw. Winterlaicher handeln. Diskussion 72 Abb. 31: Beifang (hauptsächlich Hering und Finte) vom 26.05.2004, Farge (UW-km 29). Abb. 32: Beifang (Kaulbarsch, Stint (Jungfische), Hering, Flunder, 1+ Finte) vom 29.07.2004, Rechtenfleth (UW-km 46). Besonders hervorzuheben sind außerdem noch die FFH-Arten Flussneunauge und Meerneunauge. Diese konnten in der Zeit von Anfang Mai bis Anfang August im Untersuchungsgebiet zwischen UW-km 28 und 46 nachgewiesen werden. Eine weitere Besonderheit ist die eingeschleppte Art (Micropogonias undulatus, Einzelfund), die zu den Umberfischen gehört und in den nordamerikanischen Brackwasserregionen einen bedeutenden Nutzfisch darstellt. Diskussion 73 5.3 Laichverhältnisse und Reproduktion Die Unterweser wurde im Jahr 2004 von den Finten besiedelt und als Laichplatz genutzt (Abb. 33). Abb. 33: Nachweis von adulten und einjährigen Finten, die Verbreitung von Finteneiern, der einzige Fund der Fintenlarve sowie das Gebiet der beobachteten Laichaktivität in der Unterweser für das Jahr 2004. 5.3.1 Laichgebiet Das Hauptlaichgebiet 2004 liegt aufgrund der eigenen Beobachtungen im Unterweser-Abschnitt zwischen UW-km 22,5 und 29 (zwischen Blumenthal und Farge, Abb. 34). Weitere Laichaktivitäten weiter flussab und/ oder flussauf der beobachteten Laichplätze sind denkbar. Es gibt jedoch aufgrund der Lauschbeobachtungen keine Hinweise darauf, dass Laichaktivitäten stromaufwärts von UW-km 22,5 stattgefunden haben. Selbst an den Tagen, an denen Laichaktivitäten im Hauptlaichgebiet beobachtet wurden, sind zur selben Uhrzeit weiter flussaufwärts von 2. Beobachtern keine Geräusche vernommen worden. Bereits im Bereich Vegesack, nur 2 - 4 km vom Laichgebiet entfernt, konnte keine Laichaktivität mehr festgestellt werden. Aufgrund der Beobachtungen des Fischers U. Willig kann davon ausgegangen werden, dass die Finten diesen Laichplatz nicht zum ersten Mal genutzt haben. Der Fischer konnte die Finten bereits in den Jahren zuvor beim Laichen hören. Da die höchste Eidichte in der Nähe von Blumenthal (UW-km 22) am 23.05.2004 zu verzeichnen war, also drei Tage nach der ermittelten Hauptlaichzeit, wird die oben gemachte Diskussion 74 Aussage zum Hauptlaichgebiet untermauert. An diesem Tag konnte immer weniger Fintenlaich nachgewiesen werden je weiter flussaufwärts beprobt wurde. Diese räumliche Verteilung konnte auch für die darauf folgenden Beprobungen bestätigt werden. Die vereinzelten Eierfunde oberhalb der Lesummündung deuten darauf hin, dass die Eier lediglich mit der Strömung aus dem Hauptlaichgebiet nach stromauf verdriftet wurden. Nach HASS (1968) können die Eier in der Elbe je nach Strömung und Tidenbewegung vom Hauptlaichgebiet jeweils in beide Flussrichtungen ca. 20 - 30 km weiter verdriften. Auf die Verhältnisse in der Unterweser übertragen, würde das bedeuten, dass eine Verdriftung der Eier vom Hauptlaichgebiet durch Tidenströme weseraufwärts bis UW-km 2 und weserabwärts bis UW-km 53 erfolgen kann (SCHIRMER & SCHULZE 2005). Das von HASS (1968) in der Elbe ermittelte Hauptlaichgebiet umfasst einen Abschnitt von ca. 11 km Länge. In der Weser konnte das Laichen auf einer Strecke von insgesamt 6,5 km Länge zwischen den am weitesten entfernten Laichplätzen beobachtet werden. Der einzige Anhaltspunkt aus der Literatur über die Lage des Laichgebietes der Finte in der Unterweser kommt von NOLTE (1976). Der Autor schreibt, dass die Laichplätze früher in dem Flussabschnitt zwischen Brake und Bremen gelegen haben sollen, welches durch diese Arbeit bestätigt bzw. näher eingegrenzt werden konnte. Abb. 34: Laichgebiet der Finten in der Unterweser (links Farge UW-km 28/29, rechts Farge UW-km 28/29 U-Boot-Bunker). Diskussion 75 5.3.2 Laichzeit Aufgrund der Daten (Laichreife der adulten Finten, Laichverhalten, Eierfunde) kann als Laichzeitraum für den Ort Farge Anfang Mai bis Anfang Juni 2004 festgelegt werden. Die beobachtete Hauptlaichzeit fand (unter den seinerzeit herrschenden Temperatur- und Abflussbedingungen) im Zeitraum vom 18.05. bis 20.05.2004 statt. Diese Laichzeit findet sich zahlreich in der Literatur bestätigt: EHRENBAUM (1936) konnte in der Elbe in zwei Jahren Laichaktivitäten im Mai (besonders in der 2. Hälfte dieses Monats) nachweisen. Bei HASS (1968) variierte die Laichzeit in zwei aufeinanderfolgenden Jahren zwischen Anfang Mai bis Mitte Juni und zwischen Mitte Mai bis Ende Juni. Der Autor führt die im zweiten Jahr festgestellte zeitliche Verlagerung auf die kühleren Frühjahrstemperaturen zurück. Nach MAITLAND & HATTON-ELLIS (2003) liegt die Laichzeit zwischen Mitte Mai und Mitte Juli, und laut APRAHAMIAN et al. (1998) und VÉRON et al. (2000) laichen die Finten, abhängig von der Temperatur, zwischen Mitte Mai und Mitte Juni. Es ist davon auszugehen, dass die Wassertemperatur Auslöser für die Laichaktivität ist. Nach Lage der Fänge und Verlauf der Temperatur erscheint es möglich, dass Laichaktivitäten auch schon vorher stattgefunden haben könnten (Anfang Mai: 15°C). Dies wird durch die Ergebnisse von U. Haesloop bestätigt, der in der Nähe des U-Boot-Bunkers in Farge Anfang Mai „fintenähnliche Fische“ an der Wasseroberfläche beobachten und später Fintenlaich nachweisen konnte (SCHIRMER & SCHULZE 2005). Gemäß der Untersuchung in der Elbe von GERKENS & THIEL (2001) erstreckt sich die Zeit, in der Fintenlarven gefunden wurden, von Ende Mai bis Anfang Juli. Dottersacklarven konnten gegen Ende Mai und Ende Juni nachgewiesen werden. Da in der Zwischenzeit keine Dottersacklarven gefangen werden konnten, vermuten GERKENS & THIEL (2001), dass es im Untersuchungsjahr zwei Laichpeaks gegeben hat. Gründe für solche Beobachtungen können zum einen die sich verändernde Wassertemperatur sein. Zum anderen zählen die Finten wie bereits oben diskutiert zu den Portionslaichern, die ihre Eier schubweise in der Laichzeit abgeben. Betrachtet man die Wassertemperatur im Untersuchungsjahr, so ist festzustellen, dass die Wassertemperatur im Jahr 2004 insgesamt geringer war, als in den Vorjahren. Zum anderen sank die Temperatur Anfang/ Mitte Mai auf 12,6°C ab, um dann zu den beobachteten Laichaktivitäten wieder auf rund 15°C anzusteigen. Das Ende der Laichzeit kann auf Anfang Juni festgelegt werden. Zu dieser Zeit nahmen die Fänge von adulten, laichreifen Finten stark ab und Finteneier konnten nur bis zum 08.06.2004 in der Unterweser nachgewiesen werden. Auch die Ergebnisse der Untersuchung von Diskussion 76 HAESLOOP (2004b), der um den 9./10.06.2004 die letzten Finteneier nachweisen konnte, deuten auf ein Ausklingen der Fortpflanzungsmethode in der ersten Junihälfte hin. 5.3.3 Laichtemperatur Die zur Hauptlaichzeit gemessene Wassertemperatur von ca. 15°C (14,7 - 15,9°C) und die mittlere Tageslufttemperatur (17 - 22,5°C) kann in einer Reihe von Literaturangaben wiedergefunden werden. Von EHRENBAUM (1894) wird z.B. eine Wassertemperatur von 16,4°C und eine Lufttemperatur von 17,4°C angegeben. Bei HASS (1968) lag die Wassertemperatur zur Hauptlaichzeit bei 14 - 18°C und bei MANYUKAS (1989) zwischen 16 und 17°C. Auch für den amerikanischen Maifisch werden Temperaturen von 16 bis 17°C angegeben (MASSMANN 1951). Insgesamt war das Frühjahr im Untersuchungsjahr kühler als die Vorjahre. Von STERNER (1918) wird berichtet, dass Kälterückschläge im Frühjahr oder nächtlicher Regen die Laichperiode unterbrechen, während anhaltend warme Witterung den Verlauf beschleunigt. Ähnliches wird auch von SCHWOLERT (1891) berichtet, der bei Regen und kalter Witterung nur wenig „Maifische“ fing. Diese Aussagen können zum Teil dadurch bestätigt werden, dass U. Haesloop bereits am 03.05.2004 Laichaktivitäten (SCHIRMER & SCHULZE 2005) beobachten konnte. An diesem Tag lag die Wassertemperatur bei 15,9°C. Dann sank die Wassertemperatur auf Werte bis zu 12,6°C (13.05.2004), um dann zur beobachteten Hauptlaichzeit wieder auf Werte zwischen 14,7 - 15,9°C anzusteigen. Auch für den amerikanischen Maifisch wird ein Zusammenhang zwischen der Laichaktivität und der Wassertemperatur beschrieben (LEIM 1925). 5.3.4 Laichverhalten Nach BALON (1975) zählen die Finten hinsichtlich ihres Laichverhaltens zu den pelagophilen Laichern. Diese Einstufung kann durch vorliegende Untersuchung bestätigt werden. Die Finten laichten an der Wasseroberfläche im Freiwasserkörper ab. Die Laichaktivität konnte stromauf der Brackwassergrenze im gezeitenbeeinflussten Süßwasserbereich der Unterweser beobachtet werden. Auch in der Untersuchung von APRAHAMIAN (1988) laichen die Finten im Süßwasser, ebenso der amerikanische Maifisch (ZYDLEWSKI et al. 2000). Schlecht vergleichbar sind die häufig in der Literatur genannten Laichgebiete in kleineren Flüssen wie z.B. Irland, wo das Ablaichen in Flussabschnitten mit Wassertiefen von 1 - 2 m stattfindet (DOHERTY et al. 2004) oder in den englischen Flüssen, wo die Finten an Stellen Diskussion 77 laichen, die weniger als 1 m tief sind (APRAHAMIAN et al. 1998; CASWELL & APRAHAMIAN 2001). Die Wassertiefe im beobachteten Laichgebiet reicht hingegen bis zu 14 m. Laut Literatur werden kiesige Stellen (FLORIN 1949), flache, saubere und schnell fließende Stellen mit steinigem und kiesigem Substrat (APRAHAMIAN et al. 1998; MAITLAND & HATTON-ELLIS 2003), schlammige - sandige - kiesige Substrate (APRAHAMIAN et al. 2001; CASWELL & APRAHAMIAN 2001) bevorzugt. Nach STEINBERG (1992) laichen die Finten ufernah über kiesigem Gewässergrund mit stetiger Strömung. In der Unterweser hingegen laichten die Finten mitten im Strom ab, obwohl ihnen im Laichgebiet sogar eine ufernahe, strömungsberuhigte Zone (kleine Bucht) beim U-Boot-Bunker Farge zur Verfügung stand. Im beobachteten Laichgebiet ist sandiges Laichsubstrat zu erwarten. Aus diesen Gründen wird der Anspruch der Finten gegenüber dem Laichhabitat in der Unterweser als nicht sehr hoch eingeschätzt. Wie sich aus den eigenen Beobachtungen ergab, fand das Laichen ausschließlich nachts statt, welches auch durch verschiedene Literaturangaben bestätigt wird (SCHNAKENBECK 1953; DOHERTY et al. 2004). Nach APRAHAMIAN et al. (2003) laichen die Finten nachts zwischen 22.00 und 03.00 Uhr. Außerdem könnte es einen Zusammenhang zwischen der Witterung und dem Verlauf des Laichgeschäftes geben. Einige Autoren berichten, dass das Ablaichen bei stillem, warmem Wetter stattfindet (SCHWOLERT 1891; EHRENBAUM 1894, 1921). Die durchschnittliche Tageslufttemperatur zur beobachteten Laichzeit (18.05. - 20.05.2004) lag zwischen 17 und 22,5°C. Ab dem 21.05.2004 sank die Temperatur auf 14°C. Es war besonders nachts deutlich kälter als in den Nächten zuvor. Ab diesem Tag konnten keine Laichaktivitäten mehr im Laichgebiet beobachtet werden. Durch Schiffsverkehr wurde das Laichgeschehen zwar kurzzeitig unterbrochen, jedoch nach kurzer Zeit fortgesetzt. Diese Störungsempfindlichkeit trat nur in der Anfangsphase des Laichaktes auf. Im weiteren Verlauf ließen sich die Finten nicht mehr stören. Anzumerken ist, dass die beobachtete Laichaktivität zur Neumondphase stattfand. Für das Auslösen des Laichens spielt die Wassertemperatur sicherlich eine viel größere Rolle. Es lässt sich jedoch nicht ausschließen, dass auch die Mondphase einen Einfluss auf das Laichgeschäft der Finten haben könnte. Der Fischer U. Willig berichtet davon, dass er auch die Jahre zuvor Diskussion 78 die Finten bei Neumond beim Laichen beobachten konnte, und zwar in der Regel auch beim ermittelten Laichplatz in Farge beim U-Boot-Bunker. Vergleichbare Beobachtungen konnten in der Literatur nicht gefunden werden, lediglich Arbeiten, in denen ein Zusammenhang zwischen Mondphasen und Fischverhalten, insbesondere von Heringen, diskutiert wird (z.B. GRAHAM 1931; BALLS 1951; CASPERS 1951; JENS 1952/1953, 1954). Die folgende Abbildung 35 zeigt sehr charakteristisch die laichenden Finten (aus BAGLINIÈRE & ELIE 2000 in: APRAHAMIAN et al. 2003). Ähnliche kreisende, schnelle Bewegungen, die das Foto erahnen lassen, konnten auch in der Unterweser beobachtet werden. Abb. 35: Laichende Finten aus BAGLINIÈRE & ELIE 2000 in: APRAHAMIAN et al. 2003. In Frankreich wird das Laichverhalten sogar zu Monitoring-Zwecken genutzt. Da die Fische an die Wasseroberfläche kommen und geräuschvoll ablaichen, werden sie vor Ort einzeln oder in Paaren gezählt (ANONYMUS 2001). Zusammenfassend lässt sich feststellen, dass der Zeitpunkt und die Dauer des Laichens sowie die vorher stattfindende Laichwanderung von einigen Faktoren abhängt bzw. abhängen könnte: • vom Entwicklungszustand der Gonaden, • vom Gang der Wassertemperaturkurve, • vom Verlauf der Witterung, • von der Mondphase, • und ggf. von der Stärke der Oberwasserführung. Diskussion 79 5.4 Eier- und Larvenfänge 5.4.1 Eierfänge Die Eier konnten nicht nur in bodennahen Wasserschichten, sondern auch an der Wasseroberfläche gefangen werden. Die Eier sinken laut Literatur zu Boden und werden dort in der Bodenwasserschicht mit der Strömung hin und her bewegt. Der größte Teil der Eier soll sich in der Wasserschicht zwischen dem Grund und 2,5 m Höhe befinden. Durch die Strömungen und die Tidenbewegung können die Eier trotzdem durch den gesamten Wasserkörper gewirbelt werden (z.B. HASS 1968) und somit auch in geringen Wassertiefen erfolgreich nachgewiesen werden. 5.4.2 Larvenfänge Mittels verschiedener Methoden (Kescher, Dredge, Hamen, Larvennetz, Beprobungen in den Rückspülbecken der Stahlwerke Bremen) wurden zwar regelmäßig Larven der typischen Fischarten gefangen, jedoch nur eine einzige Fintenlarve. Die Gründe hierfür sind unbekannt. Neben dem Einsatz verschiedener Methoden wurden auch unterschiedliche Wassertiefen beprobt. Laut APRAHAMIAN et al. (2001) gelangen die Fintenlarven in den oberen Schichten der Wasseroberfläche langsam seewärts; nach MÖLLER & DIEKWISCH (1991) sind die Fintenlarven im Hauptstrom der Elbe zu fangen. Daher hätten besonders mit Hilfe der Hamenfänge (Maschenweite im Steert 6 mm) Fintenlarven gefangen werden müssen. Trotz nachweislich zahlreicher laichbereiter Finten und umfangreichen Laichaktivitäten, die zu großen Dichten befruchteter Eier führten, von denen sogar einige im Aquarium zum Schlupf gebracht werden konnten, wurden im Jahr 2004 auch bei weiteren Untersuchungen insgesamt nur 6 Fintenlarven gefangen (HAESLOOP 2004b; SCHIRMER & SCHULZE 2005; FLACHWASSERPROJEKT (noch andauerndes Projekt, bearbeitet von der AG Aquatische Ökologie, Uni Bremen für die BfG)). Bei den Sommerbeprobungen in den Jahren 1993 und 1994 konnten auch von THIEL et al. (1996b) keine Fintenlarven in der Unterweser erbeutet werden. Im Gegensatz dazu wurden 1988 von SCHEFFEL (1989) in den Monaten April bis September 37 Fintenlarven unterhalb der Vegesacker Kurve nachgewiesen. Die im Aquarium erbrüteten, geschlüpften Larven konnten eindeutig als Fintenlarven bestimmt werden. Da die geschlüpften Larven bereits nach kurzer Zeit verendet sind (evtl. zu wenig Sauerstoff, Verpilzung etc.) sind die Bedingungen für folgende Versuche noch zu verbessern (siehe dazu die Zusammenstellung von BEECK 2003 für „Maifischeier“). Diskussion 80 Nach den erfolglosen Larvenfängen ist die erfolgreiche Reproduktion im Jahr 2004 in Frage zu stellen. Die Fänge der zahlreichen einjährigen Finten deuten jedoch zumindest auf eine erfolgreiche Reproduktion im letzten Jahr hin, falls die Finten tatsächlich Homing-Verhalten zeigen. Überlegungen zum Fintenlarven-Defizit werden ausführlich im Gutachten von SCHIRMER & SCHULZE (2005) aufgestellt. Daraus werden die Kernaussagen zitiert und zum Teil er- gänzt (zur Methodik s. Unterkapitel Larvenfänge im Kapitel 5.5). Wassertemperatur Es ist durchaus möglich, dass trotz stattgefundener Laichaktivität und Nachweis befruchteter Eier die Reproduktion aufgrund von Umweltstress (Wassertemperatur), Interaktionen und anderen Störungen nicht erfolgreich war. Die Ausbildung einer guten Jahrgangsstärke wird mit warmen Jahren in Verbindung gebracht (HOLMES & HENDERSON 1990; APRAHAMIAN & APRAHAMIAN 2001). Auch CLARIDGE & GARDNER (1978) nehmen an, dass durch zu geringe Wassertemperaturen die Laichaktivität sowie das Überleben der Larven beeinflusst werden, welches sich durch weniger nachgewiesene Individuen äußert. Die Bedeutung des Einflusses der abiotischen Faktoren auf das Überleben der Larven und die daraus resultierende Größe der Population von Alosa sapidissima werden unter anderem von CRECCO & SAVOY (1984), CRECCO et al. (1986) sowie von LEACH & HOUDE (1999) beschrieben. Die Wassertemperaturen zur Laichzeit lagen bei ca. 15 - 16°C, anschließend sanken sie um ca. 1°C ab. Für die optimale Entwicklung der Finteneier werden Temperaturen zwischen 15 und 25°C benötigt (EHRENBAUM 1921; APRAHAMIAN et al. 2001). Temperaturen darüber oder darunter erwiesen sich als schädlich (EHRENBAUM 1921). Von HOESTLANDT (1958) werden für die Alse ähnliche Temperaturen für eine erfolgreiche Reproduktion genannt: Bei Temperaturen unter 16°C treten Missbildungen bei den Larven auf, während bei Temperaturen unter 18°C die Larven in keiner guten Verfassung sind und Schwierigkeiten haben, aus den Eiern auszuschlüpfen. Von GERKENS & THIEL (2001) wurde beobachtet, dass junge Larven Temperaturen zwischen 17 und 20°C präferieren, ältere Larven 17 bis 21,5°C. Höhere Temperaturen werden gemieden. Temperaturen ab 17°C wurden in 2004 erst ab Anfang Juni festgestellt. Es ist also nicht gänzlich unwahrscheinlich, dass die Reproduktion aufgrund der recht geringen Wassertemperaturen in 2004 weniger erfolgreich war, welches sich in einem verringerten Aufkommen von Fintenlarven niederschlägt. Diskussion 81 Interaktion, Störungen Weiterhin kann Prädation durch Räuber zur Ausdünnung der Larvendichte führen. Als Räuber kommen insbesondere Fische in Frage. Ab dem 26.05.2004 konnten in den Hamenfängen große Mengen an Heringen nachgewiesen werden. Diese wiesen die richtige Größe auf (5 - 10 cm), um sich von Fintenlarven zu ernähren. Als weitere Gründe, die zur Ausdünnung der Fintenlarven beigetragen haben könnten, wären zum einen der durch den Schiffsverkehr verursachte Wellenschlag zu nennen, welcher zu mechanischen Schäden an Fischeiern und -larven führen kann. Zum anderen könnte zeitweise Nahrungsmangel geherrscht haben. Zum Beispiel fanden JOHNSON & DROPKIN (1995) heraus, dass Beutedichte und kurzzeitiger Abzug von Nahrung Effekte auf das Wachstum und das Überleben der Larven von Alosa sapidissima hat. Alle diese Erklärungsansätze lassen jedoch den Fang von nur insgesamt 6 Fintenlarven im Sommer 2004 nicht als plausibel erscheinen. Diskussion 82 5.5 Methodendiskussion Hamen Der Hamen zählt zu den besten Methoden, mit denen die adulten Finten gefangen werden können, da er besonders zum Fang von pelagischen Fischarten geeignet ist (MÖLLER 1984). Auch bei umfangreichen Untersuchungen auf der Elbe stellte sich der Hamen neben anderen Fanggeräten (Garnelenkurre, Schleppnetz: Boden-Jungfischnetz) als die am Besten geeignete Methode zum Fang von Finten heraus (MÖLLER 1988). Es wurde nur im Hauptstrom gefischt, da es zum einen in der Unterweser kaum noch zum Fischen geeignete Nebengewässer gibt. Zum anderen kommen die Finten in den Nebenstromgewässern der Elbe nur in geringen Zahlen vor, wobei andere Fischarten in diesen Zonen häufiger sind als im angrenzenden Hauptstrom (THIEL et al. 1995; KAFEMANN et al. 1996). Weitere Methoden Mit den anderen genannten Methoden sollte ein Vorkommen der Finten in den weiter flussauf liegenden Gebieten, in denen der Hamenkutter nicht mehr fischen darf, überprüft werden. Es konnte weder mit dem Treibnetz, noch mittels Reusen Finten erbeutet werden. Die im Untersuchungsgebiet befragten angelnden Sportfischer sowie die reusenstellenden Fischer fingen ebenfalls keine Finten. Nach folgenden Literaturangaben ist es jedoch grundsätzlich möglich, mit den angegebenen Methoden Finten zu fangen: Reusen (MUUS & DAHLSTRÖM 1998), Treibnetz (STERNER 1918; SCHNAKENBECK 1928, 1953; EHRENBAUM 1936; MOHR 1941; MUUS & DAHLSTRÖM 1998) und Angel (ANONYMUS 2001; APRAHAMIAN et al. 2003; STEMMER 2003; DOHERTY et al. 2004). Es wurde leider keine Treibnetzbefischung in den Gebieten durchgeführt, in denen Finten nachzuweisen waren. Es ist also trotz der negativen Ergebnisse möglich, dass vereinzelt Finten weiter als UW-km 18 gewandert sind. Aufgrund der Ergebnisse der Lauschfahrten und der Eierfänge erscheint es jedoch als sehr wahrscheinlich, dass der Großteil der Finten in dem benannten Laichgebiet verblieb, dort laichte und dann wieder abwanderte. Sollten Finten tatsächlich weiter stromauf gewandert sein, handelt es sich wahrscheinlich nur um Einzeltiere. Larvenfänge Theoretisch ist es möglich, dass die Beprobungen nie zur richtigen Zeit und am richtigen Ort stattgefunden haben. Dem steht entgegen, dass der Untersuchungszeitraum sowie die beprobte Strecke in der Unterweser sehr groß war. Zudem wurden verschiedene, für Ei- und Larven- Diskussion 83 nachweise übliche Fangmethoden, eingesetzt. Nicht nur die beprobte Strecke der Unterweser war lang (UW-km 7 - 57), sondern es wurde zusätzlich darauf geachtet, dass die Fänge an verschiedenen Positionen im Querschnitt durchgeführt wurden (Steinschüttung, Ufernah, Strommitte, von den Anlegern aus). Für die Angemessenheit der Beprobungen spricht auch, dass andere Fischlarven nachgewiesen wurden. Auch wenn Schwarmbildung (Patchiness) die repräsentative Erfassung erschwert, hätten jedoch wenigstens mit dem Hamen Fintenlarven gefangen werden müssen, da die Hamenfänge einen recht repräsentativen Eindruck über die Fischfauna vermitteln. Hinzu kommt, dass sie Maschenweite im Steert nur 6 mm betrug und auch andere Larven in den erwarteten FintenGrößen erbeutet wurden. Bereits 1936 wurde von EHRENBAUM erwähnt: „Die jungen Formen werden durch den Hamen zahlreich vernichtet.“ Für weitere Untersuchungen soll auch die Empfehlung von HILLMAN (2003) weitergegeben werden, Larvenfänge zur Niedrigwasserzeit durchzuführen. Zudem erscheint es sinnvoll, die Beprobungen in der Strommitte durchzuführen, da sich nach der Untersuchung von GERKENS & THIEL (2001) die juvenilen Finten in der Elbe bevorzugt im Hauptstrom aufhalten und die Seitenbereiche sowie die Hafengebiete eher meiden. Diskussion 84 5.6 Ausblick Mit dieser Arbeit konnte gezeigt werden, dass die Finten in die Unterweser einwandern und dort zur Reproduktion kommen. Wie bereits angedeutet, sind besonders Deutschland und Frankreich gemäß FFH-Richtlinie verpflichtet, diese Art zu schützen. Dies muss vorrangig in den Flüssen stattfinden. Denn wie schon bereits von HOEK (1900) für den Schutz von Maifischen angemerkt hat: „Solange diese Fische im Meere weilen, sind sie unserer Pflege ganz entzogen, während des Aufenthaltes im Flusse können wir vielleicht etwas für sie tun; dann müssen wir ihre Lebensweise aber so genau wie möglich kennen. Hier haben die wissenschaftlichen Untersuchungen gewiss eine große Bedeutung für die Praxis.“ Dabei hat die vorliegende Arbeit nach über 100 Jahren einen weiteren Teil zur Erkenntnis der Biologie und Ökologie der Finte besonders in der Unterweser beigetragen. Es konnten Ergebnisse geliefert werden, die für die Einschätzung der Bestandssituation und für den Schutz der Finten von Bedeutung sind. Zu empfehlen sind weitere folgende Beobachtungen und Untersuchungen in den nächsten Jahren: • Validierung des ermittelten Laichgebietes und der Laichzeit in den folgenden Jahren. • Handelt es sich um ein etabliertes Laichgebiet? Wie weit erstreckt sich das Laichgebiet weiter flussabwärts? • Welchen Einfluss üben die abiotischen Parameter (u.a. Wassertemperatur und Mondphase) auf die Laichzeit aus? • Wo verbleiben die Larven? • Folgen die Finten einem Heimkehrverhalten? • Kommen die einjährigen Finten in den nächsten Jahren auch wieder in der Unterweser vor? • Gibt es einen genetisch einheitlichen Nordseebestand oder setzt sich der Bestand aus unterschiedlichen Populationen in den einzelnen Flüssen (Weser, Ems, Elbe) zusammen? • Exaktere Altersbestimmung der Finten anhand von Schuppen oder Otolithen. • War das Jahr 2004 eine Ausnahme hinsichtlich ihrer Nahrungsaufnahme während der Laichwanderung? • Untersuchungen zur Populationsdynamik. • Überprüfung der Fänge auf Alsen und Hybriden zwischen Alse und Finte. Zusammenfassung 6 85 Zusammenfassung Ausgehend von den derzeit vorliegenden Ergebnissen scheint sich der Bestand der Finten in Deutschland zu erholen. Seit 1990 hat die Fangfrequenz der Finte in der Deutschen Bucht deutlich zugenommen. In der Ostsee nehmen die Bestände seit etwa 10 Jahren wieder zu; für die Ems lässt sich eine Bestandserholung der Finte seit den letzten 8 Jahren verzeichnen. In die Weser wandern die Finten nicht nur seit etwa 10 Jahren wieder vermehrt ein, sondern im Jahr 2004 konnte sogar aufgrund eigener Beobachtungen ein Laichgebiet in der Unterweser nachgewiesen werden. In der Zeit vom 29.04.2004 bis zum 13.08.2004 konnten durch Hamenfänge 918 adulte Finten auf ihrer Laichwanderung in die Unterweser zwischen UW-km 20,5 und 46 nachgewiesen werden. Die maximal festgestellte Laichwanderung reichte bis UW-km 18 (Vegesack). Weiter stromauf treten die Finten nach den hier ermittelten Befunden nur in Ausnahmefällen auf. Im Zeitraum 09.06. - 13.08.2004 konnten in den Hamenfängen zwischen UW-km 28 und 46 auch einjährige Finten nachgewiesen werden. Es ist davon auszugehen, dass diese im Sommer erneut in die Weser einwanderten und sich nicht während des ganzen Jahres dort aufhielten. Die Auswertung der populationsbiologischen Parameter ergab folgende Ergebnisse: • Die Finten wiesen einen geschlechtsspezifischen Unterschied in Länge und Gewicht auf. Die Weibchen waren deutlich größer und schwerer (♀♀ 37 - 50 cm, ♂♂ 27 - 42 cm; ♀♀ 0,40 - 1,17 kg, ♂♂ 0,17 - 0,64 kg). • Die adulten Finten konnten grob in die Altersgruppe 2+ und älter, die meisten müssen jedoch in die Altersgruppe 3+ eingeordnet werden. • Die Anzahl der Kiemenreusendornen der adulten Finten variierte zwischen 35 und 44, die der einjährigen Finten zwischen 29 und 39. Die Zahl der Kiemenreusendornen steigt mit zunehmender Körperlänge bzw. dem Alter an und nähert sich asymptotisch dem o.g. Durchschnittswert. • Alle gefangenen „Maifsche“ gehörten der Art Alosa fallax an. Es konnten keine Alsen oder Hybriden zwischen beiden Arten nachgewiesen werden. • Die Anzahl der Punkte schwankte zwischen 1 und 17 und eignet sich nicht zur Artdiagnose zwischen Alse und Finte. Zusammenfassung • 86 Während der Untersuchung wurden deutlich mehr Weibchen als Männchen gefangen; es ergaben sich jedoch Hinweise auf ein wechselndes Geschlechterverhältnis im Verlauf der Laichperiode. • Die Laichprodukte der Finten reiften auf ihrer Laichwanderung weiter heran. Aufgrund der nachgewiesenen unterschiedlichen Reife der Eier im Ovar zur gleichen Zeit ist anzunehmen, dass die Finten portionsweise über einen Zeitraum laichen. • Die Finten nahmen während ihrer gesamten Laichwanderung Nahrung auf, wobei die Nahrungsaufnahme nach dem Laichen verstärkt stattfindet. Die Nahrung war stark piscivor. Der Laichzeitraum für das Jahr 2004 lag zwischen Anfang Mai bis Anfang Juni. Gesicherte Laichaktivitäten durch eigene Beobachtungen fanden in den Tagen zwischen dem 18.05. und dem 20.05.2004 statt. Dieser Zeitraum kann außerdem aufgrund der nachgewiesenen hohen Eidichten als Hauptlaichzeitraum festgelegt werden. Die Laichtemperatur lag damit bei ca. 15°C. Das Hauptlaichgebiet liegt aufgrund der eigenen Beobachtungen von Laichaktivitäten im Unterweser-Abschnitt zwischen UW-km 22,5 und 29 (zwischen Blumenthal und Farge). Die erfolgreiche Reproduktion kann nur insofern bestätigt werden, dass sich viele laichbereite Finten im Untersuchungszeitraum nachweisen ließen, nächtliche Laichaktivitäten beobachtet werden konnten sowie anschließend befruchtete Eier gefangen werden konnten. Durch das Ausbleiben der Fintenlarven bleibt der letzte Schritt des Beweises einer erfolgreichen Reproduktion in bestandserhaltender Größenordnung offen. Literaturverzeichnis 7 87 Literaturverzeichnis ALEXANDRINO PJ (1996): Genetic and morphological differentiation among some Portuguese populations of allis shad Alosa alosa (L., 1758) and twaite shad Alosa fallax (Lacépède, 1803). Publicaciones Especiales Instituto Espaňol de Oceanografia 21: 15 – 24. ALEXANDRINO P (2001): Genetic Research and Conservation of European shads, Alosa alosa and Alosa fallax. A Conference on the Status and Conservation of Shads Worldwide, May 20-23, 2001. http://www.cbr.washington.edu/~hinrich/shad/shad2001/abtalks-combined.pdf. ALEXANDRINO PJ, SOUSA C, PEREIRA A, FERRAND N (1993): Genetic polymorphism of adenosine deaminase (ADA; E.C. 3.5.4.4.) in allis shad, Alosa alosa and twaite shad, Alosa fallax. Journal of Fish Biology 43: 951 – 953. ALEXANDRINO PJ, FERRAND N, ROCHA J (1996): Genetic polymorphism of a haemoglobin chain and adenosine deaminase in European shads: evidence for the existence of two distinct genetic entities with natural hybridization. Journal of Fish Biology 48: 447 – 456. ANONYMUS (1898): Kleinere Mitteilungen (Maifischfang auf der Unterweser). FischereiZeitung, Band 1: 324. ANONYMUS (1900): Rückblick auf die Ergebnisse und die Arten der Flußfischerei der Unterund Außenweser im Jahre 1900. Fischerei-Zeitung, Band 3: 722 – 723. ANONYMUS (2001): Towards a methodology for assessing whether the UK populations of allis and twaite shad are at favourable conservation status. Stage 1 Task Report. Review of shad monitoring in the UK, other EU countries and the USA, March 2001, 26 S. ANONYMUS (2005a): Alosa fallax fallax (Lacépède, 1803) Alosa fallax rhodanensis (Roule, 1924) L’Alose feinte et l’Alose feinte du Rhône. http://www.ecologie.gouv.fr/IMG/ natura2000/habitats/pdf/tome7/1103.pdf (27.04.2005). ANONYMUS (2005b): Alosa alosa (L., 1758) La Grande alose, L’Alose vraie. http://www.ecologie.gouv.fr/IMG/natura2000/habitats/pdf/tome7/1102.pdf (27.04.2005). APRAHAMIAN MW (1985): The effect of the migration of Alosa fallax fallax (Lacépède) into fresh water, on branchial and gut parasites. Journal of Fish Biology 27: 521 – 532. APRAHAMIAN MW (1988): The biology of the twaite shad, Alosa fallax fallax (Lacépède), in the Severn Estuary. Journal of Fish Biology 33 (Supplement A): 141 – 152. APRAHAMIAN MW (1989): The diet of juvenile and adult twaite shad Alosa fallax fallax (Lacépède) from the rivers Severn and Wye (Britain). Hydrobiologia 179: 173 – 182. Literaturverzeichnis 88 APRAHAMIAN MW, APRAHAMIAN CD (1990): Status of the genus Alosa in the British Isles; past and present. Journal of Fish Biology 37 (Supplement A): 257 – 258. APRAHAMIAN MW, APRAHAMIAN CD (2001): The influence of water temperature and flow on year class strength of twaite shad (Alosa fallax fallax) from the river Severn, England. Bull. Fr. Pêche Piscic. 362/363: 953 – 972. APRAHAMIAN MW, LESTER SM (2001): Variation in the age at first spawning of female twaite shad (Alosa fallax fallax) from the river Severn, England. Bull. Fr. Pêche Piscic. 362/363: 941 – 951. APRAHAMIAN MW, LESTER SM, APRAHAMIAN CD (1998): Shad Conservation in England and Wales. Environment Agency Technical Report W110, Environment Agency North West Region, Warrington, 133 S. APRAHAMIAN MW, BAGLINIÈRE JL, SABATIÉ MR, ALEXANDRINO P, THIEL R, APRAHAMIAN CD (2001): Biology, Status and Conservation of the Anadromous Twaite Shad, Alosa fallax fallax (Lacépède, 1803). A Conference on the Status and Conservation of Shads Worldwide, May 20-23, 2001. http://www.cbr.washington.edu/~hinrich/shad/shad2001/abtalks-combined.pdf. APRAHAMIAN MW, APRAHAMIAN CD, BAGLINIÈRE JL, SABATIÉ R, ALEXANDRINO P (2003): Alosa alosa and Alosa fallax spp. Literature Review and Bibliography. Environment Agency Research and Development Report W1-014/TR, Environment Agency, Bristol, 349 S. ARGE ELBE (1995): Spektrum und Verbreitung der Rundmäuler und Fische in der Elbe von der Quelle bis zur Mündung. Aktuelle Befunde im Vergleich zu alten Daten, 29 S. www.arge-elbe.de/wge/Download/Berichte/95Fischart.pdf. ARGE WESER (Arbeitsgemeinschaft zur Reinhaltung der Weser) (1993): Die Unterweser 1993, 82 S. ARGE WESER (Arbeitsgemeinschaft zur Reinhaltung der Weser) (2001): Wesergütebericht 2001,103 S. ASSIS CA, ALMEIDA PR, MOREIRA F, COSTA JL, COSTA MJ (1992): Diet of the twaite shad Alosa fallax (Lacépède) (Clupeidae) in the River Tagus Estuary, Portugal. Journal of Fish Biology 41: 1049 – 1050. ATKINSON CE (1951): Feeding habits of adult shad (Alosa sapidissima) in fresh water. Ecology 32(3): 556 – 557. BAGENAL TB, BRAUM E (1978): Eggs and Early Life History. In: BAGENAL T (Hrsg.): Methods for Assessment of Fish Production in Fresh Waters. International Biological Literaturverzeichnis 89 Programm Handbook No.3, Blackwell Scientific Publications, Oxford, London, Edinburgh, Melbourne, 165 – 201. BAGLINIÈRE JL, SABATIÉ MR, ROCHARD E, ALEXANDRINO P, APRAHAMIAN MW (2001): The allis shad (Alosa alosa Linné, 1758): Biology, Ecology, Range and Status of Populations. A Conference on the Status and Conservation of Shads Worldwide, May 20-23, 2001. http://www.cbr.washington.edu/~hinrich/shad/shad2001/abtalks-combined.pdf. BALLS R (1951): Environmental Changes in Herring Behaviour: A Theory of Light Avoidance, as Suggested by Echo-Sounding Observations in the North Sea. Journ. du Cons. XVII (3): 274 – 298. BALON EK (1964): Verzeichnis und ökologische Charakteristik der Fische der Donau. Hydrobiologia, Vol. XXIV: 441 – 451. BALON EK (1975): Ecological guilds of fishes: a short summary of the concept and its application. Verh. Internat. Verein Limnologie 19: 2430 – 2439. BARTL G, TROSCHEL H (1997): Historische Verbreitung, Bestandsentwicklung und aktuelle Situation von Alosa alosa und A. fallax im Rheingebiet. Z. Fischk. 4(1/2): 119 – 162. BAUCH G (1955): Die einheimischen Süßwasserfische. Neumann Verlag, Radebeul und Berlin, 162 – 165. BAUCH G (1966): Die einheimischen Süßwasserfische. 5. Auflage, Verlag J. NeumannNeudamm-Melsungen, 153 – 155. BAUMGÄRTNER M (2002a): Erfolgreiche Jahresbilanz 2001 des Fischpasses Iffezheim. Allgemeine Fischerei Zeitung Fischwaid, Verband Deutscher Sportfischer e.V., Heft 5/2002: 14. BAUMGÄRTNER M (2002b): Mythos Maifisch. Allgemeine Fischerei Zeitung Fischwaid, Verband Deutscher Sportfischer e.V., Heft 5/2002: 14 – 16. BEECK P (2003): Vorstudie zum möglichen Besatz des Maifisch (Alosa Alosa) im Rheinsystem. Ergebnisbericht. Universität Köln, 49 S. BELAUD A, DAUTREY R, LABAT R, LARTIGUE JP, LIM P (1985): Observations sur le comportement migratoire des Aloses (Alosa alosa L.) dans le canal artificiel de l’usine de Golfech. Annales de Limnologie 21(2): 161 – 172. BENTZEN P, LEGGETT WC, BROWN GG (1993): Genetic relationships among the shads (Alosa) revealed by mitochondrial DNA analysis. Journal of Fish Biology 43: 909 – 917. BERG LS (1933): Übersicht der Verbreitung der Süßwasserfische Europas. III. Clupeidae. Zoogeographica 1: 110 – 111. Literaturverzeichnis 90 BERG LS (1962): Freshwater fishes of the U.S.S.R and adjacent countries. Vol. 1, 4. Auflage, Oldbourne Press, London, 149 – 151. BERVOETS L, COECK J, VERHEYEN RF (1990): The value of lowland rivers for the conservation of rare fish in Flanders. Journal of Fish Biology 37 (Supplement A): 223 – 224. BLESS R (1978): Bestandsänderungen der Fischfauna in der Bundesrepublik Deutschland. Ursachen, Zustand und Schutzmaßnahmen. In: Naturschutz aktuell Nr. 2, Kilda - Verlag Greven, 66 S. BLESS R (1979): Wandernde Fischarten und deren besondere Schutzbedürfnisse. Natur und Landschaft 6: 202 – 205. BLESS R, LELEK A, WATERSTRAAT A (1998): Rote Liste der in Binnengewässern lebenden Rundmäuler und Fische (Cyclostomata & Pisces). In: Bundesamt für Naturschutz (Hrsg.): Rote Liste gefährdeter Tiere Deutschlands. Schriftenreihe für Landschaftspflege und Naturschutz, Bundesamt für Naturschutz, Bonn-Bad Godesberg, Heft 55: 53 – 59. BOISNEAU P, MENNESSON C, BAGLINIERE JL (1985): Observations sur l’activité de migration de la grande alose, Alosa alosa L. en Loire (France). Hydrobiologia 128: 277 – 284. BOISNEAU P, MENNESSON-BOISNEAU C, GUYOMARD R (1992): Electrophoretic identity between allis shad, Alosa alosa (L.), and twaite shad, A. fallax (Lacépède). Journal of Fish Biology 40: 731 – 738. BRACKEN J, KENNEDY M (1967): Notes on some Irish estuarine and inshore fishes. Irish Fisheries Investigations Series B (Marine) 3: 4 – 8. BUSCH D, SCHRÖDER K, SCHUCHARDT B (1982): Niedergang der Flussfischerei auf der Unterweser. Projekt Weserwasser, Universität Bremen, 174 S. BUSCH D, SCHIRMER M, SCHUCHARDT B, SCHRÖDER K (1984): Der Ausbau der Unterweser zum Großschifffahrtsweg und seine Auswirkungen auf das Flussökosystem und die Flussfischerei. Neues Archiv für Niedersachsen 33(1): 60 – 80. BUSCH D, HAESLOOP U, SCHEFFEL H-J, SCHIRMER M (1988): Fish and their environment in large european river ecosystems The river Weser, FRG. Sciences de l’Eau 7(1): 75 – 94. BUSCH D, SCHIRMER M, SCHUCHARDT B, ULLRICH P (1989): Historical Changes of the River Weser. In: PETTS GE, MÖLLER H, ROUX AL (Hrsg.): Historical change of large alluvial rivers: Western Europe. John Wiley & Sons, Chichester, New York, Brisbane, Toronto, Singapore, 297 – 321. Literaturverzeichnis 91 CASPERS H (1951): Rhythmische Erscheinungen in der Fortpflanzung von Clunio marinus (Dipt. Chiron.) und das Problem der lunaren Periodizität bei Organismen. Archiv für Hydrobiologie, Supplement-Band XVIII: 415 – 575. CASWELL PA, APRAHAMIAN MW (2001): Use of habitat survey to determine the spawning habitat characteristics of twaite shad (Alosa fallax fallax). Bull. Fr. Pêche Piscic. 362/363: 919 – 929. CATING JP (1953): Determining age of Atlantic shad from their scales. Fishery Bulletin 85, Vol. 54: 187 – 199. CHANGEAUX T, PONT D (1995): Current status of the riverine fishes of the French Mediterranean basin. Biological Conservation 72: 137 – 158. CHITTENDEN ME JR. (1976): Weight loss, mortality, feeding and duration of residence of adult American shad, Alosa sapidissima, in fresh water. Fishery Bulletin 74(1): 151 – 157. CLARIDGE PN, GARDNER DC (1978): Growth and movements of the twaite shad, Alosa fallax (Lacépède), in the Severn Estuary. Journal of Fish Biology 12: 203 – 211. CLAUS B, NEUMANN P, SCHIRMER M (1995): Leitbild, Entwicklungsziele und Entwicklungskonzept zur Renaturierung der Unterweser und ihrer Marsch. Arch. Hydrobiol. Suppl. 101, Large Rivers 9(3/4): 615 – 627. CLOUGH SC, LEE-ELLIOTT IE, TURNPENNY AWH, HOLDEN SDJ, HINKS C (2004): The swimming speeds of twaite shad (Alosa fallax). R&D Technical Report W2-049/TR3, Environment Agency, Bristol, 18 S. plus Anhänge. COLLARES-PEREIRA MJ, COWX IG, SALES LUIS T, PEDROSA N, SANTOS-REIS M (1999): Observations on the ecology of a landlocked population of allis shad in Aguieira Reservoir, Portugal. Journal of Fish Biology 55: 658 – 664. COSTELLO M, ELLIOT M, THIEL R (2002): Endangered and rare Species. In: ELLIOT M, HEMINGWAY KL (Hrsg.): Fishes in Estuaries. Blackwell Science, Oxford, 217 – 262. COULL KA, JERMYN AS, NEWTON AW, HENDERSON GI, HALL WB (1989): Length/Weight Relationships for 88 Species of Fish Encountered in the North East Atlantic. Scottish Fisheries Research Report 43, 80 S. CRECCO VA, SAVOY TF (1984): Effects of Fluctuations in Hydrographic Conditions on YearClass Strength of American Shad (Alosa sapidissima) in the Connecticut River. Canadian Journal of Fisheries and Aquatic Sciences 41: 1216 – 1223. CRECCO V, SAVOY T, WHITWORTH W (1986): Effects of Density-Dependent and Climatic Factors on American shad, Alosa sapidissima, Recruitment: A Predictive Approach. Canadian Journal of Fisheries and Aquatic Sciences 43: 457 – 463. Literaturverzeichnis 92 DEGEL D (2003): Der Fischpass an der Staustufe Iffezheim. http://www.lfvbaden.de/DegelBericht/DD040201-Ino31231.pdf (31.12.2003). DE GROOT SJ (1990): The former allis and twaite shad fisheries of the lower Rhine, The Netherlands. Journal of Applied Ichthyology 6: 252 – 256. DE GROOT SJ (2002): A review of the past and present status of anadromous fish species in the Netherlands: is restocking the Rhine feasible? Hydrobiologia 478: 205 – 218. DE HAAS W, KNORR F (1990): Was lebt im Meer an Europas Küsten? Müller Rüschlikon Verlag, Cham, 390 S. DIEKWISCH B (1987): Die Verteilung der Fischbrut in der Unterelbe 1985, Diplomarbeit Universität Kiel. DOHERTY D, MC CARTHY TK (2002): Aspects of the ecology, parasites and future conservation of twaite shad, Alosa fallax, and allis shad, Alosa alosa, in south-eastern Ireland. In: COLLARES-PEREIRA MJ, COWX I, COELHO MM (Hrsg.): Conservation of freshwater fishes: Options for the future. Oxford, Fishing New Books, Blackwell Science, 98 – 112. DOHERTY D, O’MAOILÉIDIGH N, MC CARTHY TK (2004): The biology, ecology and future conservation of Twaite shad (Alosa fallax Lacépède), Allis shad (Alosa alosa L.) and Killarney shad (Alosa fallax killarnensis Tate Regan) in Ireland. Biology and Environment: Proceedings of the Royal Irish Academy, Vol. 104B, No. 3: 93 – 102. DOUCHEMENT C (1981): Les Aloses des fleuves français (Alosa fallax Lacépède 1803 et Alosa alosa Linné, 1758). Biométrie, écobiologie, Autonomie des populations. Montpellier, Université des Sciences et Technique du Languedoc Montpellier, 377 S. DOYLE MJ (1977): A morphological staging system for the larval development of the herring, Clupea harengus L.. J. mar. biol. Ass. U.K. 57: 859 – 867. DUNCKER G, LADIGES W (1960): Die Fische der Nordmark. Hamburg (Cram, de Gryter & Co.), 432 S. DÜVER W (2003): Fisch des Jahres 2004. Der Maifisch (Alosa alosa L.). Allgemeine Fischerei Zeitung Fischwaid, Verband Deutscher Sportfischer e.V., Heft 6: 12. EHRENBAUM E (1894): Beiträge zur Naturgeschichte einiger Elbfische. Wiss. Meeresunters. Abt. Helgoland Bd.1: 54 – 63. EHRENBAUM E (1921): Die Maifischarten. Der Fischerbote XIII: 681ff und 726ff. EHRENBAUM E (1936): Naturgeschichte und Wirtschaftliche Bedeutung der Seefische Nordeuropas. Sonderausgabe aus dem Handbuch der Seefischerei Nordeuropas Band II, E. Schweizerbart’sche Verlagsbuchhandlung (Erwin Nägele) G.m.b.H., 26 – 28. Literaturverzeichnis 93 EHRENBAUM E (1964): Eier und Larven von Fischen. In: Nordisches Plankton, Zoologischer Teil, Erster Band, Kiel und Leipzig, Verlag von Lipsius & Tischer, 361 – 375. EIRAS JC (1980): Alosa fallax from north and South of Portugal: Study of its numerical characters. Anais de Faculdade de Ciencias do Porto LXII 67: 19 – 27. EU (1992): RICHTLINIE 92/43/EWG DES RATES vom 21. Mai 1992 zur Erhaltung der natürlichen Lebensräume sowie der wildlebenden Tiere und Pflanzen. Amtsblatt der Europäischen Gemeinschaften Nr. 206. FAHY E (1982): A commercial net fishery taking twaite shad Alosa fallax (Lacépède) in the estuary of the river Slaney. Ir. Nat. J. 20(11): 498 – 500. FAIRBRIDGE RW (1980): The Estuary: It´s Definition and Geodynmic Cycle. In: OLAUSSON E, CATO I (Eds.): Chemistry and Biochemistry of Estuaries. Wiley, Chichester, New York, Brisbane, Toronto, 1 – 35. FARIA R, WALLNER B, WEISS S, ALEXANDRINO P (2004): Isolation and characterization of eight dinucleotide microsatellite loci from two closely related clupeid species (Alosa alosa and A. fallax). Molecular Ecology Notes 4: 586 – 588. FGG WESER (2003): Wesergütebericht 2002. Flussgebietsgemeinschaft Weser, 100 S. FLORIN J (1949): Ergebnisse aus biometrischen Untersuchungen an Alosa finta, Cuv., des Stromgebietes des Po. Verh. Internat. Verein. Limnol. 10: 134 – 140. FREIE HANSESTADT BREMEN (Hrsg.) (1995): Gewässergütebericht des Landes Bremen 1995 vom Senator für Frauen, Gesundheit, Jugend, Soziales und Umweltschutz, Bremen, 82 S. FRENZ C (2003): Zur Fischfauna der Fließgewässer Norddeutschlands. In: SOMMERHÄUSER M, SCHUHMACHER H: Handbuch der Fließgewässer Norddeutschlands. Typoplogie Bewertung - Management, Atlas für die limnologische Praxis. Ecomed Verlagsgesellschaft AG & Co.KG, Landsberg, 215 – 221. FRICKE R (1987): Deutsche Meeresfische. Bestimmungsbuch. Hamburg (Deutscher Jugendbund für Naturbeobachtung), 219 S. FRICKE R (2003): Auswirkungen des geplanten Ausbaus des Containerterminals CT IV, Bremerhaven auf FFH-Fisch- und- Rundmaularten in der Unterweser. Gutachten im Auftrag der Stadtgemeinde Bremen. Stuttgart (20.11.2003, unveröffentlicht), 7 S. FRICKE R (2004): Der Maifisch (Alosa alosa). Fisch des Jahres 2004. Verband Deutscher Sportfischer e.V., 39 S. FRICKE R, RECHLIN O, WINKLER H, BAST H-D, HAHLBECK E (1996): Rote Liste und Artenliste der Rundmäuler und Meeresfische des deutschen Meeres- und Küstenbereichs der Literaturverzeichnis 94 Ostsee. Schriftenreihe für Landschaftspflege und Naturschutz, Bundesamt für Naturschutz, Bonn-Bad Godesberg, Heft 48: 83 – 90. FRICKE R, BERGHAHN R, RECHLIN O, NEUDECKER T, WINKLER H, BAST H-D, HAHLBECK E (1998): Rote Liste der in Küstengewässern lebenden Rundmäuler und Fische (Cyclostomata & Pisces) (Bearbeitungsstand: 1994). In: Bundesamt für Naturschutz (Hrsg.): Rote Liste gefährdeter Tiere Deutschlands. Schriftenreihe für Landschaftspflege und Naturschutz, Bundesamt für Naturschutz, Bonn-Bad Godesberg, Heft 55: 60 – 64. GALLEGO A, HEATH MR (1994): The development of schooling behaviour in Atlantic herring Clupea harengus. Journal of Fish Biology 45: 569 – 588. GAUMERT D, KÄMMEREIT M (1993): Süßwasserfische in Niedersachsen. Hrsg.: Niedersächsisches Landesamt für Ökologie, Dezernat Binnenfischerei, Hildesheim, 161 S. GERKENS M, THIEL R (2001): Habitat use of age- 0 twaite shad (Alosa fallax LACÉPÈDE, 1803) in the tidal freshwater region of the Elbe River, Germany. Bull. Fr. Pêche Piscic. 362/363: 773 – 784. GERSTMEIER R, ROMIG T (2003): Die Süßwasserfische Europas für Naturfreunde und Angler. 2. Auflage, Franckh-Kosmos-Verlag, Stuttgart, 152 – 155. GESNER C (1563): Fischbuch, das ist eine kurtze, doch vollkommne beschreibung aller Fischen so in dem Meer und süssen wasseren, Seen, Flüssen, oder anderen Bächen jr wonung habend, sampt irer waren conterfactur, zu nutz und gutem allen Artzeten, Maleren, Weydelüten und Köchen gestellt…/ Erstlich in Latin durch… Cunrat Geßner beschriben: yetz neüwlich aber durch D. Cunrat Forer zu grösserem nutz allen liebharbernen der künsten in das Teutsch gebracht. I-CCII (Doppelseite); Zürich (Froschower), 1. Ausgabe in Deutsch, einzusehen in der Herzog-August Bibliothek in Wolfenbüttel. GLEBE BD, LEGGETT WC (1981): Latitudinal Differences in Energy Allocation and Use During the Freshwater Migrations of American Shad (Alosa sapidissima) and Their Life History Consequences. Canadian Journal of Fish and Aquatic Sciences 38: 806 – 820. GRAHAM M (1931): Some Problems in Herring Behaviour. The substance of a paper read to the Challenger Society in London on January 29th, 1931. Journ. du Cons. 2: 252 – 265. GRIFFITHS D (1997): The status of the Irish freshwater fish fauna: a review. Journal of Applied Ichthyology 13: 9 – 13. GROENEWOLD K (2003): Fauna der Unteren Ems. Untersuchungsbericht Oktober 2001 – Oktober 2002. Landesfischereiverband Weser – Ems e.V. Sportfischer-Verband, 24 S. Literaturverzeichnis 95 GUILLARD J, COLON M (2000): First results on migrating shad (Alosa fallax) and mullet (Mugil cephalus) echocounting in a lock on the Rhône river (France) using a split-beam sounder, and relationships with environmental data and fish caught. Aquat. Living Resour. 13: 327 – 330. HAESLOOP U (2004a): Untersuchungen zur Fischfauna der Unterweser. Auswertung von Hamenfängen in 2004. Endbericht, i.A. des Wasser- und Schifffahrtsamt Bremerhaven, 7 S. + Anhang (unveröffentlicht). HAESLOOP U (2004b): Untersuchungen zum Fischlarvenvorkommen in der Unterweser unter besonderer Berücksichtigung des Fintenaufkommens in 2004. Endbericht, i.A. des Wasser- und Schifffahrtsamt Bremerhaven, 7 S. + Anhang (unveröffentlicht). HAESLOOP U (2005): Untersuchungen zur Fischfauna des Weserästuars. Auswertung von Hamenfängen in der inneren Aussenweser im Winter 2005. i.A. des Wasser- und Schifffahrtsamt Bremerhaven, 5 S. + Anhang (unveröffentlicht). HALBEISEN H-W (1988): Bestimmungsschlüssel für Fischlarven der Nordsee und angrenzender Gebiete. Berichte aus dem Institut für Meereskunde an der ChristianAlbrechts-Universität zu Kiel, Nr. 178, 76 S. HÄPKE L (1878): Ichthyologische Beiträge. Abh. naturwiss. Verein Bremen 5: 157 – 192. HÄPKE L (1880): Fische und Fischerei im Wesergebiete. Abh. naturwiss. Verein Bremen 6: 577 – 616. HARDY JD (1978a): Development of fishes of the Mid-Atlantic bight. An atlas of egg, larval and juvenile stages. Volume 2, Anguillidae through Syngnathidae. Fish and Wildlife Service, 341 – 359. HARDY JD (1978b): Development of fishes of the Mid-Atlantic bight. An atlas of egg, larval and juvenile stages. Volume 3, Aphredoderidae through Rachycentridae. Fish and Wildlife Service, 281 – 313. HASS H (1965): Untersuchungen über den Laichfischbestand der Elbfinte, Alosa fallax (Lacépède 1803). Archiv für Fischereiwissenschaft 16(2): 150 – 168. HASS H (1968): Untersuchungen über die vertikale und horizontale Verteilung der Eier der Finte, Alosa fallax (LACÉPÈDE, 1803), in der Elbe. Archiv für Fischereiwissenschaft 19(1): 46 – 55. HASS H (1969): Unterscheidungsmerkmale dottersackloser Larven von Clupeiformes aus der Unterelbe. Archiv für Fischereiwissenschaft 20: 22 – 25. HA-ZEITUNG (2004): Der Maifisch ist wieder da – er galt als ausgestorben. Hannoversche Allgemeine Zeitung vom 04.08.2004. Literaturverzeichnis 96 HILLMAN R (2003): The Distribution, Biology and Ecology of Shad in South-West England. R&D Technical Report W1-047/TR Enviroment Agency, 147 S. http://publications.environment-agency.gov.uk/pdf/SW1-047-TR-e-e.pdf. HILLMAN RJ, COWX IG, HARVEY J (2003): Monitoring Allis and Twaite Shad. Conserving Natura 2000 Rivers Monitoring Series No. 3, English Nature, Peterborough, 27 S. HOEK PPC (1899): Neuere Lachs- und Maifisch-Studien. Tijdschr. ned. dierk. Vereen. 2: 156 – 242. HOEK PPC (1900): Neuere Lachs- und Maifisch- Studien. Auszug aus: Tydschrift der Nederlandsche Dierkundige Vereenigung, Fischerei-Zeitung, Band 3: 52 – 55, 86 – 88. HOESTLANDT H (1958): Reproduction de l’Alose Atlantique (Alosa alosa LINNÉ) et transfert au bassin Méditerranéen. Verhandlungen Internationale Vereinigung für Theoretische und Angewandte Limnologie 13: 736 – 742. HOLMES RHA, HENDERSON PA (1990): Brief communication. High fish recruitment in the Severn estuary: the effect of a warm year? Journal of Fish Biology 36: 961 – 963. JENKINS JT (1902): Altersbestimmung durch Otolithen bei den Clupeiden. Wiss. Meeresunters. Abt. Kiel und Abt. Helgoland 6: 83 – 122. JENS G (1952/53): Über den lunaren Rhythmus der Blankaalwanderung. Archiv für Fischereiwissenschaft 4: 94 – 110. JENS G (1954): Untersuchungen über rhythmische Erscheinungen beim Heringsfang in der Nordsee. Archiv für Fischereiwissenschaft 5: 113 – 119. JOHNSON JH, DROPKIN DS (1995): Effects of prey density and short term food deprivation on the growth and survival of American shad larvae. Journal of Fish Biology 46: 872 – 879. JONES FRH (1968): The Herring. Chapter 6. In: JONES FRH (Hrsg.): Fish Migration. Edward Arnold Ltd., London, 86 – 143. JONES PW, MARTIN FD, HARDY JD (1978): Development of fishes of the Mid-Atlantic bight. An atlas of egg, larval and juvenile stages. Volume 1, Acipenseridae through Ictaluridae. Fish and Wildlife Service, 75 – 121. JUNGWIRTH M, HAIDVOGEL G, MOOG O, MUHAR S, SCHUTZ S (2003): Angewandte Fischökologie an Fließgewässern. UTB Facultas, 547 S. KAFEMANN R, THIEL R, SEPÚLVEDA A (1996): Die fischökologische Bedeutung der Nebenstromgewässer der Unterelbe. Arch. Hydrobiol. Suppl. 110, Unters. Elbe-Ästuar 7(2/3): 199 – 214. Literaturverzeichnis 97 KENNEDY CR (1981): The occurrence of Eubothrium fragile (Cestoda: Pseudophyllidae) in twaite shad, Alosa fallax (Lacépède) in the River Severn. Journal of Fish Biology 19: 171 – 177. KLINKHARDT M (1996): Der Hering, Clupea harengus. Westarp-Wissenschaften, Magdeburg, Spektrum Akad. Verlag, Heidelberg, Die Neue Brehm-Bücherei, Bd. 199, 230 S. KLOPPMANN M, ZEILER M, STELZENMÜLLER V, EHRICH S, ZAUKE G-P, BÖTTCHER U (2003a): Zur Ausweisung von Natura 2000-Schutzgebieten in der AWZ von Nord- und Ostsee unter Berücksichtigung der FFH-Lebensraumtypen und -Fischarten, 35 S. http://www.bfa-fish.de/news/news-d/aktuell/AWZ/AWZ%20HP.html (15.12.2003). KLOPPMANN M, BÖTTCHER U, DAMM U, EHRICH S, MIESKE B, SCHULTZ N, ZUMHOLZ K (2003b): Erfassung von FFH-Anhang II-Fischarten in der deutschen AWZ der Nord- und Ostsee. F+E-Vorhaben FKZ: 802 85 200, erstellt im Auftrag des Bundesamtes für Naturschutz, 82 S. KÖHLER A (1981): Fluktuationen der Fischfauna im Elbe-Ästuar als Indikator für ein gestörtes Ökosystem. Helgoländer Meeresuntersuchungen 34: 263 – 285. KÜHL H (1976): Zum Stand der Hamenfischerei in der Unterelbe. Neues Archiv für Niedersachsen 25(4): 315 – 324. KÜHLE H, KUNZE B, GRABEMANN I, MÜLLER A (1989): Gutachten zur Beurteilung des Gewässergütezustandes der Unterweser. Teilbericht: Einfluß der Kläranlage Seehausen auf den Sauerstoff- und Nährstoffgehalt der Unterweser. GKSS Forschungszentrum Geesthacht GmbH. KYLE HM, EHRENBAUM E (1929a): Teleostei, Anhang A: Fischeier. In: GRIMPE G (Hrsg.): Die Fische der Nord- und Ostsee. Akademische Verlagsgesellschaft, Leipzig, XII. c85. KYLE HM, EHRENBAUM E (1929b): Teleostei, Anhang A: Fischeier. In: GRIMPE G (Hrsg.): Die Fische der Nord- und Ostsee. Akademische Verlagsgesellschaft, Leipzig, XII. f10 – XII. f34. LACEPÈDE BGE (1803): Histoire Naturelle des Poissons. Paris: Plassan, 803 S. LADIGES W, VOGT D (1979): Die Süßwasserfische Europas. Bis zum Ural und Kaspisches Meer. Ein Bestimmungsbuch für Sport- und Berufsfischer, Biologen und Naturfreunde. 2. Auflage, Paul Parey, Hamburg und Berlin, 62 – 69. LAMBERT P, VANDEMBULCKE D, ROCHARD E, BELLARIVA JL, CASTELNAUD G (2001): Age of migration for spawners from three cohorts of allis shad (Alosa alosa) in the Gironde watershed (France). Bull. Fr. Pêche Piscic. 362/363: 973 – 987. Literaturverzeichnis 98 LEACH SD, HOUDE ED (1999): Effects of environmental factors on survival, growth, and production of American shad larvae. Journal of Fish Biology 54: 767 – 786. LE CORRE M, SABATIE R, BAGLINIERE JL (2000): Charactérisation démographique de populations d’Alosa fallax rhodanensis (Clupeidae) de la Méditerranée française. Cybium 24 (Supplement 3): 119 – 128. LEIM AH (1925): The Life History of the Shad (Alosa sapidissima (Wilson)) with special Reference to the factors limiting its Abundance. Contr. to Canad. Biol., Vol. 2, Part 1, Nr.11: 161 – 284. LELEK A (1976): Veränderungen der Fischfauna in einigen Flüssen Zentraleuropas (Donau, Elbe, Rhein). Schriftenreihe Vegetationskunde 10: 295 – 308. LELEK A (1987): The Freshwater Fishes of Europe. Threatened fishes of Europe. Aula Verlag, Wiesbaden, Vol. 9: 58 – 62. LILLELUND K (1961): Untersuchungen über die Biologie und Populationsdynamik des Stintes, Osmerus eperlanus eperlanus (LINNAEUS 1758), der Elbe. Archiv für Fischereiwissenschaft 12, Beiheft 1: 1 – 128. LILLELUND K (1963): Die Auswirkung der Kanalisierung unserer Flüsse auf die Fischfauna und ihre Lebensbedingungen. Umschau 5: 148 – 152. LIMBURG K (2001): American Shad in its Native Range. A Conference on the Status and Conservation of Shads Worldwide, May 20-23, 2001. http://www.cbr.washington.edu/~hinrich/shad/shad2001/abtalks-combined.pdf. LOHMEYER C (1909): Übersicht der Fische des unteren Ems-, Weser- und Elbgebietes. Abh. naturwisss. Verein Bremen, XIX: 149 – 180. LOZÁN JL (1990): Zur Gefährdung der Fischfauna - Das Beispiel der diadromen Fischarten und Bemerkungen über andere Spezies. In: LOZÁN JL, LENZ W, RACHOR E, WATERMANN B, WESTERNHAGEN H v. (Hrsg.): Warnsignale aus der Nordsee. Verlag Paul Parey, Berlin und Hamburg, 231 – 249. LOZÁN JL, KAUSCH H (2004): Angewandte Statistik für Naturwissenschaftler. 3. Auflage, Wissenschaftliche Auswertungen, Hamburg, 300 S. LOZÁN JL, LENZ W, RACHOR E, WATERMANN B, WESTERNHAGEN H v. (Hrsg.) (1990): Warnsignale aus der Nordsee. Verlag Paul Parey, Berlin und Hamburg, 431 S. LOZÁN J, KÖHLER C, SCHEFFEL HJ, STEIN H (1996): Gefährdung der Fischfauna der Flüsse Donau, Elbe, Rhein und Weser. In: LOZÁN JL, KAUSCH H (Hrsg.): Warnsignale aus Flüssen und Ästuaren. Paul Parey Verlag Hamburg, 217 – 227. Literaturverzeichnis 99 MAITLAND PS (1983): Der Kosmos-Fischführer. Die Süßwasserfische Europas in Farbe. Mit 248 Abbildungen und 121 Zeichnungen. Kosmos. Gesellschaft der Naturfreunde. Franckh’sche Verlagsbuchhandlung, Stuttgart, 80 – 87. MAITLAND PS, HATTON-ELLIS TW (2003): Ecology of the Allis and Twaite Shad. Conserving Natura 2000 Rivers Ecology Series No. 3, English Nature, Peterborough, 28 S. MANYUKAS YL (1989): Biology of the Atlantic shad, Alosa fallax fallax, in Kurshskiy Bay. Journal of Ichthyology 29: 125 – 128. MARSHALL W (1895): Die deutschen Meere und ihre Bewohner. Verlag A. Twietmeyer, Leipzig, 670 – 671. MASSMANN WH (1951): Characteristics of spawning areas of shad, Alosa sapidissima (Wilson) in some Virginia streams. American Fisheries Society 81: 78 – 93. MEINKEN H (1974): Zur Verbreitung der Fische und Kriechtiere im Bremer Gebiet, 1905 – 1965. Abh. naturwiss. Verein Bremen 37(3/4): 453 – 486. MOHR E (1941): Maifische (Clupeiden). In: DEMOLL R, MAIER HN: Handbuch der Binnenfischerei Mitteleuropas IIIa. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart, 527 – 551. MÖLLER H (1984): Daten zur Biologie der Elbfische. Verlag H. Möller, Kiel, 217 S. MÖLLER H (1988): Fischbestände und Fischkrankheiten in der Unterelbe 1984 – 1986. Möller, Kiel, 344 S. MÖLLER H (1991): Der Zustand der Fischfauna in der Tideelbe. Fischökologie 4: 23 – 44. MÖLLER H (1993): Status of the fish fauna of the lower Elbe River and concepts for its protection. In: BRAUNBECK T, HANKE W, SEGNER H (Hrsg.): Fish- Ecotoxicology and Ecophysiology. Proceedings of an International Symposium, Heidelberg, September 1991, VCH, Weinheim, New York, Basel, Cambridge, 159 – 172. MÖLLER H, DIEKWISCH B (1991): Larval fish production in the tidal River Elbe 1985 – 1986. Journal of Fish Biology 38: 829 – 838. MUUS BJ, DAHLSTRÖM P (1998): Süßwasserfische Europas – Biologie, Fang, wirtschaftliche Bedeutung. 8. Auflage, BLV Verlagsgesellschaft München, Bern, Wien, 48 – 49. MUUS BJ, NIELSEN JG (1999): Die Meeresfische Europas in Nordsee, Ostsee und Atlantik. Franckh – Kosmos Verlag- GmbH & C., Stuttgart, 87 – 95. NOLTE W (1968): Die Küstenfischerei in der Unter- und Außenweser und die Abwasserbedrohung. Helgoländer wiss. Meeresunters. 17: 156 – 167. NOLTE W (1976): Die Küstenfischerei in Niedersachsen. Kommissionsverlag Göttinger Tageblatt GmbH & Co., Göttingen, Hannover, 109 S. Literaturverzeichnis 100 OESMANN S, THIEL R (2001): Feeding of juvenile twaite shad (Alosa fallax LACÉPÈDE, 1803). Bull. Fr. Pêche Piscic. 362/363: 785 – 800. OLNEY JE, DENNY SC, HOENIG JM (2001): Criteria for determining maturity stage in female American shad, Alosa sapidissima, and a proposed reproductive cycle. Bull. Fr. Pêche Piscic. 362/363: 881 – 901. O’MAOILEIDIGH N, CAWDERY S, BRACKEN JJ, FERGUSON A (1988): Morphometric, meristic character and electrophoretic analyses of two Irish populations of twaite shad, Alosa fallax (Lacépède). Journal of Fish Biology 32: 355 – 366. PĘCZALSKA A (1973): Parposz, Alosa fallax (Lacépède, 1800) – ryba mało znana. Alosa fallax (Lacépède, 1800), a Fish little known. Przegląd Zoologiczny 17(2): 195 – 200. PETERMEIER A, SCHÖLL F, TITTIZER T (1996): Die ökologische und biologische Entwicklung der deutschen Elbe. Ein Literaturbericht. Lauterbornia 24: 1 – 95. PINA T, ESTEVES E, ANDRADE JP (2003): Gross and histological observations of ovarian development in twaite shad, Alosa fallax fallax, from the Rivers Mira and Guadiana (Portugal). Scientia Marina 67(3): 313 – 322. PINDER AC (2001): Keys to larval and juvenile stages of coarse fishes from fresh waters in the British isles. Freshwater Biological Association Scientific Publications No. 60, 136 S. QUIGLEY DTG, FLANNERY K (1996): Endangered freshwater fish in Ireland. In: KIRCHHOFER A, HEFTI D (Hrsg): Conservation of Endangered Freshwater Fish in Europe. Birkhäuser Verlag Basel, Boston, Berlin, 27 – 34. QUIGNARD JP, DOUCHEMENT C (1991a): Alosa fallax fallax (Lacepède, 1803). In: HOESTLANDT H (Hrsg.): The freshwater fishes of Europe Vol. 2: Clupeidae, Anguillidae. Aula-Verlag Wiesbaden, 225 – 253. QUIGNARD JP, DOUCHEMENT C (1991b): Alosa alosa (Linnaeus, 1758). In: HOESTLANDT H (Hrsg.): The freshwater fishes of Europe Vol. 2: Clupeidae, Anguillidae. Aula-Verlag Wiesbaden, 89-126. QUIGNARD JP, DOUCHEMENT C (1991c): Alosa fallax killarnensis (Regan, 1916). In: HOESTLANDT H (Hrsg.): The freshwater fishes of Europe Vol. 2: Clupeidae, Anguillidae. Aula-Verlag Wiesbaden, 254 – 256. QUIGNARD JP, DOUCHEMENT C (1991d): Alosa fallax lacustris (Fatio, 1890). In: HOESTLANDT H (Hrsg.): The freshwater fishes of Europe Vol. 2: Clupeidae, Anguillidae. Aula-Verlag Wiesbaden, 257 – 264. Literaturverzeichnis 101 QUIGNARD JP, DOUCHEMENT C (1991e): Alosa fallax nilotica (Geoffrey Saint-Hilaire, 1808). In: HOESTLANDT H (Hrsg.): The freshwater fishes of Europe Vol. 2: Clupeidae, Anguillidae. Aula-Verlag Wiesbaden, 265 – 273. QUIGNARD JP, DOUCHEMENT C (1991f): Alosa fallax rhodanensis (Roule, 1924). In: HOESTLANDT H (Hrsg.): The freshwater fishes of Europe Vol. 2: Clupeidae, Anguillidae. Aula-Verlag Wiesbaden, 274 – 288. QUIGNARD JP, KARTAS F (1977): Les Aloses fintes Alosa fallax (Lacepède, 1803) Poissons Clupéiformes de l’Atlantique nord-est et de la Méditerranée. Étude des caractères numériques. Bull. Mus. natn. Hist. Nat. Paris, Zoologie 350, 501: 1241 – 1256. REDEKE HC (1939): Über den Bastard Clupea Alosa finta Hoek. Archives Neerlandaise de Zoologie 3: 148 – 158. REGAN CT (1916): The British Fishes of the Subfamily Clupeinae and Related Species in other Seas. The Annals and Magazine of Natural History Vol. 18(8), Nr. 103: 1 – 19. ROULE L (1925): Les poissons des eaux douces de la France. Paris, Presses Universitaires de France, 228 S. RUSSELL FS (1976): The Eggs and Planktonic Stages of British Marine Fishes. Academic Press, London, New York, San Francisco, 534 S. SABATIÉ M-R (1990): Croissance linéaire de l’Alose vraie, Alosa alosa Linné, 1758 (Clupeidae), dans l’Oued Sebou (Façade nord-Atlantique du Maroc). Cybium 14(2): 131 – 142. SABATIE MR (1993): Recherches sur l’écologie et la biologie des aloses du Maroc (Alosa alosa Linné, 1758 et Alosa fallax Lacépède 1803). Exploitation et taxiinomie des populations atlantiques; bioécologie des aloses de l’oued Sebou. Brest, Université de Bretagne Occidentale en Océanologie Biologique, 326 S. plus Anhänge. SACHS L (1992): Angewandte Statistik. Anwendung statistischer Methoden. 7. Auflage, Springer-Verlag, Berlin, Heidelberg, New York, London, Paris, Tokyo, Hong Kong, Bearcelona, Budapest, 846 S. SCHEFFEL H-J (1989): Untersuchungen zum Jungfischaufkommen in der Bremer Unterweser. Diplomarbeit Universität Bremen FB2, 233 S. SCHEFFEL H-J, SCHIRMER M (1991): Larvae and juveniles of freshwater and euryhaline fishes in the tidal River Weser at Bremen, FRG. Verh. Internat. Verein. Limnol. 24: 2446 – 2450. SCHEFFEL H-J, SCHIRMER M (1997): Die Fischgesellschaften im Bereich der Tideweser. Bremer Beiträge für Naturkunde und Naturschutz, Band 3: 25 – 36. Literaturverzeichnis 102 SCHIRMER M (1991): Die Verbreitung der Fische im Land Bremen. Abh. Naturw. Verein Bremen 41(3): 405 – 465. SCHIRMER M (1994): Ökologische Konsequenzen des Ausbaus der Ästuare von Elbe und Weser. In: LOZÁN JL, RACHOR E, REISE K, WESTERNHAGEN H v., LENZ W (Hrsg.): Warnsignale aus dem Wattenmeer. P. Parey, Hamburg, 164 – 171. SCHIRMER M (1996): Die Weser – eine Zustandsbeschreibung. In: LOZÁN JL, KAUSCH H (Hrsg.): Warnsignale aus Flüssen und Ästuaren. Paul Parey Verlag Hamburg, 75 – 82. SCHIRMER M, SCHULZE S (2005): Gutachten über die Betroffenheit der Fischart „Finte“ (Alosa fallax, Lacépède) durch die Baumaßnahmen zum Wesertunnel der A 281 im Einschwimm-/Absenkverfahren. Erstellt für die Freie Hansestadt Bremen, vertreten durch die GPV, unter Beteiligung von R. Droste und U. Haesloop, 34 S. (unveröffentlicht). SCHIRMER M, HACKSTEIN E, LIEBSCH H (1983): Kritische Belastung des O2- Haushalts der Unterweser durch kommunale und industrielle Abwässer.Verhandlungen der Gesellschaft für Ökologie, Band 10: 337 – 344. SCHNAKENBECK W (1928): Die Nordseefischerei. In: Handbuch der Seefischerei Nordeuropas, Band 5, Deutsche Seefischerei, Heft 1, E. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart, 37 – 69. SCHNAKENBECK W (1953): Die deutsche Seefischerei in Nordsee und Nordmeer. HamburgBlankenese: Kröger, 113 – 199. SCHÖNBORN W (1992): Fließgewässerbiologie. Gustav Fischer Verlag Jena, Stuttgart, 44 – 45. SCHRÖDER K, BUSCH D, SCHIRMER M, SCHUCHARDT B (1983): Reaktionen der Fischfauna auf anthropogene chemische und physikalische Veränderungen des Wassers der Unterweser. Neues Archiv für Niedersachsen 32(4): 418 – 430. SCHUCHARDT B, BUSCH D, SCHIRMER M, SCHRÖDER K (1984): Von Pödder, Längen und Pümpelgarn. Die Monotonisierung der Fischereimethoden an der Unterweser. Gezeiten: 67 – 75. SCHUCHARDT B, BUSCH D, SCHIRMER M, SCHRÖDER K (1985): Die aus Fangstatistiken rekonstruierbare Bestandsentwicklung der Fischfauna der Unterweser seit 1891: Ein Indikator für Störungen des Ökosystems. Natur und Landschaft 60. Jg., Heft 11: 441 – 444. SCHUCHARDT B, MÜLLER M, SCHIRMER M (1989): Veränderungen im Sauerstoff-Haushalt der Unterweser nach der Reduzierung kommunaler und industrieller Einleitungen. Deutsche Gewässerkundliche Mitteilungen 33(3/4): 98 – 103. Literaturverzeichnis 103 SCHUCHARDT B, HAESLOOP U, SCHIRMER M (1993): The tidal freshwater reach of the Weser Estuary: Riverine or estuarine? Netherlands Journal of Aquatic Ecology 27(2-4): 215 – 226. SCHULZE S, SCHIRMER M (2005): Die Wiederentdeckung der Finte in der Unterweser. Deutsche Gesellschaft für Limnologie (DGL), Tagungsbericht 2004 (Potsdam), im Druck. SCHWOLERT H (1891): Bericht über die künstliche Zucht des Maifisches der Elbe. Circulare des D. F. V., Nr. 30: 164 – 166. SPRENGEL G (1997): Verluste an Organismen im Bereich der deutschen Küsten von Nordund Ostsee einschließlich der Ästuare durch die Entnahme von Wasser für großtechnische Kühlsysteme. – Bestandsaufnahme, ökologische Bewertung und Vorstellung von Verfahren zur Problemminderung. Forschungsbericht 202 04 258, GUT Umwelttechnik GmbH, 352 S. STEINBERG L (1992): Fische unserer Bäche und Flüsse. Verbreitung, Gefährdung und Schutz in Nordrhein-Westfalen. Ministerium für Umwelt, Raumordnung und Landwirtschaft des Landes Nordrhein-Westfalen, 121 S. STEINMANN I, BLESS R (2004): Alosa fallax (LA CEPÈDE, 1803). In: PETERSEN B, ELLWANGER G, BLESS R, BOYE P, SCHRÖDER E, SSYMANK A: Das europäische Schutzgebietssystem Natura 2000. Ökologie und Verbreitung von Arten der FFH-Richtlinie in Deutschland. Band 2: Wirbeltiere. Schriftenreihe für Landschaftspflege und Naturschutz, Bundesamt für Naturschutz, Bonn-Bad Godesberg, Heft 69: 223 – 227. STEINMANN I, THIEL R (2005): Kriterien zur Bewertung des Erhaltungszustandes der Populationen der Finte (Alosa fallax (LA CEPEDE, 1803)) - Allgemeine Bemerkungen. http://www.bfn.de/03/030306_fische.pdf STEINMANN I, INGENDAHL D, KLINGER H, SCHÜTZ C (2005): Kriterien zur Bewertung des Erhaltungszustandes der Populationen des Maifisches (Alosa alosa (LINNAEUS, 1758)) Allgemeine Bemerkungen. http://www.bfn.de/03/030306_fische.pdf STELZENMÜLLER V, ZAUKE G-P (2003): Analyse der Verteilungsmuster der anadromen Wanderfischart Finte (Alosa fallax) in der Nordsee. – F+E-Vorhaben „Prüfung der fachlichen Notwendigkeit zur Benennung von FFH-Gebieten zum Schutz der Fischart Finte“, Forschungsbericht gefördert durch das Bundesamt für Naturschutz, Bonn (FKZ: 802 85 230, UFOPLAN 2002), Institut für Chemie und Biologie des Meeres (ICBM), Carl von Ossietzky Universität Oldenburg, 31 S. www.icbm.de/~aqua/Veranstaltungen/Reader-Texte/alosa_icbm_03f.pdf (15.09.2003). Literaturverzeichnis 104 STELZENMÜLLER V, MAYNOU F, EHRICH S, ZAUKE G-P (2004): Spatial Analysis of Twaite Shad, Alosa fallax (LACEPÈDE, 1803), in the Southern North Sea: Application of NonLinear Geostatistics as a Tool to Search for Special Areas of Conservation. Internat. Rev. Hydrobiol. 89(4): 337 – 351. STEMMER B (2003): Invasion der Süßwasserheringe. Ein Bericht der Laichwanderungen von Maifisch und Finte in Frankreich. Allgemeine Fischerei Zeitung Fischwaid, Verband Deutscher Sportfischer e.V., Heft 1/2003: 10 – 13. STERNER E (1918): Die niederelbische Küstenfischerei. Der Maifischfang. Der Fischerbote Jg. X: 13 – 16. ŠVAGŽDYS A (1999): Characteristics of the spawning shoal of twaite shad (Alosa fallax fallax) immigrants in the Kuršių Lagoon. Acta Zoologica Lituanica 9(1): 174 – 177. SVETOVIDOV AN (1963): Systematic report on anadromous clupeids of the genera Alosa, Caspialosa, and Pomolobus in Europe and North America. Zool. Zh. AN U.S.S.R. 42(10): 1523 – 1538. SVETOVIDOV AN (1973): Clupeidae. In: HUREAU JC, MONOD Th (Hrsg.): Check-list of the fishes of the north-eastern Atlantic and of the Mediterranean (CLOFNAM) Volume 1, UNESCO, Paris, 99 – 109. SWEETMAN KE, MAITLAND PS, LYLE AA (1996): Scottish natural heritage and fish conservation in Scotland. In: KIRCHHOFER A, HEFTI D (Hrsg): Conservation of Endangered Freshwater Fish in Europe. Birkhäuser Verlag Basel, Boston, Berlin, 23 – 26. TAVERNY C, ELIE P (2000): Répartition spatio-temporelle des Aloses Alosa alosa (LINNÉ, 1766) et Alosa fallax (LACÉPÈDE, 1803) dans le Golfe de Gascogne. Cemagref Bordeaux: 1 ère conférence sur les aloses européennes, 22. - 25. Mai 2000. http://alpha.bordeaux.cemagref.fr/rabx/alose.shad/taverny1.html (05.04.2005). TAZ NORD BREMEN (2003): Ein Fisch namens Finte. Die Tageszeitung Nord Bremen vom 30.12.2003. TAZ BREMEN (2004): Vorsicht, Finte! Die Tageszeitung Bremen Nr. 7381 vom 12.06.2004, Seite 5, 185 TAZ-Bericht, S.Gieffers / A. Simon. TAZ NORD (2004): Finte torpediert Windkraft. Die Tageszeitung Nord Nr. 7429 vom 07.08.2004, Seite 32, TAZ-Bericht, ksc. TEROFAL F (1974): Meeresfische. Nordatlantik und Mittelmeer. BLV Verlagsgesellschaft München - Bern - Wien. THIEL R, POTTER IC (2001): The ichthyofaunal composition of the Elbe Estuary: an analysis in space and time. Marine Biology 138: 603 – 616. Literaturverzeichnis 105 THIEL R, SEPÚLVEDA A, KAFEMANN R, NELLEN W (1995): Environmental factors as forces structuring the fish community of the Elbe Estuary. Journal of Fish Biology 46: 47 – 69. THIEL R, SEPÚLVEDA A, OESMANN S (1996a): Occurrence and distribution of twaite shad (Alosa fallax Lacépède) in the lower Elbe River, Germany. In: KIRCHHOFER A, HEFTI D (Hrsg): Conservation of Endangered Freshwater Fish in Europe. Birkhäuser Verlag Basel, Boston, Berlin, 157 – 170. THIEL R, MEHNER T, KÖPCKE B, KAFEMANN R (1996b): Diet Niche Relationships among Early Life Stages of Fish in German Estuaries. Mar. Freshwater Res. 47: 123 – 136. THIEL R, OESMANN S, GERKENS M (2000): Spatial and temporal gradients in habitat use of age-0 twaite shad (Alosa fallax Lacépède) in the Elbe Estuary. Cemagref Bordeaux: 1 ère conférence sur les aloses européennes, 22. - 25. Mai 2000. http://www.bordeaux.cemagref.fr/rabx/alose.shad/thiel.html (05.04.2005). THIENEMANN A (1925): Die Binnengewässer Mitteleuropas. Bd. 1, Schweizerbart’sche Verlagsbuchhandlung, Stuttgart. TREWAVAS E (1938): The Killarney shad or “goureen” (Alosa fallax killarnensis Regan, 1916). Proceedings of the Linnaen Society 150(2): 110 – 112. VERON V (1999): Les populations de grande Alose (Alosa alosa, L.) et d’Alose feinte (Alosa fallax Lacépède) des petits fleuves français du littoral Manche Atlantique. Rennes, ENSAR Laboratoire Halieutique and INRA, Rennes, 81 S. VERON V, SABATIE R, BAGLINIERE J-L, ALEXANDRINO P (2000): Charactérisation morphologique, biologique et génétique des populations de Grande Alose (Alosa alosa) et d’alose feinte (Alosa fallax) de la Charente. Cemagref Bordeaux: 1 ère conférence sur les aloses européennes, 22. - 25. Mai 2000. http://alpha.bordeaux.cemagref.fr/rabx/alose.shad/veron.html (05.04.2005). VILCINSKAS A (1993): Einheimische Süßwasserfische, Alle Arten: Merkmale, Verbreitung, Lebensweise. Naturbuch Verlag, 207 S. VON DEM BORNE M (1882): Die Fischereiverhältnisse des Deutschen Reiches, ÖsterreichUngarns, der Schweiz und Luxemburgs. Berlin (Moeser), 33 – 36. WALDMAN J (2001): An Introduction to the Alosines. A Conference on the Status and Conservation of Shads Worldwide, May 20-23, 2001. http://www.cbr.washington.edu/~hinrich/shad/shad2001/abtalks-combined.pdf. WALTER E (1913): Unsere Süßwasserfische. Eine Übersicht über die heimische Fischfauna nach vorwiegend biologischen und fischereiwirtschaftlichen Gesichtspunkten. Sehmeils naturwissenschaftliche Atlanten, Verlag von Quelle und Meyer in Leipzig. Literaturverzeichnis 106 WATERS JM, EPIFANIO JM, GUNTER T, BROWN BL (2000): Homing behaviour facilitates subtle genetic differentiation among river populations of Alosa sapidissima: microsatellites and mtDNA. Journal of Fish Biology 56: 622 – 636. WA UNTERWESERBERICHT (1999): Die Unterweser 1999. Der Senator für Bau, Umwelt und Verkehr, Bremen. http://www.umwelt.bremen.de/buisy/scripts/buisy.asp?doc=WA+Unterweserbericht+1999. WHEELER A (1975): Das Grosse Buch der Fische. Verlag Eugen Ulmer, Stuttgart, 121 – 122. WHEELER A (1978): Key to the Fishes of Northern Europe. A guide to the identification of more than 350 species. Frederick Warne, 66 – 70. WHITEHEAD PJP (1984): Clupeidae. In: WHITEHEAD PJP, BAUCHOT M-L, HUREAU J-C, NIELSEN J, TORTONESE E (Hrsg.): Fishes of the North-eastern Atlantic and the Mediterranean. UNESCO, Paris Vol. 1, 268 – 281. WIKTOR J (1989): Fish farming in Polish Baltic waters and its role in preserving the stocks of valuable species. Bulletin of Sea Fisheries Institute Gdynia 20: 50 – 54. WILKENS H, KÖHLER A (1977): Die Fischfauna der unteren und mittleren Elbe: die genutzten Arten, 1950 – 1975., Abh. Verh. naturwiss. Ver. Hamburg 20 (N.F.): 185 – 222. WINKLER HM (1991): Changes of Structure and Stock in Exploited Fish Communities in Estuaries of the Southern Baltic Coast (Mecklenburg-Vorpommern, Germany). Int. Revue ges. Hydrobiol. 76: 413 – 422. WINKLER H, SKORA K, REPECKA R (2000): The historical and recent state of allis shad (Alosa alosa) and twaite shad (Alosa fallax fallax) in the Baltic sea. Cemagref Bordeaux: 1 ère conférence sur les aloses européennes, 22. - 25. Mai 2000. http://alpha.bordeaux.cemagref.fr/rabx/alose.shad/winkler.html (05.04.2005). WITTMACK L (1875): Beiträge zur Fischerei-Statistik des Deutschen Reichs sowie eines Theiles von Oesterreich-Ungarn und der Schweiz. Circ. Dtsch. Fisch. Ver.: 3 – 143. WURMBACH H (1936): Wanderungen der Süßwasserfische. Fischerei-Zeitung Nr. 35, Band 39: 537 – 540. ZÖFEL P (1992): Statistik in der Praxis. 3. Auflage, Gustav Fischer Verlag, Stuttgart, Jena, UTB für Wissenschaft, 422 S. ZYDLEWSKI J, MC CORMICK SD, KUNKEL JG (2000): The physiological ecology of American shad (Alosa sapidissima). Cemagref Bordeaux: 1 ère conférence sur les aloses européennes, 22. - 25. Mai 2000. http://alpha.bordeaux.cemagref.fr/rabx/alose.shad/zydlewski.html (05.04.2005). Literaturverzeichnis 107 Literatur aus dem Internet • http://www.bfn.de/03/030301_ffh_arten.pdf: Liste der in Deutschland vorkommenden Arten der Anhänge II, IV, V der FFH- Richtlinie (92/43/EWG) (27.04.2005) • http://www.conventions.coe.int/Treaty/en/Treaties/Html/104.htm: Conventions on the Conservation of European Wildlife and Natural Habitats, Bern, 19.XI.1979 (05.01.2005) • http://www.pivi.de/php/_adodb/browse3.php?Artname=Finte (19.04.2005) • http://www.environment-agency.gov.uk/news/521091?lang=_e&region=&projectstatus= &theme=&subject=&searchfor=Twaite+shad&topic=&ares=&month: Shrinking Shad Shoal Researched. Autor: Kempster D, Publiziert: 25.07.03 (13.11.2003) • http://www.wissenschaft-online.de/abo/lexikon/bio/3220 (anadrome Fische) • http://www.bfa-fish.de/news/news-d/presse/pr_01.htm: Presseinformation Nr. 359 vom 12.12.2001, Bedrohte Meeresfischarten wieder häufiger • http://www.larvalbase.org • http://www.mlur.brandenburg.de/presse/e0713001.htm: Pressemitteilung: Maifisch wiederentdeckt (13. Juli 2001) (13.07.2001) • http://www.fishbase.org(a):http://www.fishbase.org/Summary/SpeciesSummary.cfm?ID= genusname=Alosa&Speciesname=fallax (04.03.2005) • http://www.fishbase.org(b):http://www.fishbase.org/Summary/SpeciesSummary.cfm?id=1 01&genusname=Alosa&speciesname=alosa (04.03.2005) Glossar 8 108 Glossar • Abfluss: pro Zeiteinheit abfließende Wassermenge (Einheit: m3/s) • abiotisch: unbelebt; chemische, physikalische/ hydromorphologische Faktoren der Umwelt eines Organismus (JUNGWIRTH et al. 2003) • absolute Fekundität: Anzahl reifer Eier in den Ovarien vor der nächsten Laichperiode (BAGENAL & BRAUM 1978) • Abundanz: Anzahl der Organismen in Bezug auf eine bestimmte Fläche oder Rauminhalt (JUNGWIRTH et al. 2003) • adult: erwachsen und geschlechtsreif • anadrom: aus dem Meer zum Ablaichen ins Süßwasser aufsteigend (BLESS 1978); Tiere, die zur Eiablage aus dem Meer ins Süßwasser ziehen (JUNGWIRTH et al. 2003) • anthropogen: vom Menschen beeinflusst • Ästuar: der gesamte unter Tideeinfluss stehende Bereich eines ins Meer mündenden Flusses. Lässt sich in drei Teile teilen: mariner Teil mit freier Verbindung zum Meer, brackige Vermischungszone und tidebeeinflusster Süßwasserbereich • Beifang: bei der Fischerei auf bestimmte Tiere mitgefangene Organismen, oft nicht genutzt • biotisch: belebt, lebend; auf die biologischen Aspekte der Umwelt eines Organismus bezogen (JUNGWIRTH et al. 2003) • Brackwasser: Gemisch aus Süß- und Salzwasser (Salzgehalt: 0,5 – 30 ‰) • Cladoceren: griech. für Wasserflöhe • Copepoden: griech. für Ruderfußkrebse • Crustacea: Krebstiere • Cypriniden: Karpfenartige Fische • Detritus: feinste Teilchen organischer Substanz und zerfallende Tier- und Pflanzenreste als Schwebestoffe oder Bodensatz im Wasser • diadrom: diadrome Fische führen Laichwanderungen zwischen Meer und Süßwasser durch (siehe auch anadrom und katadrom) (LOZÁN et al. 1990); Fischarten, die zwischen Meer und Süßwasser wandern (JUNGWIRTH et al. 2003) • Dredge, Dredsche: Schleppnetz zum Fang am Boden lebender Tiere; in der Regel wird das Netz durch einen festen Rahmen offen gehalten (LOZÁN et al. 1990) • Drift: Treiben mit der Strömung (LOZÁN et al. 1990) • FFH- Richtlinie: Fauna und Flora Habitatrichtlinie (FFH- RL); „Richtlinie 92/43/EWG des Rates der Europäischen Gemeinschaften zur Erhaltung der natürlichen Lebensräume sowie der wildlebenden Tiere und Pflanzen“ (vom 21. Mai 1992, geändert durch die RL 97/62/EG vom Glossar 109 27.Oktober 1997); Fauna = Tierwelt, Flora = Pflanzenwelt, Habitat = Lebensraum; Aufbau eines Netzes von natürlichen und naturnahen Lebensräumen und von Vorkommen gefährdeter Tier- und Pflanzenarten, um so das europäische Naturerbe für kommende Generationen zu bewahren. Hierfür sind ausgewählte Lebensräume von europäischer Bedeutung aus verschiedenen geographischen Regionen miteinander zu verknüpfen. Sie bilden zusammen mit den Gebieten der 1979 erlassenen EU-Vogelschutzrichtlinie das europäische Schutzgebietsverbundsystem NATURA 2000. FFH-Richtlinie und Vogelschutzrichtlinie sind verbindlich umzusetzendes EURecht (JUNGWIRTH et al. 2003) • Fischregion: Abschnitte in Fließgewässern mit charakteristischen Vertretern der Fischfauna (JUNGWIRTH et al. 2003) • Gammariden: Flohkrebse • Gezeitenhub, Tidenhub: Unterschied zwischen Hoch- und Niedrigwasserstand (Amplitude) (LOZÁN et al. 1990) • Hamen: Sackförmiges Netz • Heimkehrverhalten (homing): Laichwanderung zu den Laichplätzen der Eltern (JUNGWIRTH et al. 2003) • Hybride: Nachkommen genetisch unterschiedlicher Eltern, insbesondere von Eltern, die zu unterschiedlichen Arten gehören (JUNGWIRTH et al.,2003) • juvenil: jugendlich und noch nicht geschlechtsreif • katadrom: aus dem Süßwasser zum Ablaichen ins Meer aufsteigend; Tiere, die zur Eiablage aus dem Süßwasser ins Meer ziehen (JUNGWIRTH et al. 2003) • Larvalphase: Jugendstadium eines tierischen Organismus, das im Körperbau vom adulten Organismus stark abweicht (JUNGWIRTH et al. 2003) • Leitfähigkeit: (unspez.) Summenparameter des Gesamtionenhaushaltes (JUNGWIRTH et al. 2003) • limnisch: im Süßwasser lebend • Merkmal: Eigenschaft, die variiert und für Klassifikations- und Bewertungszwecke herangezogen wird (JUNGWIRTH et al. 2003) • Milchner: männlicher Fisch, so genannt wegen der milchartigen Samenflüssigkeit („Milch“) • Morphologie: Wissenschaft von der Form/Gestalt (JUNGWIRTH et al. 2003) • Mysidacea: Schwebegarnelen • NATURA 2000: mit dem europäischen Schutzgebietssystem NATURA 2000 haben sich die Staaten der europäischen Union die Erhaltung der biologischen Vielfalt in Europa zum Ziel gesetzt. Schutzgebietssystem der Europäischen Union, umfasst die Gebiete nach der FFHRichtlinie und der Vogelschutzrichtlinie (JUNGWIRTH et al. 2003) • Nematoden: Fadenwürmer Glossar • 110 Ontogenie: Verlauf der typischen Entwicklung eines Organismus vom befruchteten Ei bis zum Abschluss von Wachstum und Differenzierung (JUNGWIRTH et al. 2003) • Osmoregulation: Regulation des Wassergehaltes und der Ionenkonzentration von Zellen und Organismen gegenüber dem umgebenden Medium, z.B. Süßwasser oder Salzwasser (JUNGWIRTH et al. 2003) • Otolithen: Steinchen im Gleichgewichtsorgan des Ohres, zur Altersbestimmung bei Fischen geeignet • pelagophil: freiwasserliebend • Perciden: Barschartige Fische • piscivor: fischfressend • Population: Reproduktionsgemeinschaft in einem abgegrenzten Raum (JUNGWIRTH et al. 2003) • potamodrom: Tiere, die zur Eiablage innerhalb von Flusssystemen wandern (JUNGWIRTH et al. 2003) • relative Fekundität: Anzahl Eier/kg Gesamtgewicht • Reproduktion: Fortpflanzung • Rogner: weiblicher Fisch, so genannt wegen der Eier („Rogen“) • Steert: enger Beutel am Ende eines Netzes, in dem sich der Fang sammelt • Taxon/Taxa: systematische Gruppe, d.h. eine Einheit des biologischen Systems (JUNGWIRTH et al. 2003)