Virustatika Antiinfektiva
Werbung
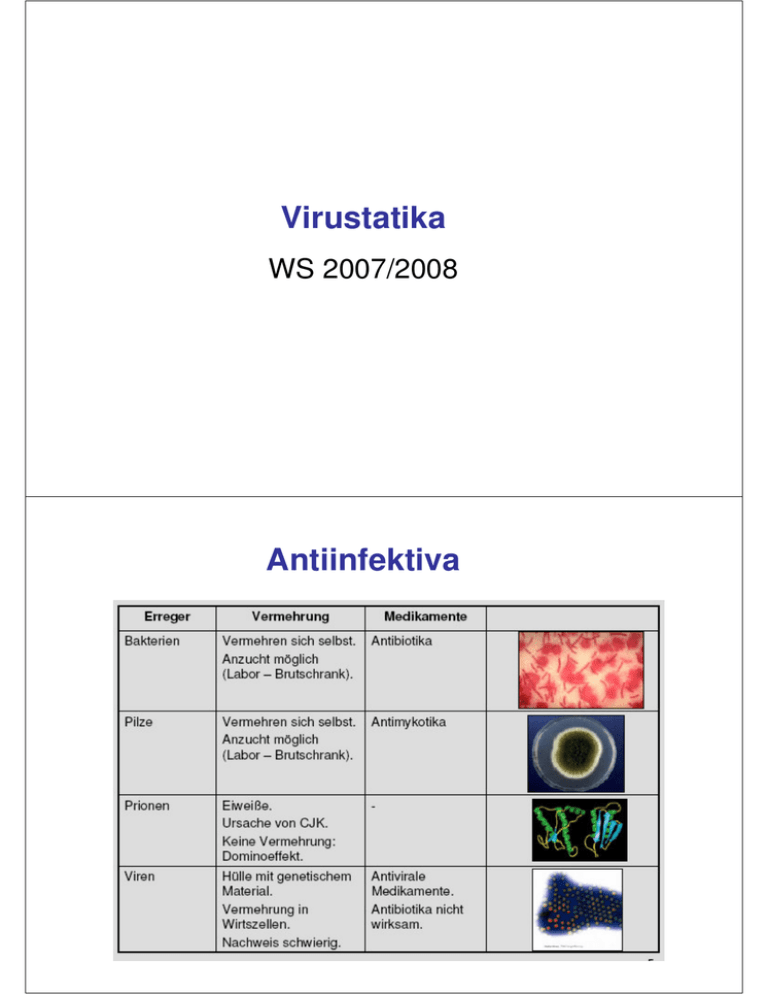
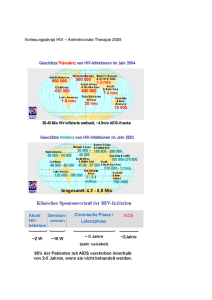
Virustatika WS 2007/2008 Antiinfektiva Virustatika Virustatika Virustatika „Erkältung“ im Winter Virustatika HIV Familie: humane Retroviren Subfamilie/Gruppe: Lentiviren Zeitlicher Verlauf einer HIV-Infektion Akute HIV-Erkrankung • bei 50-70%, 3-6 Wochen nach Primärinfektion • Symptomatik ähnlich wie bei infektiöser Mononukleose (=Pfeifersches Drüsenfieber): Fieber, Lymphknotenschwellung, Kopfschmerzen, Gelenksschmerzen • Neurologische Symptome: Gesichtslähmungen, kognitive Störungen, Psychosen Dynamik der HIV-Infektion • Virusreplikation während des gesamten Verlaufs der HIV-Infektion • HIV-Produktion: 1010 bis 1011 Viruspartikel pro Tag Zeitlicher Verlauf einer HIV-Infektion „aquired immunodeficiency syndrome“ erworbenes Immunschwäche-Syndrom, AIDS) • z.B. Infektionen mit (Pneumocystis carinii, Zytomegalie-Virus) opportunistischen Erregern atypische Mykobakterien, • Kaposi-Sarkom u.a. HIV-assoziierte Malignome • HIV-assoziierte Schwindsucht • u.a. Pharmakologische Angriffspunkte für die HIV-Therapie NRTI NNRTI Hemmstoff der Integrase HIV-Therapie • nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI, NUC) • nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) • Protease-Inhibitoren (PPI), NPPI • Fusionsinhibitoren • Integrase-Inhibitoren Reverse-Transkriptase-Inhibitoren HIV - reverse Transkriptase: Struktur Antiretrovirale Nukleosidanaloga (NRTI) Angriffspunkt Nucleinsäuresynthese Zidovudin (AZT; RETROVIR) Didanosin (ddI; VIDEX) Stavudin (d4T; ZERIT) Abacavir (ZIAGEN) Zalcitabin Lamivudin (ddC; HIVID) (3TC; EPIVIR) Tenofovir (VIREAD) nukleosidische Reverse-TranskriptaseInhibitoren (NRTI, NUC) Zidovudin (AZT) Azido-Gruppe Abacavir Didanosin (ddI) Lamivudin (3TC) Stavudin (D4T) Zalcitabin (ddC) Zidovudin (RetrovirR) Zidovudin Zidovudin-P Thymidin-Kinase Zidovudin-P2 Thymidylat-Kinase Zidovudin-P3 NucleosiddiphosphatKinase Umwandlung durch wirtszelleigene Kinasen nötig Hemmt nur neu in eine Wirtszelle penetrierte Viren! Zidovudin (Azidothmidin, AZT) Phosphorylierung Reverse Transkriptase Antimetabolit Abbruch der Transkription Indikation HIV-Infektion, AIDS (in Kombination!) Anwendung per os (BV ca. 70%, jedoch variabel) UAW / Risiken Kopfschmerz, Erbrechen, Schlafstörungen, Anämie, Neutropenie Therapieproblem Resistenzentwicklung (v.a. bei Monotherapie) Antiretrovirale Nukleosidanaloga (NRTI): UAW Zidovudin (AZT) Myelosuppression, GI-Intoleranz, Kopfschmerz, Schlafstörungen, Muskelatrophie Didanosin (ddL) Pankreatitis, periphere Neuropathie, Nausea, Diarrhoe Zalcitabin (ddC) periphere Neuropathie, Stomatitis, Pankreatitis Stavudin (d4T) periphere Neuropathie, Lipodystrophie Lamivudin (3TC) vergleichsweise gut verträglich, schnelle Resistenz Abacavir allergische Komplikationen: Fieber, Rash („Hypersensitivitätssyndrom“ = HSR) Antiretrovirale nicht - Nukleosidanaloga (NNRTI) Angriffspunkt Nucleinsäuresynthese Nevirapin (VIRAMUNE) Delavirdin (RESCRIPTOR) Efavirenz (SUSTIVA) Antiretrovirale nicht - Nukleosidanaloga Wirkmechanismus: Bindung an RT an der Substratbindestelle, allosterische Hemmung Probleme: schnelle Resistenzentwicklung (wichtigstes Problem!) nur wirksam gegen HIV-1 Kreuzresistenz mit den anderen NNRTI • Hepatotoxizität (N) • allergische Komplikationen: Rash (N, D) • ZNS: Schwindel, Alpträume, Schlafstörungen (E) • Wechselwirkungen via CYP3A4 (N, D, E) • Teratogenität (E) Antiretrovirale nicht - Nukleosidanaloga Nevirapin Delavirdin Efavirenz BV (%) > 90 85 Fett! HWZ (h) 25-30 6 40-50 CYP3A4 (Induktor) CYP3A4 (Inhibitor) CYP3A4 (Induktor) überw. renal biliär + renal überw. biliär Metabolismus Elimination Antiretrovirale Proteaseinhibitoren Angriffspunkt Virusreifung Polyprotein Schnittstellen Pharmakologische Hemmung der HIV-Protease Protease Indinavir, Ritonavir, Saquinavir, Nelfinavir, Aprenavir Polyprotein wird in aktive Proteine zerlegt Protease: hydrolysiert Phe-Pro Protease-Inhibitoren (PI) Saquinavir Nelfinavir Indinavir Amprenavir Ritonavir Lopinavir Antiretrovirale Proteaseinhibitoren Saquinavir (INVIRASE) Indinavir (CRIXIVAN) Ritonavir (NORVIR) Nelfinavir (VIRACEPT) Amprenavir (AGENERASE) Lopinavir (KALETRA) HIV-1 Protease [erforderlich zur Synthese von viralen Strukturproteinen und viralen Enzymen (RT, Protease)] Indikation Kombinationstherapie bei HIV-Infektion Anwendung oral (gute BV) Protease-Inhibitoren (PI) - Pharmakokinetk Saquniavir Ritonavir Amprenavir Indinavir Nelfinavir Lopinavir orale BV (%) 12 60 70 50 50 ? Plasma t1/2 (h) 10 2 4 4 9 7 Metabolisierung CYP3A4 CYP3A4 CYP3A4 und 2D6 CYP3A4 und 2D6 CYP3A4 CYP3A4 CYP-Hemmung + ++ ++++ ++ ++ +++ Aufbewahrung +4° RT +4° RT RT RT Protease-Inhibitoren (PI) – wichtige Nebenwirkungen – Nausea Diarrhoe Thrombopenie Hepato- und Nephrotoxizität Fettstoffwechselstörungen (Lipodystrophie, Hyperlipidämie→KHK!) Wechselwirkungen via CYP3A4 Extremer „Büffelnacken“ unter Indinavir Lipodystrophie Enfuvirtid (FuzeonR) Bindung an das virale GP41 Peptid aus 36 AS sehr aufwändige Synthese (106 Schritte) Therapiekosten x 2 Kinetik subkutane Injektion gute Resorption HWZ ca. 4 h VF ca. 5L / 70 kg Nebenwirkungen wenig lokale Reaktionen an Injektionsstelle Kopfschmerz/Übelkeit Antiretrovirale Kombinationstherapie (highly active antiretroviral therapy: HAART) drei Strategien: 1. NRTI + NRTI + NRTI 2. NRTI + NRTI + NNRTI 3. NRTI + NRTI + PI „Nukes-Backbone“ Tipranavir (Aptivus®) Tipranavir ist der erste nicht-peptidische Proteaseinhibitor (NPPI) und zeigte in vitro eine gute Wirksamkeit gegen PI-resistente Viren. Wegen der schlechten oralen Bioverfügbarkeit ist eine Ritonavir-Boosterung erforderlich! Tipranavir darf u.a. nicht zusammen mit folgenden Substanzen eingenommen werden: Rifampicin um 80 %), (reduziert Tipranavir-Spiegel Raltegravir (Raltegravir-Talspiegel werden um 55% reduziert), Tipranavir (Aptivus®) •Tipranavir (Aptivus®) muss immer zusammen mit niedrig dosiertem Ritonavir als pharmakokinetischem Verstärker angewendet werden •Nebenwirkungen: •Durchfall, Übelkeit, Müdigkeit und Kopfschmerzen. •Unter Tipranavir (Aptivus®) kann es zu Leberfunktionsstörungen und Triglycerid-Erhöhungen kommen. •Eine antiretrovirale Kombinationstherapie, die auch Behandlungsregime mit einem Protease-Hemmer einschließt, ist bei einigen Patienten mit einer Umverteilung des Körperfetts verbunden. •Selten: Rhabdomyolyse wurden im Zusammenhang mit ProteaseHemmern Integrase-Inhibitoren Lancet (2007; 369: 1261-1269) MK-0518 (Raltegravir/ Altegravir) Isentress®; Abk.: RGV Der erste Integraseinhibitor, der 2007/2008 für Patienten mit viralen Resistenzen gegen mindestens ein Medikament der Substanzklassen NRTI, NNRTI und PI verfügbar sein wird. Bislang gut verträgliche, vielversprechende Substanz Keine Langzeiterfahrungen! Bislang sehr gut verträglich, selten Übelkeit, Schwindel, Kopfschmerzen. Keine Langzeitdaten Maraviroc (Celsentri®): CCR5-Blocker bei AIDS/HIV (seit Oct. 07) Ausschließlich bei CCR5-tropen HIV-1Stämmen und nicht bei CXCR4tropen oder dual- / gemischt-tropen Virus-Stämmen wiksam Die häufigen Nebenwirkungen sind Leberfunktionsstörungen, Gewichtsverlust, Schwindelgefühl, Parästhesie, Beeinträchtigung, des Geschmackssinns, Schläfrigkeit, Husten, Magen-DarmBeschwerden, Hautausschlag, Juckreiz, Muskelkrämpfe, Rückenschmerzen, Kraftlosigkeit und Schlaflosigkeit. Virustatika „Erkältung“ im Winter Influenzaviren 8 RNAElemente Influenzaviren Einzel(−)-Strang-RNA-Viren = ss(−)RNA Die Familie Orthomyxoviridae (griech. myxa: Schleim) umfasst behüllte Viren mit einzelsträngiger RNA als Genom. Ihr RNA-Genom ist auf mehrere Segmente verteilt Die Segmentierung ihres Genoms ermöglicht den Orthomyxoviridae eine hohe genetische Flexibilität und Anpassungsfähigkeit an neue Wirtsspezies Durchmischung der verschiedenen Segmente verschiedener Subtypen und Mutanten durch das sogenannte Reassortment. Pandemie: Grippe-Epidemien in Deutschland Angriffspunkte der Pharmakotherapie Hemmung des Uncoatings Hemmung der Freisetzung Amantadin Angriffspunkt: Hemmung des Uncoatings Virus M2 M2 Golgi-Vesikel H+ NH2 Amantadin (VIREGYT) Indikation Influenza (bsd. A2) Anwendung oral (gute Resorption) Risiken Unruhe, Tremor, Sedierung, Mundtrockenheit, Übelkeit/Erbrechen (atropinähnliche Wirkungen) Neuraminidase-Inhibitoren Angriffspunkt Hemmung der Virus-Freisetzung Neuraminidase 1. Mittels Hämagglutinin erkennt Virus die Zellen des menschlichen Respirationstrakts Sialinsäure 2. Weitere Kopplung Neuraminsäure, Sialinsäure über 3. Internalisierung, Virusreplikation Neuraminidase 4. Knospung neuer Viren, die mittels Sialinsäure an der Memban verankert bleiben 5. Virusfreisetzung durch enzymatische Spaltung der Sialinsäure Neuraminidase-Inhibitoren Sialinsäure Neuraminidase Neuraminidase-Inhibitoren Zanamivir (Relenza®) Oral: minimale Resorption Pulver zur Inhalation: lokal ausreichende Konzentrationen erreicht Oseltamivir (Tamiflu®) (2002) Prodrug: Wirkstoff: Oseltamircarboxylat Oral verfügbar (Konzentration in der Lunge ausreichend) gegen alle 9 bekannten Neuraminidase (N)-Subtypen der Influenza A-Viren sowie gegen die Neuraminidase des Influenza B-Virus wirksam. Therapie und Prophylaxe (Senkung der Erkrankungshäufigeit 92%) Gute Verträglichkeit, gelegentlich (O): Übelkeit, Erbrechen Herpesviren (Herpes simlex, Varicella zoster, Zytomegalevirus, Eppstein-Barr-Virus) Doppelsträngige DNA-Viren = dsDNA Angriffspunkt: Nucleinsäuresynthese Nucleosid-Analoga (z.B. Aciclovir) Aciclovir normal HO CH2 O Base O O P O O Desoxynukleosid (dN) OH zelluläre Kinase P O CH2 O Base dNP CH2 O Base CH2 O O P O OH zelluläre Kinase Base O dNPPP P P P O CH2 O Base O O P O O - O CH2 O Base Base O CH2 O O P O OH O OH Aciclovir zelluläre Kinase P P P O CH2 P P P O CH2O virale Thymidinkinase Guanin Aciclovir-TP P O CH2O O Base Guanin Aciclovir O CH2 O O P O O OH Guanin Aciclovir-MP HO CH2O Base Base DNA-DNAvirale Polymerase Polymerase O CH2 O N O N N NH N HO CH2 Wirkstoff N NH N HO CH2 NH2 NH2 O O OH Aciclovir Ganciclovir (ZOVIRAX) (CYMEVEN) Indikation pathogene Herpesviren Herpes-, Varicella-, Epstein-Barr-, Cytomegalie-Virus Anwendung oral (BV nur 20%, Valaciclovir besser) intravenös lokal nur intravenös wg. geringer Resorption Risiken Nierenschäden, Exantheme Neutropenie (40%), Thrombopenie (20%), Fieber, Exantheme Geringe Spezifität Prodrug: Valciclovir Foscarnet Interaktion mit PyrophosphatBindungsstelle - O O P O - - 3 Na P + P P O C H2 O B a se O Base P O O C H2 O OH O O Foscarnet (TRIAPTEN) O O - Phosphorsäure und Ameisensäure O P O - O - 3 Na Foscarnet + Base O O O P O - O C H2 DNAPolymerase Indikation CMV-Infektionen Aciclovir-resistente Herpes-simplex-Inf. Anwendung intravenös Risiken toxisch! Nierenschädigung, Hypokalzämie, Fieber, häufig Kopfschmerzen Hepatitis C Angriffspunkte: Nucleinsäuresynthese Zytokine: Interferone Ribavirin (Rebetol®) Angriffspunkt Nucleinsäuresynthese •Guanosinnucleosid-Analogon •hemmt Synthese von Guanosin-monophosphat (Hemmung der zellulären Kinase) •hemmt mRNA-Verkappung (Anheftung mod. Guanosin) •Oral: gut resorbiert α-Interferone Angriffspunkt Zytokine Zelluläre Virenabwehr •Verbessern Abwehrmechanimus der Wirtszelle •Virale Replikation wird reduziert •UAW: grippeähnliche Symptome Papillomaviren Immune Response Modifier (IRM): Imiquimod (Aldara®) aktiviert das Immunsystem der Haut, damit es selbst gegen die Viren oder den Tumor ankämpft. Imiquimod provoziert eine Entzündungsreaktion, indem es an TLR7 und TLR8, zwei toll-like „receptors“ (TLRs) bindet. (Oberflächenmoleküle von Zellen des Immunsystems, insbesondere von Makrophagen) Papillomaviren Immune Response Modifier (IRM): Imiquimod (Aldara®) UAW: Juckreiz, Brennen, Schmerzen Viraler Replikationszyklus