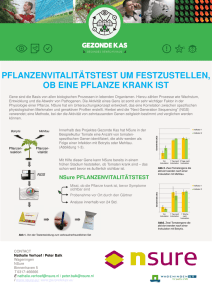
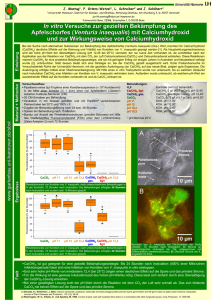
Untersuchungen zur bakteriellen Erkrankung Acidovorax
Werbung

Aus dem Institut für Phytomedizin Universität Hohenheim Fachgebiet Phytomedizin Privatdozent Dr. Jan Hinrichs-Berger In Zusammenarbeit mit dem Dienstleistungszentrum Ländlicher Raum – Rheinpfalz Abteilung Gartenbau Neustadt an der Weinstraße Untersuchungen zur bakteriellen Erkrankung Acidovorax valerianellae an Feldsalat Dissertation zur Erlangung des Grades eines Doktors „Doktor der Agrarwissenschaften“ (Dr.sc.agr./ Ph.D. in Agricultural Sciences) vorgelegt der Fakultät Agrarwissenschaften von Inga Braje aus Wilhelmshaven 2012 2 Die vorliegende Arbeit wurde am 16.03.2012 von der Fakultät Agrarwissenschaften der Universität Hohenheim als „Dissertation zur Erlangung des Grades eines Doktors der Agrarwissenschaften“ angenommen. Tag der mündlichen Prüfung: 16.04.2012 1. Prodekan: Prof. Dr. A. Fangmeier 1. Prüfer: Dr. J. Hinrichs-Berger 2. Prüfer: Prof. Dr. W. Claupein Prüfer: Prof. Dr. M. Kruse 3 Die Arbeit wurde unter dem Titel „Untersuchungen zur Biologie und Entwicklung praxis-relevanter Nachweismethoden für bakterielle Erkrankungen an Feldsalat [Valerianella locusta (L.)] als Grundlage für die Selektion von Resistenzquellen gegen den Erreger von Blattflecken (Acidovorax valerianellae sp. nov.)“ vom Bundesministerium für Wirtschaft und Technologie über die AiF als Forschungsvorhaben AiF-Nr. 15235 BG/2 der Forschungsvereinigung Gemeinschaft zur Förderung der privaten deutschen Pflanzenzüchtung e.V. (GFP) im Programm zur Förderung der „Industriellen Gemeinschaftsforschung (IGF)“ finanziell gefördert. DANKSAGUNG 4 DANKSAGUNG Herrn Prof. Dr. H. Buchenauer, Herrn Prof. Dr. R. Blaich und Herrn Dr. J. HinrichsBerger möchte ich an dieser Stelle für die Überlassung des Themas, für die zahlreichen Diskussionen und die hilfreiche Kritik bei der Abfassung der Arbeit sowie für die Unterstützung als Betreuungsteam im Promotionsstudiengang Agrarwissenschaften herzlich danken. Herrn Dr. J. Hinrichs-Berger, Herrn Prof. Dr. W. Claupein und Herrn Prof. Dr. M. Kruse danke ich neben Herrn Prof. Dr. A. Fangmeier für die Übernahme der Gutachten dieser Dissertation und die Begleitung im Promotionsverfahren. Ganz besonders möchte ich mich beim Dienstleistungszentrum Ländlicher Raum – Rheinpfalz für die Bereitstellung der Arbeitsplätze, die Hilfsbereitschaft bei der Versuchsgestaltung, -durchführung und -auswertung und für das stets freundliche Arbeitsklima bedanken. Insbesondere gilt mein Dank Herrn Dr. N. Laun und allen „Queckis“ des Lehr- und Versuchsbetriebes Gemüsebau Queckbrunnerhof und Herrn Dr. H.-J. Krauthausen und den „Phytos“ der Abteilung Phytomedizin sowie Herrn M. Jutzi. Ein bedeutender Teil der Arbeiten erfolgte in Zusammenarbeit mit dem Julius KühnInstitut in Quedlinburg. Herrn Dr. F. Rabenstein und Frau K. Thiele danke ich für die stete Bereitschaft zur kollegialen und fairen Zusammenarbeit sowie für ein stets offenes Ohr für meine Fragen und die Unterstützung beim Erlernen der TAS-ELISAgestützten Untersuchungsmethode. Danken möchte ich auch Frau A. Schieder, Frau U. Miersch, Frau J. Oosterhof, Herrn G. Hiddink stellvertretend für die Firmen Enza Zaden und Rijk Zwaan für die Bereitstellung von Saatgut und für die vielfältige Unterstützung der Arbeit. Ebenso gilt den Firmen Clause Tézier und Nunhems/Hild mein aufrichtiger Dank. DANKSAGUNG 5 Ein Dankeschön gehört auch Frau Dr. E. Moltmann, Landwirtschaftliches Technologiezentrum Augustenberg, sowie der Deutschen Sammlung für Mikroorganismen und Zellkulturen in Braunschweig für die freundliche Überlassung von A. valerianellae-Isolaten. Schließlich möchte ich mich bei Herrn P. Krämer für die aktive Mitarbeit bedanken, die er im Rahmen seines Berufpraktischen Projektes geleistet hat. Ein herzliches Dankeschön für die Korrekturarbeiten und die vielfach fachliche, moralische und private Unterstützung an Jan, Dr. Crus, Dr. Arnold, Dr. Örschel, Dr. Börger und Dr. E sowie an Gabi, Usanne, Elke, Ewald, Pit, Stephan, inKa, Adelinde, Christof, Lothar, Angela, Tino, Isabelle, Janine, Matthias, Jörg, Suse, NO, Frank, Sabine, Saschi-Spatz, Marco, Patte, Basti und Mama Ki. - Ihr seid die Besten. Die Anfertigung der vorliegenden Arbeit wäre nicht ohne finanzielle Unterstützung der Universität Hohenheim, der Gemeinschaft zur Förderung der privaten deutschen Pflanzenzüchtung e.V. (GFP), der Arbeitsgemeinschaft industrieller Forschungsvereinigungen e.V. (AiF) und den Firmen Enza Zaden und Rijk Zwaan möglich gewesen. Ihnen gilt deshalb mein besonderer Dank! Nicht zuletzt möchte ich mich an dieser Stelle bei meinen Eltern bedanken, die mir die gewünschte Ausbildung ermöglichten und mich während meiner Zeit als Doktorandin unterstützten. INHALTSVERZEICHNIS 6 INHALTSVERZEICHNIS ABKÜRZUNGSVERZEICHNIS .......................................................... I ABBILDUNGSVERZEICHNIS ..........................................................IV TABELLENVERZEICHNIS...............................................................IX 1 Einleitung..................................................................................................... 1 2 Material und Methoden.............................................................................. 7 2.1 Chemikalien ............................................................................................ 7 2.1.1 Nährmedien ..................................................................................... 7 2.1.1.1 Kings medium B (King-Agar B)................................................. 7 2.1.1.2 Tryptic Soy Agar (TSA-Agar) .................................................... 7 2.1.2 Natriumchlorid-Lösung................................................................... 8 2.1.3 Pflanzenschutzmittel ....................................................................... 8 2.2 Versuchssteuerung .................................................................................. 8 2.2.1 Gewächshaus................................................................................... 8 2.2.2 Klimaschränke und Klimakammern ............................................... 9 2.3 Isolierung und Charakterisierung von Acidovorax valerianellaeBakterien .................................................................................................. 9 2.3.1 Fluoreszenz ................................................................................... 10 2.3.2 Gramreaktions-Test (nach SUSLOW et al., 1982) ......................... 10 2.3.3 Mikrobiologie Bactident® Oxidase-Test (nach KOVACS, 1956).. 10 2.3.4 Hypersensitivitätsreaktion (nach GARDAN et al., 2003)............... 11 2.3.5 Indirekter ELISA (TAS Triple antibody sandwich)...................... 12 2.4 Verwendete Acidovorax valerianellae-Stämme ................................... 15 2.5 Verwendetes Valerianella locusta (L.) – Saatgut ................................. 16 2.6 Keimfähigkeit........................................................................................ 19 2.7 Aussaat von Feldsalatpflanzen.............................................................. 19 2.8 Herstellung von A. valerianellae - Inokulum........................................ 20 2.9 Inokulation der Feldsalatpflanzen ......................................................... 21 2.10 Bonitur von Feldsalatpflanzen .......................................................... 23 2.11 Statistische Auswertung der Daten ................................................... 23 2.12 Untersuchungen zu Infektionsbedingungen von Acidovorax valerianellae....................................................................................... 24 2.12.1 Einfluss der Temperatur auf die Infektion in vivo .................... 24 2.12.2 Einfluss des Blattalters und der Blattnässedauer auf die Infektion………………………………… …………………….24 2.12.3 Einfluss der Blattnässedauer auf die Infektion beziehungsweise die Symptomentwicklung .............................. 25 2.12.3.1 Einfluss der Blattnässedauer auf die Symptomentwicklung..... 25 2.12.3.2 Einfluss der Blattnässedauer unmittelbar nach der Inokulation 27 2.12.4 Einfluss der Inokulumdichte auf die Infektion.......................... 28 2.13 Untersuchungen zur Sortenanfälligkeit............................................. 29 2.13.1 Einfluss der Sorte auf die Infektion .......................................... 29 2.13.2 Einfluss der Sorte und des Isolates auf die Infektion................ 29 INHALTSVERZEICHNIS 7 2.13.3 Einfluss der Inokulumdichte und der Sorte auf die Infektion ... 30 2.14 Versuche zum Übertragungsweg von Acidovorax valerianellae...... 31 2.14.1 Boden ........................................................................................ 31 2.14.2 Alternative Wirtspflanzen ......................................................... 33 2.14.2.1 Alternative Wirtspflanzen I....................................................... 34 2.14.2.2 Alternative Wirtspflanzen II ..................................................... 37 2.14.2.3 Alternative Wirtspflanzen III .................................................... 39 2.14.3 Saatgut....................................................................................... 40 2.15 Saatgutuntersuchungen ..................................................................... 47 2.15.1 Nachweismethoden von Acidovorax valerianellae am Saatgut 47 2.15.1.1 Sweatbox-Test in der Klimakammer ........................................ 47 2.15.1.2 Aufwuchstest im Gewächshaus................................................ 48 2.15.1.3 Ankeimmethode auf Papier...................................................... 49 2.15.1.4 Bestimmungen durch Fremdfirmen ......................................... 49 2.15.2 Dekontaminationsmaßnahmen (Warmwasserbehandlung und Dampfdesinfektion).................................................................... 50 3 Ergebnisse.................................................................................................. 52 3.1 Untersuchungen zu Infektionsbedingungen.......................................... 52 3.1.1 Einfluss der Temperatur auf die Infektion (in vivo) ..................... 52 3.1.2 Einfluss des Blattalters und der Blattnässedauer auf die Infektion59 3.1.3 Einfluss der Blattnässedauer auf die Infektion beziehungsweise die Symptomausprägung.............................................................. 63 3.1.3.1 Einfluss der Blattnässedauer auf die Symptomentwicklung..... 63 3.1.3.2 Einfluss der Blattnässedauer unmittelbar nach der Inokulation 67 3.1.4 Einfluss der Inokulumdichte auf die Infektion.............................. 72 3.2 Untersuchungen zur Sortenanfälligkeit................................................. 75 3.2.1 Einfluss der Sorte auf die Infektion .............................................. 75 3.2.2 Einfluss der Sorte und des Isolates auf die Infektion.................... 77 3.2.3 Einfluss der Inokulumdichte und der Sorte auf die Infektion ....... 84 3.3 Infektionsversuche von Acidovorax valerianellae zu Übertragungswegen................................................................................ 87 3.3.1 Boden ............................................................................................ 87 3.3.2 Alternative Wirtspflanzen ............................................................. 92 3.3.2.1 Alternative Wirtspflanzen I....................................................... 92 3.3.2.2 Alternative Wirtspflanzen II ..................................................... 95 3.3.2.3 Alternative Wirtspflanzen III .................................................... 97 3.3.3 Saatgut......................................................................................... 102 3.4 Saatgutuntersuchungen ....................................................................... 105 3.4.1 Nachweismethoden von Acidovorax valerianellae am Saatgut.. 105 3.4.1.1 Sweatbox-Test in der Klimakammer und Aufwuchstest im Gewächshaus............................................................................ 105 3.4.1.2 Ankeimmethode auf Papier..................................................... 109 3.4.1.3 Bestimmungen durch Fremdfirmen ........................................ 112 3.4.2 Dekontaminationsmaßnahmen.................................................... 115 3.4.2.1 Überprüfungen einer Warmwasserbehandlung....................... 115 3.4.2.2 Überprüfungen einer Dampfdesinfektion ............................... 122 3.4.2.3 Überprüfungen einer weiteren Dekontaminationsmaßnahme. 128 INHALTSVERZEICHNIS 8 4 Diskussion ................................................................................................ 131 4.1 Untersuchungen zu Infektionsbedingungen........................................ 131 4.2 Sortenanfälligkeit ................................................................................ 139 4.3 Übertragungswege............................................................................... 140 4.3.1 Boden .......................................................................................... 140 4.3.2 Alternative Wirtspflanzen ........................................................... 142 4.3.3 Saatgut......................................................................................... 145 4.4 Dekontamination von Saatgut ............................................................. 152 5 Zusammenfassung................................................................................... 158 6 Summary.................................................................................................. 160 7 Literaturverzeichnis ............................................................................... 162 8 Anhang ..................................................................................................... 167 8.1 Publikationen ...................................................................................... 167 8.2 Lebenslauf ........................................................................................... 168 8.3 Versicherung ....................................................................................... 169 8.4 Erklärung............................................................................................. 169 ABKÜRZUNGSVERZEICHNIS ABKÜRZUNGSVERZEICHNIS % Prozent ® registered trademark (gesetzlich geschützte Marke) °C Grad Celsius µl Mikroliter Abb. Abbildung ad. auffüllen auf Aqua dest. / dest. aqua destillata (lateinisch), Destilliertes Wasser ca. circa (lateinisch), in etwa cfu colony forming unit (Koloniebildende Einheit) dpi days past inoculation (Tage nach Inokulation) ELISA Enzyme Linked Immunosorbent Assay et al. et alia (lateinisch), und andere g Gramm GmbH Gesellschaft mit beschränkter Haftung GmbH & Co. KG Gesellschaft mit beschränkter Haftung & Compagnie Kommanditgesellschaft H2O Chemische Summenformel für Wasser ha Hektar HCl Chemische Summenformel für Salzsäure IgG Immunglobulin G k.A. keine Angabe KB King-Agar B (Kings medium B) I ABKÜRZUNGSVERZEICHNIS KCl Kaliumchlorid KH2HPO4 * 2 H2O Chemische Summenformel für Kaliumdihydrogenphosphat Dihydrat KOH Chemische Summenformel für Kaliumhydroxid mAK Monoklonaler Antikörper mg Milligramm min. Minute ml Milliliter mm Millimeter n Pflanzenanzahl Na2CO3 Chemische Summenformel für Dinatriumcarbonat NaCl Chemische Summenformel für Natriumchlorid NaHCO3 Chemische Summenformel für Natriumhydrogencarbonat NaOH Chemische Summenformel für Natronlauge nm Nanometer OD-Wert Wert der optischen Dichte am ELISA-Meßgerät PCR Polymerase Chain-Reaction (Polymerase Kettenreaktion) pH-Wert pondus Hydrogenii (lateinisch), Maß für eine saure oder alkalische Reaktion einer wässrigen Lösung pv. Pathovar von patho (griechisch) und varia (griechisch), Krankheitserreger RLF (rel. Luftf.) Relative Luftfeuchte rpm rounds per minute (Umdrehung pro Minute) sp. nov. species nova (latein), neue Art subsp. subspecies (latein), Unterart ssp. weitere Bezeichnung für die Abkürzung subsp. II ABKÜRZUNGSVERZEICHNIS Tab. Tabelle TAS-ELISA triple antibody sandwich ELISA var. varia (latein), Variation well Vertiefung auf der ELISA-Mikrotiter-Platte III ABBILDUNGSVERZEICHNIS IV ABBILDUNGSVERZEICHNIS Abbildung 1.1: Bildung schwarzer Blattflecken nach Inokulation von Feldsalat mit A. valerianellae. ........................................................................................................... 4 Abbildung 1.2: A. valerianellae-Symptome in einem Feldsalatbestand .................... 4 Abbildung 2.1: Mikrobiologie Bactident® Oxidase-Test zum Nachweis Oxidasepositiver A. valerianellae-Bakterien anhand eines Farbumschlages auf dem Teststäbchen............................................................................................................... 11 Abbildung 2.2: Schwache Hypersensitivitätsreaktion an Tabak im Bereich der Infiltrationsstellen (innerhalb der Kreise) am Beispiel des A. valerianellae-Isolates 6.1.a (Infiltration mit einer Konzentration von 108 cfu/ml). ...................................... 12 Abbildung 2.3: Gekeimte und nicht gekeimte Feldsalatsamen auf angefeuchtetem Filterpapier zur Überprüfung der Keimfähigkeit. ...................................................... 19 Abbildung 2.4: Inokulation von Feldsalatpflanzen mit A. valerianellae. (A): Verwendung eines Feinzerstäubers. (B): Sprühfilm zerstäubter A. valerianellaeSuspension auf der Oberseite von Feldsalatblättern. ................................................. 22 Abbildung 2.5: Container mit kontaminiertem und nicht kontaminiertem Boden (durch Einarbeitung von nicht-infiziertem und infiziertem Blattmaterial) für sukzessive Probenentnahme (einmal pro Monat) über einen Zeitraum von bis zu einem Jahr (Standort Schifferstadt, Deutschland)...................................................... 32 Abbildung 2.6: Aussaat von gesundem Saatgut (Sorte Favor) in mit A. valerianellae kontaminierten und nicht-kontaminierten Boden (durch Einarbeitung von nichtinfiziertem und infiziertem Blattmaterial) zur Überprüfung der Überdauerung von A. valerianellae-Bakterien im Boden. Die Abdeckung der Samen erfolgte mit Perlitte. ....................................................................................................................... 33 Abbildung 2.7: Versuchsanordnung der Saatgutproduktion aus gesundem (rechts) und mit A. valerianellae-infiziertem Saatgut (links) mit Aussaat im Jahr 2007 im Folienhaus in Deutschland. Abgrenzung durch einen Folienzaun. Beregnung über Kopf. .......................................................................................................................... 43 Abbildung 2.8: Versuchsanordnung der Saatgutproduktion aus gesundem (links) und mit A. valerianellae-infiziertem Saatgut (rechts) mit Aussaat im Jahr 2007 im Freiland in Frankreich. ............................................................................................... 44 ABBILDUNGSVERZEICHNIS V Abbildung 2.9: Versuchsanordnung der Saatgutproduktion aus gesundem (links) und mit A. valerianellae-infiziertem Saatgut (rechts) mit Aussaat im Jahr 2008 im Folienhaus in Deutschland. Abgrenzung durch einen Folienzaun. Beregnung über Kopf. .......................................................................................................................... 44 Abbildung 2.10: Versuchsanordnung der Saatgutproduktion aus gesundem und mit A. valerianellae-infiziertem Saatgut mit Aussaat im Jahr 2009 im gleichen Schiff eines Gewächshauses, Abgrenzung durch Folienzäune. (A): Wasserversorgung mittels Kreisregner, gesundes Saatgut rechts, kontaminiertes Saatgut links. (B): Wasserversorgung mittels Tropfbewässerung, gesundes Saatgut links, kontaminiertes Saatgut rechts. ............................................................................................................ 45 Abbildung 2.11: Benennung der gewonnenen Saatgutpartien aus der gesunden Feldsalat-Saatgutpartie (AV-60, Ausgangssaatgut) und einer kontaminierten Feldsalat-Saatgutpartie (AV-75, Ausgangssaatgut) mit Aussaaten in verschiedenen Jahren (2007 bis 2009). Die Vermehrung des Ausgangssaatguts fand mit Aussaat im Jahr 2007 in Deutschland und Frankreich statt, mit Aussaat im Jahr 2008 in Deutschland. Mit der Aussaat im Jahr 2009 wurde das Ausgangssaatgut gebeizt verwendet, die Bewässerung erfolgte über das Tröpfchenverfahren und über Kopf mit Kreisregnern......................................................................................................... 46 Abbildung 2.12: Sweatbox zum Nachweismethode von A. valerianellae am Saatgut........................................................................................................................ 48 Abbildung 2.13: Aufwuchstest im Gewächshaus zum Nachweis von A. valerianellae am Saatgut. ...................................................................................... 49 Abbildung 3.1: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 4, 6, 10 und 12 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). .................................................................... 55 Abbildung 3.2: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen nach 10, 14, 19 und 25 Tage Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). .................................................................... 56 Abbildung 3.3: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 4, 8, 10 und 14 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). .................................................................... 57 Abbildung 3.4: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 4, 6, 10, 12 und 17 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). .......................................... 58 ABBILDUNGSVERZEICHNIS VI Abbildung 3.5: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) zwischen 5 und 35 dpi (A) beziehungsweise zwischen 4 und 32 dpi (B) mit A. valerianellae (Isolat 709/2, 106 cfu/ml) im Keimblattstadium (A) beziehungsweise Laubblattstadium (B) in Abhängigkeit der Blattnässedauer (einmalig, wöchentlich, dauerhaft). .................................................................................................................. 60 Abbildung 3.6: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) sowie der Anteil befallener Blattfläche je Pflanze (Befallsstärke in %) zwischen 7 und 34 dpi mit einem A. valerianellae-Gemisch (105 cfu/ml) von Pflanzen im Laubblattstadium bei dauerhafter Kultivierung unter gesättigter Luftfeuchte........... 62 Abbildung 3.7: Auswirkungen auf die Befallsstärke (in %) unterschiedlicher Kultivierungsphasen unter trockenen und feuchten Bedingungen nach Inokulation mit A. valerianellae.................................................................................................... 64 Abbildung 3.8: Befallsstärke (%) zwischen Tag 9 und Tag 27 nach der Inokulation (dpi) mit einem A. valerianellae-Gemisch (Konzentration 108 cfu/ml) unter dauerhafter Kultivierung bei gesättigten Luftfeuchten. Die Pflanzen wurden entweder sofort Wechseltemperaturen (15 °C Nacht, 20 °C Tag) ausgesetzt beziehungsweise für die ersten 96 Stunden nach der Inokulation bei konstant 20 °C kultiviert. .......... 69 Abbildung 3.9: Auswirkungen unterschiedlich langer Kultivierungsphasen bei gesättigter Luftfeuchte nach Sprühinokulation mit A. valerianellae (zwischen null und 72 Stunden plus 5 Stunden Antrocknungsdauer) auf die Befallsentwicklung bei Feldsalat. Versuch A. ................................................................................................. 70 Abbildung 3.10: Auswirkungen unterschiedlich langer Kultivierungsphasen bei gesättigter Luftfeuchte nach Sprühinokulation mit A. valerianellae (zwischen null und 72 Stunden plus 5 Stunden Antrocknungsdauer) auf die Befallsentwicklung bei Feldsalat. Versuch B. ................................................................................................. 71 Abbildung 3.11: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) zwischen Tag fünf und Tag 19 nach der Inokulation (dpi) mit sechs verschiedenen Konzentrationen zwischen 102 cfu/ml und 107 cfu/ml des A. valerianellae-Isolates 6.1.a (A), 16619 (B), 552 (C)..................................................................................... 74 Abbildung 3.12: Befallsstärke (% nekrotische Blattfläche je Pflanze) von unterschiedlichen Feldsalatsorten 18 Tage nach Inokulation eines A. valerianellaeGemisches (Konzentration 106 cfu/ml). Der Versuch wurde bei 13 °C – 24 °C (1. Versuch) und bei 20 °C – 29 °C (2. Versuch) durchgeführt................................. 76 Abbildung 3.13: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) bei unterschiedlichen Feldsalatsorten 18 Tage nach Inokulation eines A. valerianellaeGemisches (Konzentration 106 cfu/ml). Der Versuch wurde bei 13 °C – 24 °C (1. Versuch) und bei 20 °C – 29 °C (2. Versuch) durchgeführt................................. 77 ABBILDUNGSVERZEICHNIS VII Abbildung 3.14: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) von drei Feldsalatsorten (AV-1, AV-5, AV-3) und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (16619, IV2) mit einer Konzentration von 104 cfu/ml bei Kultur unter gesättigter Luftfeuchte. .................................................. 80 Abbildung 3.15: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (6.1.a, 553) mit einer Konzentration von 106 cfu/ml und Kultivierung unter gesättigter Luftfeuchte................................................................. 82 Abbildung 3.16: Anteil an befallener Blattfläche je Pflanze (Befallsstärke in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation von vier A. valerianellae-Isolaten (6.1.a, 553, 16619, IV2) mit einer Konzentration von 105 cfu/ml und Kultivierung unter gesättigter Luftfeuchte. ....................................... 83 Abbildung 3.17: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation von vier A. valerianellae-Isolaten (6.1.a, 553, 16619, IV2) mit einer Konzentration von 105 cfu/ml und Kultivierung unter gesättigter Luftfeuchte. ....................................... 84 Abbildung 3.18: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) von zwei verschiedenen Feldsalatsorten und der Wildart AV-13 neun Tage nach Inokulation eines A. valerianellae-Isolategemisches mit fünf verschiedenen Konzentrationen zwischen 102 cfu/ml und 106 cfu/ml............................................... 85 Abbildung 3.19: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) von zwei verschiedenen Feldsalatsorten (AV-1 und AV-5) und der Wildart AV-13 zwischen Tag sieben und Tag 20 nach Inokulation (dpi) eines A. valerianellaeIsolategemisches mit einer Konzentrationen von 106 cfu/ml..................................... 86 Abbildung 3.20: Verteilung von A. valerianellae-Symptome tragende Pflanzen (mit x gekennzeichnet) aus A. valerianellae-infiziertem Saatgut, 40 Tage nach der Aussaat im Jahr 2007 in Deutschland, in drei jeweils 1 m² großen abgesteckten Parzellen, die aus je neun Aussaatreihen bestanden, in denen zwischen 18 und 26 Pflanzen wuchsen (grau hinterlegte Fläche). ......................................................... 1170 103 Abbildung 3.21: Feldsalatpflanzen aus infiziertem Saatgut 69 Tage (A) und 135 Tage (B) nach der Aussaat im Jahr 2008 in einem Folienhaus......................... 104 Abbildung 3.22: Sichtbare typische A. valerianellae-Symptome 25 Tage nach der Aussaat in Vermiculit (Sweatbox-Test) bei Kultivierung unter gesättigter Luftfeuchte .............................................................................................................. 106 Abbildung 3.23: Keimfähigkeit von warmwasserbehandelten Samen aus dem 119 Jahr 2009. . ............................................................................................................... 120 Abbildung 3.24: OD-Wert im TAS-ELISA (nach 60 Minuten) nach 0, 4, 9 und 14 Tagen Inkubation in der Ankeimmethode auf Papier von warmwasserbehandelten Samen der A. valerianellae-kontaminierten Sorten AV-17 (A) und AV-219 (B). .. 121 ABBILDUNGSVERZEICHNIS VIII Abbildung 3.25: Keimfähigkeit (in % bei 4 °C unter Lichtausschluß) drei verschiedener Feldsalatsorten nach Behandlung mit Dampf bei (A) 66 °C für 90 beziehungsweise 105 Sekunden und bei (B) 64 °C für 120 beziehungsweise 150 Sekunden im Vergleich zur unbehandelten Kontrolle. ............................................ 126 Abbildung 3.26: OD-Wert im TAS-ELISA (nach 60 Minuten) nach Homogenisierung von dampfbehandelten Samen der A. valerianellae-kontaminierten Sorten AV-17 (A) und AV-219 (B) (Ankeimmethode auf Papier).......................... 127 Abbildung 3.27: Keimfähigkeit (in % 4 °C unter Lichtausschluß) drei verschiedener Feldsalatsorten nach Behandlung durch einen Dienstleister im Vergleich zur unbehandelten Kontrolle. ......................................................................................... 129 Abbildung 3.28: OD-Wert im TAS-ELISA (nach 60 Minuten) der mit A. valerianellae-kontaminierten Sorten AV-17 (A) und AV-219 (B) zwischen Tag null und Tag 14 nach Aussaat auf angefeuchtetem Filterpapier und Inkubation bei Raumtemperatur (Ankeimmethode auf Papier). Die Samen waren unbehandelt beziehungsweise durch einen Dienstleister behandelt worden. ............................... 130 TABELLENVERZEICHNIS IX TABELLENVERZEICHNIS Tabelle 2.1: Verwendetes Saatgut für die Versuche zur Sortenanfälligkeit. ............ 18 Tabelle 2.2: Verwendete Pflanzen aus elf Familien zur Überprüfung ihrer Eignung als alternative Wirtspflanzen von A. valerianellae nach Infiltration und Sprühinokulation. ....................................................................................................... 35 Tabelle 2.3: Verwendete Pflanzen aus sieben Familien zur Überprüfung der Eignung als Wirtspflanzen von A. valerianellae nach Sprühinokulation. ................. 38 Tabelle 2.4: Verwendete Pflanzen aus sechs Familien zur Überprüfung ihrer Eignung als alternative Wirtspflanzen von A. valerianellae nach Stichinokulation.. 40 Tabelle 2.5: Verwendete Temperaturen (°C) und Inkubationszeiten (Minuten) bei einer Warmwasserbehandlung von Feldsalatsaatgut. ................................................ 51 Tabelle 3.1: Befallsstärke (% nekrotische Blattfläche) 9, 16, 23, 30 und 37 Tage nach Inokulation (dpi) mit einem A. valerianellae-Gemisch (Konzentration 108 cfu/ml). Bis 9 dpi erfolgte die Kultur bei gesättigter Luftfeuchte, anschließend ohne erhöhte Luftfeuchtigkeit.. .................................................................................. 66 Tabelle 3.2: Befallsstärke (% nekrotische Blattfläche) 38, 43 und 51 Tage nach Inokulation (dpi) mit einem A. valerianellae-Gemisch (Konzentration 108 cfu/ml). Einer zu Beginn neuntägigen Kultivierung unter gesättigter Luftfeuchte folgten Phasen unterschiedlicher Dauer unter normal vorherrschenden Luftfeuchten (zwischen 7 und 28 Tagen), bevor sich eine erneute Kultur unter gesättigter Luftfeuchte anschloss................................................................................................. 67 Tabelle 3.3: Auftreten erster Symptome (in Tagen) nach Inokulation einzelner A. valerianellae-Isolate in Abhängigkeit von der Konzentration. ............................. 73 Tabelle 3.4: Anteil an befallener Blattfläche je Pflanze (Befallsstärke in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (16619, IV2) mit einer Konzentration von 104 cfu/ml bei Kultur unter gesättigter Luftfeuchte........................................................................... 79 Tabelle 3.5: Anteil an befallener Blattfläche je Pflanze (Befallsstärke (BS) in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (6.1.a, 553) mit einer Konzentration von 106 cfu/ml und Kultivierung unter gesättigter Luftfeuchte................................................................. 81 Tabelle 3.6: Anteil symptomtragender Pflanzen (%) und TAS-ELISA-Nachweis von A. valerianellae in Symptom tragenden Pflanzen. Die Pflanzen wurden zu verschiedenen Zeiten (über ein Jahr) in zuvor durch Einarbeitung von befallenem A. valerianellae-Pflanzenmaterial kontaminierten Boden gesät (Standort Schifferstadt). ............................................................................................................. 89 TABELLENVERZEICHNIS X Tabelle 3.7: Anteil symptomtragender Pflanzen (%) und TAS-ELISA-Nachweis von A. valerianellae in Symptom tragenden Pflanzen. Die Pflanzen wurden zu verschiedenen Zeiten (über acht Monate) in zuvor durch Einarbeitung von befallenem A. valerianellae-Pflanzenmaterial kontaminierten Boden gesät (Standort Quedlinburg). ............................................................................................................. 90 Tabelle 3.8: Temperaturwerte (in 2 Meter Höhe) und Niederschlagswerte im Monatsmittel im Zeitraum von September 2009 bis September 2010 in Schifferstadt und von März 2010 bis November 2010 in Quedlinburg. ......................................... 91 Tabelle 3.9: Krankheitssymptome nach Infiltration und Sprühinokulation mit A. valerianellae (Konzentration 108 cfu/ml) 7, 13 und 20 dpi bei verschiedenen Pflanzenarten.............................................................................................................. 93 Tabelle 3.10: Krankheitssymptome nach Sprühinokulation mit A. valerianellae (Konzentration 108 cfu/ml) 10, 25 und 30 dpi bei verschiedenen Pflanzenarten....... 96 Tabelle 3.11: Veränderungen in der Blattstruktur um die Einstichstelle bei verschiedenen Pflanzenarten nach Stichinokulation mit A. valerianellae (Konzentration 108 cfu/ml) an unterschiedlichen Tagen nach der Inokulation (dpi). .................................................................................................................................. 100 Tabelle 3.12: Nachweis von lebensfähigen A. valerianellae-Bakterien in injizierten und nicht-injizierten Blatthälften verschiedener Pflanzenarten 12, 19, 26 und 33 dpi. .................................................................................................................................. 101 Tabelle 3.13: Nachweis von A. valerianellae in zwölf Saatgutpartien im SweatboxTest und im Aufwuchstest. Der Nachweis erfolgte durch klassisches Isolieren und mittels TAS-ELISA in Pflanzen mit verdächtigen A. valerianellae-Symptomen.. . 107 Tabelle 3.14: OD-Wert von Proben verschiedener Saatgutpartien im TAS-ELISA bei der Ankeimmethode auf Papier.......................................................................... 110 Tabelle 3.15: Nachweis von A. valerianellae in zwölf Saatgutpartien im SweatboxTest in Kombination mit einer PCR bei den Firmen Enza Zaden und Rijk Zwaan... .................................................................................................................................. 113 Tabelle 3.16: Keimfähigkeit (in % bei 20 °C und 12 Stunden Licht pro Tag) drei verschiedener Feldsalatsorten nach Behandlung mit Dampf bei 66 °C für 90 beziehungsweise 105 Sekunden und bei 64 °C für 120 beziehungsweise 150 Sekunden im Vergleich zur nicht-behandelten Kontrolle........................................ 125 EINLEITUNG 1 1 EINLEITUNG Die Ursprünge des heutigen Feldsalates [Valerianella locusta (L.)] - Gemeiner Feldsalat - gehen auf eine in Mitteleuropa wildwachsende Form zurück. Mit dem aufkommenden Ackerbau siedelte sich der Feldsalat als Unkraut in Wintergetreide und in Weinbergen an und wurde als Wildpflanze geerntet. Er wurde erstmals im Mittelalter in Kultur genommen und eine erste Eignung als Blattgemüse wird beschrieben. Seit Anfang des 19. Jahrhunderts mit der Einführung der mineralischen Düngung wird Feldsalat erwerbsmäßig angebaut (MEYER-REBENTISCH, 2011). Seit Ende der 1990er Jahre hat Feldsalat einen starken Anbauzuwachs erfahren, wobei vor allem vorverpackter und gewaschener Feldsalat hoch im Kurs liegt, da er den Konsumentenwunsch nach einfacher Zubereitung und langer Haltbarkeit, verbunden mit gutem Geschmack und hohem Gesundheitswert erfüllt (persönliche Mitteilung N. Laun, Dienstleistungszentrum Ländlicher Raum - Rheinpfalz). Wilden Feldsalat findet man heutzutage kaum noch. Der Beginn des kommerziellen Feldsalatanbaus lag in Frankreich, wo auch heute noch die Hauptanbaugebiete liegen. Von Frankreich aus kam der Feldsalat über die Schweiz nach Deutschland. Der Anbau konzentriert sich in Deutschland im Wesentlichen auf zwei Bundesländer: Rheinland-Pfalz und hier schwerpunktmäßig die Pfalz, die als größtes zusammenhängendes Anbaugebiet Deutschlands gilt, sowie Baden-Württemberg mit Schwerpunkten im Stuttgarter Raum und in Südbaden. Aus der Literatur sind unterschiedliche Angaben zu den Anbauflächen und dem Produktionswert, auf denen Feldsalat kultiviert wird, zu entnehmen. So beschreiben SCHLAGHECKEN (2010) und BEHR (2009), dass in der franzözischen Region um Nantes (Loire Atlantique und Vendée) auf einer Fläche von 6000 ha rund 75 % der Weltproduktion und 85 % der französischen Erzeugung an Feldsalat angebaut werden. Nach RAMPOLD (2004) betrug die Anbaufläche in Deutschland im Jahr 2003 rund 1590 ha und 270 ha in Unterglasanlagen (davon 705 ha in Rheinland-Pfalz und 660 ha in Baden-Württemberg). Der Produktionswert der europäischen Feldsalaterzeugung betrug ca. 118 Millionen Euro auf einer 6750 ha großen Anbaufläche (Stand: Oktober 2004). Im Jahr 2008 lag der deutsche Produktionswert EINLEITUNG 2 bei knapp 24.000 Tonnen, wovon circa 10 % aus Unterglasanbau stammen. Die französische Produktion lag bei 32.300 Tonnen (BEHR, 2009). Feldsalat gehört zu der Familie der Valerianaceae und ist eine winterannuelle Pflanze, die Temperaturen von bis zu -15 °C bis -20 °C aushält. Er ist eine klassische Winterkultur und wird vorwiegend im Herbst ausgesät beziehungsweise gepflanzt. Gut 85 % des Feldsalatkonsums im Jahr konzentrieren sich in Deutschland und Frankreich auf die Monate Oktober bis April (BEHR, 2009). Ein ganzjähriger Anbau ist jedoch möglich, unter anderem durch die Verwendung von Schattierungsnetzen (in den Sommermonaten), die ein Schießen der Pflanzen verhindern. In der französischen Region um Nantes begann die Sommerproduktion im Jahr 1985 (PÉRON und REES, 1998). Je nach Jahreszeit steht für den Anbau die Direktsaat mittels Saatgut oder das Pflanzen von Jungpflanzen im Vordergrund. Feldsalat-Direktsaat erfolgt ab Mitte August bis Anfang Oktober, während von März bis Juli in der Regel gepflanzt wird. Die Anzuchtdauer für die Jungpflanzen beträgt zwischen vier und sechs Wochen. Der Vorzug einer Pflanzung ist, dass Jungpflanzen in Einzeltöpfen bereits größer und weniger anfällig sind und so eine sicherere Produktion ermöglichen, des Weiteren kann die Ernte besser terminiert werden. Zudem wird ein deutlicher Unterschied zwischen den verwendeten Sorten für die Direktsaat und für die Pflanzung gemacht. Das wichtigste Kriterium ist für den Sommeranbau die Produktion „kurzstieliger“ Sorten, die zudem langsam wachsen sollten. In der Produktionstechnik von Feldsalat wurden in den letzten Jahren offene Fragen bezüglich der Unkrautkontrolle und der Pflanzenernährung geklärt. Ungelöst ist bisher dagegen die Frage, wie Schäden durch Acidovorax valerianellae sp. nov., den Erreger bakterieller Blattflecken bei Feldsalat, vermieden werden können. Das Bakterium Acidovorax valerianellae an Feldsalat wurde in Frankreich (Feldsalatanbaugebiet um Nantes) zum ersten Mal 1990 diagnostiziert und zunächst als nicht-fluoreszierende Pseudomonas-Art beschrieben (RAT und GARDAN, 1993). WILLEMS et al. (1992) transferierten einige Pseudomonas-Arten in die Gattung Acidovorax. Die neue Artbezeichnung Acidovorax valerianellae sp. nov. erfolgte EINLEITUNG 3 durch GARDAN et al. (2003). 1998 wurde A. valerianellae in Belgien identifiziert (GRONDEAU et al., 2001), ein Nachweis für Deutschland erfolgte erstmals 1999 an Feldsalatproben aus der Pfalz (BARCHEND, 2003, MOLTMANN et al., 2000). A. valerianellae gehört zu der Gruppe der Gram- und Arginin-negativen, Oxidase-, Catalase- und Urease-positiven, aeroben Pseudomonaden. Die Bakterien besitzen eine Geißel, fluoreszieren nicht und bilden kein Levan auf saccharosehaltigen Nährmedien. Die Bakterien wachsen auf Nährböden langsam und erreichen nach vier Tagen einen Durchmesser von zwei Millimeter. Unter 4 °C und über 41 °C findet kein Wachstum der Zellen statt. Das Wachstumsoptimum liegt bei einer Temperatur von 28 °C. Aufgrund ihres langsamen Wachstums in vitro werden sie leicht von saprophytischen Bakterien überwachsen (BRAJE, 2005, JASU, 2004). Die Symptome einer A. valerianellae-Infektion von Feldsalat äußern sich zunächst als sehr kleine Punkte von dunkelgrüner Färbung, die im Gegenlicht wässrig bis ölig durchscheinen (Abb. 1.1). Bei Fortschreiten des Befalls werden die Flecken größer und können einen Durchmesser von bis zu 4 mm erreichen, sie färben sich dabei schwarz und sind etwa drei bis vier Tage nach der Infektion gut sichtbar. Zunächst weisen die Flecken keinen Hof auf. Im Verlauf der Krankheit kann sich aber ein chlorotischer Hof um die dunklen Flecken bilden. Die über die Blattspreite verteilten oder am Blattrand lokalisierten Flecken sind unregelmäßig geformt bis rund und scharf zum gesunden Gewebe abgegrenzt. Es können Blätter jeglichen Alters infiziert werden, das heißt sowohl die Keimblätter als auch Blätter erntereifer Pflanzen. Werden die Blätter sehr früh in der Blattentfaltung infiziert, so verkrümmen sie sich oft bei fortschreitendem Wachstum (BRAJE, 2005, MOLTMANN, 1999). Eine Infektion mit A. valerianellae führt nicht zum Absterben der Feldsalatpflanzen, tritt aber insbesondere bei feuchter Witterung vor allem an den unteren Blättern auf und führt zu massiven qualitativen Schäden (Abb. 1.2). Der Umbruch ganzer Feldsalatanbauflächen kann die Folge sein (GRONDEAU et al., 2007). Auch schwach befallene Ware ist für eine Vermarktung ungeeignet, da der Befall sich in den oft folienumhüllten Verkaufsgebinden weiterentwickelt und im fortgeschrittenen Stadium in Fäulnis übergehen kann. EINLEITUNG 4 Abbildung 1.1: Bildung schwarzer Blattflecken nach Inokulation von Feldsalat mit A. valerianellae. Abbildung 1.2: A. valerianellae-Symptome in einem Feldsalatbestand Als Infektionsquellen werden der Boden und das Saatgut diskutiert. So überdauert A. valerianellae, laut HINRICHS-BERGER et al. (2005), eine gewisse Zeit im Boden. Untersuchungen, bei denen Feldsalat in kontaminiertem Boden ausgesät wurde, führen mit jeder Kultur zu einem Anstieg an Symptom tragenden Pflanzen. Die Ausbreitung erfolgt dabei zunächst in der Reihe, sobald sich die Blätter benachbarter EINLEITUNG Pflanzen 5 berühren. Eine Ausbreitung über Saatreihen hinweg ist nach Bestandesschluss festzustellen. Blattkontakt und Wasserspritzer sind vermutlich für diese Übertragung verantwortlich. GRONDEAU et al. (2007) berichten, dass A. valerianellae-Bakterien bis zu 39 Tage nach der Ernte von infizierten Pflanzen an deren Pflanzenresten im Boden nachweisbar sind und der Boden somit eine Inokulumquelle für weitere Aussaaten darstellt. Feldsalatsaatgut ist zunächst, laut RAT und GARDAN (1993), keine Inokulumquelle von A. valerianellae. Die Isolierung des Bakteriums aus kommerziellem Saatgut gelingt nicht, während der Nachweis nach künstlicher Saatgutinfektion funktioniert (BARCHEND, 2003 und 2004). Im Jahr 2006 wird, nach Untersuchungen von sechs Saatgutpartien, eine Saatgutbelastung mit A. valerianellae nachgewiesen (GRONDEAU und SAMSON, 2009) und die Saatgutübertragung erscheint möglich. Verstärkt tritt die Krankheit in den französischen beziehungsweise süddeutschen Anbaugebieten auf (MOLTMANN et al., 2000, PERON und REES, 1998), wo die Hauptanbaugebiete von Feldsalat liegen. Die Krankheit stellt zurzeit die wichtigste und gefährlichste Erkrankung an Feldsalat in Frankreich dar (GRONDEAU et al., 2007) und Bekämpfungsmöglichkeiten sind rar. Die französischen Feldsalatanbauer verhindern derzeit eine Bodenübertragung durch eine Desinfektion des Bodens mit Metam-Natrium. Diese Entseuchungsmaßnahme erfordert einen hohen Aufwand in Form von Spezialgeräten und garantiert lediglich eine Befallsminderung aber keine Befallsfreiheit (persönliche Mitteilung, T. Weinheimer, BOLAP GmbH). Gegen diese Krankheit sind in Deutschland bisher keine chemischen Pflanzenschutzmittel zugelassen, noch kann damit gerechnet werden, dass Antibiotika zur Bekämpfung zugelassen werden. Erste Hinweise auf eine mögliche Saatgutübertragung liegen vor (HINRICHS-BERGER et al., 2005, GRIMAULT et al., 2006, GRONDEAU und SAMSON, 2009) und eine weitere Ausdehnung der Befallsfläche auf diesem Weg wird befürchtet. Dieser Ausbreitungsweg bedroht eine wirtschaftliche Saatgutproduktion und die Feldsalatzüchtung. Eine sinnvolle Bekämpfungsstrategie von A. valerianellae beruht auf Kenntnis der Epidemiologie des Bakteriums (HINRICHS-BERGER et al., 2005). Als Regulierungsmöglichkeiten bieten sich vor allem pflanzenbauliche Maßnahmen an. EINLEITUNG 6 So sollte nach FRANKENBERG (2005) zunächst gesundes Saatgut verwendet werden. Auf einen Anbau in der wärmeren Jahreszeit sollte bei Bakterienbefall weitestgehend verzichtet werden, ebenso wie auf Beregnungen in den Abendstunden. Treten infizierte Feldsalatpflanzen auf, sollte eine Anbaupause von zwei Jahren für Feldsalat angestrebt werden. Nach GRONDEAU et al. (2003, 2006) überdauert das Bakterium nämlich im Boden und kann erneute Aussaaten schädigen. . TOMIHAMA et al. (2006) beschreiben braune Flecken an Teeblättern in Japan, die von A. valerianellae verursacht werden. Ebenfalls durch A. valerianellae verursachte Blattflecken kommen an der Gartenhortensie (Hydrangea macrophylla) vor (IKEDA et al., 2009). Neben A. valerianellae an Feldsalat, Teeblättern und Gartenhortsensie gibt es noch weitere phytopathogene Acidovorax-Arten, die an verschiedenen Wirtspflanzen vorkommen. Nach WILLEMS et al. (1992) kommen Acidovorax avenae subsp. cattleyae-Bakterien an Orchideen vor, wo sie braune Flecken hervorrufen, während Acidovorax konjaci-Bakterien an der Konjakknolle vorkommen. Acidovorax avenae subsp. avenae und Acidovorax avenae subsp. citrulli verursachen an Cucurbitaceae bakteriellen Flecken an Blättern und Früchten. Das Ziel der vorliegenden Arbeit bestand in der Aufklärung biologischer und epidemiologischer Grundlagen von A. valerianellae an Feldsalat. Vor allem die Erregeransprüche an Temperatur, Blattalter, Inokulumdichte, Feldsalatsorte und Blattnässedauer sollten geklärt werden, um dabei kritische Infektionsbedingungen charakterisieren zu können und darauf aufbauend geeignete Maßnahmen zur Vermeidung von Schäden zu entwickeln. Die einzelnen Übertragungswege waren zu bewerten, insbesondere die Bedeutung und das Ausmaß der Saatgutübertragung in Abgrenzung zu befallenen Boden oder alternativen Wirtspflanzen. Verschiedene Saatgutbehandlungen wurden in ihrer Dekontaminationswirkung geprüft. Die gewonnenen Erkenntnisse dienen der Erarbeitung praxisorientierter Lösungsansätze zur Vermeidung und Bekämpfung der Blattfleckenkrankheit an Feldsalat. MATERIAL UND METHODEN 2 MATERIAL UND METHODEN 2.1 Chemikalien 2.1.1 Nährmedien 2.1.1.1 Kings medium B (King-Agar B) 7 Zum Herstellen von King-Agar B (KB)-Platten wurden 16,5 g Fertig-Agar der Firma Sigma-Aldrich Chemie GmbH laut Anweisung mit 500 ml destilliertem Wasser gemischt und zunächst in der Mikrowelle vorgewärmt. Nachdem das Pulver vollständig gelöst war, wurden 6,5 g Glycerin der Firma neoLab Migge LaborbedarfVertriebs GmbH zugesetzt. Das Medium wurde anschließend bei 121 °C für 20 Minuten autoklaviert. Sobald es auf ca. 60 °C abgekühlt war, wurde es unter sterilen Bedingungen in Petrischalen gegossen (etwa 10 ml je Schale). Bei KB-Agar-Schalen mit fungiziden Antibiotikum, wurde dem 60 °C warmen Medium (500 ml) 1 ml Cycloheximid (1 g Cycloheximid gelöst in 10 ml 75 %-igem Methanol, steril filtriert) zugesetzt und unter sterilen Bedingungen in Petrischalen gegossen (etwa 10 ml je Schale). Die fertigen Schalen wurden bei 4 °C bis zur Verwendung gelagert. 2.1.1.2 Tryptic Soy Agar (TSA-Agar) Zum Herstellen von TSA-Agar-Platten wurden 20 g Fertig-Agar der Firma BD Diagnostic Systems laut Anweisung mit 500 ml destilliertem Wasser gemischt und zunächst in der Mikrowelle vorgewärmt. Das Medium wurde anschließend bei 121 °C für 20 Minuten autoklaviert. Sobald es auf ca. 60 °C abgekühlt war, wurde es unter sterilen Bedingungen in Petrischalen gegossen (etwa 10 ml je Schale). MATERIAL UND METHODEN 2.1.2 8 Natriumchlorid-Lösung Zur Herstellung der A. valerianellae-Suspension wurde in allen Versuchen eine 0,85 %-ige Natriumchlorid (NaCl)-Lösung verwendet. 2.1.3 Pflanzenschutzmittel Auftretender Mehltau der Gattung Erysiphe wurde mit den Mitteln „Euparen M WG“ (Wirkstoff Tolylfluanid) der Firma Bayer oder „Bayfidan“ (Wirkstoff Triadimenol) der Firma Bayer behandelt. Als Breitbandfungizide gegen Botrytis cinerea und Rhizoctonia solani wurden die Mittel „Signum WG“ (Wirkstoffe F 500 (Pyraclostrobin) und Boscalid) und „Rovral WP“ (Wirkstoff Iprodion) der Firma BASF im Wechsel verwendet. Auftretender Befall mit freifressenden Schmetterlingsraupen wurde mit dem Mittel „Steward WG“ (Wirkstoff Indoxacarb) der Firma DuPont behandelt. Der Einsatz der Pflanzenschutzmittel erfolgte jeweils nach den Anwendungshinweisen des Herstellers. 2.2 Versuchssteuerung 2.2.1 Gewächshaus Die Feldsalatpflanzen wurden für die Dauer der Anzucht, das heißt nach dem Ankeimen bis zur Verwendung für Versuche, im Gewächshaus kultiviert. Eine Bewässerung wurde manuell bei Bedarf durchgeführt, ebenso wie die Verwendung eines Energieschirmes und die Ausbringung von Pflanzenschutzmitteln. In den Wintermonaten wurde zusätzlich ein Kunstlicht eingesetzt. Versuche zu Untersuchungen der Sortenanfälligkeit (Kapitel 2.13) wurden im Gewächshaus durchgeführt. MATERIAL UND METHODEN 2.2.2 9 Klimaschränke und Klimakammern Soweit nicht anders erwähnt, wurden alle Versuche in Klimaschränken beziehungsweise Klimakammern durchgeführt, wobei die Temperatur- sowie Lichteinstellung je nach Versuch variierten. Die Bewässerung erfolgte manuell bei Bedarf. Verwendet wurden dabei eine geräumige, begehbare Klimakammer des Typs VEKZ 05/440 der Firma Vötsch Industrietechnik GmbH, Balingen, Deutschland, ein Pflanzenwachstumsschrank des Typs KBWF 720 der Firma Binder GmbH, Tuttlingen, Deutschland und Klimaschränke der Firma Rubarth Apparate GmbH, Laatzen, Deutschland. Des Weiteren wurde ein Kühlbrutschrank der Marke Friocell von der Firma IUL Instruments GmbH, Königswinter, Deutschland verwendet. 2.3 Isolierung und Charakterisierung von Acidovorax valerianellae-Bakterien Bei Auftreten von Blattsymptomen, die durch das Bakterium A. valerianellae verursacht sein könnten, wurde versucht, die Bakterien aus diesen Blattbereichen zu isolieren. Dafür wurden die Symptom tragenden Blätter zunächst mit 70 %-igem Alkohol und danach mit destilliertem Wasser abgespült und so von anhaftenden Schmutzpartikeln und möglicherweise vorkommenden Epiphyten befreit und oberflächendesinfiziert. Die Blätter wurden anschließend mit Zellstoff getrocknet und dann in einem Mörser mit 1 ml 0,85 %-iger NaCl-Lösung homogenisiert. Das Homogenat wurde 1:100 und 1:1000 verdünnt. Jeweils 20 µl des unverdünnten Homogenats sowie der beiden Verdünnungen wurden auf eine KB-Agar-Schale mit Cycloheximid in dreifacher Wiederholung aufgetragen und mittels Drigalskispatel gleichmäßig verteilt. Nach ein- bis dreitägigem Wachstum bei 20 °C wurden Verdünnungsausstriche mit Hilfe einer sterilen Impföse angefertigt, um reine Bakterienkulturen auf KB-Agar-Schalen zu erzeugen. Dieser Schritt wurde bei Bedarf mehrmals wiederholt. Anschließend wurden die Bakterienkolonien näher charakterisiert Oxidase-Test, (Fluoreszenz, Gramreaktions-Test, Hypersensitivitätsreaktion, Mikrobiologie indirekter Bactident® ELISA). A. valerianellae besitzt einen typischen Geruch, der darüber hinaus die Identifizierung unterstützte. MATERIAL UND METHODEN 2.3.1 10 Fluoreszenz Zur Prüfung der Fluoreszenz wurden die auf KB-Agar-Platten wachsenden Kolonien unter eine Schwarzlichtlampe gehalten. Handelt es sich bei den zu testenden Kolonien um A. valerianellae-Bakterien, so fluoreszieren sie nicht. Sie sind daher deutlich von den fluoreszierenden Pseudomonaden zu unterscheiden. 2.3.2 Gramreaktions-Test (nach SUSLOW et al., 1982) Zum Test der Gramreaktion wurden zu testende Einzelkolonien beziehungsweise Reinkulturen auf einer Impföse in einen Tropfen 1 %-iger Kaliumhydroxid (KOH)Lösung auf einem Objektträger verrieben. Handelt es sich um A. valerianellaeBakterien, so bildet sich aufgrund der Zellwandzusammensetzung des Gramnegativen Bakteriums ein Faden, wenn man die Impföse langsam aus dem Tropfen hebt. 2.3.3 Mikrobiologie Bactident® Oxidase-Test (nach KOVACS, 1956) Zum Test der Oxidase-Tätigkeit, wobei es sich um einen Nachweis der Cytochromoxidase in Mikroorganismen handelt, werden Einzelkolonien beziehungsweise Reinkulturen auf einer Impföse auf die Reaktionszone eines Teststäbchens aufgetragen und verrieben. Die Teststäbchen stammen von der Firma Merck KGaA aus Darmstadt. Nach 20 bis 60 Sekunden wird die Reaktion mit einer Farbskala verglichen (Abb. 2.1). In Anwesenheit molekularen Sauerstoffs kann das Cytochromoxidase/Cytochrom c-System eine ganze Reihe von organischen Substanzen reduzieren, unter anderem das sogenannte NaDi-Reagenz (1-Naphthol + Dimethyl-paraphenylendiamin) unter Bildung des Kondensationsmoleküls Indophenolblau. Diese Reaktion wird zur Klassifizierung und Identifizierung von Bakterien verwendet. Handelt es sich bei der zu testenden Kultur um A. valerianellae-Bakterien, so färbt sich die Reaktionszone blau bis blauviolett und die Kultur gilt als Oxidase-positiv. MATERIAL UND METHODEN 11 Abbildung 2.1: Mikrobiologie Bactident® Oxidase-Test zum Nachweis Oxidase-positiver A. valerianellae-Bakterien anhand eines Farbumschlages auf dem Teststäbchen. 2.3.4 Hypersensitivitätsreaktion (nach GARDAN et al., 2003) Bei Prüfung der Hypersensitivitätsreaktion wird die zu testende Bakteriensuspension mit einer Konzentration von 108 cfu/ml (Herstellung in Kapitel 2.8 beschrieben) in Tabakblätter (Nicotiana tabacum) der Sorte Samsun infiltriert. Handelt es sich bei der zu testenden Bakterienlösung um eine Suspension von A. valerianellae, so ist nach zwei bis drei Hypersensitivitätsreaktion (Abb. 2.2). Tagen im eine Bereich der sehr schwache bis schwache Infiltrationsstelle zu beobachten MATERIAL UND METHODEN 12 Abbildung 2.2: Schwache Hypersensitivitätsreaktion an Tabak im Bereich der Infiltrationsstellen (innerhalb der Kreise) am Beispiel des A. valerianellae-Isolates 6.1.a (Infiltration mit einer Konzentration von 108 cfu/ml). 2.3.5 Indirekter ELISA (TAS Triple antibody sandwich) Der TAS-ELISA wurde 2009 von Frau K. Thiele, Institut für Epidemiologie und Pathogendiagnostik des Julius Kühn-Instituts, Quedlinburg, entwickelt und freundlicherweise für diese Arbeit zur Verfügung gestellt. Hierzu gehörte das polyklonale Immuglobulin G (IgG) 44 und der monoklonale Antikörper 7C10ESB10 aus dem Hybridomüberstand. Das Serum (IgG 44) und der monoklonale Antikörper wurden gegen das A. valerianellae-Isolat 16619 der Deutschen Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig entwickelt. Die zu beschichtenden Maxisorpplatten mit 96 Vertiefungen (442404, F96 Maxisorp, Nunc-Immuno-Plate, Lot. 111276) stammen von der Firma Thermo Fisher Scientific, Dänemark. Das verwendete Ziege-Anti-Maus-Anti-Körper (ZAMAK) - Konjugat wurde unter dem Namen Alkaline Phosphatase-conjugated AffiniPure Goat AntiMouse IgG + IgM (H+L) (Code: 115-055-044, Lot: 81251) von der Firma Jackson ImmunoResearch Europe Ltd, Suffolk CB8 1JX bezogen. Als Substrat diente 4-Nitrophenyl phosphate-disodium salt (p-NPP) C 180506) der Firma LOEWE Biochemica GmbH, Deutschland. (No. 00130/025, MATERIAL UND METHODEN 13 Die für den TAS-ELISA verwendeten Puffer wurden wie folgt selbst hergestellt: Coatingpuffer: 1,59 g Na2CO3 2,93 g NaHCO3 ad. 1000 ml H2O dest. pH-Wert 9,6 wurde eingestellt mit NaOH/HCl Waschpuffer (PBS): 8 g NaCl 0,2 g KH2PO4 1,46 g Na2HPO4 * 2 H2O 0,2 g KCl 0,5 ml Tween 20 ad. 1000 ml H2O dest. pH-Wert 7,4 wurde eingestellt mit NaOH/HCl Extraktionspuffer: 20 g Polyvinylpyrrolidinone 25 2 g Trockenmilch ad. 1000 ml Waschpuffer Der für den letzten Schritt verwendete Substratpuffer (Substrate Buffer 5 *, No. 07602/025) stammte von der Firma LOEWE Biochemica GmbH, Deutschland und wurde vor Verwendung 5-fach mit Aqua dest. verdünnt. Der TAS-ELISA wurde folgendermaßen durchgeführt: 1. Coating: Polyklonales Immunglobulin G (IgG) 44 wurde 1:100 in Coatingpuffer verdünnt und 100 µl wurden in je eine Vertiefung aufgetragen. Die folgende Inkubation wurde für zwei Stunden bei 37 °C durchgeführt. Vor dem nächsten Schritt wurden die Platten dreimal mit Waschpuffer (PBS) gewaschen. MATERIAL UND METHODEN 2. 14 Blockierung: 200 µl Waschpuffer (PBS) mit 1 % Trockenmilch (TM) wurden in jede Vertiefung pipettiert. Die Platten wurden anschließend für eine Stunde bei 37 °C inkubiert. Für den folgenden Schritt wurden die Platten nicht gewaschen, sondern nur Blockierungspuffer entfernt. 3. Pflanzensaft beziehungsweise Probe: Die zu untersuchenden Pflanzenblätter oder gewachsenen Bakterienkolonien wurden 1:10 oder 1:20 (je nach Materialmenge) in Extraktionspuffer homogenisiert und entweder direkt verwendet oder eingefroren. 100 µl der Probe (frisch oder aufgetaut) wurde in je eine Vertiefung gefüllt, wobei jede Probe als Doppelbestimmung aufgetragen worden ist. Die Inkubation erfolgte bei 4 °C über Nacht. Am darauf folgenden Tag wurden die Platten viermal mit Waschpuffer (PBS) gewaschen. 4. monoklonaler Antikörper: 100 µl des 1:2000 in Waschpuffer mit 1 % Trockenmilch verdünnten monoklonalen Antikörpers 7C10ESB10 wurde in jede Vertiefung pipettiert. Die Platten wurden anschließend bei 37 °C inkubiert. Nach zwei Stunden wurden die Platten viermal mit Waschpuffer (PBS) gewaschen. 5. Konjugat (Ziege Anti Maus-Anti-Körper (ZAMAK): Für diesen Schritt wurde das verwendete Konjugat im Verhältnis von 1:2000 in Waschpuffer mit 1 % Trockenmilch verdünnt. Die Inkubation von 100 µl pro Vertiefung wurde für eine Stunde bei 37 °C durchgeführt. Danach wurden die Platten viermal mit Waschpuffer gewaschen. 6. Substrat: 200 µl 1 mg p-Nitrophenyldihydrogenphosphat je 1 ml Substratpuffer wurde pro Vertiefung aufgetragen. Die Inkubation erfolgte für eine Stunde bei Raumtemperatur unter Lichtausschluss. Am ELISA-Reader wurden Messungen bei 405 nm und 490 nm Wellenlänge durchgeführt. Nicht-inokulierte, symptomlose Blätter wurden als Negativkontrolle und inokulierte, Symptom tragende Blätter als Positivkontrolle 1:50 in Extraktionspuffer verdünnt und in die erste Spalte (gesund) und in die letzte verwendete Spalte (infiziert) auf der Platte aufgetragen, um ein Verschleppen während des Auftragens beziehungsweise MATERIAL UND METHODEN 15 Waschens zu verhindern. Jeweils die Hälfte der aufgetragenen Kontroll-Spalten (Vierfachbestimmung) wurde mit monoklonalem Antikörper befüllt (Negativbeziehungsweise Positivkontrolle), die andere Hälfte nur mit Waschpuffer plus 1 % Trockenmilch (sogenannte Blindwerte, Schritt 4). Der Mittelwert der Blindwerte wurde von allen Messwerten abgezogen. Der Mittelwert der Negativkontrollen zuzüglich des zweifachen Wertes der Standardabweichung dieser Messwerte (mean + 2 * s) wurde für jede ELISA-Platte als Schwellenwert festgelegt. Mehrfachbestimmungen derselben Probe wurden gemittelt und mit dem Schwellenwert verglichen. Als A. valerianellae-positive Proben galten alle, deren gemittelte Messwerte abzüglich des Blindwertes oberhalb des Schwellenwertes einer Maxisorpplatte lagen. 2.4 Verwendete Acidovorax valerianellae-Stämme Für die Versuche wurde, wenn nicht anders benannt, ein Isolategemisch aus den Isolaten 6.1.a, 16619, 709/2, 552 und IV2 verwendet. Das Isolat 6.1.a stammt aus der Gegend um Karlsruhe, Deutschland. Dieses wurde freundlicherweise von Frau Dr. Esther Moltmann von dem Landwirtschaftlichen Technologiezentrum Augustenberg, Außenstelle Stuttgart, Deutschland zur Verfügung gestellt. Das Isolat 16619 stammt aus der Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Deutschland und wurde dort unter der DSM-Nummer 16619 beziehungsweise CFBP 4730, NCPPB 4283 bestellt. Das Isolat 709/2 stammt aus dem Raum Neustadt an der Weinstraße, Deutschland und wurde dankenswerterweise von Herrn Dr. Hermann-Josef Krauthausen von dem Dienstleistungszentrum Ländlicher Raum Rheinpfalz, Neustadt an der Weinstraße, Deutschland zur Verfügung gestellt. Die Firma Enza Zaden, Enkhuizen, Niederlande war so freundlich die Isolate 552 und 553 zur Verfügung zu stellen, während das Isolat IV2 von der Firma Rijk Zwaan, Frasem, Frankreich freundlicherweise bereit gestellt wurde. Die Isolate wurden bei -75 °C in einer CryobankTM, einem Stammhaltungssystem zur Langzeitlagerung für Mikroorganismen der Firma Mast Diagnostica Laboratoriums- MATERIAL UND METHODEN 16 Präparate GmbH, Reinfeld, Deutschland aufbewahrt und je nach Bedarf auf KBAgar-Schalen rekultiviert. 2.5 Verwendetes Valerianella locusta (L.) – Saatgut Für alle Feldsalatversuche mit Ausnahme der Sortenversuche, den Versuchen zur Saatgutübertragung, den Versuchen von Nachweismethoden von A. valerianellae am Saatgut und den Dekontaminationsmaßnahmen wurde die Sorte AV-1 (Kalibergröße 2,00-2,25, 2006) der Firma Enza Zaden Deutschland GmbH & Co. KG, Dannstadt-Schauernheim, verwendet. Das Saatgut der Sorten und der Wildart V. rimosa (AV-13) für die Versuche zur Sortenanfälligkeit (Tab. 2.1) wurde sowohl von der Firma Enza Zaden, der Firma Clause (Nickerson Zwaan), Edemissen, Deutschland, der Firma Nunhems/Hild, Marbach/Neckar, Deutschland als auch von der Firma Rijk Zwaan De Lier, Niederlande zur Verfügung gestellt. Das Saatgut für diese Versuche wurde vor der Aussaat einer Warmwasserbeize unterzogen. Hierbei wurde das Saatgut für 20 Minuten in ein 42 °C bis 45 °C warmes Wasserbad gelegt (persönliche Mitteilung, A. Schieder, Enza Zaden). Anschließend wurde das Saatgut auf Filterpapier bei einer Temperatur von 27 °C für 24 bis 48 Stunden zurückgetrocknet. Für die Versuche zur Saatgutübertragung mit Aussaat in den Jahren 2007 und 2008 wurden die nicht-infizierte, gesunde Sorte AV-60 (2006, Kalibergröße 2,00-2,25) und die infizierte Sorte AV-75 (2005, Kalibergröße 2,00-2,25) von der Firma Enza Zaden, Enkhuizen, Niederlande zur Verfügung gestellt. Für den Folgeversuch zur Saatgutübertragung mit Aussaat im Jahr 2009 wurden die gleichen Sorten eingesetzt, allerdings waren beide Sorten mit Thiram, Metalaxyl und Iprodion gebeizt. Für die Versuche von Nachweismethoden von Acidovorax valerianellae am Saatgut (Kapitel 2.15.1) wurden sowohl die Ausgangssaatgutpartien als auch die selbstproduzierten Partien aus den Versuchen zur Saatgutübertragung herangezogen. Für die Dekontaminationsmaßnahmen (Kapitel 2.15.2) wurden zwei Sorten verschiedener Züchterhäuser benutzt. Als Vergleichssorte wurde die Sorte AV-220 (2009, Kalibergröße 2,00-2,25) von der Firma Enza Zaden, Enkhuizen, Niederlande MATERIAL UND METHODEN 17 verwendet. Als kontaminierte Sorten wurden die Sorten AV-219 (2009, Kalibergröße 2,00-2,25) von der Firma Enza Zaden, Enkhuizen, Niederlande und die Sorte AV-17 (2009, Kalibergröße 2,00-2,25) von der Firma Rijk Zwaan De Lier, Niederlande verwendet. MATERIAL UND METHODEN 18 Tabelle 2.1: Verwendetes Saatgut für die Versuche zur Sortenanfälligkeit. k.A.: keine Angabe Sorte Züchter AV-2 Kalibrierung 2,25-2,5 Rijk Zwaan Beizung Thiram, Carbendazim, Metalaxyl-M AV-3 2,00-2,25 - AV-4 2,25-2,5 - 1,75-2,00 - AV-6 2,50-2,75 - AV-7 2,25-2,50 - AV-8 1,75-2,00 - AV-9 2,00-2,25 - AV-10 2,00-2,25 AV-11 2,00-2,25 AV-5 Clause Nunhems/Hild AV-12 AV-13 Enza Zaden 2,00-2,25 Thiram, Iprodion, Metalaxyl-M Thiram, Iprodion+, Metalaxyl-M k.A. - AV-14 k.A. - AV-15 k.A. - V. rimosa MATERIAL UND METHODEN 2.6 19 Keimfähigkeit Zur Überprüfung der Keimfähigkeit wurden 4 * 100 Samen je Saatgutpartie auf gefaltetem, mit Leitungswasser angefeuchtetem Filterpapier ausgelegt und unter kühlen, dunklen Bedingungen (4 °C, Kühlschrank) inkubiert (Abb. 2.3). Die Samen wurden mehrmals auf ihre Keimung hin überprüft (innerhalb von vier Wochen), wobei jeweils die Anzahl an gekeimten Samen festgestellt wurde. Der Endwert der Keimfähigkeit (nach 28 Tagen) je Partie wurde aus vier Wiederholungen gemittelt. Abbildung 2.3: Gekeimte und nicht gekeimte Feldsalatsamen auf angefeuchtetem Filterpapier zur Überprüfung der Keimfähigkeit. (Foto: P. Krämer) 2.7 Aussaat von Feldsalatpflanzen Die Aussaat des Feldsalates für die Gewächshaus- und Klimakammerversuche erfolgte, wenn nicht anders erwähnt, in 4-er beziehungsweise 5-er Erdpresstöpfe, die aus einem Anzuchtsubstrat mit organischer Aufdüngung für Gemüsejungpflanzen (KKS Bio Potgrond) der Firma Klasmann-Deilmann GmbH, Geeste, Deutschland hergestellt wurden. Die Erdpresstöpfe wurden mittels einer Erdpresstopfmaschine MATERIAL UND METHODEN 20 der Firma Unger, Landmaschinen, Heidelberg-Dossenheim, Deutschland hergestellt und in Aussaatkisten abgelegt. Bis zur weiteren Verwendung wurden fertige Kisten im Kühlhaus gelagert. Die Aussaat des Feldsalates erfolgte entweder von Hand um eine definierte Kornablage zu gewährleisten (für die Versuche zur Sortenanfälligkeit) beziehungsweise über ein Handsähgerät, mit dem bei jeder Betätigung drei bis fünf Körner in den Topf abgelegt wurden. Um ein Austrocknen der Töpfe zu verhindern und eine gleichmäßige Befeuchtung zu gewährleisten wurden die Töpfe abschließend mit Sand abgestreut. Fertig ausgesäte Kisten wurden für die ersten fünf bis sechs Tage zum Ankeimen bei konstanten Temperaturen von 15 °C gelagert. Nach dem Ankeimen wurden die Feldsalatpflanzen im Gewächshaus weiterkultiviert. Eine Bewässerung erfolgte, wenn nicht anders erwähnt, über Kopf nach Bedarf. Vor einer weiteren Verwendung der Feldsalatpflanzen wurde jeder Erdpresstopf auf eine gut entwickelte Pflanze vereinzelt. 2.8 Herstellung von A. valerianellae - Inokulum Zur Herstellung einer A. valerianellae-Suspension wurden Bakterienzellen von zwei bis drei Tage alten Kulturen von KB-Agar-Platten abgenommen und in eine Natriumchloridlösung (0,85 %) suspendiert. Die optische Dichte wurde dabei anhand des Standards für Gram-negative Bakterien des BIOLOG-Verfahrens (GN-NENT) mittels Turbidimeter auf eine Bakterienkonzentration von ungefähr 3*108 cfu/ml eingestellt. Da die Konzentrationseinstellung über diesen Weg nicht genauer bestimmt werden konnte, war ein zusätzliches Ausplattieren der Bakteriensuspension unerlässlich. Zunächst wurde die Konzentration auf einen Wert von in etwa 103 cfu/ml verdünnt und anschließend auf acht bis zehn KB-Agar-Platten zu je 20 µl ausplattiert. Die Schalen wurden für drei bis vier Tage bei 20 °C beziehungsweise für zwei bis drei Tage bei 25 °C inkubiert und abschließend fand ein Auszählen der Kolonien statt und die Umrechnung auf Bakterienanzahl pro Milliliter in der Ausgangssuspension. Ausgehend von einer A. valerianellae-Konzentration von ungefähr 108 cfu/ml (Einstellung über das Turbidimeter des BIOLOG-Verfahrens) wurden die Konzentrationen 102 cfu/ml, 103 cfu/ml, 104 cfu/ml, 105 cfu/ml, 106 cfu/ml, 107 cfu/ml für die Verdünnungsreihe mit 0,85 %-iger NaCl-Lösung eingestellt. Die MATERIAL UND METHODEN 21 Suspension mit der höchsten Konzentration von 108 cfu/ml wurde dabei zunächst in einem Verhältnis von 1:10 verdünnt. Das so entstandene Inokulum mit der Konzentration von 107 cfu/ml wiederum als Ausgangssuspension zur Herstellung der Konzentration von 106 cfu/ml verwendet, wobei die Suspension im Verhältnis von 1:10 verdünnt wurde. Die Bakteriensuspensionen für die anderen Konzentrationen wurden nach dem gleichen Verfahren hergestellt. 2.9 Inokulation der Feldsalatpflanzen Das Bakterium A. valerianellae wurde, wenn nicht anders erwähnt, in allen Versuchen als Suspension eines Isolategemisches (aus den Isolaten 6.1.a, 16619, IV2, 552 und 709/2) und mit einer Konzentration von 108 cfu/ml verwendet. Die Inokulation erfolgte, wenn nicht anders erwähnt, durch Sprühinokulation auf die nicht verletzte, trockene Pflanzenoberfläche mittels Feinzerstäuber. Die Bakteriensuspension wurde bis zum Ablaufen des Sprühfilms auf die Pflanzen ausgebracht (Abb. 2.4). Nach der Inokulation wurden die Pflanzen unter einer Haube beziehungsweise Folie bei annähernd gesättigter Luftfeuchtigkeit weiterkultiviert. Die Dauer der Abdeckung war je nach Versuchsfrage unterschiedlich. MATERIAL UND METHODEN A B Abbildung 2.4: Inokulation von Feldsalatpflanzen mit A. valerianellae. (A): Verwendung eines Feinzerstäubers. (B): Sprühfilm zerstäubter A. valerianellae-Suspension auf der Oberseite von Feldsalatblättern. (Foto (A): G. Hörner, Dienstleistungszentrum Ländlicher Raum Rheinpfalz) 22 MATERIAL UND METHODEN 2.10 23 Bonitur von Feldsalatpflanzen Die Bonitur von Feldsalatpflanzen wurde, wenn nicht anders erwähnt, mehrmals zu verschiedenen Zeitpunkten nach der Inokulation bis Versuchende vorgenommen. Es wurden sowohl die Anzahl von Symptom tragenden Pflanzen (Befallshäufigkeit in %) ermittelt als auch der Anteil nekrotischer Blattfläche je Einzelpflanze (Befallsstärke in %) geschätzt. Bei der Bonitur der Pflanzen im Bodenüberdauerungsversuch wurden sowohl die Gesamtanzahl der aufgelaufenen Feldsalatpflanzen als auch die Zahl der Symptom tragenden Pflanzen beurteilt und in Prozent angegeben (Befallshäufigkeit in %). Bei der Bonitur der Pflanzen des Ausgangssaatgutes bei der Saatgutproduktion (mit Aussaat in den Jahren 2007 bis 2009) wurden zunächst Symptom tragende Pflanzen mit einem Holzstab markiert und anschließend wurde die Gesamtanzahl an Symptom tragenden Pflanzen geschätzt. 2.11 Statistische Auswertung der Daten Die Daten wurden mit dem Statistikpaket XLSTAT von MS Excel, Version 6, ausgewertet. Mit allen Daten wurde eine Varianzanalyse durchgeführt, vorausgehend wurden die Residuen mit dem Shapiro Wilk Test auf Normalverteilung geprüft. Die Unterschiede zwischen normalverteilten Behandlungen wurden mit dem Tukey`s HSD-Test auf Signifikanz bei p < 0,05 geprüft (und sind nachfolgend in den Abbildungen nochmals gesondert beschriftet). Nicht normalverteilte Stichproben wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verglichen und auf Signifikanz bei p < 0,05 nachgerechnet. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. MATERIAL UND METHODEN 2.12 24 Untersuchungen zu Infektionsbedingungen von Acidovorax valerianellae 2.12.1 Einfluss der Temperatur auf die Infektion in vivo Die Versuche wurden in Klimaschränken bei konstanten Temperaturen von 10 °C, 15 °C, 20 °C, 25 °C und 30 °C im 12 Stunden Tag- (mit Beleuchtung) und 12 Stunden Nachtrhythmus (ohne Beleuchtung) durchgeführt. Feldsalatpflanzen im 2- bis 4-Blattstadium wurden direkt nach der Inokulation mit einem A. valerianellaeGemisch (siehe Kapitel 2.4) in einer Konzentration von 109 cfu/ml bei genannten Temperaturen unter gesättigter Luftfeuchte aufgestellt und bis Versuchende mehrmals bonitiert. Die Bewässerung der Pflanzen erfolgte über das Anstauverfahren, um eine Ausbreitung des Erregers über Spritzwasser zu vermeiden. Bonitiert wurde der Anteil an befallener Blattfläche (Befallsstärke in %) und die Anzahl an Symptom tragenden Pflanzen (Befallshäufigkeit in %). 2.12.2 Einfluss des Blattalters und der Blattnässedauer auf die Infektion Für diesen Versuch wurden Feldsalatpflanzen (n=20) in verschiedenen Stadien (Keim- und Laubblattstadium) mit dem Isolat 709/2 mit einer Konzentration von 106 cfu/ml inokuliert und anschließend unter gesättigter Luftfeuchte kultiviert. Die Dauer der Abdeckung zur Erhöhung der Luftfeuchtigkeit wurde variiert. In der ersten Variante wurden die Pflanzen unmittelbar nach der Inokulation einmalig für 48 Stunden bei gesättigter Luftfeuchte kultiviert (einmalige Abdeckung). In der zweiten Variante wurden die Pflanzen direkt nach der Inokulation für 48 Stunden bei gesättigter Luftfeuchte und nach einer jeweils fünftägigen Phase ohne Abdeckung erneut für 48 Stunden bei gesättigter Luftfeuchte kultiviert. Das erfolgte im wöchentlichen Abstand, so dass über 35 Tage jeweils an zwei von sieben Tagen gesättigte Luftfeuchtigkeiten herrschten. In Variante drei wurden die Pflanzen bis Versuchende, 35 Tage nach der Inokulation, dauerhaft bei gesättigter Luftfeuchte MATERIAL UND METHODEN 25 gehalten (dauerhafte Abdeckung). Die Klimakammerführung wurde auf 20 °C und 18 °C im 12-Stundenwechsel mit 16 Stunden Licht eingestellt. An verschiedenen Tagen nach der Inokulation wurden Bonituren vorgenommen, bei denen ermittelt wurde, wie viele Pflanzen von den 20 inokulierten Pflanzen Symptome zeigten. Begonnen wurde am vierten Tag nach der Inokulation, während die letzte Bonitur nach 35 Tagen stattfand. In einer Versuchswiederholung wurden Pflanzen im Laubblattstadium mit einem Isolategemisch (Konzentration 105 cfu/ml) inokuliert und anschließend, wie oben beschrieben kultiviert. 2.12.3 Einfluss der Blattnässedauer auf die Infektion beziehungsweise die Symptomentwicklung Um zu testen, ob die Dauer der Blattnässe beziehungsweise die Dauer des Vorhandenseins einer hohen (gesättigten) Luftfeuchte einen Einfluss auf eine Infektion von A. valerianellae besitzt, wurden mehrere Versuche angelegt. Bei allen Versuchen zum Einfluss der Blattnässedauer auf die Infektion erfolgte die Inokulation von Pflanzen im 2- bis 4-Blattstadium mit einer A. valerianellaeSuspension aus einem Isolategemisch mit einer Konzentration von 108 cfu/ml, wenn nicht anders erwähnt. Die Bewässerung erfolgte über das Anstauverfahren, um eine Erregerausbreitung durch Spritzwasser zu vermeiden. Erfasst wurden Befallsstärke und Befallshäufigkeit an verschiedenen Tagen nach der Inokulation bis Versuchende. 2.12.3.1 Einfluss der Blattnässedauer auf die Symptomentwicklung In einem ersten Versuchsansatz unter Klimakammerbedingungen bei Temperaturen von 25 °C für 12 Stunden und 18 °C für 12 Stunden bei 16 Stunden Licht wurde der Einfluss einer zwischengeschalteten Trockenphase von sieben beziehungsweise acht Tagen auf die Symptomausprägung bereits befallener Feldsalatpflanzen untersucht. Nach der Inokulation wurden alle Versuchspflanzen bei gesättigter Luftfeuchte kultiviert, um zunächst einen 100 %-igen Befall zu erreichen. Dies geschah an Tag sieben nach der Inokulation. Diese erste Phase unter gesättigten Luftfeuchten wurde, den Versuchsgliedern entsprechend, bis zum Tag 18 nach Inokulation ausgeweitet. MATERIAL UND METHODEN 26 Nach einer jeweils zwischengeschalteten Trockenphase von sieben beziehungsweise acht Tagen bei normal vorherrschenden Luftfeuchten von 88 % relativer Luftfeuchte, wurde die Pflanzenanzahl je Versuchsglied halbiert. Eine Hälfte der Pflanzen wurde weiterhin „trocken“ (bei normal vorherrschender Luftfeuchte) und die andere Hälfte erneut „feucht“ (bei gesättigter Luftfeuchte) kultiviert. Pflanzen des Versuchsgliedes 08/15 wurden demnach wie folgt behandelt: die ersten acht Tage nach der Inokulation wurden die Pflanzen unter gesättigter Luftfeuchte kultiviert, dann folgte eine siebentägige Kultivierung bis Tag 15 nach Inokulation unter normal vorherrschender Luftfeuchte und ab Tag 15 erfolgte eine Zweiteilung der Versuchspflanzen. Das heißt, die Versuchspflanzen wurden bis Versuchende (32 Tage nach der Inokulation) entweder weiterhin bei normal vorherrschender Luftfeuchte „trocken“ beziehungsweise unter gesättigter Luftfeuchte „feucht“ kultiviert. Pflanzen des Versuchsgliedes 10/18 wurden für die ersten zehn Tage unter gesättigten Bedingungen kultiviert. Es folgte eine Kultivierung unter normal vorherrschender Luftfeuchte (Trockenphase) von acht Tagen Dauer, mit anschließender Weiterkultivierung (ab Tag 18) entweder unter trockenen beziehungsweise gesättigten Luftfeuchten, bis zum 32. Tag nach der Inokulation. Entsprechendes gilt für die anderen Versuchglieder (12/19, 14/22 und 18/25). Die erste Zahl steht für die erste Phase der Kultivierung unter gesättigter Luftfeuchte, die zweite Zahl benennt den Tag nach Inokulation, ab dem die Versuchspflanzen zweigeteilt wurden und entweder weiterhin „trocken“ beziehungsweise erneut „feucht“ kultiviert wurden. In einem weiteren Versuch unter Klimakammerbedingungen (20 °C für 14 Stunden und 15 °C für zehn Stunden bei 16 Stunden Licht) wurden inokulierte Feldsalatpflanzen bis zum sichtbaren Befall an allen Pflanzen (neun Tage nach Inokulation) bei gesättigter Luftfeuchte kultiviert. In der daran anschließenden Trockenphase wurden alle Pflanzen der Versuchsglieder bei 88 % relativer Luftfeuchte kultiviert und die darauffolgende, erneute Kultivierung der Pflanzen unter gesättigter beziehungsweise normal vorherrschender Luftfeuchte (bei jeweils der Hälfte der Pflanzen) wurde im wöchentlichen Abstand bis Tag 37 nach der Inokulation ausgeweitet. Das heißt befallene, Symptom tragende Pflanzen wurden MATERIAL UND METHODEN 27 bis 16, 23, 30 und 37 Tage nach Inokulation bei trockenen Bedingungen kultiviert. Daran anschließend wurden die Hälfte der Pflanzen weiterhin trocken und die andere Hälfte erneut unter gesättigten Luftfeuchten kultiviert (wie oben bereits beschrieben) und zu verschiedenen Tagen nach der Inokulation bonitiert. 2.12.3.2 Einfluss der Blattnässedauer unmittelbar nach der Inokulation In einem zweiten Versuchsansatz wurde die Dauer der vorherrschenden Luftfeuchte in der Klimakammer nach der Inokulation variiert. Die Klimakammer wurde dabei auf Temperaturen von 20 °C für 14 Stunden und 15 °C für 10 Stunden bei 16 Stunden Licht eingestellt. Die Pflanzen wurden 0, 6, 9, 12, 24, 48 und 72 Stunden nach der Inokulation unter gesättigter Luftfeuchte kultiviert. Nach jeweils sieben Tagen „Trockenheit“ bei 85 % relativer Luftfeuchte wurde die Hälfte der Pflanzen der jeweiligen Versuchsglieder bei gesättigter Luftfeuchte kultiviert. Die Pflanzen wurden ab dem neunten Tag nach der Inokulation bonitiert. Bonitiert wurden dabei sowohl die Pflanzen, die nach einer Trockenphase erneut bei gesättigter Luftfeuchte kultiviert wurden, als auch die Pflanzen, die bis Versuchende bei normal vorherrschender Luftfeuchte wuchsen. Die Bonitur von Pflanzen, die zunächst für 48 und 72 Stunden bei gesättigter Luftfeuchte kultiviert wurden, wurde am neunten Tag nach der Inokulation lediglich an Pflanzen innerhalb der Trockenperiode vorgenommen. Ab der zweiten Bonitur (13 dpi) wurden die Pflanzen aus allen Varianten entweder als trocken oder feucht weiterkultiviert und bonitiert. Dieser Versuch wurde ebenfalls bei einer konstanten Temperatur von 20 °C mit 12 Stunden Licht am Tag für die ersten 96 Stunden nach der Inokulation und danach mit einem Tag/Nacht-Rhythmus von 20 °C Tag und 15 °C Nacht durchgeführt. Als Vergleich zu beiden Temperaturvarianten wurden inokulierte Pflanzen, die über die gesamte Zeit des Versuches dauerhaft bei gesättigter Luftfeuchte kultiviert wurden, ebenfalls hinsichtlich der Befallsstärke bonitiert. MATERIAL UND METHODEN 2.12.4 Es wurden 28 Einfluss der Inokulumdichte auf die Infektion Feldsalatpflanzen im Laubblattstadium mit einzelnen A. valerianellae-Isolaten (6.1.a, 16619, 552) in verschiedenen Konzentrationen inokuliert und in der Klimakammer unter gesättigter Luftfeuchte aufgestellt. Die Konzentration der Isolate lag dabei zwischen 102 cfu/ml und 107 cfu/ml. Zwischen dem 5. und dem 19. Tag nach der Inokulation wurde die Anzahl an Symptom tragenden Pflanzen ermittelt. Die Bewässerung erfolgte über das Anstauverfahren. MATERIAL UND METHODEN 2.13 Untersuchungen zur Sortenanfälligkeit 2.13.1 Einfluss der Sorte auf die Infektion 29 Es wurden für diesen Versuch die Sorten AV-2, AV-3, AV-4, AV-5, AV-6, AV-7, AV-8, AV-9, AV-10, AV-11, AV-12, AV-14 und AV-15 der Züchterhäuser Clause Tézier, Enza Zaden, Rijk Zwaan und Nunhems untersucht. Des Weiteren war die Wildform V. rimosa (AV-13) Gegenstand der Untersuchungen zum Einfluss der Sorte auf die Infektion. Die Aussaat fand am 16.11.2007 (erste Wiederholung) und am 14.01.2008 (zweite Wiederholung) statt. Am 31. (1. Wiederholung) beziehungsweise 35. (2. Wiederholung) Tag nach der Aussaat wurden die Pflanzen im Laubblattstadium inokuliert. Für die Sprühinokulation wurde ein Isolategemisch mit einer Konzentration von 106 cfu/ml verwendet. Die Pflanzen wurden für 18 Tage bei gesättigter Luftfeuchte im Gewächshaus randomisiert kultiviert (zwischen 13 °C und 24 °C bei 12 Stunden Kunstlicht im ersten Versuch, höhere Temperaturen zwischen 20 °C bis 29 °C bei 12 Stunden Kunstlicht im zweiten Versuch) und abschließend bezüglich Befallstärke und Befallshäufigkeit ausgewertet. 2.13.2 Einfluss der Sorte und des Isolates auf die Infektion Um zu testen, ob einzelne Isolate unterschiedlicher Herkunft bei verschiedenen Feldsalatsorten zu unterschiedlichen Symptomausprägungen führen, wurden drei Sorten (AV-1, AV-5, AV-3) und eine Wildart V. rimosa (AV-13) im Laubblattstadium mit jeweils vier Isolaten (6.1.a, 553, 16619, IV2) inokuliert. Nach der Sprühinokulation (am 10.03.2009 in der ersten Wiederholung und am 30.03.2009 in der zweiten Wiederholung) wurden die Pflanzen in einer randomisierten Blockanlage unter Gewächshausbedingungen (zwischen 9 °C und 34 °C in der ersten Wiederholung beziehungsweise zwischen 2 °C und 45 °C in der zweiten Wiederholung) bis Versuchende dauerhaft unter gesättigter Luftfeuchte kultiviert. Die Konzentration der am 10.03.2009 verwendeten Isolate belief sich auf 104 cfu/ml (Isolate 16619, IV2) und 106 cfu/ml (Isolate: 6.1.a, 553). Bei der Inokulation 20 Tage später wurde eine Konzentration von 105 cfu/ml für alle Isolate verwendet. Die MATERIAL UND METHODEN 30 Endbonitur von Befallsstärke und Befallshäufigkeit fand für beide Wiederholungen 16 Tage nach der Inokulation statt. 2.13.3 Einfluss der Inokulumdichte und der Sorte auf die Infektion In einem Versuch zum Einfluss der Inokulumdichte und der Sorte auf die Infektion wurden Feldsalatpflanzen zweier unterschiedlicher Sorten (AV-9 und AV-5) und die Wildart V. rimosa (AV-13) im Laubblattstadium mit einem Isolategemisch (aus 6.1.a, 16619, IV2, 553) inokuliert und anschließend unter gesättigter Luftfeuchte im Gewächshaus aufgestellt. Die Konzentrationen der Inokula lagen dabei zwischen 102 cfu/ml und 106 cfu/ml. Es wurde an drei Boniturterminen (zwischen Tag sieben und Tag 20) die Anzahl an Symptom tragenden Pflanzen ermittelt. Die Pflanzen wurden über das Anstauverfahren bewässert. MATERIAL UND METHODEN 2.14 31 Versuche zum Übertragungsweg von Acidovorax valerianellae 2.14.1 Boden Bei der Überprüfung, wie lange das Bakterium im Boden überdauern kann, wurden am 09.09.2009 nicht-infiziertes und infiziertes Blattmaterial mit A. valerianellae jeweils in Boden (Schifferstadt, Pfalz, Deutschland) eingemischt. Die Böden wurden anschließend in Containern im Erdreich eingesenkt (Abb. 2.5). Damit sollten die natürlichen Bodenverhältnisse in Abhängigkeit der bodenbiologischen Aktivität und Umsetzung mit der gegebenen Witterung nachgeahmt werden. Der Nachweis erfolgte im monatlichen Abstand durch die Aussaat von gesundem Saatgut (Sorte AV-1) in Proben dieser Böden (Abb. 2.6), die jeweils in Einheiten von ca. 800 g Boden entnommen wurden. In vier Reihen wurden jeweils 15 Samen abgelegt und mit Perlitte abgedeckt. Die sich entwickelnden Pflanzen wurden in der Klimakammer bei 20 °C Tag- und 15 °C Nachttemperatur bei 16 Stunden Licht unter gesättigten Luftfeuchten bis Versuchende (etwa 12 Wochen nach der jeweiligen Aussaat) inkubiert. Die Pflanzen wurden bei Bedarf gegossen, so dass es teilweise zum Hochspritzen von Bewässerungstropfen und Bodenpartikeln kommen konnte. Blattbereiche mit für A. valerianellae typischen Symptomen wurden mittels TASELISA auf einen A. valerianellae-Befall untersucht. Dieser Versuchsansatz wurde mit Boden vom Julius Kühn-Institut, Quedlinburg, Deutschland freundlicherweise von Frau Katja Thiele im März 2010 für die Dauer von acht Monaten wiederholt. MATERIAL UND METHODEN 32 Abbildung 2.5: Container mit kontaminiertem und nicht kontaminiertem infiziertem und Boden (durch infiziertem Einarbeitung Blattmaterial) für von nicht- sukzessive Probenentnahme (einmal pro Monat) über einen Zeitraum von bis zu einem Jahr (Standort Schifferstadt, Deutschland). MATERIAL UND METHODEN 33 Abbildung 2.6: Aussaat von gesundem Saatgut (Sorte Favor) in mit A. valerianellae kontaminierten und nicht-kontaminierten Boden (durch Einarbeitung von nicht-infiziertem und infiziertem Blattmaterial) zur Überprüfung der Überdauerung von A. valerianellae-Bakterien im Boden. Die Abdeckung der Samen erfolgte mit Perlitte. 2.14.2 Um Alternative Wirtspflanzen den Wirtspflanzenkreis von A. valerianellae einzugrenzen, wurden Infektionsversuche mit verschiedenen Pflanzenarten durchgeführt. Als mögliche Wirtspflanzen von A. valerianellae wurden Gemüse- und Ackerbaukulturen, die in einem unter Praxisbedingungen vorkommenden Fruchtwechsel mit Feldsalat angebaut werden, sowie verschiedene Unkräuter geprüft. Der Befall potentieller alternativer Wirtspflanzen wurde zunächst visuell und später mittels TAS-ELISA geprüft. MATERIAL UND METHODEN 2.14.2.1 34 Alternative Wirtspflanzen I In einem ersten Versuch wurde bei einem breiten Artenspektrum (Tab. 2.2) und Feldsalat als anfälligem Standard in einzelne Blätter die A. valerianellae-Suspension eines Isolategemisches mit einer Konzentration von 108 cfu/ml infiltriert und auf die gesamte Pflanze gesprüht. Anschießend erfolgte die Kultivierung der Pflanzen bei gesättigter Luftfeuchte in der Klimakammer (20 °C Tag-, 15 °C Nachttemperatur bei 16 Stunden Licht). Zwischen dem 1. Tag und 20. Tag nach Infiltration beziehungsweise Sprühinokulation wurden die Pflanzen auf eine Veränderung der Blattstrukturen im Vergleich zur Kontrolle (Infiltration und Sprühinokulation mit 0,85 %-iger Natriumchloridlösung) visuell überprüft. Die Überprüfung erfolgte dabei sowohl an infiltrierten Blattbereichen als auch an Blattbereichen, die durch Sprühen inokuliert wurden. MATERIAL UND METHODEN 35 Tab 2.2: Verwendete Pflanzen aus elf Familien zur Überprüfung ihrer Eignung als alternative Wirtspflanzen von A. valerianellae nach Infiltration und Sprühinokulation. 1 diese Pflanzen konnten aufgrund der kleinen Blattfläche nicht in einzelne Blätter infiltriert werden. Familie Art Valerianaceae Valerianella locusta (L.) (Baldriangewächse) (Feldsalat) Amaranthus retroflexus (L.) (Zurückgekrümmter Fuchsschwanz) Amaranthaceae Chenopodium hybridum (L.) (Fuchsschwanzgewächse) (Bastard-Gänsefuß) Chenopodium album (L.) (Weißer Gänsefuß) Lactuca sativa (L.) (Batavia-Salat) Lactuca sativa (L.) Asteraceae (Eissalat) (Korbblütler) Matricaria chamomilla (L.)1 (Kamille) Senecio vulgaris (L.) (Gemeines Kreuzkraut) Brassica rapa ssp. pekinensis (Lour.) Hanelt Brassicaceae (Chinakohl) (Kreuzblütengewächse) Capsella bursa-pastoris (L.) Medik. (Hirtentäschel) Caryophyllaceae Stellaria media (L.) Vill. (Nelkengewächse) (Vogelmiere) Phaseolus vulgaris (L.) Fabaceae (Buschbohne) (Hülsenfrüchtler) Pisum sativum (L.) (Markerbse) MATERIAL UND METHODEN 36 Tab 2.2 – Fortsetzung: Familie Art Hydrophylloideae Phacelia tanacetifolia (Juss.)1 (Wasserblattgewächse) (Rainfarn-Phacelie) Lamiaceae Lamium album (L.) (Lippenblütler) (weiße Taubnessel) Plantago major (L.) Plantaginaceae (Breitwegerich) (Wegerichgewächse) Veronica persica (Poir.) (Persischer Ehrenpreis) Poaceae Eleusine coracana (L.) Gaertn. (Süßgräser) (Fingerhirse) Portulaceae Portulaca oleracea (L.) (Portulakgewächse) (Portulak) MATERIAL UND METHODEN 2.14.2.2 37 Alternative Wirtspflanzen II In einem zweiten Versuch wurden Pflanzen aus sechs Familien (Tab. 2.3) und Feldsalat als anfälligem Standard mittels Sprühinokulation mit einer A. valerianellae-Suspension eines Isolategemisches mit einer Konzentration von 108 cfu/ml inokuliert. Für die ersten 48 Stunden sowie 28 bis 30 Tage nach Inokulation wurden die Pflanzen bei gesättigter Luftfeuchte im Gewächshaus kultiviert. Am 10. Tag nach der Inokulation sowie am 25. und 30. Tag nach der Inokulation wurden die Pflanzen visuell auf eine Veränderung in der Blattstruktur bonitiert. Als Vergleich wurden entsprechende mit Natriumchloridlösung inokulierte Kontrollpflanzen herangezogen. 0,85 %-iger MATERIAL UND METHODEN 38 Tab 2.3: Verwendete Pflanzen aus sieben Familien zur Überprüfung der Eignung als Wirtspflanzen von A. valerianellae (Alternative Wirtspflanzen II) nach Sprühinokulation. Familie Art Valerianaceae Valerianella locusta (L.) (Baldriangewächse) (Feldsalat) Beta vulgaris subsp. vulgaris var. conditiva (L.) Amaranthaceae (Rote Bete) Spinacia oleracea (L.) (Fuchsschwanzgewächse) (Spinat) Foeniculum vulgare (L.) Mill. Apiaceae (Doldenblütler) (Fenchel) Daucus carota subsp. sativus (Hoffm.) Schübl. et G. Martens (Möhre) Petroselium crispum (Mill.) Nyman & A.W. Hill (Petersilie, glatt und kraus) Raphanus sativus subsp. oleiformes (L.) (Ölrettich) Raphanus sativus subsp. sativus (L.) Brassicaceae (Kreuzblütengewächse) (Radies) Raphanus sativus (L.) (Rettich) Eruca sativa (L.) (Rucola) Phaseolus vulgaris (L.) Fabaceae (Hülsenfrüchtler) (Buschbohne) Pisum sativum (L.) Poaceae (Markerbse) Zea mays (L.) (Süßgräser) Solanaceae (Mais) Capsicum annuum (L.) (Nachtschattengewächse) (Paprika) MATERIAL UND METHODEN 2.14.2.3 39 Alternative Wirtspflanzen III In einem dritten Versuchsansatz wurde geprüft, wie lange das Bakterium in sieben Pflanzenarten aus fünf Familien (Tab. 2.4) lebensfähig ist und ob diese Pflanzen als potentielle Wirte für das Bakterium geeignet sind. Dazu wurde in jeweils acht Blätter jeder Versuchspflanze sowie Feldsalat als anfälligem Standard eine A. valerianellaeSuspension aus einem Isolategemisch mit der Konzentration von 108 cfu/ml injiziert. Die Injektion erfolgte über Nadelstiche nur auf einer Blatthälfte. Als Kontrolle wurde 0,85 %-ige Natriumchloridlösung in Blatthälften weiterer Versuchspflanzen infiziert. Die Pflanzen wurden insgesamt fünf Wochen auf Veränderungen im Vergleich zur Kontrolle untersucht. Die ersten 12 Tage nach der Inokulation wurden die Pflanzen bei gesättigter Luftfeuchte kultiviert, um den Bakterien eine optimale Umgebung zu bieten. Danach erfolgte die Kultur bei der im Gewächshaus vorherrschenden Luftfeuchtigkeit. Nach 12 Tagen unter gesättigten Bedingungen erfolgte eine erste Untersuchung der inokulierten Blätter. Der Nachweis lebensfähiger Bakterien erfolgte über Ausplattieren von Pflanzensaftproben von den mit 70 %-igem Alkohol oberflächendesinfizierten, injizierten und den nicht-injizierten Blatthälften auf KBAgarschalen (plus Cycloheximid). Gewachsene Bakterienkolonien wurden anschließend näher charakterisiert (Fluoreszenz, Gramreaktions-Test, Mikrobiologie Bactident® Oxidase-Test, Hypersensitivitätsreaktion, indirekter TAS-ELISA). Die Pflanzen wurden über die Dauer des Versuches so gegossen, dass die injizierten Blattbereiche weder berührt noch feucht wurden. MATERIAL UND METHODEN 40 Tab. 2.4: Verwendete Pflanzen aus sechs Familien zur Überprüfung ihrer Eignung als alternative Wirtspflanzen von A. valerianellae nach Stichinokulation. Familie Art Valerianaceae Valerianella locusta (L.) (Baldriangewächse) (Feldsalat) Beta vulgaris subsp. vulgaris var. conditiva (L.) Amaranthaceae (Rote Bete) (Fuchsschwanzgewächse) Spinacia oleracea (L.) (Spinat) Apiaceae Petroselium crispum (Mill.) Nyman & A.W. Hill (Doldenblütler) (Petersilie, kraus) Asteraceae Lactuca sativa (L.) (Korbblütler) (Eissalat) Raphanus sativus subsp. oleiformes (L.) (Ölrettich) Brassicaceae Raphanus sativus subsp. sativus (L.) (Kreuzblütengewächse) (Radies) Raphanus sativus (L.) (Rettich) Phaseolus vulgaris (L.) Fabaceae (Buschbohne) (Hülsenfrüchtler) Pisum sativum (L.) (Markerbse) 2.14.3 Saatgut Um zu überprüfen, ob es bei der Saatgutproduktion von mit A. valerianellaeinfiziertem Saatgut der Sorte AV-75 zu einer Übertragung des Bakteriums auf die Tochtergeneration kommt, wurde je ein Versuch in den Jahren 2007, 2008 und 2009 angelegt. Im Vergleich dazu wurde jedes Mal eine nicht-infizierte Saatgutpartie der Sorte AV-60 ausgesät und ebenfalls bis zur Saatgutproduktion kultiviert. MATERIAL UND METHODEN 41 Die Aussaat des Feldsalates erfolgte sowohl im Jahr 2007 als auch im Jahr 2008 im Monat Mai in einem Folienhaus mittels Feldsaatmaschine Type Miniair S der Firma Accord-Landmaschinen H. Weiste & Co. GmbH, Soest, Deutschland. Jede Saatgutpartie wurde in einem Abstand von 4,2 cm in der Reihe und 12,5 cm zwischen den Reihen ausgesät (10 Reihen je Saatgutpartie), wobei zuerst die nichtinfizierte Partie in die Erde abgelegt wurde, um ein Verschleppen bei der Aussaat zu verhindern. Um eine Übertragung von A. valerianellae mittels Spritzwasser bei der Beregnung (Gießwagen) zu vermeiden wurden zwischen den infizierten und nichtinfizierten Saatgutpartien Folienzäune in Höhe von einem Meter aufgebaut (Abb. 2.7, Abb. 2.9). Der Versuch zur Saatgutproduktion mit Aussaat im Jahr 2007 wurde zusätzlich in Frankreich im Freiland durchgeführt. Die Fläche wurde von der Firma Enza Zaden, Allonnes, Frankreich zur Verfügung gestellt. Die Versuchsdurchführung (Aussaat, Beregnung, Bonitur, Ernte) wurde freundlicherweise von den dort ansässigen Mitarbeitern durchgeführt. Die Beregnung erfolgte zusätzlich zu natürlichem Regen über Kreisregner. Ein Folienzaun wurde nicht aufgebaut (Abb. 2.8). Die Aussaat für die Saatgutproduktion 2009 erfolgte im November 2009 mittels einer Handsämaschine HS der Firma Sembdner Maschinenbau GmbH, Germering, Deutschland in einem Gewächshaus, wobei die Kornablage wie in den Aussaatjahren zuvor erfolgte (4,2 cm in der Reihe, 12,5 cm zwischen den Reihen). Begonnen wurde auch hier mit der Aussaat der nicht-infizierten Saatgutpartie. Beide Saatgutpartien wurden gebeizt verwendet (Beize aus Thiram, Metalaxyl und Iprodion). Die Wasserversorgung der Pflanzen erfolgte zum einen über Kopf mit Kreisregnern (das heißt plus Spritzwasser) zum anderen über Tropfbewässerung (das heißt ohne Spritzwasser). Um eine Übertragung von A. valerianellae mittels Spritzwasser zu vermeiden, wurde sowohl zwischen der infizierten und nicht-infizierten Saatgutpartie, die über Kopf beregnet wurde, ein ein Meter hoher Folienzaun aufgebaut als auch zwischen den Varianten Kopfberegnung und Tropfschlauchbewässerung (die Zaunhöhe entsprach hier der Gewächshaushöhe, Abb. 2.10). MATERIAL UND METHODEN 42 Die Feldsalatpflanzen wurden für die Dauer der Saatgutproduktion auf einen A. valerianellae-Befall hin visuell überprüft und die Befallshäufigkeit (%) gezählt (Aussaat im Jahr 2007, Deutschland und Frankreich) beziehungsweise geschätzt (Aussaat in den Jahren 2008 und 2009, Deutschland). Die Ernte der Samen fand in den Jahren nach der Aussaat im Mai beziehungsweise Juni statt. Das Saatgut wurde nach der Trocknung zunächst für vier bis acht Wochen bei 4 °C gelagert, anschließend gereinigt und bis zur weiteren Verwendung bei Raumtemperatur aufbewahrt. Die Saatgutpartien (Abb. 2.11) wurden mit verschiedenen Verfahren (siehe 2.15.1) auf Kontamination beziehungsweise Befallsfreiheit geprüft. Parallel wurden bei den Firmen Enza Zaden und Rijk Zwaan die dort etablierten Routineprüfungen (Sweatbox-Test, anschließend Nachweis mit PCR) auf A. valerianellae-Befall durchgeführt (siehe 2.15.1.4). Die Bodenart in den Häusern war ein sandiger Lehm. MATERIAL UND METHODEN Abbildung 2.7: Versuchsanordnung der Saatgutproduktion aus gesundem (rechts) und mit A. valerianellae-infiziertem Saatgut (links) mit Aussaat im Jahr 2007 im Folienhaus in Deutschland. Abgrenzung durch einen Folienzaun. Beregnung über Kopf. 43 MATERIAL UND METHODEN Abbildung 2.8: Versuchsanordnung der Saatgutproduktion aus gesundem (links) und mit A. valerianellae-infiziertem Saatgut (rechts) mit Aussaat im Jahr 2007 im Freiland in Frankreich. (Foto: A. Schieder, Enza Zaden) Abbildung 2.9: Versuchsanordnung der Saatgutproduktion aus gesundem (links) und mit A. valerianellae-infiziertem Saatgut (rechts) mit Aussaat im Jahr 2008 im Folienhaus in Deutschland. Abgrenzung durch einen Folienzaun. Beregnung über Kopf. 44 MATERIAL UND METHODEN 45 A B Abbildung 2.10: Versuchsanordnung der Saatgutproduktion aus gesundem und mit A. valerianellae-infiziertem Saatgut mit Aussaat im Jahr 2009 im gleichen Schiff eines Gewächshauses, Abgrenzung durch Folienzäune. (A): Wasserversorgung kontaminiertes mittels Saatgut Kreisregner, links. (B): gesundes Saatgut Wasserversorgung rechts, mittels Tropfbewässerung, gesundes Saatgut links, kontaminiertes Saatgut rechts. MATERIAL UND METHODEN 46 Ausgangssaatgut AV-60 (gesund) Aussaatjahr 2007 AV-61 (Deutschland) AV-63 (Frankreich) AV-76 (Deutschland) AV-78 (Frankreich) aus AV-60 aus AV-60 aus AV-75 aus AV-75 Aussaatjahr 2008 Aussaatjahr 2009 (Verwendung von gebeiztem Saatgut) Ausgangssaatgut AV-75 (kontaminiert) AV-62 AV-77 aus AV-60 aus AV-75 AV-64 (Tröpfchen) AV-65 (Regner) AV-79 (Tröpfchen) AV-80 (Regner) aus AV-60 (gebeizt) aus AV-60 (gebeizt) aus AV-75 (gebeizt) aus AV-75 (gebeizt) Abbildung 2.11: Benennung der gewonnenen Saatgutpartien aus der gesunden FeldsalatSaatgutpartie (AV-60, Ausgangssaatgut) und einer kontaminierten Feldsalat-Saatgutpartie (AV-75, Ausgangssaatgut) mit Aussaaten in verschiedenen Jahren (2007 bis 2009). Die Vermehrung des Ausgangssaatguts fand mit Aussaat im Jahr 2007 in Deutschland und Frankreich statt, mit Aussaat im Jahr 2008 in Deutschland. Mit der Aussaat im Jahr 2009 wurde das Ausgangssaatgut gebeizt verwendet, die Bewässerung erfolgte über das Tröpfchenverfahren und über Kopf mit Kreisregnern. MATERIAL UND METHODEN 47 2.15 Saatgutuntersuchungen 2.15.1 Nachweismethoden von Acidovorax valerianellae am Saatgut Alle verwendeten Saatgutpartien sowie die neu gewonnenen Partien aus der Saatgutproduktion (siehe 2.14.3) wurden mittels verschiedener Methoden auf eine A. valerianellae-Kontamination hin untersucht. 2.15.1.1 Sweatbox-Test in der Klimakammer Für den Sweatbox-Test wurden in geschlossenen Kunststoff-Schalen zwei Liter Vermiculit ausgebracht und mit 1000 ml Wasser befeuchtet (Abb. 2.12). 5000 Samen je Saatgutpartie und Schale wurden großflächig ausgebreitet und abschließend mit einer Vermiculit-Schicht von einem Liter bedeckt. Die Schalen wurden bei nahezu 100 % rel. Luftfeuchte bei 18 °C Nacht- (12 Stunden) und 25 °C Tagtemperaturen (12 Stunden, mit Licht) für bis zu 28 Tage aufgestellt. Nach dem Auflaufen wurde eine erste Befallshäufigkeit je Schale geschätzt. Bis Versuchende (28 Tage) nach Aussaat erfolgten weitere Bonituren der Befallshäufigkeit. Pflanzen mit verdächtigen Symptomen wurden im indirekten TAS-ELISA geprüft. MATERIAL UND METHODEN 48 Abbildung 2.12: Sweatbox zum Nachweis von A. valerianellae am Saatgut. (Foto: P. Krämer) 2.15.1.2 Aufwuchstest im Gewächshaus Das auf einen A. valerianellae Befall zu überprüfende Saatgut wurde in Erdpresstöpfe ausgesät. Mit Beginn des sich entwickelnden Laubblatts (ca. drei bis vier Wochen nach der Aussaat) wurden die Pflanzen für bis zu 55 Tage bei gesättigter Luftfeuchte im Gewächshaus kultiviert. Die Pflanzen wurden visuell auf einen Befall mit A. valerianellae-Symptomen hin begutachtet (Abb. 2.13). Die Beobachtung der Befallshäufigkeit wurde bis zum Versuchende fortgeführt. Auffällige Pflanzen wurden mittels indirekten TAS-ELISA untersucht. MATERIAL UND METHODEN 49 Abbildung 2.13: Aufwuchstest im Gewächshaus zum Nachweis von A. valerianellae am Saatgut. 2.15.1.3 Ankeimmethode auf Papier 0,2 g der auf A. valerianellae-Befall zu untersuchenden Saatgutpartien wurden mit 0,3 ml Probenpuffer homogenisiert (Tag null) und eingefroren. Am gleichen Tag wurden die Samen (zu je 0,2 g) in jeweils drei Petrischalen, die zuvor mit Leitungswasser angefeuchtetem Filterpapier auslegt worden waren, ausgesät und bei Raumtemperatur (zwischen 20 °C und 22 °C) inkubiert. Nach vier, neun und 14 Tagen nach der Aussaat wurden diese Samen beziehungsweise Keimlinge mit jeweils 0,3 ml Probenpuffer homogenisiert und ebenfalls eingefroren. Eine Untersuchung der gewonnenen Proben wurde zum gleichen Zeitpunkt mittels indirektem TAS-ELISA durchgeführt, indem Proben als Zweifachbestimmung aufgetragen, gemessen und gemittelt wurden (siehe Kapitel 2.3.5). 2.15.1.4 Bestimmungen durch Fremdfirmen Die Firmen Enza Zaden und Rijk Zwaan untersuchten dankenswerterweise das Saatgut aus der Saatgutproduktion mittels dort etablierter Routineprüfungen auf einen A. valerianellae-Befall (Sweatbox-Test mit anschließender PCR verdächtiger MATERIAL UND METHODEN 50 Pflanzen mit A. valerianellae-Symptomen). Über genauere Informationen zur Methode geben die Firmen Auskunft. 2.15.2 Dekontaminationsmaßnahmen (Warmwasserbehandlung und Dampfdesinfektion) Zur Prüfung von Dekontaminationsmaßnahmen am Saatgut wurden die Samen der Sorten AV-220 (gesund), AV-17 (kontaminiert) und AV-219 (kontaminiert) bei einer Warmwasserbehandlung in einen Teebeutel verpackt und in einem Wasserbad für eine bestimmte Zeit mit einer definierten Temperatur eingetaucht (Tab. 2.5). Nach dem Tauchen wurden die Samen zunächst zwischen eine Lage Handtücher gelegt, um überschüssiges Wasser zu entfernen. Anschließend wurden die Samen bei 27 °C und ca. 30 % rel. Luftfeuchte für 24 bis 48 Stunden zurückgetrocknet. Alle Samen wurden nach erfolgter Behandlung auf ihre Keimfähigkeit hin überprüft sowie mit der Ankeimmethode auf Papier und anschließendem TAS-ELISA auf eine Reduktion beziehungsweise Eliminierung der A. valerianellae-Kontamination untersucht (siehe Kapitel 2.15.1.3). Die Interpretation der OD-ELISA-Werte wurde wie folgt durchgeführt: die Mittelwerte der Tage null der jeweiligen Behandlung wurden als Schwellenwerte für die nachfolgenden Mittelwerte der Tage vier, neun und vierzehn jeder Behandlung herangezogen. Einzelne Probenwerte (unabhängig vom Aussaattermins), die deutlich über diesem Schwellenwert lagen, galten als weiterhin A. valerianellae-positive Werte und die Probe war noch immer mit A. valerianellae belastet und nicht dekontaminiert. Des Weiteren konnte dankenswerterweise auf zwei andere Arbeitsweisen zurückgegriffen werden. Bei der ersten Methode handelte es sich um eine Dampfdesinfektionsmaßnahme des Eidgenössischen Volkswirtschaftsdepartement EVD, Forschungsanstalt Agroscope Changins-Wädenswil ACW, bei der die Samen der Sorten AV-220, AV-17 und AV-219 einer Applikationstemperatur von 66 °C für 90 beziehungsweise 105 Sekunden oder bei 64 °C für 120 beziehungsweise 150 Sekunden ausgesetzt waren. Anschließend wurden die Samen bei 25 - 28 °C für 36 Stunden rückgetrocknet. MATERIAL UND METHODEN 51 Die zweite Methode wurde von einer für Saatgut spezialisierten Firma durchgeführt. Zu der Methode können allerdings keine weiteren Angaben gemacht werden, da sie ein Betriebsgeheimnis der Firma ist. Abschließend fanden auch hier eine Überprüfung der Keimfähigkeit sowie die dekontaminierende Wirkung der Methode mittels Ankeimmethode auf Papier und TAS-ELISA statt. Tabelle 2.5: Verwendete Temperaturen (°C) und Inkubationszeiten (Minuten) bei einer Warmwasserbehandlung von Feldsalatsaatgut. Warmwasserbehandlung Temperatur (°C) Zeit (Minuten) 43 20 47 45 50 10 50 20 55 10 55 20 60 5 ERGEBNISSE 52 3 ERGEBNISSE 3.1 Untersuchungen zu Infektionsbedingungen 3.1.1 Einfluss der Temperatur auf die Infektion (in vivo) Bei den Untersuchungen wurden Feldsalatpflanzen am vierten, sechsten, zehnten und zwölften Tag nach Inokulation (dpi) bonitiert, um den Einfluss der Temperatur auf die Infektion zu erfassen (Kapitel 2.12.1). Sowohl Befallsstärke als auch Befallshäufigkeit stiegen im zeitlichen Verlauf in allen drei Temperaturvarianten an. Dabei stiegen die Befallsstärke sowie Befallshäufigkeit mit der Inkubationstemperatur an. Pflanzen, die bei 10 °C kultiviert wurden, erreichten zwölf Tage nach der Inokulation eine maximale Befallstärke von 3,3 % und eine Befallshäufigkeit von 60 %, während Pflanzen, die bei 20 °C kultiviert wurden, eine Befallstärke von 13,8 % und eine Befallshäufigkeit von 98,3 % erreichten. Zwölf Tage nach der Inokulation konnten Pflanzen, die bei 30 °C wuchsen, nicht mehr ausgewertet werden, da diese den hohen Temperaturen bei gesättigter Luftfeuchte nicht standhielten. Zehn Tage nach der Inokulation fand bei der 30 °C-Variante die letzte Bonitur statt, bei der die Pflanzen eine maximale Befallsstärke von 18,2 % und Befallshäufigkeit von 96,7 % erreichten (Abb. 3.1). In einer zweiten Wiederholung wurden lediglich die Pflanzen, die bei Temperaturen von 10 °C und 20 °C wuchsen, bonitiert. Die Pflanzen, die bei 30 °C kultiviert wurden, brachen bereits vor der ersten Bonitur zusammen und konnten somit nicht zur Auswertung herangezogen werden. Die Bonituren fanden nach zehn, 14, 19 und 25 Tagen statt. 25 dpi war bei Pflanzen, die bei 20 °C kultiviert wurden, eine Schätzung der Befallsstärke nicht mehr möglich, da sie stark mit Echtem Mehltau befallen waren. Die Befallsstärke stieg bei Pflanzen, die bei 10 °C inkubiert wurden, von 0,3 % am zehnten Tag nach der Inokulation auf 5,5 % am 25. Tag nach der Inokulation konstant an. Ebenso stieg der Wert der Symptom tragenden Blattfläche bei Pflanzen, die bei 20 °C inkubiert wurden, an. Der Anteil an Symptom tragenden Pflanzen betrug am zehnten Tag nach der Inokulation 18,3 % und stieg über die Dauer des Versuches an, wobei die Pflanzen aus dieser Gruppe an einzelnen Boniturtagen eine etwas höhere Anzahl an infizierten Pflanzen aufwiesen als die ERGEBNISSE 53 Pflanzen aus der Gruppe, die bei 10 °C inkubiert wurden (Abb. 3.2). Tendenziell verhielten sich die Ergebnisse aus der ersten und der zweiten Wiederholung gleich: Bei höheren Temperaturen waren sowohl Befallsstärken als auch Befallshäufigkeiten höher, allerdings war der Befall in der zweiten Wiederholung zeitlich deutlich verzögert gegenüber der ersten Wiederholung. Erste Symptome waren hier nicht wie bei der ersten Wiederholung bereits nach vier Tagen nach der Inokulation sichtbar, sondern erst 10 dpi. Des Weiteren war der Befall in der zweiten Wiederholung deutlich vermindert. Um zu überprüfen, wie der Einfluss von Temperaturen von 15 °C und 25 °C hinsichtlich Befallsstärke und Befallshäufigkeit auf die Infektion war, wurden Feldsalatpflanzen mit einem Isolategemisch (Konzentration 109 cfu/ml) inokuliert und bei den genannten Temperaturen unter gesättigter Luftfeuchte kultiviert. In der ersten Wiederholung wurden die Pflanzen zwischen Tag vier und Tag 14 nach der Inokulation bonitiert. Die Befallsstärke und die Befallshäufigkeit stiegen bei beiden Inkubationstemperaturen mit zunehmender Dauer unter gesättigter Luftfeuchte an, wobei erste Symptome bei Pflanzen, die bei 25 °C kultiviert wurden, vier Tage früher sichtbar waren als bei Pflanzen, die bei 15 °C kultiviert wurden. Zudem erreichten sowohl Befallsstärke als auch Befallshäufigkeit von inokulierten Pflanzen, die bei höheren Temperaturen kultiviert wurden, höhere Werte. So wurden bereits 10 dpi eine Befallsstärke von 19,7 % und eine Befallshäufigkeit von 96,7 % erreicht, im Vergleich zu 5,6 % beziehungsweise 70 % bei der niedrigeren Inkubationstemperatur von 15 °C. 14 Tage nach der Inokulation wurden lediglich die Pflanzen, die bei einer niedrigeren Temperatur kultiviert wurden, zur Auswertung herangezogen. Pflanzen, die bei 25 °C kultiviert wurden, waren 14 dpi zu stark mit Echtem Mehltau befallen und konnten nicht bonitiert werden (Abb. 3.3). In der zweiten Wiederholung wurden diese Ergebnisse weitestgehend bestätigt: Pflanzen, die bei höheren Inkubationstemperaturen kultiviert wurden, zeigten höhere Befallsstärken und Befallshäufigkeiten als Pflanzen, die bei 15 °C inkubiert wurden. Zudem lagen die Werte in dieser zweiten Wiederholung insgesamt über denen, die bei der ersten Wiederholung erreicht wurden. ERGEBNISSE 54 Vier Tage nach der Inokulation waren bei 25 °C Inkubationstemperatur auch hier die ersten Symptome sichtbar und somit zwei Tage früher als bei Pflanzen, die einer Temperatur von 15 °C ausgesetzt waren. 17 Tage nach der Inokulation waren alle Pflanzen bei einer Inkubationstemperatur von 25 °C infiziert und zeigten knapp 30 % Symptome auf der Blattfläche, während Pflanzen, die bei 15 °C kultiviert wurden, lediglich eine Befallsstärke von 15 % und eine Befallshäufigkeit von 95 % zeigten (Abb. 3.4). Die Temperatur besaß einen Einfluss auf die Infektion. Je höher die Temperatur war, bei der inokulierte Pflanzen kultiviert wurden, desto höher waren auch Befallsstärken und Befallshäufigkeiten. Beide Parameter nahmen innerhalb jeder gewählten Temperaturstufe, mit fortschreitender Dauer nach der Inokulation, zu. Es waren bei allen Temperaturstufen zwischen 10 °C und 30 °C nach der Inokulation Symptome an Feldsalatpflanzen sichtbar, eine Infektion demnach möglich. ERGEBNISSE Befallsstärke in % A 24 22 20 18 16 14 12 10 8 6 4 2 0 55 b b b ab b ab ab ab a a a 10 °C 20 °C 30 °C Inkubationstemperatur 4 dpi B 6 dpi b 100 Befallshäufigkeit in % 90 12 dpi b b b 80 70 ab ab ab 60 50 40 10 dpi a ab a a 30 20 10 0 10 °C 20 °C 30 °C Inkubationstemperatur 4 dpi 6 dpi 10 dpi 12 dpi Abbildung 3.1: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 4, 6, 10 und 12 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). Bei 30 °C konnte keine Bonitur nach zwölf Tagen vorgenommen werden, da die Pflanzen abgestorben waren. Behandlungen mit gleichen Buchstaben (Boniturtage) sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE Befallsstärke in % A 24 22 20 18 16 14 12 10 8 6 4 2 0 56 bc c b ab ab a a 10 °C 20 °C Inkubationstemperatur 10 dpi B 19 dpi 25 dpi c 100 90 Befallshäufigkeit in % 14 dpi 80 70 a b a 60 a 50 40 a a 30 20 10 0 10 °C 20 °C Inkubationstemperatur 10 dpi 14 dpi 19 dpi 25 dpi Abbildung 3.2: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 10, 14, 19 und 25 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). Bei 20 °C konnte keine Bonitur nach 25 Tagen vorgenommen werden, da die Pflanzen abgestorben waren. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten der Inkubationstemperatur von 20 °C wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). Die Daten der Inkubationstemperatur von 10 °C wurden mit dem Tukey`s HSD-Test verrechnet (p < 0,05). ERGEBNISSE A 57 35 30 Befallsstärke in % b 25 ab 20 b 15 ab b 10 a 5 a 0 15 °C 25 °C Inkubationstemperatur 4 dpi B 10 dpi 14 dpi b 100 ab b b 90 Befallshäufigkeit in % 8 dpi a 80 ab 70 60 50 40 30 20 10 a 0 15 °C 25 °C Inkubationstemperatur 4 dpi 8 dpi 10 dpi 14 dpi Abbildung 3.3: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 4, 8, 10 und 14 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). Bei 25 °C konnte keine Bonitur nach 14 Tagen vorgenommen werden, da die Pflanzen abgestorben waren. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE A 58 b 35 30 Befallsstärke in % ab 25 ab 20 c 15 ab bc abc 10 5 a ab a 0 15 °C 25 °C Inkubationstemperatur 4 dpi B b Befallshäufigkeit in % 100 90 6 dpi b 10 dpi b 12 dpi a 17 dpi a a a a 80 70 60 50 40 ab 30 20 10 a 0 15 °C 25 °C Inkubationstemperatur 4 dpi 6 dpi 10 dpi 12 dpi 17 dpi Abbildung 3.4: Einfluss der Inkubationstemperatur auf die Symptombildung von A. valerianellae (A: Befallstärke in %, B: Befallshäufigkeit in %) an Feldsalatpflanzen 4, 6, 10, 12 und 17 Tage nach Inokulation (dpi) mit A. valerianellae (Isolatemix, Konzentration 109 cfu/ml). Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 3.1.2 59 Einfluss des Blattalters und der Blattnässedauer auf die Infektion Der Einfluss des Balttalters sowie der Blattnässedauer auf die Ausprägung von Symptomen nach Inokulation von Feldsalatpflanzen mit A. valerianellae wurde in den hier vorgestellten Untersuchungen geprüft (Kapitel 2.12.2). Bei der einmaligen Kultur für 48 Stunden nach Inokulation unter gesättigter Luftfeuchte waren weder an den Keimblättern noch an den Laubblättern A. valerianellae typische Symptome erkennbar (Abb. 3.5). Bei einer wöchentlich wiederkehrenden Kultur unter gesättigter Luftfeuchte von 48 Stunden zeigten viele der inokulierten Pflanzen im Laubblattstadium Symptome. Bereits neun Tage nach der Inokulation waren 16 Pflanzen befallen und zeigten Symptome (Abb. 3.5 B). Bei Pflanzen, die im Keimblattstadium inokuliert wurden, zeigten sich 16 Tage nach der Inokulation die ersten Symptome (an zwei Pflanzen). Ein Wert von maximal vier Symptom tragenden Pflanzen wurde aber über die Dauer von 35 Tagen nicht überschritten (Abb. 3.5 A). Die Befallshäufigkeit nahm sowohl bei Pflanzen im Keimblattstadium als auch bei Pflanzen im Laubblattstadium nach 21 dpi ab und stieg bei Pflanzen im Laubblattstadium bis zu Versuchende leicht wieder an. Eine dauerhafte Abdeckung unter gesättigter Luftfeuchte hatte den größten Einfluss auf die Symptomausprägung. Pflanzen, die im Keimblattstadium inokuliert wurden, zeigten bereits nach fünf Tagen erste Symptome, wobei der Anteil an Symptom tragenden Pflanzen 12 dpi stark anstieg, 23 dpi waren alle Pflanzen befallen und zeigten Symptome (Abb. 3.5 A). Bei Pflanzen, die im Laubblattstadium inokuliert wurden, zeigten sich erste Symptome bereits nach vier Tagen und alle Pflanzen wiesen 11 dpi typische Krankheitssymptome auf (Abb. 3.5 B). ERGEBNISSE 60 A 100 b b b b b b b b b b Befallshäufigkeit in % 90 80 70 b 60 50 40 30 20 10 ab b a bb b ab a b b b a a b a b a b a b a a b a b a 0 5 8 12 14 16 19 21 23 26 28 30 33 35 bb bb bb Tage nach Inokulation einmalig b B 100 b Befallshäufigkeit in % 90 b b b b b wöchentlich dauerhaft b b b b b b b 80 70 60 b 50 40 30 20 10 ab b a b a a a a a a a a a a 0 4 6 9 11 14 16 18 21 23 25 28 32 Tage nach Inokulation einmalig wöchentlich dauerhaft Abbildung 3.5: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) zwischen 5 und 35 dpi (A) beziehungsweise zwischen 4 und 32 dpi (B) mit A. valerianellae (Isolat 709/2, 106cfu/ml) im Keimblattstadium (A) beziehungsweise Laubblattstadium (B) in Abhängigkeit der Blattnässedauer (einmalig, wöchentlich, dauerhaft). Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 61 Auch das Ergebnis aus der Versuchswiederholung zeigte bei dauerhafter Inkubation unter gesättigter Luftfeuchte einen charakteristischen Verlauf von Befallsstärke und Befallshäufigkeit. So waren nach zehn Tagen bereits 70 % der Pflanzen befallen und zeigten Symptome, 2,7 % der Blattfläche einzelner Pflanzen waren dabei mit Symptomen bedeckt. Nach 19 Tagen unter dauerhaft feuchter Kultivierung waren bereits 95 % der Pflanzen Symptom tragend, während sich die Befallsstärke vervierfacht (10,6 %) hatte. Zu Versuchende (34 dpi) waren 100 % der Pflanzen infiziert und zeigte auf 1/5 der Blattfläche (20,4 %) Symptome (Abb. 3.6). Pflanzen, die nach der Inokulation im wöchentlichen Abstand unter gesättigter Luftfeuchte kultiviert wurden, zeigten über die Dauer des Versuches (bis Tag 34 nach Inokulation) keine Symptome (Daten nicht gezeigt). Die Versuche zeigten, dass sowohl das Blattalter als auch die Dauer der Blattnässe einen Einfluss auf die Infektion haben. Pflanzen im Keim- und im Laubblattstadium wiesen nach erfolgter Inokulation keine Symptome auf, wenn die Blätter lediglich einmalig 48 Stunden nass waren. Waren die Blätter hingegen in wöchentlichem Abstand für 48 Stunden nass, so waren Symptome an Pflanzen sichtbar. Bei im Keimblattstadium inokulierten Pflanzen war dies zu einem späteren Zeitpunkt nach der Inokulation der Fall als bei Pflanzen, die im Laubblattstadium inokuliert worden waren. Die Befallshäufigkeit lag bei im Keimblattstadium inokulierten Pflanzen über die Dauer des Versuches auf einem niedrigeren Niveau als bei Pflanzen, die im Laubblattstadium inokuliert worden waren. Eine dauerhafte Kultivierung bei gesättigten Luftfeuchten führte bei allen inokulierten Pflanzen, unabhängig vom Blattalter, zu Symptomen. Der Zeitpunkt, zu dem alle Pflanzen Symptome zeigten, war jedoch bei Pflanzen im Laubblattstadium früher erreicht. ERGEBNISSE 62 ab 100 ab b ab 30 80 25 ab ab 70 AB 20 60 B 50 40 AB 30 10 AB 20 10 15 AB a 5 AB A 0 7 Befallsstärke in % Befallshäufigkeit in % 90 0 10 13 19 21 26 34 Tage nach Inokulation Befallshäufigkeit in % Befallsstärke in % Abbildung 3.6: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) sowie der Anteil befallener Blattfläche je Pflanze (Befallsstärke in %) zwischen 7 und 34 dpi mit einem A. valerianellae-Gemisch (105 cfu/ml) von Pflanzen im Laubblattstadium bei dauerhafter Kultivierung unter gesättigter Luftfeuchte. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 3.1.3 63 Einfluss der Blattnässedauer auf die Infektion beziehungsweise die Symptomentwicklung 3.1.3.1 Einfluss der Blattnässedauer auf die Symptomentwicklung Die Prüfung des Einflusses der Blattnässedauer auf die Infektion wurde mit inokulierten Feldsalatpflanzen durchgeführt (Kapitel 2.12.3.1). Je länger die erste Phase unter gesättigten Luftfeuchten dauerte, desto höher war die Befallsstärke zu Beginn der trockenen Phase von sieben Tagen (Abb. 3.7). So lag nach acht Tagen unter gesättigten Luftfeuchten die Befallsstärke bei 12,4 % (Versuchsglied 08/15; Abb. 3.7 A), während dieser Wert innerhalb von vier Tagen auf bis zu 25,1 % anstieg (nach zwölf Tagen, Versuchsglied 12/19; Abb. 3.7 C). Nach weiteren sechs Tagen (Tag 18, Versuchsglied 18/25, Abb. 3.7 E) fiel die Befallsstärke wieder auf 16,3 % zurück, war aber immer noch deutlich höher als zu Beginn nach acht Tagen nach der Inokulation. Die Werte waren zu diesen Zeitpunkten signifikant voneinander verschieden. Innerhalb der siebentägigen Phase unter trockenen Luftfeuchten blieb der Wert der Befallsstärke entweder annähernd konstant (Versuchsglied 08/15; Abb. 3.7 A) oder fiel immer schneller ab, je länger die erste Phase der Kultivierung unter gesättigter Luftfeuchte war (Abb. 3.7 B-E). Bei einer anschließenden Kultivierung unter gesättigten Luftfeuchten stiegen die Werte der Befallsstärke deutlich an, bei Versuchsglied 08/15 sogar dreimal so hoch wie zum Ende der Trockenphase. Der Anfangswert der Befallstärke wurde in den drei Versuchsgliedern 12/19, 14/22 und 18/25 trotz erneuter Kultivierung unter gesättigter Luftfeuchte nicht erneut erreicht (Abb. 3.7). Auch hier waren die Werte zu diesen Zeitpunkten signifikant voneinander verschieden, ebenso wie die Werte des Versuchsglieds 10/18 (ohne Tabelle). ERGEBNISSE 64 B Ve rsuchsglie d 08/15 Ve rsuchsglie d 10/18 40 40 35 35 30 30 Befallsstärke in % Befallsstärke in % A 25 20 15 10 25 20 15 10 5 5 0 0 8 10 12 14 15 18 22 25 28 32 10 12 14 trocken 22 trocken feucht D Ve rsuchsglied 12/19 25 28 32 40 35 35 30 30 25 20 15 10 5 feucht Ve rsuchsglied 14/22 40 Befallsstärke in % Befallsstärke in % C 18 Tage nach Inokulation Tage nach Inokulation 25 20 15 10 5 0 0 12 14 18 19 22 25 28 32 14 18 22 Tage nach Inokulation trocken 25 28 32 Tage nach Inokulation feucht trocken E feucht Ve rsuchsglied 18/25 40 35 Befallsstärke in % 30 25 20 15 10 5 0 18 22 25 28 32 Tage nach Inokulation trocken Abbildung 3.7: Auswirkungen auf die feucht Befallsstärke (in %) unterschiedlicher Kultivierungsphasen unter trockenen und feuchten Bedingungen nach Inokulation mit A. valerianellae. Die Pflanzen wurden bis 8 (A), 10 (B), 12 (C), 14 (D), und 18 (E) dpi feucht kultiviert, ab 15 (A), 18 (B), 19 (C), 22 (D), und 25 (E) dpi wurde die Hälfte der Pflanzen trocken, die andere Hälfte feucht weiterkultiviert. ERGEBNISSE 65 In dem zweiten Versuchsansatz waren 9 dpi an allen Pflanzen Symptome sichtbar. Die Anfangsbefallstärke lag dabei bei 1,6 %. Über die Dauer von 37 Tagen nach der Inokulation (davon neun Tage unter gesättigter Luftfeuchte) nahm die Befallsstärke lediglich um 1 % auf 2,6 % zu (Tab. 3.1). Wurde eine Hälfte der Pflanzen erneut bei gesättigter Luftfeuchte kultiviert, so stieg die Befallsstärke wieder an. Der Anstieg war umso höher, je länger die zweite Phase der Kultur bei gesättigter Luftfeuchte dauerte, mit Ausnahme der Pflanzen, bei denen eine kurze trockene Phase von sieben Tagen Dauer, dazwischen geschalten wurde. Auffallend war, dass selbst nach einer 28-tägigen Kultivierung unter trockenen Bedingungen die Befallsstärke anstieg. So wurde am 38. Tag nach der Inokulation eine Befallsstärke von 3,5 % beobachtet, die innerhalb von 13 Tagen (51 dpi) auf einen Wert von 4,7 % zunahm (Tab. 3.2). Eine, nach erfolgter Inokulation von Feldsalatpflanzen, erste Kultivierungsphase unter gesättigten Luftfeuchten führte mit zunehmender Dauer zu höheren Befallsstärken und bestätigte vorangegangene Ergebnisse. In einer sich daran anschließenden Phase, bei der die Pflanzen bei normal vorherrschender Luftfeuchte kultiviert wurden, blieb der Wert der Befallsstärke entweder auf dem Niveau bestehen oder fiel ab, das heißt die Schwere der Symptome war rückläufig. Bei einer sich an diese Trockenperiode anschließenden erneuten Kultivierung unter gesättigten Luftfeuchten stiegen die Werte der Befallsstärke erneut an. Deutlich sichtbare und typische A. valerianellae-Symptome an Feldsalatpflanzen wurden durch für Bakterien ungünstige, kurzfristige Bedingungen (normal vorherrschende Luftfeuchte) nicht vollständig eliminiert. Traten anschließend erneut günstige Bedingungen (gesättigte Luftfeuchte) für A. valerianellae auf, so führte dies zu einem sich fortsetzenden Krankheitsverlauf und die Befallsstärke nahm zu. Trockenperioden von bis zu 28 Tagen überlebte das Bakterium somit in Feldsalatpflanzen. ERGEBNISSE 66 Tabelle 3.1: Befallsstärke (% nekrotische Blattfläche) 9, 16, 23, 30 und 37 Tage nach Inokulation (dpi) mit einem A. valerianellae-Gemisch (Konzentration 108 cfu/ml). Bis 9 dpi erfolgte die Kultur bei gesättigter Luftfeuchte, anschließend ohne erhöhte Luftfeuchtigkeit. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). Tage nach Inokulation Befallsstärke in % Signifikanz (p < 0,05) 9 1,6 a 16 2,1 a 23 1,9 a 30 2,5 a 37 2,6 a (dpi) ERGEBNISSE 67 Tabelle 3.2: Befallsstärke (% nekrotische Blattfläche) 38, 43 und 51 Tage nach Inokulation (dpi) mit einem A. valerianellae-Gemisch (Konzentration 108 cfu/ml). Einer zu Beginn neuntägigen Kultivierung unter gesättigter Luftfeuchte folgten Phasen unterschiedlicher Dauer unter normal vorherrschenden Luftfeuchten (zwischen 7 und 28 Tagen), bevor sich eine erneute Kultur unter gesättigter Luftfeuchte anschloss. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Tukey`s HSD-Test verrechnet (p < 0,05). Tage nach Inokulation Davon Tage (dpi), davon 9 unter Tage unter normaler gesättigter Luftfeuchte Davon Tage Luftfeuchte 38 43 51 3.1.3.2 unter erneuter gesättigter Befallsstärke Signifikanz in % (p < 0,05) Luftfeuchte 7 22 9,2 ab 14 15 10,8 b 21 8 4,1 a 28 1 3,5 a 7 27 8,3 ab 14 20 11,3 b 21 13 5,9 a 28 6 4,5 a 7 35 9,2 ab 14 28 12,1 b 21 21 8,6 ab 28 14 4,7 a Einfluss der Blattnässedauer unmittelbar nach der Inokulation Inokulierte Feldsalatpflanzen wurden mit einer Blattnässedauer von bis zu 72 Stunden kultiviert (Kapitel 2.12.3.2). Die Antrocknungsdauer des Bakteriensprühnebels nach der Inokulation betrug in etwa fünf Stunden. ERGEBNISSE 68 Bei Pflanzen, die nach der Inokulation dauerhaft unter gesättigter Luftfeuchte kultiviert wurden, zeigte sich eine kontinuierlich ansteigende Befallsstärke zwischen dem neunten und 27. Tag nach der Inokulation (Abb. 3.8). So stieg diese von einem Anfangsbefall von 0,4 % (konstante Temperaturen für die ersten 96 Stunden) beziehungsweise 1,4 % (Wechseltemperaturen) auf 21 % beziehungsweise 29,9 % an. Pflanzen, die sofort nach der Inokulation unter gesättigter Luftfeuchte bei Wechseltemperaturen kultiviert wurden, zeigten eine höhere Befallsstärke, wobei der Wert sogar drei bis vier Tage früher erreicht wurde als bei Pflanzen, die zunächst bei einer konstanten Temperatur von 20 °C kultiviert wurden. So wurde beispielsweise eine Befallsstärke von 5,3 % (unter Wechseltemperaturen) am 13. Tag nach der Inokulation erreicht, während sie bei zunächst unter konstanten Temperaturen kultivierten Pflanzen erst nach 16 Tagen (5,2 %) erreicht wurde. Bei Pflanzen, die nach der Inokulation für bis zu 72 Stunden bei gesättigter Luftfeuchte kultiviert wurden und anschließend unter trockenen Bedingungen wuchsen, zeigten sich in keinem Fall Symptome (Abb. 3.9 und 3.10). Pflanzen, die nach einer jeweils wöchentlichen Trockenperiode erneut dauerhaft bei gesättigter Luftfeuchte kultiviert wurden, zeigten, unabhängig von der ersten Temperaturführung während der ersten 96 Stunden, ein einheitliches Bild: alle Pflanzen zeigten zwischen dem 20. und 27. Tag nach der Inokulation Symptome. Die Ergebnisse zeigten, dass die Temperaturführung einen gewissen Einfluss auf den zeitlichen Krankheitsverlauf inokulierter Pflanzen besaß. So wurde eine Befallshäufigkeit von 100 % unter Wechseltemperaturen schneller erreicht als bei Pflanzen, die erst nach 96 Stunden bei konstanten Temperaturen den Wechseltemperaturen ausgesetzt waren. Dies deckt sich mit den Ergebnissen von Pflanzen, die dauerhaft bei gesättigter Luftfeuchte kultiviert wurden. Die Variante ohne zusätzliche feuchte Abdeckung bei konstant 20 °C bildete hier allerdings eine Ausnahme, hier waren am Tag 20 nach der Inokulation lediglich knapp 85 % der Pflanzen Symptom tragend. Dieser Wert ging innerhalb von weiteren sieben Tagen unter gesättigter Luftfeuchte sogar auf 82 % zurück (Abb. 3.10). Aus den Ergebnissen wurde deutlich, dass eine Blattnässedauer unter gesättigter Luftfeuchte einen großen Einfluss auf inokulierte Pflanzen und deren Befallsausprägung besitzt, wobei bereits eine Dauer von ca. 5 Stunden für das ERGEBNISSE 69 Antrocknen des Sprühfilms nach Inokulation für eine Infektion ausreichend war und die Infektion nicht durch eine siebentägige Trockenperiode gestoppt wurde. c 27 dpi c bc Tage nach Inokulation 23 dpi bc abc 20 dpi abc abc 16 dpi abc ab 13 dpi ab a 9 dpi a 0 10 20 30 40 Befallsstärke in % Wechseltemperaturen konstante Temperaturen für die ersten 96 Stunden Abbildung 3.8: Befallsstärke (%) zwischen Tag 9 und Tag 27 nach der Inokulation (dpi) mit einem A. valerianellae-Gemisch (Konzentration 108 cfu/ml) unter dauerhafter Kultivierung bei gesättigten Luftfeuchten. Die Pflanzen wurden entweder sofort Wechseltemperaturen (15 °C Nacht, 20 °C Tag) ausgesetzt beziehungsweise für die ersten 96 Stunden nach der Inokulation bei konstant 20 °C kultiviert. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 70 Befallshäufigkeit in % ohne zusätzliche feuchte Inkubation nach Inokulation a a 100 90 80 70 60 50 40 30 20 10 0 a a 23 27 a a 9 13 16 20 Tage nach Inokulation trocken a a 9 13 9 Stunden feuchte Inkubation nach Inokulation a a a a a Befallshäufigkeit in % Befallshäufigkeit in % 6 Stunden feuchte Inkubation nach Inokulation a a a 100 90 80 70 60 50 40 30 20 10 0 feucht 16 20 23 100 90 80 70 60 50 40 30 20 10 0 27 a 9 13 Tage nach Inokulation trocken feucht trocken Befallshäufigkeit in % Befallshäufigkeit in % 13 16 20 23 100 90 80 70 60 50 40 30 20 10 0 27 9 13 16 20 Befallshäufigkeit in % 20 23 a 27 23 27 feucht 72 Stunden feuchte Inkubation nach Inokulation a a a a 100 90 80 70 60 50 40 30 20 10 0 a a a 9 Tage nach Inokulation trocken 16 trocken Befallshäufigkeit in % 13 feucht a feucht a 9 27 Tage nach Inokulation 48 Stunden feuchte Inkubation nach Inokulation a a a a 100 90 80 70 60 50 40 30 20 10 0 23 a Tage nach Inokulation trocken 20 24 Stunden feuchte Inkubation nach Inokulation a a a a a 9 16 Tage nach Inokulation 12 Stunden feuchte Inkubation nach Inokulation a a a a 100 90 80 70 60 50 40 30 20 10 0 a feucht 13 16 20 23 27 Tage nach Inokulation trocken feucht Abbildung 3.9: Auswirkungen unterschiedlich langer Kultivierungsphasen bei gesättigter Luftfeuchte nach Sprühinokulation mit A. valerianellae (zwischen null und 72 Stunden plus 5 Stunden Antrocknungsdauer) auf die Befallsentwicklung bei Feldsalat. Versuch A. Nach einer sich an die Inokulation jeweils anschließenden Trockenphase von 7 Tagen wurde die Befallshäufigkeit (in %) ab dem neunten Tag bis zum 27. Tag nach der Inokulation unter gesättigten Luftfeuchte-Bedingungen („feucht“) und normalen Luftfeuchte-Bedingungen („trocken“) erhoben. Die Kultivierung der Pflanzen erfolgte in der Klimakammer bei Wechseltemperaturen (20 °C Tag, 15 °C Nacht) mit 16 Stunden Licht. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 71 Befallshäufigkeit in % ohne zusätzliche feuchte Inkubation nach Inokulation a 100 90 80 70 60 50 40 30 20 10 0 a a a a a 9 13 16 20 23 27 Tage nach Inokulation trocken a 9 13 16 20 9 Stunden feuchte Inkubation nach Inokulation a a a a a Befallshäufigkeit in % Befallshäufigkeit in % 6 Stunden feuchte Inkubation nach Inokulation a a a a 100 90 80 70 60 50 40 30 20 10 0 feucht 23 100 90 80 70 60 50 40 30 20 10 0 27 a 9 13 16 Tage nach Inokulation trocken feucht trocken Befallshäufigkeit in % Befallshäufigkeit in % 13 16 20 23 100 90 80 70 60 50 40 30 20 10 0 13 20 23 27 23 feucht 72 Stunden feuchte Inkubation nach Inokulation a a a a 100 90 80 70 60 50 40 30 20 10 0 27 a a a 9 13 16 Tage nach Inokulation trocken 20 trocken a 16 16 feucht a 13 a Tage nach Inokulation 48 Stunden feuchte Inkubation nach Inokulation a a a 9 feucht a 9 27 Befallshäufigkeit in % Befallshäufigkeit in % 100 90 80 70 60 50 40 30 20 10 0 27 a Tage nach Inokulation trocken 23 24 Stunden feuchte Inkubation nach Inokulation a a a a a 9 20 Tage nach Inokulation 12 Stunden feuchte Inkubation nach Inokulation a a a a 100 90 80 70 60 50 40 30 20 10 0 a 20 23 27 Tage nach Inokulation feucht trocken feucht Abbildung 3.10: Auswirkungen unterschiedlich langer Kultivierungsphasen bei gesättigter Luftfeuchte nach Sprühinokulation mit A. valerianellae (zwischen null und 72 Stunden plus 5 Stunden Antrocknungsdauer) auf die Befallsentwicklung bei Feldsalat. Versuch B. Nach einer sich daran jeweils anschließenden Trockenphase von 7 Tagen wurde die Befallshäufigkeit (in %) ab dem neunten Tag bis zum 27. Tag nach der Inokulation unter gesättigten Luftfeuchte-Bedingungen („feucht“) und normalen Luftfeuchte-Bedingungen („trocken“) erhoben. Die Kultivierung der Pflanzen erfolgte in der Klimakammer bei Wechseltemperaturen (20 °C Tag, 15 °C Nacht) mit 16 Stunden Licht, wobei die erste Kultivierungsphase (96 Stunden nach der Inokulation) bei konstant 20 °C erfolgte. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden (p < 0,05). mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet ERGEBNISSE 3.1.4 72 Einfluss der Inokulumdichte auf die Infektion Die Versuche zum Einfluss der Inokulumdichte auf die Infektion sollten zeigen, ob eine Infektion auch bei schwachen Inokulumkonzentrationen möglich ist und wann erste Symptome auftreten (Kapitel 2.12.4). Das Auftreten erster Symptome war sowohl vom verwendeten Isolat als auch von der Konzentration der Isolate abhängig (Tab. 3.3). Mit kleinen Abweichungen waren generell bei höheren Konzentrationen Symptome eher sichtbar als bei niedrigeren Konzentrationen. Das Isolat 16619 zeigte bei einer Konzentration von 107 cfu/ml eine schwächere Aggressivität als die Isolate 6.1.a und 552, da hier nicht bereits nach fünf Tagen Symptome sichtbar waren, sondern erst nach sieben Tagen. Sichtbare Symptome waren allerdings bei einer Konzentration von 104 cfu/ml bereits nach fünf Tagen vorhanden. Bei niedrigeren Konzentration von 102 cfu/ml war das Isolat 552 aggressiver (12 Tage nach Inokulation erste Symptome) als die Isolate 6.1.a und 16619 (19 Tage nach Inokulation erste Symptome). Das Ergebnis des Einflusses der Inokulumdichte auf die Infektion zeigte einen für Inokulumdichten typischen Gradienten in Hinblick auf den Anteil an befallenen Pflanzen. Dies gilt für alle drei verwendeten Isolate (Abb. 3.11). Die Häufigkeit der Symptomausprägung war, mit kleinen Abweichungen, umso höher, je höher die Konzentration des A. valerianellae-Inokulms war. So zeigten bei der geringen Inokulumkonzentration von 102 cfu/ml zwischen 15 % und 35 % der Pflanzen Symptome (19 Tage nach der Inokulation), während bei der hohen 7 Inokulumkonzentration von 10 cfu/ml zum gleichen Zeitpunkt 85 % bis 100 % der Pflanzen Symptome aufwiesen. Mit zunehmender Zeit nach der Inokulation waren mehr Symptom tragende Pflanzen auch bei kleineren Konzentrationen vorhanden, was sich durch die Vermehrung von A. valerianellae in der Pflanze beziehungsweise der Ausbreitung zwischen den Pflanzen eines Versuchsglieds erklären lässt. ERGEBNISSE 73 Tabelle 3.3: Auftreten erster Symptome (in Tagen) nach Inokulation einzelner A. valerianellaeIsolate in Abhängigkeit von der Konzentration. Erste sichtbare Symptome (in Tagen) nach Inokulation in Abhängigkeit der verwendeten Konzentration 102 103 104 105 106 107 cfu/ml cfu/ml cfu/ml cfu/ml cfu/ml cfu/ml 6.1.a 19 7 7 7 12 5 16619 19 12 5 7 7 7 552 12 12 7 7 5 5 Isolat ERGEBNISSE 74 A b b b b B 80 b b b 70 60 50 ab ab ab 40 30 a 20 10 a a a ab a a ab ab ab a a 103 70 5 dpi 7 dpi 12 dpi b 60 ab 50 106 a 20 107 ab a a a 0 a a 102 103 b b b a 80 ab a 104 105 Verdünnungsstufe in cfu/ml 7 dpi 12 dpi a 106 a 107 19 dpi b b ab b 70 a ab 90 Befallshäufigkeit in % a 5 dpi 100 ab 30 19 dpi C ab ab 40 10 a a 104 105 Verdünnungsstufe in cfu/ml b b 80 0 102 b b 90 Befallshäufigkeit in % Befallshäufigkeit in % 90 ab b 100 ERGEBNISSE 100 60 50 a 40 a ab a 30 ab 20 10 a a a a a a ab a a a 0 2 10 3 10 4 10 105 Verdünnungsstufe in cfu/ml 5 dpi 7 dpi 12 dpi 106 107 19 dpi Abbildung 3.11: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) zwischen Tag fünf und Tag 19 nach der Inokulation (dpi) mit sechs verschiedenen Konzentrationen zwischen 102 cfu/ml und 107 cfu/ml des A. valerianellae-Isolates 6.1.a (A), 16619 (B), 552 (C). Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). 74 ERGEBNISSE 75 3.2 Untersuchungen zur Sortenanfälligkeit 3.2.1 Einfluss der Sorte auf die Infektion In den Untersuchungen zum Einfluss der Sorte auf die Infektion wurden elf Sorten unterschiedlicher Züchter sowie zwei Hobbyanbausorten und die resistente Wildart V. rimosa (AV-13) auf ihre Anfälligkeit gegenüber A. valerianellae untersucht (Kapitel 2.13.1). Alle Sorten zeigten in der ersten Wiederholung bei Temperaturen zwischen 13 °C und 24 °C einen deutlichen Befall und wiesen charakteristische Symptome mit 3 % bis 10 % befallener Blattfläche auf (Abb. 3.12). Die Befallshäufigkeiten lagen zwischen 70 % und 98 % (Abb. 3.13). Sowohl die Befallsstärken als auch die Befallshäufigkeiten wiesen dabei signifikante Sortenunterschiede auf. So waren die Sorten AV-3, AV-5, AV-6, AV-14, AV-4, AV-2, AV-7, AV-9 und AV-8 bezüglich der Befallsstärke deutlich von den stärker befallenen Sorten AV-12, AV-11, AV-10 und AV-15 zu unterscheiden. Die Sorten AV-3 und AV-5 waren bezüglich der Befallshäufigkeit signifikant zu den übrigen Sorten unterschiedlich. Alle Sorten waren jedoch anfällig für A. valerianellae. Lediglich die Wildform AV-13 zeigte keine Symptome. Die Ergebnisse aus der ersten Wiederholung wurden in einem zweiten Versuch bei etwas höheren Temperaturen von 20 °C bis 29 °C bestätigt. Die Befallsstärken (zwischen 2 % und 9 %) und Befallshäufigkeiten (zwischen 38 % und 91 %) lagen etwas niedriger als im ersten Versuchsansatz. Sortenunterschiede waren wiederum sichtbar und die Wildform AV-13 zeigte auch hier wieder keine sichtbaren Symptome. Deutlich signifikante Unterschiede in der Befallsstärke und der Befallshäufigkeit zeigten, wie bereits in der ersten Wiederholung, die Sorten AV-3, AV-5, AV-14 und AV-4 im Gegensatz zu der anfälligen Sorte AV-15 (Abb. 3.12 und Abb. 3.13). ERGEBNISSE 76 20 18 Befallsstärke in % 16 14 aa 12 10 bc 8 6 cd 4 2 bc bcabc bc bc ab ab bc abc bc bc ab abc bc abc abc ab abc bc abc bc c dd A V13 A V3 A V5 A V6 A V14 A V4 A V2 A V7 A V9 A V8 A V12 A V11 A V10 A V15 0 Sorte 1. Versuch, 13 °C - 24 °C 2. Versuch, 20 °C - 29 °C Abbildung 3.12: Befallsstärke (% nekrotische Blattfläche je Pflanze) von unterschiedlichen Feldsalatsorten 18 Tage nach Inokulation eines A. valerianellaeGemisches (Konzentration 106 cfu/ml). Der Versuch wurde bei 13 °C – 24 °C (1. Versuch) und bei 20 °C – 29 °C (2. Versuch) durchgeführt. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 77 100 bc 90 c bc 80 Befallshäufigkeit in % abc abc abc abc abc ababc ab ab abc a a ab abc ab ababc ab abc abc bc 70 bc 60 c 50 40 30 20 10 dd A V13 A V3 A V5 A V6 A V14 A V4 A V2 A V7 A V9 A V8 A V12 A V11 A V10 A V15 0 Sorte 1. Versuch, 13 °C - 24 °C Abbildung 3.13: Anteil an befallenen 2. Versuch, 20 °C - 29 °C Pflanzen (Befallshäufigkeit in %) bei unterschiedlichen Feldsalatsorten 18 Tage nach Inokulation eines A. valerianellaeGemisches (Konzentration 106 cfu/ml). Der Versuch wurde bei 13 °C – 24 °C (1. Versuch) und bei 20 °C – 29 °C (2. Versuch) durchgeführt. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). 3.2.2 Einfluss der Sorte und des Isolates auf die Infektion Es wurden die Interaktionen zwischen A. valerianellae-Isolaten verschiedener Herkünfte einerseits und andererseits zwischen zweier Sorten und einer Wildart (V. rimosa) bezüglich der Symptomausprägung geprüft (Kapitel 2.13.2). V. rimosa konnte wie in den Versuchen zum Einfluss der Inokulumdichte auf die Infektion (Kapitel 3.1.4) und zum Einfluss der Sorte auf die Infektion (Kapitel 3.2.1) nicht infiziert werden (Tab. 3.4, Abb. 3.14, Tab. 3.5, Abb. 3.15, Abb. 3.16, Abb. 3.17), so dass sie als resistent gelten kann. Die Isolate 16619 und IV2 wurden dabei mit einer niedrigen Konzentration von 104 cfu/ml aufgesprüht und führten insgesamt zu sehr geringen Befallsstärken zwischen 0,1 % (Isolat IV2) und 0,3 % (Isolat 16619) an den drei Feldsalatsorten AV-1, AV-5 und AV-3 (Tab. 3.4). Bei der Sorte AV-3 waren nach Inokulation mit ERGEBNISSE 78 dem Isolat IV2 zudem keine sichtbaren Symptome vorhanden (Tab. 3.5). Die Befallshäufigkeiten lagen zwischen 2 % und 22 % (Abb. 3.14). Aufgrund eines starken Befalls mit Echtem Mehltau konnte nur eine sehr kleine Pflanzenmenge bonitiert werden. Dies erklärt das Fehlen der statistischen Auswertung für die Isolate 16619 und IV2 mit der geringeren Konzentration von 104 cfu/ml. Nach Inokulation mit einer Konzentration von 106 cfu/ml (Isolate: 6.1.a, 553) lag der Anteil an befallener Blattfläche je Pflanze zwischen 0,8 % und 4 % (Tab. 3.5), die Befallshäufigkeiten lagen zwischen 50 % und 92 % (Abb. 3.15). Mit steigender Konzentration der Bakterienisolate 6.1.a und 553 war die Sorte AV-3 weniger anfällig in Bezug auf Befallsstärke und Befallshäufigkeit als die Sorten AV-1 und AV-5. Die Ergebnisse wurden in einem zweiten Versuch bei einer weiter auseinander liegenden Temperaturspanne zwischen 2 °C bis 45 °C weitestgehend bestätigt, obwohl die Isolate mit einer höheren (Isolate 16619 und IV2) beziehungsweise niedrigeren Konzentration (Isolate 6.1.a und 553) von 105 cfu/ml inokuliert wurden. Auch hier zeigte sich die Sorte AV-3 als etwas weniger anfällig gegenüber A. valerianellae und eine maximale Befallsstärke von 9 % (Isolat IV2) wurde nicht überschritten (Abb. 3.16). Die Befallsstärken der Sorten AV-1 und AV-5 lagen zwischen knapp 3 % und 19 %, während die Befallshäufigkeiten zwischen 79 % und 100 % lagen (Abb. 3.17). Vermutlich aufgrund der höheren Temperaturen im zweiten Versuch lagen auch die Befallsstärke und Befallshäufigkeit deutlich höher als im ersten Versuchsansatz. Die Isolate variierten in der Virulenz. Nach Inokulation geringerer 4 Bakterienkonzentrationen (10 cfu/ml) war das Isolat 16619 aggressiver als das Isolat IV2, während sich die Aggressivität bei höheren Bakterienkonzentrationen (105 cfu/ml) umkehrte. Die höhere Aggressivität des Isolates 553 bestätigte sich sowohl nach Inokulation mit einer Konzentration von 106 cfu/ml als auch bei etwas geringeren Konzentrationen (105 cfu/ml). Die Versuche zeigten, dass eine Infektion mit sichtbaren Symptomen an Feldsalatpflanzen nicht ausschließlich von der verwendeten Isolatkonzentration abhängig war, sondern auch vom verwendeten ERGEBNISSE 79 Isolat selber, so dass die Verwendung eine Isolategemisches zur Inokulation zur Vermeidung von Isolat-Sorten-Interaktionen von Vorteil ist. Tabelle 3.4: Anteil an befallener Blattfläche je Pflanze (Befallsstärke in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (16619, IV2) mit einer Konzentration von 104 cfu/ml bei Kultur unter gesättigter Luftfeuchte. Befallsstärke (in %) Sorte Isolat 16619 Isolat IV2 AV-1 0,34 0,08 AV-5 0,31 0,02 AV-3 0,28 0 AV-13 0 0 ERGEBNISSE 80 100 Befallshäufigkeit in % 90 80 70 60 50 40 30 20 10 0 16619 AV IV2 2 Isolat AV-1 AV-5 AV-3 AV-13 Abbildung 3.14: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) von drei Feldsalatsorten (AV-1, AV-5, AV-3) und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (16619, IV2) mit einer Konzentration von 104 cfu/ml bei Kultur unter gesättigter Luftfeuchte. ERGEBNISSE 81 Tabelle 3.5: Anteil an befallener Blattfläche je Pflanze (Befallsstärke (BS) in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellae-Isolate (6.1.a, 553) mit einer Konzentration von 106 cfu/ml und Kultivierung unter gesättigter Luftfeuchte. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). Isolat 6.1.a Isolat 553 Sorte BS (%) Signifikanz (p < 0,05) BS (%) Signifikanz (p < 0,05) AV-1 1,35 b 3,95 c AV-5 1,51 b 2,52 bc AV-3 0,79 a 1,74 b AV-13 0 a 0 a ERGEBNISSE 82 100 b Befallshäufigkeit in % 90 80 b b b b 70 b 60 50 40 30 20 10 a a 0 6.1.a 553 Isolat AV-1 AV-5 AV-3 AV-13 Abbildung 3.15: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation zweier A. valerianellaeIsolate (6.1.a, 553) mit einer Konzentration von 106 cfu/ml und Kultivierung unter gesättigter Luftfeuchte. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). Befallsstärke in % ERGEBNISSE 24 22 20 18 16 14 12 10 8 6 4 2 0 83 c c b bc b b c b b a a b a 6.1.a a a 553 16619 a AV2 IV2 Isolat AV-1 AV-5 AV-3 AV-13 Abbildung 3.16: Anteil an befallener Blattfläche je Pflanze (Befallsstärke in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation von vier A. valerianellae-Isolaten (6.1.a, 553, 16619, IV2) mit einer Konzentration von 105 cfu/ml und Kultivierung unter gesättigter Luftfeuchte. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE 100 Befallshäufigkeit in % 90 84 c b b b bc b b b b b b b 80 70 60 50 40 30 20 10 a a a a 0 6.1.a 553 16619 IV2 AV2 Isolat AV-1 AV-5 AV-3 AV-13 Abbildung 3.17: Anteil an befallenen Pflanzen (Befallshäufigkeit in %) von drei Feldsalatsorten und der Wildart AV-13 16 Tage nach Inokulation von vier A. valerianellaeIsolaten (6.1.a, 553, 16619, IV2) mit einer Konzentration von 105 cfu/ml und Kultivierung unter gesättigter Luftfeuchte. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). 3.2.3 Einfluss der Inokulumdichte und der Sorte auf die Infektion In Versuchen zum Einfluss der Inokulumdichte und der Sorte auf die Infektion (Kapitel 2.13.3) konnte aufgrund eines starken Befalls mit Echtem Mehltau nur eine sehr kleine Pflanzenmenge bonitiert werden. Dies erklärt das Fehlen der statistischen Auswertung. Das Ergebnis zeigte 9 dpi einen für Inokulumdichten typischen Gradienten in Hinblick auf die Befallshäufigkeit. Die Häufigkeit der Symptomausprägung war, mit kleinen Abweichungen, umso höher, je höher die verwendete Konzentration des A. valerianellae-Inokulums war. Die Wildart AV-13 zeigte, auch nach Inokulation mit einer hohen Bakterienkonzentration, keine Symptome (Abb. 3.18). Nach Inokulation mit der höchsten Konzentration von 106 cfu/ml zeigten sich lediglich am ersten und am zweiten Boniturtermin (7 dpi und 9 dpi) Unterschiede in ERGEBNISSE 85 der Befallshäufigkeit. 13 und 20 Tagen nach der Inokulation zeigten alle Pflanzen der Sorten Symptome. Zwischen den Feldsalatsorten AV-1 und AV-5 waren keine großen Sortenunterschiede zu erkennen (Abb. 3.19). 100 90 Befallshäufigkeit in % 80 70 60 50 40 30 20 10 0 102 103 104 105 106 Verdünnungsstufe in cfu/ml AV-13 AV-1 AV-5 Abbildung 3.18: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) von zwei verschiedenen Feldsalatsorten und der Wildart AV-13 neun Tage nach Inokulation eines A. valerianellae-Isolategemisches mit fünf verschiedenen Konzentrationen zwischen 102 cfu/ml und 106 cfu/ml. ERGEBNISSE 86 100 Befallshäufigkeit in % 90 80 70 60 50 40 30 20 10 0 AV-13 AV-1 AV-5 Sorte 7 dpi 9 dpi 13 dpi 20 dpi Abbildung 3.19: Anteil Symptom tragender Pflanzen (Befallshäufigkeit in %) von zwei verschiedenen Feldsalatsorten (AV-1 und AV-5) und der Wildart AV-13 zwischen Tag sieben und Tag 20 nach Inokulation (dpi) eines A. valerianellae-Isolategemisches mit einer Konzentrationen von 106 cfu/ml. ERGEBNISSE 3.3 87 Infektionsversuche von Acidovorax valerianellae zu Übertragungswegen 3.3.1 Boden Ziel des Versuches war es herauszufinden, ob das Bakterium A. valerianellae im Boden überdauern kann und wie lange es infektiös ist. Durch die Einarbeitung gesunder und mit A. valerianellae-infizierter Feldsalatblätter in den Boden und die anschließende Einsenkung ins Erdreich (Freiland) erfolgte unter annähernd natürlichen Bodenverhältnissen die Umsetzung beziehungsweise der Abbau von Pflanzenmaterial (siehe Kapitel 2.14.1). Nach Aussaat von gesundem Saatgut in Proben von Böden, in die zuvor gesundes Feldsalat-Blattmaterial eingearbeitet wurde, zeigten sich über die Dauer des einjährigen (Schifferstadt) beziehungsweise achtmonatigen (Quedlinburg) Versuches keine A. valerianellae-Symptome an Feldsalatpflanzen (nicht dargestellt). In der ersten Zeit nach Beginn der monatlichen Probennahme von mit A. valerianellae-infizierten Feldsalat-Blattmaterial durchmischten Böden und anschließender Aussaat von gesundem Saatgut in diese Böden wurde ein A. valerianellae-Befall sowohl in Schifferstadt als auch in Quedlinburg festgestellt. Die Symptome zu Beginn der Untersuchungen waren in beiden Fällen mit 28,3 % an Symptom tragenden Pflanzen im Monat September 2009 (Tab. 3.6) und 100 % im Monat März 2010 (Tab. 3.7) am höchsten und nahmen innerhalb von drei Monaten nahezu konstant ab. So zeigten sich am Standort Schifferstadt einen Monat nach Versuchsbeginn mit 28,3 % genauso viele Symptom tragende Pflanzen wie direkt nach der Einarbeitung von infiziertem Blattmaterial in den Boden (September 2009) mit anschließender Aussaat. Bei Pflanzen, die zwei Monate nach Versuchbeginn ausgesät wurden, zeigte sich ein Befall an einem Fünftel aller Pflanzen (20,2 % Symptom tragende Pflanzen), während einen Monat später (3. Monat nach Kontamination) nur noch 8,4 % der Pflanzen A. valerianellae-Symptome aufwiesen. Aussaaten nach vier beziehungsweise fünf Monaten zeigten zunächst bei 1,6 % der Pflanzen A. valerianellae-verdächtige Symptome, ein A. valerianellae-Befall konnte ERGEBNISSE 88 allerdings im anschließenden TAS-ELISA nicht bestätigt werden (Tab. 3.6). Ebenso verhielt es sich bei Pflanzen mit verdächtigen Symptomen (11,1 %), die im 9. Monat nach Kontamination ausgesät worden waren. Auch hier wurde A. valerianellae an den verdächtigen Pflanzen nicht nachgewiesen. Pflanzen aus dem 10. Monat zeigten keine Symptome, während im 11. Monat an 4,5 % der gewachsenen Pflanzen untypische A. valerianellae-Symptome vorhanden waren, die sich nach TAS-ELISAUntersuchung als positiv erwiesen. Zu Versuchende (September 2010) waren keine Symptome an Pflanzen sichtbar. Am Standort Quedlinburg konnte zu Beginn der Untersuchungen im März 2010 lediglich eine Pflanze beobachtet und näher untersucht werden. A. valerianellae wurde an dieser Pflanze visuell ermittelt und im TAS-ELISA bestätigt. Pflanzen, die ein, zwei und drei Monate nach Kontamination des Bodens ausgesät wurden, zeigten einen Befall von 60 % (1. Monat), 41,6 % (2. Monat) und 50 % (3. Monat), der im TAS-ELISA bestätigt wurde. Pflanzen, die in den Bodenproben sechs beziehungsweise sieben Monate nach Kontamination ausgesät worden waren, zeigten untypische A. valerianellae-Symptome und ein A. valerianellae-Befall wurde nicht nachgewiesen (Tab. 3.7). Zu Versuchende (November 2010) waren hier keine Symptome an Pflanzen sichtbar. An beiden Standorten herrschten zum Zeitpunkt der Versuche unterschiedliche Klimabedingungen. In Schifferstadt wurde der Versuch im September 2009 begonnen, in Quedlinburg im März 2010, so dass unterschiedliche Temperatur- und Niederschlagswerte vorlagen (Tab. 3.8). A. valerianellae konnte in diesen Versuchen bis zu elf Monate im Boden überdauern und eine neue Feldsalatkultur befallen. ERGEBNISSE 89 Tabelle 3.6: Anteil symptomtragender Pflanzen (%) und TAS-ELISA-Nachweis von A. valerianellae in Symptom tragenden Pflanzen. Die Pflanzen wurden zu verschiedenen Zeiten (über ein Jahr) in zuvor durch Einarbeitung von befallenem A. valerianellae-Pflanzenmaterial kontaminierten Boden gesät (Standort Schifferstadt). Zeit nach Einarbeitung Symptom tragende Pflanzen in % TAS-ELISA-Nachweis von A. valerianellae Start (September 2009) 28,3 positiv 1. Monat 28,3 positiv 2. Monat 20,2 positiv 3. Monat 8,4 positiv 4. Monat 1,6 (untypisch) negativ 5. Monat 1,6 (untypisch) negativ 6. Monat 0 negativ 7. Monat 0 negativ 8. Monat 0 negativ 9. Monat 11,1 (untypisch) negativ 10. Monat 0 negativ 11. Monat 4,5 (untypisch) positiv Ende (September 2010) 0 negativ ERGEBNISSE 90 Tabelle 3.7: Anteil symptomtragender Pflanzen (%) und TAS-ELISA-Nachweis von A. valerianellae in Symptom tragenden Pflanzen. Die Pflanzen wurden zu verschiedenen Zeiten (über acht Monate) in zuvor durch Einarbeitung von befallenem A. valerianellaePflanzenmaterial kontaminierten Boden gesät (Standort Quedlinburg). Zeit nach Einarbeitung Symptom tragende Pflanzen in % TAS-ELISA-Nachweis von A. valerianellae Start (März 2010) 100 (eine gewachsene Pflanze) positiv 1. Monat 60 positiv 2. Monat 41,6 positiv 3. Monat 50 positiv 4. Monat 53,8 positiv 5. Monat 26,6 positiv 6. Monat 7,7 (untypisch) negativ 7. Monat 4 (untypisch) negativ Ende (November 2010) 0 negativ ERGEBNISSE 91 Tabelle 3.8: Temperaturwerte (in 2 Meter Höhe) und Niederschlagswerte im Monatsmittel im Zeitraum von September 2009 bis September 2010 in Schifferstadt und von März 2010 bis November 2010 in Quedlinburg. Quelle Schifferstadt: Dienstleistungszentren Ländlicher Raum Rheinland Pfalz, Agrarmeteorologie Quelle Quedlinburg: Julius Kühn-Institut Standort Schifferstadt Jahr 2009 2010 Monat Standort Quedlinburg Temperatur Niederschlag Temperatur Niederschlag (°C) (mm) (°C) (mm) September 17 30,3 Oktober 10,8 42,7 November 9,2 56,2 Dezember 2,9 84,8 Januar -0,8 21,7 Februar 2,6 28,5 März 6,9 25,1 4,9 26,4 April 11,9 30,1 8,6 24,2 Mai 13,1 123,1 10,3 142,2 Juni 19,4 68,2 16,2 35,6 Juli 22,5 48,3 20,6 60,8 August 18,7 125,3 17,5 104 September 14,1 54 13,1 127,8 Oktober 9 25,8 November 5 93,1 ERGEBNISSE 92 3.3.2 Alternative Wirtspflanzen 3.3.2.1 Alternative Wirtspflanzen I Die Untersuchungen wurden mit Pflanzen aus zehn Familien (Amaranthaceae, Asteraceae, Brassicaceae, Caryophyllaceae, Fabaceae, Hydrophylloideae, Lamiaceae, Plantaginaceae, Poaceae und Potulaceae) und Feldsalat als anfälligem Standard durchgeführt. Zur Inokulation dieser Pflanzen wurden verschiedene Verfahren (Infiltration und Sprühinokulation) eingesetzt (siehe Kapitel 2.14.2). Bei den Kontrollpflanzen waren über die Dauer des Versuches keinerlei Veränderungen an den Pflanzen durch die Inokulation zu erkennen (nicht dargestellt). Nach Infiltration mit einer A. valerianellae-Suspension in einzelne Blätter zeigten mehrere Blattbereiche 20 Tage nach Inokulation (dpi) unterschiedliche Reaktionen im Vergleich zur Kontrolle in Form von feuchten, aufgehellten oder nekrotischen Blattveränderungen. Feldsalatpflanzen zeigten dabei die für A. valerianellae typischen Symptome. Diese Veränderungen waren bei Amaranthus retroflexus (L.), Chenopodium album (L.), Lactuca sativa (L.) (Batavia-Salat und Eissalat), Senecio vulgaris (L.), Brassica rapa ssp. pekinensis (Lour.) Hanelt, Capsella bursa-pastoris (L.) Medik., Stellaria media (L.) Vill., Lamium album (L.), Plantago major (L.) und Veronica persica (Poir.) sichtbar. Keine sichtbaren Veränderungen an infiltrierten Blattbereichen waren zum gleichen Zeitpunkt (20 dpi) bei Chenopodium hybridum (L.), Phaseolus vulgaris (L.), Pisum sativum (L.), Eleusine coracana (L.) Gaertn. und Portulaca oleracea (L.) vorhanden. Auch nach Sprühinokulation kam es zu Veränderungen im Blattgewebe. Behandelte Pflanzen zeigten an besprühten Blattbereichen nach sieben Tagen bereits Auffälligkeiten durch diese Inokulation. Bei Chenopodium album (L.) und Lactuca sativa (L.) (Batavia-Salat und Eissalat) waren dunkle Verfärbungen auf der Blattspreite zu erkennen, die teilweise mit schwarzen Rändern zum gesunden Gewebe abgegrenzt waren. Außerdem waren bei Matricaria chamomilla (L.) und Senecio vulgaris (L.) aufgehellte Blattbereiche 13 dpi sichtbar. Die Pflanzen mit auffälligen Blattbereichen waren vor allem nach Sprühinokulation zu finden und besonders bei Arten aus der Familie der Asteraceae (Tab. 3.9). ERGEBNISSE 93 Tabelle 3.9: Krankheitssymptome nach Infiltration und Sprühinokulation mit A. valerianellae (Konzentration 108 cfu/ml) sieben, 13 und 20 dpi bei verschiedenen Pflanzenarten. + = feuchte, aufgehellte oder nekrotische Blattveränderungen - = keine Krankheitssymptome erkennbar Inokulierte Pflanze Familie Valerianaceae Art Valerianella locusta (L.) Amaranthus retroflexus (L.) Amaranthaceae Chenopodium hybridum (L.) Chenopodium album (L.) Lactuca sativa (L.) (Batavia-Salat) Lactuca sativa (L.) (Eissalat) Krankheitssymptome nach Inokulation an Blättern Infiltration Sprühinokulation (20 dpi) (7 und 13 dpi) + + + - - - + + + + + + nicht infiltriert + + + + - + - + - Asteraceae Matricaria chamomilla (L.) Senecio vulgaris (L.) Brassica rapa ssp. pekinensis (Lour.) Brassicaceae Hanelt Capsella bursapastoris (L.) Medik. Caryophylloideae Stellaria media (L.) Vill. ERGEBNISSE 94 Fortsetzung Tab. 3.9 Inokulierte Pflanze Familie Art Phaseolus vulgaris (L.) Krankheitssymptome nach Inokulation an Blättern Infiltration Sprühinokulation (20 dpi) (7 und 13 dpi) - - - - nicht infiltriert - + - + - + - - - - - Fabaceae Pisum sativum (L.) Phacelia Hydrophylloideae tanacetifolia (Juss.) Lamiaceae Lamium album (L.) Plantago major (L.) Plantaginaceae Veronica persica (Poir.) Poaceae Portulaceae Eleusine coracana (L.) Gaertn. Portulaca oleracea (L.) ERGEBNISSE 3.3.2.2 Pflanzen 95 Alternative Wirtspflanzen II aus sieben verschiedenen Pflanzenfamilien wurden inokuliert (Sprühinokulation) und für die ersten 48 Stunden bei gesättigter Luftfeuchte und danach bis Versuchende bei normal vorherrschenden Luftfeuchten im Gewächshaus kultiviert. Eine visuelle Bonitur auf eine Veränderung an den Blättern erfolgte 10, 25 und 30 dpi. Zu keinen auffälligen Veränderungen im Blattgewebe kam es nach Inokulation mit 0,85 %-iger Natriumchloridlösung. Ebenso waren keinerlei Veränderungen nach Inokulation von A. valerianellae bei Beta vulgaris subsp. vulgaris var. conditiva (L.), Spinacia oleracea (L.), Foeniculum vulgare (L.) Mill., Petroselium crispum (Mill.) Nyman & A.W. Hill (kraus), Eruca sativa (L.), Pisum sativum (L.) und Capsicum annuum (L.) zu beobachten (nicht dargestellt). Pflanzen aus den Familien Apiaceae (Möhre), Brassicaceae (Radies), Fabaceae (Buschbohne) und Poaceae (Mais) zeigten am zehnten Tag nach der Inokulation mit A. valerianellae Auffälligkeiten gegenüber mit Kochsalzlösung inokulierten Pflanzen, die allerdings an späteren Terminen (25 und 30 dpi) nicht mehr sichtbar waren. Ebenso wurden auffällige Blattbereiche an Ölrettich (Brassicaceae) 25 dpi beobachtet. Durch eine erneute Kultur bei gesättigter Luftfeuchte, die für das Bakterium A. valerianellae eine optimale Bedingung für eine Infektion darstellt, veränderten sich die Symptome. An Petroselium crispum (Mill.) Nyman & A.W. Hill (glatt) wurden zu allen drei Beobachtungsterminen Blätter mit gelblichen Aufhellungen beobachtet, bei Raphanus sativus (L.) wurden Blattränder mit schwarzen Punkten sichtbar (Tab. 3.10). Feldsalatpflanzen zeigten über die Dauer des Versuches die für A. valerianellae typischen Symptome. ERGEBNISSE 96 Tabelle 3.10: Krankheitssymptome nach Sprühinokulation mit A. valerianellae (Konzentration 108 cfu/ml) 10, 25 und 30 dpi bei verschiedenen Pflanzenarten. - = keine sichtbaren Krankheitssymptome erkennbar Inokulierte Pflanze Valerianella locusta (L.) Krankheitssymptome nach Sprühinokulation an Blättern Nach 10 Tagen Nach 25 Tagen Nach 30 Tagen typische typische typische A. valerianellae- A. valerianellae- A. valerianellae- Symptome Symptome Symptome - - Blätter mit Blätter mit Blätter mit gelblichen gelblichen gelblichen Aufhellungen Aufhellungen Aufhellungen ein Blatt mit einem Daucus carota schwarzen Punkt; subsp. sativus mehrere (Hoffm.) Schübl. pergamentartige et G. Martens Stellen mit dunklen Punkten Petroselium crispum (Mill.) Nyman & A.W. Hill (glatt) Blattrand eines Raphanus sativus subsp. oleiformes (L.) - Blattes mit schwarzen Punkten - ERGEBNISSE 97 Fortsetzung Tab. 3.10 Inokulierte Pflanze Raphanus sativus subsp. sativus (L.) Raphanus sativus (L.) Krankheitssymptome nach Sprühinokulation an Blättern Nach 10 Tagen 2 Blätter mit schwarzen Rändern - Phaseolus pergamentartige vulgaris (L.) Flecken Zea mays (L.) Ränder an Blattenden teilweise gelb Nach 25 Tagen Nach 30 Tagen - - Blattränder mit Blattränder mit schwarzen schwarzen Punkten Punkten - - - - ERGEBNISSE 3.3.2.3 98 Alternative Wirtspflanzen III Der Versuch wurde mit Pflanzenarten aus fünf Familien und Feldsalat durchgeführt. Es sollte nach Stichinokulation auf einer Blatthälfte der Pflanzen überprüft werden, ob und wie lange das Bakterium A. valerianellae lebensfähig war (siehe Kapitel 2.14.2.3). Pflanzen, die lediglich mit einer 0,85 %-igen Natriumchloridlösung inokuliert wurden, zeigten über die Dauer des gesamten Versuches, außer einer Verletzung durch die Nadel, keine visuellen Veränderungen im Aussehen der Blätter um die Einstichstelle. Zudem wurde die Befallsfreiheit von diesen Pflanzensaftproben mittels Ausplattierung auf KB-Agar und Untersuchung im TAS-ELISA bestätigt (nicht dargestellt). Ab dem 12. Tag nach der Stichinokulation mit A. valerianellae wurden erste Veränderungen in der Blattstruktur um die Einstichstelle beobachtet (Tab. 3.11). An Feldsalatpflanzen waren über die fünfwöchige Dauer des Versuches (bis Tag 33 nach der Inokulation, 33 dpi) typische A. valerianellae-Symptome in Form von schwarzen Flecken sichtbar. Bei Beta vulgaris subsp. vulgaris var. conditiva (L.) und Petroselium crispum (Mill.) Nyman & A.W. Hill (kraus) waren lediglich Verletzungen zu erkennen, während bei Raphanus sativus subsp. sativus (L.), Raphanus sativus subsp. oleiformes (L.), Phaseolus vulgaris (L.), Pisum sativum (L.) und Raphanus sativus (L.) der Bereich um die Einstichstelle schwarz verfärbt war. Lediglich anfänglich sichtbare Verletzungen entwickelten sich bei Spinatpflanzen ab dem 19. Tag nach der Inokulation zu wässrigen dunklen Läsionen. Bei Eissalatpflanzen waren wässrige dunkle Läsionen bereits zu Anfang der Untersuchungen (12 dpi) erkennbar. Lebensfähige Bakterien aus injizierten Blattbereichen wurden am 12. Tag nach der Stichinokulation in Radies-, Ölrettich-, Buschbohne-, Rettich- und Eissalatsaftproben nach Ausplattierung auf KB-Agarschalen nachgewiesen und mittels TAS-ELISA als A. valerianellae identifiziert. In Feldsalatproben wurden lebensfähige Bakterien sowohl nach 12, 26 und 33 Tage nach der Stichinokulation ERGEBNISSE 99 auf KB-Agarschalen detektiert und mittels TAS-ELISA als A. valerianellae diagnostiziert. Lebensfähige Bakterien aus nicht-injizierten, aber den injizierten Blatthälften benachbarten Blattbereichen, wuchsen 12 Tage nach Stichinokulation auf KB-Agarschalen sowohl bei Feldsalat als auch bei Petersilie. Nach 19 Tagen wuchsen Bakterien aus Proben von Markerbse und Petersilie, nach 26 Tagen bei Feldsalat, Buschbohne und Markerbse und nach 33 Tagen lediglich bei Markerbse (Tab. 3.12). Alle Bakterienkolonien wurden abschließend mittels TAS-ELISA als A. valerianellae-Bakterien identifiziert. Das Bakterium A. valerianellae war über die Dauer von bis zu 33 Tagen in inokulierten Pflanzen lebensfähig und nachweisbar. Diese befallenen Pflanzen wiesen auch Krankheitssymptome auf. ERGEBNISSE 100 Tabelle 3.11: Veränderungen in der Blattstruktur um die Einstichstelle bei verschiedenen Pflanzenarten nach Stichinokulation mit A. valerianellae (Konzentration 108 cfu/ml) an unterschiedlichen Tagen nach der Inokulation (dpi). Veränderungen nach Stichinokulation an Blättern Inokulierte Pflanze 12 dpi Valerianella locusta (L.) 19 dpi, 26 dpi, 33 dpi typische A. valerianellae-Symptome Beta vulgaris subsp. vulgaris var. conditiva Verletzung sichtbar (L.) Spinacia oleracea (L.) Verletzung sichtbar wässrige dunkle Läsionen Petroselium crispum (Mill.) Nyman & A.W. Verletzung sichtbar Hill (kraus) Lactuca sativa (L.) Raphanus sativus subsp. oleiformes (L.) Raphanus sativus subsp. sativus (L.) wässrige dunkle Läsionen Bereich um Einstichstellen schwarz Bereich um Einstichstellen schwarz Raphanus sativus (L.) Bereich um Einstichstellen schwarz Phaseolus vulgaris (L.) Bereich um Einstichstellen schwarz Pisum sativum (L.) Bereich um Einstichstellen schwarz ERGEBNISSE 101 Tabelle 3.12: Nachweis von lebensfähigen A. valerianellae-Bakterien in injizierten und nichtinjizierten Blatthälften verschiedener Pflanzenarten 12, 19, 26 und 33 dpi. Nachweis von A. valerianellae (+) beziehungsweise kein Nachweis von A. valerianellae (-) in inokulierten und nicht-inokulierten Blatthälften. dpi Injizierte Nicht-injizierte Blatthälfte Blatthälfte + + + - + - + - + - Raphanus sativus (L.) + - Phaseolus vulgaris (L.) + - + - Pisum sativum (L.) + - Valerianella locusta (L.) + + Phaseolus vulgaris (L.) + - Pisum sativum (L.) + - Valerianella locusta (L.) + - Pisum sativum (L.) + - Potentieller Wirt Valerianella locusta (L.) Petroselium crispum (Mill.) Nyman & A.W. Hill Lactuca sativa (L.) 12 Raphanus sativus subsp. oleiformes (L.) Raphanus sativus subsp. sativus (L.) Petroselium crispum (Mill.) 19 26 Nyman & A.W. Hill 33 ERGEBNISSE 3.3.3 102 Saatgut Die Versuche zum Übertragungsweg Saatgut wurden mit einer gesunden und einer mit A. valerianellae-kontaminierten Saatgutpartie und deren Tochtergenerationen in verschiedenen Jahren durchgeführt. Es sollte gezeigt werden, ob eine Übertragung von A. valerianellae über das Saatgut auf die Tochtergeneration möglich ist. Weiterhin wurde geprüft, ob die verwendete Bewässerungsstrategie einen Einfluss auf die Kontamination der Samen hat. Die Pflanzen wurden in allen Aussaatjahren visuell bis zur Samenernte auf einen A. valerianellae-Befall untersucht. Abschließend erfolgte, nach Samenreifung und dem Bruch der Dormanz, die Untersuchung der Saatgutpartien auf Befall mit A. valerianellae (siehe Kapitel 3.4.1). A. valerianellae-Schadsymptome traten im Jahr 2007 nur sporadisch zu Kulturbeginn und ausschließlich an den Pflanzen aus infiziertem Saatgut auf. Der Anteil Symptom tragender Pflanzen lag bei den in Deutschland kultivierten Pflanzen 40 Tage nach der Aussaat bei 4,7 % und war gleichmäßig im Bestand verteilt (Abb. 3.20). In Frankreich waren lediglich an 1,1 % der Pflanzen sichtbare Symptome nach sechs Monaten nach der Aussaat vorhanden (nicht dargestellt). Pflanzen, die im Oktober 2008 ausgesät wurden, zeigten 69 Tage nach der Aussaat von infiziertem Saatgut einen geschätzten Befallswert von 10 % (Abb. 3.21 A). Dieser Schätzwert erhöhte sich innerhalb von einem Monat auf 15 % (103 Tage nach der Aussaat). 135 Tagen nach der Aussaat lag der Befallswert bei 30 % bis 35 % (Abb. 3.21 B). An Pflanzen, die im Jahr 2009 ausgesät wurden, war zu keiner Zeit der Kulturführung beziehungsweise Saatgutproduktion ein Befall sichtbar. Die Befallswerte schwankten zwischen den einzelnen Jahren stark, obwohl immer die gleiche kontaminierte Saatgutpartie ausgesät wurde. Allerdings erfolgte die Aussaat an verschiedenen Standorten unter verschiedenen Kulturbedingungen (Gewächshaus, Folienhaus, Freiland) und zu verschiedenen Jahreszeiten. ERGEBNISSE 2 3 4 5 6 x 7 8 9 11 12 Pflanze 13 14 15 16 17 18 19 20 21 22 23 24 25 26 x x Reihe x x x x x x x 2 3 4 x 5 6 7 x 8 9 10 x x 11 12 13 x x x 14 x 15 16 17 18 19 20 21 x x 20 21 x 22 x 23 24 25 26 22 23 24 25 26 x x x Reihe Reihe 10 ERGEBNISSE Parzelle 1 1 1 2 3 4 5 6 7 8 9 Parzelle 2 1 1 2 3 4 5 6 7 8 9 Parzelle 3 1 1 2 3 4 5 6 7 8 9 x 2 3 4 5 6 7 8 9 10 11 12 x 13 14 15 16 17 18 19 x x x Abbildung 3.20: Verteilung von A. valerianellae-Symptome tragende Pflanzen (mit x gekennzeichnet) aus A. valerianellae-infiziertem Saatgut, 40 Tage nach der Aussaat im Jahr 2007 in Deutschland, in drei jeweils 1 m² großen abgesteckten Parzellen, die aus je neun 103 Aussaatreihen bestanden, in denen zwischen 18 und 26 Pflanzen wuchsen (grau hinterlegte Fläche). ERGEBNISSE 104 A B Abbildung 3.21: Feldsalatpflanzen aus infiziertem Saatgut 69 Tage (A) und 135 Tage (B) nach Aussaat im Jahr 2008 in einem Folienhaus. Pflanzen mit A. valerianellae-Symptomen wurden mit einem Stab gekennzeichnet. ERGEBNISSE 105 3.4 Saatgutuntersuchungen 3.4.1 Nachweismethoden von Acidovorax valerianellae am Saatgut Die Saatgutpartien stammten aus den Versuchen zum Übertragungsweg Saatgut (Kapitel 2.13.3). Sowohl das gesunde und infizierte Ausgangssaatgut sowie die daraus gewonnenen zehn Partien aus verschiedenen Jahren wurden auf einen Befall mit A. valerianellae überprüft. 3.4.1.1 Sweatbox-Test in der Klimakammer und Aufwuchstest im Gewächshaus Samen aus verschiedenen Versuchsvarianten zur Saatgutübertragung von A. valerianellae wurden für den Sweatbox-Test in Vermiculit (5000 Samen pro zwei Liter Vermiculit) und für den Aufwuchstest in Erde ausgesät. Die Kultur erfolgte für den Sweatbox-Test ab Aussaat und für den Aufwuchstest mit Beginn des sich entwickelnden Laubblattstadiums der Pflanzen unter gesättigter Luftfeuchte. Aufgelaufene Pflanzen wurden auf einen Befall von A. valerianellae an verschiedenen Terminen visuell bonitiert (Abb. 3.22). Die Befallshäufigkeit wurde an mehreren Tagen erfasst. Die Endbonitur fand bei Pflanzen im Sweatbox-Test 28 Tage nach der Aussaat statt und für die Pflanzen im Aufwuchstest nach 28 Tagen unter gesättigter Luftfeuchte. Von Pflanzen mit verdächtigen oder typischen Symptomen wurden Bakterien isoliert und mittels TAS-ELISA näher bestimmt. Die gesunde Ausgangspartie (AV-60) war sowohl nach dem Sweatbox-Test als auch nach dem Aufwuchstest im Gewächshaus als frei von Acidovorax anzusehen. Das wurde auch durch die Überprüfung mittels TAS-ELISA bestätigt. In der infizierten Ausgangspartie (AV-75) wurden sowohl im Sweatbox-Test als auch im Aufwuchstest Pflanzen mit typischen A. valerianellae-Symptomen bonitiert. A. valerianellae-Bakterien wurden in diesen Symptom zeigenden Pflanzen nachgewiesen. Die in den Folgejahren aus der gesunden Ausgangspartie produzierten Saatgutpartien (mit Aussaaten in den Jahren 2007 bis 2009) zeigten weder im Sweatbox-Test noch ERGEBNISSE 106 im Aufwuchstest Symptome und ein Befall mit A. valerianellae wurde nicht nachgewiesen. Die Saatgutpartien aus der infizierten Ausgangspartie zeigten hingegen nach Aussaat im Jahr 2007 in Deutschland (AV-76) und nach Aussaat im Jahr 2008 (AV-77) typische Symptome. Ein eindeutiger Nachweis von A. valerianellae-Bakterien erfolgte mittels TAS-ELISA. Pflanzen aus Saatgutpartien, die in Frankreich und in Deutschland produziert wurden (AV-78 (Frankreich), AV-79 (Tröpfchen), AV-80 (Regner)), zeigten keinen nachweisbaren Befall (Tab. 3.13). Demnach lieferte eine infizierte Ausgangspartie, die Symptome sowohl im Sweatbox-Test als im Aufwuchstest zeigt, nicht zwangsläufig A. valerianellae kontaminiertes Saatgut. Aus einer gesunden symptomlosen Ausgangspartie entstand wiederum gesundes Saatgut. Abbildung 3.22: Sichtbare typische A. valerianellae-Symptome 25 Tage nach der Aussaat in Vermiculit (Sweatbox-Test) bei Kultivierung unter gesättigter Luftfeuchte. ERGEBNISSE 107 Tabelle 3.13: Nachweis von A. valerianellae in zwölf Saatgutpartien im Sweatbox-Test und im Aufwuchstest. Der Nachweis erfolgte durch klassisches Isolieren und mittels TAS-ELISA in Pflanzen mit verdächtigen Symptomen. Nachweis von A. valerianellae Saatgutpartie AV-60 Ausgangssaatgut (gesund) (ungebeizt) AV-75 (kontaminiert) AV-60 Ausgangssaatgut (gesund) (gebeizt) AV-75 (kontaminiert) Sweatbox-Test Aufwuchstest - - + + - - - - - - + + - - - - AV-61, Deutschland (gesund) AV-76, Deutschland Aussaat 2007 (kontaminiert) AV-63, Frankreich (gesund) AV-78, Frankreich (kontaminiert) ERGEBNISSE 108 Fortsetzung Tab. 3.13 Nachweis von A. valerianellae Saatgutpartie AV-62 (gesund) Sweatbox-Test Aufwuchstest - - + + - - - - - - - - Aussaat 2008 AV-77 (kontaminiert) AV-64, Tröpfchen (gesund) AV-65, Regner Aussaat 2009 (gesund) AV-79, Tröpfchen (kontaminiert) AV-80, Regner (kontaminiert) ERGEBNISSE 3.4.1.2 109 Ankeimmethode auf Papier Mit der Ankeimmethode auf Papier wurden Saatgutpartien auf eine Belastung mit A. valerianellae untersucht. Die Nachweisgrenzen lagen bei diesen Untersuchungen bei einem OD-Wert von 0,076 für die Beurteilung des Ausgangssaatgutes sowie für die Saatgutpartien mit Aussaat 2007 beziehungsweise bei einem OD-Wert von 0,098 für die Saatgutpartien, die im Jahr 2008 und 2009 ausgesät wurden. Die OD-Werte der gesunden Ausgangspartie (AV-60) lagen zu allen Zeitpunkten nach der Aussaat unterhalb der Nachweisgrenze von 0,076. Die infizierte, ungebeizte Ausgangspartie (AV-75) erreichte am Tag null der Untersuchung einen OD-Wert von 0,15 und war somit mit A. valerianellae belastet. Beide Saatgutpartien keimten jedoch nicht, so dass eine Befallsfreiheit beziehungsweise Kontamination mit A. valerianellae nicht im Keimverlauf nachgewiesen wurde. Bei der Untersuchung aller anderen Saatgutpartien wurden ab dem vierten Tag Keimlinge zur Untersuchung herangezogen. So lagen, mit Ausnahme der Saatgutpartie „AV-76 (Deutschland, kontaminiert)“ und „AV-64 (Tröpfchen, gesund)“ alle Saatgutpartien zu allen vier Zeitpunkten unterhalb der Nachweisgrenzen. Die beiden Saatgutpartien “AV-76 (Deutschland)“ und „AV-64 (Tröpfchen)“ lagen am vierzehnten Tag nach der Aussaat mit OD-Werten von 1,765 beziehungsweise 2,094 deutlich beziehungsweise 0,098 (Tab. 3.14). über den Nachweisgrenzen von 0,076 ERGEBNISSE 110 Tabelle 3.14: OD-Wert von Proben verschiedener Saatgutpartien im TAS-ELISA bei der Ankeimmethode auf Papier. OD-Werte über einer Nachweisgrenze von 0,076 (Ausgangssaatgut, Aussaat 2007) beziehungsweise 0,098 (Aussaat 2008, Aussaat 2009) galten als A. valerianellae-positiv (gekennzeichnet durch ein +). OD-Wert (TAS-ELISA) nach feuchter Inkubation der Samen für Aussaat 2007 Ausgangssaatgut Ausgangssaatgut Saatgutpartie verschiedene Tage nach Aussaat Tag 0 Tag 4 Tag 9 Tag 14 AV-60 (gesund, ungebeizt) 0 0 0 0 AV-60 (gesund, gebeizt) 0,01 0 0 0 AV-60 (gesund, entbeizt) 0 0 0 0 AV-75 (kontaminiert, ungebeizt) 0,15+ 0 0 0 AV-75 (kontaminiert, gebeizt) 0,03 0 0 0,03 AV-75 (kontaminiert, entbeizt) 0,04 0,01 0,01 0,04 AV-61, Deutschland (gesund) 0 0 0 0,02 0,03 0 0,03 1,76+ 0 0 0 0,01 0 0 0 0,01 AV-76, Deutschland (kontaminiert) AV-63, Frankreich (gesund) AV-78, Frankreich (kontaminiert) ERGEBNISSE 111 Fortsetzung Tab. 3.14 OD-Wert (TAS-ELISA) nach feuchter Inkubation der Samen für Aussaat 2008 Saatgutpartie verschiedene Tage nach Aussaat Tag 0 Tag 4 Tag 9 Tag 14 AV-62 (gesund) 0 0 0 0 AV-77 (kontaminiert) 0 0,03 0 0 0 0 0 2,09+ 0 0 0 0 0 0 0 0 0 0 0 0 AV-64, Tröpfchen Aussaat 2009 (gesund) AV-79, Tröpfchen (kontaminiert) AV-65, Regner (gesund) AV-80, Regner (kontaminiert) ERGEBNISSE 3.4.1.3 112 Bestimmungen durch Fremdfirmen Freundlicherweise wurden Saatgutpartien aus dem Versuch zum Übertragungsweg Saatgut von zwei Fremdfirmen auf ihre Kontamination mit A. valerianellae untersucht. So wurde das Saatgut bei den Firmen Enza Zaden und Rijk Zwaan im Sweatbox-Test in Kombination mit einer PCR-Methode auf eine A. valerianellae-Belastung untersucht. Beide Firmen bonitierten das nicht-infizierte Ausgangssaatgut (AV-60) als nicht-symptomzeigend und entnommene Pflanzenproben waren PCR-negativ. Pflanzen aus der kontaminierten Partie (AV-75) zeigten Symptome und im PCRVerfahren war A. valerianellae nachweisbar. Bei den nach Aussaat im Jahr 2007 produzierten und 2008 geernteten Partien in Deutschland und Frankreich war bei Enza Zaden keine Untersuchung der Samen möglich. Zum einen keimte das Saatgut aus Deutschland (AV-61 (gesund) und AV-76 (kontaminiert)) nicht, zum anderen wurde das gekeimte Saatgut aus Frankreich (AV-63 (gesund) und AV-78 (kontaminiert)) zu schnell von Pilzen überwachsen. Bei Rijk Zwaan war ebenfalls keine Untersuchung der Saatgutpartien, die in Deutschland produziert wurden, möglich. Die Saatgutpartien, die in Frankreich produziert wurden, wurden von Rijk Zwaan als nicht befallen (AV-63 (gesund)) beziehungsweis als befallen (AV-78 (kontaminiert)) identifiziert. Die nach Aussaat im Jahr 2008 im Folgejahr geernteten Saatgutpartien (AV-62 (gesund) und AV-77 (kontaminiert)) waren nach Untersuchung von Enza Zaden mit A. valerianellae belastet, während die Saatgutpartie, die aus gesundem Ausgangssaatgut produziert wurde, laut Rijk Zwaan gesund und die, die aus infiziertem Saatgut produziert wurde, infiziert war. Die im Jahr 2010 geernteten vier Saatgutpartien (Aussaat 2009) waren laut Untersuchung von Enza Zaden alle negativ. Die Untersuchung derselben Saatgutpartien bei Rijk Zwaan erbrachte keine Ergebnisse, da die Proben zu stark mit Pilzen kontaminiert waren (Tab. 3.15). ERGEBNISSE 113 Tabelle 3.15: Nachweis von A. valerianellae in zwölf Saatgutpartien im Sweatbox-Test in Kombination mit einer PCR bei den Firmen Enza Zaden und Rijk Zwaan. 1 keine Keimung des Saatgutes, daher keine visuelle Bonitur und Probenahme möglich 2 gekeimtes Saatgut stark von Pilzen überwachsen, keine Auswertung möglich Nachweis von A. valerianellae Saatgutpartie AV-60 Ausgangssaatgut (gesund) (ungebeizt) AV-75 (kontaminiert) Enza Zaden Rijk Zwaan - - + + 1 1 AV-61, Deutschland (gesund) AV-76, Deutschland Aussaat 2007 (kontaminiert) AV-63, Frankreich (gesund) 2 AV-78, + Frankreich (kontaminiert) AV-62 Aussaat 2008 (gesund) AV-77 (kontaminiert) + - + + ERGEBNISSE 114 Fortsetzung Tab 3.15 Nachweis von A. valerianellae Saatgutpartie Enza Zaden Rijk Zwaan AV-64, Tröpfchen - (gesund) AV-65, Regner Aussaat 2009 - (gesund) 2 AV-79, Tröpfchen - (kontaminiert) AV-80, Regner (kontaminiert) - ERGEBNISSE 115 3.4.2 Dekontaminationsmaßnahmen 3.4.2.1 Überprüfungen einer Warmwasserbehandlung In den Jahren von 2006 bis 2009 wurden zunächst an gesundem Saatgut der Sorte AV-1 (Kalibrierung 2,00-2,25) Behandlungen mittels Warmwasserbeize und deren Wirkungen auf die Keimfähigkeit überprüft, um Grenzwerte zu ermitteln, ab denen ein nicht tolerierbarer Keimfähigkeitsverlust auftrat. So wurden Behandlungen bei 30 °C für 120 Minuten, 35 °C für 90 Minuten, 40 °C für 60 Minuten, 50 °C für 40 Minuten, 55 °C für 30 und 40 Minuten und bei 60 °C für 10 und 20 Minuten durchgeführt, die sich aufgrund hoher Verluste in der Keimfähigkeit als ungeeignet erwiesen (Ergebnisse nicht dargestellt). Außerdem war der mit den Jahren natürliche Verlust an Keimfähigkeit durch die Lagerung der Samen zu erkennen. Erstaunlich war, dass ein und dieselbe Behandlung (gleiche Temperatur und Einwirkzeit) in verschiedenen Jahren einen unterschiedlichen Einfluss auf die Keimfähigkeit hatte (Ergebnisse nicht dargestellt). Grundsätzlich nahm die Keimfähigkeit mit steigenden Temperaturen und steigenden Einwirkzeiten tendenziell ab. Behandlungen bei 43 °C für 20 Minuten, 47 °C für 45 Minuten, 50 °C und 55 °C für jeweils 10 und 20 Minuten und bei 60 °C für 5 Minuten erwiesen sich hingegen als tolerierbar in Bezug auf die Keimfähigkeit. So kam es bei der Warmwasserbeizung bei 55 °C für 20 Minuten zu einer Abnahme der Keimfähigkeit von 20 %, die Keimfähigkeiten der Samen der anderen Warmwasserbehandlungen reduzierten sich lediglich um 3,2 % (Abb. 3.23 A). Dieses Ergebnis wurde mit den Saatgutsorten AV-220 (Kalibergröße 2,00-2,25), AV-17 (Kalibergröße 2,00-2,25) und AV-219 (Kalibergröße 2,00-2,25) überprüft. So war die Keimfähigkeit der Samen der Sorte AV-220 nach Behandlung bei 55 °C für 20 Minuten lediglich um 2,5 % in ihrer Keimfähigkeit (89,8 %) in Bezug auf die unbehandelte Variante (Kontrolle, Keimfähigkeit 92,3 %) reduziert, während die Keimfähigkeit durch die anderen sechs Behandlungen teilweise auf 98,3 % (Behandlung für 20 Minuten bei 43 °C) gesteigert wurde (Abb. 3.23 B). Das gleiche Bild zeigte sich nach entsprechender Behandlung der Samen bei der Sorte AV-17. Eine deutliche Reduzierung der Keimfähigkeit zeigte sich auch hier nur bei den ERGEBNISSE 116 Samen, die bei 55 °C für 20 Minuten warmwasserbehandelt wurden. So keimten 78 % dieser Samen gegenüber gekeimten Samen in der Kontrolle (93 %). Andere warmwasserbehandelte Samen zeigten eine Steigerung der Keimfähigkeit. Bei den Behandlungen bei 50 °C für 20 Minuten und bei 60 °C für 5 Minuten steigerte sich die Keimfähigkeit auf 98 % (Abb. 3.23 C). Die Keimfähigkeit der Samen der Sorte AV-219 wurde nach 20-minütiger Behandlung bei 43 °C minimal gesteigert (von 97,3 % in der Kontrolle auf 98,8 %). Die Behandlungen bei höheren Temperaturen führten insgesamt zur Reduzierung der Keimfähigkeit. Nach einer Behandlung bei 47 °C für 45 Minuten keimten 49,5 % der Samen. Eine Behandlung bei 50 °C für 20 Minuten (62,3 %) sowie bei 55 °C für 10 (58 %) und 20 Minuten Behandlungszeit (33 %) und bei 60 °C für 5 Minuten (69,5 %) führte zu Keimfähigkeitsreduzierungen (Abb. 3.23 D). Ebenso wurden diese Warmwasserbehandlungen auf ihre Eignung als Dekontaminationsmaßnahme an den infizierten Sorten AV-17 (2009, Kalibergröße 2,00-2,25) und AV-219 (2009, Kalibergröße 2,00-2,25) überprüft. Die Dekontaminationswirkung wurde mittels Ankeimmethode auf Papier und TASELISA geprüft. Die Samen beziehungsweise Keimlinge wurden an den Tagen null, vier, neun und 14 nach der Aussaat mit Extraktionspuffer homogenisiert (je 0,2 g Samen plus 3 ml Puffer) und im ELISA analysiert. Als kontaminiert galten die Saatgutproben von Keimlingen, die nach vier, neun oder 14 Tagen höhere OD-Werte als zum Zeitpunkt null erreichten, da steigende OD-Werte auf eine Vermehrung von A. valerianellae deuten. Unbehandelte Samen der Sorte AV-17 erreichten einen OD-Wert von 0,132 am Tag null, vier Tage nach der Aussaat wurde ein OD-Wert von 0,091 gemessen, während die Werte für den neunten (OD-Wert 0,807) und 14. Tag (OD-Wert 2,88) nach Aussaat deutlich oberhalb des ursprünglichen Wertes von 0,132 lagen. Samen, die für 20 Minuten bei 43 °C warmwasserbehandelt wurden, zeigten einen Anfangs-ODWert von 0,224. Am Tag vier reduzierte sich der OD-Wert auf 0,068, um am neunten Tag deutlich anzusteigen (OD-Wert 1,498) und erneut auf einen OD-Wert von 0,193 am Tag 14 zurückzufallen. Ebenso reagierten die Samen, die für 45 Minuten bei 47 °C behandelt wurden. Auch hier fiel der OD-Wert von zunächst 0,046 (Tag null) ERGEBNISSE 117 auf 0,032 (Tag vier) ab, stieg auf einen OD-Wert von 0,213 (Tag neun) an und fiel erneut ab (OD-Wert 0,099, Tag 14). Nach einer Behandlung bei 50 °C für 10 Minuten lagen die OD-Werte bei 0,153 (Tag null), 0,11 (Tag vier), 0,735 (Tag neun) und 0,324 (Tag 14). Nach 20-minütiger Behandlung bei 50 °C stiegen die ODWerte kontinuierlich von 0,132 (Tag null) auf 0,363 (Tag 14) an. Eine 10-minütige Behandlung bei 55 °C lieferte ebenfalls eine Zunahme der OD-Werte von Beginn 0,068 (Tag null) auf 0,257 am 14. Tag. OD-Werte von Samen, die für 20 Minuten in 55 °C warmem Wasser behandelt wurden, lagen anfangs bei 0,353, fielen auf über die Hälfte auf 0,148 (Tag vier) ab, stiegen deutlich auf 0,392 (Tag neun) an und fielen erneut auf 0,184 (Tag 14). Bei 60 °C für 5 Minuten behandelte Samen lieferten einen kontinuierlichen Anstieg der OD-Werte von Tag null zu Tag 14 von 0,073 auf 0,932 (Abb. 3.24 A). Alle OD-Werte behandelter Samen, mit Ausnahme der für 20 Minuten bei 55 °C durchgeführten Behandlung, waren an mindestens einem Termin zwischen Tag vier und 14 im Vergleich zu Tag null eindeutig angestiegen und galten somit als A. valerianellae belastet. OD-Werte unbehandelter Samenproben der Sorte AV-219 zeigten einen kontinuierlichen und eindeutigen Anstieg von Tag null (OD-Wert 0,118) auf Tag 14 (OD-Wert 1,585). Samen, die für 20 Minuten bei 43 °C warmwasserbehandelt wurden, wiesen einen kurzfristigen Anstieg der OD-Werte von 0,013 (Tag null) auf 0,092 (Tag vier) und 0,079 am neunten Tag auf, während der OD-Wert am vierten Auswertungstag auf 0,013 abfiel (Tag 14). Innerhalb der vierzehntägigen Untersuchungsdauer stiegen die OD-Werte von Samen, die für 45 Minuten bei 47 °C behandelt wurden, von 0,063 (Tag null) über 0,068 (Tag neun) auf 0,394 (Tag 14) an. Nach Behandlung bei 50 °C für eine 10-minütige Dauer lag der OD-Wert zu Beginn bei 0,044, fiel etwas innerhalb von vier Tagen auf 0,033 (Tag vier) ab und stieg am neunten und 14. Tag auf OD-Werte von 0,964 und 1,785 an. Nach einer 20minütigen Behandlungszeit bei 50 °C stieg der OD-Wert ebenfalls an, von anfänglich 0,108 (Tag null) auf 1,356 (Tag 14). Nach einer Behandlung bei 55 °C für 10 und 20 Minuten stiegen die OD-Werte ebenso innerhalb der vierzehntägigen Untersuchungsdauer an. Anfängliche OD-Werte von 0,013 (55 °C, 10 Minuten) beziehungsweise 0,094 (55 °C, 20 Minuten) stiegen auf 1,469 (Tag 14 nach ERGEBNISSE 118 10-minütiger Behandlung) beziehungsweise 0,833 (Tag neun nach 20-minütiger Behandlung) an. Die 5-minütige Samenbehandlung bei 60 °C führte zu geringen ODWerten. Am ersten Untersuchungstag (Tag null) wurde ein OD-Wert von 0,03 gemessen, am Tag vier ein OD-Wert von 0,015, am Tag neun ein OD-Wert von 0,004 und 14 Tage nach Untersuchungsbeginn ein OD-Wert von 0,056. Alle ODWerte behandelter Samen, mit Ausnahme der für 20 Minuten bei 43 °C und für 5 Minuten bei 60 °C durchgeführten Behandlungen, waren an mindestens einem der drei Untersuchungstage zwischen Tag vier und 14 im Vergleich zu Tag null eindeutig angestiegen. Die entsprechenden Saatgutpartien waren demzufolge weiterhin als mit A. valerianellae anzusehen (Abb. 3.24 B). Warmwasserbehandlungen haben somit einen Einfluss auf gesundes und mit A. valerianellae kontaminiertes Saatgut in Bezug auf die Keimfähigkeit und den A. valerianellae-Befall. Die Keimfähigkeiten nahmen mit steigenden Temperaturen und Einwirkzeiten grundsätzlich ab, dennoch reagierten die behandelten Saatgutpartien der Sorten unterschiedlich. Die Untersuchungen im TAS-ELISA lieferten in der Regel geringere OD-Werte als die unbehandelte Kontrolle. Das deutet auf Befallsreduzierungen durch die Warmwasserbehandlungen befallsreduzierende Effekt war sortenabhängig. hin. Der ERGEBNISSE A 119 100 a a a a a a a a 90 Keimfähigkeit in % 80 70 60 50 40 30 20 10 0 Kontrolle 20 Min. 45 Min. 10 Min. 20 Min. 10 Min. 20 Min. 5 Min. 43 °C 47 °C 50 °C 50 °C 55 °C 55 °C 60 °C Behandlung B 100 ab b ab ab 20 Min. 45 Min. 43 °C 47 °C b ab ab 10 Min. 20 Min. 10 Min. 20 Min. 5 Min. 50 °C 50 °C 55 °C 55 °C 60 °C a 90 Keimfähigkeit in % 80 70 60 50 40 30 20 10 0 Kontrolle Behandlung Abbildung 3.23: Keimfähigkeit von warmwasserbehandelten Samen aus dem Jahr 2009. (A): Sorte AV-1, gesund, 2006, Kalibrierung 2,00 – 2,25. (B): Sorte AV-220, gesund, 2009, Kalibrierung 2,00 – 2,25. (C): Sorte AV-17, kontaminiert mit A. valerianellae, 2009, Kalibrierung 2,00 – 2,25. (D): Sorte AV-219, kontaminiert mit A. valerianellae, 2009, Kalibrierung 2,00 – 2,25. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE C 120 100 ab ab ab ab b b ab a 90 Keimfähigkeit in % 80 70 60 50 40 30 20 10 0 Kontrolle 20 Min. 45 Min. 10 Min. 20 Min. 10 Min. 20 Min. 5 Min. 43 °C 47 °C 50 °C 50 °C 55 °C 55 °C 60 °C Behandlung D 100 bc c abc 90 abc Keimfähigkeit in % 80 abc 70 60 abc ab 50 a 40 30 20 10 0 Kontrolle 20 Min. 45 Min. 10 Min. 20 Min. 10 Min. 20 Min. 5 Min. 43 °C 47 °C 50 °C 50 °C 55 °C 55 °C 60 °C Behandlung Fortsetzung Abbildung 3.23: ERGEBNISSE 121 2,88 A 1,5 OD-Wert 1 0,5 0 Tag 0 0 Tag 4 4 Tag 9 9 Tag 1414 feuchte Inkubation Inkubationsdauer (Tage) unbehandelt 43 °C 20 Min. 47 °C 45 Min. 50 °C 10 Min. 50 °C 20 Min. 55 °C 10 Min. 55 °C 20 Min. 60 °C 5 Min. 1,785 1,5 B 1,585 OD-Wert 1 0,5 0 0 0 Tag 4 4 Tag 99 Tag Tag1414 Inkubationsdauer (Tage) feuchte Inkubation unbehandelt 43 °C 20 Min. 47 °C 45 Min. 50 °C 10 Min. 50 °C 20 Min. 55 °C 10 Min. 55 °C 20 Min. 60 °C 5 Min. Abbildung 3.24: OD-Wert im TAS-ELISA (nach 60 Minuten) nach 0, 4, 9 und 14 Tagen Inkubation in der Ankeimmethode auf Papier von warmwasserbehandelten Samen der A. valerianellae-kontaminierten Sorten AV-17 (A) und AV-219 (B). ERGEBNISSE 3.4.2.2 122 Überprüfungen einer Dampfdesinfektion Dankenswerterweise wurde das gesunde Saatgut (AV-220, 2009) und das mit A. valerianellae kontaminierte Saatgut (AV-17, 2009 und AV-219, 2009) durch das Eidgenössische Volkswirtschaftsdepartement EVD, Forschungsanstalt Agroscope Changins-Wädenswil ACW mit der Dampfdesinfektion behandelt. Die Dampfdesinfektionsmaßnahme wurde sowohl bei 66 °C für 90 und für 105 Sekunden (am 13.07.2010) als auch bei 64 °C für 120 und 150 Sekunden (am 14.09.2010) durchgeführt. Nach der Rücktrocknung wurde die Keimfähigkeit (auf Wasseragar bei 20 °C) und die A. valerianellae-Kontamination des Saatguts untersucht. Diese Dampfdesinfektionen beeinflussten die Keimfähigkeit der Samen weitestgehend positiv (Tab. 3.16 und Abb. 3.25). So betrug der Wert der Keimfähigkeit der gesunden Saatgutpartie (AV-220) vor der Dampfdesinfektion 98 %, während er nach Desinfektion bei 66 °C leicht verringert (94 % nach 90-sekündiger Behandlung) beziehungsweise erhöht (100 % nach 105-sekündiger Desinfektion) war. Die Keimfähigkeit der kontaminierten Sorte AV-219 wurde nicht (94 % vor und nach Behandlung bei 66 °C für 90 Sekunden) oder nur geringfügig abgeschwächt (88 % nach Behandlung bei 66 °C für 105 Sekunden), während die Keimfähigkeit der Sorte AV-17 nach jeder Behandlung erhöht war. So wurde die Ausgangskeimfähigkeit von 86 % auf 94 % (90-sekündige Behandlung) beziehungsweise 100 % (105-sekündige Behandlung) erhöht. Durch die Dampfdesinfektion bei 64 °C wurden Keimfähigkeiten reduziert. So wurde bei der Sorte AV-220 eine Ausgangskeimfähigkeit von 92 % ermittelt, bei der Sorte AV-219 keimten 84 % und bei der Sorte AV-17 88 %. Nach 120-sekündiger Behandlung mit 64 °C heißem Dampf keimten 96 % (nach 120-sekündiger Behandlung) der Samen der Sorte AV-220, während nach 150-sekündiger Behandlung 90 % der Samen keimten. Die Samen der Sorte AV-219 erreichten durch beide Dampfdesinfektionen nicht den Keimfähigkeitswert vor der Behandlung. Nach 120 Sekunden keimten 80 %, nach 150 Sekunden 74 % der Samen. Die Keimfähigkeit der Samen der Sorte AV-17 wurde erhöht (auf 96 % nach 120-sekündiger Behandlung und auf 98 % nach 150-sekündiger Desinfektion). Nach beiden Dampfdesinfektionen wurde beobachtet, dass der Befall mit anhaftenden Pilzen (Phoma, Cladosporium, Stemphylium, Rhizopus) rückläufig war. ERGEBNISSE 123 Sie waren nach der Behandlung kaum beziehungsweise gar nicht mehr vorhanden (nicht dargestellt). Eine Überprüfung der Keimfähigkeit dampfbehandelter Samen auf Filterpapier und bei kühlen, dunklen Bedingungen (wie in Kapitel 2.6 beschrieben) lieferte ein ähnliches Ergebnis (Abb. 3.25). Die Keimfähigkeit der Sorte AV-220 betrug vor der Behandlung 92 %, die durch die Dampfdesinfektion bei 66 °C sowohl für 90 als auch für 105 Sekunden auf 96 % (90 Sekunden) beziehungsweise 93 % (105 Sekunden) gesteigert werden konnte. Eine Dampfdesinfektion bei 64 °C (bei 120- und 150-sekündiger Behandlung) hatte eine Reduzierung der Keimfähigkeit auf 87 % zu Folge. Die Keimfähigkeit der Sorte AV-219 wurde sowohl nach Behandlung bei 66 °C als auch nach Behandlung bei 64 °C reduziert. Bei beiden Temperaturen wurde jeweils eine geringere Keimfähigkeit bei länger einwirkender Desinfektionsphase erzielt. Stärkste Einbußen waren nach Behandlung bei 64 °C für 150 Sekunden (auf 79 %) sichtbar. Die Keimfähigkeit der Sorte AV-17 wurde durch eine Dampfdesinfektion in allen Fällen gesteigert. Vor der Behandlung betrug die Keimfähigkeit 90 %, nach der Behandlung bei 66 °C hingegen 98 % beziehungsweise nach Behandlung bei 64 °C 97 % (120 Sekunden) oder 93 % (nach 150 Sekunden). Die Dekontaminationswirkung der Dampfdesinfektion wurde ebenso wie die Warmwasserbehandlung an den Sorten AV-17 und AV-219 mittels Ankeimmethode auf Papier im Vergleich zu unbehandelten Samen kontrolliert. OD-Werte der Tage null bei jeder Dampfbehandlung wurden als Schwellenwerte für die jeweilig erzielten OD-Werte der Behandlungen für den vierzehntägigen Versuchszeitraum für die Ankeimmethode auf Papier herangezogen. Unbehandelte Samen der Sorte AV-17 erreichten am Tag null einen OD-Wert von 0,904. Dieser hohe Wert verringerte sich zunächst am vierten Tag auf einen OD-Wert von 0,362, steigerte sich jedoch auf einen OD-Wert von 3,279 (Tag neun) und auf 3,317 (Tag 14). Dampfbehandelte Samen, die für 90 Sekunden bei 65 °C behandelt wurden zeigten zu Beginn einen OD-Wert von 0,468 (Tag null), vom vierten über den neunten bis zum 14. Tag verringerten sich jedoch die OD-Werte von 0,741 über 0,315 auf 0,105. Die Behandlung, die ebenfalls bei 65 °C und für 105 Sekunden ERGEBNISSE 124 durchgeführt wurde, zeigte einen kontinuierlichen Anstieg der OD-Werte von anfänglich 0,625 (Tag null) auf 2,566 (Tag 14). Nach einer Dampfbehandlung bei 64 °C für 120 Sekunden wurde am Tag null ein OD-Wert von 0,361 erreicht, der dann auf 0,243 (Tag vier) abfiel, um nach neun beziehungsweise 14 Tagen auf einen OD-Wert von 0,72 und 2,851 anstieg. Nach einer Behandlung bei 64 °C für 150 Sekunden ergab sich zu Beginn ein OD-Wert von 0,628. Nach vier Tagen fiel der OD-Wert auf 0,577, um nach neun Tagen auf 1,055 anzusteigen und nach 14 Tagen erneut auf einen OD-Wert von 0,061 abzufallen (Abb. 3.26 A). Bei der Untersuchung von Keimlingen beziehungsweise Pflanzen aus unbehandelten Samen der Sorte AV-219 zeigte sich ein ähnliches Bild wie bei der Sorte AV-17. OD-Werte unbehandelter Samen der Sorte AV-219 stiegen über den vierzehntägigen Zeitraum der Untersuchung für die Ankeimmethode auf Papier nahezu kontinuierlich an. Zu Beginn wurde ein OD-Wert von 0,497 (Tag 0) gemessen, der sich auf einen hohen OD-Wert von 3,143 (Tag 14) steigerte. Samen, die nach einer Dampfbehandlung bei 66 °C für 90 Sekunden untersucht wurden, erreichten geringere OD-Werte. Zum Zeitpunkt null wurde dabei ein anfänglicher OD-Wert von 0,117 gemessen, am vierten Tag nach Aussaat wurde ein OD-Wert von 0,069 gemessen. Zum neunten Tag nach Aussaat wurde ein OD-Wert von 0,266 ermittelt während am Tag 14 lediglich ein OD-Wert von 0,007 erzielt wurde. Nach einer Dampfbehandlung für 105 Sekunden (bei 66 °C) wurde zunächst ein OD-Wert von 0,191 (Tag 0) gemessen, nach vier Tagen von 0,077, nach neun Tagen von 0,031 und abschließend (Tag 14) von 0,175. OD-Werte nach einer 120-sekündigen Behandlung bei 64 °C lagen bei 0,188 (Tag 0), 0,437 (Tag 4), 0,027 (Tag 9) und bei 0,0003 (Tag 14). Nach einer 150-sekündigen Behandlung bei 64 °C stiegen die OD-Werte von 0,081 (Tag 0) kontinuierlich auf 2,658 (Tag 14) an (Abb. 3.26 B). Die Behandlung mit Dampf hatte bezüglich Keimfähigkeit und Dekontamination einen Einfluss auf die Samen. Die Keimfähigkeit war nach Dampfbehandlung lediglich bei der Sorte AV-219 signifikant von den unbehandelten Samen verschieden und führte zu verminderten Keimfähigkeiten. Nach Durchführung der Ankeimmethode auf Papier wurden bei der Sorte AV-17 keine durchgängigen Verringerungen der OD-Werte erzielt, während bei der Sorte AV-219 die ERGEBNISSE 125 Behandlung bei 66 °C für 105 Sekunden einen positiven, dekontaminierenden Einfluss zu haben schien. Tabelle 3.16: Keimfähigkeit (in % bei 20 °C und 12 Stunden Licht pro Tag) drei verschiedener Feldsalatsorten nach Behandlung mit Dampf bei 66 °C für 90 beziehungsweise 105 Sekunden und bei 64 °C für 120 beziehungsweise 150 Sekunden im Vergleich zur nicht-behandelten Kontrolle. Keimfähigkeit (%) Dampfdesinfektion unbehandelt (vor Behandlung bei 66 °C) 66 °C, 90 Sekunden 66 °C, 105 Sekunden unbehandelt (vor Behandlung bei 64 °C) 64 °C, 120 Sekunden 64 °C, 150 Sekunden AV-17, AV-219, AV-220, kontaminiert kontaminiert gesund 86 94 98 94 94 94 100 88 100 88 84 92 96 80 96 98 74 90 ERGEBNISSE a AV-219 a a 66 °C, 105 Sekunden unbehandelt a 66 °C, 90 Sekunden 66 °C, 105 Sekunden AV-17 ab unbehandelt b 66 °C, 105 Sekunden a 66 °C, 90 Sekunden a 66 °C, 90 Sekunden 90 80 70 60 50 40 30 20 10 0 a unbehandelt Keimfähigkeit in % A 100 126 AV-220 b a AV-17 64 °C, 120 Sekunden unbehandelt 64 °C, 150 Sekunden ab AV-219 a a a 64 °C, 150 Sekunden a unbehandelt a 64 °C, 150 Sekunden a 64 °C, 120 Sekunden 100 90 80 70 60 50 40 30 20 10 0 unbehandelt Keimfähigkeit in % B 64 °C, 120 Sekunden Sorte AV-220 Sorte Abbildung 3.25: Keimfähigkeit (in % bei 4 °C unter Lichtausschluß) drei verschiedener Feldsalatsorten nach Behandlung mit Dampf bei (A) 66 °C für 90 beziehungsweise 105 Sekunden und bei (B) 64 °C für 120 beziehungsweise 150 Sekunden im Vergleich zur unbehandelten Kontrolle. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE A 127 2,851 3,317 2 2,566 OD-Wert 1,5 1 0,5 0 Tag 0 Tag 4 Tag 9 Tag 14 feuchte Inkubation unbehandelt 64 °C 120 Sek. B 66 °C 90 Sek. 64 °C 150 Sek. 3,143 2 66 °C 105 Sek. 2,658 OD-Wert 1,5 1 0,5 0 Tag 0 Tag 4 Tag 9 Tag 14 feuchte Inkubation unbehandelt 64 °C 120 Sek. 66 °C 90 Sek. 64 °C 150 Sek. 66 °C 105 Sek. Abbildung 3.26: OD-Wert im TAS-ELISA (nach 60 Minuten) nach Homogenisierung von dampfbehandelten Samen der A. valerianellae-kontaminierten Sorten AV-17 (A) und AV-219 (B) (Ankeimmethode auf Papier). ERGEBNISSE 3.4.2.3 128 Überprüfungen einer weiteren Dekontaminationsmaßnahme Das Saatgut der drei Sorten AV-220, AV-219 und AV-17 wurden von einer für Saatgutbehandlungen spezialisierten Firma behandelt. Zur Firma und zu der Methodik der Behandlung dürfen keine Angaben gemacht werden. Die Keimfähigkeiten der drei Sorten lagen vor der Behandlung über einem Wert von 90 %, während die Keimfähigkeiten nach Behandlung etwas erhöht (Sorte AV-220 und Sorte AV-17) beziehungsweise erniedrigt (Sorte AV-219) waren. So war bei der Sorte AV-220 ein um 2 Prozentpunkte erhöhter Wert in der Keimfähigkeit auf 94 % vorhanden, während bei der Sorte AV-17 die Keimfähigkeit von 90 % auf 97 % gesteigert wurde. Die Sorte AV-219 zeigte durch die Behandlung eine Keimfähigkeitsreduzierung von 98 % auf 95 %. Diese Behandlung führte jedoch bei allen drei Sorten zu keinen signifikanten Unterschieden in der Keimfähigkeit (Abb. 3.27). Eine Überprüfung der Dekontaminationswirkung durch diese Maßnahme erfolgte mittels Ankeimmethode auf Papier im Vergleich zur unbehandelten Variante. Vor einer Behandlung wurden bei der Sorte AV-17 hohe OD-Werte von 0,904 zum Zeitpunkt null und nach 14 Tagen von 3,317 gemessen. Nach einer Behandlung durch den Dienstleister stiegen die OD-Werte von 0,645 (Tag null) auf 2,898 (Tag neun) und auf 3,075 am 14. Tag nach Aussaat (Abb. 3.28 A). Die mittels TAS-ELISA erzielten Ergebnisse lieferten über den vierzehntägigen Zeitraum bei den unbehandelten Samen der Sorte AV-219 einen Anfangs-OD-Wert von 0,497 (Tag null), der sich kontinuierlich auf 3,143 (Tag 14) steigerte. OD-Werte behandelter Samen lagen an Tag null bei 0,108, nach vier Tagen bei einem OD-Wert von 0,048 und stiegen dann ebenfalls kontinuierlich auf 3,016 (Tag 14) an (Abb. 3.28 B). Die Saatgutbehandlung durch den Dienstleister führte im Gegensatz zu Warmwasserbehandlungen und Dampfbehandlungen lediglich zu geringen Effekten. ERGEBNISSE 129 So kam es zu einer zu vernachlässigbaren Veränderung in der Keimfähigkeit. Aber AV-17 a AV-219 Behandlung Dienstleister a a unbehandelt a Behandlung Dienstleister a unbehandelt a Behandlung Dienstleister 100 90 80 70 60 50 40 30 20 10 0 unbehandelt Keimfähigkeit in % auch eine Dekontaminationswirkung war nicht festzustellen. AV-220 Sorte Abbildung 3.27: Keimfähigkeit (in % bei 4 °C unter Lichtausschluß) drei verschiedener Feldsalatsorten nach Behandlung durch einen Dienstleister im Vergleich zur unbehandelten Kontrolle. Behandlungen mit gleichen Buchstaben sind nicht signifikant voneinander verschieden. Die Daten wurden mit dem Kruskal-Wallis-Test (Dunns Prozedur) verrechnet (p < 0,05). ERGEBNISSE A 130 4 3,5 OD-Wert 3 2,5 2 1,5 1 0,5 0 Tag 0 Tag 4 Tag 9 Tag 14 feuchte Inkubation unbehandelt B Behandlung Dienstleister 4 3,5 OD-Wert 3 2,5 2 1,5 1 0,5 0 Tag 0 Tag 4 Tag 9 Tag 14 feuchte Inkubation unbehandelt Behandlung Dienstleister Abbildung 3.28: OD-Wert im TAS-ELISA (nach 60 Minuten) der mit A. valerianellaekontaminierten Sorten AV-17 (A) und AV-219 (B) zwischen Tag null und Tag 14 nach Aussaat auf angefeuchtetem Filterpapier und Inkubation bei Raumtemperatur (Ankeimmethode auf Papier). Die Samen waren unbehandelt beziehungsweise durch einen Dienstleister behandelt worden. DISKUSSION 4 131 DISKUSSION Mit den durchgeführten Untersuchungen zu Acidovorax valerianellae an Feldsalat wurden Erkenntnisse im Bereich der Erregerbiologie und Epidemiologie sowie des Einflusses von Infektionsbedingungen auf den Krankheitsverlauf gewonnen. Zudem wurden grundlegende Erkenntnisse zu Übertragungswegen und zu Bekämpfungsstrategien von A. valerianellae gewonnen. 4.1 Untersuchungen zu Infektionsbedingungen In den Untersuchungen zu den Infektionsbedingungen des Bakteriums wurden die Einflüsse von Temperatur, Blattalter, Blattnässedauer und Inokulumdichte erforscht. Nach GARDAN et al. (2003) und HINRICHS-BERGER et al. (2004) kann das Bakterium A. valerianellae Pflanzen sowohl im Keimblattstadium als auch Pflanzen im Laubblattstadium infizieren und zu Symptomen führen. Dies bestätigte sich in den Versuchen, in denen Pflanzen unterschiedlichen Blattalters inokuliert wurden (Kapitel 3.1.2). Der Befall an Feldsalatpflanzen war zudem innerhalb der Infektionsversuche sehr von den vorherrschenden Luftfeuchtigkeiten beziehungsweise der Blattnässedauer abhängig. Die Versuchspflanzen wurden einmalig für 48 Stunden, wöchentlich wiederkehrend (jeweils von 48-stündiger Dauer) oder dauerhaft unter gesättigter Luftfeuchte kultiviert (Kapitel 2.12.2). Allgemein fiel ein starker Unterschied zwischen der Symptomatik inokulierter Pflanzen auf, sobald sie weitestgehend trocken kultiviert beziehungsweise bei nahezu 100 % relativer Luftfeuchte mit lang andauernder Blattnässe kultiviert wurden. Gerade bei feuchter Witterung traten vermehrt Symptome auf. GRONDEAU und SAMSON (2009) fanden heraus, dass ein sichtbarer A. valerianellae-Befall stark von einem für 90 Stunden andauernden Wert von über 85 % relativer Luftfeuchtigkeit gefördert wird. Daher sollten Feldsalatbestände möglichst trocken gehalten werden, um einen Befall mit A. valerianellae zu vermeiden beziehungsweise zu vermindern (MOLTMANN et al., 2000). Alle Pflanzen, die bei eigenen Versuchen nach der Inokulation lediglich für die ersten 48 Stunden bei gesättigter Luftfeuchte kultiviert DISKUSSION 132 wurden, zeigten keine Symptome. Alle Pflanzen, die dauerhaft bei gesättigter Luftfeuchte kultiviert wurden, waren zu Versuchende Symptom tragend. Bei Pflanzen, die im wöchentlichen Abstand bei hoher Luftfeuchtigkeit (das heißt für die ersten 48 Stunden erfolgte die Kultivierung nach der Inokulation bei gesättigter Luftfeuchte, dann fünf Tage bei normal vorherrschender Luftfeuchte, danach erneut für 48 Stunden bei gesättigter Luftfeuchte und so fort) kultiviert wurden, zeigten sich ebenfalls Symptome. Eine 100 %-ige Befallshäufigkeit wurde dabei aber nicht erreicht. Es war ein deutlicher Unterschied zwischen den im Keimblatt und den im Laubblatt inokulierten Pflanzen sichtbar, was mit einer unterschiedlichen Blattoberfläche und -masse zusammenhing. Je weniger Blattmasse vorhanden war, desto schneller trockneten die Blätter ab. Die Feuchtigkeit ist für die Bakterien von enormer Wichtigkeit. So überstanden sie eine fünftägige Zeitspanne bei trockenen Bedingungen ohne Blattnässe (wöchentlicher Abstand), wohl aber nicht eine Trockenperiode von 30 Tagen beziehungsweise 33 Tagen bei einmaliger Kultur für 48 Stunden unter gesättigten Luftfeuchten nach der Inokulation, da zu Versuchende keine Symptome sichtbar waren (Abb. 3.5). Aus den Versuchen, wie sie in Kapitel 3.1.3 beschrieben sind, wird diese Abhängigkeit zwischen Blattnässe beziehungsweise einer hohen relativen Luftfeuchte und Symptomatik an inokulierten Feldsalatpflanzen deutlich. Nach einer 28-tägigen Kultivierung unter trockenen Bedingungen führte eine Weiterkultur bei gesättigter Luftfeuchte zwischen 38 dpi und 51 dpi zu einer leichten Zunahme der Befallsstärke von 3,5 % auf 4,7 % (Tab. 3.2). Ebenfalls wurde gezeigt, dass die Bakterien innerhalb von fünf Stunden in die Pflanze eindringen und mindestens sieben Tage unter ungünstigen, trockenen Bedingungen überleben, bevor sie bei gesättigter Luftfeuchte zu Symptomen führen (Abb. 3.9 und Abb 3.10). Die Bakterien lebten bei trockener Kultur der inokulierten Pflanzen nicht epiphytisch auf der Blattoberfläche, da Symptome bereits neun Tage nach Inokulation sichtbar waren. Wären die Bakterien erst innerhalb von zwei Tagen (ab 7 dpi) bei für sie günstigen, feuchten Bedingungen in das Blatt eingedrungen, so wären Symptome frühestens nach vier Tagen nach Wiederbefeuchtung beziehungsweise 11 dpi sichtbar gewesen. Die Ergebnisse in den Abbildungen 3.1, 3.3, 3.4 und 3.5 B belegen, dass sichtbare Symptome frühestens 4 dpi, bei Kultur unter gesättigter DISKUSSION 133 Luftfeuchte, an Pflanzen vorhanden sind. MOLTMANN (1999) beschrieb hingegen, dass Xanthomonas campestris pv. vitians Kopf- und Eissalatpflanzen sowie viele Unkrautarten epiphytisch besiedelt. So kann sich diese bakterielle Blattfleckenkrankheit so lange ohne Symptome auf der Pflanzenoberfläche halten, wie die Witterungsbedingungen für sie zunächst ungünstig sind. Erst nach längeren Regenperioden oder häufiger, starker Taubildung kommt es zu einem Befallsausbruch. Zu erkennen waren zwei grundsätzliche Ergebnisse: Der sichtbare Befall an Pflanzen war stark von der Blattnässedauer beziehungsweise der relativen Luftfeuchte abhängig. Ist keine für Bakterien günstige, annähernd gesättigte Luftfeuchte vorhanden, so führt eine Inokulation nicht zu einem sichtbaren Befall an Pflanzen (Abb. 3.5, 3.9, 3.10). Die starke Abhängigkeit zwischen Feuchtigkeit in Form von Blattnässe und Krankheitssymptomen wurde bei vielen Pflanzenpathogenen beschrieben. So zeigt der Forschungsauftrag des LANDWIRTSCHAFT UND FORSTEN BUNDESMINISTERIUM FÜR ERNÄHRUNG, (2001), dass die Krankheitsentwicklung des Pilzes Septoria petroselini an Petersilieblättern stark von der relativen Luftfeuchtigkeit abhängig ist. Bei einer relativen Luftfeuchte von 65 % kommt es zu einer geringen Krankheitsentwicklung, während der Befall bei einer Erhöhung der Luftfeuchte auf 85 % deutlich ansteigt. Förderlich für den Befall ist zudem eine zeitlich direkt auf die Inokulation folgende hohe Luftfeuchtigkeit. Aber auch nach einer längeren Trockenphase von bis zu 72 Stunden nach der Inokulation werden hohe Befallsstärken erzielt, wenn danach wieder feuchte Bedingungen herrschen. LEBEN (1988) berichtet, dass sich an inokulierten Gurkenknospen keine Pseudomonas syringae pv. lachrymans- und P. syringae pv. syringae-Bakterien isolieren lassen, sobald die Pflanzen nach der Inokulation bei relativen Luftfeuchten zwischen 30 % und 50 % kultiviert werden. Werden sie im Tag-/Nachtrhythmus bei unterschiedlichen Luftfeuchten zwischen 50 % bis 60 % und 90 % kultiviert, so ist der Nachweis intermediär. Nach Kultivierung zwischen 80 % und 90 % relativer Luftfeuchte lassen sich jedoch aus nahezu allen Knospen Bakterien isolieren. Eine starke Abhängigkeit zwischen dem Befall von Xanthomonas smithii ssp. citri an Zitrusgewächsen und der Blattnässedauer wird ebenfalls berichtet. So reichen vier DISKUSSION 134 Stunden Blattnässe aus, um bei optimalen Temperaturen zwischen 25 °C und 35 °C, einen 100 %-igen Befall an Pflanzen hervorzurufen (PRIA et al., 2006) Diese Ergebnisse lassen sich auf die hier vorgestellten Ergebnisse übertragen. Die Feldsalatpflanzen zeigten, trotz zeitweiliger Verringerung der Luftfeuchtigkeit, eine teilweise starke Erhöhung der Krankheitsentwicklung bezüglich Befallsstärke und Befallshäufigkeit, sobald anschließend wieder feuchte Bedingungen herrschten (Abb. 3.5, 3.7, 3.9, 3.10, Tab. 3.2). Dieser Anstieg des Kranheitsverlaufs bei erneuter Kultivierung unter gesättigter Luftfeuchtigkeit war jedoch von der Dauer der ersten Phase unter gesättigter Luftfeuchtigkeit abhängig. Dies wird aus den Ergebnissen der Abbildung 3.7 deutlich. Je länger die erste Phase unter feuchten Bedingungen andauerte, desto geringer war der Anstieg der Befallsstärke nach Wiederbefeuchten der Feldsalatpflanzen. Inokulierte Pflanzen, die in der ersten Phase 14 Tage beziehungsweise 18 Tage feucht inkubiert wurden (Abb. 3.7, Versuchsglieder D und E), zeigten nach siebentägiger Kultivierung unter trockenen Bedingungen bei Wiederbefeuchtung nur eine sehr schwache oder keine Zunahme der Befallsstärke. Normalerweise sind geschwächte Pflanzen anfälliger gegenüber Pathogenen und zeigen mehr Symptome. Dies trifft in diesem Fall jedoch nicht zu. Auf welchen Grund dieses Ergebnis zurückzuführen war, konnte abschließend nicht geklärt werden. CAVALCANTI et al. (2005) beschreiben, dass Acidovorax avenae subsp. citrulliBakterien zwischen 1 °C und 42 °C wachsen, wobei ihr Optimum bei 32 °C liegt. A. valerianellae-Bakterien weisen hingegen auf Nährmedium ein Wachstumsoptimum bei 28 °C auf, während unter einer Minimumtemperatur von 4 °C und über einer Maximumtemperatur von 41 °C kein Wachstum stattfindet (GARDAN et al., 2003, JASU, 2004). Aus vorherigen Versuchen war bekannt, dass Infektionsversuche im Bereich zwischen 10 °C bis 25 °C (GRONDEAU und SAMSON, 2009), 15 ° C (BARCHEND, 2006) und 18 °C (BRAJE, 2005) erfolgreich waren. Um den Temperatureinfluss in vivo zu ermitteln, wurden inokulierte Feldsalatpflanzen bei Temperaturen zwischen 10 °C und 30 °C bei gesättigten Luftfeuchten kultiviert und hinsichtlich Befallsstärke und Befallshäufigkeit bonitiert (Kapitel 3.1.1). Da in den letzten Jahren die Züchtung von Sommersorten zugenommen hat und somit ein ganzjähriger Anbau möglich ist, waren diese Untersuchungen innerhalb dieser DISKUSSION 135 Temperaturspanne sinnvoll. Im Feldsalatanbau werden durchaus tiefere (vor allem im Winter im Freiland) beziehungsweise höhere (vor allem im Sommer bei Anbau im Gewächshaus) Temperaturen erzielt. Unter den getesteten Temperaturen gab es keine, bei der die inokulierten Pflanzen keine A. valerianellae-Symptome zeigten. Eine Kultivierung der Pflanzen führte bei allen Temperaturen unter gesättigter Luftfeuchtigkeit zu einem sichtbaren Befall. Es waren jedoch in der Symptomausprägung und in der Symptomhäufigkeit Unterschiede zwischen den einzelnen Temperaturstufen während der Inkubation festzustellen. So nahmen beide Parameter mit zunehmender Temperatur während des Versuches zu. Innerhalb einer Inkubationstemperaturstufe nahmen die Werte mit zunehmender Dauer der Kultivierung ebenfalls zu. Eine Korrelation zwischen Befall und Temperatur war deutlich zu erkennen. Je höher die Temperatur desto höher war der sichtbare Befall an Feldsalatpflanzen (Abb. 3.1 und 3.2). Dies bestätigen auch GRONDEAU und SAMSON (2009), die zeigten, dass die Anzahl befallener Feldsalatpflanzen zunimmt, wenn die Temperatur steigt und die Phase mit Luftfeuchten über 85 % länger als 90 Stunden andauert. Weiterhin war in eigenen Versuchen zu erkennen, dass bei höheren Temperaturen und gesättigter Luftfeuchte das Pflanzenwachstum nicht optimal war. Die Pflanzen wuchsen zum einen bei höheren Temperaturen schneller, zum anderen waren sie durch den sich weiterentwickelnden Befall geschwächt und konnten daher zur Bonitur teilweise nicht herangezogen werden (Abb. 3.1, 30 °C, 12 dpi und Abb. 3.2, 20 °C, 25 dpi). Eine Überprüfung des Einflusses von Temperaturen zwischen 15 °C und 25 °C auf die Infektion von Feldsalat mit A. valerianellae lieferte ein entsprechendes Ergebnis: Befallsstärken und Befallshäufigkeiten waren umso höher, je höher die Inkubationstemperatur lag (Abb. 3.3 und 3.4). Diese Beobachtung lässt sich auch in anderen Wirt-Parasit-Systemen machen. So beschreiben FUKUI et al. (1999) eine lineare Beziehung zwischen höherer Temperatur (zwischen 19 °C und 35 °C) und der in Prozent befallenen Blattfläche an Anthurium andraeanum nach Inokulation mit Xanthomonas axonopodis pv. dieffenbachiae. LATORRE et al. (2002 b) berichten von einer signifikant positiven Beziehung zwischen der Temperatur (innerhalb von 5 °C und 20 °C) und dem Auftreten des Brand-Befalls an Birnenblüten durch Pseudomonas syringae pv. syringae. DISKUSSION 136 Die Ergebnisse, die bei Versuchen zum Einfluss auf die Infektion mit A. valerianellae in Abhängigkeit der Temperatur, dem Blattalter von Feldsalatpflanzen, der Blattnässedauer und der Inokulumkonzentration (Kapitel 3.1.4 und 3.2.3) erzielt wurden, waren wie erwartet. Generell waren bei höheren Konzentrationen der verwendeten Einzel-Isolate beziehungsweise des Isolategemisches mehr Pflanzen sichtbar erkrankt als bei geringeren Konzentrationen (Tab. 3.3 und Abb. 3.11). Das gilt auch für die Feldsalatsorten AV-1 und AV-5 (Abb. 3.18). Die Symptome waren zudem nach Inokulation mit höheren Inokulumdichten schneller sichtbar als nach Inokulation mit niedrigen Konzentrationen (Tab. 3.3). Das Ergebnis zeigte einen für Inokulumdichten typischen Gradienten. Da die inokulierten Pflanzen dauerhaft bei gesättigten Luftfeuchten kultiviert wurden, scheint das Ergebnis nicht weiter verwunderlich. So wurden schon mit einer geringen Konzentration von 102 cfu/ml Feldsalatpflanzen inokuliert und zeigten sichtbare Symptome. Mit zunehmender Zeit nach der Inokulation gleicht sich der Befall, wie er nach Inokulation mit niedrigen Isolatkonzentrationen erreicht wurde, mehr und mehr dem Befall nach Inokulation mit höheren Isolatkonzentrationen an (Abb. 3.11). Durch das stetige Wachstum aller Versuchspflanzen während der Versuche kam es vermehrt zu Berührungen zwischen einzelnen Symptom tragenden Blättern mit zunächst symptomlosen Blättern benachbarter Pflanzen. Eine sekundäre Ausbreitung war vermutlich die Folge. LESSL et al. (2007) beschreiben ebenfalls einen positiven Zusammenhang zwischen einer höheren Inokulumkonzentration und der Besiedlung von Wassermelonenblüten durch Acidovorax avenae ssp. citrulli. Durch Bonitur des A. valerianellae-Befalls nach Inokulation mittels verschiedener Methoden (Infiltration, Sprühinokulation, Bodeninokulation und Stichinokulation) durch JASU (2004) wird auch ein für Inokulumdichten typischer Gradient beobachtet. BRAJE (2005) berichtet, dass höhere Konzentrationen nach Bodeninokulation vermehrt zu sichtbarem Befall an Feldsalatpflanzen führen: so wiesen 75 % der Pflanzen nach Inokulation mit einer Konzentration von 108 cfu/ml Symptome auf gegenüber 3 % befallene Pflanzen bei 102 cfu/ml. Über den positiven Einfluss von Inokulumkonzentrationen in Abhängigkeit von der Temperatur auf einen Befall berichteten LATORRE et al. (2002 a). Es kommt vermehrt zu Frucht- und Zweiginfektionen an Süßkirsche durch Pseudomonas DISKUSSION 137 syringae pv. syringae, sobald die Bakterienkonzentration einen Wert von mindestens 103 cfu/ml übersteigt und gleichzeitig Temperaturen von mindestens 5 °C (Zweiginfektionen) beziehungsweise 10 °C (Fruchtinfektionen) herrschen. Weiterhin zeigen sie, dass der Befall an Früchten und Zweigen stark von der Dauer einer gesättigten Luftfeuchtigkeit abhängig ist. Je länger die Phase mit erhöhter Luftfeuchte andauert, desto mehr Frucht- und Zweigbefall ist bei geringeren Temperaturen von 5 °C und gleichzeitig erhöhten Inokulumkonzentrationen (107 cfu/ml) vorhanden. Temperatur und hohe Luftfeuchtigkeiten stellen die kritischen Faktoren für ein Überleben und die Krankheitsentwicklung dar, wobei die Temperatur bei P. syringae pv. syringae an Kirsche das größere Gewicht hat. Bei A. valerianellae stellte hingegen die Luftfeuchtigkeit den größten Einfluss auf die Infektion dar. Auch bei anderen Bakterienarten wie zum Beispiel Xanthomonas campestris pv. campestris an Brassica werden sowohl die Keimlinge als auch Pflanzen im Blühoder Fruchtstadium befallen. Zudem können hier Samen, Früchte, Blätter oder die Sprossachsen Symptome zeigen. Normalerweise zeigen infizierte Pflanzen erst ab einer Konzentration von mindestens 105 cfu/ml Symptome. Die optimale Wachstumstemperatur liegt bei 25 °C bis 30 °C, bei der nach sieben bis 14 Tagen Symptome sichtbar werden. Bei Temperaturen unter 18 °C bis 20 °C entwickeln sich keine sichtbaren Symptome an Kohlpflanzen (ANONYM, 2001). Die Ergebnisse A. valerianellae tragen dazu besser zu bei, die verstehen. Infektionsbiologie Grundsätzlich des Bakteriums entsprachen die Versuchsergebnisse den Erwartungen, insbesondere bei der Frage nach den Infektionstemperaturen, dem Blattalter und der Inokulumdichte. Die Ergebnisse des Einflusses der Blattnässedauer überraschten allerdings. Hier entsprachen die Ergebnisse der Erwartung, dass eine längere Blattnässedauer zu einem höheren Befall in Form von sichtbaren Symptomen führt, nur zum Teil. Aus den Ergebnissen wie sie in Kapitel 3.1.2 und 3.1.3 dargestellt wurden, ließ sich ein neues Phänomen in der Symptomatik erkennen. Es kam teilweise zu einem Rückgang in der Symptomausprägung an einzelnen Pflanzen und Blättern (siehe Abb. 3.5 und Abb. 3.7). Die Erklärung hierfür lieferte eine Betrachtung des Symptomverlaufs in Vorversuchen (zuvor nicht dargestellt). Es wurden Feldsalatpflanzen mit DISKUSSION 138 A. valerianellae-Suspension inokuliert und bei wechselfeuchten (an zwei aufeinanderfolgenden von sieben Tagen in der Woche war die Luftfeuchtigkeit regelmäßig gesättigt) und dauerhaft bei feuchten (nahezu 100 % Luftfeuchtigkeit) Bedingungen kultiviert. Die entstandenen Symptome wurden für jede Blattetage (von den Keimblättern bis zum zweiten Laubblattpaar) über die Dauer des Versuches in ihrem Aussehen und ihrer Anzahl ausgewertet. Die Symptome waren zunächst als wässrige, ölige, dunkelgrüne Flecken zu erkennen und konnten lediglich in dieser Stufe wieder verschwinden (Stufe 1). Die Flecken verfärbten sich nach und nach dunkler bis sie eine schwarze Farbe annahmen (Stufe 2). Bei fortschreitendem Befall wurden die schwarzen Flecken in einem weiteren Entwicklungsschritt nekrotisch und es entstand eine bräunliche Verfärbung mit chlorotischen Höfen (Stufe 3). Dies beschrieben neben MOLTMANN et al. (2000) auch GRONDEAU et al. (2007) und FRANKENBERG (2005). Die Anzahl an Symptom tragenden Pflanzen nahm bei Kultur unter gesättigter Luftfeuchte bis zum Versuchende kontinuierlich zu. Die Anzahl der Symptom tragenden Pflanzen, die unter wechselfeuchten Bedingungen kultiviert wurden, nahm grundsätzlich ebenfalls zu, es wurde jedoch auch ein partieller Rückgang der Anzahl befallener Pflanzen beobachtet. Sobald die Luftfeuchtebedingungen nicht mehr den für das Bakterium optimalen Infektionsbedingungen entsprachen, konnten Symptome, die sich in der ersten Entwicklungsstufe (Stufe 1) befanden, wieder verschwinden. Bei Wiederauftreten von gesättigten Luftfeuchten entwickelten sich die Bakterien im Blattgewebe jedoch weiter und der Befall war in Form von Symptomen erneut sichtbar. Haben sich die Bakterien schon so weit entwickelt, dass die Symptome die erste Entwicklungsstufe überschritten haben, so ist ein Verschwinden der Symptome nicht mehr möglich, auch wenn ungünstige Bedingungen herrschen. Der Befall bleibt sichtbar. DISKUSSION 4.2 139 Sortenanfälligkeit Bei einem Vergleich von verschiedenen Feldsalatsorten zeigte sich, dass alle getesteten Sorten nach Inokulation typische A. valerianellae-Symptome aufwiesen und keine Sorte eine vollständige Resistenz zeigte (Kapitel 3.2). Dies deckt sich mit Beobachtungen aus dem Feld (persönliche Mitteilung T. Brand, Nützlingseinsatz Baden e.V.). Signifikante Unterschiede gab es jedoch in der Befallsstärke und Befallshäufigkeit inokulierter Pflanzen verschiedener Sorten (Abb. 3.12 und 3.13). Die getestete Wildform V. rimosa (AV-13) war hingegen in allen Versuchen befallsfrei und damit hoch resistent gegen A. valerianellae (Abb. 3.12 und 3.13). Bei der Verwendung von einzelnen Isolaten und Inokulumdichten (Kapitel 3.2.2 und 3.2.3) wurde ebenfalls kein Befall an diesen Pflanzen hervorgerufen (Abb. 3.14, 3.15, 3.16, 3.17, 3.18 und 3.19, Tab. 3.4 und 3.5). Auch BRAJE (2005) berichtet, dass alle acht getesteten Sorten nach Bodeninokulation ohne signifikante Unterschiede anfällig für A. valerianellae waren. Die Ergebnisse der Resistenzprüfung von Feldsalat gegen A. valerianellae bestätigen ebenfalls eine Resistenz der Wildformen (BARCHEND 2006): V. rimosa und V. dentata erweisen sich als nicht infizierbar, während alle 15 getesteten Sorten aus dem Sortiment des Jahres 2002 anfällig waren. Für die zukünftige Züchtung von resistenten Sorten erscheint daher ein Rückgriff auf diese Wildarten zum Einkreuzen am vielversprechendsten. DISKUSSION 140 4.3 Übertragungswege 4.3.1 Boden GRONDEAU et al. (2003) berichten, dass das Bakterium A. valerianellae als bodenübertragbar gilt und den Wirt (Feldsalat) in einem frühen Wachstumsstadium infiziert. Weiterhin berichten sie von einer Befallszunahme bei erneuter Feldsalataussaat je mehr A. valerianellae-Inokulum anfangs im Boden vorhanden ist und dass Metam Sodium bei hoher Dosierung signifikant die Anzahl an Symptom tragenden Pflanzen im Vergleich zum unbehandelten Boden reduziert. In aufeinanderfolgenden Feldsalataussaaten nimmt mit jeder Aussaat die Befallshäufigkeit zu, wenn die infizierten Pflanzen in den Boden eingearbeitet werden. Ein direkter Nachweis des Inokulumanstiegs im Boden wurde durch Ausplattieren von Bodenproben auf semiselektivem Medium (nach GRONDEAU et al., 2007) geführt. Auch HINRICHS-BERGER et al. (2004) bestätigten eine Zunahme an infizierten, Symptom tragenden Pflanzen mit jeder Kultur, die unmittelbar nacheinander auf derselben zuvor kontaminierten Fläche erfolgte. Untersuchungen von BRAJE (2005) bestätigen die Überdauerung ebenfalls. Nach Einarbeitung von Ernterückständen befallener Feldsalatpflanzen und erneuter Aussaat von gesundem Feldsalatsaatgut zeigen dort gewachsene Pflanzen bereits im Keimblattstadium typische A. valerianellae-Symptome. Der gesamte Bestand zeigt acht Wochen nach der Aussaat an allen Pflanzen Symptome. Eine Kalkstickstoffgabe und eine Hitzeeinwirkung durch Abflammen des Oberbodens haben A. valerianellae nicht eliminiert. Die eigenen Versuche des Bodenüberdauerungsversuches über einen Zeitraum von acht beziehungsweise zwölf Monaten an zwei Standorten ergaben, dass die Befallshäufigkeiten in den ersten Monaten nach Einarbeitung von infiziertem Feldsalatblattmaterial in die Böden und nachfolgender Aussaat von gesundem Saatgut in diese Böden höher waren als mit längerem zeitlichem Abstand zur Einarbeitung (Tab. 3.6 und 3.7). Diese Beobachtung der Symptomatik wurde mittels TAS-ELISA-Ergebnisse bestätigt. Am Standort Quedlinburg wurden fünf Monate nach Kontamination an neuen Feldsalataussaaten sichtbare A. valerianellaeSymptome festgestellt und auch der Nachweis im TAS-ELISA an den Pflanzen war DISKUSSION 141 positiv. Am Standort Schifferstadt wurden zunächst über einen Zeitraum von drei Monaten nach Kontamination positive Nachweise geführt. Nach elf Monaten wurden jedoch erneut an 4,5 % der Pflanzen untypische A. valerianellae-Symptome im TASELISA als positiv detektiert. Eine Überdauerung über einen Zeitraum von mindestens elf Monaten scheint somit wahrscheinlich. Aufgrund unterschiedlicher Rottebedingungen kam es vermutlich zu einer ungleichmäßigen Verteilung des Inokulums im Boden und neue Aussaaten wurden befallen. Neben A. valerianellae sind noch andere Bakterienarten bodenübertragbar. So berichtet HSU (1991) davon, dass Pseudomonas solanacearum umso länger im Boden überdauert, je nasser dieser ist. Eine Infektion von Nachtschattengewächsen ist dabei umso höher, je höher die Inokulumdichte im Boden ist. Xanthomonas campestris pv. campestris überdauert ebenfalls im Boden. KOCKS et al. (1998) beschreiben eine dreijährig durchgeführte Studie, bei der Erntereste von infizierten Kohlbeständen in den Boden eingearbeitet wurden. Bakterien aus dem Boden wurden anschließend isoliert und in Kohlpflanzen infiltriert (Koch`sche Postulate). Die Wiederfindungsrate lag bei 58 %, wobei das Verschwinden der Bakterien aus dem Boden von dem Rottegrad abhängig ist und durch höhere Temperaturen (> 5 °C) gefördert wird. Ein kontinuierlicher Kohlanbau von Jahr zu Jahr wäre aufgrund der zeitlichen Abnahme des Bodeninokulums und dem völligen Verschwinden nach dem Winter möglich. Aus der Literatur sind unterschiedliche Angaben zu der Dauer des Überlebens von Xanthomonas campestris pv. campestris im Boden zu entnehmen. So wird von ANONYM (2001) berichtet, dass das Bakterium so lange im Boden überdauert wie unverrottete Pflanzenreste vorhanden sind, ohne Wirt bis zu 14 Tage im Sommer und bis zu 42 Tage im Winter. Nach SCHAAD und WHITE (1974) überdauert das Bakterium allerdings bis zu 244 Tage, während STRANDBERG (1973) sogar einen Zeitraum von zwei Jahren in kühlen Klimaten angibt. Die Infektionskette von Xanthomonas campestris pv. vitians an Salat kann durch eine möglichst schnelle und vollständige Verrottung der Pflanzenreste unterbrochen werden (MOLTMANN, 1999). WÖLK und SARKAR (1994) beschreiben, dass Xanthomonas campestris pv. pelargonii in Komposterde bis zu 26 Monate DISKUSSION überdauert 142 und der Bakteriengehalt mit zunehmender Zersetzung der Pelargoniestücke abnimmt. Die Literatur zeigt, dass eine Überdauerung von Pathogenen oft nur so lange nachweisbar ist, wie sich Wirte oder befallene Pflanzenreste im Boden vorfinden. Die Umsetzung der Pflanzenreste ist stark von den klimatischen Gegebenheiten und somit vom Standort abhängig. Der Standort hat somit auch einen wesentlichen Einfluss auf die Überdauerung von A. valerianellae im Boden. Für Feldsalat ist aufgrund des kleineren Habitus und dem weicheren Gewebe eine kürzere Verrottungszeit anzunehmen als bei Kohl. Die Überdauerungszeit von A. valerianellae im Boden beträgt mindestens elf Monate, abhängig von Inokulum und Standort. Dass der Standort auf den Zersetzungsgrad einen großen Einfluss hat, zeigten die Nachweise, die über elf (Schifferstadt) beziehungsweise fünf Monate (Quedlinburg) durchgeführt wurden. Zudem wurden die Versuche zu unterschiedlichen Zeitpunkten im Jahr angelegt. In Schifferstadt erfolgte die Einarbeitung im Herbst (September), in Quedlinburg im Frühjahr (März). Aufgrund der klimatischen Unterschiede an den beiden Standorten (Tab. 3.8) und der Unterschiede in der biologischen Bodenaktivität, die vom Bodenleben abhängig ist, erscheint es nicht verwunderlich, dass Pflanzenreste schneller oder langsamer abgebaut wurden. Niederschlag, Temperatur und Bodenaktivität stellten die kritischen Faktoren für das Überleben der Bakterien beziehungsweise für den Fortschritt der Zersetzung dar, wobei der Niederschlag und die Bodenaktivität hier die größeren Einflussfaktoren waren. 4.3.2 Als Alternative Wirtspflanzen weitere potentielle Wirtspflanzen neben Feldsalat wurden insgesamt 30 Pflanzenarten aus zwölf Familien geprüft (Kapitel 3.3.2). Alle Pflanzen wurden dazu durch Infiltrieren, Sprühen oder Stichverletzungen inokuliert. Die Auswertung erfolgte zum einen durch visuelle Bonituren (bei zwei Versuchsansätzen), zum anderen zusätzlich zu den visuellen Bonituren mittels Isolationen und anschließender Durchführung des TAS-ELISA (dritter Versuchansatz). Eine Schwierigkeit bei der Frage nach alternativen Wirtspflanzen war die methodische Umsetzung. DISKUSSION 143 A. valerianellae blieb im TAS-ELISA nachweisbar, auch wenn die entsprechenden Blattabschnitte zuvor mit 70 %-igem Alkohol oberflächendesinfiziert wurden. Somit ließ sich zwar durch TAS-ELISA feststellen, dass die Inokulation erfolgt war und dass es sich um A. valerianellae-Bakterien handelte, nicht aber, ob eine Infektion oder sogar eine Vermehrung der Bakterien im alternativen Wirtspflanzengewebe stattfand und diese Pflanzen Wirtspflanzen von A. valerianellae sein könnten. Die Ergebnisse basierten daher bei zwei Versuchsansätzen ausschließlich auf visueller Bonitur (Kapitel 3.3.2.1 und 3.3.2.2). Dass es zu sichtbaren Blattveränderungen durch die Infiltration bei verschiedenen Pflanzenarten kam, erschien nicht weiter verwunderlich, da massiv in das Pflanzengewebe eingegriffen wurde. Die Bonitur sprühinokulierter intakter Blattbereiche erschien dagegen aufschlussreicher zu sein. So zeigten Pflanzen der Familien Amaranthaceae (Chenopodium album (L.)), Apiaceae (Daucus carota subsp. sativus (Hoffm.) Schübl et. G. Martens., Petroselium crispum (Mill.) Nyman & A. W. Hill), Fabaceae (Phaseolus vulgaris (L.)) und Poaceae (Zea mays (L.)) nach Sprühinokulation Krankheitssymptome wie auch Pflanzen, die aus den Familien Asteraceae (Lactuca sativa (L.), Matricaria chamomilla (L.), Senecio vulgaris (L.)) und Brassicaceae (Raphanus sativus subsp. oleiformes (L.), Raphanus sativus subsp. sativus (L.), Raphanus sativus (L.)) stammten. Da die bonitierten Krankheitssymptome den typischen A. valerianellae-Symptomen an Feldsalat aber nicht in Form und Farbe glichen, wurde die Frage nach einer potentiellen Wirtspflanzeneignung nicht abschließend beantwortet. Es wurde weder bestätigt noch entkräftet, dass die sichtbaren Veränderungen von A. valerianellae verursacht wurden und dass es zu einer Anreicherung des Pathogens im alternativen Pflanzengewebe kam. Es muss daher davon ausgegangen werden, dass die untersuchten Pflanzen als Wirtspflanzen deutlich weniger geeignet waren als der Feldsalat oder keine Wirtspflanzen von A. valerianellae waren. Da sich bei der methodischen Umsetzung und der Probenaufbereitung in den ersten beiden Versuchsansätzen Schwierigkeiten ergaben, wurde ein dritter Versuchsansatz durchgeführt (Kaitel 3.3.2.3). Hier wurden lediglich einzelne Blatthälften von Pflanzen aus fünf Familien und Feldsalat mit A. valerianellae-Suspension inokuliert (Stichinokulation). Nachweise wurden sowohl durch visuelle Veränderungen im DISKUSSION 144 Blattgewebe als auch durch die Isolation von Bakterien aus diesen Bereichen geführt. Die Bakterienkolonien wurden anschließend im TAS-ELISA als A. valerianellaepositiv oder -negativ bestimmt. In den inokulierten Blatthälften von Feldsalatpflanzen waren lebensfähige Bakterien nach zwölf, 26 und 33 Tagen nachweisbar. Nach Isolationen aus den gegenüberliegenden nicht inokulierten Blatthälften von Feldsalat wurden ebenfalls nach zwölf und 26 Tagen lebensfähige A. valerianellae-Bakterien nachgewiesen. Das heißt, dass Bakterium hat sich in den nicht-inokulierten Blattbereich ausgebreitet. Zwölf bis 26 Tage nach der Stichinokulation waren an Pflanzenblättern der Familien Asteraceae (Lactuca sativa (L.)), Apiaceae (Petroselium crispum (Mill.) Nyman & A.W. Hill), Brassicaceae (Raphanus sativus subsp. oleiformes (L.), Raphanus sativus subsp. sativus (L.), Raphanus sativus (L.)) und Fabaceae (Phaseolus vulgaris (L.), Pisum sativum (L.)) Veränderungen sichtbar, aus denen zudem lebensfähige Bakterien isoliert wurden. Ein Nachweis lebensfähiger Bakterien war somit an allen untersuchten Pflanzen, mit Ausnahme der Pflanzen der Familie Amaranthaceae, möglich. Da sich das Bakterium bei diesen Pflanzen aber nicht in den nichtinokulierten Blattbereich ausgebreitet hatte, wie es bei Feldsalatpflanzen der Fall war, muss davon ausgegangen werden, dass keine der untersuchten Pflanzen Wirtspflanzen von A. valerianellae waren. Bei den untersuchten Pflanzen handelte es sich sowohl um weitverbreitete Unkräuter als auch um Gemüsepflanzen. Im Pfälzer Anbaugebiet kommt es zu einer wechselnden Bewirtschaftung gleicher Flächen durch verschiedene Anbauer. Somit kann Feldsalat im Fruchtfolgewechsel eine Vor- oder Nachfrucht von Möhre-, Petersilie-, Erbse-, Zuckermais-, Eissalat-, Bataviasalat-, Radies-, Rettich- und anderen Beständen sein (persönliche Mitteilung J. Kreiselmaier, DLR Rheinpfalz). Ein Anbau von Feldsalat auf der gleichen Fläche wird von den Anbauern in der Regel in einem Abstand von zwei Jahren durchgeführt (persönliche Mitteilung J. Geil, Pfälzer Anbauer). Eine Eignung dieser Pflanzen als potentielle Wirte wäre somit theoretisch denkbar, wurde aber in diesen Versuchen nicht nachgewiesen. Als Bekämpfungsmaßnahme wären eine weite und abwechselnde Fruchtfolge zu nennen, wie sie auch MOLTMANN (1999) als Bekämpfungsmaßnahme von DISKUSSION 145 Xanthomonas campestris pv. vitians an Salat rät. Weiterhin rät sie zu einer sorgfältigen Unkrautbekämpfung. Die Adernschwärze, verursacht durch Xanthomonas campestris pv. campestris, kann an vielen Arten der Brassica-Familie vorkommen, zu denen auch Unkräuter gehören. So können Symptome an Hirtentäschelkraut (Capsella bursa-pastoris), Acker-Rettich (Raphanus raphanistrum) und Acker-Schmalwand (Arabidopsis thaliana) vorkommen. Das Pathogen sitzt dabei an Früchten, Blättern, Wurzeln, Sprossachsen und Samen (ANONYM, 2001). Da A. valerianellae vermutlich in Feldsalatpflanzen und Rückständen von Feldsalatpflanzen überdauert, erscheint eine Unkrautbekämpfung zur Unterbindung der Ausbreitung von A. valerianellae nicht unbedingt erforderlich. Es sei denn, Feldsalatpflanzen kommen in der Fruchtfolge oder zusätzlich in bestehender Feldsalatkultur als Unkräuter und somit als Inokulumquelle vor. 4.3.3 Saatgut Um Feldsalatsaatgut auf eine Kontamination mit A. valerianellae zu untersuchen und in diesem Zusammenhang die Frage nach einer möglichen Saatgutübertragung zu beantworten, standen verschiedene Methoden zur Verfügung. So wurden die zu untersuchenden Samen entweder in Vermiculit (Sweatbox-Test, Kapitel 2.15.1.1), in Erde (Aufwuchstest im Gewächshaus, Kapitel 2.15.1.2) oder auf Papier (Ankeimmethode auf Papier, Kapitel 2.15.1.3) ausgesät und an verschiedenen Tagen nach Aussaat bonitiert, wobei die Ankeimmethode auf Papier im November 2010 von Frau K. Thiele (Julius Kühn-Institut) bereitgestellt wurde. Die drei verwendeten Nachweisverfahren besaßen zwei Gemeinsamkeiten: die Notwendigkeit einer hohen Luftfeuchtigkeit nach Aussaat der Samen und eine Untersuchung von Keimlingen beziehungsweise Pflanzen im TAS-ELISA. Unterschiedlich waren hingegen die für die Keimlinge verfügbaren Nährstoffe und somit auch ihre Entwicklung und Widerstandsfähigkeit gegenüber A. valerianellae und anderen Pathogenen wie beispielsweise Pilzen. Die Durchführung und Handhabung des Aufwuchstests im Gewächshaus war einfach. So wurde eine geringe, nicht abgezählte Samenanzahl in Erde ausgesät und nach Kultivierung bei gesättigter Luftfeuchte wurden die Symptome an den DISKUSSION 146 aufgelaufenen Pflanzen bonitiert. Von Pflanzen mit sichtbaren Symptomen wurden Pflanzensaftproben im TAS-ELISA überprüft. Diese Methode wurde zu unterschiedlichen Jahreszeiten und bei unterschiedlichen Temperaturbedingungen im Gewächshaus durchgeführt und war nicht standardisierbar, so dass die Ergebnisse kaum reproduzierbar waren. Sie eignet sich daher nicht für eine im Routineverfahren eingesetzte Nachweismethode, zumal das gesamte Nachweisverfahren nahezu zwei Monate dauern würde. Zudem fehlte die Nachweissicherheit. Kontaminierte Saatgutpartien, die zuvor in verschiedenen Versuchen nach Aussaat A. valerianellaeSymptome an Pflanzen zeigten, wurden im Aufwuchstest im Gewächshaus als nichtkontaminiert ausgewiesen. Besser geeignet erschien hingegen der Sweatbox-Test, der unter standardisierten Bedingungen in der Klimakammer durchgeführt wurde. Diese Nachweismethode wird derzeit als Routineverfahren bei Saatgutzüchtern eingesetzt. Die Pflanzen werden dabei visuell auf einen A. valerianellae-Befall untersucht und bei verdächtigen beziehungsweise typischen Symptomen werden diese mittels PCRUntersuchung näher geprüft. Sobald eine Saatgutbelastung detektiert wird, wird diese Saatgutpartie nicht für den weiteren Vertrieb zugelassen (persönliche Mitteilung, A. Schieder, Enza Zaden). Die Kultivierung der Pflanzen wurde in eigenen Versuchen in Vermiculit durchgeführt. Nach Aussaat von 5000 Samen wurde der Test für maximal 28 Tage durchgeführt, was nur der Hälfte der Zeit gegenüber dem Aufwuchstest im Gewächshaus entspricht. Teilweise wurden die Pflanzen sehr stark von Pilzen überwachsen, so dass eine Bonitur nicht mehr durchzuführen war. Kontaminierte Saatgutpartien zeigten im Sweatbox-Test zudem nicht immer einen Befall an Pflanzen. Für die Ankeimmethode auf Papier mit anschließendem TAS-ELISA wurden zu untersuchende Samen als Einzelproben für bis zu 14 Tage auf feuchtem Filterpapier ausgelegt und zu vier verschiedenen Zeitpunkten für die ELISA-Untersuchung herangezogen. Dies entspricht der Hälfte der Zeit gegenüber dem Sweatbox-Test und dem Viertel der Zeit gegenüber dem Aufwuchstest im Gewächshaus. Ein leichter Rückgang der OD-Werte innerhalb des vierzehntägigen Untersuchungszeitraumes war aufgrund des Schwankungsbereichs der Probennahme (Einzelansätze) erklärbar. Nach Berechnung des Kontaminationsschwellenwertes (mean + 2 * s) jeder Maxisorpplatte gab der gemessene OD-Wert der zu untersuchenden Saatgutprobe DISKUSSION 147 Aufschlüsse über die Kontamination beziehungsweise über eine Befallsfreiheit. Das Verfahren war schnell, einfach durchzuführen, nachweissicher und reproduzierbar. Zudem konnte auch bei hoher Pilzbelastung ein zufriedenstellendes Ergebnis erzielt werden. Diese Methode eignet sich daher für ein Routineverfahren. Eine Keimlingsentwicklung war für diese Untersuchung unerlässlich. Nach persönlicher Mitteilung von K. Thiele (Julius Kühn-Institut) erreicht eine schwach belastete Partie nach neun bis dreizehn Tagen ihren maximalen OD-Wert im TASELISA, während der OD-Wert bei einer stark belasteten Partie nach fünf bis sieben Tagen am höchsten sei. Nach neuesten Untersuchungen am Julius Kühn-Institut ist für einen Saatgutnachweis eine Homogenisierung angekeimter Samen nach sieben Tagen ausreichend. Bei geringer Pathogenlast ergibt eine weitere Messung nach zehn Tagen weiterhin Aufschluss über die Befallsfreiheit beziehungsweise Kontamination des zu testenden Saatgutes. Die Untersuchung am Tag null ist für eine Routinetestung nicht nötig. Die Befallsfreiheit der gesunden Ausgangssaatgutpartie „AV-60“ und die Kontamination der infizierten Ausgangssaatgutpartie „AV-75“ wurden mit allen drei Methoden (Sweatbox-Test, Aufwuchstest im Gewächshaus, Ankeimmethode auf Papier) bestätigt. Da die Samen der beiden Ausgangspartien, egal ob ungebeizt, gebeizt oder mit entfernter Beize, mit der Ankeimmethode auf Papier zu einem späteren Zeitpunkt (ab November 2010) untersucht wurden, keimten diese kaum noch (> 5 %) oder gar nicht mehr. Im Fall der untersuchten Ausgangssaatgutpartien ähneln daher die Auswertungstage vier, neun und 14 dem Ergebnis der am Tag null durchgeführten Untersuchung und lassen keinen sicheren Nachweis zu, aber eine Tendenz erkennen (Tab 3.18 und 3.19). Da bei der Ankeimmethode auf Papier für jeden der vier Auswertungstage eine gesonderte Menge des zu untersuchenden Saatgutes untersucht wurde (vier Einzelansätze) und die Probenmenge von 0,2 g gering war, wurde schwach kontaminiertes Saatgut nicht immer sicher nachgewiesen. So konnten die durch Rijk Zwaan nachgewiesene Kontamination des Partie „AV-78 (Frankreich)“ und durch Enza Zaden nachgewiesene Kontamination der Partie „AV-62“ (Tab. 3.15) weder mit dem Aufwuchstest im Gewächshaus, dem Sweatbox-Test noch mit der Ankeimmethode auf Papier bestätigt werden. Die im Sweatbox-Test und im Aufwuchstest im Gewächshaus nachgewiesene Kontamination der Partie „AV-76 DISKUSSION 148 (Deutschland)“ wurde lediglich am vierten Untersuchungstag (Tag 14) durch die Ankeimmethode auf Papier und dem TAS-ELISA bestätigt (Tab. 3.14). Die Ergebnisse zeigen, dass eine Saatgutübertragung von A. valerianellae möglich war und auch mit verschiedenen Nachweismethoden diagnostiziert wurde. GRIMAULT et al. (2006) sowie GRONDEAU und SAMSON (2009) bestätigen ebenfalls eine Saatgutübertragung von A. valerianellae bei Feldsalatsaatgut. Zu untersuchende Saatgutpartien werden hier nach einem Nachweisverfahren, das von GRIMAULT et al. (2006) entwickelt wurde, entweder auf Papier (8 * 450 Samen) ausgelegt oder in Substrat (jeweils 4 * 250 Samen) ausgesät. Die Kulturführung der Substratvariante war unterschiedlich. Die Hälfte der Kisten wird bei normalen Bedingungen kultiviert, die übrigen bei gesättigter Luftfeuchte. Alle Methoden ergeben einen sichtbaren Befall mit A. valerianellae, wobei mehr Pflanzen sichtbar befallen sind, wenn sie auf Papier ausgelegt werden. Für Saatgutpartien mit hoher saprophytischer Belastung ist eine Aussaat in Substrat von Vorteil. GRONDEAU und SAMSON (2009) beschreiben eine qualitative Untersuchung von Feldsalatsaatgut. Dafür werden die zu untersuchenden Samen in Wasser geschüttelt (eine Stunde bei 4 °C). Der Überstand der Schüttelkultur wird auf Nährmedium ausplattiert. Die sich entwickelnden Bakterien werden danach näher bestimmt. Ob Feldsalatpflanzen, die sich aus kontaminiertem Saatgut entwickelt haben, das Bakterium an die Folgegeneration weitergeben, scheint von mehreren Faktoren abhängig zu sein. Zum einen trägt der entsprechende Standort, an dem die Pflanzen das Folgesaatgut produzieren, wesentlich zu einer Übertragung bei, da an jedem Standort unterschiedliche klimatische Bedingungen vorherrschen. So unterschieden sich die Standorte Deutschland und Frankreich deutlich voneinander. Zum anderen tragen das verwendete Saatgut und seine Kontamination wesentlich zu einer Saatgutübertragung bei. Es wurde in diesen Versuchen sowohl ungebeiztes als auch gebeiztes Saatgut einer Sorte eingesetzt. Im Allgemeinen wird eine Saatgutbeize gegen pilzliche samenübertragbare Krankheitserreger eingesetzt und kann Ertragsausfälle und Qualitätseinbußen minimieren. Weiterhin lässt sich ein Zusammenhang zwischen der A. valerianellae- Befallshäufigkeit im Saatgutproduktionsbestand und der Nachweishäufigkeit im DISKUSSION Saatgut 149 erkennen. Sind an vielen Pflanzen des Produktionsbestandes A. valerianellae-Symptome sichtbar, dann weisen auch die Einzelergebnisse verschiedener Methoden auf eine höhere Belastung des produzierten Saatguts hin. So wurde die Saatgutpartie „AV-76 (Deutschland)“ mit allen drei Methoden (Sweatbox-Test, Aufwuchstest im Gewächshaus, Ankeimmethode auf Papier) als kontaminiert ausgewiesen (Tab. 3.13 und 3.14), im Produktionsbestand zeigten 4,7 % der Pflanzen A. valerianellae-Symptome (Abb. 3.20). Die Saatgutpartie „AV78 (Frankreich)“ wurde nur in der Untersuchung der Firma Rijk Zwaan als belastet eingestuft, im Produktionsbestand wiesen 1,1 % der Pflanzen Symptome auf. Eine sekundäre Ausbreitung als Ursache für die Befallsrate der beiden Saatgutpartien („AV-76 (Deutschland)“ und „AV-78 (Frankreich)“) erscheint jedoch unwahrscheinlich, da die befallenen Pflanzen gleichmäßig im Bestand verteilt auftraten und keine Ausbreitungsherde zu beobachten waren. Nach Aussaat der kontaminierten Ausgangspartie im Jahr 2008 wurde ein zunehmender A. valerianellae-Befall (bis 35 %) innerhalb von 66 Tagen an Pflanzen bonitiert (Abb. 3.21). Eine sekundäre Ausbreitung war hierfür die Ursache und Ausbreitungsherde wurden beobachtet. Die produzierte Saatgutpartie „AV-77“ wurde lediglich mit dem Sweatbox-Test und dem Aufwuchstest im Gewächshaus als kontaminiert nachgewiesen (Tab. 3.13), mit der Ankeimmethode auf Papier war die Saatgutpartie befallsfrei (Tab. 3.14). Ob eine Saatgutpartie kontaminiert wird und ob die Kontamination schwach oder stark ist, hängt somit von der im Produktionsbestand vorkommenden Befallshäufigkeit ab. Ein hoher Befall scheint eine hohe Kontaminationsrate des Tochtersaatguts zur Folge zu haben. Ob es aber auch zu einer Übertragung kommt, wenn im Produktionsbestand kein Befall sichtbar war, ließ sich weder bestätigen noch ausschließen. Bei der samenübertragbaren Krankheit Xanthomonas campestris pv. campestris an Kohl können auch symptomlose Pflanzen infizierte Samen produzieren (ANONYM, 2001). WALCOTT et al. (2003) berichten ebenfalls, dass es ohne sichtbaren Befall zu einer Saatgutübertragung von Acidovorax avenae ssp. citrulli an Wassermelonen kommt. Nach WALKER (1952) findet die Saatgutkontamination vor allem bei hoher Luftfeuchtigkeit und Beregnung statt, weniger durch vaskulären Transport. DISKUSSION 150 In elektronenmikroskopischen Untersuchungen mit Goldpartikelmarkierung, die am Julius Kühn-Institut von mit A. valerianellae-kontaminierten Feldsalatsamen durchgeführt wurden, waren vermehrt Bakterien am äußeren Rand eines Saatgutkornes zu finden und nur sehr vereinzelt im Inneren des Kornes lokalisiert (persönliche Mitteilung K. Thiele, Julius Kühn-Institut). Dies deutet darauf hin, dass die Saatgutkontamination durch A. valerianellae vermehrt durch äußere Einflüsse als durch vaskulären Transport geschieht. Durch die im Jahr 2009 durchgeführte Aussaat der gebeizten Ausgangssaatgutpartien sollte vor allem ein Einfluss der Bewässerungsstrategie auf die Saatgutübertragung von A. valerianellae ermittelt werden. Verwendet wurde hier gebeiztes Saatgut, da das ungebeizte Saatgut nicht mehr im ausreichenden Maße zur Verfügung stand. Die Bestände wurden zum einen mittels Tröpfchenbewässerung gewässert, zum anderen durch eine Beregnung über Kopf, wie sie auch in den Vorjahren stattfand. Die Vermutung, dass eine Saatgutübertragung nur dann zustande kommt, wenn es über die Bewässerung zu einem Hochspritzen von Bakterien aus Symptom tragenden Blättern in die Blüte und somit von außen an das Saatgut kommt, konnte jedoch auf Basis der Ergebnisse nicht bestätigt werden. Alle untersuchten Saatgutpartien waren gesund, mit Ausnahme der Saatgutpartie „AV-64 (Tröpfchen)“. Diese war nach Untersuchung mittels Sweatbox-Test und Aufwuchstest im Gewächshaus frei von A. valerianellae (Tab. 3.13), während sie nach Durchführung der Ankeimmethode auf Papier als kontaminiert ausgewiesen wurde (Tab. 3.14). Bewässerungsunabhängig traten im Produktionsbestand keine A. valerianellae-Symptome auf, weder bei Pflanzen der gesunden Ausgangspartie noch bei Pflanzen der kontaminierten Ausgangspartie, so dass das Ergebnis der Ankeimmethode auf Papier als falsch-positiv zu bewerten ist. Verantwortlich für dieses Ergebnis scheint dennoch weder das Aussaatjahr noch die Bewässerung zu sein, sondern die Beize des Saatguts. Eine chemische Saatgutbeize kann einen A. valerianellae-Befall mindern. So bestätigten Untersuchungen der gebeizten Ausgangssaatgutpartien im Sweatbox-Test eine Befallsfreiheit (Tab. 3.13). Nach persönlicher Mitteilung von G. Hiddink (Enza Zaden) kann eine Beizung mit Thiram, Metalaxyl und Iprodion einen bakteriellen A. valerianellae-Befall an Pflanzen überraschend abschwächen. Ergebnisse eigener Vorversuche (Ergebnisse nicht dargestellt) konnten dies ebenso bestätigen. Aus der Literatur ist bekannt, dass DISKUSSION 151 eine Samenbehandlung mit Thiram die Vermehrung von schnell-wachsenden Bakterien verhindern und zum Tod von langsam-wachsenden Bakterien führen kann und so den Ertrag von Sojabohnen steigert (TIL’BA et al., 2011, Abstract). Um den Einfluss der Bewässerungstechnik auf eine Saatgutübertragung eindeutig zu untersuchen und damit auch die Frage nach der Lokalisierung von A. valerianellae am oder im Samen zu beantworten, müsste dieser Versuch mit ungebeiztem Saatgut einer stark kontaminierten Saatgutpartie wiederholt werden. DISKUSSION 4.4 152 Dekontamination von Saatgut Die eigenen Ergebnisse und die Ergebnisse aus der Literatur zeigen, dass es sich bei A. valerianellae um eine saatgutübertragbare Krankheit an Feldsalat handelt. Eine Strategie für die Produktion gesunden Saatguts ist daher von enormer Wichtigkeit. Um eine solche Strategie für gesundes Saatgut zu realisieren, müssen laut ROBERTS (2009) folgende Maßnahmen beachtet werden: Die Saatgutproduktion muss zunächst in Gebieten stattfinden, die frei von bestimmten Pathogenen sind. Saatgutpartien sollen mittels Saatguttests auf ihre Pathogenbelastung untersucht werden. Möglicherweise müssen die Partien, bei positivem Befund, verworfen oder mittels Dekontaminationsmethode behandelt werden. Eine weitere Maßnahme wäre, unabhängig vom gesundheitlichen Status, eine generelle Saatgutbehandlung mit dem Ziel das Pathogen im Saatgut zu eliminieren beziehungsweise das Inokulum auf ein nicht schädliches Niveau zu reduzieren. Dabei sollte die Keimfähigkeit und Lebensfähigkeit der Samen nicht reduziert werden. Die Behandlung sollte darüber hinaus für Mensch und Tier sowie Umwelt unschädlich sein. Mit Blick auf diese Punkte wurden zwei kontaminierte Partien (AV-219 und AV-17) für die Untersuchungen herangezogen (Kapitel 3.4.2). Es sollte eine geeignete Dekontaminationsmaßnahme für mit A. valerianellae-kontaminiertes Saatgut ermittelt werden. Die Ausgangsbelastung des unbehandelten Saatguts wurde zunächst mit der Ankeimmethode auf Papier und anschließendem TAS-ELISA überprüft. Das kontaminierte Ausgangssaatgut wurde sicher nachgewiesen, wobei die Nachweisgrenze bei < 10 % infizierter Samen lag. Die Nachweisgrenze wurde nach Untersuchung von gesunden und kontaminierten Saatgutpartien unterschiedlicher Belastung in Form eines Ringtests durch verschiedene Labore bestätigt (Ergebnis nicht dargestellt). Über drei Strategien (Warmwasserbehandlungen, Dampfbehandlungen und eine unbekannte Behandlung durch einen Dienstleister) wurde versucht, diese Belastung zu verringern oder sogar zu eliminieren. Das Saatgut wurde vor und nach einer DISKUSSION 153 Behandlung zudem auf seine Keimfähigkeit überprüft. Eine gute Keimfähigkeit ist mit über 90 % gegeben (persönliche Mitteilung A. Schieder, Enza Zaden). Aus den Ergebnissen der Dekontaminationswirkungen und mit Blick auf die erzielten Keimfähigkeiten war ersichtlich, dass die Behandlungen unterschiedliche Einflüsse auf das zu dekontaminierende Feldsalatsaatgut hatten. OD-Werte unbehandelter, kontaminierter Feldsalatsamen stiegen normalerweise über die Dauer der Kultivierung an und lagen spätestens ab dem dritten Auswertungstag (Tag neun nach Aussaat) deutlich oberhalb des errechneten ELISA-Grenzwertes (mean + 2 * s). Für den ersten Untersuchungstag (Tag null) wurde das Saatgut ohne vorheriges Ankeimen für den TAS-ELISA aufgearbeitet und gemessen. Für die Untersuchungstage vier, neun und 14 wurde das Saatgut entsprechend vier, neun und 14 Tage lang auf feuchtem Filterpapier angekeimt, bevor es für den TAS-ELISA aufgearbeitet wurde. In dieser Arbeit wurde für die Ankeimmethode auf Papier eine Probenmenge von 0,2 g je Auswertungstag eingesetzt, was sich als ausreichend erwies. Die Sorten AV-17 und AV-219 wiesen nämlich eine A. valerianellae-Ausgangskontaminationen von 17 % beziehungsweise 10 % auf. Bei einer zu untersuchenden schwächer kontaminierten Partie könnte sich diese Probenmenge als zu gering erweisen. Es sollten daher mindestens 0,5 g, was je nach Korngewicht 215 bis 430 Samen entspricht, ausgelegt werden. Die Gefahr, dass nur gesunde Samen ausgelegt und das Ergebnis verfälschen würden, wäre umso höher, je geringer die Ausgangskontamination und die eingesetzte Probenmenge ist. Für die Frage, ob es durch eine Behandlung (Warmwasser, Dampf und Dienstleisterbehandlung) zu einer Dekontamination der Samen kam, wurde eine andere Interpretation der Messergebnisse vorgenommen. Die Inanspruchnahme einer berechneten Nachweisgrenze (mean + 2 * s), ab welcher höhere OD-Werte eindeutig A. valerianellae-positiv und niedrigere OD-Werte eindeutig A. valerianellae-negativ waren, erfolgte hier nicht. Grund dafür waren die Schwankungen der Kontamination mit A. valerianellae bei einzelnen Saatgutkörnern. Ausschlaggebend für eine Interpretation der Ergebnisse waren daher OD-Werte, die am ersten DISKUSSION 154 Untersuchungstag nach Dekontamination (Tag null, ohne Ankeimen der Samen) erzielt und als Schwellenwerte herangezogen wurden. Eine Dekontamination wurde angenommen, wenn die OD-Werte der Tage vier, neun und 14 nach dem Ankeimen alle unterhalb des Schwellenwertes beziehungsweise am Schwellenwert (um 0,01 Messwerte verschieden) lagen. Die Dekontamination war unzureichend, wenn mindestens einer der OD-Werte der Tage vier, neun oder 14 deutlich oberhalb des Schwellenwertes (mindestens doppelter Messwert) lag. Aufgrund des getrennten Ankeimens der Samen für die Tage vier, neun und 14 kam es vor, dass lediglich ein Messergebnis angekeimter Samen über dem Schwellenwert lag und eine unzureichende Dekontamination auswies. Eine alleinige Betrachtung vor und nach Behandlung einer kontaminierten Saatgutpartie jeweils zum Zeitpunkt des ersten Untersuchungstages ohne Ankeimen (Tag null) reicht nicht aus, um einen Dekontaminationserfolg der Methode zu ermitteln, da der A. valerianellae-Befall möglicherweise unter der Nachweisgrenze liegt. Durch eine Aussaat und Kultur unter feuchten Bedingungen vermehrt sich das möglicherweise nicht abgetötete Bakterium und wird so nachweisbar. Die Behandlung durch einen Dienstleister führte an Samen zu keinen Keimfähigkeitsverlusten (AV-17: 97 %, AV-219: 95 %) und erfüllte damit eine positive Erwartung (Abb. 3.27). Im Hinblick auf die Dekontamination zeigte sich jedoch keine zufriedenstellende Wirkung. Proben beider Saatgutpartien erreichten hohe OD-Werte, die dem Verlauf der unbehandelten kontaminierten Samen nahezu identisch folgten (Abb. 3.28). Somit ergab sich eine mangelnde Dekontaminationswirkung der Behandlung und eine solche Behandlung ist eindeutig als nicht sinnvoll einzustufen. Nach Dampfbehandlung waren bei der Sorte AV-219 Keimfähigkeitsverluste auf bis zu 80 % (64 °C, 150 Sekunden) zu verzeichnen, während die Sorte AV-17 positiv in ihrer Keimfähigkeit beeinflusst wurde (Abb. 3.25 und Tab. 3.16). Nach Durchführung der Ankeimmethode auf Papier wurde ersichtlich, dass lediglich die Sorte AV-219 nach einer Behandlung bei 66 °C für 105 Sekunden tendenziell gute Erfolge erzielte, nicht jedoch nach einer Behandlung bei 64 °C für 150 Sekunden (Abb. 3.26 B). Die Sorte AV-17 wurde durch keine Dampfbehandlung ausreichend DISKUSSION 155 dekontaminiert (Abb. 3.26 A). Die Erforschung und Weiterentwicklung einer Dampfbehandlung als Dekontaminationsmaßnahme verspricht im Allgemeinen dennoch gute Erfolge. So beschreiben KOCH et al. (2010), dass bei der Untersuchung von Karottensamen unterschiedlicher Sorte und Saatgutpartie, die mit Alternaria dauci und A. radicina befallen sind, eine Dampfbehandlung die besten Wirkungsergebnisse erzielt. Auch SCHMITT et al. (2009) beschreiben höchste Wirksamkeiten mit bis zu 90 % an Reduktion des Ausgangsbefalls von Phoma valerianellae an Feldsalat durch Behandlungen mit Heißluft. Nach Durchführung der Warmwasserbehandlungen bei verschiedenen Temperaturen und Einwirkzeiten wurde ersichtlich, dass einzelne Sorten auf gleiche Behandlungen deutlich unterschiedlich in ihrer Keimfähigkeit reagierten, wobei die Sorte AV-17 weniger stark als die Sorte AV-219 reagierte (Abb. 3.23). Beide Sorten wurden jedoch von der Behandlung bei 55 °C für 20 Minuten deutlich in ihrer Keimfähigkeit geschwächt (AV-17: 78 %, AV-219: 33 %). Bei beiden Sorten wurde jedoch keine Warmwasserbehandlung mit komplettem Wirkungserfolg in Form einer Dekontamination erzielt. So beschreibt dies auch ROBERTS (2009) bei der Untersuchung von mit Xanthomonas campestris pv. campestris belastetem Kohlsaatgut. Eine Reduzierung durch Heißwasser wird erzielt, nicht aber eine vollständige Elimination. Bei der Sorte AV-17 stellte sich die Behandlung bei 55 °C für 20 Minuten als am vielversprechendsten heraus, während es bei der Sorte AV-219 die Behandlungen bei 43 °C für 20 Minuten und bei 60 °C für 5 Minuten waren (Abb. 3.24). Bei der Untersuchung von Feldsalatsamen unterschiedlicher Sorte und Saatgutpartie, die mit Phoma valerianellae befallen sind, führt eine Behandlung mit Heißwasser bei 50 °C für 20 Minuten und bei 53 °C für 10 Minuten zu den höchsten Wirkungsergebnissen zwischen 19 % und 40 % (SCHMITT et al., 2009). Die Erforschung und Weiterentwicklung einer Warmwasserbehandlung erscheint demnach auch hier sinnvoll. Aus den Keimfähigkeitsergebnissen nach Durchführung der drei Behandlungen war ersichtlich, dass jede Saatgutpartie anders reagierte. Die Sorte AV-17 reagierte mit geringeren Keimfähigkeitseinbußen als die Sorte AV-219. Am stärksten DISKUSSION beeinträchtigt 156 war die Warmwasserbehandlungen bei Keimfähigkeit höheren nach Durchführung Wassertemperaturen und der längeren Einwirkzeiten (55 °C, 20 Minuten), weniger durch Dampfdesinfektion und durch die unbekannte Behandlung eines Dienstleisters. Dies deutet darauf hin, dass die Warmwasserbehandlung auch tiefere Samenschichten erfasste und den Keimling schädigte. Das Saatgut scheint bei der Dauer der Behandlung aufgequollener zu sein, je mehr Wasser es umgeben hat. Der Keimvorgang wurde dadurch vermutlich schneller eingeleitet als durch Dampfbehandlung und durch die Behandlung eines Dienstleisters. Die Wärmebelastung am Saatgut war dadurch höher, so dass das Saatgut empfindlicher reagierte und schlechter keimte. Dass eine Behandlung mit heißem Dampf beziehungsweise heißer Luft zu weniger Keimfähigkeitseinbußen führt als eine Warmwasserbehandlung, ist auch aus der Literatur bei anderen Samenarten bekannt. So beschreiben GRONDEAU et al. (1992) einen höheren Keimfähigkeitsverlust bei Erbsensamen durch eine Behandlung mit Heißwasser als mit Heißluft. Die Behandlungen für 72 Stunden bei 65 °C (Heißluft) beziehungsweise 15 Minuten bei 55 °C Wassertemperatur führen zu 5 % bis 20 % an Keimfähigkeitsverlusten im Gegensatz zu unbehandelten Erbsensamen. Eine Heißwasserbehandlung für 15 Minuten bei 60 °C führt sogar zu 20 % bis 45 % an Keimfähigkeitsverlusten. Eine Befallsminderung von Pseudomonas syringae pv. pisi wird durch beide Behandlungen erzielt, wobei die Behandlung mit Heißwasser die Bakterienwerte an Erbsensamen einer schwach kontaminierten Partie stärker reduziert, teilweise unterhalb der Nachweisgrenze. Bei einer stark kontaminierten Erbsenpartie führt die Heißwasserbehandlung nur zu einer Halbierung der Ausgangskontamination. Die bei GRONDEAU et al. (1992) beschriebene Befallsminderung durch eine Warmwasserbehandlung, im Gegensatz zu einer Heißluftbehandlung, scheint von der vermehrten Auswaschung des Pathogens abhängig zu sein. Pathogene an der äußeren Samenschale werden abgewaschen und im Inneren lokalisierte Pathogene werden vermutlich durch die Einwirkung des heißen Wassers geschädigt. Bei den durch heiße Luft behandelten Samen wurde eine geringere Befallsminderung festgestellt, was darauf schließen lässt, dass diese Behandlung zwar Pathogene an der Samenoberfläche mindert, die Pathogene im Inneren des Samens jedoch nicht DISKUSSION 157 vollständig gehemmt wurden. Beim Quellprozess nach der Aussaat konnten sich diese Pathogene vermehren und zu einem stärkeren Befall führen. Die nachgewiesene Befallsminderung von A. valerianellae mittels Dampfdesinfektion und Warmwasserbehandlung waren erste Erfolge dieser Dekontaminationsmaßnahmen, eine vollständige Dekontamination wurde aber nicht erreicht. Aus der Literatur sind neben physikalischen Desinfektionsmethoden (Heißwasser, Dampf, Elektronenbehandlung) auch reine Oberflächensterilisationen (Natriumhypochlorit, verschiedene Öle und Säuren) bekannt, die gute Erfolge bei samenbürtigen Pathogenen besitzen. Da die Lokalisierung von A. valerianellae am oder im Saatgut unklar ist, sollten Kombinationen aus Behandlungen, die Pathogene innerhalb des Samens und Behandlungen, die vermehrt die Samenoberfläche angreifen, für zukünftige Untersuchungen ebenso berücksichtigt werden wie Einzelbehandlungen. Für den Feldsalatanbau sind keine Bakterizide zugelassen, daher sollte die Ausbreitung von A. valerianellae in Beständen mit pflanzenbaulichen Maßnahmen kontrolliert werden. Dazu gehört, dass zunächst gesundes Saatgut ausgesät wird. Resistente Feldsalatsorten sind derzeit nicht vorhanden. Des Weiteren soll darauf geachtet werden, dass Feldsalat in einer Fruchtfolge angebaut wird, bei der auf gleicher Fläche Feldsalat nicht direkt auf Feldsalat folgt, sondern mit mindestens einjährigem Abstand, um einer Bodenüberdauerung entgegenzuwirken. Die Feldsalatkultur soll zudem entsprechend der Erregeransprüche so trocken wie möglich geführt werden, um eine Infektion zu vermeiden. Das heißt, dass man auf ein rasches Abtrocknen der Blätter achten muss, indem der Bestand gut durchlüftet wird. Beregnungen in den Abendstunden sind nach Möglichkeit nicht durchzuführen. Da die Vermehrung von A. valerianellae bei höheren Temperaturen umso schneller erfolgt, kann ein Feldsalatanbau in der wärmeren Jahreszeit nicht befallsreduzierend wirken (HINRICHS-BERGER et al., 2005, MOLTMANN et al., 2000). ZUSAMMENFASSUNG 5 158 ZUSAMMENFASSUNG Ziel der vorliegenden Arbeit war es, einen Beitrag zur Aufklärung der Epidemiologie des phytopathogenen [Valerianella locusta Bakteriums (L.)] zu Infektionsbedingungen, zur Saatgutuntersuchungen durchgeführt Acidovorax leisten, Sortenanfälligkeit, wurden. valerianellae indem zum an Feldsalat Untersuchungen zu Übertragungsweg und Darauf aufbauend sollten Bekämpfungsmöglichkeiten aufgezeigt werden. Die Ergebnisse der Untersuchungen zu den Infektionsbedingungen zeigten, dass die Infektion von A. valerianellae von der Temperatur, dem Blattalter, der Inokulumdichte und der Blattnässedauer abhängig war. Eine Inokulation war bei Temperaturen zwischen 10 °C und 30 °C erfolgreich. Infizierbar waren sowohl Keim- als auch Laubblätter. Zudem war die Infektion unabhängig von der Inokulumdichte zwischen 102 cfu/ml und 107 cfu/ml möglich. Die Infektionsgeschwindigkeit und Symptomausprägung nahmen dabei zu, je höher die Temperatur, je älter die Blätter und je konzentrierter das Inokulum waren. Die Blattnässedauer beziehungsweise die relative Luftfeuchtigkeit waren für die Infektion von enormer Wichtigkeit. Bei ausschließlich trockenen Bedingungen wurde kein Befall an inokulierten Feldsalatpflanzen hervorgerufen. Ein Auftreten beziehungsweise Wiederauftreten feuchter Bedingungen nach der Inokulation förderte hingegen den Befall maßgeblich. Für eine Infektion waren fünf Stunden Blattnässedauer ausreichend. Insgesamt konnte gezeigt werden, dass eine gezielte Kulturführung mit kurzen Blattnässezeiten eine Möglichkeit zur Kontrolle des Schaderregers A. valerianellae darstellt. Alle der 13 getesteten kommerziellen Feldsalatsorten waren anfällig, die Resistenz der Wildart V. rimosa wurde hingegen bestätigt. Ein Rückgriff auf diese Wildart zum Einkreuzen mit kommerziellen Sorten erscheint geboten. A. valerianellae überdauerte einen Zeitraum von bis zu elf Monaten im Boden. Feldsalatkulturen, die unmittelbar beziehungsweise ein bis elf Monate nach infiziertem Feldsalat angebaut wurden, waren teilweise in erheblichen Umfang ZUSAMMENFASSUNG 159 befallen. Die Anzahl an Symptom tragenden Pflanzen war mit zunehmender Verrottung von infiziertem Feldsalatmaterial abnehmend. Eine Anbaupause von mindestens zwölf Monaten und ein Fruchtfolgewechsel stellen somit eine geeignete Methode zur Eliminierung von A. valerianellae aus dem Boden dar. Alternative Wirtspflanzen von A. valerianellae wurden neben Feldsalat in den vorgestellten Untersuchungen nicht gefunden und sind in der Literatur auch nicht beschrieben. A. valerianellae ist saatgutübertragbar. Um eine weitere Ausbreitung dieser gefährlichen Krankheit des Feldsalats auf neue Flächen zu unterbinden, ist ein besonderes Gewicht auf den Einsatz gesunden Saatgutes zu legen. Die Ergebnisse der Dekontaminationsmaßnahmen zeigten, dass die A. valerianellaeBelastung von Saatgut durch eine Warmwasser- (43 °C für 20 Minuten, 55 °C für 20 Minuten, 60 °C für 5 Minuten) oder Dampfbehandlung (66 °C für 105 Sekunden) reduziert wurde. Eine vollständige Elimination des Bakteriums wurde allerdings nicht erreicht. Auf Grundlage der vorliegenden Arbeit ergeben sich folgende Bekämpfungsmöglichkeiten: Durch die Aussaat von gesundem Saatgut auf Flächen, auf denen mindestens zwölf Monate zuvor kein infizierter Feldsalat stand und durch eine trockene Kulturführung kann der A. valerianellae-Befall von Feldsalat reduziert werden. SUMMARY 6 160 SUMMARY The aim of this study was to contribute to clarifying the epidemiology of the phytopathogenic bacterium Acidovorax valerianellae on corn salad [Valerianella locusta (L.)]. To this end, research was conducted on infection conditions, cultivar sensitivities, transmission paths and seeds. Based on these results, control strategies shall be demonstrated. The tests performed under infectious conditions revealed that the infection of A. valerianellae is dependent on temperature, leaf age, inoculum concentration and leaf moisture, as well as the relative humidity. Inoculation was possible at temperatures between 10 °C and 30 °C. It was possible for leaves of any age to be infected. Moreover, infection was independent of the inoculum concentration, and occurred between 102 and 107 cfu/ml. The speed of infection and the characteristics of the symptoms increased with increasing temperature, leaf age and inoculum concentration. Both the duration of leaf moisture and the relative humidity played a crucial role in the infection process. Under dry conditions, inoculated corn salad plants developed no symptoms. However, infestation increased significantly under humid conditions or during humid periods. Five hours of leaf moisture sufficed for an infection to occur. It was demonstrated that targeted dry growth conditions with short leaf moisture periods constitute an option for controlling A. valerianellae. All 13 tested commercial corn salad cultivars were prone to A. valerianellae. However, the resistance of the wild type V. rimosa was confirmed. For this reason, it seems advisable to cross the wild type with commercial cultivars. A. valerianellae endured for up to eleven months in the soil. Some of the corn salad cultivars cultivated immediately (and one up to eleven months, respectively) after infected plants were severely infected. The number of infected plants decreased in line with increased rotting of infected old plant material. A cultivation break of at least twelve months and the rotation of crops therefore appear to be appropriate ways to eliminate A. valerianellae from the soil. SUMMARY 161 No alternative hosts were detected in the experiments or in the literature. In addition, this study revealed that A. valerianellae is transmitted via seeds. It is therefore important to focus on healthy seeds to prevent the further dissemination of this hazardous disease to uncontaminated crop land. Seeds with natural A. valerianellae contamination were tested using a variety of decontamination methods. Warm water treatment (43 °C for 20 minutes, 55 °C for 20 minutes, 60 °C for 5 minutes) or hot steam treatment (66 °C for 105 seconds) managed to reduce the contamination rate. However, it was not possible to completely eliminate the bacterium. In summary, sowing healthy seeds after a cultivation break of at least twelve months and under dry growth conditions may reduce the infestation of corn salad with A. valerianellae. LITERATURVERZEICHNIS 7 162 LITERATURVERZEICHNIS ANONYM (2001): Crop Protection Compendium 2001, CAB International, Wallingford, United Kingdom (CD-ROM). BARCHEND, G. (2003): Analyse der Ursachen der Blattfleckenkrankheit beim Feldsalat (Valerianella locusta L.), BAZ-Bericht 2159, 58-59. BARCHEND, G. (2004): Blattfleckenkrankheit am Feldsalat (Valerianella locusta L.), Mitteilung Biologische Bundesanstalt für Land- und Forstwirtschaft, 396, 541542. BARCHEND, G. (2006): Resistenzprüfung von Feldsalat (Valerianella locusta L.) gegen Acidovorax valerianellae ssp. nov., Gesellschaft für Pflanzenzüchtung 68. BEHR, H.-C. (2009): 2008/09 weniger Feldsalat in Deutschland und Frankreich, Artikel aus „AMI Marktwoche Obst&Gemüse“ 12/2009, Bonn, 28.08.2009. BRAJE, I. (2005): Untersuchungen zur Epidemiologie des phytopathogenen Bakteriums Acidovorax valerianellae an Feldsalat [Valerianella locusta (L.)], Diplomarbeit, Universität Hohenheim, Deutschland. BUNDESMINISTERIUM FÜR ERNÄHRUNG, LANDWIRTSCHAFT UND FORSTEN, Forschungsauftrag 95 HS 041 (2001): Erarbeitung von Lösungen zur Bekämpfung der Septoria-Blattfleckenkrankheit an Petersilie – Schlussbericht. CAVALCANTI, M. T., DA SILVEIRA, E. B., DE LIMA RAMOS MARIANO, R., VIANA, I. O. (2005): Crescimento de Acidovorax avenae subsp. citrulli sob diferentes temperatures, pH, concentrações de cloreto de sódio e fonts de carbono, Ciência Rural, v. 35, n. 6, 1313-1318. FRANKENBERG, A. (2005): Bakterienblattfleckenkrankheit an Feldsalat, ÖKOmenischer Gärtner-Rundbrief Nr. 02/2005, Ausgabe für April, Mai und Juni, 36. FUKUI, R., FUKUI, H., ALVAREZ, A. M. (1999): Effect of temperature on the incubation period and leaf colonization in bacterial blight of anthurium, Phytopathology, 89, 11, 1007-1014. GARDAN, L., STEAD, D. E., DAUGA, C., GILLIS, M. (2003): Acidovorax valerianellae sp. nov., a novel pathogen of lamb´s lettuce [Valerianella locusta (L.) Laterr.], International Journal of Systematic and Evolutionary microbiology, 53, 795-800. LITERATURVERZEICHNIS 163 GRIMAULT, V., OLIVIER, V., GUYOT, L., VALETTE, N., VIALLEVIEILLE, F., LYBEERT, H. (2006): Seed transmission of Acidovorax valerianellae on corn salad, Proceedings of the 3rd International Seed Health Conference, Bydgoszcz, Poland, September 6-8. GRONDEAU, C., LADONNE, F., FOURMOND, A., POUTIER, F., SAMSON, R. (1992): Attempt to eradicate Pseudomonas syringae pv. pisi from pea seeds with heat treatments, Seed Science and Technology, 20, 3, 515-525. GRONDEAU, C., SAMSON, R., GARDAN, L. (2001): Description and Identification of the new Phytopathogenic Bacterium causing Bacterial Black Spots on Corn Salad (Valerianella locusta), as Acidovorax valerianellae, Plant Pathogenic Bacteria, 165-166. GRONDEAU, C., CERCEAU, V., BUREAU, C., SAMSON, R. (2003): Evidences that Acidovorax valerianellae, the agent of bacterial black spot of corn salad (Valerianella locusta), is soil transmitted, 6th International Conference on Pseudomonas syringae Pathovars and Related Pathogens, September 15-19. GRONDEAU, C., GÉRARD, S., MÉVEL, S., VERRON, P. (2006): Soil survival and occurence of Acidovorax valerianellae in relation to the time between two successive corn-salad (Valerianella locusta) crops, Proceedings of the 11th International Conference on Plant Pathogenic Bacteria, Edinburgh, United Kingdom, Juli 10-14. GRONDEAU, C., MANCEAU, C., SAMSON, R. (2007): A semiselective medium for the isolation of Acidovorax valerianellae from soil and plant debris, Plant pathology, 56, 302-310. GRONDEAU, C., SAMSON, R. (2009): Detection of Acidovorax valerianellae in cornsalad seeds, seed transmission of the pathogen and disease development in the field, Plant Pathology, 58, 846-852. HINRICHS-BERGER, J., BERGER, S., BRAJE, I., JASU, H., BUCHENAUER, H. (2004): Zur Epidemiologie des phytopathogenen Bakteriums Acidovorax valerianellae an Feldsalat, 54. Deutsche Pflanzenschutztagung, 73-74. HINRICHS-BERGER, J., BRAJE, I., BERGER, S., JASU, H., BUCHENAUER, H. (2005): Neues über diesen bakteriellen Schaderreger: Acidovorax – ernstes Problem bei Feldsalat, Gemüse, 3, 32-34. HSU, S. T. (1991): Ecology and control of Pseudomonas solanacearum in Taiwan, Plant Protection Bulletin (Taipei), 33, 1, 72-79. IKEDA, K., KUWABARA, K., FURUYA, O., TAKIKAWA, Y. (2009): The occurence of bacterial leaf spot of hydrangea caused by Acidovorax valerianellae in Gunma Prefecture and its pathogenicity. Kanto-Tosan Plant Protection Society, Tsukuba, Jan, Annual Report of the Kanto-Tosan Plant Protection Society, 56, 79-83. LITERATURVERZEICHNIS 164 JASU, H. (2004): Acidovorax valerianellae – in vitro Growth and Optimization of Inoculation Methods to Lamb`s Lettuce (Valerianella locusta), Bachelor Thesis, HAS Den Bosch University of Professional Education, The Netherlands. KOCH, E., SCHMITT, A., STEPHAN, D., KROMHARDT, C., JAHN, M., KRAUTHAUSEN, H. J., FORSBERG, G., WERNER, S., AMEIN, T., WRIGHT, S. A. I., TINIVELLA, F., GULLINO, M. L., ROBERTS, S. J., VAN DER WOLF, J., GROOT, S. P. C. (2010): Evaluation of non-chemical seed treatment methods for the control of Alternaria dauci and A. radicina on carrot seeds, European Journal of Plant Pathology, 2010, 127, 1, 99-112. KOCKS, C. G., RUISSEN, M. A., ZADOKS, J. C., DUIJKERS, M. G. (1998): Survival and extinction of Xanthomonas campestris pv. campestris in soil, European Journal of Plant Pathology, 104, 911-923. KOVACS, N. (1956): Identification of Pseudomonas pyocyanea by the oxidase reaction, Nature, 178, 703. LATORRE, B. A., LILLO, C., RIOJA, M. E. (2002 a): Effects of Temperature, Free Moisture Duration and Inoculum Concentration on infection of sweet Cherry by Pseudomonas syringae pv. syringae, Phytoparasisitca, 30 (4), 410-419. LATORRE, B. A., RIOJA, M. E., LILLO, C. (2002 b): The effect of temperature on infection and warning system for pear blossom blast caused by Pseudomonas syringae pv. syringae, Crop Protection, 21, 33-39. LEBEN, C. (1988): Relative humidity and the survival of epiphytic bacteria with buds and leaves of cucumber plants, Phytopathology, 78, 2, 179-185. LESSL, J. T., FESSEHAIE, A., WALCOTT, R. R. (2007): Colonization of Female Watermelon Blossoms by Acidovorax avenae ssp. citrulli and the Relationship between Blossom Inoculum Dosage and Seed Infestation, Journal of Phytopathology, 155, 114-121. MEYER-REBENTISCH, K. (2011): Feldsalat in der Geschichte, http://www.gemueseinfo.de/feldsalat/geschichte.html (05.05.2011). MOLTMANN, E. (1999): Bakterielle Blattfleckenkrankheit an Salat, Gemüse, 35 (3), 164-165. MOLTMANN, E., BLUM, E., DETZEL, P., RIESTERER, K., KRAUSS, J., SCHRAMEYER, K. (2000): Blattflecken an Feldsalat durch das Bakterium Acidovorax valerianellae, Gemüse, 36 (12), 10-12. PÉRON, J.-Y., REES, D. C. (1998): High-tech production of corn salad (Valerianella locusta (L.) Laterr.), a loca, french vegetable crop, Acta Horticulturae, 467, 259-268. LITERATURVERZEICHNIS 165 PRIA, M. DALLA, CHRISTIANO, R. C. S., FURTADO, E. L., AMORIN, L., BERGAMIN FILHO, A., (2006): Effect of temperature and leaf wetness duration on infection of sweet oranges by Asiatic citrus canker, Blackwell Publishing, Oxford, UK, Plant Pathology, 2006, 55, 5, 657-663. RAMPOLD, C. (2004): Die kleine Marktstudie: Feldsalat, Gemüse, 40 (11), 61-63. RAT, B., GARDAN, L. (1993): Mâche – la tache bactérienne due à un Pseudomonas sp., Fruits et Légumes, 111, 42-43. ROBERTS, S. J. (2009): Eradication of seed-borne plant pathogens, XLII Brazilian Phytopathology Congress, Rio de Janeiro, 3-7 August 2009, Tropical Plant Pathology. Supplement 2009. SCHAAD, N. W., WHITE, W. C. (1974): Survival of Xanthomonas campestris in soil. Phytopathology, 64 (11), 1231-1234. SCHLAGHECKEN, J. (2010): Nantes 2009, das franzözische Anbauzentrum für Feldsalat, Porree und Radies!, Hortigate – das Gartenbau-Informationssystem, http://www.hortigate.de/Apps/WebObjects/Hortigate.woa/1/wo/nCNKJAHYO gGJooxra1JSf0/6.7.6.5.1.23.2.1.1.11.1 (30.08.2011). SCHMITT, A., KOCH, E., STEPHAN, D., KROMPHARDT, C., JAHN, M., KRAUTHAUSEN, H. J., FORSBERG, G., WERNER, S., AMEIN, T., WRIGHT, S. A. I., TINIVELLA, F., VAN DER WOLF, J., GROOT, S. P. C. (2009): Evaluation of non-chemical seed treatment methods fort he control of Phoma valerianellae on lamb`s lettuce seeds, Journal of Plant Diseases and Protection, 116 (5), 200207, ISSN 1861-3829. STRANDBERG, J. (1973): Spatial distribution of cabbage black rot and the estimation of diseased plant populations, Phytopathology, 63 (8), 998-1003. SUSLOW, T.V., SCHROTH, M.N., ISAKA, M. (1982): Application of a Rapid Method for Gram Differentiation of Plant Pathogenic and Saprophytic Bacteria Without Staining, Phytopathology, 72 (7), 917-918. TIL’BA, V. A., MASHCHENKO, N. V., BEGUN, S. A. (2011): Problems of chemical dressing and bacterization of soybean seeds in the amur oblast, Allerton Press, Inc., New York, USA, Russian Agricultural Sciences, 37, 1, 31-34. TOMIHAMA, T., NONAKA, T., NAKAMURA, M., IWAI, H., ARAI, K. (2006): Bacterial spot of tea caused bay Acidovorax valerianellae, Japanese Journal of Phytopathology/The Phytopathological society of Japan, 72, 185-190. WALCOTT, R. R., GITAITIS, R. D., CASTRO, A. C. (2003): Role of Blossoms in Watermelon Seed Infestation by Acidovorax avenae subsp. citrulli, Phytopathology, 93, 528-534. LITERATURVERZEICHNIS 166 WALKER, J. C. (1952): Diseases of Vegetable Crops, New York, USA, McGraw-Hill Book Company, Inc. WILLEMS, A., GOOR, M., THIELEMANS, S., GILLIS, M., KERSTERS, K., DE LEY, J. (1992): Transfer of Several Phytopathogenic Pseudomonas Species to Acidovorax as Acidovorax avenae subsp. avenae subsp. nov., comb. nov., Acidovorax avenae subsp. citrulli, Acidovorax avenae subsp. cattleyae, and Acidovorax konjaci, International Journal of Systematic Bacteriology, 42, 107119. WÖLK, M., SARKAR, S. (1994): Überleben einer Xanthomonas campestris pv. pelargonii-Mutante in einjähriger Komposterde, Anzeiger für Schädlingskunde, Pflanzenschutz, Umweltschutz, 67 (4), 69-71. ANHANG 167 8 ANHANG 8.1 Publikationen THIELE, K., BRAJE, I., RABENSTEIN, F., LAUN, N., SMALLA, K. (2011): Untersuchungen zur Biologie und Entwicklung praxis-relevanter Nachweismethoden für bakterielle Erkrankungen am Feldsalat [Valerianella locusta (L.)] als Grundlage für die Selektion von Resistenzquellen gegen den Erreger von Blattflecken (Acidovorax valerianellae sp. nov), 18. Innovationstag Mittelstand des Bundesministeriums für Wirtschaft und Technologie in Berlin, Posterbeitrag. THIELE, K., SMALLA, K., BRAJE, I., RABENSTEIN, F. (2010): Nachweis und molekulare Charakterisierung von Acidovorax valerianellae, dem Erreger von bakteriellen Blattflecken an Feldsalat (Valerianella locusta (L.) Laterr., 57. Deutsche Pflanzenschutztagung in Berlin, Posterbeitrag. BRAJE, I., ALBRECHT, A., LAUN, N., KRAUTHAUSEN, H.-J., BARCHEND, G., FELGENTREU, D., RABENSTEIN, F. (2008): Acidovorax valerianellae als Erreger bakterieller Blattflecken an Feldsalat, 56. Deutsche Pflanzenschutztagung in Kiel, Posterbeitrag. LEINHOS, G., BRAJE, I., HÖRENER, G., KRAUTHAUSEN, H.-J. (2006): Falscher Mehltau an Petersilie: Vorkommen, Biologie und Kontrollstrategien, 55. Deutsche Pflanzenschutztagung in Göttingen, Posterbeitrag. BRAJE, I. (2005): Untersuchungen zur Epidemiologie des phytopathogenen Bakteriums Acidovorax valerianellae an Feldsalat [Valerianella locusta (L.)], Diplomarbeit, Universität Hohenheim, Deutschland. HINRICHS-BERGER, J., BRAJE, I., BERGER, S., JASU, H., BUCHENAUER, H. (2005): Neues über diesen bakteriellen Schaderreger: Acidovorax – ernstes Problem bei Feldsalat, Gemüse, 3, 32-34. HINRICHS-BERGER, J., BERGER, S., BRAJE, I., JASU, H., BUCHENAUER, H. (2004): Zur Epidemiologie des phytopathogenen Bakteriums Acidovorax valerianellae an Feldsalat, 54. Deutsche Pflanzenschutztagung in Hamburg, 73-74. . ANHANG 8.2 168 Lebenslauf Name Inga Braje Geburtsdatum 16.07.1979 Geburtsort Wilhelmshaven Schulausbildung 1986 – 1990 Grundschule Voslapp, Wilhelmshaven 1990 - 1992 Orientierungsstufe Nogatstrasse, Wilhelmshaven 1992 – 1999 Gymnasium Käthe-Kollwitz-Schule, Wilhelmshaven Abschluß: Abitur Universität 10/2000 – 03/2005 Agrarbiologie, Universität Hohenheim Abschluß: Diplom (Dipl. Agr.-Biol.) seit 04/2006 Promotion, Universität Hohenheim, Fachgebiet Phytomedizin (extern am Dienstleistungszentrum Ländlicher Raum Rheinpfalz, Neustadt an der Weinstrasse) Berufstätigkeit 04/2005 – 12/2005 Dienstleistungszentrum Ländlicher Raum Rheinpfalz, Queckbrunnerhof, Schifferstadt 01/2006 – 03/2006 Enza Zaden Deutschland, Dannstadt-Schauernheim Praktika 08/1999 – 08/2000 Freiwilliges Ökologisches Jahr, Verein Umwelterziehung Iffens e.V., Butjadingen 08/2002 – 09/2002 Demeter-Hof Friedhard Bühler, Murr 08/2003 – 09/2003 Nitratlabor Heidelberg und Betreuungsdienst Nützlingseinsatz Nordbaden e. V., Heidelberg ___________________ Inga Braje ANHANG 8.3 169 Versicherung Hiermit versichere ich, Inga Braje, dass ich nicht bereits früher oder gleichzeitig einen Antrag auf Eröffnung eines Promotionsverfahrens unter Vorlage der hier eingereichten Dissertation gestellt habe. Böhl-Iggelheim, 24.10.2011 ___________________ Inga Braje 8.4 Erklärung Hiermit erkläre ich, Inga Braje, dass ich die vorliegende Dissertation selbständig angefertigt und nur die angegebenen Quellen als Hilfsmittel benutzt habe. Wörtlich und inhaltlich übernommene Stellen sind als solche in der Arbeit gekennzeichnet. Böhl-Iggelheim, 24.10.2011 ___________________ Inga Braje