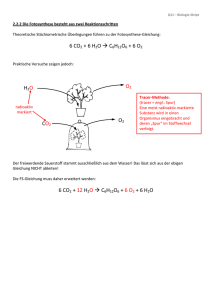
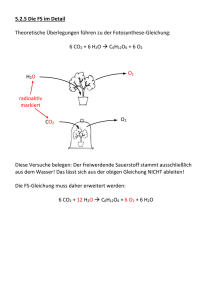
Schauexperimente - cci.ethz.ch
Werbung

Chemische Schauexperimente (Versuchsvorschriften) Dr. Wolfram Uhlig und Bruno Rüttimann, Laboratorium für Anorganische Chemie der ETH Zürich Redoxreaktionen Oszillierende Reaktion nach Belusow-Zhabotinsky Oszillierende Iod-Uhr Tanzende Holzkohle Pharaoschlange Bengalische Feuer Iodstickstoff Verbrennung von Eisen in Sauerstoff Verbrennung von Stahlwolle Reaktivität von Aluminium gegenüber salzsauren Kupfersalzlösungen Cu-Fe-Element Mg / Trockeneis Farb- und Leuchtstoffe Bleichen einer roten Rose Blue Bottle Redoxreaktion mit Indigocarmin („Verkehrsampel“) Sechs Farben Drei unmischbare Flüssigkeiten Nickel-Komplexe Chemolumineszenz bei der Oxidation von Oxalsäureestern Katalyse „Schaumschlange“ (Zersetzung von Wasserstoffperoxid mittels Iodid-Katalyse) Zersetzung von Wasserstoffperoxid mittels MnO2 oder KMnO4 Oszillierender Pt-Draht (Oxidation von Methanol) Ammoniak-Oxidation an Chrom(III)-oxid Blau-Gold-Reaktion Gase Ammoniak-Springbrunnen (2 Versionen) Entgasung von Bier im Vakuum Schwebender Ballon CO2-Diffusion in Seifenblasen N2O-P(rot) Tanzendes Feuer Brennender Wasserstoffschaum Flaschengeist „Pulsierendes Sektglas“ „Bellender Hund“ Chemie im Alltag Böllerbüchse Verpuffung von brennendem Öl (Paraffinöl / Wasser) Seilbahn Säure-Base-Reaktionen Rotkohlsaft als Universalindikator Gleichgewicht Kohlensäure / Hydrogencarbonat / Carbonat (NaOH / Trockeneis) Indikator-Mix Achtung! Von wenigen Ausnahmen abgesehen finden sich Videoaufzeichnungen aller Versuche auf der Website http://www.cci.ethz.ch . Dort finden Sie auch die jeweils relevanten Sicherheitshinweise sowie weiterführende Literaturangaben. Redoxreaktionen Oszillierende Reaktion nach Belusow-Zhabotinsky Versuch: In einem grossen Messzylinder werden nacheinander die folgenden 4 Lösungen vereinigt: Lösung 1: 19 g KBrO3 / 500 ml H2O Lösung 2: 16 g H2C(COOH)2 / 3.5 g KBr / 500 ml H2O Lösung 3: 5.3 g Ce(NH4)2(NO3)6 / 135 g H2SO4 (konz.)/ mit Wasser auf 500 ml aufgefüllt Lösung 4: 30 ml Ferroin* *(0.23 g FeSO4 x 7 H2O / 0.56 g o-Phenanthrolin / 100 ml H2O Die Farbe der anfangs grünen Lösung wechselt über Blau und Violett nach Rot und zurück nach Grün. Dieser Zyklus kann über eine längere Zeit (bis zu 1 h) beobachtet werden. Vertiefung: Zu den bekanntesten oszillierenden Reaktionen gehört die Belousow-Zhabotinsky-Reaktion. Gesteuert werden diese rhythmischen Reaktionen von Rückkopplungsmechanismen, bei welchen zwischenzeitlich gebildete Moleküle oder Ionen vorgelagerte Start- oder Zwischenreaktionen entscheidend beeinflussen. Die 1958 von Belousov bei der Umsetzung von Kaliumbromat mit Cer(IV)-sulfat und Citronensäure zufällig entdeckte Oszillation ist in den folgenden Jahren von Zhabotinsky systematisch untersucht und ausgebaut worden. Stark vereinfacht kann der Prozess folgendermassen interpretiert werden. In einer ersten Phase (I) werden Ce4+-Ionen zu Ce3+-Ionen reduziert und gleichzeitig die Malonsäure bromiert. In einer zweiten Phase (II) erfolgt die Oxidation von Ce3+- zu Ce4+-Ionen mit Hilfe noch vorhandener Bromat-Ionen. Der Gesamtprozess (III) der Oszillation ergibt sich durch die Zusammenfassung beider Teilschritte. 4+ BrO3 - + 2 H2C(COOH)2 + 4 Ce 3+ BrHC(COOH)2 + 4 Ce 3+ BrO3 + H2C(COOH)2 + 4 Ce - + +5H + 2 BrO3 + 3 H2C(COOH)2 + 2 H + + 3 CO2 + 3 H + H2O (I) 4+ BrHC(COOH)2 + 4 Ce + 3 H2O (II) 2 BrHC(COOH)2 + 3 CO2 + 4 H2O (III) Das Änderung des Potenzials E(Ce4+ / Ce3+) wird entsprechend der Nernstschen Gleichung durch die Konzentrationsänderung beider Spezies bestimmt. Man kann dieses sich rhythmisch ändernde Potenzial gegen eine Bezugselektrode messen. Man kann die Potenzialänderung aber auch durch Zugabe des Redoxindikators Ferroin beobachten. Das Zentralion dieses Komplexes ist Eisen. In der Oxidationsstufe +2 ist der Komplex rot gefärbt, in der Oxidationsstufe +3 hingegen blau. Bei hoher Konzentration von Ce4+ wird das Eisen zur Oxidationsstufe +3 oxidiert, eine hohe Konzentration von Ce3+ führt hingegen zu Reduktion des Eisens. Diese Gleichgewichtsverschiebung wird durch entsprechende Farbwechsel der Lösung sichtbar. [Ce4+] E = 1.61V + 0.059 log Ce3+ + Fe3+ farblos blau [Ce3+] Ce4+ + Fe2+ gelb rot Anwendung: Oszillierende Reaktionen zählen zweifellos zu den beeindruckendsten, aber auch geheimnisvollsten Demonstrationsversuchen in der experimentellen anorganischen Chemie. Oszillierende Iod-Uhr Versuch: Die folgenden drei Reaktionslösungen werden gleichzeitig in ein Becherglas geschüttet und die Mischung wird stark gerührt. Lösung 1: 205 ml H2O2 30% / mit Wasser auf 500ml auffüllen Lösung 2: 21.5 g KIO3 / 2.2 ml H2SO4 (konz) / mit Wasser auf 500ml auffüllen Lösung 3: 8 g H2C(COOH)2 / 1.7 g MnSO4 / 0.5 g Stärke / mit Wasser auf 500 ml auffüllen Die zunächst farblose Mischung färbt sich nach wenigen Sekunden gelb und anschliessend tiefblau. In der Folge oszilliert die Reaktion mehrfach zwischen blau und farblos. Vertiefung: Die von Th. S. Briggs und W. C. Rauscher beschriebene oszillierende Reaktion verwendet Bausteine der Belousow-Zhabotinsky-Reaktion (siehe dort) sowie der Bray-LiebhafskyReaktion. Eine bestimmende Rolle spielt hierbei die iodkatalysierte Disproportionierung von Wasserstoffperoxid in Wasser und Sauerstoff. 2 H2O2 2 H2O + O2 Die Blaufärbung ist das Ergebnis einer periodisch auftretenden Produktion von elementarem Iod. Dieses bildet mit Stärke den bekannten tiefblauen Iod-Stärke-Komplex. Stark vereinfacht lassen sich die Bildung und der Verbrauch des Iods durch folgende Gleichungen beschreiben. I - + HOI + H+ I2 + H2C(COOH)2 I2 + H2O (blau) IHC(COOH)2 + H+ + I - Eine ausfühliche Diskussion des Reaktionsmechanismus findet sich in dem angegeben Buch von Shakhashiri (s. Abschn. Literatur). Tanzende Holzkohle 5g Kaliumnitrat werden in einem Reagenzglas mit der Bunsenbrennerflamme aufgeschmolzen. Steigen Gasblasen in der Salzschmelze auf, gibt man ein erbsengrosses Stück Holzkohle hinzu. Die Holzkohle verbrennt unter intensivem Aufglühen und tanzt auf der Salzschmelze. Vertiefung: Kaliumnitrat zersetzt sich in der Schmelze unter Bildung von Kaliumnitrit und Sauerstoff. Es ist daher ein ausgezeichnetes Oxidationsmittel und reagiert mit Holzkohle gemäss folgender, in der Realität etwas komplexerer Reaktion. 3 C + 2 KNO3 K2CO3 + N2 + CO + CO2 Anwendung: Beide Reaktanden dieses Versuchs sind Bestandteile des „Schwarzpulvers“, einer Mischung aus 75% Kaliumnitrat, 15% Holzkohle und 10% Schwefel. Aus 1 kg Schiesspulver der obigen Zusammensetzung entstehen bei der Verbrennung rund 350 Liter Gas. Pharaoschlange Versuch: Auf einer feuerfesten Unterlage wird Bleicherde (evt. auch Sand) zu einem Kegel aufgeschüttet. In dessen Spitze steckt man eine Emser Pastille (bestehend aus Natriumhydrogencarbonat, Natriumcitrat und Zucker), tränkt diese mit Ethanol und entzündet den Alkohol. Nach dem Abbrennen des Alkohols beginnt sich die Pastille bei höheren Temperaturen zu schwärzen. Sie bläht sich auf und erhebt sich aus dem Kegel, einer Schlange gleich. Diese kann - daumendick – bis zu einem Meter lang werden. Vertiefung: Die aus dem Natriumhydrogencarbonat beim Erhitzen entstehenden Gase erzeugen mit dem geschmolzenen Zucker einen äusserst voluminösen Schaum. Ein Teil des Zuckers verbrennt ebenfalls. Die in der Folge angegebene Oxidationsgleichung ist allerdings idealisiert. In der Realität erfolgt die Verbrennung unvollständig und es kommt dabei zur teilweisen Verkohlung des Zuckers. Die Mischung aus dem zersetzten Salz und der Kohle ergibt den schaumartig zur Schlange aufgeblähten Rückstand. 200°C 2 NaHCO3 C12H22O11+ 12 O2 Na2CO3 + H2O + CO2 12 CO2 + 11 H2O Anwendung: Friedrich Wöhler (1800-1882) erfand einen Jahrmarktsrenner, die Pharaoschlange. Der Farbenchemiker O.N.Witt schildert diesen Versuch so: „Sie besteht aus einem Kegel mit gepresstem gräulich-weissen Pulver, das auf einer feuerfesten Unterlage angebrannt wird.Bläuliche Flamme, daraus stieg phantastisch gefärbtes Ungetüm von braungelber Farbe auf, das wohl geeignet war, die Erinnerungen an die Erzählung in der Bibel nachzuprüfen, derzufolge Moses seinen und seiner Begleiter vor dem Pharao niedergeworfene Stäbe in Schlangen verwandelte...“ Natriumhydrogencarbonat findet als Backpulver Verwendung. Es dient dabei zur Auflockerung des Teiges durch das in Hitze entwickelte Kohlendioxid. Landolt-Reaktion Versuch: Drei Bechergläser enthalten gleiche Mengen einer angesäuerten, wässrigen Lösung von Natriumsulfit und Stärke jedoch in einer wachsenden Menge Wasser. Gleichzeitig wird unter Rühren in alle drei Bechergläser die gleiche Menge Kaliumiodat gegeben. Nach etwa 15 Sekunden beobachtet man in der Lösung mit dem kleinsten Volumen eine plötzliche Verfärbung nach schwarzblau. Die Reaktionszeit in den anderen Bechergläsern wächst mit dem Volumen der Lösungen. Lösung A: 1.4 g KIO3 / 320 ml H2O Lösung B: 1.3 g H2SO4 (konz) / 3.2 ml Ethanol / 0.37 g Na2SO3/ mit Wasser auf 320 ml auffüllen Lösung C: 0.5 g Stärke, aufschlemmen in wenig Wasser, 100 ml siedendes Wasser zugeben, nochmals aufkochen lassen, abkühlen Vorlage H2O (ml) Zugabe Lösung B (ml) Zugabe Lösung C (ml) Demonstration: Zugabe Lösung A (ml) Blaufärbung nach 600 ml 200 100 20 Bechergläser 800 ml 400 100 20 1000 ml 600 100 20 100 15 s 100 30 s 100 60 s Vertiefung: Die Reaktion ist als Landolt-Zeitversuch bekannt. Die beiden Ausgangslösungen enthalten Iodat bzw. eine angesäuerte Lösung von Natriumsulfit. In jedem Becherglas laufen nacheinander die folgenden Reaktionen ab. IO3- - langsam - + 3 HSO3 - 5 I + IO3 + 6 H + I2 + HSO3- + 3 H2O I - + 3 HSO4- schnell 3 I2 + 3 H2O sehr schnell 2 I - + HSO4- + 2 H3O+ Da die letzte Reaktion am schnellsten verläuft, wird die Farbe des elementaren Iods erst sichtbar, wenn das Sulfit vollständig verbraucht ist. Iod allein färbt sich in wässriger Lösung gelb. Setzt man hingegen der Sulfitlösung etwas Stärke zu, so entsteht die charakteristische Einlagerungsverbindung von Iod in Amylose. Diese färbt die Lösung schwarzblau. In allen drei Gefässen werden die gleichen Stoffmengen der Reaktanden umgesetzt. Das unterschiedliche Volumen der Lösungen wird allein durch wachsende Mengen des Lösungsmittels Wasser hervorgerufen. Damit verbunden ist eine Verringerung der Stoffmengenkonzentration. Da die Reaktionsgeschwindigkeit von der Stoffmengenkonzentration abhängt, verläuft die Reaktion bei der kleinsten Stoffmengenkonzentration am langsamsten (s. Abschn. Anwendung). Anwendung: Der vorgestellte Versuch ist ein Schauversuch. Die Reduktion von Iodat mit Sulfit hat jedoch auch technische Bedeutung. Sie bildet die Grundlage für die technische Herstellung elementaren Iods aus der Iodat-haltigen Mutterlauge des Chilesalpeters entsprechend der ersten beiden Gleichungen im Abschnitt „Vertiefung“. Der Versuch dient schon lang als Vorlesungsexperiment zur Demonstration der Gesetze der chemischen Kinetik. Eingeführt wurde er von J. Eggert und A. Skrabal. Hierzu schreibt A. Skrabal 1922: „Vorlesungsversuche zur Demonstration der Gesetze der chemischen Kinetik sind vielfach vorgeschlagen worden. Sie genügen jedoch nicht den Anforderungen, die man an ein Vorlesungsexperiment hinsichtlich Einfachheit, Durchsichtigkeit, Anschaulichkeit und Zuverlässigkeit mit Fug und Recht stellen darf. Was Anschaulichkeit, Schärfe der Erscheinung sowie das Moment der Überraschung angelangt, steht die Landoltsche Reaktion an erster Stelle. Die zu demonstrierende Reaktion soll eine einfache Reaktion sein und einem einfachen Zeitgesetz unterliegen. Sie soll ferner mit konstanter Geschwindigkeit verlaufen. Die Reaktionsgeschwindigkeit braucht alsdann nicht mehr durch einen Differentialquotienten definiert zu werden, sondern kann durch den Quotienten Länge der Reaktionsbahn Reaktionsgeschwindigkeit = Reaktionszeit dargestellt werden. Wie beim fahrenden Eisenbahnzug oder beim laufenden Pferd kann man die Geschwindigkeit aus einer Bahnstrecke und der zur Zurücklegung der letzteren erforderlichen Zeit ermitteln. Die Konstanz der Geschwindigkeit ist gegeben, wenn die gemessene Bahnstrecke im Verhältnis zur Gesamtlänge der Bahn klein ist. Die Reaktionszeit, in ihrer Abhängigkeit von der Länge der Reaktionsbahn und der konstanten Reaktionsgeschwindigkeit, ist durch die folgende Gleichung gegeben: Länge der Reaktionsbahn Reaktionszeit = Reaktionsgeschwindigkeit Alle diese Forderungen lassen sich an der Landoltschen Reaktion verwirklichen.“ Zitiert nach H. W. Roesky, K. Möckel „Chemische Kabinettstücke“ Variation der Landolt-Reaktion: „Bier-Herstellung“ Bei diesem Schauversuch handelt es sich um die Landolt-Reaktion ohne Stärke-Zusatz. In einem 1l-Bierhumpen gibt man ein farbloses Tensid, z.B. ein Haarwasch- oder Geschirrspülmittel. Die richtige Menge muss erprobt werden. Man gibt die Lösungen A und B gleichzeitig in das Glas. Nach etwa 15 s erfolgt eine Gelbfärbung der Lösung und es entsteht der Eindruck eines frisch gezapften Biers. Lösung A: 1.08 g KIO3 / 500 ml H2O Lösung B: 1 g H2SO4 (konz) / 2.5 ml Ethanol / 0.28 g Na2SO3 / mit Wasser auf 500 ml aufgefüllt Bengalische Feuer Versuch: Drei Nickel-Tiegel enthalten eine Mischung aus 10 g Kaliumchlorat, 10 g Puderzucker sowie 20 g eines Metallnitrats (NaNO3, Sr(NO3)2, Ba(NO3)2). Auf die Mischung tropft man 1-2 ml konzentrierte Schwefelsäure. Nach einer kurzen Induktionsperiode kommt es zur Selbstentzündung des Reaktionsgemisches. Die Flammen zeigen eine vom zugesetzten Metallnitrat abhängige Färbung. Vertiefung: Während Chlorate relativ schwache Oxidationsmittel sind, wirkt die korrespondierende Säure stark oxidierend. Diese bildet sich, wenn man Kaliumchlorat mit konzentrierter Schwefelsäure versetzt. Chlorsäure oxidiert Zucker unter Selbstentzündung in einer stark exothermen Reaktion zu Kohlendioxid und Wasser. 8 KClO3 + C12H22O11 H2SO4 (konz) 8 KCl + 12 CO2 + 11 H2O Die beigemischten Metallsalze färben die Flamme in charakteristischer Weise. Die Aussenelektronen der Alkali- und Erdalkalimetalle werden durch die freigesetzte Energie in angeregte Zustände überführt. Beim Übergang in den Grundzustand senden sie Licht mit charakteristischer Wellenlänge aus. Metall Farbe Hauptwellenlängen (nm) Natrium gelb 590 (gelb), 589 (gelb) Strontium karminrot 605 (orange), 461 (blau) Barium grün 524 (grün), 513 (grün) Anwendung: Im alten Indien, in der Provinz Bengalen, wurden von den Priestern Strontiumsalze mit Kohle, Schwefel und Kaliumchlorat zu Kugeln oder Pyramiden gepresst und im Halbdunkel der Tempel angezündet: Bengalische Feuer. Auch ohne Schwefel gelingt das farbenprächtige Feuerwerk. Dessen Faszination, so schreibt der Venezianer Vannocio Biringuccio 1540 in seinem Buch „De la pirotechnia“, dauere leider „nicht länger als der Kuss der Geliebten oder vielleicht noch kürzer“. (zitiert nach H. R. Roesky, Chemische Kabinettstücke). Iodstickstoff Versuch: 1.5 g Iod und 10 ml konz. Ammoniak-Lösung werden in einem Mörser mit dem Pistill verrieben und 10-15 Minuten stehengelassen. Anschliesend filtriert man den Festkörper über einen Porzellantrichter, auf dem ein Papierrundfilter mit einer Drahtschlaufe liegt. Man wäscht den Niederschlag 3x mit Ethanol und 3x mit Diethylether. Anschliessend legt man den Rundfilter auf einen Korkring, der auf einer Holzunterlage liegt. Nach einer Trocknungszeit von mindestens 45 min berührt man die Substanz mit einer Hühnerfeder. Es kommt zu einer heftigen Explosion. Achtung! Alle benutzten Geräte (Trichter, Mörser, Pistill) sofort mit viel Wasser abspülen. Bei Trocknung der Rückstände besteht die Gefahr einer spontanen Explosion! Vertiefung: Die Umsetzung von Iod mit Ammoniak führt über mehrere Stufen (Gleichgewichte) zum Stickstofftriiodid-Triammoniakat. Dieses wandelt sich bei Raumtemperatur langsam in das Monoammoniakat um. Dieses ist in Ammoniakatmosphäre bei Raumtemperatur im Dunkeln unbegrenzt haltbar. In trockenem Zustand explodiert es jedoch bei der geringsten Berührung, bei gelinder Erwärmung oder Bestrahlung. Hauptursache hierfür ist die extreme Stabilität des elementaren Stickstoffs. 3 I2 + 7 NH3 NI3. 3 NH3 + 3 NH4I NI3. 3 NH3 NI3. NH3 + 2 NH3 8 NI3. NH3 5 N2 + 6 NH4I + 9 I2 In NI3. NH3 sind die NI3-Moleküle über Iod zu Ketten verbrückt. I I I N I I I N I I I N I I N I Verbrennung von Eisen in Sauerstoff Versuch: Der Boden einer 5-l-Glasflasche wird mit Sand bedeckt. Anschliessend leitet man einige Minuten reinen Sauerstoff in die Flasche. Ein dünner Eisendraht (∅ ≈ 1 mm) wird zu einer Spirale gebogen, an deren unterem Ende ein Streichholz befestigt ist. Nach dem Anzünden hält man die Eisenspirale sofort in die Sauerstoffatmosphäre. Funkensprühend verbrennt das Eisen. Die extreme Hitze wird dadurch verdeutlicht, dass geschmolze Eisenpartikel (Fp. ≈ 1540°C) von der Spirale abfallen. Vertiefung: Gasförmiger Sauerstoff verbindet sich mit fast allen Elementen zu Oxiden. Vielfach beobachtet man bei diesen Redoxreaktionen eine erheblicher Energieabgabe (Feuererscheinungen). Derartige Verbrennungsvorgänge verlaufen im allgemeinen erst bei erhöhten Temperaturen mit ausreichender Geschwindigkeit und müssen folglich durch Zündung in Gang gebracht werden. Teilweise gelingt auch eine Beschleunigung mittels Katalysatoren. Bei Raumtemperatur verhält sich Triplett-Sauerstoff jedoch gegen oxidable Stoffe ausgesprochen reaktionsträge. Diese Tatsache ist für die Existenz von ("brennbaren") Lebewesen in der Erdatmosphäre von grosser Bedeutung. Tatsächlich setzt sich gasförmiger Sauerstoff allerdings auch unter Normalbedingungen langsam mit oxidablen Stoffen um. Zu diesen als "stille Verbrennung" ("Autoxidation") bezeichneten Prozessen gehört das Rosten von Eisen, das Vermodern von Holz und ähnliche Prozesse. Setzt man die oxidierbaren Stoffe in feinverteilter oberflächenreicher Form oder den Sauerstoff in konzentriertem Zustand ein, so wird die Geschwindigkeit stiller Verbrennungen so erhöht, dass die vermehrte Wärmeabgabe zu einer Steigerung der Temperatur des Reaktionsgemisches führt, was wieder eine Beschleunigung der Reaktion bedingt usw. So kann es zu Explosionen (Kohlenstaubexplosion, Explosion von organischen Stoffen in flüssigem Sauerstoff) kommen. Auch die Oxidation von Eisen kann in reiner SauerstoffAtmosphäre so beschleunigt werden, dass es nach dem Anzünden mittels eines Streichholzes abrennt. 3 Fe + 2 O2 Fe3O4 ΔH° = -1119 kJ/mol Das entstehende Eisen(II,III)-oxid ist das beständigste Oxid des Eisens und kommt auch in der Natur als schwarzer Magneteisenstein (Magnetit) vor. Es besitzt eine inverse SpinellStruktur FeIIFe2IIIO4 (kubisch dichteste Packung von O2- - Ionen, Fe2+ in oktaedrischen, Fe2+ zur Hälfte in tetraedrischen, zur anderen Hälfte in oktaedrischen Lücken. Anwendung: Fe3O4 entsteht unter anderem als „Hammerschlag“ beim Verbrennen der beim Schmieden von glühendem Eisen abspringenden Eisenteilchen. Wegen seiner grossen Beständigkeit gegen saure und alkalische Agentien sowie gegen Chlor dient geschmolzener Magnetit zur Herstellung von Elektroden für die Chloralkali-Elektrolyse. Die elektrische Leitfähigkeit von Fe3O4 ist millionenmal grösser als die von Fe2O3, was wahrscheinlich durch einen raschen Austausch von Valenzelektronen zwischen Fe(II) und Fe(III) bewirkt wird. Verbrennung von Stahlwolle Versuch: Stahlwolle wird an der Querstange eines Stativs aufgehängt. Man entzündet sie am unteren Ende, indem man mittels einer Batterie einen Kurzschluss hervorruft. Die Stahlwolle brennt unter Aufglühen ab. Die Menge des Materials sollte der Grösse des Raums angepasst werden! Vertiefung: Das Phänomen der Eisenverbrennung wurde bereits im vorhergehenden Versuch erläutert. Lithium, Natrium und Kalium in Wasser Im Experiment wird in einer Kristallisierschale oder einem Becherglas Wasser vorgelegt. Zum Nachweis der Hydroxidionen wird Phenolphthalein als Indikator (Umschlagpunkt farblos-rot: pH 8...10) zugesetzt. Nach Zugabe des Alkalimetalls setzt mit unterschiedlicher Heftigkeit eine Wasserstoffentwicklung bis zur vollständigen Auflösung des Metalls ein, wobei sich die Lösung rot färbt. Das Metall schwimmt aufgrund seiner geringen Dichte auf dem Wasser. Auch andere protonenaktive Substanzen, z.B. Alkohole, reagieren mit Alkalimetallen unter Wasserstoffentwicklung. Als Beispiel wird die Reaktion von Ethanol (pKS = 16,0) mit Natrium gezeigt. Die Reaktion verläuft deutlich langsamer als mit Wasser. 2 Li + 2 H2O → 2 Li+ + 2 OH- + H2 (g) 2 Na + 2 H2O → 2 Na+ + 2 OH- + H2 (g) 2 Na + 2 C2H5OH → 2 Na+ + 2 C2H5O- + H2 (g) 2 K + 2 H2O → 2 K+ + 2 OH- + H2 (g) Chemische Grundlagen Entsprechend der stark negativen Normalpozentiale E°(Li+ / Li ) = – 3,02 V E°(Na+ / Na) = – 2,71 V E°(K+ / K) = – 2,92 V wird Wasser [E(H+ / H2) = – 0,42 V bei pH 7] unter Bildung von Wasserstoff und den entsprechenden Metallhydroxiden reduziert. Der aus dem Rahmen fallende hohe negative Wert des Normalpotenzials von Lithium ist auf die besonders hohe Hydratationsenthalpie des Lithium-Ions (ΔH° = - 499,5 kJ/mol) zurückzuführen, welche die Bildung von Li+-Ionen in wässriger Lösung begünstigt. Entsprechend dem mit steigender Atommasse zunehmenden elektropositiven Charakter nimmt die Reaktivität der Alkalimetalle gegenüber Wasser vom Lithium zum Kalium zu. Lithium reagiert mit Wasser, ohne zu schmelzen und ohne Entzündung des Wasserstoffs; Natrium schmilzt bei der Reaktion, ohne dass der Wasserstoff verbrennt. Kalium (sowie auch die schwereren Alkalimetalle) reagiert so heftig, dass sich der Wasserstoff entzündet und mit violetter Flamme verbrennt. Didaktische Hinweise Die stetige Änderung der Reaktivität bei den Alkalimetallen wird zur Demonstration der Periodizität in den Eigenschaften der Elemente und zur Einführung des Periodensystems der Elemente eingesetzt. Reaktivität von Aluminium gegenüber salzsauren Kupfersalzlösungen Versuch: In einem Erlenmeyerkolben werden 100 ml einer CuSO4-Lösung (1mol·l-1) mit 50 ml 30%iger Schwefelsäure versetzt. In einem zweiten Kolben gibt man zu 100 ml CuCl2-Lösung (1mol·l-1) 50 ml konz. Salzsäure. In beide Kolben gibt man ein Stück geknüllte Aluminiumfolie. In der schwefelsauren Lösung bleibt die Folie unverändert. Mit der salzsauren Kupferchlorid-Lösung tritt dagegen eine heftige Reaktion ein. Dabei entsteht ein Gas, das sich entzünden lässt und mit blaugrüner Flamme brennt. Die Lösung erhitzt sich stark. Der dabei entstehende Wasserdampf führt nach kurzer Zeit zum Erlöschen der Flamme. Im Kolben findet sich nach dem Abklingen der Reaktion metallisches Kupfer. Vertiefung: Aluminium ist ein sehr unedles Metall (E° (Al3+/Al) = -1.66 V). An der Luft überzieht es sich mit einer dichten Oxidschicht. Es wird dadurch passiviert und ist vor weiterem Angriff geschützt. Aluminiumoxid ist praktisch wasserunlöslich und auch gegen verdünnte Säuren und schwache Laugen beständig. Liegen jedoch Komplexbildner vor, hier sind dies die Chlorid-Ionen, kann die Oxidschicht leicht aufgelöst werden. Sobald an einer Stelle die Metalloberfläche frei liegt, kann daran eine Redox-Reaktion mit den Kupferionen einsetzen. Elementares Kupfer scheidet sich ab. Dabei bildet sich ein Lokalelement aus. An diesem erfolgt die intensive Reaktion des Aluminiums mit der Salzsäure, wobei Wasserstoff entsteht. Der Wasserstoff lässt sich entzünden. Die Flamme wird durch Kupfer blaugrün gefärbt. Die Reaktionen an den Elektroden des Lokalelementes können folgendermassen beschrieben werden: Anode (Cu): 3 H+ + 3 e- 1.5 H2 Kathode (Al): Al Al3+ + 3 e- 3 H+ + Al 1.5 H2 + Al3+ Anwendung: Das Experiment demonstriert die Passivierung des Aluminiums gegenüber Säuren sowie eine Methode (Komplexbildung) zur Aufhebung der Passivierung . Die Passivierung ist Grundbedingung dafür, dass Aluminium als Konstruktionsmaterial verwendet werden kann. Die Schutzwirkung kann noch erheblich verbessert werden, indem man durch anodische Oxidation künstlich eine wesentlich dickere, harte Oxidhaut (0.02 mm) erzeugt (Eloxal-Verfahren; Eloxal = Elektrisch oxidiertes Aluminium). So behandeltes („eloxiertes“) Aluminium ist weitgehend beständig gegen Witterung, Seewasser, Säuren und Alkalilaugen. Cu-Fe-Element Versuch: Das Experiment zeigt die Reaktionen eines Lokalelements zwischen Kupfer und Eisen. Eine Kupfer-Elektrode (links) und eine Eisenelektrode (rechts) werden in einem Becherglas aufgehängt und mittels eines Leitungsdrahtes verbunden. In das Becherglas wird eine NaClLösung als Elektrolyt gefüllt. Um die Reaktionen sichtbar zu machen, werden der Lösung Phenolphthalein und K3[Fe(CN)6] (rotes Blutlaugensalz) als Indikatoren zugesetzt. Die Umgebung der Kupferelektrode färbt sich nach kurzer Zeit rot, was auf die basische Form des Phenolphthaleins zurückzuführen ist. In der Umgebung der Eisenelektrode wird nach einiger Zeit ein tiefblauer Feststoff ("Berliner Blau") sichtbar, der auf die Umsetzung der entstandenen Fe2+ - Ionen mit dem Eisenkomplex zurückzuführen ist. Die Gesamtdauer der im Video gerafften Reaktion beträgt etwa 30 min. Vertiefung: Korrosion ist die Reaktion eines Werkstoffes mit seiner Umgebung, die eine messbare Veränderung des Werkstoffes bewirkt und zu seiner Schädigung (Risse, Löcher, Mulden) führt. Die meisten Korrosionsprozesse sind elektrochemischer Art. Die elektrochemische Korrosion wird durch die Bildung eines galvanischen Elementes verursacht. Berühren sich zwei Metalle in einer Elektrolytlösung wie z.B. CO2 - haltigem Wasser (Regenwasser), entsteht an der Berührungsstelle ein Lokalelement. Das unedlere Metall (Anode) löst sich auf (korrodiert), am edleren Metall (Kathode) wird häufig Sauerstoff zu OH- - Ionen reduziert. Entsprechend den Potenzialen E°(Cu2+ / Cu) = + 0,35 V und E°(Fe2+ / Fe) = - 0,44 V reagiert Kupfer in diesem Lokalelement als Kathode und Eisen als Anode. Die Elektrodenreaktionen und die Folgereaktionen können folgendermaßen beschrieben werden: Anode: Fe2+ + 2 e- Fe +3 Kathode: +2 +3 Fe2+ + [Fe(CN)6]3- [FeFe(CN)6]- 0.5 O2 + H2O + 2 e- 2 OH- "Berliner Blau" OH - Ionen färben Phenolphthalein rot Die Gesamtreaktion der Korrosion ohne Folgereaktionen lautet: Fe + 0.5 O2 + H2O Fe(OH)2 Anwendung: Korrosion von Metallen, besonders von Eisen, ist ein Problem von volkswirtschaftlicher Dimension. Es fehlt daher nicht an Verfahren zur Eindämmung dieses Prozesses. Vollständig zu verhindern ist er aber kaum. So lässt sich die Haltbarkeit des Eisens gegenüber feuchter Luft durch Anstriche (z.B. Mennige-Grundierung) oder durch Überziehen mit Zink („verzinktes Eisenblech“) oder Zinn („Weissblech“) erhöhen. Die rostschützende Wirkung von Mennige Pb3O4 beruht auf Passivierung durch oxidative Bildung eines EisenoxidÜberzuges. Das unedlere Zink bildet mit dem edleren Eisen ein galvanisches Element, bei welchem das Eisen Kathode ist, so dass kein Rost gebildet wird. Das edlere Zinn schützt das Eisen vor dem Rosten, solange der Überzug unverletzt ist. Tritt allerdings erst einmal an einer Stelle Eisen zutage, so erfolgt durch Ausbildung eines Lokalelementes eine rasche Zerstörung des als Anode fungierenden Eisens. Mg / Trockeneis Versuch In die Mitte eines Trockeneis-Blocks wird ein Loch gebohrt und mit Magnesium-Band gefüllt. Man entzündet das Metall mit dem Bunsenbrenner. Sobald das Magnesium mit blendend weissem Licht brennt, wird es mit weiterem Trockeneis abgedeckt. Mit fortschreitender Reaktion beginnt der gesamte Block zu glühen. Nach Abklingen der Reaktion findet man im Zentrum des Blocks den entstandenen schwarzen Kohlenstoff. CO2 + 2 Mg → 2 MgO + C Chemische Grundlagen Magnesium ist an der Luft trotz seiner hohen Affinität zu Sauerstoff bei Zimmertemperatur recht beständig, da es sich wie auch Aluminium mit einer dünnen Oxidhaut überzieht. Bei höheren Temperaturen verbrennt es mit blendend weissem Licht. Aufgrund der Affinität zu Sauerstoff dient Magnesium als sehr kräftiges Reduktionsmittel. Es reduziert in der Hitze auch so beständige Oxide wie SiO2 und B2O3. Im Experiment wird die Reduktionswirkung am Beispiel des CO2 gezeigt. Anwendungen und Alltagsbezug Kohlendioxid liegt bei – 78,5°C und einem Druck von 1 bar in festem Zustand vor ("Kohlensäureschnee, Trockeneis"). Beim sehr raschen Verdampfen von flüssigem CO2 kühlt es sich so stark ab, dass es gefriert. Das Molekülgitter wird durch van der Waals-Kräfte zusammengehalten. Die sehr hohe Sublimationsenthalpie des festen CO2 (573,2 kJ/kg bei – 78,5°C) macht es als Kältemittel geeignet. Die obige Reaktion ist ein Beleg dafür, dass Metallbrände nicht mit CO2-Feuerlöschern bekämpft werden dürfen. (Naumann, L., Wasser und Kohlenstoffdioxid - keine Löschmittel für brennende Leichtmetalle!, Naturw. im Unterricht, Sammelband 1997 (Experimente interessant und praxisnah), S. 37) Magnesium wird wegen seiner gleissend heller Flamme in der Pyrotechnik und für Theaterblitze verwendet. Farb- und Leuchtstoffe Bleichen einer roten Rose Versuch: Man stellt eine Rose in einem als Vase dienenden Erlenmeyerkolben auf eine feuerfeste Platte. Daneben wird in einer Glasschale etwas Schwefel entzündet. Anschliessend stülpt man über Blume und Glasschale ein Becherglas. Nach einigen Sekunden ist die Rose weiss gebleicht. Besteht wieder der Wunsch nach einer roten Blume, taucht man die weisse Rose in ein Becherglas mit konzentrierter Salzsäure und erhält wieder eine rote Blume. Vertiefung: Anthocyanine sind als Derivate der 2-Phenylbenzopyrylium-Salze (Flavylium-Salze) für die blauen, violetten und roten Farben vieler Blumen, Früchte, Fruchtsäfte und Rotweinsorten verantwortlich. Die vier in wässrigen Lösungen möglichen Cyaninstrukturen stehen miteinander im Gleichgewicht. OH OH HO O OH - H+ O O OH OR OR OR OR Flavylium-Kation pH 1-2; rot Chinoide Base pH 6-6.5; rot-violett H2O / H+ OH OH OH HO OHO HO O OH OH OR OR OR Carbinol-Pseudobase pH ca. 4.5; farblos OR Chalkon-Pseudobase pH > 7; farblos Bei Umsetzungen mit Schwefeldioxid im pH-Bereich von 1-3 spielt lediglich das rote Flavylium-Kation eine Rolle. Der Verlust der Pigmentierung der Rose beruht auf der nucleophilen Addition des Hydrogensulfits an das Flavylium-Kation unter Ausbildung eines sehr stabilen Addukts. Das Hydrogensulfit resultiert aus der Umsetzung von SO2 mit Wasser gemäss folgendem Gleichgewicht. SO2 + 2 H2O HSO3- + H3O+ Taucht man die Rose in konz. Salzsäure, so wird das Gleichgewicht nach links verschoben. Die Konzentration des Hydrogensulfits sinkt und das Addukt wird zerstört. Man erhält wieder das rote Flavylium-Kation. Anwendung: Dieser Versuch ist ein Schauversuch, der eindrücklich demonstriert, dass Schwefeldioxid als Schadstoff in der Luft mit biologischen Organismen in Wechselwirkung tritt. Dabei muss natürlich darauf hingewiesen werden, dass der Partialdruck (Konzentration) von SO2 in der Luft um viele Zehnerpotenzen geringer ist als in unserem Experiment. Blue Bottle In einem Glasgefäss (Flasche, Kolben) werden 10 g NaOH in 750 ml Wasser gelöst. Man fügt 40 g Glucose hinzu. Nun versetzt man mit 10 ml Methylenblau-Lösung (0.2% in Wasser) und verschliesst das Gefäss. Nach rund einer Minute entfärbt sich das Methylenblau. Danach schüttelt man den Kolben kräftig durch, worauf die blaue Färbung wieder zurückkehrt. Dieser Prozess kann mehrfach wiederholt werden. Chemische Grundlagen Viele organische Verbindungen können mittels Luftsauerstoff oxidiert werden. Diese Reaktion kann besonders gut an organischen Farbstoffen beobachtet werden, die in der reduzierten und oxidierten Form verschiedene Farben zeigen. Als Beispiel wird das Redoxverhalten von Methylenblau demonstriert: Der blaue Farbstoff kann mittels Glucose leicht zum farblosen Leukomethylenblau reduziert werden, wobei Glucose schliesslich zu einem Gemisch von Gluconolacton, Gluconsäure und Glucuronsäure oxidiert wird. Bei Zutritt von Luftsauerstoff wird die Leukobase wieder zum blauen Farbstoff oxidiert. Die Reaktionen sind im folgenden Schema zusammengefasst. N(CH3)2 N(CH3)2 Reduktion Cl + C6H12O6 N S HN S + HCl + O2 Oxidation N(CH3)2 Methylenblau N(CH3)2 Leukomethylenblau Anwendungen und Alltagsbezug Robert Koch gelang es gegen Ende des 19. Jahrhunderts, mit Methylenblau Tuberkelbazillen anzufärben und damit zu markieren. Das kann als Beginn der Chemotherapie angesehen werden. Paul Ehrlich etablierte die Verwendung des Methylenblaus zur Färbung des peripheren Nervensystems. Heute wird Methylenblau immer noch zum Einfärben histologischer Präparate verwendet. Es findet ausserdem als Tinten-und Textilfarbstoff Verwendung. Der Übergang des blauen Farbstoffes in die farblose Leukoform kann als eine Analogie zum Tintenkiller dienen. Allerdings verläuft die Entfärbung der Tinten mit Tintenkiller oxidativ und nicht reduktiv wie beim Methylenblau und sie sollte auch irreversibel sein. M. Tausch (Photo-Blue-Bottle - Modellversuche zur Photosynthese und zur Atmung , Praxis der Naturw.- Chemie. 3 (1994), 13 - 18) plädiert für die Verwendung eines analogen Experimentes (Photo-Blue-Bottle) im Chemieunterricht als Analogie für Photosynthese und Atmung. Bei diesemVersuch wird ein chemisches System durch Licht in einen energiereichen (blauen) Zustand übergeführt (entsprechend der Photosynthese) und unter Wärmeabgabe und Sauerstoffverbrauch kehrt das System in den energieärmeren (gelben) Zustand zurück (entsprechend der Atmung). Redoxreaktion mit Indigocarmin („Verkehrsampel“) Versuch: Ein 2-l-Becherglas enthält die Glucoselösung (A) und wird auf 35°C erwärmt. Nach Zugabe von Indigocarmin (C) wird die nun blaue Lösung mit Lösung (B) versetzt und verfärbt sich nach grün. Nach kurzer Zeit erfolgt ein Farbumschlag über rot nach goldgelb. Giesst man diese Lösung aus 1-2 m Höhe in ein leeres 2-l-Becherglas, so liegt wieder eine grüne Lösung vor. Diese Demonstration kann mehrfach wiederholt werden. Lösung (A): 22.4 g Glucose in 1120 ml Wasser Lösung (B): 9.6 g NaOH in 320 ml Wasser (C): 0.064 g Indigocarmin Vertiefung: Der Wollfarbstoff Indigocarmin ist sehr luftempfindlich. Die Farbstofflösung wird durch Glucose reduziert. Beim Umgiessen erfolgt Oxidation durch Luftsauerstoff. Es laufen ähnliche Redoxprozesse wie beim Versuch „Blue Bottle“ ab. O H N Indigo N H O O H N SO3H Indigocarmin N H HO3S O Sechs Farben Versuch: Sechs Glasgefässe werden vor der Demonstration mit geringen Mengen farbloser oder schwach gefärbter Lösungen gefüllt. Für den Überraschungseffekt ist es günstig, wenn das Publikum die Lösungen nicht erkennen kann. Wir benutzen in der Regel Burgundergläser mit einem Volumen von etwa 500 ml. Die Gläser werden mit folgenden Lösungen gefüllt: Glas 1: Phenolphthalein 1% in Methanol, 1½ Pipetten lang (unmittelbar vor der Demo zugeben) Glas 2: Natriumcarbonat 5% in Wasser, 10 Tropfen Glas 3: FeCl3 (Hydrat) 50% in Wasser, 10 Tropfen Glas 4: Ammoniumthiocyanat 30% in Wasser, 5 Tropfen Glas 5: Gelbes Blutlaugensalz K4[Fe(CN)6] 5% in Wasser, 10 Tropfen Glas 6: NaOH 30% in Wasser, > 6 Tropfen Die Lösungen in den Gläser 2-6 können bis zu 3h vorher vorgelegt werden. Zur Demonstration füllt man Glas 1 aus dem Wasserhahn mit Leitungswasser und kippt die farblose Lösung in Glas 2, wobei sie sich rot färbt. Glas 2 wird nun in Glas 3 gekippt usw. Vertiefung: Die Farbänderungen während des Umkippens sind im folgenden Schema zusammengefasst. In den Gläsern 1-3 handelt es sich lediglich um Farbwechsel des Phenolphthaleins. In den Gläsern 3-6 liegen verschiedene Eisenkomplexe vor: Phenolphthalein K4[Fe(CN)6] FeCl3 x 6 H2O Na2CO3 NH4SCN 2 1 3 NaOH 30% 4 Fe(SCN)3 farblos, pH < 8 rot, pH > 8 OH O 5 K[FeIIFeIII(CN)6] 2 OH O C O OH 2H O O C O 6 Fe(OH)3 Drei unmischbare Flüssigkeiten Drei Lösungen in den Farben Blau-Gelb-Rot stehen in einem Glas übereinander. Auch durch Schütteln sind sie nicht mischbar, sie trennen sich nach kurzer Zeit wieder in die einzelnen Phasen. Durch geeignete Wahl der Lösungsmittel ist es möglich, drei nicht mischbare Phasen zusammenzustellen. Das Experiment beruht darauf, dass Ethanol zwar mit Wasser, nicht aber mit gesättigten Salzlösungen mischbar ist. Als dritte Phase wird ein unpolares organisches Lösungsmittel (Ligroin) verwendet. Vertiefung: Beim Versetzen einer 1:1-Mischung von Ethanol und Wasser mit Kaliumcarbonat bis zur Sättigung kommt es zu einer Phasentrennung von gesättigter Salzlösung und Ethanol. Fügt man nun das unpolare Ligroin (Leichtbenzin, Kp. 65-100°C) zu, so entsteht ein nicht mischbares Dreiphasensystem. Die einzelnen Phasen werden mittels geeigneter Farbstoffe angefärbt. Die wässrige Phase wird durch das Salz Kupfersulfat blau gefärbt. In der basischen Lösung liegt dann in merklicher Konzentration ein tiefblaues Cuprat-(II) vor. Die alkoholische Phase wird durch Methylorange angefärbt und das Ligroin mittels Sudan III. Ligroin / Sudan III rot H2O / C2H5OH / Methylorange gelborange H2O / K2CO3 / CuSO4 blau Methylorange NaO3S N N N(CH3)2 Sudan III N N N N HO Nickel-Komplexe Versuch: Sieben Bechergläser enthalten eine wässrige Lösung von Nickel(II)-sulfat. Ein Becherglas dient zum Farbvergleich. Die übrigen Bechergläser werden mit verschiedenen Komplexbildnern (Ammoniak, Ethylendiamin im stöchiometrischen Verhältnis 1:1, 1:2 bzw. 1:3, Dimethylglyoxim, Kaliumcyanid) versetzt. Es bilden sich stark farbige Komplexe des zweiwertigen Nickels. 7 400-ml-Bechergläser werden mit 20 ml wässriger NiSO4-Lösung 1 M gefüllt. Anschliessend werden alle Gläser mit Wasser auf 300 ml aufgefüllt. Es empfiehlt sich, ein Leuchtpult hinter die Gläser zu stellen. Glas 1: Vergleichslösung (grün) Glas 2: + 40 ml NH3 5 M (dunkelblau) Glas 3: + 5 ml Ethylendiamin 25% (hellblau) Glas 4: + 10 ml Ethylendiamin 25% (dunkelblau) Glas 5: + 15 ml Ethylendiamin 25% (violett) Glas 6: + 25 ml Dimethylglyoxim 1% (rot) Glas 7: + 60 ml KCN 2 M (gelb) Anmerkung: Das hochgiftige KCN sollte in diesen Mengen nur verwendet werden, wenn eine sachgemässe Entsorgung gewährleistet ist! Vertiefung: Die vorgestellten Reaktionen und die Strukturen der Komplexe sind im folgenden Schema zusammengefasst: NH3 H3N Ni H3N NH2 2+ NH3 H2N NH3 H2 O NH3 2+ OH2 Ni OH2 OH2 dunkelblau hellblau en K = 10 β = 109 6 NH3 K = 109 en NH2 H2N OH2 Ni H2 O OH2 NH 2+ OH2 Ni 2+ OH2 HN H2O 6 dunkelblau OH2 en K = 10 5 OH2 3 en 18 β = 10 grün NH2 H2N Ni HN 17 β = 10 NH 2 dmg 2+ H2 N N H2 violett - H3C C C O N N O N O Ni H O 4 CN 18 β = 10 CH3 N H NC CN 2- Ni C H3C NC C rot CH3 CN gelb Anwendung: Der vorgestellte Versuch ist ein Schauversuch, der die farbliche und strukturelle Vielfalt von Nickel(II)-Komplexen unterstreichen soll. Nickel-Komplexe besitzen jedoch als Katalysatoren auch praktische Bedeutung. Es sei hier nur auf die homogenkatalytische Oligomerisierung konjugierter Diene mittels π-Allyl-Nickel-Komplexen und auf verschiedene Hydrierprozesse an ungesättigten organischen Verbindungen hingewiesen. Chemolumineszenz bei der Oxidation von Oxalsäureestern Versuch: Im abgedunkelten Raum werden zwei Lösungen A und B über einen Trichter gemeinsam in eine farblose PET-Flasche (500 ml) gekippt. Es tritt sofort eine rote, grüne oder blau Chemolumineszenz auf, die einige Minuten anhält. Lösung A: 225 ml Dimethylphthalat 1.01g Bis(2,4,6-trichlorophenyl)oxalat (TCPO) 0.23 g Rhodamin B (rot) oder 0.23 g 9,10-Diphenylanthracen (blau) oder 0.23 g 9,10-Bis(phenylethinyl)anthracen Lösung B: 167 ml Dimethylphthalat 42 ml tert.-Butanol 0.06 g Natriumsalicylat 17 ml H2O2 (30%) – kurz vor der Demonstration zugeben Vertiefung: Die summarische Redoxgleichung ist im folgenden wiedergegeben: RO O O C C OR + H2O2 2 CO2 + 2 ROH + hν Sensibilisatoren: Rhodamin B 9,10- Diphenylanthracen 9,10-Bis(phenylethinyl)anthracen Der exakte Mechanismus ist nicht bekannt. Es sollte jedoch intermediär ein Dioxetandion entstehen, dass mit dem Farbstoff einen Charge-Transfer-Komplex bildet. Dieser zerfällt in ein angeregtes Farbstoffmolekül und Kohlendioxid. Beim Übergang des Farbstoffs in den Grundzustand wird Licht emittiert. Katalyse „Schaumschlange“ (Zersetzung von Wasserstoffperoxid mittels Iodid-Katalyse) Versuch: In einen Messzylinder werden 100 ml Wasserstoffperoxid (30%) gefüllt. Dazu gibt man 25 ml eines Tensids (Geschirrspülmittel). Nach Zugabe einer katalytischen Menge Kaliumiodid (2g) beginnt eine heftige Gasentwicklung. Der dabei gebildete, feinporige Schaum quillt aus dem Messzylinder. Achtung! Grosse Auffangschale für den Schaum benutzen! Vertiefung: Wasserstoffperoxid zeigt ein starkes Bestreben, unter grosser Wärmeentwicklung in Wasser und Sauerstoff zu zerfallen (Disproportionierung): 2 H2O2 2 H2O + O2 ΔH = - 196.2 kJ/mol Bei Zimmertemperatur ist die Zerfallsgeschwindigkeit allerdings unmessbar klein, so dass Wasserstoffperoxid sowohl in reinem wie auch in gelöstem Zustand praktisch beständig (metastabil) ist. Erst bei höheren Temperaturen zersetzt es sich, unter Umständen auch explosionsartig. Die grosse Zerfallshemmung beruht darauf, dass der erste Schritt einer H2O2Thermolyse in einer energieaufwendigen Molekülspaltung in zwei OH-Radikale besteht. Letztere setzen sich unter Auslösung einer Radikalkettenreaktion weiter mit H2O2 um. Durch Katalysatoren (z.B. feinverteiltes Silber, Gold, Platin, Braunstein oder Staubteilchen als heterogene Katalysatoren sowie I-, IO3-, OH-, Fe3+ oder Cu2+ als homogene Katalysatoren) lässt sich die Zersetzungsgeschwindigkeit stark erhöhen. Gegebenenfalls tritt bereits bei Raumtemperatur stürmische Sauerstoff-Entwicklung ein und bei hochkonzentrierten Lösungen wegen der starken Wärmeentwicklung sogar explosionsartiger Zerfall. Tenside (latein.: tensio = Spannung ) sind Verbindungen, welche die Grenzflächenspannung herabsetzen. Tenside sind amphiphile (bifunktionelle) Verbindungen mit mindestens einem hydrophoben und einem hydrophilen Molekülteil. Der hydrophobe Rest ist zumeist eine möglichst lineare Kohlenwasserstoff-Kette mit acht bis 22 Kohlenstoff-Atomen. Spezielle Tenside haben auch (Dimethyl-)Siloxan-Ketten oder perfluorierte Kohlenwasserstoff-Ketten als hydrophoben Molekülteil. Der hydrophile Rest ist entweder eine negative oder positive elektrisch geladene (hydratisierbare) oder eine neutrale polare Kopfgruppe. Der Schaum entsteht, wenn das bei der Reaktion gebildete Sauerstoffgas durch die Lösung nach oben strömt. Anwendung: Die hier gezeigte Variante der Zersetzung von H2O2 ist ein Schauversuch. Man nutzt den katalytischen Zerfall von H2O2 zur Darstellung von Sauerstoff im Labor, indem man H2O2 (30%) an einem platinierten Nickelblech zersetzt oder Braunstein zu einer 10-15 %igen H2O2 – Lösung gibt. Überschüssiges H2O2 in Reaktionsgefässen zerstört man durch Erhitzen mit Alkalilauge. Der Zerfall erfolgt offensichtlich auf dem Wege einer nucleophilen Substitution. Auch die Natur bedient sich eines Katalysators (z.B. des Fe3+haltigen Enzyms Catalase) zum raschen Abbau des im lebenden Organismus durch eine Reihe von Prozessen erzeugten Wasserstoffperoxids. Zersetzung von Wasserstoffperoxid mittels Braunstein oder KMnO4 Versuch: In einem Reagenzglas wird eine katalytische Menge Mangan(IV)-oxid („Braunstein“) vorgelegt. Übergiesst man die Substanz mit Wasserstoffperoxid (30%), so kommt es zu einer heftigen Zersetzungsreaktion unter Sauerstoff-Entwicklung. Grosse Variante „Dampfsäule“ (Nur in hohen Räumen oder unter freiem Himmel durchführen! Schutzbrille! Zuschauer sollten einige Meter Abstand halten!): In einen 200 ml Weithals-Erlenmeyerkolben gibt man etwa 30-50 ml Wasserstoffperoxid (30%). Nach Zugabe einer Spatelspitze KMnO4 schiesst eine Dampfsäule aus dem Kolben. Um den Dampfstrahl gerichtet nach oben zu lenken, kann man auf den Kolben noch ein Plexiglasrohr aufsetzen. Vertiefung: Wasserstoffperoxid zeigt ein starkes Bestreben, unter grosser Wärmeentwicklung in Wasser und Sauerstoff zu zerfallen (Disproportionierung): 2 H2O2 2 H2O + O2 ΔH = - 196.2 kJ/mol Bei Zimmertemperatur ist die Zerfallsgeschwindigkeit allerdings unmessbar klein, so dass Wasserstoffperoxid sowohl in reinem wie auch in gelöstem Zustand praktisch beständig (metastabil) ist. Erst bei höheren Temperaturen zersetzt es sich, unter Umständen auch explosionsartig. Die grosse Zerfallshemmung beruht darauf, dass der erste Schritt einer H2O2Thermolyse in einer energieaufwendigen Molekülspaltung in zwei OH-Radikale besteht. Letztere setzen sich unter Auslösung einer Radikalkettenreaktion weiter mit H2O2 um. Durch Katalysatoren (z.B. feinverteiltes Silber, Gold, Platin, Braunstein oder Staubteilchen als heterogene Katalysatoren sowie OH-, Fe3+ oder Cu2+ als homogene Katalysatoren) lässt sich die Zersetzungsgeschwindigkeit stark erhöhen. Gegebenenfalls tritt bereits bei Raumtemperatur stürmische Sauerstoff-Entwicklung ein und bei hochkonzentrierten Lösungen wegen der starken Wärmeentwicklung sogar explosionsartiger Zerfall. Anwendung: Man nutzt den katalytischen Zerfall von H2O2 zur Darstellung von Sauerstoff im Labor, indem man H2O2 (30%) an einem platinierten Nickelblech zersetzt oder Braunstein zu einer 10-15 %igen H2O2 – Lösung gibt. Überschüssiges H2O2 in Reaktionsgefässen zerstört man durch Erhitzen mit Alkalilauge. Der Zerfall erfolgt offensichtlich auf dem Wege einer nucleophilen Substitution. Auch die Natur bedient sich eines Katalysators (z.B. des Fe3+haltigen Enzyms Catalase) zum raschen Abbau des im lebenden Organismus durch eine Reihe von Prozessen erzeugten Wasserstoffperoxids. Oszillierender Pt-Draht (Oxidation von Methanol) Versuch: In ein Becherglas gibt man Methanol. In das Becherglas hängt man nun einen Pt-Draht, der in unserem Fall zum ETH-Signet geformt wurde (Abstand zur Methanoloberfläche etwa 1 cm). Vor Beginn des Versuchs wird der Pt-Draht mit dem Brenner erhitzt. Nach Abdunkeln des Raumes sieht man den glühenden Draht über dem Methanolspiegel. In der hellsten Glühphase des Drahtes entzündet sich das Methanol, brennt kurze Zeit und erlischt. Während der Brennphase verblast die Rotglut des Drahtes. Das Glühen beginnt jedoch bald darauf erneut und das Methanol wird wiederum entzündet. Der Vorgang wiederholt sich bis zum vollständigen Verbrauch des Methanols. Es muss darauf geachtet werden, dass der Gasaustausch mit der Umgebung jederzeit gewährleistet ist (Zuführung des zur Oxidation benötigten Luftsauerstoffs). Vertiefung: Die Oxidation des Methanols kann auf zwei Weisen verlaufen. Die platinkatalysierte Oxidation führt zum Formaldehyd und Wasser (I). Bei der Verbrennung des Methanols entstehen Kohlendioxid und Wasser (II). Aufglühen des Drahtes: O Pt CH3OH + 0.5 O2 H C + H2O (I) H Entflammen der Lösung: CH3OH + 1.5 O2 CO2+ 2 H2O (II) In der Glühphase dominiert der Prozess (I). Dabei heizt sich das Methanol-LuftDampfgemisch über der Lösung immer mehr auf, bis es zur Selbstentzündung kommt (II). Da die Verbrennung mehr Sauerstoff benötigt, herrscht für kurze Zeit Sauerstoffmangel. Daher erlischt die Flamme und die katalytische Oxidation wird gebremst. Nachdem neuer Luftsauerstoff nachgeliefert wurde, setzt zunächst die katalytische Oxidation wieder ein und der Reaktionszyklus beginnt von vorn. Anwendung: Formaldehyd (Methanal) ist ein wichtiges organisches Zwischenprodukt und wird weltweit jährlich in der Grössenordnung von mehreren Millionen Tonnen durch katalytische Oxidation von Methanol mit Sauerstoff hergestellt. In der Technik verwendet man als Katalysator in der Regel allerdings nicht Platin sondern das billigere Silber. Trotzdem ist Platin das wichtigste und häufigste Metall der Platingruppe und findet ausgedehnte technische Verwendung als Katalysator (Jahresweltproduktion etwa 100 t). Ammoniak-Oxidation an Chrom(III)-oxid Versuch: 50 ml einer konzentrierten wässrigen Ammoniak-Lösung (35%) werden in einen 10-lGlaskolben gefüllt. Durch Schütteln bildet sich über der Flüssigkeit ein Ammoniak-LuftGemisch. Ausserhalb des Kolbens wird Cr2O3 in einem Metalltiegel zur Rotglut erhitzt. Man führt den Tiegel in den Kolben ein und versprüht die heissen Partikel mittels Luftdruck. An der Oberfläche der Partikel wird Ammoniak mittels Luftsauerstoff oxidiert, wobei der Katalysator hell aufglüht. Das verwendete Cr2O3 sollte eine möglichst grosse Oberfläche besitzen. Daher eignet sich besonders gut Chrom(III)-oxid, das bei der Verbrennung von Ammoniumchromat („Vulkan“) entsteht. Vertiefung: Die Synthese von Ammoniak aus Stickstoff und Wasserstoff ist die einzige grosstechnisch nutzbare Methode zur Spaltung der Dreifachbindung des Stickstoffmoleküls. Daher führen alle technischen Synthesen von Stickstoffverbindungen aus Luftstickstoff über die Stufe des Ammoniaks. Für die Herstellung von Salpetersäure und Nitraten muss der Ammoniak gezielt zu Stickstoffmonoxid oxidiert werden. Ohne den Einsatz eines Katalysators verbrennt er an der Luft jedoch vorrangig zu elementarem Stickstoff und Wasser. Bei Einsatz eines Katalysators ist jedoch bei hohen Temperaturen eine selektive Verbrennung zum endothermen Stickstoffmonoxid (ΔH° = + 90.6 kJ/mol) möglich. Dieses wird anschliessend durch Luftsauerstoff zu Stickstoffdioxid weiter oxidiert. In der Technik werden Platinnetze mit grosser Oberfläche als Katalysatoren verwendet (Ostwald-Verfahren). Der hier gezeigte Versuch verwendet Cr2O3 als Katalysator, wobei ein analoger Effekt beobachtet wird. 4 NH3 + 5 O2 Cr2O3 > 600°C 4 NO + 6 H2O Anwendung: Die katalytische Oxidation von Ammoniak ist Teil des technischen Prozesses zur Gewinnung von Salpetersäure, Nitraten (Düngemittel, Sprengstoffe) sowie organischen Nitroverbindungen. Die hier gezeigte Variante der Oxidation mit Hilfe von Chrom(III)-oxid ist ein Schauversuch. Blau-Gold-Reaktion Versuch: In einem 2-l-Becherglas wird eine auf 50°C vorgewärmte Lösung von 25g Seignettesalz in 150 ml Wasser gerührt. Nach Zugabe von 6 ml H2O2 (30%) und 0.38g CuSO4 x 5 H2O setzt die Reaktion unter Aufschäumen ein und führt zum Farbumschlag von blau nach orange. Durch mehrfache Zugabe von Wasserstoffperoxid (6 ml 30%-ige oder 60 ml 3%-ige Lösung) kann das Farbspiel zwischen blau und orange mehrfach wiederholt werden. Diese Reaktion ist unter dem Namen „Blau-Gold-Reaktion“ bekannt. Vertiefung: Die Oxidation von Natriumkaliumtartrat ("Seignettesalz") mit Wasserstoffperoxid verläuft in unkatalysiertem Zustand sehr langsam. Der Zusatz eines Schwermetall-Ions, in unserem Fall Cu2+ oder beschleunigt die Reaktion jedoch stark. C4H4O62- + 5 H2O2 Cu2+ 4 CO2 + 6 H2O + 2 OH - COO C4H4O62- = H HO OH H COO Tartrat = Salz der Weinsäure Wird eine wässrige Lösung von Tartrat und Wasserstoffperoxid mit einer katalytischen Menge von blauer CuSO4 - Lösung versetzt, so kommt es zu einer starken Gasentwicklung (teilweise mit Überschäumen), gefolgt von einem Farbumschlag nach gelb-orange. Diese Färbung wird durch festes Cu2O hervorgerufen. Die Zugabe von weiterem Wasserstoffperoxid bringt zunächst die blaue Farbe von Cu2+ zurück. Nach erneutem Aufschäumen tritt wiederum der Farbwechsel nach gelb-orange ein. Dieser Reaktionszyklus kann mehrfach wiederholt werden, bis das Lösungsmittelvolumen zu gross und die Konzentrationen der Reaktionspartner zu klein werden. Die folgenden Gleichungen fassen den Reaktionszyklus zusammen. Dabei sollte berücksichtigt werden, dass der Mechanismus durch Nebenreaktionen deutlich komplexer wird. So wird H2O2 durch Schwermetallkationen auch zu Sauerstoff und Wasser zersetzt. 2- C4H4O6 + 4 H2O2 + 2 Cu2+ Cu2O + 4 CO2 + 5 H2O + 2 H+ blau orange Cu2O + H2O2 + 2 H+ 2 Cu2+ + 2 OH - + H2O orange blau 2+ 2C4H4O6 Cu + 5 H2O2 4 CO2 + 6 H2O + 2 OH - Die gleiche Redoxreaktion kann auch mit dem Katalysator Co2+ durchgeführt werden. Im Gegensatz zum Kupfer scheint jedoch keine Redoxreaktion am Metall-Ion stattzufinden. Anwendung: Bei Gegenwart von „Seignettesalz“ werden Cu(II)-salze durch Alkalilaugen nicht gefällt. Es entsteht vielmehr eine tiefblaue Lösung, die einen quadratisch planaren Komplex mit nachfolgender Konstitution enthält: K O C O O C O Na H C H O O C H Cu H C O O H C H Na O C O O C O K Unter dem Namen „Fehlingsche Lösung“ dienen derartige alkalische Kupfersalzlösungen zum Nachweis reduzierender Stoffe wie Zucker. Der Nachweis erfolgt durch den Farbumschlag zum orange-gelben Cu2O. Gase Ammoniak-Springbrunnen (2 Versionen) Versuch: Drei Rundkolben enthalten Wasser, welches mit den Indikatoren Bromkresolgrün, Phenolphthalein und Methylrot sowie jeweils einigen Tropfen Salzsäure versetzt wurde. Die Indikatoren liegen dabei in der sauren Form vor. Über Steigrohre sind die Kolben mit drei gleich grossen Rundkolben verbunden, welche mit Ammoniak-Gas gefüllt sind. Durch kurzes Anblasen (Überdruck) gelangt Wasser in die oberen Kolben. In der Folge wird das gesamte Wasser unter Bildung einer wässrigen Ammoniak-Lösung nach oben gezogen, was durch den Farbwechsel der Indikatoren verdeutlicht wird. Der zweite Teil des Versuches zeigt eine spezielle Version des Ammoniak-Springbrunnens. Anstatt eines Glaskolbens wird eine 1.5-l-PET-Flasche mit Ammoniakgas gefüllt. Spritzt man wiedeum Wasser ein, so wird die PET-Flasche infolge des starken Unterdrucks zusammengequetscht. Vertiefung: Ammoniak ist in Wasser ausserordentlich gut löslich. 1 Liter Wasser löst bei 0°C 1176 Liter, bei 20°C 702 Liter Ammoniak, entsprechend einer 35%igen Lösung. Die wässrige Lösung („Salmiakgeist“) reagiert schwach basisch. NH3 (g) + H2O NH3 . H2O NH4+ + OH - Der Springbrunnen-Versuch zeigt die grosse Heftigkeit, mit der der Ammoniak von Wasser absorbiert wird. Infolge der Absorption des Ammoniaks im Wasser sinkt der Druck im Kolben, sodass das Wasser aus der oberen – verengten – Öffnung des Steigrohres austritt. Die so vergrösserte Wasseroberfläche führt zu einer raschen Steigerung der Absorptionsgeschwindigkeit, bis schliesslich das Wasser wie eine Fontäne in den Glaskolben einschiesst. Dabei ändert sich auf Grund der basischen Wirkung des Ammoniaks die Farbe des Indikators. Anwendung: Dieser Versuch dient zur Demonstration der guten Löslichkeit von Ammoniak-Gas in Wasser. Ammoniak wird heute in einer Menge von etwa 100 Millionen Tonnen pro Jahr hergestellt. Zum überwiegenden Teil (80%) wird er in verschiedenen Formen als Düngemittel eingesetzt. Weitere wichtige Verwendungszwecke sind die Herstellung von Kunststoffen, Fasern sowie Sprengstoffen. Entgasung von Bier im Vakuum Versuch: Ein Glas Bier wird unter ein evakuierbares Glasrohr gestellt. Nach Einschalten der Vakuumpumpe beobachtet man eine Gasentwicklung im Bier. Bei einem Druck von p < 400 mbar beginnt eine Schaumsäule aus dem Glas zu steigen. Diese kann in Abhängigkeit vom verwendeten Glasrohr eine Höhe von mehreren Metern erreichen. Ungekühltes Hefe-Weissbier eignet sich für diesen Versuch am besten, da es einen vergleichsweise hohen Tensid-Anteil enthält. Vertiefung: Bier ist ein CO2-haltiges Getränk, das durch alkoholische Gärung eines mit Hopfen gekochten wässrigen Auszuges aus gekeimtem Getreide entsteht. Einige Inhaltsstoffe des Bieres haben Tensidcharakter (Schaumbildner). Es handelt sich hierbei um die leicht bitteren Inhaltsstoffe des Hopfens Humolon und Lupolon. Je mehr Hopfen im Bier ist, umso eindrucksvoller ist der Schaum. H O CH3 O CH3 H3C CH3 HO O Humolon HO CH3 CH3 1 Liter Wasser löst bei 20°C 0.9 Liter, bei 15°C 1 Liter und bei 0°C 1.7 Liter Kohlendioxid von Atmosphärendruck. Mit steigendem Druck nimmt die Löslichkeit zu. Die entstehende Lösung ist schwach sauer. Das kommt daher, dass sich physikalisch gelöstes Kohlendioxid mit Wasser in geringem Betrag (≈ 0.2%) zu Kohlensäure H2CO3 umsetzt (K = 2·10-3 ; pK = 2.70). Diese (als freie Säure nicht isolierbare) Kohlensäure ist theoretisch eine mittelstarke Säure. Ihre Dissoziationskonstante KS1 beträgt 1.7·10-4 (pKS1 = 3.76). Da aber ≈ 99.8% des gelösten Kohlendioxids nicht als H2CO3 sondern als hydratisiertes CO2 vorliegen, wirkt die Gesamtlösung als schwache Säure. Gewöhnlich gibt man daher die „Scheinbare Dissoziationskonstante“ an, indem man als undissoziierten Säureanteil im Massenwirkungsgesetz die Gesamtkonzentration von Kohlensäure und Kohlendioxid einsetzt. Dann bekommt KS1 den um drei Zehnerpotenzen kleineren Wert 3.47·10-7 (pKS1 = 6.46). Die zweite Dissoziationskonstante KS2 beträgt 3.98·10-11 (pKS2 = 10.4). "pKS1" = 6.46 pK = 2.70 CO2(g) + H2O CO2 . H2O pKS1 = 3.76 H2CO3 pKS2 = 10.40 + - H + HCO3 + 2- 2 H + CO3 Öffnet man eine Bierflasche, so stellt sich zwischen dem Kohlendioxid in der flüssigen Phase und dem Kohlendioxid der Luft ein Gleichgewicht ein. Dieses wird durch das HenryDaltonsche Gesetz beschrieben. Die Proportionalitäts-Konstante wird auch als HenryKonstante bezeichnet. pCO2 p° K= cCO2 ,aq γ CO2 ,aq ⋅ c° Die Löslichkeit des CO2 in der flüssigen Phase ist also proportional seinem Partialdruck in der Gasphase (Luft). In unserem Versuch wird die Luft durch Anlegen eines Vakuums abgepumpt. Damit veringert sich die Löslichkeit des CO2 im Bier und das Gas entweicht. Die schnelle Entgasung in Anwesenheit von Tensiden führt zur gezeigten Schaumsäule. Anwendung: Der vorgestellte Versuch ist ein Schauversuch. Vom didaktischen Gesichtspunkt bietet er jedoch vielseitige Ansatzpunkte (Lösung von Gasen in Wasser, Chemie des Biers). Schwebender Ballon Versuch: Eine Plexiglasröhre steht auf einer ebenen Unterlage. Auf dem Boden liegen eine Stücke festes Kohlendioxid („Trockeneis“). Durch Sublimation des festen CO2 füllt sich die Röhre allmählich mit CO2-Gas. Ein mit wenig Wasserstoff gefüllter Ballon, der in Luft sinkt, wird von oben in die Röhre geführt. An der Grenzfläche zwischen Luft (oben) und CO2 (unten) wird er in der Schwebe gehalten. Kippt man die Röhre leicht an, so sinkt der Ballon nach unten. Vertiefung: Die Steigfähigkeit eines Ballons ist umso grösser, je grösser sein Volumen und je kleiner sein Gewicht ist. Man kann daher einen Ballon durch Füllen mit Wasserstoff so austarieren, dass er in Luft gerade noch sinkt. Sinkt dieser Ballon auf eine Schicht gasförmigen Kohlendioxids, so erfährt er einen grösseren Auftrieb. Dieses ist auf die grössere Dichte von CO2 gegenüber Luft zurückzuführen. Der Ballon schwebt an der Grenzfläche beider Gase. Kippt man das Rohr an, so fliesst das spezifisch schwerere CO2 sofort aus der Röhre und Luft strömt von oben nach. Damit verlagert sich die Grenzfläche beider Gase nach unten und der Ballon sinkt auf den Boden ab. In analoger Weise können auch Seifenblasen zum Schweben gebracht werden. Anwendung: Es handelt sich um einen historischen Versuch aus der Frühzeit des Luftballons. Zitiert werden soll dazu eine historische Quelle (Wieglebs Magie 1793): „Ein in der Luft frei schwebender Körper, der steigt, wenn man ihn niederdrückt, und wieder sinkt, wenn man ihn hebt.“ Diese belustigende und sehr sonderbar anzusehende Erscheinung beruhet darauf, dass ein kleiner durch eine Figur versteckter Luftball mit entzündbarer Luft (Anm.: H2) gefüllet wird. Hiernächst muss ein grosses Zuckerglas zur Hand seyn. Dieses Zuckerglas wird mit fixer Luft (Anm.: CO2) angefüllet. Sobald dies geschehen, wirft man die kleine aerostatische Maschine, die in der gemeinen Luft zu Boden fallen wird, in das Zuckerglas, worin sie, anstatt zu sinken, in der Mitte desselben schwebend sich erhalten wird. Eben diese Erscheinung äussert sich, wenn man eine solche angefüllte kleine Figur in einen Keller zu der Zeit hineinwirft, wenn frisch gefasster junger Wein brausst, oder Bier in der Gärung steht. Giebt man im letzteren Fall dem versteckten kleinen Luftballon die Figur eines Menschen, so wird diese frey in der Luft schwebende Figur von allen Unkundigen wundervoll angestaunt, aber auch gewiss von andern Personen, welchen die natürliche Ursache bekannt ist, nicht ohne Ergötzen angesehen werden.“ CO2-Diffusion in Seifenblasen Versuch: In einem grossen Glasgefäss liegen einige Stücke Trockeneis. Nach einigen Minuten hat das sublimierte CO2-Gas die Luft weitgehend aus dem Gefäss verdrängt. Man nimmt ein kleines Glasgefäss und taucht es in eine Seifenlösung, so dass sich eine Seifenhaut über den oberen Rand spannt. Nun stellt man das kleine Gefäss in das grosse hinein. Nach kurzer Zeit wölbt sich die Seifenhaut nach oben und wird aufgeblasen. Vertiefung: Das kleine Gefäss enthält Luft. Stellt man es in das grosse hinein, so wird die Luft im Glasinneren von der äusseren Kohlendioxidatmosphäre nur durch eine dünne Seifenhaut getrennt. Das Kohlendioxid versucht, das Konzentrationsgefälle mittels Diffusion auszugleichen. Die CO2-Moleküle durchdringen die Seifenhaut und heben sie kräftig an. Als Diffusion wird allgemein die Bewegung eines Gases infolge Wärmebewegung (Brownsche Molekularbewegung) aus einem Bereich höherer Konzentration in einen Bereich niedrigerer Konzentration bezeichnet. Die Diffusionsgeschwindigkeit eines Gases ist dabei direkt proportional zur Temperatur und indirekt proportional zu seiner Molekülmasse. N2O-P(rot) Versuch: Ein grosser Erlenmeyer-Kolben wurde vor der Demonstration mit Distickstoffmonoxid gefüllt. Ausserhalb des Gefässes entzündet man in einem Metalllöffel roten Phosphor. Dieser brennt an der Luft mit kleiner Flamme. Bringt man den brennenden Phosphor jedoch in die N2O-Atmosphäre, so wird die Verbrennung unter hellem Aufleuchten stark beschleunigt. Dieser Versuch kann mehrfach wiederholt werden. Vertiefung: Distickstoffoxid unterhält die Atmung nicht. Es darf daher bei Narkosen nur bei gleichzeitiger Sauerstoffzufuhr eingeatmet werden. Die Verbrennung leicht entzündlicher Stoffe wird dagegen lebhaft unterhalten. So verbrennen Phosphor, Schwefel, Kohle oder ein glimmender Holzspan darin wie in Sauerstoff. Gemische mit Wasserstoff explodieren beim Entzünden wie Knallgas. Δ 10 N2O 10 N2 + 5 O2 4 P(rot) + 5 O2 P4O10 10 N2O + 4 P P4O10+ 10 N2 Die Verbrennung mit N2O ist im allgemeinen schwieriger einzuleiten als mit Sauerstoff, da Distickstoffoxid bei niedrigen Temperaturen recht beständig ist und erst bei etwa 600°C in die Elemente zerfällt. Die Stabilität ist jedoch kinetisch, nicht thermodynamisch bestimmt. Die Konstitution des linear gebauten Oxids lässt sich durch zwei mesomere Grenzstrukturen wiedergeben. Das Molekül ist isoster mit CO2. N2O N N2 + 0.5 O2 N O ΔH = - 82.1 kJ/mol N N O Anwendung: Distickstoffmonoxid zeigt schwach betäubende Wirkung. Es kommt daher in verflüssigtem Zustand in Stahlflaschen für Narkosezwecke in den Handel. In geringen Mengen eingeatmet, ruft es einen rauschartigen Zustand und eine krampfhafte Lachlust hervor („Lachgas“). Tanzendes Feuer Versuch: In einem Schlenkgefäss werden 10 ml Methan (Erdgas) (Kühlmittel: flüssiger Stickstoff, 77 K) oder 10 ml Butan/Propan (aus Campingbrenner, Kühlmittel: Trockeneis/Isopropanol, -78 °C) kondensiert. Die Gefässe werden bis zur Demonstration im Kühlmittel gelagert. Günstigerweise verschliesst man die Gefässe mit einem Ballon. Dadurch kann ein Verdampfen wegen ungenügender Kühlung sofort bemerkt werden. Anderseits wird auch verhindert, dass in das Methan Luftsauerstoff einkondensiert wird. Zur Demonstration nimmt man die Gefässe aus dem Kühlmittel, erwärmt sie leicht mit der Hand und entzündet die entweichenden Dämpfe. Man giesst den gesamten Inhalt auf eine flache Metallplatte und beobachtet die sogenannten „tanzenden Feuer“. Vertiefung: Bei diesem Versuch handelt es sich um eine einfache Verbrennung von Kohlenwasserstoffen. Das „Tanzen“ der Feuer wird dadurch hervorgerufen, dass die verdampfenden KW kleine Kugeln bilden, die sich fast reibungsfrei auf der glatten Oberfläche bewegen („Leidenfrostsches Phänomen“). 2 CnH2n+2 + (3n + 1) O2 2n CO2 + (2n+2) H2O ΔH°(Verbrennung) kJ/mol Methan CH4 -890.0 Propan C3H8 -2221.6 Butan C4H10 -2878.1 Brennender Wasserstoffschaum Versuch: Gasförmiger Wasserstoff wird in Wasser geleitet, das mit einem Tensid (Geschirrspülmittel oder Shampoo) versetzt wurde. Es kommt zu intensiver Schaumbildung. Der Schaum kann mit der Hand abgenommen und mittels eines brennenden Streicholzes entzündet werden. Vertiefung: Wasserstoff und Luftauerstoff setzen sich in einer stark exothermen Reaktion zu Wasser um (Knallgasreaktion): 2 H2 + O2 2 H2O ΔH° = -572 kJ/mol Bei Zimmertemperatur erfolgt die Umsetzung von Wasserstoff und Sauerstoff mit unmessbar geringer Geschwindigkeit, da der molekulare Wasserstoff infolge seiner hohen Dissoziationsenergie (436 kJ·mol-1) sehr reaktionsträge ist. Ein Gemisch von H2 und O2 im Verhältnis 2:1 kann man jahrelang aufbewahren, ohne dass es zu einer merklichen Umsetzung kommt. Bei Zugabe eines Katalysators (z.B. Pd, Pt) erfolgt jedoch schon bei Zimmertemperatur – oft unter Explosion – quantitative Bildung von Wasser. Bei erhöhter Temperatur erfolgt die Wasserbildung hingegen auch ohne Katalysator. Erhitzt man ein Wasserstoff-Sauerstoff-Gemisch an einer Stelle durch Berühren mit einer Flamme auf 600°C, so kommt die Reaktion in Gang. Durch die hierbei freiwerdende Wärme werden die Nachbarpartien der erhitzten Stelle zur Umsetzung angeregt. In einer Kettenreaktion wird in der Folge das ganze Gemisch umgesetzt. Tenside (latein.: tensio = Spannung ) sind Verbindungen, welche die Grenzflächenspannung herabsetzen. Tenside sind amphiphile (bifunktionelle) Verbindungen mit mindestens einem hydrophoben und einem hydrophilen Molekülteil. Der hydrophobe Rest ist zumeist eine möglichst lineare Kohlenwasserstoff-Kette mit acht bis 22 Kohlenstoff-Atomen. Spezielle Tenside haben auch (Dimethyl-)Siloxan-Ketten oder perfluorierte Kohlenwasserstoff-Ketten als hydrophoben Molekülteil. Der hydrophile Rest ist entweder eine negative oder positive elektrisch geladene (hydratisierbare) oder eine neutrale polare Kopfgruppe. Der Schaum entsteht, wenn das Wasserstoffgas durch die Lösung nach oben strömt. Anwendung: Dieser Versuch ist ein Schauversuch. Die Umsetzung von Wasserstoff mit Sauerstoff erhält jedoch wachsende Bedeutung für die Energieerzeugung („Wasserstoffwirtschaft“). Wasserstoff soll als Brennstoff in naher Zukunft die fossilen Energieträger Kohle, Gas und Öl ergänzen und in fernerer Zukunft vielleicht ersetzen. Dabei spielen sowohl die elektrochemische Nutzung (Brennstoffzelle) als auch die einfache Verbrennung mit Luftsauerstoff (Wasserstoffmotor) eine wachsende Rolle. Flaschengeist Versuch: In einen grossen Rundkolben gibt man 10 g feste Borsäure, sowie 20 ml Methanol und einige Tropfen konzentrierte Schwefelsäure als wasserentziehendes Mittel. Der Kolben wird kräftig geschüttelt damit sich in der Dampfphase ein zündfähiges Gemisch aus Luft und Borsäureester bildet. Nach einigen Minuten entzündet man die Dampfphase und beobachtet im Dunkeln den bizarren Tanz grüner Flammen. Vertiefung: Während des Schüttelns entsteht der leicht flüchtige Borsäuretrimethylester (Kp. 68°C). Dieser bildet mit überschüssigem Methanol und dem Luftsauerstoff ein brennbares Gasgemisch. Nach dem Zünden verbrennt der Borsäureester mit intensiv grüner Flamme. Die konzentrierte Schwefelsäure als hygroskopische Substanz dient dazu, das Gleichgewicht nach rechts zu verschieben. OCH3 H2SO4 B(OH)3 + 3 CH3OH H3CO + 3 H2O B OCH3 Anwendung: Die Grünfärbung, die der Borsäureester der Alkoholflamme erteilt, dient zum qualitativen Nachweis von Bor. Im klassischen analytischen Trennungsgang dient die Reaktion auch zum Abtrennen störender Borate aus der Analysensubstanz. Diese wird dazu solange mit Methanol versetzt und abgebrannt bis die Flamme keine Grünfärbung mehr zeigt. „Pulsierendes Sektglas“ Versuch: 10 g CuCl2·2H2O in 50 ml konz. HCl und 10 ml Wasser lösen. 10 ml dieser Lösung in einem Becherglas mit 10 ml ca. 35%iger H2O2-Lösung mischen und sofort in das Sektglas füllen. Es beginnt eine Gasentwicklung, die sich im Laufe weniger Minuten verstärkt, wobei sich eine Schaumkrone bildet. Es folgen mehrere Schübe intensiver Gasentwicklung, zwischen denen die Gasfreisetzung und damit die Schaumkrone merklich abnehmen. Für einen optimalen Ablauf sollte das Sektglas vor der Durchführung für ca. 12 Stunden mit ca. 30%iger Natronlauge gefüllt und anschließend gründlich mit destilliertem Wasser gewaschen werden. Vertiefung: Die Zersetzung von Wasserstoffperoxid wird von vielen Schwermetallionen katalysiert. Der entstehende Sauerstoff bleibt zunächst gelöst, erst wenn die Lösung übersättigt ist, beginnt die Gasfreisetzung, zunächst an der Glaswand. Nun werden große Mengen Sauerstoffgas freigesetzt, die Lösung schäumt auf. Dabei wird mehr Sauerstoff freigesetzt, als durch den katalytischen Prozess nachgebildet wird. Die Sättigungsgrenze wird dadurch unterschritten und die Gasentwicklung geht merklich zurück. Erst wenn wieder eine Übersättigung erreicht wurde, erfolgt die nächste intensive Gasfreisetzung. (s.a. Katalyse) „Bellender Hund“ Versuch: Die Umsetzung CS2/N2O ("Bellender Hund", H. Roesky, Chemische Kabinettstücke) erfolgt in einem senkrechten 1,5 m langen Rohr. Dieses wurde aus einer Lachgasbombe gefüllt und anschliessend mit 3.5 ml CS2 versetzt. Man öffnet das obere Ende des Rohrs und entzündet das Gasgemisch, welches rasch und unter starkem Rauschen verbrennt. Eine effektive Methode zur Füllung grosser Rohre mit Lachgas wird demonstriert. Vertiefung: Sowohl NO (ΔH° = + 90,3 kJ/mol) als auch N2O (ΔH° = + 82,1 kJ/mol) ("Lachgas") sind endotherme Verbindungen. Die Redoxreaktion mit dem ebenfalls endothermen Schwefelkohlenstoff (ΔH° = + 117,4 kJ/mol) führt zu Stickstoff, Schwefel und den stark exothermen Gasen SO2 (ΔH° = - 297,0 kJ/mol), CO2 (ΔH° = - 393,7 kJ/mol) bzw. CO (ΔH° = - 110,6 kJ/mol). Für die Reaktion ist daher eine erhebliche Energiefreisetzung zu erwarten. Da die gezeigten Reaktionen nicht stöchiometrisch (CS2 wird im Unterschuss eingesetzt) durchgeführt werden, soll auf die Berechnung der genauen Reaktionsenthalpien verzichtet werden. CS2 + 4 NO → 2 N2 + S + SO2 + CO2 CS2 + 3 N2O → 3 N2 + S + SO2 + CO Chemie im Alltag Böllerbüchse Versuch: Von einer Konservendose (Volumen 2 - 4 l , Metall) wird der Deckel entfernt und in den Boden ein Loch gebohrt. Man stellt die Dose mit Bohrloch nach oben auf eine feuerfeste Unterlage. Von unten wird Wasserstoff eingeleitet, wobei das Bohrloch verschlossen wird (z.B. mit einem Bleistift). Nach etwa 1 min wird die Wasserstoffzufuhr entfernt. Man kippt die Büchse leicht an, entfernt den Bleistift und zündet das austretende Wasserstoffgas an. Die zunächst grosse Flamme zieht sich nach einiger Zeit in die Büchse zurück und es kommt zur Explosion. Vertiefung: Wasserstoff und Sauerstoff setzen sich in einer stark exothermen Reaktion zu Wasser um (Knallgasreaktion): 2 H2 + O2 2 H2O ΔH° = -572 kJ/mol Anfangs entweicht der leichte Wasserstoff durch das Bohrloch und verbrennt zu Wasser, während gleichzeitig Luft von unten in die Büchse einströmt. Gegen Ende des Versuchs verringert sich die Strömungsgeschwindigkeit des Wasserstoffs im so weit, dass die Flamme in die Büchse zurückschlägt und das mittlerweile in der Büchse entstandene WasserstoffLuft-Gemisch zur Explosion bringt. Wasserstoff-Luft-Gemische detonieren bei einem Gehalt von 6-67 Vol% Wasserstoff (Explosionsgrenzen). Anwendung: Der Versuch eignet sich besonders zur Demonstration der Explosivität der Gemische brennbarer Gase mit Luft. Er eignet sich ebenfalls dazu, das Zurückschlagen einer Flamme bei zu geringer Strömungsgeschwindigkeit eines Gases zu verdeutlichen. Verpuffung von brennendem Öl Versuch: Man erhitzt in einer Porzellanschale Paraffinöl CnH2n+2 bis zum Flammpunkt, der bei ungefähr 250°C liegt. Das Öl beginnt dabei zu rauchen. Man entzündet die Paraffindämpfe mit dem Brenner. Werden einige Tropfen Wasser in das brennende Öl gespritzt, so schiesst eine Feuersäule aus der Porzellanschale. Die Reaktion kann mehrfach wiederholt werden. Die Idee zur Aufzeichnung dieses Versuches entnahmen wir dem Kapitel „Sicherheit im Chemiesaal“ auf der Homepage der Arbeitsgruppe von Prof. Rüdiger Blume (Fakultät für Chemie der Universität Bielefeld) Vertiefung: Paraffinöl verbrennt mittels Luftsauerstoff zu Kohlendioxid und Wasser. In der Porzellanschale läuft dieser Prozess kontrolliert nur an der Flüssigkeitsoberfläche ab. Tropft man Wasser in das brennende Öl, so verdampft dieses explosionsartig und reisst grosse Mengen des Öl in feiner Verteilung mit sich. Dadurch kommt es zum grossflächigen Ölbrand. 2 CnH2n+2 + (3n + 1) O2 2n CO2 + (2n+2) H2O ΔH°(Verbrennung) kJ/mol Propan C3H8 -2221.6 Butan C4H10 -2878.1 Pentan C5H12 -3512.0 Hexan C6H14 -4166.1 Anwendung: Dieser Versuch dient als „Modellversuch zum Fritteusenbrand“. Er demonstriert, dass heisse brennende Ölbäder sowohl im Labor als auch im Haushalt niemals mit Wasser gelöscht werden dürfen. Seilbahn Versuch Kleine Version: Eine 100 ml-PET-Flasche wird mit reinem Sauerstoff gefüllt. Dazu gibt man etwa 0.2 ml (ca. 3 mmol) CS2 und verschliesst die Flaschenöffnung mit einer Zündkerze. Die Mischung wird mittels eines piezoelektrischen Zündfunkengebers zur Explosion gebracht. Die Flasche explodiert oder fliegt in die Luft. (Schutzscheibe erforderlich!) Grosse Version: Eine 500 ml-Cola-Flasche wird mit Sauerstoff und 0.5 ml Schwefelkohlenstoff gefüllt. Den Bau einer „Seilbahn“ zeigen wir im Hörsaal. Chemische Grundlagen Kohlenstoff bildet mehrere Sulfide, von denen CS2 das wichtigste ist. Schwefelkohlenstoff ist eine farblose, brennbare Flüssigkeit (Kp.: 46°C, Flammpunkt -30°C, Selbstentzündungstemperatur 100°C, Explosionsgrenzen in Luft : 1.25-50%). Da CS2 eine endotherme Verbindung ist (ΔH° = + 117,4 kJ/mol), verläuft die vollständige Verbrennung zu CO2 und SO2 stark exotherm. Auch wenn die Oxidation in der Praxis meist nicht vollständig verläuft - erkennbar an Schwefelausscheidungen an der Wand des Reaktiongefässes - ist die Energiefreisetzung erheblich. CS2 + 3 O2 → CO2 + 2 SO2 ΔH° = –1104,1 kJ/mol Didaktische Hinweise Das Experiment soll die Explosivität von Lösungsmittel / Luftgemischen in Gegenwart einer Zündquelle verdeutlichen. Anwendungen und Alltagsbezug Wie das Beispiel verdeutlicht, können schon geringe Lösungsmittelkonzentrationen (z.B. bei Ethern) zu heftigen Explosionen führen Säure-Base-Reaktionen Rotkohlsaft als Universalindikator Versuch: Acht Reagenzgläser enthalten jeweils 10 ml Pufferlösungen mit abgestuften pH-Werten (pH 2.1 ... 12). Bei Zugabe von 5 ml blauviolettem Rotkohlsaft erhält man ein Farbspektrum von rot (saure Lösung) über blau und grün nach gelb (basische Lösung). Lösungen zur Herstellung der Pufferlösungen: I II III IV V VI HCl KH2PO4 K2HPO4 K3PO4 NaOH Na2CO3 0.1 M 0.1 M 0.1 M 0.1 M 0.1 M 0.1 M Serie: pH 2.1: pH 3.6: pH 5.9: pH 7.0: pH 7.4: pH 9.8: pH 11.0: pH >12: 9.5 ml I + 0.5 ml II 0.5 ml I + 9.5 ml II 9.0 ml II + 1.0 ml III 4.0 ml II + 6.0 ml III 2.0 ml II + 8.0 ml III 5.0 ml II + 5.0 ml IV 10.0 ml VI 10 ml V Vertiefung: In zahlreichen Beerenfrüchten, Blüten und Blumen, so auch im Rotkohl, sind Anthocyanpigmente enthalten. In diesen ist der Farbstoff (Anthocyanidin) glykosidisch mit Glucose oder anderen Monosacchariden verbunden. Der Name leitet sich von den griechischen Worten kyaneos (blau) und anthos (Farbe) ab. Die drei Stammverbindungen der Anthocyanidine sind Pelargonidin, Cyanidin und Delphinidin. Die Farbe von Anthocyanpigmenten ist pH-abhängig. Sie erscheinen rot im sauren und violett im neutralen Bereich. Im basischen Medium variiert die Farbe von dunkelrot über braun bis grün. Im folgenden Schema sind die Säure-Base-Reaktionen am Beispiel des Cyanins dargestellt. OH OH OH Cl Cl HO O HO O OH OH OH OH Cyanidinchlorid Pelargonidinchlorid OH OH Cl HO O OH OH OH Delphinidinchlorid OH O HO O OC6H11O5 OC6H11O5 + HCl + NaOH violett, pH 7 OH O Na OH O Cl HO O HO O OC6H11O5 OC6H11O5 rot, pH 2 OC6H11O5 OC6H11O5 grün, pH 11 Anwendung: Diese Säure-Base-Reaktion der Anthocyane nutzt man gelegentlich in der Küche. So bekommt Rotkohl durch Zusatz von etwas Weinessig eine rote Farbe. Gleichgewicht Kohlensäure / Hydrogencarbonat / Carbonat Versuch: Drei Bechergläser sind mit verdünnter Natronlauge (0.01 mol·l-1) gefüllt. Die drei Indikatoren Phenolphthalein (farblos – rotviolett, pH 8.4....10), Bromthymolblau (gelb – blau, pH 6....7.5) und Kongorot (blau – rot, pH 3.0....5.2) werden zugegeben und liegen in ihrer basischen Form vor. Fügt man zu diesen Lösungen festes Kohlendioxid („Trockeneis“), so werden Phenolphthalein und Bromthymolblau nach kurzer Zeit in die saure Form überführt. Dieses ist am Farbumschlag zu erkennen. Bei Kongorot bleibt der Farbumschlag aus. Nur durch Zugabe einer starken Säure (Salzsäure) kann auch Kongorot in die saure, blaue Form überführt werden. Vertiefung: 1 Liter Wasser löst bei 20°C 0.9 Liter, bei 15°C 1 Liter und bei 0°C 1.7 Liter Kohlendioxid von Atmosphärendruck. Mit steigendem Druck nimmt die Löslichkeit zu. Die entstehende Lösung ist schwach sauer. Das kommt daher, dass sich physikalisch gelöstes Kohlendioxid mit Wasser in geringem Betrag (≈ 0.2%) zu Kohlensäure H2CO3 umsetzt (K = 2·10-3 ; pK = 2.70). Diese (als freie Säure nicht isolierbare) Kohlensäure ist theoretisch eine mittelstarke Säure. Ihre Dissoziationskonstante KS1 beträgt 1.7·10-4 (pKS1 = 3.76). Da aber ≈ 99.8% des gelösten Kohlendioxids nicht als H2CO3 sondern als hydratisiertes CO2 vorliegen, wirkt die Gesamtlösung als schwache Säure. Gewöhnlich gibt man daher die „Scheinbare Dissoziationskonstante“ an, indem man als undissoziierten Säureanteil im Massenwirkungsgesetz die Gesamtkonzentration von Kohlensäure und Kohlendioxid einsetzt. Dann bekommt KS1 den um drei Zehnerpotenzen kleineren Wert 3.47·10-7 (pKS1 = 6.46). Die zweite Dissoziationskonstante KS2 beträgt 3.98·10-11 (pKS2 = 10.4). "pKS1" = 6.46 pK = 2.70 CO2 . H2O CO2(g) + H2O pKS1 = 3.76 H2CO3 pKS2 = 10.40 + - H + HCO3 + 2- 2 H + CO3 Gibt man festes CO2 zu verdünnter Natronlauge, so bildet sich Natriumhydrogencarbonat. Mit überschüssigem, gelösten CO2 („Kohlensäure“) entsteht ein Puffersystem, dessen pH-Wert im Bereich von 6.5 liegt (s. Henderson-Hasselbalch-Gleichung). Die Indikatoren Phenolphthalein und Bromthymolblau liegen bei diesem pH-Wert in der sauren Form vor. Zugabe von Natronlauge ergibt nur kurzzeitig die basische Form, da die Lauge rasch wieder mit Kohlensäure neutralisiert wird. Da die Löslichkeit von CO2 in Wasser begrenzt ist, kann der pH-Wert nicht deutlich unter 6 absinken. Das bedeutet, dass Kongorot mit einem Umschlagpunkt bei pH 4 in dieser Lösung nicht in die saure Form überführt werden kann. Erst bei Zusatz von Salzsäure beobachtet man die blaue, saure Form von Kongorot. pH = pK S + log [A ] = 6.46 + log [HCO ] − [HA] − 3 [H 2 CO3 ] Anwendung: Puffer sind Lösungen schwacher Säuren oder Basen und ihrer Salze, die in der Lage sind, in einem gewissen Umfang H+- oder OH −- Ionen aufzunehmen, ohne den pH-Wert wesentlich zu verändern. Sie werden in Chemie und Biochemie bei Reaktionen zur Stabilisierung des pH-Werts eingesetzt. Eine besonders wichtige Anwendung eines Puffers in der Biochemie ist die Pufferung des menschlichen Blutes auf pH 7.38. Hierbei wirken mehrere Puffersysteme zusammen. Neben dem hier gezeigten Carbonat-Puffer spielen dabei Phosphat- und Eiweiss-Puffer eine wichtige Rolle. H2CO3, 0.01 mol/l pKa1: 6.3 pKa2: 10.3 log [OH- ] 0 -1 log [CO32- ] -2 -3 -4 -5 log [HCO3- ] -6 log [Species] -7 -8 -9 -10 -11 log [H2CO3] -12 -13 -14 0 1 2 3 4 5 6 7 pH 8 9 10 11 12 13 14 log [H3O+] Indikator-Mix Versuch: Auf dem Overhead-Projektor wird eine Kristallisierschale platziert, die eine gelbe, wässrige Lösung zweier Säure-Base-Indikatoren enthält und auf pH 5 eingestellt ist. Von der Seite wird vorsichtig etwas Ammoniakgas über die Lösung geblasen. In der Lösung entstehen blaue, fraktale Strukturen. Bläst man anschliessend Chlorwasserstoffgas über die Lösung, so färbt sich die Lösung wieder gelb. Fügt man ein Plätzchen festes KOH zu, so tritt erneut Blaufärbung ein. In unmittelbarer Nähe der Kalilauge werden ausserdem rote Farbspuren sichtbar. Setzt man anschliessend konz. Salzsäure zu so erfolgt wiederum Farbumschlag nach gelb. Lösung A: 450 ml Wasser + 50 ml Ethanol Lösung B: 0.2 g Bromthymolblau in 25 ml Ethanol lösen, mit Wasser auf 100 ml auffüllen, 20 Tropfen NaOH 0.1 M zusetzen (Lösung muss gelb-orange bleiben) Lösung C: 0.8 g Phenolphthalein in 100 ml Ethanol lösen 50 ml A in Kristallisierschale (Durchmesser 14 cm) + 2 Pipetten (≈ 3 ml) B + 2 Pipetten C Vertiefung: Die wässrige Lösung enthält die Indikatoren Bromthymolblau (gelb – blau, pH 6.0....7.5) und Phenolphthalein (farblos – rotviolett). Bei pH 5 ist die Lösung folglich gelb. Ammoniakgas ist in Wasser sehr gut löslich. Bläst man NH3 (g) über das Wasser, so löst sich das Gas und es entsteht eine basische Lösung. Bromthymolblau schlägt in seine basische, blaue Form um. Bläst man anschliessend Chlorwasserstoffgas über die Lösung, so kommt es zur Neutralisation und man beobachtet Gelbfärbung. Das entstehende Ammoniumchlorid ist ein saures Salz. NH3(g) + H2O NH4+(aq) + OH - (aq) + HCl(g) NH4+(aq) + OH - (aq) NH4+(aq) + Cl - (aq) + H2O Fügt man dieser Lösung festes KOH zu, so entsteht wieder eine basische Lösung (Blaufärbung). Da bei Auflösung der starken Base Kaliumhydroxid aber ein höherer pH-Wert erreicht wird als mit Ammoniak, beobachtet man in unmittelbarer Nähe des KOH-Plätzchens auch rote Farbspuren. Diese werden durch den Umschlag des zweiten Indikators Phenolphthalein in seine rotviolette, basische Form hervorgerufen. Letztlich kann durch Neutralisation mit Salzsäure (konz.) die gelbe Ausgangsfarbe zurückerhalten werden. Zum Begriff „Fraktale Strukturen“ s. Anwendung. Anwendung: Bei den hier gezeigten Neutralisationsexperimenten handelt es sich um Schauversuche. Fraktale: Von B. B. Mandelbrot geprägter Begriff aus der Mathematik. Fraktale sind geometrische Strukturen, in denen sich das gleiche Motiv in immer kleinerem Massstab wiederholt; man redet von "Selbstähnlichkeit". Viele natürliche Strukturen wie Wolken, Küstenlinien oder Blutgefässsysteme haben offensichtlich fraktalen Aufbau. In der Chemie findet das Konzept der Fraktale z.B. Anwendung bei Wachstumsprozessen wie dem Kristallwachstum oder in der heterogenen Katalyse. Zwischen Fraktalen und Chaos besteht ein enger Zusammenhang.