V23A Eleektrische Leitfähigkeit - Medizinische Hochschule Hannover
Werbung

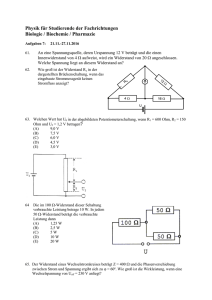
V23A Elektrische Leitfähigkeit 1 Einführung 1.1 Vorbereitung Die theoretischen Grundlagen aus V3 "Wheatstonesche Brücke" und die Kapitel 3.2 "Die sinusförmige Wechselspannung" und 3.3 "Effektivwerte sinusförmiger Wechselspannungen und Wechselströme" im Abschnitt E des Skriptes "Praktikum der Physik" werden als Vorbereitung zu diesem Versuch vorausgesetzt. 1.2 Elektrische Leitungsmechanismen Materie ist zum Transport elektrischer Ladungen unterschiedlich geeignet und läßt sich grob in elektrische Leiter und Isolatoren einteilen. Für diesen Versuch sind Elektronen und Ionen die wichtigsten Ladungsträger. Elektronen besitzen die negative Elementarladung e = 1,6 * 10-19 Coulomb und eine Masse von me = 9,1 * 10-31 kg. Ein Elektronentransport findet in metallischen Leitern, in Kohlenstoff und in sog. Halbleitern statt. Metalle bestehen aus einem Gitter von positiv geladenen Atomrümpfen mit frei beweglichen Elektronen. Erst mit Anlegen einer äußeren elektrischen Spannung kommt es zu einem Transport dieser sog. Leitungselektronen, sprich: es fließt ein elektrischer Strom I = Q/t . Der mit dem Elektronentransport verbundene Massetransport ist wegen der geringen Masse des Elektrons vernachlässigbar. Anders sieht das bei den Ionen aus, deren kleinstes und leichtestes das Wasserstoff-Ion mit mH+ = 1,6 * 10-27 kg ist. Daneben können Ionen einfach oder mehrfach, positiv oder negativ geladen sein. Bei positiv geladenen Ionen spricht man von Kationen, da sie sich zur negativ geladenen Kathode bewegen. Negativ geladene Ionen heißen dann Anionen. Flüssigkeiten, die durch Dissoziation entstandene Ionen enthalten, heißen Elektrolyte und eignen sich so zum Ladungstransport zwischen zwei Elektroden bei angelegter elektrischer Spannung. Neben einem Ladungstransport erfolgt durch das Ion auch ein Massetransport, der nicht mehr vernachlässigt werden kann. Bei der sog. Elektrolyse z.B. mit Elektroden aus Kupfer und einer Kupfersulfatlösung (CuSO4) als Elektrolyt scheidet sich Kupfer an der Kathode ab, während an der Anode Kupfer ständig in Lösung geht. In der Medizin macht man sich dieses mir sog. Iontophorese zu Nutze, mit der man dissoziierende Medikamente gezielt an bestimmte Orte im Körper transportieren kann. Den Zusammenhang zwischen abgeschiedener Menge und der transportierten Ladung beschreiben die Faradayschen Gesetze. Fließt ein Strom durch einen Elektrolyten, so kommt es nicht nur zur Ionenwanderung, sondern auch zu chemischen Veränderungen an der Grenzfläche zwischen Elektrode und Elektrolyt. Die dort entstandene galvanische Spannung wirkt der Elektrolysespannung entgegen und wird Polarisationsspannung genannt. V 23A.1 Will man bei elektrischen Messungen an einem Elektrolyten, z.B. einer Widerstandsmessung, das Auftreten von Elektrolyse und Polarisationsspannung verhindern, so kann man das mit Wechselstrom erreichen. 1.3 Leitwert und Widerstand Ein einfacher elektrischer Stromkreis besteht aus einer Spannungsquelle (z.B. einer Batterie) mit einer Spannung U [V], sprich: "Potentialdifferenz" zwischen zwei Polen und einem Transportweg, sprich: "elektrischer Leiter", der es ermöglicht, daß Ladungen mit dem Strom I [A] vom hohen Potential zum niederen fließen können. Der Strom im Leiter ist von der vorhandenen Spannung abhängig ist und oft findet sich eine proportionale Beziehung. I ~ U. (1.1) Außer der Spannung beeinflussen natürlich auch die Leitereigenschaften den Stromfluß. Vergrößert man bei unveränderter Spannung den Leiterquerschnitt A [m²], so können proportional zur Fläche mehr Ladungen pro Zeit fließen. Vergrößert sich dagegen der Leitungsweg l [m], so dauert es länger bis die Ladungen den Leiter passiert haben, sprich: der Strom wird geringer. Außer der Geometrie beeinflußt noch das Leitermaterial mit den spezifischen Eigenschaften der Ladungsträger den Stromfluß. Diese Größe wird als Leitfähigkeit [-1 m-1] bezeichnet. Hieraus ergibt sich für den Strom folgende Beziehung, die auch Ohmsches Gesetz genannt wird : A U l I (1.2) Die Größe G [-1] wird als Leitwert bezeichnet, dann vereinfacht sich das Ohmsche Gesetz zu: A l (1.3) I G U (1.4) G Den Quotienten aus U [V] und I [A] bezeichnet man als den elektrischen Widerstand R []. Ist dieser Quotient konstant, dann spricht man bei R von einem sog. Ohmschen Widerstand: Damit gilt auch: R U I (1.5) R 1 G (1.6) Ebenso wie für den Leitwert kann man auch für den Widerstand eine materialspezifische Größe angeben, den spez. Widerstand [m] : 1 V 23A.2 (1.7) 1.4 Bestimmung eines elektrischen Widerstands Man kann im Prinzip den Wert eines unbekannten Widerstands durch eine Strom- und Spannungsmessung nach Abb.1.1. und Gl.(1.5) bestimmen. Dabei tritt jedoch ein prinzipieller Fehler auf: Der gemessene Strom I ist dabei die Summe aus dem Strom durch den Widerstand R und dem Strom durch das Voltmeter mit seinem Innenwiderstand ri. Damit der Fehlerstrom durch das Voltmeter vernachlässigbar klein wird, wählt man hier Meßgeräte mit sehr hohem Innenwiderstand bzw. Eingangswiderstand. ~ Abb.1.1. Gleichstromkreis mit Schaltsymbolen. Die Zusammenhänge in Kapitel 1.3. lassen sich natürlich auch auf Wechselstromkreise anwenden. Als Spannungsquelle dient dann ein Wechselspannungsgenerator mit geeigneter Frequenz. Die Meßgeräte müssen dann für Wechselstrommessungen geeignet und geeicht sein. Zur Widerstandsbestimmung werden dann in Gl.(1.5) die Effektivwerte von Strom und Spannung verwendet. R Ueff Ieff V 23A.3 (1.8) V 23A.4 2 Der Versuch 2.1 Durchführung Die Meßobjekte sind auf einer Experimentierplatte angeordnet. Zur Strom- und Spannungsmessung stehen zwei Digitalmultimeter mit einem Innenwiderstand von 10 M zur Verfügung. Für die Spannungsmessung ist der Wechselspannungsmeßbereich ( 20 V ) und für die Strommessung der Wechselstrommeßbereich ( 200 mA ) zu wählen. Als Spannungsquelle dient ein Funktionsgenerator mit nachgeschaltetem Leistungsverstärker. Der Generator wird auf Sinusspannug und die Frequenz von 1 kHz eingestellt. Mit den vorhandenen Laborkabeln ist die Meßschaltung Abb. 1.1. aufzubauen. Die Eingangsbuchse "COM" der Multimeter ist in der Meßschaltung mit "-" bezeichnet, der Eingang "V" wird bei der Spannungsmessung mit "+" verbunden, bei der Strommessung ist es der Eingang "A". Die schwarze Ausgangsbuchse des Leistungsverstärkers stellt den "-" Pol und die rote Buchse den "+" Pol dar. Als Verbraucher ist je nach Meßaufgabe der entsprechende Widerstand in der Schaltung zu verwenden. Bevor Sie mit einer neuen Meßreihe beginnen, überprüfen Sie bitte Ihre Meßschaltung bei ausgeschaltetem Generator. 2.2 Messung an einem OHMschen Widerstand Der Ohmsche Widerstand befindet sich in einem schwarzen Kästchen auf der Experimentierplatte. Nachdem Sie ihn in die Schaltung eingesetzt und sie überprüft haben, werden die Meßgeräte und der Generator eingeschaltet. Mit Hilfe des Amplitudenreglers stellen Sie den ersten Spannungswert gemäß Tabelle 2.1. ein, lesen den zugehörigen Stromwert am Meßgerät ab und tragen diesen in die Tabelle ein. Entsprechend fahren Sie in der Tabelle fort. Nehmen Sie 7 Wertepaare zwischen 0,5V und 2,0V auf. Anschließend sind die Widerstandswerte zu berechnen. Ueff [V] 0,5 2,0 Ieff [mA] Rx [] Tabelle 2.1. : Meßreihe des Ohmschen Widerstandes Auswertung: a) Geben Sie den mittleren Widerstand und seinen prozentualen Fehler an. Abschließend ist das Ergebnis nach den Rundungsregeln darzustellen. b) Prüfen Sie, ob Ihr gemessener Widerstandswert Rx innerhalb der 1%-Grenze des vorhandenen Widerstandes liegt. Der Wert steht auf dem Widerstand und ist als Rsoll ins Protokoll zu übernehmen. V 23A.5 V 23A.6 2.3 Messung an einer Glühlampe Die Glühlampe befindet sich auf einem schwarzen Kästchen auf der Experimentierplatte. Nachdem Sie sie in die Schaltung eingebunden und sie überprüft haben, werden die Meßgeräte und der Generator eingeschaltet. Mit Hilfe des Amplitutenreglers stellen Sie den ersten Spannungswert gemäß Tabelle 2.2. ein, lesen den zugehörigen Stromwert am Meßgerät ab und tragen diesen in die Tabelle ein. Nehmen Sie 7 Wertepaare zwischen 0,5V und 2,0V auf. Entsprechend fahren Sie in der Tabelle fort. Anschließend sind die Widerstandswerte zu berechnen. Ueff [V] 0,5 2,0 Ieff [mA] RGlüh [] Tabelle 2.2. : Meßreihe der Glühlampe Auswertung: a) Tragen Sie den Widerstand RGlüh der Glühlampe als Funktion der anliegenden Spannung UGlüh in einem Diagramm (Millimeterpapier verwenden) auf. Als Achsenmaßstab wählen Sie bei der Spannung 0,5 V pro 4 cm und beim Widerstand 2 pro 1 cm. Zeichnen Sie in das Diagramm mit Hilfe eines Kurvenlineals eine glatte Kurve ein, die möglichst gut dem Verlauf der Meßpunkte folgt . b) Ermitteln Sie aus dem Diagramm den Kaltwiderstand der Glühlampe, indem Sie den Kurvenverlauf bis UGlüh -> 0 Volt extrapolieren. c) Zeigen Sie, daß der Widerstand einer Glühlampe im Vergleich zum Ohmschen Widerstand für den gleichen Spannungsbereich kein ohmsches Verhalten zeigt. d) Auf der verwendeten Glühlampe sind 3,8 V und 0,07 A als Kennwerte aufgeprägt. Welche elektrische Leistung nimmt die Glühlampe in ihrem Arbeitspunkt auf ? Welche Leistung verbraucht sie im Einschaltmoment, wenn ihr Kaltwiderstand 7,5 Ohm und die Schaltspannung 3,8 V beträgt ? V 23A.7 2.4 Messung an einem Elektrolyten Der Elektrolyt wird je nach Aufgabenstellung bis zu einer Höhe h [cm] in den elektrolytischen Trog (Abb. 2.1.) eingefüllt. Der Trog befindet sich auf der Experimentierplatte und besitz die Innenmaße: lmax = 14,3 cm, b = 5,0 cm und hmax = 9,0 cm . An beiden Stirnflächen befinden sich parallel zueinander zwei Niroblech-Elektroden im Abstand l [cm] . Zwischen den Elektroden A und B liegt die Spannung U und damit ein elektrisches Kraftfeld. Entlang dieses Kraftfeldes kann ein elektrischer Strom fließen, der durch den elektrischen Widerstand des Elektrolyten bestimmt wird. V 23A.8 Spannung U Elektrode B Br ei te b Höhe h Elektrode A Länge l Abb. 2.1.: Elektrolytischer Trog ( Die Längenmaße sind Innenmaße mit: lmax = 14,3 cm, b = 5,0 cm und hmax = 9,0 cm ) 2.4.1 Messung mit 0,1 M/l NaCl Füllen Sie aus dem Vorratsgefäß mit der 100 mM Lösung mit Hilfe eines Becherglases ca. 530 ml in den elektrolytischen Trog. Messen Sie jetzt zuerst die Temperatur der Lösung und notieren Sie sie im Protokollheft. Ebenso notieren Sie den Flüssigkeitsstand h [cm] und den Elektrodenabstand l [cm] im Heft. Nachdem Sie den elektrolytischen Trog als Widerstand über die beiden Elektroden A und B in die Meßschaltung eingefügt und Sie diese überprüft haben, werden die Meßgeräte und der Generator eingeschaltet. Mit Hilfe des Amplitudenreglers am Generator stellen Sie den ersten Spannungswert gemäß Tabelle 2.1. ein, lesen den zugehörigen Stromwert am Meßgerät ab und tragen diesen in die Tabelle ein. Nehmen Sie 7 Wertepaare zwischen 0,5V und 2,0V auf . Entsprechend fahren Sie in der Tabelle fort. Nach Durchführung der Meßreihe ist der Inhalt des Troges mit Hilfe des Becherglases wieder zurück ins Vorratsgefäß zu gießen und das Gefäß zu verschließen. Ueff [V] 0,5 2,0 Ieff [mA] R100 mM [] Tabelle 2.1. : Meßreihe des Elektrolyten NaCl mit c = 100 mM/l 2.4.2 Auswertung a) Geben Sie den mittleren Widerstand und seinen prozentualen Fehler für die gemessene Konzentration an. Das Ergebnis ist nach den Rundungsregeln darzustellen. b) Aus dem mittleren Widerstand ist für die Konzentration c [Mol/l] der spezifische Widerstand [m] und die spez. Leitfähigkeit [-1m-1] des Elektrolyten zu bestimmen. Bitte die Einheiten beachten und in die Rechnung mit einbeziehen ! V 23A.9 V 23A.10 3 Übungsfragen 1. In welchen Einheiten werden die elektrischen Größen Strom, Spannung und Widerstand gemessen? 2. Unter welcher Bedingung erfüllt ein elektrischer Leiter das OHMsche Gesetz? 3. Gegeben sei folgender Stromkreis aus drei Widerständen R1 , R2 und R3 : a) Welcher Gesamtwiderstand ist in diesem Stromkreis wirksam? b) Welchen Wert haben die Teilspannungen U1 bzw. U2 (gegeben seien die Größen R1, R2, R3 und U0)? c) Welcher Zusammenhang besteht zur im Versuch verwendeten Schaltung (Abb. 1.1)? 4. Wie groß ist der elektrische Widerstand eines Drahtes der Länge l und des Querschnitts A; wie heißt die dabei auftretende Stoffkonstante? 5. Worin besteht der Vorteil der Brückenschaltung gegenüber einfachen Bestimmungen von Rx durch eine Strom-Spannungsmessung? 6. Welcher chemische Vorgang findet bei der Elektrolyse an den Elektroden statt? 7. Was unterscheidet den Stromfluß bei einem Elektrolyten von dem bei Metallen? 8. Wovon hängt die Geschwindigkeit ab, mit der sich Ionen bewegen? Kalkulieren sie die physiologischen Gleichgewichtspotentiale für Na+, K+, Ca+ und Cl-. V 23A.11 V 23A.12 V23B Membranpotential 1 Einführung 1.1 Physiologischer Bezug Eine Vielzahl physiologischer Prozesse beruhen auf elektrischen Prozessen an Zellmembranen, die die mit Elektrolyten gefüllten intra- und extrazellulären Räume trennen. Als Elektrolyt steht ein Gemisch aus wässerigen Lösungen hauptsächlich von NaCl, KCl und CaCl2 zur Verfügung, die beiderseits der Membran in unterschiedlichen Konzentrationen vorliegen. Die Zellmembran selbst besteht aus einer Lipiddoppelschicht, die einen perfekten elektrischen Isolator darstellt. In diese sind spezialisierte Membranproteine, sog. Ionenkanäle, eingelagert. Die Ionenkanäle sind in der Lage, den Durchtritt von Kationen und Anionen durch die Membran zu steuern und damit ein Diffusionspotential bzw. Membranpotential aufzubauen. 1.2 Physikalische Grundlagen 1 2 Membran jD C1 jE C2 x Abb. 1.1 Doppelkammer mit kationenselektiver Membran zur Trennung unterschiedlicher Elektrolytkonzentrationen. In Abb. 1.1 ist eine Doppelkammer mit den Teilkammern 1 & 2 dargestellt. Befüllt man die Teilkammer 1 mit der Konzentration C1 und die Teilkammer 2 mit der Konzentration C2 gleichzeitig mit z.B. einer NaCl-Lösung, so liegt mit C1 > C2 zwischen beiden Kammern der Konzentrationsgradient dc/dx vor. Dieser Gradient (chemische Triebkraft) bewirkt einen Teilchenstrom durch eine permeable Membran hin zur geringeren Konzentration. Hieraus ergibt sich nach dc ( 1.1 ) jD D dx die sog. Teilchenstromdichte jD [m-2 s-1] mit der Diffusionskonstanten D. V 23B.1 Ist die Membran zwischen den Teilkammern z.B. nur kationenselektiv, so diffundieren nur die Na+-Ionen entlang des Konzentrationsgradienten durch die Membran. Sie hinterlassen in der - höher konzentrierten NaCl-Lösung jeweils ein Cl -Ion. Da die Ionen die Ladung Q z e0 besitzen, läßt diese Ladungstrennung ein ansteigendes elektrisches Feld E [V m-1] entstehen, das der chemischen Triebkraft entgegen wirkt. Es bedeuten e0 1,6 1019 Coulomb 1C 1As 6, 24 10 18 e0 die Elementarladung und z die Wertigkeit des Ions. Für die elektrisch erzeugte Teilchenstromdichte jE [m-2 s-1] gilt dann jE c( x) E ; ( 1.2 ) die das Ohmsche Gesetz für wässerige Lösungen darstellt. Die Größe [m V s ] ist die Ionenbeweglichkeit und c(x) [mol m-3] die Konzentration c in Abhängigkeit vom Ort x. 2 -1 -1 Durch das zunehmende elektrische Feld kommt es nach kurzer Zeit zum Stillstand der Ionendiffusion, d.h. die chemische und die elektrische Triebkraft stehen im Gleichgewicht. Also kann man auch die Teilchenstromdichten jD und jE gleichsetzen und erhält mit E dU dx den Zusammenhang D dc dU . c( x) dx dx ( 1.3 ) Durch einfaches Umstellen und Integrieren folgt daraus U2 dU U1 D c2 c1 dc . c ( 1.4 ) Da und D beide die Ionendiffusion durch die gleichen Kanäle beschreiben, müssen sie in einem bestimmten Verhältnis stehen. Dieses ist durch die Einsteinbeziehung kT D , ( 1.5 ) z e0 mit der Temperatur T [K] und der Ionenwertigkeit z ( zNa 1 , zCl 1 ) gegeben. Mit der Lösung der Integralgleichung (Gl. 1.4) erhält man die Nernstsche Formel für das Diffusionspotential U 21 kT c1 ln , z e0 c2 ( 1.6 ) wobei k 1,38 . 10-23 J K die Boltzmann-Konstante darstellt. Will man aus gemessenen Membranpotentialen die Konzentrationen von Lösungen ermitteln, so muß man Gl. 1.6 umformen und erhält dann C2 C1 e z e U 21 0 k T V 23B.2 . ( 1.7 ) 2 Der Versuch 2.1 Versuchsaufbau Multimeter mV - + Elektroden 1 2 Aufbewahrungsgefäß Meßkammer 1 & 2 Abb. 2.1 Versuchsaufbau zur Messung von Membranpotentialen Die Versuchsanordnung ist wie in Abb.2.1 auf den Labortischen aufgebaut und sollte nicht verändert werden. Die beiden Elektroden befinden sich anfangs in einer Stativhalterung über dm Aufbewahrungsgefäß, daß mit einer 0,1 M KCl-Lösung gefüllt ist. Die Elektroden sind elektrisch so mit dem Multimeter verbunden, wie es in Abb.2.1 gezeigt ist. Die Meßkammern befinden sich unter einer weiteren Halterung, in die die Elektroden zur Messung des Membranpotentials gehängt werden müssen. V 23B.3 2.2 Durchführung 1. Messung: 1.) Die Meßkammer wird auf die Stirnfläche der Kammer 1 gestellt und durch Lösen von vier Rändelschrauben in zwei Teile zerlegt. Dann wird ein vorgeschnittenes Membranstück aus dem Reservoir (Farbmarkierung im Protokoll notieren !) entnommen, zwischen die Flansche der beiden Kammerhälften gelegt und anschließend wieder verschraubt. Die beiden Kammerhälften sind mit "1" und "2" gekennzeichnet. In das Becherglas "1" werden 80 ml einer 0,1 molaren NaCl-Lösung gefüllt, ihre Temperatur gemessen und im Protokollheft (Tabelle 2.1.) als A [K] notiert. In das Becherglas "2" werden aus der Lösungsflasche "E" wiederum 80 ml NaCl-Lösung abgefüllt. Anschließend werden die Kammern mit Hilfe eines Trichters und der entsprechenden Nummernzuordnung mit den Lösungen befüllt. Die Meßkammer wird dann so unter die Elektrodenhalterung geschoben, daß die Elektroden leichtgängig in die Kammern eingeführt werden können. Die Silberchloridelektroden müssen zu diesem Zweck aus dem Aufbewahrungsgefäß entnommen und vorher mit Zellstoff abgeputzt werden. 2.) Zur Messung wird die Elektrode in Kammer "1" mit dem "-" Pol (COM) und diejenige aus Kammer "2" mit dem "+" Pol (V/) des Multimeters verbunden. Der Rotationswahlschalter des Meßgerätes wird auf 200 mV= eingestellt. Nun wird das Meßgerät für ca. 3 Sekunden eingeschaltet, der Spannungswert Umess dabei abgelesen und in Tabelle 2.1. notiert. Danach werden die Elektroden sofort wieder aus den Kammern entnommen, abgeputzt und in das Aufbewahrungsgefäß zurückgestellt. Dort kann ein sog. Asymmetriepotential Uass auftreten, das ebenfalls durch kurzes Einschalten des Meßgerätes (ca. 3 Sekunden) zu ermitteln und zu notieren ist. Das Membranpotential U21 selbst erhält man dann durch Subtraktion des Asymmetriepotentials vom Spannungswert zwischen den Kammern. Dieser Meßvorgang wird im Abstand von 1/2 Minuten zweimal wiederholt und die Spannungen notiert. 3) Zum Abschluß dieser Meßreihe wird die Kammer "1" mit einem Stopfen verschlossen und die Kammer "2" entleert. Dann wird die gesamte Meßkammer senkrecht auf die Stirnfläche von Kammer "1" gestellt und nach Lösen der vier Rändelschrauben die Teilkammer "2" abgehoben und mit Zellstoff ausgetrocknet. Abschließend ist die Teilkammer wieder zu montieren, wobei die Meßkammer in senkrechter Position verbleibt. Nach der letzten Messung der Meßreihe ist auch die Kammer 1 zu entleeren und die Membran zurück ins Aufbewahrungsgefäß zu legen. 2. Messung: 1.) In das Becherglas "2" werden aus der Lösungsflasche "D" 80 ml NaCl-Lösung abgefüllt, die Temperatur gemessen und im Protokollheft als A [K] notiert. Anschließend wird die aufrecht stehende Meßkammer in die Waagerechte gebracht und die Kammer "2" über einen Trichter mit der Lösung aus Becherglas "2" befüllt. Der Korken aus Kammer "1" wird entfernt. Die Meßkammer wird dann wieder so unter die Elektrodenhalterung geschoben, daß die Elektroden leichtgängig in die Kammern eingeführt werden können. V 23B.4 Die Silberchloridelektroden müssen zu diesem Zweck wieder aus dem Aufbewahrungsgefäß entnommen und mit Zellstoff abgeputzt werden. 2.) Der weitere Ablauf der 2. Messung erfolgt nun wie unter 2.) und 3.) bei der ersten Messung beschrieben. 3. Messung: In das Becherglas "2" werden aus der Lösungsflasche "C" 80 ml NaCl-Lösung abgefüllt und wie bei der 2. Messung fortgefahren. 4. Messung: In das Becherglas "2" werden aus der Lösungsflasche "B" 80 ml NaCl-Lösung abgefüllt und wie bei der 2. Messung fortgefahren. Konzentration TA [K] Messung Umess[mV] Uass[mV] U21[mV] mol C2 l mol C2 l 1 E 2 3 1 D 2 3 1 C 2 3 1 B 2 3 Tabelle 2.1: Meßreihe von Membranpotentialen bei verschiedenen Konzentrationen und einer mol Referenzkonzentration von C1 0,1 . l V 23B.5 2.3 Auswertung Die Membran ist z.B. kationenselektiv und undurchlässig für Anionen. Damit ist für die entstehende Spannung über der Membran die unterschiedliche Konzentration der Kationen in der wässerigen Lösung maßgebend, die sich im Konzentrationsgefälle zum Ort der geringeren Konzentration hinbewegen. Sie lassen dabei die Anionen auf der Gegenseite zurück. Dadurch baut sich auf der einen Seite eine negative und auf der anderen eine positive Ladung aufbaut, die als Spannung über der Membran gemessen werden kann und als Membranpotential bezeichnet wird. Es kommt jedoch nicht zu einem Konzentrationsausgleich, da die durch den Kationenstrom anwachsende elektrische Feldstärke zu einem Gleichgewicht mit der Wirkung des Diffusionsdruckes führt. Das so entstandene Membranpotential ist somit abhängig vom Konzentrationsunterschied der beteiligten Kationen. Bei Verwendung einer anionenselektiven Membran kehren sich die oben beschrieben Verhältnisse um. Das Membranpotential hängt dann vom Konzentrationsunterschied der beteiligten Anionen ab. 1.) Finden Sie heraus, ob bei Ihrer Meßreihe eine kationen- oder eine anionenselektive Membran verwandt wurde ! ( C1 > C2 ) 2.) Ermitteln Sie aus den gemessenen Membranspannungen die Konzentrationen C2 der Lösungen, die Sie aus den Gefäßen "B" bis "E" entnommen haben und tragen Sie sie in Tabelle 2.1. ein. 3 Simulierte Aktionspotentiale und Spannungsklemmmessungen am Tintenfischriesenaxon Das Programm Nerve finden Sie im Internet unter: http://nerve.bsd.uchicago.edu/nerve1.htm Es erlaubt die Simulation von Aktionspotentialen (APs) und Stromregistrierungen für eine Vielzahl von Ionenzusammensetzungen. Ein AP wird durch Klicken auf "Membrane AP" gestartet. Die ionischen Bedingungen werden durch Klicken auf "Concentrations" geändert. Im Plot des simulierten AP kann man mittels Mausklicks und Bewegung des Kursors Zeitund Spannungswert ablesen. 3.1 Aktionspotentiale Simulieren Sie ein Aktionspotential unter den vorgegebenen Bedingungen. Verändern Sie dann die extrazellulären [K+] and [Na+] in einem weiten Bereich (mindestens 6 verschiedene Werte). Was passiert, wenn TTX oder Pronase dazu gegeben wird? TTX blockiert den Natriumkanal, während Pronase eine Proteasegemisch ist, das einen Abschnitt des Natriumkanals abspaltet und so die Inaktivierung aufhebt. Beschreiben und zeichnen Sie die beobachteten Veränderungen! Fügen Sie die numerischen Werte in den Tabellen ein! Erklären Sie die Ergebnisse! V 23B.6 extrazelluläre K+ Konzentration [mM] extrazelluläre Na+ Konzentration [mM] Ruhemembranpotential [mV] Zeit des Höhe des Zeit des APAPAPMaximums Maximums Minimums [ms] [mV] [ms] Ruhemembranpotential [mV] Zeit des Höhe des Zeit des APAPAPMaximums Maximums Minimums [ms] [mV] [ms] 240 10 440 640 extrazelluläre Na+ Konzentration [mM] extrazelluläre K+ Konzentration [mM] 1 440 25 Tabelle 3.1: Parameter des simulierten Tintenfischaktionspotentials bei unterschiedlichen ionischen Bedingungen TTX Konzentration [nM] Ruhemembranpotential [mV] Zeit des APMaximums [ms] Höhe des APMaximums [mV] Zeit des APMinimums [ms] 2 3 4 5 Tabelle 3.2: Parameter des simulierten Tintenfischaktionspotentials bei den ausgangsionischen Bedingungen und unterschiedlicher TTX-Konzentration. V 23B.7 Pronase Konzentration [µg/ml] Ruhemembranpotential [mV] Zeit des APMaximums [ms] Höhe des APMaximums [mV] Zeit des APMinimums [ms] 0 100 300 600 Tabelle 3.3: Parameter des simulierten Tintenfischaktionspotentials bei den ausgangsionischen Bedingungen und unterschiedlicher Pronasekonzentration. 3.2 Stromregistrierungen bei 0 mV Simulieren Sie die Stromantwort eines Tintenfischriesenaxons auf einen Spannungssprung auf 0 mV im Spannungsklemm-Modus. Verändern Sie jetzt die [K+] and [Na+] sowie [TTX] und [Pronase] auf die im vorangegangenen Abschnitt benutzten Werte. Beschreiben und erklären Sie Ihre Beobachtungen. Die Fragestellungen zur Simulation sollten möglichst schon zu Hause vor Praktikumsbeginn beantwortet werden. Ausreichende Internetzugänge sind in der Bibliothek zu finden. 3 Übungsfragen 1. Welche elektrische Eigenschaften charakterisieren die Zellmembran? Welche chemische Zusammensetzung haben Blutplasma und Zytoplasma? 2. Definieren Sie das Ohm'sche und das Fick'sche Gesetz für wässrige Lösungen. 3. Wie wird aus den obengenannten Gesetze die Nernst'sche Gleichung abgeleitet? Kalkulieren sie die physiologischen Gleichgewichtspotentiale für Na+, K+, Ca+ und Cl-. 4. Wie werden sich in den Praktikumsversuchen anionen- und kationenselektive Membrane unterscheiden? 5. Warum weisen Zellen ein Ruhemembranpotential auf? Wie hängt die GoldmannHodgkin-Katz Gleichung mit der Nernst'schen Gleichung zusammen? 6. Beschreiben Sie das physiologische Aktionspotential! Aus welchen Phasen besteht es? 7. Welche Proteine sind für die Aktionspotentialbildung verantwortlich? 8. Welche Effekte auf das Aktionspotential erwarten Sie bei einer erhöhten Kaliumkonzentration des Blutplasmas? Welche Effekte auf das Aktionspotential erwarten Sie bei einer erhöhten Natriumkonzentration des Blutplasmas? V 23B.8



![Elektrischer Widerstand R [Ω]](http://s1.studylibde.com/store/data/006518028_1-4af4ec827900d40a8b56147bdb9d8eea-300x300.png)

![Elektrische Leistung P [W]](http://s1.studylibde.com/store/data/005607414_1-882a48066cdb2383e462dacafae730e7-300x300.png)