YARA Megalab®
Werbung

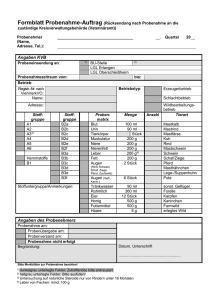
YARA Megalab ® Anleitung zur Pflanzenprobenahme Einführung Um eine aussagekräftige Analyse und Empfehlung zu gewährleisten, sind bei der Probenahme folgende Hinweise zu beachten: Die Strategie der Probenahme zielt im allgemeinen darauf ab, eine möglichst repräsentative Probe für den zu untersuchenden Schlag oder Bestand zu erreichen. Dies wird erreicht, indem an verschiedenen Stellen Teilproben entnommen werden. Die so genannte Ganglinie über den Schlag sollte nicht entlang sondern quer oder diagonal zu den Fahrgassen sein. Mögliche Ganglinie: Die Probenahme soll repräsentativ über den Schlag erfolgen. Pflanzenprobenahme Bestimmte Bereiche sollten von der Beprobung ausgeschlossen werden, so z.B. •Vorgewende • Stellen, die in der Vergangenheit als Lagerplatz für Stroh, Stallmist oder Silage verwendet wurden •Feldränder • Einzugsbereich von Bäumen oder Hecken • Nähe zu Strommasten Für jede Probe und für jedes Feld ist das entsprechende Etikett auf der Probetüte zu beschriften. Nur so kann eine ordnungsgemäße Analyse und die darauf aufbauende Interpretation gewährleistet werden. INTERNAL Zum Abschneiden der zum Abschneiden der Pflanzen scharfes Messer Pflanzen ein scharfes rostfreiem Stahl Messer ausaus rostfreiem benutzen Stahl benutzen. Pflanzen Pflanzen ca. 1 – 2 cm über ca. 1 – 2 cm der derüber Bodenoberfläche abschneiden Bodenoberfläche keine abgestorbenden oder abschneiden. verschmutzen Pflanzenteile beproben Pflanzenprobenahme Keine abgestorbenden oder Probenmenge: ca. 200 – verschmutzen Pflanzenteile INTERNAL 250 g Frischmasse beproben. Probenmenge: ca. 150 – 200 g Frischmasse. Pflanzen nicht mit Wurzeln aus dem Boden Pflanzen nicht mit Wurzeln aus dem Boden ziehen. HWO - Date: 2004-12-21 - Page: 2 Bei akuten Entwicklungs- oder Wachstums-Störungen sollten zwei Proben von einem Schlag genommen werden. Diese sollten gezielt von Stellen mit gutem und schlechtem Wuchs, bzw. mit und ohne Auffälligkeit, entnommen werden. HWO - Date: 2004-12-21 - Page: 4 YARA GmbH & Co. KG, Hanninghof 35, D-48249 Dülmen / E-mail: [email protected] Tel. 0 25 94 / 79 80, Fax. 0 25 94 / 798 118 / www.yara.de Folgende allgemeine Hinweise sind weiterhin zu beachten: • Die Probenahme zur Pflanzenanalyse sollte möglichst zu Beginn der Woche erfolgen, damit ein schneller Transport zum Labor gewährleistet werden kann • Verletzte, absterbende oder bereits abgestorbene Pflanzenteile nicht mit in die Probe geben (Ausnahme siehe Einführung) • Je nach Fragestellung, Zeitpunkt der Beprobung und Pflanzenart die richtigen Pflanzenteile beproben • Die Pflanzenproben dürfen nicht mit Boden verschmutzt sein • Anhaftendes Wasser kann vorsichtig mit Küchenkrepp oder Papiertaschentüchern aufgenommen werden; vielfach kann eine Vortrocknung des Pflanzenmaterials an einer normalen Heizung oder auf der Fensterbank sinnvoll sein • Probenahmetüten und Etiketten erhalten Sie mit Ihrem Pflanzenanalyse-Toolkit bei Bestellung der Probe • Für die Aufbereitung und Analyse sind ca. 150 - 200 g Frischsubstanz erforderlich, die aus Teilproben von ca. 10 verschiedenen Probenahme-Stellen stammen sollten Unbedingt das Probenetikett komplett ausfüllen und auf die Probentüte kleben. Wichtig ist, die Kultur, das genaue BBCH Stadium sowie den Schlagnamen einzutragen. Nur so kann später die richtige Empfehlung abgeleitet werden. Die Pflanzenprobe in die Probentüte einfüllen und in der Versandtasche verpacken. Die Versandtasche schnellst möglich absenden. Kultur BBCH-Code Beschreibung Rüben bis 39 Ab Juni bis zum Reihenschluss: über 90 % der Pflanzen benachbarter Reihen berühren sich Gerade voll entwickelte Blätter Getreide (außer Weizen) 28 bis 45 8 Bestockungstriebe sichtbar – Blattscheide des Fahnenblattes geschwollen Gesamte oberirdische Pflanze Weizen 24 bis 45 4 Bestockungstriebe sichtbar - Blattscheide des Fahnenblattes geschwollen Gesamte oberirdische Pflanze 31 bis 39 Beginn Reihenschluss: 10 % der benachbarten Reihen berühren sich – Reihenschluss: über 90 % der benachbarten Reihen berühren sich 51 bis 79 Knospen der 1. Blütenanlage (Hauptsproß) sichtbar (1-2 mm) – 90 % der Beeren des 1. Fruchtstandes haben nahezu endgültige Größe erreicht (oder sind bereits abgefallen) 33 bis 36 3. Stengelknoten wahrnehmbar – 6. Stengelknoten wahrnehmbar 51 bis 59 Beginn des Rispenschiebens; Rispe in Tüte gut fühlbar – Ende des Rispenschiebens: untere Rispenmitteläste voll 61 bis 69 Männliche Infloreszenz*: Beginn der Blüte; Mitte des Rispenmittelastes blüht, weibliche Infloreszenz*; Spitze der Kolbenanlage schiebt aus der Blattscheide – Ende der Blüte 30 bis 53 Beginn des Längewachstums – Hauptinfloreszenz überragt die obersten Blätter 55 Einzelblüten der Hauptinfloreszenz sichtbar (geschlossen) 57 bis 59 Einzelblüten der sekundären Infloreszenzen* sichtbar (geschlossen) – erste Blütenblätter sichtbar, Blüten noch geschlossen 62 bis 65 Ca. 20 % der Blüten am Haupttrieb offen- Vollblüte: ca. 50 % der Blüten am Haupttrieb offen. Infloreszenzachse verlängert Kartoffeln Mais Raps *Infloreszenz: Blütenstand Probeorgan Jüngste, vollentwickelte Blätter Mittlere Blätter Kolbenblätter Jüngste, vollentwickelte Blätter Quelle: „Entwicklungsstadien von Pflanzen“, Biologische Bundesanstalt für Land- und Forstwirtschaft, Blackwell Wissenschaftsverlag, 1997 YARA GmbH & Co. KG, Hanninghof 35, D-48249 Dülmen / E-mail: [email protected] Tel. 0 25 94 / 79 80, Fax. 0 25 94 / 798 118 / www.yara.de / www.yara.de/megalab