7 Aldehyde und Ketone
Werbung

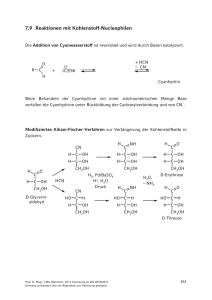
7 Aldehyde und Ketone 7.1 Allgemeines 2 Reaktivitätszentren: H ·· O: δ– R C C δ+ : H :X ·· α-Wasserstoff Reaktionen an der (Kap. 9) Carbonylgruppe X = H: Aldehyde X = Alkyl, Aryl: Ketone X = Hal, OR, NH2: Carbonsäurederivate Kapitel 7: Reaktionen an der Carbonylgruppe von Aldehyden und Ketonen Kapitel 8: Reaktionen von Carbonsäuren und deren Derivaten Kapitel 9: Enolate 7.2 Bisher besprochene wichtige Herstellungsmethoden für Aldehyde und Ketone • Oxidationen primärer und sekundärer Alkohole: Kap. 6 • Hydratisierung von Alkinen (H2O/Hg2+ bzw. Hydroborierung und H2O2): Kap. 4 • Ozonolyse von Alkenen und (im Fall von Aldehyden reduktive) Aufarbeitung: Kap. 4 • Acylierung und Formylierung von Arenen: Kap. 5 • Hydrolyse von α,α-Dihalogeniden: Kap. 2 Ph–CHCl2 • H2O Ph–CHO HCO3– Oxo-Synthese (Hydroformylierung) (Kap. 4) R–CH=CH2 + CO + H2 Co2(CO)8-kat. R CH CH3 + R–CH2–CH2–CHO CHO Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 152 7.3 Mechanismen der Additionen an die Carbonylgruppe von Aldehyden und Ketonen C O δ+ δ– C O C O μ ~ 9 x 10–30 Cm Die Additionen von HX an die Carbonylgruppe verlaufen entweder über einen primären Angriff eines Elektrophils oder eines Nucleophils H+ :X– :X– H+ R C O R' Anders als bei CC-Doppelbindungen ist bei CO-Doppelbindungen die π-Bindungsenergie größer als die σ-Bindungsenergie. Daher liegt das Gleichgewicht der Additionen von HX an die Carbonylgruppe häufig auf der Seite der Reaktanten. 7.4 Bildung von Hydraten durch Wasseraddition Zusammenhang zwischen Struktur und Hydratisierungsgleichgewicht R H C O + O R' H O Cl3C K C O O H % Hydrat in H2O 100% H C H 99% Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. H3C C O H 58% H 3C C CH3 < 1% 153 Trichloracetaldehyd (Chloral) bildet ein stabiles Hydrat, Formaldehyd liegt in wässriger Lösung überwiegend als Hydrat vor (Formalin) während Ketone kaum hydratisiert werden. O + R H2O 7.5 Reaktion mit Alkoholen: Halbacetale und Acetale Die Bildung von Halbacetalen ist wie die Hydratisierung reversibel und wird durch Säuren oder Basen katalysiert. R R' + C O H O K H Halbacetal (Hemiacetal) Die Gleichgewichtskonstanten der Halbacetal-Bildung aus Carbonylverbindungen und Alkoholen hängen in ähnlicher Weise von der Struktur der Carbonylverbindungen ab wie die Hydratisierungsgleichgewichte. Befinden sich Aldehyd- und Hydroxylgruppe im selben Molekül, kommt es zur Bildung cyclischer Halbacetale, wenn dabei ein 5- oder 6-Ring entsteht. H2 C H2C H2C O H C O H Halbacetale stehen immer im Gleichgewicht mit den Edukten, so dass sie die typischen Carbonylreaktionen zeigen. Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 154 Die Bildung cyclischer Halbacetale spielt in der Kohlenhydrat-Chemie eine wichtige Rolle: H O C H OH HO H H OH H OH O OH OH HO = HO H HO = HO HO HO O OH OH OH OH OH O OH CH2OH D-Glucose (Traubenzucker) H H C O OH OH H OH = H OH OH H OH CH2OH HO O OH O = OH HO O HO OH HO OH OH D-Ribose Unter Säurekatalyse entstehen in Gegenwart überschüssigen Alkohols Vollacetale. In Abwesenheit von Säure können Halbacetale jedoch nicht zu Vollacetalen weiterreagieren. OR' R C H H+ Halbacetal OR' R C H C H O H OR' R + H – H2O O H H – H+ R C + OR' R'OH OR' Acetal Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 155 OH Bruttogleichung R C O [H+] + 2 R'OH H Alkohol + H2O C H Aldehyd OR' R OR' Acetal (Vollacetal) Acetale sind gegenüber Basen (Nucleophilen) inert (warum?) lassen sich aber durch Säuren leicht spalten. Acetale eignen sich daher als Schutzgruppen. für die Carbonylgruppe. Insbesondere die aus 1,2-Diolen gebildeten cyclischen Acetale finden hierbei Verwendung (warum?). H2 C HO CH2 O HO C H R [H+] + H2O Cyclisches Acetal Beispiele für den Einsatz von Acetal-Schutzgruppen: H Bu C C: – Li+ + I CH2 CH2 C O S N2 Bu C C O H+, H2O 4-Noninal Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 156 Die Bildung cyclischer Acetale aus 1,2- und 1,3-Diolen ist aus Entropie-Gründen besonders günstig. Cyclische 1,2-Diole mit Ringgröße ≤ 6 bilden solche Acetale nur, wenn die beiden OH-Gruppen cis-ständig sind. OH OH OH O O H HO + OH OH H3C O C H2SO4 H H O CH3 O H + 2 H2O O H α-D-Galactose O 1,2:3,4-Di-O-isopropylidenα-D-galactopyranosid OH CHO H OH H OH H HO O OBn HCl OH CH2 OH HO O HO + OH OH kinetisches Produkt OH OBn thermodynamisches Produkt 7.6 Thioacetale aus Carbonylgruppen und Thiolen Für die Bildung von Thioacetalen aus Carbonylverbindungen und Thiolen verwendet man Lewis-Säuren (BF3, ZnCl2) anstelle von Protonen-Säuren wie bei der Acetal-Bildung. Ihre Spaltung gelingt ebenfalls nicht mit Brønsted-Säuren, sondern kann beispielsweise mit HgCl2 durchgeführt werden. O R C + 2 R'SH H Aldehyd H SR' + H2O oder [ZnCl2] Thiol SR' R C [BF3] Thioacetal HgCl2 H2O Alternative Hydrolyse von Dithioacetalen: Erwärmen mit Methyliodid in Aceton, das geringe Mengen Wasser enthält. Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 157 Corey-Seebach-Reaktion: Umpolung der Carbonyl-Reaktivität H R C O HS + [BF3] BuLi R'CH2Br SH Hydrolyse wie oben RaneyNickel 7.7 Bisulfit-Addukte aus Aldehyden und Natriumhydrogensulfit Versuch: Herstellung des Bisulfit-Addukts aus Benzaldehyd ·· : – + :O Na O Ph C + H .. S O OH Natriumsalze der α-Hydroxysulfonsäuren Die Bisulfitaddukte sind wasserlöslich und können daher zur Reinigung von Aldehyden verwendet werden. Sie zerfallen beim Erwärmen in verdünnter Säure oder Lauge, so dass die Aldehyde regeneriert werden. Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 158 7.8 Nucleophile Addition von Ammoniak und Aminen H . R N. R' + C R'' O H Halbaminal H+ – H2O – H+ H R' R N C R'' O H H Iminium-Ion Aminocarbenium-Ion Imin Schiffsche Base Azomethin Der vorstehend beschriebene Bildungsmechanismus eines Imins ist eine Plausibilitätsbetrachtung, wobei die Reihenfolge der Protonenübertragungen von den Reaktionsbedingungen abhängt. R' N C R'' R Oxim Imin H H H O N R N H H Hydroxylamin primäres Amin R' O C R'' O H2N C H H H N N N N H Semicarbazid Semicarbazon Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. H H Phenylhydrazin Phenylhydrazon 159 Nitron-Bildung R ·· N H + O C R' R" HO Nitron Reaktion von Ammoniak mit Formaldehyd Das aus Ammoniak und Formaldehyd gebildete Methanimin (H2C=NH) (Mechanismus wie bei primären Aminen) ist nicht stabil, sondern reagiert weiter unter Bildung von Urotropin (Name wegen seiner Verwendung als HarnwegDesinfiziens). Urotropin enthält vier Triazacyclohexan-Sessel und besitzt dieselbe Struktur wie Adamantan, das als Ausschnitt aus dem Diamant-Gitter angesehen werden kann. H C H – H2O H O .. H N H H H C H H 3x NH3 N 3 HCHO N H Methanimin N N H 1,3,5-Triazacyclohexan N N N N Urotropin Hexamethylentetramin Adamantan Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 160 Bildung von Enaminen aus Aldehyden oder Ketonen und sekundären Aminen H H R N.. + R' C O C R'' R H+ H analog der Reaktion von primären Aminen R H R' C N C R R'' H R' H R C N C R Iminium-Ion Aminocarbenium-Ion H R'' – H+ Enamin Enamine enthalten eine elektronenreiche CC-Doppelbindung, die leicht von Elektrophilen angegriffen werden kann. Wichtiges Prinzip biochemischer Mechanismen! Reduktive Aminierungen nutzen die Tatsache, dass schwache Hydrid-Überträger, wie NaBH3CN, mit Iminium-Ionen, nicht aber mit Carbonylverbindungen reagieren. O + Na+ H H B– CN H H3C + CH3 N + Na+ H H B– CN H Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 161 Iminium-Ionen werden hierbei i. A. in situ erzeugt, wenn eine Carbonylverbindung mit Ammoniak oder einem Amin und Natriumcyanoborhydrid gemischt wird. NH3 O Ph NaBH3CN pH 6 CH3 Mechanismus: Ph CH3 H H B– CN O Ph H2N H NH3 H pH 6 CH3 Als Hydriddonor kann auch das Formiat-Ion dienen: Bei der Leuckart-WallachReaktion werden Carbonylverbindungen mit Aminen und Ameisensäure (im einfachsten Fall Ammoniumformiat) erhitzt. O– H C O R' R O + NH4+ Auf diese Weise gelingt die Monomethylierung sekundärer Amine. + HCHO + HCO2H Ph 100 °C N H Mannich-Reaktion: Die aus sekundären Aminen und Carbonylverbindungen entstehenden Iminiumionen können beispielsweise an elektronenreichen Arenen angreifen. Andere Varianten der Mannich-Reaktion folgen in Kapitel 9. N(CH3)2 + HCHO + HN(CH3)2 N H N H Gramin (Indol-Alkaloid, das in zahlreichen Pflanzen vorkommt) Mechanismus: Elektrophile aromatische Substitution (Aminoalkylierung) N H CH3 + H2C N + CH3 Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 162 „Iminium-katalysierte“ Diels-Alder-Reaktionen (MacMillan, 2000) Da α,β-ungesättigte Iminiumionen viel stärkere Dienophile sind als die entsprechenden Carbonylverbindungen, können chirale sekundäre Amine die enantioselektive Bildung von Diels-Alder-Addukten aus prochiralen Reaktanten katalysieren. O N Ph + als Dienophil fungiert CH3 + CH3 N H H Cl– O H CH3 (5 mol-%) O N CHO Ph CH3 + N 82 % 94 % ee H CH3 CH3 Cl– Heterocyclen-Synthese Umsetzungen von Dicarbonylverbindungen mit Aminen sind für die Herstellung von N-Heterocyclen sehr wichtig. So sind z. B. viele substituierte Pyrazole, Pyrrole und Oxazole sehr leicht zugänglich. • α-Diketone H2N O + H2N O 2,3-Dimethyl-chinoxalin • β-Diketone NH H2N–NH2 N O 3,5-Dimethyl-pyrazol O H2N–OH N O 3,5-Dimethyl-isoxazol • γ-Diketone und analoge Verbindungen NH3 N O O O H Prof. H. Mayr, LMU München, OC-2 Vorlesung im WS 2009/2010 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. N H 2,5-Dimethyl-pyrrol 163