Oxidation von Alkoholen 2016 - Rauber (Exp)
Werbung

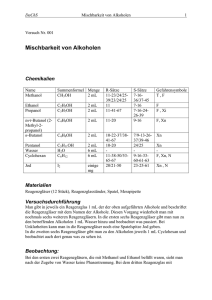
Fachdidaktik Chemie III Demonstrationsexperiment Oxidierbarkeit von primären, sekundären und tertiären Alkoholen ______________________________________________ Sven Rauber [email protected] Unterrichtsfach Biologie & Chemie 04.11.2016 Fachdidaktik Chemie III Experimentierkurs Oxidierbarkeit von primären, sekundären und tertiären Alkoholen Ziele: Der Versuch zeigt, wie der Name schon sagt, die Unterschiede hinsichtlich der Oxidierbarkeit von primären, sekundären und tertiären Alkoholen. Erstere können in zwei Schritten über Aldehyde zu Carbonsäuren oxidiert werden. Sekundäre Alkohole können nur einmal zu Ketonen oxidieren während die Tertiären überhaupt nicht durch diese Weise oxidiert werden können. Der Versuch ist gut als Überleitung zu den Stoffklassen Aldehyde und Ketone am Ende der Unterrichtseinheit geeignet. Er kann aber grundsätzlich auch bei Alkoholen oder Carbonsäuren verwendet werden. Voraussetzung: Als Vorwissen muss zwingend die Redoxchemie behandelt worden sein. Der Versuch ist also eine gute Auffrischung Zeitbedarf: ~ 5 min Vorbereitung, < 10 min Durchführungszeit Skizze: Oxidation von Isopropanol mit Kaliumpermanganat 1-Propanol S. Rauber Isopropanol tert-Butanol HS 2016 Fachdidaktik Chemie III Experimentierkurs Materialliste: 3 Petrischalen oder Reagenzgläser, Messpipetten (Peleusball), Pasteurpipetten mit Hütchen, 1 kleiner Erlenmeyerkolben (50 ml) Chemikalien: 1-Propanol, Isopropanol, tert-Butanol, 1 M Natronlauge, Kaliumpermanganat-Lösung (c=0,006mol/L) Durchführung: 1. 0,006 m Kaliumpermangant-Lösung aus 14 mg Kaliumpermangant und 15 mL destilliertem Wasser herstellen 2. Zugabe von 15 mL einer 1 M Natronlauge 3. Gleichmässiges Verteilen der Lösung auf drei Petrischalen/Reagenzgläser 4. Zugabe von ~ 2 mL des jeweiligen Alkohols mit einer Pipette Beobachtung: Petrischale 1: Die vorbereitete, violette Lösung verfärbt sich nach Zugabe von 1-Propanol über grün zu gelb-braun. Petrischale 2: Nach Zugabe von Isopropanol schlägt die Lösung von violett zu grün um Petrischale 3: Die Lösung bleibt nach Zugabe des tert-Butanols farblich unverändert Erklärung: Kaliumpermanganat wirkt als Oxidationsmittel und oxidiert die Alkohole bis zu unterschiedlichen Oxidationsstufen. Primärer Alkohol (1-Propanol): Oxidation in zwei Schritten zu 1-Propansäure. Im ersten Schritt entsteht das Aldehyd 1-Propanal. Dabei werden die Mangan-Ionen auf die Oxidationsstufe +VI reduziert, was an der Grünfärbung der Lösung zu erkennen ist. Im zweiten Schritt werden die Aldehyde-Moleküle zu genannten Carbonsäuren oxidiert und die Mangan-Ionen auf Oxidationsstufe +IV reduziert. Man erhält Braunstein, was an der gelblich-braunen Färbung der Lösung auszumachen ist. Sekundärer Alkohol (2-Isopropanol): Aufgrund der Grünfärbung der Lösung kann man bereits schlussfolgern, dass die Mangan-Ionen in diesem Fall nur bis zur Oxidationsstufe +VI reduziert werden. Dies ist damit zu erklären, dass am α-Kohlenstoff nur ein Wasserstoffatom gebunden ist und eine Oxidation, zumindest mit diesen Reagenzien, nach der Ketonbildung (2-Propanon) zum Erliegen kommt. Tertiärer Alkohol (tert-Butanol): Die violette Färbung nach Zugabe des Kaliumpermanganats bleibt unverändert. Es findet demnach keine Veränderung der Oxidationsstufe der Mangan-Ionen statt. Reaktionsgleichungen: Primärer Alkohol (1-Propanol): Erster Oxidationsschritt: C3H7OH → C2H5CHO(l) + 2 H+(aq) + 2 eErster Reduktionsschritt: MnO4-(aq) + 2 H+(aq) + e- → MnO3 (aq) + H2O(l) Zweiter Oxidationsschritt: C2H5CHO(l) + H2O(l) → C2H5COOH (l) + 2 H+(aq) + 2 eZweiter Reduktionsschritt: MnO3 (aq) + 2 H+(aq) + 2 e- → MnO2 (s) + H2O(l) Gesamtreaktion: 3 C3H7OH + 4 MnO4-(aq) + 4 H+(aq) → 3 C2H5COOH (l) + 4 MnO2 (s) + 5 H2O(l) Sekundärer Alkohol (Isopropanol): Oxidation: C3H8O(l) → CH3OCH3 (l)+ 2 H+(aq) + 2 eReduktion: MnO4-(aq) + 2 H+(aq) + e- → MnO3 (aq) + H2O(l) Gesamtreaktion: C3H8O(l) + 2 MnO4-(aq) + 2 H+(aq) → CH3OCH3 (l) + 2 MnO2 (s) + 2 H2O(l) S. Rauber HS 2016 Fachdidaktik Chemie III Experimentierkurs Entsorgung: Die Lösungen kommen zum Schwermetall-Abfall. Bemerkungen: Der Versuch ist am besten auf dem Hellraumprojektor in Petrischalen, bei leicht verdunkeltem Schulzimmer durchzuführen. Der Farbumschlageffekt ist so sehr gut sichtbar. Das Experiment eignet sich auch gut als Schülerversuch im Praktikum. Für reduzierten Chemikalienverbrauch empfiehlt es sich hier, Reagenzgläser anstatt Petrischalen zu verwenden. Literatur & Abbildungen: http://www.unterrichtsmaterialien-chemie.uni-goettingen.de/material/9-10/V9-260.pdf http://chids.online.unimarburg.de/dachs/experimente/005oxidierbarkeit_prim_sek_ter_alkohole.xml http://axel-schunk.net/experiment/edm0799.html S. Rauber HS 2016