Als PDF speichern - Nephrologie, Rheumatologie, Diabetologie und
Werbung
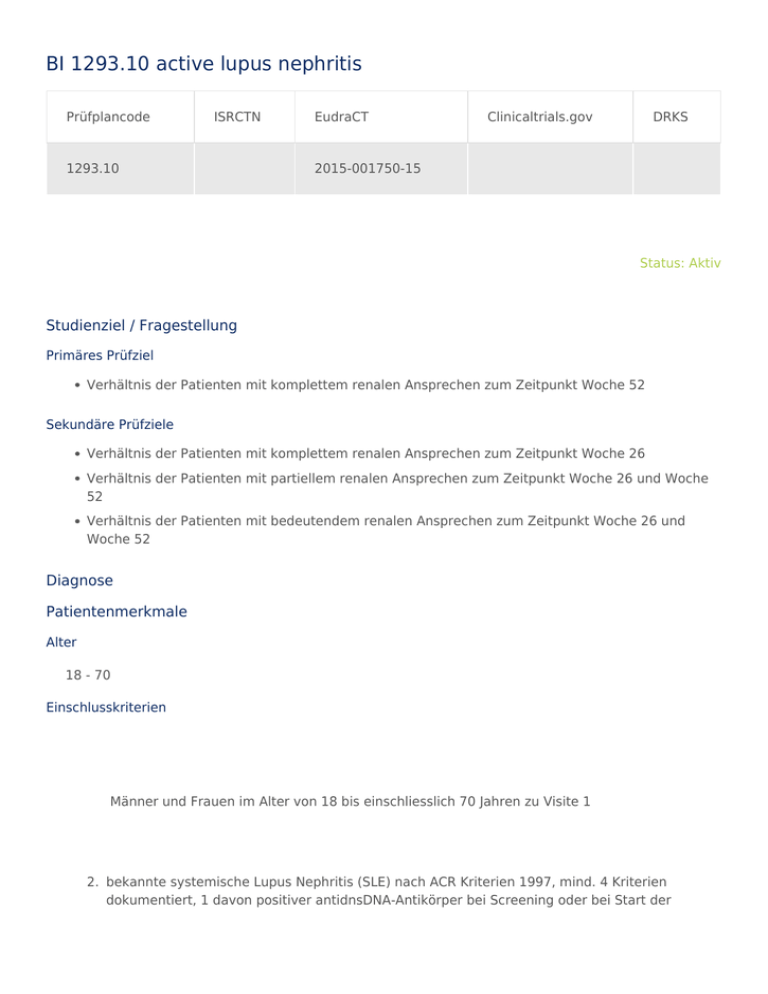
BI 1293.10 active lupus nephritis Prüfplancode ISRCTN 1293.10 EudraCT Clinicaltrials.gov DRKS 2015-001750-15 Status: Aktiv Studienziel / Fragestellung Primäres Prüfziel Verhältnis der Patienten mit komplettem renalen Ansprechen zum Zeitpunkt Woche 52 Sekundäre Prüfziele Verhältnis der Patienten mit komplettem renalen Ansprechen zum Zeitpunkt Woche 26 Verhältnis der Patienten mit partiellem renalen Ansprechen zum Zeitpunkt Woche 26 und Woche 52 Verhältnis der Patienten mit bedeutendem renalen Ansprechen zum Zeitpunkt Woche 26 und Woche 52 Diagnose Patientenmerkmale Alter 18 - 70 Einschlusskriterien Männer und Frauen im Alter von 18 bis einschliesslich 70 Jahren zu Visite 1 2. bekannte systemische Lupus Nephritis (SLE) nach ACR Kriterien 1997, mind. 4 Kriterien dokumentiert, 1 davon positiver antidnsDNA-Antikörper bei Screening oder bei Start der Therapie 3. Lupus Nephritis Klasse III oder IV, aktiv oder aktiv/chronisch, gleichzeitig bestehende Klasse V erlaubt; Nachweis durch renale Biopsie innerhalb 3 Monate vor Screening oder während Screening, wenn Therapie noch nicht gestartet 4. Aktive renale Erkrankung, bewiesen durch Proteinurie ≥ 1.0 g/day (Uprot/Ucrea ≥ 100 mg/mmol) 5. Aktive renale Erkrankung, bewiesen durch Proteinurie ≥ 1.0 g/day (Uprot/Ucrea ≥ 100 mg/mmol) bei Screening 6. Unterschriebene und datierte Einwilligungserklärung durch Patienten Ausschlusskriterien 1. Aktuell klinisch signifikante andere renale Erkrankung, basierend auf Beurteilung des Prüfers; z.B. post-infektiöse Glomerulonephritis, Pyelonephritis, interstitielle Nephritis, Glomerulosklerose 2. GFR < 30mL/min/1.73m² bei Screening 3. Akute Oligurie (<500 mL/Tag) 4. geplante Dialyse innerhalb der nächsten 12 Monate bei Screening 5. Antiphospholid-Syndrom 6. schlecht eingestellter Diabetes Mellitus, oder bekannte diabetische Retinopathie, oder diabetische Nephropathie 7. Klinisch signifikante Erkrankung, welche nach Beurteilung des Prüfers die Sicherheit des Patienten, oder der Daten beeinträchtigt 8. vorhergehende Behandlungen mit anti-CD20, anti-CD22, antiBLyS, Abatacept, Tacrolimus, Cyclosporin, Cyclophosphamid, Studienmedikamente innerhalb der letzten 12 Monate 9. Kontraindikation auf Mycophenolate Mofetil oder Korticosteroide. 10. Impfung innerhalb der letzten 6 Wochen vor Randomisierung 11. Klinisch wichtige akute oder chronische Infektion, einschließlich HIV, Hepatitis B oder C 12. Akute oder latente Tuberkulose, welche nicht mind. 6 Monate vor Start der Therapie behandelt wurde 13. Maligne Tumore, welche innerhalb der letzten 5 Jahre auftraten, außer adäquat behandelte Carcinoma in situ und behandelte Basalzell- und Plattenepithel-Ca. 14. mangelnde Compliance des Patienten 15. Alkoholabusus, oder Drogenabusus 16. Schwangere und stillende Frauen, sowie geplante Schwangerschaften während der Studie 17. Eingeschränkte Leberfunktion (Serum AST/ALT, Bilirubin oder AP > 2 x ULN Studiendesign Doppelblind,Multizentrisch,Phase I/II,Placebo-kontrolliert,Randomisiert,Vierarmig Dokumente (passwortgeschützt) (noch keine Dokumente) Zuständigkeiten Gesamtstudie Sponsor Boehringer Ingelheim Leiter der klinischen Prüfung Dr. med. Franziska Grundmann Prüfzentren Köln Nephrologie - Klinik II für Innere Medizin (UK Köln) Studienbüro Studienzentrum Med II (UK Köln) Tel.+49(0)221-478-97222 [email protected] Status Aktiv Prüfer (Hauptprüfer im Zentrum) Dr. med. Franziska Grundmann Stellvertretender Prüfer Dr. med. Volker Burst