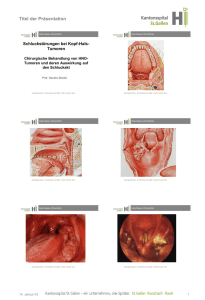
Untersuchung zum Nachweis onkogener Papillomaviren im
Werbung

Aus der Klinik und Poliklinik für Hals-, Nasen- und Ohrenheilkunde der Universität zu Köln Direktor: Universitätsprofessor Dr. med. Dr. med. h. c. K.-B. Hüttenbrink Untersuchung zum Nachweis onkogener Papillomaviren im Oropharynx Inaugural-Dissertation zur Erlangung der Doktorwürde der Hohen Medizinischen Fakultät der Universität zu Köln vorgelegt von Julia Walkenhorst aus Bonn promoviert am 18.05.2011 Druck und Bindung: Alpha Copy, Bonn Inh.: Monika Murmann Meckenheimer Allee 178; 53115 Bonn Gedruckt mit Genehmigung der Medizinischen Fakultät zu Köln 2011 Dekan: Universitätsprofessor Dr. med. Th. Krieg 1. Berichterstatter: Privatdozent Dr. med. S. F. Preuss 2. Berichterstatter: Universitätsprofessor Dr. rer. nat. Dr. h. c. H. Pfister Erklärung: Ich erkläre hiermit, dass ich die vorliegende Dissertationsschrift ohne unzulässige Hilfe Dritter und ohne Benutzung anderer als der angegebenen Hilfsmittel angefertigt habe; die aus fremden Quellen direkt oder indirekt übernommenen Gedanken sind als solche kenntlich gemacht. Bei der Auswahl und Auswertung des Materials sowie bei der Erstellung des Manuskriptes habe ich Unterstützungsleistungen von Herrn Privatdozent Dr. med. S. Preuss erhalten. Weitere Personen waren an der geistigen Herstellung der vorliegenden Arbeit nicht beteiligt. Insbesondere habe ich nicht die Hilfe einer Promotionsberaterin/ eines Promotionsberaters in Anspruch genommen. Dritte haben von mir weder unmittelbar noch mittelbar geldwerte Leistungen für Arbeiten erhalten, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertationsschrift stehen. Die Dissertationsschrift wurde von mir bisher weder im Inland noch im Ausland in gleicher oder ähnlicher Form einer anderen Prüfungsbehörde vorgelegt. Freiburg, den 31.08.2010 Julia Walkenhorst Die dieser Arbeit zugrunde liegenden Daten der Polymerasekettenreaktion (PCR) wurden von Herrn O. Siefer und nach entsprechender Anleitung durch Herrn O. Siefer von mir selbst im Labor des Jean-Uhrmacher-Instituts in Köln erhoben. Die Tonsillektomie-Präparate sind nach operativer Entfernung der Tonsillen durch den jeweiligen ärztlichen Mitarbeiter der Hals-Nasen-Ohren-Klinik der Universität zu Köln von mir selbst aus dem Frischgewebe gewonnen worden. Die Virustypisierungen sind im Institut für Virologie der Universität zu Köln von Herrn Dr. Sönke Weißenborn und seinen Mitarbeitern durchgeführt worden. Die Fragebögen wurden von mir ausgewertet. Die statistischen Ergebnisse dieser Arbeit sind von mir selbst mit Hilfe des Statistikprogrammes SPSS erarbeitet worden. Danksagung Ich möchte mich bei allen bedanken, die zur Fertigstellung dieser Arbeit beigetragen haben. Mein ganz besonderer Dank geht an Herrn Universitätsprofessor Dr. med. J. P. Klußmann, der die Idee zu dieser Arbeit hatte, mir das Thema überließ und der den experimentellen Teil dieser Arbeit begleitet und unterstützt hat. Vielen Dank für die zahlreichen Anregungen und die freundliche Überlassung von Literatur. Herrn Privatdozent Dr. med. S. F. Preuss danke ich für die Übernahme der Betreuung gegen Ende der Arbeit und für die Korrektur des Manuskriptes. Ich danke ihm auch für all die Ratschläge, die zum Abschluss der Arbeit geführt haben. Herrn Universitätsprofessor Dr. med. Dr. h.c. K. B. Hüttenbrink möchte ich dafür danken, dass er mir als Direktor der Hals-Nasen-Ohrenklinik der Universität zu Köln den Abschluss der Dissertationsschrift ermöglichte, die unter seinem Vorgänger Dr. med. em. E. Stennert begonnen wurde. Herrn O. Siefer danke ich sehr für die ständige und geduldige Unterstützung und Hilfe bei der Anfertigung der PCRs. Bei allen labortechnischen Fragen stand er mir mit Rat und Tat zur Seite. Herrn Dr. rer. nat. S. Weissenborn und seinem Team im Institut für Virologie der Universität zu Köln danke ich für die Virustypisierungen. Allen Mitarbeiter/Innen der Poliklinik der Hals-Nasen-Ohren-Universitätsklinik Köln danke ich für die freundliche Unterstützung bei der Probengewinnung und Rekrutierung der Probanden. Meinem Mann Herrn Dr. med. M. Schricker danke ich von ganzem Herzen für seine unermüdliche Geduld, für die fachliche sowie emotionale Unterstützung, für die Hilfe bei der statistischen Auswertung und Formatierung und nicht zuletzt dafür, dass er immer an mich und die Fertigstellung dieser Arbeit geglaubt hat, auch als ich es manches Mal nicht mehr tat. Er ist maßgeblich daran beteiligt, dass diese Arbeit nun endlich abgeschlossen werden konnte. Meinen Eltern Herrn B. Walkenhorst und Frau G. Hampel danke ich herzlichst für all ihre liebevolle Unterstützung während meines Studiums und dieser Arbeit. Ohne sie wäre ich niemals soweit gekommen. Meinem Vater danke ich für die grammatikalische und orthographische Korrektur. für Markus, Maximilian und meine Eltern Inhaltsverzeichnis Inhaltsverzeichnis Abbildungsverzeichnis 1 Grundlagen ........................................................................................ 5 1.1 1.2 Humane Papillomaviren ................................................................ 5 1.1.1 Einteilung ................................................................................ 6 1.1.2 Epidemiologie und Prävalenz von HPV-Infektionen ................ 7 1.1.3 Virale Onkoproteine .............................................................. 10 1.1.4 Physikalischer Status der HPV-DNA..................................... 12 1.1.5 Nachweis von Papillomainfektionen...................................... 14 Plattenepithelkarzinome des Kopf-Hals-Bereichs ....................... 15 1.2.1 Inzidenz und Epidemiologie .................................................. 15 1.2.2 Karzinogenese und Klinik ..................................................... 16 1.2.3 Humane Papillomaviren in Tumoren des Kopf-HalsBereichs ................................................................................ 18 1.2.4 Therapie und Prognose ........................................................ 18 1.2.5 HPV- Infektion als prognostischer Faktor in OropharynxKarzinomen ........................................................................... 19 1.3 Cervixkarzinom und HPV ............................................................ 21 1.3.1 Prävalenz und Epidemiologie ............................................... 22 1.3.1.1 Prävalenz onkogener HPV bei Cervixkarzinomen ...... 25 1.3.1.2 Prävalenz onkogener HPV bei unauffälligem Cervixabstrich ............................................................. 26 1.4 2 1.3.2 Klinik, Therapie und Prognose .............................................. 27 1.3.3 Prophylaxe durch Impfung .................................................... 31 Fragestellung .............................................................................. 32 Material und Methoden.................................................................... 33 2.1 Patienten / Klinische Daten ......................................................... 33 2.2 Probenbehandlung ...................................................................... 34 2.3 Materialien für die PCR ............................................................... 34 2.3.1 Chemikalien .......................................................................... 34 2.3.2 Enzyme und Proteine ............................................................ 34 2.3.3 Oligonukleotide ..................................................................... 35 2.3.3 Gebrauchsfertige Reagenziensysteme und Chemikalien ..... 35 2.3.5 Puffer und Lösungen............................................................. 36 2.3.6 Software und Laborgeräte .................................................... 36 1 Inhaltsverzeichnis Die Polymerasekettenreaktion (PCR).......................................... 37 2.4 2.4.1 Methoden der PCR ............................................................... 37 2.4.2 Durchführung der PCR ......................................................... 38 2.4.2.1 ß-Globin-Gen-PCR ..................................................... 38 2.4.2.2 Nested-PCR mit A5/A10- und A6/A8-Primern ............. 40 2.4.2.3 GP5+/GP6+-PCR ....................................................... 42 2.4.3 DNA-Sequenzierung ............................................................. 43 2.4.4 Agarosegelelektrophorese .................................................... 44 2.5 3 Statistische Analyse .................................................................... 44 Ergebnisse ....................................................................................... 45 3.1 3.2 Deskriptive Statistik des Patientenkollektivs ......................... 45 Prävalenz onkogener HPV im Oropharynx bei Patienten ohne Tumorerkrankung ............................................................. 46 3.2.1 Nachweis onkogener HPV aus Mundspülungen ................... 49 3.2.2 Nachweis onkogener HPV in Abstrichen aus der Tonsillenloge ......................................................................... 50 3.2.2.1 Nachweis onkogener HPV aus Biopsien..................... 51 3.3 4 Untersuchungen zu Risikofaktoren für die HPV-Infektion............ 52 Diskussion ....................................................................................... 56 4.1 4.2 Methodenkritische Diskussion ..................................................... 56 4.1.1 Untersuchungsgut ................................................................. 56 4.1.2 Fragebogenerhebung ........................................................... 56 4.1.3 Nachweisverfahren ............................................................... 57 Prävalenz onkogener HPV im Oropharynx bei Patienten mit und ohne Tumorerkrankung .................................................. 58 4.3 Diskussion der untersuchten Risikofaktoren …………..………….61 4.4 Vergleichbarkeit verschiedener Methoden zur Detektion onkogener HPV .......................................................................... 64 5 Zusammenfassung .......................................................................... 66 6 Literatur ............................................................................................ 68 7 Tabellenverzeichnis ........................................................................ 77 8 Abbildungsverzeichnis ................................................................... 78 9 Anhang ............................................................................................. 79 10 Lebenslauf........................................................................................ 89 2 Inhaltsverzeichnis Abkürzungsverzeichnis bp Basenpaare CIN Cervikale intraepitheliale Neoplasie CT Computertomographie DNA Desoxyribonukleinsäure EGF(R) Epidermal Groth Factor (Receptor) E-ORF open reading frames FIGO Fédération Internationale de Gynécologie et d' Obstétrique (F)ISH (Fluoreszenz-) in-situ-Hybridisierung GADPH Glyceraldehyd-3-Phosphat-Dehydrogenase HIV Human Immunodeficiency Virus HPV humane Papillomaviren HR-HPV High-Risiko-HPV LCR long control region LR-HPV Low-Risk-HPV ml Milliliter mRNA messenger-Ribonukleinsäure MRT Magnetresonanztomographie PCR Polymerase-Chain-Reaction Rb Retinoblastomprotein RFLP Restiktions-Fragment-Längen-Polymorphismus rpm rounds per minute TMN Klassifikation maligner Tumoren nach UICC SIL Squamous intraepithelial lesion URR Upper regulatory region VLP Virus Like Particles Z.n. Zustand nach 5-JÜR 5-Jahres-Überlebensrate 3 4 Grundlagen 1 Grundlagen 1.1 Humane Papillomaviren Papillomaviren gehören der Familie der Papovaviren an, deren Proteinhülle die Form eines Ikosaeders hat und aus 72 Kapsomeren besteht. Das Fehlen einer lipidhaltigen Membran ist allen Humanen Papillomaviren gemeinsam. Diese Tatsache erklärt die hohe Resistenz der Viren gegenüber Fettlösungsmitteln wie z.B. Äther. Im Kapsid der Viren findet man eine zirkuläre Doppelstrang-DNA, die aus ca. 8000 Basenpaaren besteht (15). Das Genom kann in drei Einheiten unterteilt werden, die E-ORFs (= open reading frames; offene Leseraster), die L-ORFs und die LCR (= long control region). Jede ORF ist in der Lage, spezifische mRNA (messenger RNA) zu bilden, die den genetischen Code für die Bildung viraler Proteine enthält. Insgesamt existieren 8 frühe („early“, „E“) ORFs und 2 späte („late“, „L“) ORFs. Sie werden mit E1-E8 und L1-L2 benannt. Die E-ORF E1-E8 codieren aktive virale Proteine, die in der Wirtszelle zur Produktion neuer Virus-DNA zuständig sind. Das Protein E2 z.B. ist für die Regulation der viralen Transkription zuständig, E1 mit E2 zusammen steuert den viralen Replikationszyklus und E5-E7 induziert die Zellproliferation der Wirtszellen. Die L-ORFs L1-L2 codieren virale Kapsidproteine, die auch als Strukturproteine bezeichnet werden können. In der Familie der Humanen Papillomaviren gibt es eine Vielzahl von Genotypen. Diese Genotypen unterscheiden sich in ihren stark ausgeprägten Oberflächenantigen, die sich in der Sequenz der L1-Proteine befindet. Bis zum heutigen Zeitpunkt sind bereits über 100 Subtypen bekannt. Allen Papillomaviren gemeinsam ist jedoch die Antigen-Struktur, die sich im Inneren des Virus befindet und durch das Aufbrechen der Virione entdeckt werden konnte (17). Die LCR- Einheiten steuern die Genexpression und die DNA-Replikation. Sie liegen zwischen dem Ende der späten und dem erneuten Beginn der frühen Leseraster (ORF). 5 Grundlagen Abb.1: Genomorganisation von HPV-16 Die Heterogenität der Viren-Typen wurde mittels in-situ-Hybridisierung (ISH) festgestellt, wobei hier die unterschiedlichen Sequenzen der L1Proteine bedeutsam sind. Als Definitionskriterium für einen neuen Genotyp wurde festgelegt, das er weniger als 90% Sequenzhomologie zu anderen Typen aufweisen darf, während sich Subtypen und Variationen von Genotypen per definitionem in 90 bis 98% genetisch gleichen. Wie bereits oben erwähnt, gibt es in der Familie der Humanen Papillomaviren mehr als 100 unterschiedliche Genotypen. Die Nomenklatur dieser Unterteilung besteht aus der fortlaufenden Nummerierung (z.B. HPV5; HPV16, HPV 31, u.s.w). 1.1.1 Einteilung Die diversen Genotypen der Humanen Papillomaviren lassen sich untereinander durch ihre verschiedenen Eigenschaften unterscheiden. So gelten unter anderem der Tropismus und die Affinität zu verschiedenen Geweben als wichtiges Merkmal. Hier lassen sich drei Gruppen festhalten: eine mukokutane Gruppe (HPV 1-4 u.a.), eine Epidermodysplasieassoziierte Gruppe (HPV 5, 8, 9 u.a.) und eine Schleimhaut-assoziierte (anogenital, oral, obere Atemwege) Gruppe (HPV 6, 11, 16, 18, 31, 33 u.a.). Außerdem werden HPV-Genotypen auf Grund des unterschiedlichen malignen Potentials gruppiert. 6 Grundlagen High-Risk-HPV (HR-HPV) stehen den niedrig malignen Papillomaviren (Low-Risk, LR-HPV) gegenüber. Unter den HR-HPV-Typen spielen die Genotypen HPV 16, 18 und 31 die größte Rolle, aber auch 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 und 82 werden zu dieser Gruppe der Papillomaviren gezählt (86). Diese HR-HPV-Typen werden auf Grund ihres malignen, dysplastischen Potentials auch als onkogene HPV bezeichnet. 1.1.2 Epidemiologie und Prävalenz von HPV-Infektionen Das Humane Papillomavirus ist ein ubiquitär vorkommendes Virus mit einem hohen Durchseuchungsgrad in der Bevölkerung. Zielzelle der Humanen Papillomaviren ist die Epithelzelle, vor allem das Schleimhautepithel. Allerdings können auch andere Körperregionen von HPV infiziert werden. Der Umfang an klinischen Manifestationen ist sehr vielgestaltig. Die meisten HPV-Infektionen verlaufen klinisch inapparent, andere gehen mit der Entwicklung von benignen Warzen z.B. an den Händen, Füßen oder im Gesicht, seltener mit einer Epidermodysplasia verruciformis einher, wiederum andere HPVs sind mit malignen Karzinomen unterschiedlichster Lokalisation assoziiert. Viele Humane Papillomaviren infizieren die Zellen der Schleimhäute. In den letzen Jahren wurde ein Hauptaugenmerk auf HPV-Infektionen der genitalen Schleimhaut gelegt, führend war hier die Erforschung von HPVassoziierten Karzinomen der Cervix uteri. Daneben sind jedoch auch andere Lokalisationen von Bedeutung, so z.B. Mundschleimhaut, Ösophagus, Larynx, Trachea, Konjunktiven und die Haut. Der Übertragungsweg bei der genitalen HPV-Infektion ist der Geschlechtsverkehr, bei anderen Lokalisationen der HPV-Infektion ist der Ansteckungsmechanismus weitaus manigfaltiger. So können die sehr umweltresistenten Viren durch Schmutz und Schmierinfektionen übertragen werden, z.B. auf Fußböden in Schwimmbädern oder bei Handwarzen durch die Berührung von Gegenständen. Auch besteht die Möglichkeit einer direkten Ansteckung durch körperlichen Kontakt zu Virusinfizierten (40). 7 Grundlagen Einen anderen Infektionsweg stellt die Übertragung der Papillomaviren aus anogenitalen Läsionen auf die Schleimhäute des den Geburtskanal passierenden Kindes dar. Die bei der Geburt übertragenen Papillomaviren rufen beim Kind Larynx-Papillome hervor (25). Die spezifische Übertragung von Humanen Papillomaviren ist bis heute in weiten Teilen unerforscht, man kann aber davon ausgehen, dass Mikroläsionen an proliferierenden Epithelien zu einer Infektion führen können. Zudem geht man davon aus, dass der Ausbruch und das Ausmaß einer Infektion abhängig ist von der Zahl der exponierten Zellen, deren Proliferationsstatus und der viralen Dosis. Fest steht, dass im Rahmen einer HPV-Infektion verschiedene Risikogruppen bestehen. Dazu zählen vor allem immunsupprimierte Patienten und Schwangere. Zudem kann laut einer von Gonclaves et al. geführten Studie angenommen werden, dass auf Grund einer bei Rauchern verminderten IgA-Konzentration im Speichel sich die Rate der HPVInfektion erhöht (23); (5). Die Voraussetzung für den viralen Lebenszyklus und für die Replikation ist die Differenzierung der Wirtszelle. Aus diesem Grund war eine Anzüchtung von HPV im Labor lange Zeit nicht möglich. Die Vermehrung der Viren findet dann gekoppelt an den regulären Differenzierungsmechanismus der Zelle statt. Die HPV-Infektion kann sich in ihrer Art und ihrem Verlauf unterscheiden. Man spricht hier von einer permissiven und einer persistierenden Form. Die permissive Infektion ist durch einen vollständigen viralen Lebenszyklus gekennzeichnet, bei dem es nach Erreichen der Zielzelle zu einer Produktion viraler Proteine kommt, bei der die Infektion aber durch die körpereigene Abwehr des Wirtsorganismus nach einiger Zeit zum Erliegen kommt. Die persistierende Infektion ist in der Regel durch eine sehr lange Verweildauer der Viren im Wirtsorganismus charakterisiert, es kann sich hierbei um Monate, Jahre oder gar Jahrzehnte handeln. Das Ausmaß an Produktivität solcher langfristigen viralen Infektionen konnte bis dato nicht eindeutig definiert werden. 8 Grundlagen Als sicher gilt allerdings, dass länger dauernde Persistenz Humaner Papillomaviren im Wirtsorganismus das Risiko für maligne Tumoren signifikant erhöht, da das Humane Papillomavirus – wie auch einige andere DNA-Viren – die Regulationsmechanismen des Zellorganismus aufbrechen, sich in den Proliferationszyklus der Zelle eingliedern und sich so ausbreiten und vermehren können. Histologisch kommt es bei Infektion sehr häufig zum zytopathogenen Effekt, welcher lichtmikroskopisch durch aufgehelltes Zytoplasma und einen pyknotischen Kern zu erkennen ist. Diese Zellen nennt man Koilozyten. Was unter dem Mikroskop deutlich und rasch erkennbar ist, wird vom Immunsystem des befallenen Organismus selbst jedoch wahrgenommen, so dass eine immunologische Abwehrreaktion nicht mit Zellnekrosen und Entzündungsvorgängen ausbleibt. In einigen Fällen kommt es nach der Infektion mit Humanen Papillomaviren zu gutartigen Tumoren des Plattenepithels (z.B. Condylome, Warzen, Papillome), welche jedoch größtenteils nach Jahren spontan ausheilen. Nur extrem selten entarten diese Tumoren zu bösartigen Geschwüren. Trotz - oder vielleicht auch auf Grund - der umfassenden Möglichkeiten zur Detektion Humaner Papillomaviren ist die Beurteilung der Prävalenz von HPV-Infektionen bis zum heutigen Zeitpunkt sehr schwierig, da sie extrem abhängig vom untersuchten Kollektiv (Alter, Lebensgewohnheiten, etc.), von der Art der Proben, von der Methode der Probengewinnung, von den verwendeten Geräten und vom Protokoll, mit dem das Probenmaterial weiterverarbeitet wurde, ist. So stellten sich beispielsweise signifikant unterschiedliche Ergebnisse heraus, wenn sich die Proben und die verwendeten Primer gleichen, sich die Protokolle aber unterschieden. Auf Grund dieser Tatsache ist es nur allzu verständlich, warum ein direkter Vergleich von Prävalenzen und Studien schwierig ist. Eine weitere Schwierigkeit in der Einschätzung von HPV-Infektionen stellt die Studienplanung dar. Punktuntersuchungen machen die Differenzierung zwischen transienten und persistierenden Infektionen und die Beurteilung von Risikofaktoren für die Infektion schwierig. 9 Grundlagen 1.1.3 Virale Onkoproteine Die Entstehung maligner Tumoren durch virusinduzierte Transformation konnte durch die molekularbiologische Analyse der ablaufenden Prozesse vor allem in den letzten zwei Jahrzehnten grundlegend aufgeklärt und verstanden werden. Wird eine körpereigene Zelle von einem Virus mit karzinogenem Potential infiziert, so greifen virale Proteine (so genannte Onkoproteine) in den zellulär geregelten Wachstumsmechanismus der Zelle ein und verändern diesen. Hierzu gehören beispielsweise viral induzierte unkontrollierte Zellteilungen, Blockade des Apoptose - Prozesses und der antiviralen Erkennungs- und Schutzmechanismen. Diese neuen Erkenntnisse auf molekularbiologischer Ebene ermöglichen nicht nur ein profundes Verständnis für den Wachstumszyklus von Zellen, sondern bieten zudem auch neue Perspektiven für molekularbiologische Formen der Krebstherapie (42); (52); (60). Bei der Expression der Papillomavirusgene spielen sowohl die viralen Onkoproteine E6 und E7 als auch zelleigene Regulationsproteine wie das Retinoblastomprotein (Rb) und p53-Protein, die zwei Hauptregulatoren des zelleigenen Wachstumszyklus, eine große Rolle. Durch das komplexe Zusammenspiel dieser Mechanismen wird die Expression karzinogener Virusgene überhaupt erst ermöglicht. Im gesunden Zellzyklus wird das Tumorsuppressorprotein p53-Protein durch potentiell zellschädigende Ereignisse aktiviert, induziert daraufhin Proteine (p21), die die Phosphorylierung des Retinoblastomproteins inhibieren. Das Retinoblastomprotein ist in seiner unphosphorylierten Form in der Lage, den Zellzyklus am Übergang der G1- in die S-Phase zu arretieren, indem es Faktoren (E2F) bindet, die für die Einleitung der SPhase entscheidend sind. Somit kommt es zu einem Stillstand des Teilungszyklus, bis eventuelle DNA-Schäden behoben sind. Zudem verfügt das p53-Protein über die Fähigkeit, die Apoptose der Zelle einzuleiten. Die von HPV16 und HPV18 über das Onkoprotein E6 induzierte p53Degeneration führt zu Verlusten dieses zelleigenen Schutzmechanismus und zur genetischen Instabilität der Zelle. Durch diese Instabilität kommt es 10 Grundlagen gehäuft zu DNA-Mutationen, die den Grundstein für eine maligne Entartung legen (51). Darüber hinaus haben Untersuchungen ergeben, dass HPV-infizierte Zellen eine erhöhte Aktivität des Enzyms Telomerase aufweisen. Diese Aktivitätserhöhung wird p53-unabhängig über E6 vermittelt und wirkt der natürlichen, altersabhängigen Verkürzung der Telomere im Zellteilungszyklus entgegen, die zu einer eingeschränkten Teilungsfähigkeit älterer Zellen führt (39). Das Onkoprotein E7 inaktiviert das Retinoblastomprotein, indem es sich an das Protein bindet und seine Halbwertszeit halbiert. Die arretierende Funktion des Retinoblastomproteins im Zellteilungszyklus fällt weg und die Synthese viraler DNA wird damit ermöglicht. Außerdem bindet E7 an ZyklinKinase-Inhibitoren, z.B. p21, dadurch kommt es zur Synthese von inaktivem Retinoblastomprotein (20); (34). Die Hauptfunktion des epidermalen Wachstumsfaktors (EGF) ist die Förderung von Zellwachstum und -teilung, die Reparatur von Zellschäden, die Kontrolle von Zellwanderungen innerhalb des umliegenden Gewebes und die Angiogenese. Überexpression Überexpression dieses gilt als Bei Krebszellen jedoch Wachstumsfaktors zusätzliches wird häufig beobachtet. Malignitätskriterium eine Diese gegenüber Tumorzellen ohne EGFR-Überexprimierung. Bei dem HPV16-E5 Protein konnte eine EGFR-Überexpression nachgewiesen werden (90); (9). Das Vorkommen der beiden viralen Onkogene E6 und E7 führt zu einer Störung der Choromsomenverteilung in einer Zelle während der Mitose, da beide Onkogene in den geregelten Aufbau des Zentromerapparates eingreifen. Hieraus resultieren Chromosomenbrüche und numerische Chromosomenaberrationen, die wiederum zu genomischen Schäden und zur Transformation der betroffenen Zellen beitragen können. In der Folge kommt es gehäuft zur Integration des normalerweise episomal gelegenen HPV-Genoms in die DNA der Wirtszelle (87). 11 Grundlagen 1.1.4 Physikalischer Status der HPV-DNA Nach Regezi und Sciubba folgt die virale Infektion einer klassischen Reihenfolge (63): 1. Anhaftung des Virus an die Plasma-Membran der Zelle 2. Eindringen in des Cytoplasma, entweder durch Pinozytose oder durch Verschmelzung mit der Membran 3. Das Virus befindet sich nun unbehüllt im Cytoplasma der Wirtszelle 4. Replikation oder Synthese der HPV-DNA durch Stimulation der zellulären DNA-Synthese 5. Interaktion zwischen den produzierten viralen und den zelleigenen Proteinen 6. Abgeschlossene Synthese der viralen DNA mit oder ohne Tod der Wirtszelle Die virale DNA kann in der Zelle episomal oder in die DNA integriert vorliegen. Es wurde festgestellt, dass die virale DNA meistens dann episomal in der Zelle vorliegt, wenn es sich um gutartige Läsionen oder Veränderungen handelt, eine Integration in die DNA der Wirtszelle jedoch für eine maligne Entartung spricht. Als Beispiel kann man hier die zervikale Dysplasie nennen, bei der mit zunehmendem Dysplasiegrad auch gehäuft eine Integration der HPV-DNA nachweisbar ist (35). Eine Studie von Das et al. untersuchte, ob die HPV-16 DNA in präneoplastischen und neoplastischen Veränderungen der Cervix uteri in das Wirtsgenom integriert ist oder nicht. Die Unterscheidung zwischen episomaler und integrierter DNA erfolgte durch Nachweis eines E2spezifischen Fragmentes, fehlender Nachweis des E2-Genabschnittes ist mit Integration der Virus- DNA gleichzusetzen (11). Neben den Proteinen E6 und E7 werden von dem HPV auch die Proteine E1 und E2 exprimiert, welche im Gegensatz zu den transformierend wirkenden Proteinen E6 und E7 die DNA-Replikation und Genexpression regulieren (88). Die Expression von E6 und E7 wird über einen Promotor, den URR-Abschnitt von E2 reguliert, jedoch kommt es bei der Integration der viralen DNA in die humane DNA in vielen Fällen zu einem Bruch des E2-Leserahmens bei erhaltener URR-Einheit. Die Folge hiervon ist eine 12 Grundlagen Überexpression der Onkoproteine E6 und E7 (33). Neben dieser Überexpression kann es durch die chromosomale Instabilität der Zelle jedoch auch zu einer Unterbrechung des p53-Tumorsuppressorgens kommen (86). Abb. 2: FISH mit einer HPV16-spezifischen Sonde weist HPV16-DNA in jedem Zellkern als punktförmiges Fluoreszenzsignal nach, typisches Muster für integrierte HPVDNA Abb. 3: Dysplastische Zellen in einem HPV16-positiven Karzinom sind p16-positiv und grenzen sich deutlich von nicht dysplastischen Zellen ab 13 Grundlagen 1.1.5 Die Nachweis von Papillomainfektionen meisten kutanen Infektionen Humaner Papillomaviren (z.B. Vulgärwarzen, Condyloma acuminata, u.s.w.) können durch ihre äußere klinische Erscheinung diagnostiziert werden. Über viele Jahre hinweg inapparent verlaufende, sogenannte persistente Schleimhautinfektionen hingegen können überwiegend nur durch spezielle Labormethoden nachgewiesen werden. Die Möglichkeiten zur laborchemischen Detektion Humaner Papillomaviren erlebte vor allem in den letzten 25 Jahren eine massive Weiterentwicklung. Als Methoden zur Untersuchung von HPV-Infektionen stehen unter anderem Hybridisation (z.B. Southern Blot, in-situ-Hybridisation, Fluoreszenz-in-situ-Hybridisierung), oder die Polymerase Chain Reaction (PCR) zur Verfügung. Bei der PCR erfolgt der virale Nachweis nach der DNA-Amplifikation, bei Hybridisierungs-Tests erfolgt der HPV-Nachweis ohne vorherige DNA-Amplifikation. Der Virusnachweis mittels PCR gelingt aus geringsten Mengen von Ausgangsmaterial. Die PCR wird als eine semiquantitative Methode bezeichnet, bei der sich in jedem PCR-Zyklus die Kopienzahl verdoppelt, und diese Kopien wiederum im nächsten Zyklus erneut als Matrize („template“) dienen. Ein weiterer Vorteil der PCR gegenüber den Hybridisierungsverfahren liegt in der Unabhängigkeit des physikalischen DNA-Status. Die nachzuweisende Erreger-DNA kann hier also sowohl episomal als auch integriert vorliegen. Dem Breitspektrum-HPV-Nachweis steht die typenspezifische Testung gegenüber. Die optische Darstellung der Virus-DNA nach PCR-Amplifikation kann entweder durch Färbung der Agarosegele mit Ethidiumbromid oder durch Markierung mit Biotin, Fluoreszin, Digoxigenin, sowie radioaktiven Sonden erfolgen (32). Die HPV-Typsierung kann auf verschiedene Arten erfolgen. Entweder werden direkt typusspezifische Primer verwendet oder nach BreitspektrumPCR werden die HPV-Typen durch Hybridisierung mit typusspezifischen Sonden analysiert (32). Alternativ können die Breitspektrum-PCR-Produkte mittels Restiktions-Fragment-Längen-Polymorphismus oder Sequenzanalyse typisiert werden. 14 Analyse (RFLP) Grundlagen Das Prinzip der PCR basiert auf der Amplifikation viraler DNA und dem anschließenden Sichtbarmachen. Voraussetzung für den Ablauf der Amplifikation ist die Anwesenheit sequenzspezifischer Primer, hitzestabiler DNA-Polymerase sowie der Nukleosidtriphosphate von Adenin, Guanin Thymin und Cytosin. Jeder PCR-Zyklus gliedert sich aus Denaturierung, Primer-Anlagerung und DNA-Synthese. Es werden zwischen 33 und 45 Zyklen durchlaufen (65); (24). 1.2 Plattenepithelkarzinome des Kopf-Hals-Bereichs Abb. 4: Anatomische Strukturen des Halses und der Nackenregion 1.2.1 Inzidenz und Epidemiologie Bei Karzinomen im Bereich des Oro- und Larnygopharynx handelt es sich fast ausschließlich um Plattenepithelkarzinome (95%), andere epitheliale und mesenchymale Neoplasien Chondrosarkome) in dieser Kehlkopfkarzinom ist der (z.B. Adenokarzinome, Lokalisation häufigste sind bösartige sehr Tumor Fibro- und selten. Das des oberen Aerodigestivtraktes. Es handelt sich um eine Erkrankung mit jährlich 15 Grundlagen 500.000 Erstdiagnosen, 77.000 davon allein in Europa. Prozentual machen sie 5% aller neu auftretenden Malignome aus (57). Der Altersgipfel der Erkrankung liegt zwischen dem 50. und 70. Lebensjahr. Männer sind weitaus häufiger betroffen als Frauen, das Verhältnis liegt bei etwa 9:1. Aus einem im Jahr 2000 veröffentlichten Artikel der Deutschen Gesellschaft für Hals-Nasen-Ohren-Heilkunde geht hervor, dass bösartige Erkrankungen der Kopf-Hals-Region die 6. Stelle der Häufigkeiten aller durch Malignome verursachten Todesfälle darstellen (4). Die Morbidität dieser Karzinome liegt etwa doppelt so hoch wie deren Mortalität. Bei Patienten unter 40 Jahren ist das Oropharynxkarzinom selten und geht mit einer schlechteren Prognose einher. Frauen erkranken häufiger in jungen Jahren und haben eine bessere Prognose (77). Bezogen auf die Entstehung dieser Karzinome zeigen neue Studien und umfangreiche Metaanalysen, dass es verschiedene Entitäten gibt: einige Tumoren mit HPV-Ätiologie und einen weitaus größeren Teil, der mit den klassischen Risikofaktoren und weiteren zellulären Veränderungen assoziiert ist (86). Als klassische Risikofaktoren für die Entstehung von Kopf-Hals-Karzinomen gelten heute Zigarettenrauchen und Alkoholabusus, sowie der Konsum von Kautabak als gesichert. Die Region des Oropharynx umschließt die unteren Seitenwände (Gaumentonsillen und -bögen, Glossotonsillarfurche) der Vorderwand (Zungengrund einschließlich Valleculae und linguale Epiglottisfläche), der Hinterwand (Rachenhinterwand) sowie der oberen Wand (Vorderfläche des weichen Gaumens einschließlich Uvula), nach dorsal reicht die Region vom Niveau des Gaumensegels nach kaudal bis zum Zungenbein (21). 1.2.2 Karzinogenese und Klinik Bei der Entstehung des Oropharynxkarzinoms kann ein multifaktorieller Prozess angenommen werden. Familiäre Disposition, hormonelle Einflüsse und Vitaminmangel als endogene Geschehen genauso wie exogene Faktoren wie Tabakrauchen, Alkoholkonsum und eine Vielzahl gewerblicher Noxen (Ruß, Teer, Nickel, Hitze, Asbest) können als wichtige Risiken angenommen werden (84). Dennoch gibt es eine Gruppe von Patienten, bei denen diese Risikofaktoren nicht vorliegen. In Karzinomen dieser 16 Grundlagen Patientengruppe wurden überdurchschnittlich häufig Humane Papillomaviren – vor allem HR-HPV 16 oder 18 – nachgewiesen. Die Symptome des Oropharynxkarzinoms sind in Abhängigkeit der genauen Lokalisation unterschiedlich ausgeprägt. Betroffene Patienten Schluckbeschwerden oder klagen häufig Halsschmerzen, über die zum Globusgefühl, Teil ins Ohr ausstrahlen, im fortgeschrittenen Stadium kann es zu Foetor ex ore, Blut im Speichel oder Rhinolalie kommen (77). Diagnostiziert werden Oropharynxkarzinome durch gründliche Inspektion und Palpation, kombiniert mit einer Probeexzision. Bildgebende Verfahren wie die Sonographie, das CT und das MRT spielen vor allem in der präoperativen Ausbreitungsdiagnostik eine wichtige Rolle. Die empfohlene Probeexzision mit histologischer Untersuchung erlaubt neben der Sicherung des Befundes zusätzlich auch eine Therapieplanung (38). Abb. 5: Plattenepithelkarzinom des Oropharynx, HE-Färbung, 200-fache Vergrößerung 17 Grundlagen 1.2.3 Als Humane Papillomaviren in Tumoren des Kopf-Hals-Bereichs gesicherte Auslöser von Kopf-Hals-Tumoren gelten Humane Papillomaviren bei der Entstehung von juvelinen Papillomatosen, hierfür sind die HPV Typen 6 und 11 verantwortlich, die zu den Niedrig-RisikoTypen gezählt werden. Auch bei der Entstehung von invertierten Papillomen der Nasenhaupthöhle oder von benignen Epithelhyperplasien der Mundhöhle spielen Humane Papillomaviren eine entscheidende Rolle. (40). Bei der Suche nach HPV, die an der Entstehung maligner Tumoren des Kopf-Hals-Bereiches unterschiedliche beteiligt Ergebnisse. sind, Ein ergaben Grund Studien hierfür zunächst scheinen die unterschiedlichen Nachweismethoden zu sein. Nach Metaanalyse von diversen PCR-basierten Studien fand sich eine Prävalenz von 53 % für High-risk-HPV-Typen in Tonsillenkarzinomen, durch eine hochsensitive InSitu-Hybridisierungstechnik (FISH) konnte sogar bei 56 % der Oropharynxkarzinome HPV-16-DNA nachgewiesen werden (41). Es handelt sich in den meisten Fällen um HPV-Typ 16 (90 %), seltener um HPV 18 oder HPV 33 (22); (43). 1.2.4 Therapie und Prognose Die wirksamste Behandlungsmöglichkeit des Oropharynxkarzinoms ist die radikale Operation möglicherweise in Kombination mit Strahlentherapie. Der Funktionserhalt umliegender Organe kann bei ausgedehnten Tumoren oft nicht mehr gewährleistet werden. Auf Grund der frühen lymphogenen Metastasierung der Oropharynxkarzinome wird die Indikation zur NeckDissektion in aller Regel großzügig gestellt. Meistens erfolgt primär die Operation mit anschließender postoperativer Bestrahlung (21). Trotz multimodaler verbesserter Therapiemethoden hat sich die Prognose der Kopf-Hals-Karzinome in den letzen 30 Jahren leider nicht wesentlich verbessert (16). Entscheidend für den Erfolg der Behandlung ist neben radikaler Entfernung des Primärtumors die Mitbehandlung der regionären Lymphabflußgebiete. Bei ca. der Hälfte aller betroffenen Patienten liegt bereits eine lokoregionäre Metastasierung vor (67). Mit der Induktionschemotherapie werden hohe Remissionsraten von 70-90% erreicht. Verbesserte Überlebenszeiten konnten auch nach folgender 18 Grundlagen radiochirurgischer Therapie bisher nicht belegt werden (21). Die günstigste Prognose haben Tonsillenkarzinome im Stadium T1 mit einer 5-JÜR um die 90%, weitaus ungünstiger liegen die Zungengrundkarzinome. Sie haben mit einer 5-JÜR von 60% bereits im T1-Stadium die schlechteste Prognose. Bei ca. der Hälfte aller Fälle liegen bereits bei der Diagnosestellung Lymphknotenmetastasen vor, die die 5-JÜR drastisch senken. Ungünstig auf die Überlebensrate wirkt sich auch die Tatsache aus, dass bei einem Großteil der Patienten der Tumor zum Zeitpunkt der Erstdiagnose bereits weit fortgeschritten ist und das umliegende Gewebe infiltriert. Wie Tabelle 3 zeigt, wird die 5-JÜR vor allem anhand des Stadiums abgeschätzt, welches mit Hilfe der TNM-Klassifikation in die Stadien I-IV unterteilt wird. Stadium 0 Tis N0 M0 TNM-Stadium 5-JÜR in % Stadium I T1 N0 M0 Stadium I 75-90 Stadium II T2 N0 M0 Stadium III T1 N1 M0 Stadium II 40-70 T2 N1 M0 Stadium III 20-50 T3 N0/N1 M0 Stadium IV 10-30 T4 N0/N1 M0 jedes T N2 M0 jedes T N3 M0 jedes T jedes N M1 Stadium IVa Stadium IVb Stadium IVc Tab. 3: 5-JÜR bei Kopf-Halstumoren nach UICC-Stadium (91) Tab. 2: UICC-Stadiengruppierungen des Oropharynxkarzinoms (91) 1.2.5 HPV- Infektion als prognostischer Faktor in Oropharynx-Karzinomen Einen besonderen Stellenwert in der molekularbiologischen, klinischen und prognostischen Abschätzung nehmen Oropharynx-Karzinome ein, denen eine Infektion mit onkogenen humanen Papillomaviren zugrunde liegt (44). Generell ist die Prognose von Oropharynx-Karzinomen als eher ungünstig zu betrachten und hat sich trotz Fortschritten in Chirurgie, Chemotherapie 19 Grundlagen und Bestrahlung in den letzten 25 Jahren kaum verbessert. Dennoch konnte festgestellt werden, dass HPV-positive Karzinome mit einem signifikant besseren Überleben vergesellschaftet sind als HPV-negative Karzinome (64); (69); (71). Es fällt auf, dass HPV-assoziierte Karzinome des Hals-Kopf-Bereichs häufiger bei Patienten auftreten, die nicht rauchen und keine übermäßige Alkoholexposition aufweisen als bei Patienten mit HPV-negativen Karzinomen (64); (72). Lindel begründet die Annahme für eine günstigere Prognose und bessere 5-Jahresüberlebensrate bei HPV-positiven Oropharynxkarzinomen unter anderem mit einer besseren Strahlensensitivität Karzinome (50). Abb. 6: typisches Bild eines HPV-positiven Tonsillenkarzinoms 20 als HPV-negative Grundlagen Abb. 7: Krankheitsfreies Überleben von Patienten mit HPV-positiven und HPVnegativen Oropharynxkarzinomen 1.3 Cervixkarzinom und HPV Das Cervixkarzinom stellt eine der häufigsten bösartigen Erkrankungen des weiblichen Genitale dar, die Inzidenzen variieren weltweit zwischen 5 (Spanien) und 45 (Kolumbien) pro 100.000 Frauen pro Jahr. Durch eine massive Verbesserung der Früherkennung ist die Inzidenz dieses Karzinoms jedoch in den letzten 20 Jahren stark zurückgegangen. Insgesamt liegt die Inzidenz des invasiven Cervixkarzinoms bei ca. 15 Fällen pro Jahr, bezogen auf 100.000 Frauen in Deutschland. Die Mortalität ist im Laufe der Jahre von 7,8 % auf 6,1 % gesunken (3). 90% der Cervixkarzinome sind Plattenepithelkarzinome, nur 5 % Adenokarzinome, die restlichen 5% umfassen Mischtumore (61). Ätiologisch ist für die Krebsentstehung eine Infektion mit High-risk-HPV (hauptsächlich die HPVTypen 16, 18, 31, 33, 45, 51, 52 und 56) unabdingbar. Kofaktoren wie Langzeiteinnahme von oralen Kontrazeptiva und Zahl der Geburten wie auch beispielsweise genetische Veränderungen oder erworbene Immunschwäche sind für die Tumorentstehung notwendig. Weitere Risikofaktoren für die Entstehung des Cervixkarzinoms sind schlechte 21 Grundlagen Genitalhygiene (auch des Sexualpartners), Multiparität, Immunsuppression (z.B. HIV, Z.n. Transplantation), andere genitale Infektion, z.B. mit Chlamydien oder Herpes simplex Typ 2, Mangel an Antioxidanzien und Folsäure und das Zigarettenrauchen. 1.3.1 Prävalenz und Epidemiologie Wie bereits oben erwähnt, ist die Einschätzung der Prävalenz von zervikalen HPV-Infektionen sehr schwierig. Fest steht jedoch, dass es einen Zusammenhang zwischen genitalen Warzen, beziehungsweise einer Cervikalen intraepitheliale Neoplasie (CIN) und dem Sexualverhalten, der Zahl der Geschlechtspartner, dem Alter beim ersten Geschlechtsverkehrs und diversen anderen Faktoren gibt. Dieser Zusammenhang ist auf die Infektion mit humanpathogenen Papillomaviren zurückzuführen (36). Die genitale Infektion mit Humanen Papillomaviren zählt weltweit zu den häufigsten sexuell übertragenen Krankheiten, so machen im Laufe des Lebens 70 % aller Menschen mindestens eine HPVInfektion durch. Der Altersgipfel für der Infektion liegt zwischen 20 und 30 Jahren (45). Ein wichtiger Kofaktor ist das Zigarettenrauchen (2). Auch Drogen wie z.B. Cannabis und Kokain, sowie immunsuppressive Medikamente spielen eine Rolle. Der mögliche Zusammenhang zwischen einer HPV-Infektion und der Einnahme oraler Kontrazeptiva ist nicht eindeutig festzulegen, da mit der Einnahme oraler Kontrazeptiva häufig auch die Zahl der Geschlechtspartner steigt. Einige Studien zeigen eine Assoziation zwischen Hormoneinnahme und HPV-Infektion (54); (49), andere schließen diese Assoziation aus (36); (75). Die Prävalenz für eine solche Infektion variiert neben den oben genannten Faktoren auch mit dem Alter, der Lebenssituation und dem kulturellen Hintergrund der untersuchten Gruppe. Die Prävalenz erlebt eine signifikante Zunahme bei Eintritt in die sexuelle Aktivität und mit Zunahme der Anzahl der Sexualpartner. So wurden bei Frauen mit einem normalen zytologischen Gebärmutterhalsbefund in 1,5% der sexuell nicht aktiven Frauen und in 45% der sexuell aktiven Frauen 22 Grundlagen Humane Papillomaviren entdeckt (82). Ähnliche Ergebnisse lieferten Aguilar/Lazcano-Ponce et al. auf männlicher Seite. Hier wurden bei Männern ohne Geschlechtsverkehr keine Viren auf dem Penisepithel entdeckt, wohingegen bei durchschnittlich 43% der sexuell aktiven Männer HPV gefunden werden konnten (1). Der Gebrauch von Kondomen zeigte eine hier keine signifikante Senkung der HPV Infektionsrate. Es wird geschätzt, dass sich 80% aller Frauen und Männer während ihres Lebens mit genitalen HPV infizieren. Die Infektion ist am häufigsten in den Jahren nach Aufnahme sexueller Aktivität, die Prävalenz jedoch immer noch 14,5% bei Frauen zwischen 30 und 34 Jahren und 3,8% in der Altersgruppe von 55–60 Jahren (10); (92). Woodman et al. beobachteten 1075 15- bis 19-jährige Teenager 3 Jahre lang und lieferten mit dieser longitudinalen Studie interessante Erkenntnisse über den Verlauf von HPV, vor allem auch bei Teenagern. Von den untersuchten Mädchen infizierten sich 44% mit Papillomaviren. Diese Ergebnisse lassen sich auch auf die männliche Bevölkerung übertragen. 10% der Teenager infizierten sich mit dem HR-HPV Typ 16 (92). In einer anderen Studie von Elfgren et al. wurden HPV-negative Frauen mit unauffälligem Krebsabstrich nach 5 Jahren erneut untersucht. Das Ergebnis zeigte, dass 67% der Frauen mit einer HPV16-Infektion im Laufe dieser 5 Jahre HPV-negativ wurden, hingegen 92% der mit anderen HPV-Typen infizierten Frauen keinen erneuten HPV-Nachweis hatten (14). Eine Vielzahl von weiteren Studien belegt die Annahme der sexuell übertragenen HPV-Infektion. So hat z.B. eine von Oriel geführte Studie ergeben, dass 64% der Geschlechtspartner von Menschen mit genitalen Warzen ebenfalls solche entwickelten. Schneider fand bei 87% seiner männlichen Probanden spezifische HPV-Typen oder -Subtypen, die auch bei deren Partnerinnen zu finden waren (55). Xi und Koutsky veröffentlichten 1997 eine Studie, die zeigte, dass innerhalb eines Paares spezifische Varianten von HPV16 gefunden werden konnten (93). Unklarheit bei all diesen Untersuchungen herrscht jedoch darüber, welcher der beiden Partner zuerst Träger des Virus war. Es kann davon ausgegangen werden, dass die Prävalenz von HPV-Infektionen bei 23 Grundlagen Männern ähnlich ist wie die der weiblichen Bevölkerung, jedoch ist die Studienlage hier sehr begrenzt. Betrachtet man das Auftreten des Cervixkarzinoms in der Gesellschaft, so lässt sich - in Korrelation mit den oben genannten Faktoren - eine Häufung in den unteren sozioökonomischen Schichten feststellen (37). Die meisten HPV-Infektionen heilen nach 10-14 Monaten wieder aus und bewirken keine Veränderung des Cervixepithels, nur eine über einen längeren Zeitraum fortbestehende Infektion birgt das Risiko für prämaligne oder gar maligne Veränderung von Cervix, Vagina oder Vulva (31). Die spontane Remission der Effloreszenzen in Abhängigkeit vom Immunstatus (z.B. nach Ende einer Schwangerschaft, nach dem Absetzen einer immunsuppressiven Therapie o. ä.) zeigt den engen Zusammenhang zwischen dem zellulären Immunsystem und dem klinischen Verlauf einer HPV-Infektion. Vorstufen des Cervixkarzinoms sind zunächst auf das Epithel begrenzt und weisen noch keine Infiltration des darunterliegenden Stromas auf. Eine Entdifferenzierung dieses Epithels wird dann als cervikale intraepitheliale Neoplasie (CIN) oder Squamous intraepithelial lesion (SIL) bezeichnet und in verschiedene Stadien eingeteilt. Alle Dysplasien können in ein invasives Karzinom übergehen, wobei die Wahrscheinlichkeit mit dem Grad der Dysplasie steigt. CIN I leichte Dyplasie mittelschwere Dysplasie CIN II Atypische Zellen reichen bis in höhere Schichten Es treten vermehrt Zell- und Kernatypien sowie atypische Mukosaschichten auf schwere Dysplasie/ Carcinoma in situ Atypische Veränderungen des gesamten Epithels. Seine Schichtung ist CIN III jedoch noch angedeutet erkennbar. Beim Karzinoma in situ ist jedoch die Schichtung aufgehoben; es ist ein Karzinom, das die Basalmembran noch nicht durchbrochen hat (obligate Präkanzerose) Tab. 4: Klassifikation der Vorstadien des Cervixkarzinoms (74) 24 Grundlagen 1.3.1.1 Prävalenz onkogener HPV bei Cervixkarzinomen Umfangreiche Untersuchungen über den Zusammenhang zwischen Cervixkarzinomen und der Infektion mit Papillomaviren haben ergeben, dass vor allem die mukotropen HPV-Typen 16, 18, 31, 33, 45 und 56 nicht nur maßgeblich an der Entstehung des Gebärmutterkrebses beteiligt sind, sondern eine Infektion als eine notwendige Ursache bei der Entstehung eines Cervixkarzinoms angesehen werden muss (59); (96). HPV-16, beispielsweise, erhöht das Risiko für ein Cervix-Ca auf das 130-fache (53). Es kann als gesichert gelten, dass eine persistierende Infektion mit humanen Papillomviren eine Voraussetzung für die Entwicklung eines Cervixkarzinoms ist. So konnte in 99,7% von 924 invasiven Cervixkarzinomen mittels PCR HPV-Genom nachgewiesen werden (85). Dabei wird vermutet, dass in allen Fällen HPV an der Genese von Karzinomen der Cervix beteiligt sind, die Untersuchungsergebnisse jedoch bei einigen wenigen falsch negativ ausfallen. Dabei fanden sich HPV-16 in ca. 60% und HPV-18 in ca. 10% der Cervixkarzinome. HPV-16 findet sich insbesondere bei Plattenepithelkarzinomen der Cervix, während HPV-18 vor allem beim Adenokarzinom nachgewiesen werden kann (95). Die meisten Cervixkarzinome Transformationszone. entstehen Zytopathologisch lassen im Bereich der sich während der Entstehung dieser Karzinome schon bei deren Vorstufen typische Veränderungen der Epithelzellen in Form von Koilozyten beobachten. Die Koilozytose gilt als pathognomisch für eine Infektion mit humanen Papillomaviren und bezeichnet eine morphologisch veränderte Zelle mit perinukleärer Hofbildung und Kernheterochromasie. 25 Grundlagen Abb. 8: Koilozyten in Papanicolaou-Abstrichen der Cervix uteri Deutliche Verschiebung der Kern-Plasma-Relation zu Gunsten der Zellkerne, im linken Bild sind zum Vergleich am oberen Rand normale Zellen sichtbar. 1.3.1.2 Prävalenz onkogener HPV bei unauffälligem Cervixabstrich In Abhängigkeit von Faktoren wie Alter, Sozialschicht und Kulturkreis variiert die Prävalenz einer genitalen HPV-Infektion zwischen 3 und 50 %. Mit 70 % Gesamtlebenszeitprävalenz zählt die HPV-Infektion zu den häufigsten sexuell übertragenen Infektionen. Der Altersgipfel liegt in der 3. Lebensdekade (31) . Die meisten HPV-Infektionen heilen spontan wieder aus (50-56 %). Das Risiko der prämalignen oder malignen Entartung (CIN III, Carcinoma in situ) entsteht bei einer Persistenz der Virusinfektion und tritt bei etwa 14 - 22% auf. In diesen Fällen ist die Wahrscheinlichkeit für eine weitere Progression bis hin zum invasiven Karzinom hoch (31). In Deutschland liegt die Prävalenz einer HPV-Infektion bei etwa 6,5 - 8 %, die Prävalenz einer HPV-assoziierten Erkrankung der Cervix uteri (CIN III oder Cervixkarzinom) bei 2 - 3 % (31). 26 Grundlagen Dysplasie Definition Prognose (CIN= Cervikale Intraepitheliale Neoplasie) CIN I Leichte Dyplasie Spontane = Pap III D CIN II Ausheilung Mäßige Dysplasie möglich =Pap III D CIN III Schwere Dysplasie, Therapiebedürftig Carcinoma in situ = Pap IV A Tab. 5: Übersicht über CIN-Stadien (37) 1.3.2 Klinik, Therapie und Prognose Sowohl die Therapie des Cervixkarzinoms und zervikaler Dysplasien als auch ihre Prognose hängt vom jeweiligen Zeitpunkt der Diagnosestellung ab. Asymptomatische Frühfälle führen bei fortschreitendem Verlauf zu einer drastischen Verschlechterung der Prognose. Frühe Symptome eines Cervixkarzinoms können Kontaktblutungen, z.B. postkoital oder abnorme azyklische Blutungen sowie veränderter Ausfluss sein. Im weiteren Verlauf treten oftmals allgemeine Symptome einer malignen Erkrankung wie Anämie oder Gewichtsverlust, Ödeme oder aber Urämie, Ileussymptomatik, Stauung der Ureteren oder Neuralgien der unteren Extremität auf (37); (74). Die Therapie maligner oder prämaligner Läsionen der Cervix uteri muss individuell angepasst, geplant und durchgeführt werden. Operative Maßnahmen, bei fortgeschrittenen Bestrahlung, stehen im Befunden Vordergrund, kombiniert möglicherweise mit einer kann eine Chemotherapie die Erfolgschancen verbessern. Zur Behandlung von Präkanzerosen stehen destruktive (z.B. Laservaporisation oder Elektrokauterisierung) und exzidierende Verfahren zur Verfügung. Der Verdacht einer Mikroinvasion oder Invasion schließt die 27 Grundlagen destruierenden Verfahren aus, da hier eine histologische Sicherung nicht möglich ist. Zur histologischen Abklärung oder bei bestehendem Verdacht auf Invasion, makroskopisch oder kolposkopisch nicht komplett einsehbaren Befunden, Ausdehnung der Dysplasie in den Cervixkanal, durch Kürettage gesicherte Dysplasie der Endocervix oder Adenokarzinoma in situ sollten exziedierende Verfahren zur Anwendung kommen. Hierzu zählen die Konisation (mittels Laser, Messer oder elektrischer Schlinge), die endocervicale Kürettage oder die Hysterektomie (31). Die therapeutische Herangehensweise bei malignen, invasiven Cervixkarzinomen schließt die Ergebnisse des Stagings sowie die individuelle Situation der Patientin ein (z.B. Fertilitätserhaltung), Unter- oder Übertherapien gilt es zu vermeiden, ebenso Komorbiditäten. Operative Therapie: Im FIGO-Stadium IA1 wird die Konisation (fertilitätserhaltend) oder aber die abdominale oder vaginale Hysterektomie ggfs. mit Entfernung der pelvinen Lymphknoten empfohlen. In den Stadien FIGO IA2-IIb sollte eine radikale Hysterektomie mit obligatorischer pelviner und paraaortaler Lymphnodektomie erfolgen (nach Wertheim-Meigs). Diese Operation kann offen-chirurgisch oder aber laparoskopisch-assistiert erfolgen, zur Fertilitätserhaltung gibt es bei Tumoren, die kleiner als 2 cm sind die Möglichkeit der radikalen vaginalen Trachelektomie. Hier wird nur ein Teil der Cervix und der Parametrien entfernt, der Uterus selber und damit die Fertilität bleiben erhalten. Große Studien zum onkologischen Risiko fehlen bislang bei dieser Methode. Im Stadium IVA nach FIGO sollte eine nach Ausschluss einer hämatogenen Metastasierung die Becken-Exenteration diskutiert werden. Die Patientin muss über eine hohe postoperative Mortalität, sowie schwere körperliche und psychische Belastungen (Anus praeter, künstliche Harnableitung) aufgeklärt werden (37); (74); (81). Strahlentherapie: Bei nicht-operablen Patientinnen kann die Strahlentherapie primär in sehr frühen Stadien eingesetzt werden. Eine generelle Empfehlung für eine 28 Grundlagen postoperative Nachbestrahlung existiert nicht, findet jedoch Anwendung, wenn der Tumor durch die OP nicht vollständig entfernt werden konnte oder bei inadäquater Lymphnodektomie. Bei fehlenden Kontraindikationen verbessert eine Kombination aus Radiatio mit einer Cisplatin-haltigen Chemotherapie die Heilungsergebnisse (26); (58). Chemotherapie: Um Cervixkarzinome bei fortgeschrittenem Stadium in einen operablen Zustand zu bringen, kann eine neoadjuvante Chemotherapie versucht werden, die intervallverkürzt (weniger als 14 Tage), dosisintensiviert und platinhaltig sein sollte. Die alleinige Chemotherapie ohne gleichzeitige Bestrahlung weist nach aktueller Studienlage keinen klinischen Benefit auf (81). Die Prognose des Cervixkarzinoms zeigt je nach herangezogener Studie eine erhebliche Schwankungsbreite. Die mittlere 5-Jahresüberlebensrate liegt im FIGO-Stadium I bei 80 %, im Stadium II bei 70%, im Stadium III bei 45 % und im Stadium IV bei 15 %. Eine erste grobe Abschätzung der Prognose lässt die Tumorgröße zu. Die Prognose verschlechtert sich, wenn sich der Tumor über die Grenzen der Cervix uteri ausbreitet. Außerdem steigt die Wahrscheinlichkeit der Metastasierung mit zunehmender Tumorgröße, wobei prognostisch zwischen lymphogener und hämatogener Metastasierung unterschieden werden muss. Mit Einbruch in die Lymph-, vor allem aber der Blutgefäße nimmt die 5-JÜR drastisch ab. Ohne Lymphgefäßeinbruch liegt sie mitunter bei 85 %, nach lymphogenem Befall fällt sie auf 50 %. Bei Blutgefäßeinbruch beträgt sie sogar nur 30%, bei Nichtbefall hingegen ca. 80 % (74). Die nachfolgende Tabelle gibt einen Überblick über FIGO und TNMStadien, Häufigkeit der Diagnose und damit assoziierter ungefährer 5-JÜR. 29 Grundlagen TNM Häufigkeit FIGO TX Primärtumor kann nicht beurteilt werden. T0 Kein Anhalt für Primärtumor Tis 0 Carcinoma in situ T1 I Karzinom ist streng auf die Cervix uteri begrenzt (die Ausdehnung auf das Corpus uteri bleibt unberücksichtigt) T1a IA Invasives Karzinom, das lediglich mikroskopisch identifiziert wird. Die Invasion ist begrenzt auf eine gemessene Stroma-Invasion mit einer Tiefe von < 5 mm und einer Oberflächenausdehnung von < 7 mm. T1a1 IA1 Gemessene Stroma-Invasion von < 3 mm in der Tiefe und einer Oberflächenausdehnung von < 7 mm. T1a2 IA2 Gemessene Stroma-Invasionstiefe > 3 mm und < 5 mm bei einer Oberflächenausdehnung von < 7 mm. T1b IB Klinisch erkennbare Läsionen, begrenzt auf die Cervix uteri oder subklinische Läsionen mit größeren Maßen als Stadium IA. T1b1 IB1 Klinisch erkennbare Läsionen, < 4 cm. T1b2 IB2 Klinisch erkennbare Läsionen > 4 cm. T2 II Cervixkarzinom infiltriert jenseits des Uterus, aber nicht bis zur Beckenwand und nicht bis zum unteren Drittel der Vagina T2a IIA Ohne Infiltration des Parametriums. Infiltration der oberen 2/3 der Vagina. T2b IIB Mit Infiltration des Parametriums aber keine Ausbreitung zur Beckenwand. T3 III Cervixkarzinom breitet sich bis zur Beckenwand aus und befällt das untere Drittel der Vagina und verursacht Hydronephrose oder stumme Niere. T3a IIIA Tumor befällt unteres Drittel Ausbreitung zur Beckenwand. T3b IIIB Tumor breitet sich bis zur Beckenwand aus oder verursacht Hydronephrose oder stumme Niere. T4 IV Tumor infiltriert Schleimhaut von Blase oder Rektum und/oder überschreitet die Grenzen des kleinen Beckens. T4 IA Ausbreitung auf angrenzende Organe des Beckens. T4 IVB Ausbreitung auf entfernte Organe (Fernmetastasen). 5-JÜR 100 % Tab. 6: Stadieneinteilung des Cervixkarzinoms (37) 30 der Vagina, 28 % 80-76% 37 % 70-55 % 30 % 45- 30 % 5% 15-7% keine Grundlagen 1.3.3 Prophylaxe durch Impfung Durch sexuelle Abstinenz und das Verwenden von Kondomen lässt sich die Infektion mit high-risk-HPV-Typen an der Cervix uteri verhindern. Neben diesen Maßnahmen existiert nun auch erstmals die Möglichkeit einer Impfung. Die Immunisierung schützt vor einer Infektion mit den High-riskTypen 16 und 18 und kann potentiell mindestens 70% der Cervixkarzinome verhindern. Durch das Fehlen von Tiermodellen gestaltete sich die Entwicklung eines prophylaktischen Impfstoffes zunächst schwierig. Hinzu kam die Schwierigkeit der In-vitro-Anzüchtung Humaner Papillomaviren. Nach und nach wurden vergleichbare Tiermodelle sowie nicht-infektiöse Virushüllen, sogenannte „virus like particles“ (VLP) hergestellt, die auf dem HPV-Kapsidprotein L1 basieren. Es lagert sich zu leeren Viruspartikeln zusammen und unterscheidet sich in Größe und Immunogenität nicht von echten HPV-Viren, jedoch fehlt ihnen die onkogene Virus-DNA. Es stellte sich heraus, dass es nach der Injektion solcher VLP zu einer vermehrten Bildung von Antikörpern kommt, die eine manifeste HPVInfektion verhindern. Die L1-VLP-basierten Impfstoffe sind typenspezifisch, somit besteht nach der Vakzination keine generelle Kreuzimmunität für die diversen HPV-Typen (79). In weiteren Studien wurde nun zunächst das Augenmerk auf einen HPV-16L1-VLP-Impfstoff gelegt. Es stellte sich heraus, dass dieser Impfstoff hoch immunogen ist, die Titer der spezifischen HPV-16-Antikörper lagen um ca. 40mal höher als nach einer natürlich abgelaufenen Infektion mit HPV 16. Nebenwirkungen nach der Impfung blieben aus. Nach 17,4 Monaten wurde bei 41 von 2392 Frauen eine persistierende HPV-16-Infektion, bei 9 Frauen eine HPV16-assoziierte CIN festgestellt, jedoch gehörten alle diese Frauen ausschließlich der Placebogruppe an (28); (31). Es folgte die Entwicklung eines bivalenten Impfstoffs („Cervarix“) gegen HPV-16 und -18, der in einer doppelblinden, placebokontrollierten Phase-IIStudie an 1113 Frauen getestet wurde. Als Einschlusskriterien galten ein HPV-negativer Status und eine unauffällige Cervixzytologie. Zu den Zeitpunkten 0,1 und 6 Monaten wurden einer Gruppe 20 µg HPV-16 und 18-VLP sowie ein Adjuvans verabreicht, der Placebogruppe hingegen 31 Grundlagen lediglich das Adjuvans. Nach Abschluss der Beobachtungszeit von maximal 27 Monaten konnte ein 91,6 %-iger Schutz gegen eine Erstinfektion mit HPV-16 und -18 erreicht werden (27). Die Firma Merck brachte den tetravalenten Impfstoff Gardasil gegen die HPV-Typen 6, 11, 16 und 18 auf den Markt. Dieser Impfstoff verspricht eine Immunisierung gegen 70% aller Cervix-Karzinome und rund 90 % aller Genitalwarzen. Das Impfschema war Tag 1, nach 2 und nach 6 Monaten, der Beobachtungszeitraum betrug 2,5 Jahre. Insgesamt wurden 552 HPVnegative Frauen rekrutiert, von denen jeweils eine Gruppe Impfstoff oder Placebo erhielt. Es konnte nachgewiesen werden, dass persistierende Infektionen oder damit verbundene Erkrankungen um 90 % zurückgingen. Obwohl nicht als primäres Studienziel definiert, zeigte sich, dass der Impfstoff zu 100 % cervikale Präkanzerosen verhindert, die durch die HPVStämme 6, 11, 16 und 18 hervorgerufen werden (83). 1.4 Fragestellung In der hier vorliegenden Arbeit soll das Auftreten einer klinisch inapparenten HPV-Infektion im Mund-Rachen-Raum untersucht werden. Das hierbei untersuchte Kollektiv ist uneinheitlich, es besteht aus freiwilligen Teilnehmern, die sich auf Grund unterschiedlicher Leiden oder als Begleitpersonen in der Poliklinik für Hals-Nasen-Ohrenheilkunde der Universität zu Köln eingefunden haben. Einziges Ausschlusskriterium für die Teilnahme an der Studie ist ein maligner Befund im Mund-RachenRaum. Anhand eines Fragebogens über Lebensgewohnheiten und Risikofaktoren soll bei dieser Arbeit eine Analyse über Risikofaktoren im Zusammenhang mit einer HPV-Infektion erhoben werden. Gängige Verfahren zur Detektion onkogener HPV-Infektionen sollen miteinander verglichen werden. Neben dem Abstrich aus der Tonsillenloge wird bei allen Teilnehmern eine Mundspülung auf onkogene HPV untersucht. Bei einigen Probanden kann Frischgewebe der Tonsillen gewonnen und untersucht werden. Allen drei Methoden liegt eine 32 HPV-Spezifische PCR zugrunde. Material und Methoden 2 Material und Methoden 2.1 Patienten / Klinische Daten In die Studie wurden Patienten und zum Teil deren Angehörige eingeschlossen, die auf Grund unterschiedlichster Leiden die Poliklinik für Hals-Nasen-Ohren-Heilkunde der Universität zu Köln aufsuchten. Das wichtigste Ausschlusskriterium für die Teilnahme an der Studie waren Tumorerkrankungen im Naso- und Oropharynx. Eine weitere Bedingung war die Volljährigkeit. Vor Probenentnahme wurden alle Teilnehmer aufgeklärt und um ihre schriftliche Einwilligung gebeten. Die Abstriche wurden mit Hilfe von Cytobrush aus der linken und aus der rechten Tonsillenloge gewonnen. Für die Mundspülung erhielten die Teilnehmer ein 50 ml Röhrchen mit jeweils 10 ml isotonischer Natriumchlorid-Lösung, mit der sie 60 Sekunden lang kräftig spülen sollten. Die Biopsien wurden von Patienten der Klinik und Poliklinik für Hals-NasenOhren-Heilkunde gewonnen, die zu einer geplanten Tonsillektomie in die Klinik aufgenommen waren. Sie wurden am Vortag der Operation aufgeklärt und unterschrieben die Einverständniserklärung. Es wurden ebenfalls Abstriche beider Tonsillen und eine Mundspülung genommen. Von den entfernten Tonsillen wurde die PE entnommen. Zur Datenerhebung Sexualverhalten von und - Risikofaktoren, bei weiblichen Lebensgewohnheiten, Teilnehmerinnen - Empfängnisverhütung und Cervix uteri-Status wurde den Teilnehmern ein standardisierter Fragebogen vorgelegt. Dieser bestand aus insgesamt 65 Fragen, wobei sich 11 Fragen ausschließlich an die weiblichen Studienteilnehmerinnen richteten. Das Kollektiv beinhaltete 28 (36,4%) Männer und 49 (63,6%) Frauen. Das Alter lag zwischen 18 und 85 Jahren bei durchschnittlich 43,69 Jahren. Geschlecht Patienten % gesamt 77 100 männlich 28 36,4 weiblich 49 63,6 Tab. 7: Geschlechterverteilung der Probanden 33 Material und Methoden 2.2 Probenbehandlung Nach der Entnahme wurden die Abstriche 2 Stunden an der Luft getrocknet, danach wurden zu dem Cytobrush-Bürstchen 1 ml PBS-Puffer zugegeben. Nach gründlichem Vortexen wurde die Cytobrush-Bürste aus dem Röhrchen entfernt und die verbleibende Menge PBS bei 6000 rpm 15 min zentrifugiert. Der Überstand wurde verworfen, das Pellet wurde zusammen mit 200 µl PBS-Puffer in ein 1,5 ml Eppendorf Reaktionsgefäß überführt. Die Aufbewahrung erfolgte bei -80°C. Bei den Mundspülungen wurde ohne Zugabe von PBS-Puffer eine 15minütige Zentrifugation bei 600 rpm durchgeführt. Der Überstand wurde verworfen und das Pellet mit 200 µl PBS Puffer versetzt und in einem 1,5 ml Eppendorf-Reaktionsgefäß überführt. Auch hier erfolgte die Aufbewahrung bei -80 °C. Das entnommene Tonsillengewebe wurde zunächst ohne weitere Behandlung bei -80° C aufbewahrt. 2.3 Materialien für die PCR 2.3.1 Chemikalien Ampuwa Fresenius Heidelberg dATP, dCTP, dGTP, dTTP Roche Molecular Biochemicals, Mannheim di-Natriumhydrogenphosphat Merck, Darmstadt DNA Typing Grade Agarose Invitrogen, Karlsruhe Ethanol (99,8%) Carl Roth GmbH, Karlsruhe Ethidiumbromid Serva, Heidelberg Natriumdihydrogenphosphat Merck, Darmstadt NuSieve 3:1 Agarose FMC Bio Products Biozym, Hameln 2.3.2 Enzyme und Proteine Platinum Taq DNA-Polymerase Invitrogen, Karlsruhe Ampli-Taq DNA-Polymerase Perkin Elmer, USA Taq DNA-Polymerase Pharmacia Biotech, Freiburg Proteinase K mit 10x Puffer Qiagen, Hilden RNase A mit Puffer 50mM Tris/HCl (pH 8.0) 10 mM EDTA 5% Tween 20 34 i Material und Methoden 2.3.3 Oligonukleotide Oligonukleotide wie PCR-Primer oder Sequenzierprimer wurden von Invitrogen (Karlsruhe) oder Eurogentec (Seraing, Belgien) bezogen oder entstammten Reagenzien-Kits. Als Sonden verwendete Oligonukleotide wurden von TIB MolBiol (Berlin) bezogen, entstammten Reagenzien-Kits oder wurden von den kooperierenden Laboren zur Verfügung gestellt. PCR-Primer für den qualitativen HPV-Nachweis (General Primer) Name Oligonukleotidsequenz ß-glob.1 CAA-CTT-CAT-CCA-CGT-TCA-CC ß-glob.2 GAA-GAG-CCA-AGG-ACA-GGT-AC A5-fw TAT-TYT-SCT-WCT-CCY-AGT-GG A6-fw GCM-CAG-GGM-CAY-AAY-AAT-GG A8-bw CAA-ART-TCC-ART-CYT-CAA-A A10-bw CKT-CCC-AAR-GGA-WAY-TGR-TC GP5+ TTT-GTT-ACT-GTG-GTA-GAT-ACT-AC GP6+ GAA-AAA-TAA-ACT-GTA-AAT-CAT-AAT (40) (A/C=M; A/G=R; A/T=W; C/G=S; C/T=Y; G/T=K) 2.3.4 Gebrauchsfertige Reagenziensysteme und Chemikalien Für einige Standardreaktionen/-verwendungen der Molekularbiologie werden Reagenziensätze angeboten. Um standardisierte und optimale Reaktionen zu ermöglichen, wurden diese gebrauchsfertigen Reagenziensysteme für bestimmte Schritte Polymerasekettenreaktion verwendet. Quiamp DNA mini kit Qiagen, Hilden QIAamp Tissue Kit Qiagen, Hilden QIAquick Gel Extraction Kit Qiagen, Hilden QIAquick PCR Purification Kit Qiagen, Hilden Gel loading solution Type Sigma d NTP Mix with dTTP 10 mM Applied Biosystems (2, 5 mM each) AmpliTaq DNA polymerase Applied Biosystems with GeneAmp/ 10x PCR Buffer Aqua B. Braun – Spüllösung Ecotainer 35 der Material und Methoden 2.3.5 Puffer und Lösungen 50x TAE Invitrogen, Karlsruhe 2 M TRis-Acetat, 0,05 M EDTA Probenpuffer 10x / Farbmarker 50 ml Glycerin, 3 ml 5%ige BromphenolBlaulsg., 3 ml 5%ige Xylen-Cyanol-Lösung, 0,2 ml 50x TAE, 1,3 ml H2O Ethidiumbromidstammlösung 10 mg/ml Aqua bidest. Phosphatpuffer (PBS) Stammlösung Dinatriumhydrogen-Phosphat-Dihydrat 28,8 g/dl Na-Hydrogen-Phosphat-Monohydrat 5,2 g/l Natriumchlorid 17,53 g/l 2.3.6 Software und Laborgeräte Software SPSS 17.0 SPSS Inc., II USA Microsoft Office Microsoft Blast-Search NCBI Easy Image Plus Herolab, Wiesloch EndNote 7.0.0 (Bld. 98) Thomson Isi Reseachsoft Laborgeräte Biometra Trio Thermocycler Biometra, Göttingen Elektrophorese-Kammern Biometra, Göttingen Eppendorf Thermomixer 5436 Eppendorf, Hamburg Heizplatte OMNILAB PST 100 Jürgens, Darmstadt Inkubator B5061 EC CO2 Heraeus, Hanau Magnetrührer Ikamag RCT IKA-Labortechnek, Satfen i. Brsg. Pipettierhilfen: Eppendorf Reference Pipetten Eppendorf, Hamburg Multipette 4780 Eppendorf, Hamburg Vortexer REAX2000 Heidolph Elektro GmbH, Kehlheim GFL Wasserbad GFL, Burgwedel Julabo 12 B Julabo, Seelbach Tischzentrifugen: Eppendorf Zentrifuge 5415 C Pico Fuge Eppendorf, Hamburg Stratagene, La Jolla, CA, USA Kühlzentrifuge Sigma-Zentrifuge 2K15 Sigma, Deisenhofen 36 Material und Methoden 2.4 Die Polymerasekettenreaktion (PCR) Die Polymerasekettenreaktion ermöglicht das Vervielfältigen (polymerase von chain reaction, Nukleinsäuresequenzen PCR) genau definierter Länge und Basenfolgen. Die Amplifikation erfolgt in vitro unter Zugabe von spezifischen Primern. Es werden zur Vervielfältigung der Ausgangs-DNA drei Zyklen wiederholt durchlaufen. Mit jedem Zyklus verdoppelt sich die Anzahl an DNA Doppelsträngen. 1. Denaturierung: Durch Erhitzen des zu vervielfältigenden Genoms auf 95 °C wird die DNA denaturiert und der DNA-Doppelstrang wandelt sich in zwei voneinander getrennte Einzelstränge um, so dass die Anlagerung von Primern ermöglicht wird. 2. Primerhybridisierung: Die Temperatur wird auf 50-65°C gesenkt, sodass sich die Primer anlagern können. 3. Elongation: Mit Hilfe der thermostabilen DNA Polymerase werden Nukleotide, am Primer beginnend, bei 72 °C an den jeweiligen Einzelstrang komplementär angelagert. Die Synthese erfolgt in 5'3' Richtung. 2.4.1 Methoden der PCR DNA-Extraktion Für die DNA-Extraktion aus den Mundspülungen, Abstrichen und dem Tonsillengewebe wurden Standardmethoden der Molekularbiologie angewendet. Hierzu wurde das „Qiaquick Gel Extraktion Kit“ (Qiagen) verwendet, alle Arbeitsschritte wurden nach Herstellerprotokoll durchgeführt. 37 Material und Methoden Photometrische DNA-Konzentrationsmessung Die Konzentration von DNA und RNA wurde photometrisch bestimmt. Dazu wurde die DNA-Präparation in TE-Puffer verdünnt und ihre Absorption im UV-Spektrometer bei einer Wellenlänge von 260nm gemessen. Als Kriterium für die Verunreinigung der Präparation mit Proteinen oder RNA wurde der Quotient der Absorptionen bei 260 nm (DNA) und bei 280 nm (Proteine) bestimmt. Dabei wurde angenommen, dass bei einem A260: A280- Verhältnis zwischen 1,8 und 1,95 reine DNA vorliegt und dass bei Werten kleiner als 1,8 mit Proteinverunreinigungen und bei Werten größer als 1,95 DNA mit RNA-Verunreinigungen gerechnet werden muss (66). 2.4.2 Durchführung der PCR 2.4.2.1 ß-Globin-Gen-PCR Den Nachweis über vorhandene DNA aus den unterschiedlichen Proben liefert die ß-Globin-PCR. Grundlage hierfür liefert die Tatsache, dass in jeder Zelle ein 269 bp langer DNA-Abschnitt vorliegt, der amplifiziert wird und bei Vorhandensein intakter DNA ein positives Ergebnis liefert. In einigen Proben konnte keine DNA nachgewiesen werden. Das Gesamt-Reaktionsvolumen von 50 μl für die beta-Globin-PCR setzte sich folgendermaßen zusammen: 10 μl aufgereinigte DNA 5 μl dNTP-Mix, 2 mM 5 μl 10x Perkin Elmer Puffer 1 μl beta-Globin 1-Primer, 25 μM 1 μl beta-Globin 2-Primer, 25 μM 0,5 μl Ampli Taq (1U) 27.5 μl destilliertes Wasser Die Endkonzentration der Primer betrug 0,5 μM, die der dNTPs betrug 200 μM. 38 Material und Methoden K+= Positivkontrolle; K- = Negativkontrolle; Nr. = Probanden-Nr. A. re = Abstrich rechts; A. li = Abstrich links; MS = Mundspülung Abb. 9: ß-Globin-PCR nach Agarosegelelektrophorese Abb. 10: ß-Globin-PCR nach Agarosegelelektrophorese von Tonsillengewebe 39 Material und Methoden 2.4.2.2 Nested-PCR mit A5/A10- und A6/A8-Primern Die nested-PCR stellt einen hochsensiblen qualitativen Nachweis über vorhandenes HPV-Genom dar. Sie weist ca. 90 % aller HPV-Typen nach und besteht aus zwei hintereinander durchgeführten PCRs. Das Amplikon des ersten Reaktionsansatzes wird als Templet im zweiten Reaktionsansatz eingesetzt. Die inneren Primer hybridisieren innerhalb der Sequenz, die durch die äußeren Primer flankiert ist. Durch diese zwei aufeinander aufbauenden PCRs können wesentlich geringere Mengen der AusgangsDNA vervielfältigt und nachgewiesen werden. Außerdem erhöht sich die HPV-Spezifität dadurch, dass unspezifische Genom-Kopien in der zweiten PCR nicht weiter repliziert werden können. Die unspezifischen Amplikons der ersten PCR bieten den inneren Primern der zweiten PCR nicht genügend komplementäre Sequenzen zur Anlagerung und liefern somit keine Matrize. Bei jedem PCR-Ansatz wurden außer den zu untersuchenden Proben jeweils eine Positiv- und eine Negativ-Kontrolle mit untersucht. Als Positiv-Kontrolle diente dabei ein HPV-16 Plasmid, bei den NegativKontrollen wurde reines destilliertes Wasser eingesetzt. Das Gesamt-Reaktionsvolumen von 50 μl für die PCR I der ß-Globin-PCR setzte sich folgendermaßen zusammen: 5 μl aufgearbeitete DNA 5 μl 10x PCR-Puffer 5 μl dNTP-Mix, 2 mM 5 μl A5-fw, 10 μM 5 μl A10-bw, 10 μM 0,5 μl AmpliTaq DNA Polymerase (2,5 U) 24,5 μl destilliertes Wasser Die Endkonzentration der Primer betrug 0,5 µM, die der dNTPs 200 µM. 40 Material und Methoden Die Reaktionszyklen der ersten PCR wurden wie folgt durchgeführt: Zyklen Denaturierung Annealing Synthese (72°C) (95 °C) 1x 3 min. 5x 45 sec 45 sec (50°C) 90 sec 30x 45 sec 45 sec (56°C) 90 sec Das Produkt der ersten PCR mit den Primern A5/10 ist 526 bp groß. 3µl des PCR-Produktes aus der ersten PCR wurde zur weiteren Amplifikation wie folgt mit den inneren Primern versetzt: 3 μl externes PCR-Produkt 5 μl 10x PCR-Puffer 5 μl dNTP-Mix, 2 mM 5 μl A6-fw, 10 μM 5 μl A8-bw, 10 μM 0,5 μl AmpliTaq DNA Polymerase (2,5 U) 26,5 μl destilliertes Wasser Nun folgte der Reaktionszyklus der zweiten PCR nach dem Schema: Zyklen Denaturierung Annealing (56°C) Synthese (72°C) 45 sec 90 sec (95 °C) 1x 3 min. 35x 45 sec Das Produkt der zweiten PCR mit den Primern 6/8 ist 271 bp groß. 41 Material und Methoden Abb. 11: Agarosegelelektrophorese des ersten (links) und des zweiten (rechts) Reaktionsansatzes. Die K+Stammlösung mit HPV-Plasmid wurde immer weiter verdünnt (V.1-V.9). Diese Verdünnungsreihe veranschaulicht die hohe Sensitivität dieser PCR, bei der auch sehr geringe Mengen an DNA detektiert werden können. 2.4.2.3 GP5+/GP6+-PCR Bei fraglichem Ergebnis der nested-PCR wurde zusätzlich noch eine weitere HPV-spezifische PCR durchgeführt. Das Produkt der GP5+/GP6+PCR ist nur 109 bp groß und schließt falsch-negative Ergebnisse aus, wenn die ausgangs DNA fragmentiert vorlag. Zur Erhöhung der Sensitivität und Spezifität wurde die PCR unter „hot-start“-Bedingungen durchgeführt. Hier wird dem Mastermix ein Antikörper gegen DNA-Polymerase hinzugefügt, der erst bei der Prädenaturierung inaktiviert wird. Dadurch wird verhindert, dass sich Primer während des Pipettierens der Proben unspezifisch anlagern. 42 Material und Methoden Der 50µl Ansatz enthielt: DNA-Matrize 7,5 µl des Eluats Primer I 25 pmol Primer II 25 pmol dNTPs je 200µM TaqStart antibody (Clontech) 56 pM Paq-Polymerase 2U 10xPCR Puffer (+1,5mM MgCl2) 5µl Wasser (bidest.) Die Taq-Polymerase ad 50µl wird mit dem Taq-Antikörper 5 min bei Raumtemperatur inkubiert. Die Reaktionszyklen der GP5+/GP6+-PCR wurden wie folgt durchgeführt: Zyklen Denaturierung (95 Annealing (45°C) Synthese (72°C) 30 sec 1 min °C) 1x 3 min. 40x 30 sec 1x 3 min Das Produkt der GP5+/GP6+-PCR 109 bp groß. 2.4.3 Zur DNA-Sequenzierung Typisierung der nachgewiesenen HPV-Typen wurden DNA- Sequenzierungen durchgeführt. Diese erfolgten im Servicelabor des Zentrums für Molekulare Medizin Köln (ZMMK)/ Virologie Universität Köln. Dabei wurde nach der Taq FS BigDye-Terminator Cycle Sequencing Methode gearbeitet und auf einem ABI PrismTM 377 DNA Sequenzer der Firma Applied Biosystems gemessen. Die erhaltenen Sequenzen wurden mit der Software McVector 6.5 bzw. BLAST identifiziert. 43 Material und Methoden 2.4.4 Agarosegelelektrophorese Um die Länge sowie die Sauberkeit des in der PCR amplifizierten DNAStranges zu überprüfen, wurde eine Agarosegelelektrophorese durchgeführt. Die Gele wurden folgendermaßen vorbereitet: 2 %ige Agarosegele wurden mit TAE Puffer aufgekocht, bis die Agarose völlig klar war. Nun wurde 0,1 μg/ml Ethidiumbromid zugegeben. In einen Gelschlitten wurde die abgekühlte Agarose ca. acht Millimeter hoch gegossen. Die Geltaschen waren jeweils 1,5 mm breit. Jetzt konnten jeweils 10 μl PCRProdukt und 0,7 μl Probenpuffer aufgetragen werden. In einer Geltasche lief eine 100 bp Leiter als Referenz mit. Die Elektrophorese wurde mit TAE Puffer bei einer Laufzeit von einer Stunde, einer Spannung von 110 Volt sowie einer Stromstärke von 125 Ampere durchgeführt. Anschließend wurde das Gel gefärbt, unter UV Licht mit einer Wellenlänge von 312 nm betrachtet und zur Dokumentation fotografiert. 2.5 Statistische Analyse Die statistischen Auswertungen wurden mit Hilfe von SPSS 17.0 für Windows (Chicago, Inc., II USA) durchgeführt. Unterschiede in Häufigkeiten wurden mit dem Chi-Quadrat-Test nach und dem Exakten Test nach Fisher detektiert. Die Durchschnittswerte der Variablen wurden mit dem Student t-Tests für ausgewertet. Ein p-Wert unter 0,05 wurde als signifikant gewertet. 44 Ergebnisse 3 Ergebnisse 3.1 Deskriptive Statistik des Patientenkollektivs Das Kollektiv beinhaltete 28 (36,4%) Männer und 49 (63,6%) Frauen. Geschlecht Patienten % Total 77 100 männlich 28 36,4 weiblich 49 63,6 Tab.8: Geschlechterverteilung des Kollektivs Das Alter lag zwischen 18 und 85 Jahren bei durchschnittlich 43,69 Jahren. Histogramm Durchschnitt: 43,69 J. Std-Abw.: 16,652 Häufigkeit N= 77 Alter der Probanden zum Untersuchungszeitpunkt (Jahre) Abb. 12: Altersverteilung des untersuchten Kollektivs Von dem untersuchten Kollektiv kamen 15 Patienten zur Tonsillektomie in die HNO-Klinik. Jeweils wurde von der rechten und der linken Tonsille eine PE entnommen und nach beschriebenen Methoden bearbeitet. Das entspricht prozentual 19,5 % des Kollektivs, wohingegen 80,5 % der Studienteilnehmer ohne Tonsillektomie in die Studie eingeschlossen wurden. 45 Ergebnisse Häufigkeit % Ja 15 19,5 Nein 62 80,5 Total 77 100,0 Tab. 9: Patienten mit Tonsillektomie Bei 26 Studienteilnehmern (33,8 %) war in mindestens einer untersuchten Probe die ß-Globin-PCR negativ, d. h. aus diesen Proben konnte keinerlei DNA nachgewiesen werden. Bei keinem der Teilnehmer waren alle drei bzw. fünf Proben (falls Tonsillengewebe vorlag) in der ß-Globin-PCR negativ. Die Proben mit negativer ß-Globin-PCR wurden nicht weiter auf HPV-Genom untersucht. Häufigkeit % negativ 26 33,8 positiv 51 66,2 Total 77 100,0 Tab. 10: ß-Globin-PCR negativ 3.2 Prävalenz onkogener HPV im Oropharynx bei Patienten ohne Tumorerkrankung Im untersuchten Kollektiv konnte bei drei von den insgesamt 77 untersuchten Probanden onkogene HPV nachgewiesen werden, was 3,9 % entspricht. Die HPV-Typisierung ergab, dass alle drei Probanden Träger von HPV 16 waren, somit von High-risk-HPV. Bei einem weiteren Probanden wies die nested-PCR zwar HPV nach, jedoch ergab eine genauere Typisierung den HPV Typ 11. Dieser HPV-Typ zählt im Allgemeinen nicht zu den Papillomaviren mit onkogenem Potential und wird hier in der weiteren Auswertung daher nicht näher berücksichtigt. Auffallend ist, dass alle Nachweise von onkogenen HPV aus Abstrichen aus der Tonsillenloge gelangen. Obwohl von den HPV-positiven Probanden ebenso die Mundspülung untersucht wurde, war hier zwar die ß-Globin-PCR positiv, jedoch konnte kein HPV-Genom nachgewiesen werden. 46 Ergebnisse Häufigkeit % HPV positiv 3 3,9 HPV negativ 74 96,1 Total 77 100,0 Tab. 11: onkogene HPV positiv Zwei der Studienteilnehmer mit HPV-16-Nachweis sind männlichen, eine weiblichen Geschlechts. Das durchschnittliche Alter dieser drei Probanden zum Untersuchungszeitpunkt betrug mit 59,67 Jahre etwas mehr als das Durchschnittsalter der HPV-negativen Gruppe, bei der der Altersdurchschnitt bei 43,04 Jahren lag. Der jüngste HPV-positive Patient war zum Untersuchungszeitpunkt 40, der älteste 85 Jahre alt (Abb. 13). Beim Vergleich des Durchschnittsalters beträgt die Standardabweichung der HPV-positiven Studienteilnehmer 23,03, die der HPV-negativen 16,23. Der durchschnittliche Altersunterschied zeigt mit einem p-Wert von 0,90 einen Trend, jedoch keine Signifikanz (Tab. 12). Abb. 13: Altersverteilung der HPV-16-positiven Patienten im Vergleich zum Gesamtkollektiv 47 Ergebnisse Auch beim Vergleich der durchschnittlich angegebenen Jahre, die sich die Studienteilnehmer in der Schule oder Ausbildung befanden, fällt ein Unterschied zwischen HPV-positiven und den HPV-negativen Teilnehmern auf. Während sich die HPV-negativen Studienteilnehmer 13,20 Jahre mit einer Standardabweichung von 4,51 in der Ausbildung befanden, gaben HPV-positive Teilnehmer eine durchschnittliche Ausbildungszeit von 15,33 Jahren an. Hier betrug die Standardabweichung 4,27. Die Angaben rangieren zwischen 11 und 20 Jahren. Der Unterschied zwischen den Gruppen gilt mit einem p-Wert von 0,401 als nicht signifikant (Tab. 12; Abb. 14). HPV-Status negativ Merkmal positiv Std.-Abw. p (Student t-Test) Std.-Abw. Durchschnittsalter (Jahre) 59,67 23,03 43,04 16,23 0,90 Durchschnittliche Dauer der Ausbildung (Jahre) 13,20 4,51 15,33 4,27 0,40 Tab. 12: Alter und Ausbildungsdauer der HPV-16-positiven und -negativen Probanden Abb. 14: Ausbildungsdauer der HPV-16-positiven Patienten im Vergleich zum Gesamtkollektiv 48 Ergebnisse Die Angaben zum Bruttojahreseinkommen erfolgten in einer ordinal angeordneten Reihenfolge von unter 40.000 € bis über 120.000 € im Jahr, die in vier Gruppierungen erfolgen sollte. Studienteilnehmer, die diese Frage nicht beantworten wollten oder konnten, wurden einer fünften Gruppe zugeordnet, in der sich insgesamt 21 Teilnehmer (27 %) befanden. Insgesamt drei (4,1 %) der befragten Personen machte keinerlei Angabe zu dieser Frage. Mit 41,9 % der HPV-negativen Teilnehmer befindet sich der größte Anteil dieser Kollektivgruppe in der niedrigsten Einkommensstufe, wohingegen HPV-positive Studienteilnehmer nur in der Einkommensgruppe 40.000 bis 80.000 € zu finden waren (Tab. 13). HPV-Status Merkmal negativ positiv < 40.000 31 / 74 (41,9%) 0/3 40.000-80.000 12 / 74 (16,2 %) 2/3 (66,7 %) 80.000-120.000 2 / 74 (2,7 %) 0/3 >120.000 6 / /74 (8,1 %) 0/3 möchte ich nicht beantworten 20 / 74 (27 %) 1/3 (33,3 %) fehlende Angabe 3 / 74 ( 4,1%) 0/3 Einkommen (€) Tab. 13: Einkommensverteilung 3.2.1 Nachweis onkogener HPV aus Mundspülungen Obwohl lediglich bei drei der insgesamt untersuchten Mundspülungen die ß-Globin-PCR negativ war, d.h. nur bei drei der untersuchten Mundspülungen grundsätzlich kein DNA-Nachweis erbracht werden konnte, war keine der auf HPV untersuchten Mundspülungen (96,1%) HPV-positiv, obwohl im Vergleich zu den Mundspülungen bei Abstrichen HPV-Genom nachgewiesen werden konnte. 49 Ergebnisse 3.2.2 Nachweis onkogener HPV in Abstrichen aus der Tonsillenloge Wie bereits oben erwähnt, gelang der Nachweis onkogener HPV aus Abstrichen, die den Probanden beidseits aus der Tonsillenloge entnommen wurden, bei drei der 77 Studienteilnehmern (3,9 %). Zwei Nachweise gelangen aus der linken Tonsillenloge, einer aus der rechten Tonsillenloge, jedoch bei keinem der Probanden war die HPVspezifische PCR auf beiden Seiten positiv. Abb. 15: Nested-PCR von Abstrichen und Mundspülungen mit HPV-Nachweis 50 Ergebnisse Abb. 16: Nested-PCR von Abstrichen und Mundspülungen mit HPV-Nachweis 3.2.2.1 Nachweis onkogener HPV aus Biopsien der Tonsillen Von 15 Probanden (19,5 %) wurde Tonsillengewebe beider Tonsillen auf HPV untersucht. Zunächst wurde ein DNA-Nachweis jeder einzelnen Gewebeprobe durch eine ß-Globin-PCR gesichert. Die im Folgenden durchgeführte HPV-spezifische nested-PCR erbrachte bei keiner der untersuchten Gewebeprobe einen positiven HPV-Befund. Auch die Mundspülungen und die beidseits abgenommenen Abstriche dieser 15 Patienten enthielten keine HPV-DNA. Damit besteht keine Möglichkeit, die verschiedenen gewonnenen Proben untereinander zu vergleichen. 51 Ergebnisse Abb. 17: Nested-PCR nach Agarosegelelektrophorese von Tonsillengewebe, kein Nachweis von HPV-Genom 3.3 Untersuchungen zu Risikofaktoren für die HPV-Infektion Bei der Befragung der Lebensgewohnheiten gaben 53 (71,6 %) der HPVnegativen Probanden an, aktuell oder zuvor in ihrem Leben einmal verheiratet gewesen zu sein, bei den HPV-positiven Probanden traf das auf alle (100 %) zu. Der exakte Test nach Fischer ergab einen p-Wert von 0,38, womit der Unterschied in diesem Vergleich als nicht signifikant gilt. Nur insgesamt vier Studienteilnehmer (5,6 %) gaben an, jemals in ihrem Leben kortisonhaltige Präparate benutzt zu haben (Tabletten mehr als 3 Monate oder kortisonhaltiges Nasenspray über längere Zeit). Alle dieser Probanden waren HPV-negativ. Die Frage, ob jemals im Leben regelmäßig geraucht wurde, bejahten 46 HPV-negative Personen des Kollektivs (74 %), und zwei der drei Personen (66,7 %), bei denen HPV nachgewiesen werden konnte. Der p-Wert beträgt 0,68 und weist damit keine Signifikanz auf. Regelmäßigen Alkoholkonsum von einem oder mehreren alkoholischen Getränken pro Woche über mindestens ein Jahr gaben 38 HPV-negative Probanden (52,8 %) an und keiner der HPV-positiven Probanden (0 %). Der 52 Ergebnisse p-Wert liegt bei diesem Vergleich bei 0,12 und lässt allenfalls eine Tendenz erkennen, weist jedoch keinen signifikanten Unterschied auf. Bei positiver Antwort auf eine generelle Warzen- oder Kondylomanamnese wurden typische Lokalisationen wie Hände, Füße, Gesicht, Genitalregion oder andere Körperregionen abgefragt, die jedoch bei der Auswertung alternativ in „vorhanden“ oder „nicht vorhanden“ zusammengefasst wurden. Auch hier sind die Ergebnisse nicht signifikant. 56,8 %, d.h. 42 HPVnegative Probanden hatten eine positive Warzenanamnese. Gleiches galt für einen (33,3 %) der HPV-positiven Probanden. Der errechnete p-Wert liegt bei 0,41 und somit ist der Unterschied zwischen den verglichenen Gruppen auch hier als nicht signifikant anzusehen (Tab. 14). HPV-Status Merkmal negativ positiv 53 / 74 3/3 71,6 % 100 % 4 / 71 0/3 5,6 % 0% 46 / 74 2/3 62,2 % 66,7% 38 / 72 0/3 52,8 % 0% 42 / 74 1/3 56,8 % 33,3 % Jemals verheiratet gewesen (exakter Test nach Fischer) 0,38 Jemals Kortison eingenommen 0,89 Jemals geraucht Jemals regelmäßig konsumiert p 0,68 Alkohol 0,12 Jemals Warzen gehabt 0,41 Tab. 14: Risikofaktoren 1 53 Ergebnisse Die weiblichen Studienteilnehmerinnen wurden zusätzlich noch über Einnahmemodalitäten von Hormonen befragt. Dazu zählen die Einnahme der Antibabypille und die jeweilige Dauer in Monaten, anderweitige hormonelle Kontrazeptiva sowie eine eventuelle postmenopausale hormonelle Substitution. Von den insgesamt 49 weiblichen Probandinnen beantworteten drei diese Frage nicht, 38 (82,6 %) gaben an, jemals einmal Hormone angewendet zu haben oder auch aktuell anzuwenden. Die Dauer dieser Anwendung betrug im Mittel 101,08 Monate, sie rangiert zwischen zwei und 360 Monaten. 8 Frauen (17,4 %) verneinten die Frage. Die Patientin mit einem positiven HPV-16- Nachweis befand sich ebenfalls unter den Frauen, die schon einmal die Antibabypille eingenommen hatten, und gab einen Gesamtzeitraum von 120 Monaten an, was etwas mehr als dem Durchschnittswert entspricht. Von den 49 befragten Frauen beantworteten 6 Frauen (12,5 %) die Frage, ob jemals ein auffälliger Befund des Cervixabstriches vorlag, mit „ja“. 42 Frauen (87,5 %) verneinten diese Frage, eine Antwort fehlt. Die Probandin mit dem positiven HPV-16-Abstrich gab an, niemals einen auffälligen Gebärmutterhalsabstrich gehabt zu haben. Beim weiteren Vergleich der Risikofaktoren zwischen der Probandengruppe, die einen negativen und einen positiven HPV-16Nachweis hatten, fällt auf, dass das mittlere Alter, mit dem eine sexuelle Aktivität aufgenommen wurde, bei der HPV-16-negativen Gruppe bei 17,54 Jahren, das der HPV-16-positiven Gruppe bei 17 Jahren lag. Der mit dem Student-t-Test berechnete p-Wert beträgt 0,7. Der Unterschied gilt damit als nicht signifikant. Ebenso fällt auf, dass bei der Frage nach der Anzahl der Geschlechtspartner die Angaben zwischen den unterschiedlichen Gruppen leicht variieren. Die HPV-negativen Probanden gaben an, mit durchschnittlich 7,03 Partnern Geschlechtsverkehr gehabt zu haben, der Mittelwert der HPV-positiven Probandengruppe lag mit 8,67 Geschlechtspartnern etwas darüber. Die Standardabweichung betrug 10,31 bei der HPV-16-negativen Gruppe und 8,15 bei der HPV-positiven Gruppe. 54 Ergebnisse Auf Grund der niedrigen Fallzahlen kann man mit dieser Aussage allerhöchstens einen Hinweis, jedoch keine signifikanten Unterschiede erkennen. Der p-Wert ist 0,79 (Tab. 15). HPV-Status Merkmal negativ p positiv Std.-Abw. (Student t-Test) Std.-Abw. Durchnittliches Alter bei der Kohabitarche 17,54 2,36 17,0 1,73 0,69 Durchschnittliche Anzahl der Sexualpartner 7,03 10,31 8,67 8,15 0,79 Tab.15: Vergleich der Durchschnittswerte der Risikofaktoren 55 Diskussion 4 Diskussion 4.1 Methodenkritische Diskussion 4.1.1 Untersuchungsgut Bei den Studienteilnehmern handelt es sich um ein relativ unselektiertes Normalkollektiv aus erwachsenen Männern und Frauen, die sich auf Grund unterschiedlicher Beschwerden zum Zeitpunkt der Untersuchungen in der Poliklinik für Hals-Nasen-Ohrenheilkunde befanden. Die einzigen Selektionskriterien lagen beim Ausschluss maligner Tumorerkrankungen des Oropharynx und der Voraussetzung der Volljährigkeit (>18 Jahre). Der Altersdurchschnitt der teilnehmenden Probanden lag in dieser Arbeit bei 43,69 Jahren. Dieser Durchschnitt entspricht annähernd dem aktuellen Altersdurchschnitt in der Bundesrepublik Deutschland. Laut Angaben des statistischen Bundesamtes lag der Altersdurchschnitt der in Deutschland lebenden Männer und Frauen im Jahr 2007 bei 43,43 Jahren, 2008 bei 43,67 Jahren. 4.1.2 Fragebogenerhebung Eine hohe Rücklaufquote und ein annähernd lückenloses Ausfüllen der Fragebögen wurden dadurch erreicht, dass die Fragebögen größtenteils von der Autorin persönlich an die Probanden verteilt und wieder entgegengenommen wurden. Während der Bearbeitung der Fragebögen durch die Probanden stand die Autorin für Rückfragen zur Verfügung. Bei einigen Patienten bestanden Schwierigkeiten beim eigenständigen Ausfüllen der Fragebögen, sodass in diesen Fällen die Befragung in Form eines Interviews durchgeführt wurde. Diese Schwierigkeiten wurden vor allen Dingen bei älteren Patienten beobachtet, während die jüngeren Probanden alle Fragen selbstständig und problemlos beantworten konnten. Daher ist anzunehmen, dass die Schwierigkeiten nicht auf Grund von unverständlich gestellten Fragen zustande kamen, sondern mehr auf ein nachlassendes Auffassungsvermögen im Alter beruhten. Insbesondere die Fragen, die das Sexualverhalten und die Anzahl der Geschlechtspartner betrafen, blieben in einigen Fällen unbeantwortet. 56 Diskussion 4.1.3 Nachweisverfahren In vielen Studien, die sich mit dem Nachweis von Humanen Papillomaviren beschäftigt haben, wurden unterschiedliche Nachweisverfahren miteinander verglichen. Als Methoden zur Untersuchung von HPV-Infektionen stehen unter anderem Hybridisation (z.B. Southern Blot, in-situ-Hybridisation, Fluoreszenz-in-situ-Hybridisierung) oder die Polymerase Chain Reaction (PCR) zur Verfügung. Bei Hybridisierungstest erfolgt der Nachweis von DNA ohne vorherige Amplifikation der Ziel-DNA. Da insbesondere bei den untersuchten Mundspülungen sowie den Abstrichen davon ausgegangen werden musste, dass möglicherweise nur wenig DNA für einen Nachweis zur Verfügung stand, erfolgten alle Nachweise in dieser Arbeit mittels PCR (13). Fukushima stellte in seiner Studie, in der er die Hybridisation der PCR gegenüberstellte, eine deutliche Überlegenheit der PCR fest (18). Bei der Benutzung entsprechend sensitiver PCR-Protokolle können bereits 1 bis 10 virale Genom-Kopien nachgewiesen werden (89). Zur Detektion von HPV-DNA stehen verschiedene PCR-Protokolle mit hochsensitiven Primern zur Verfügung. Neben der hier zur Anwendung gekommenen nested-PCR mit den Primern A5/A10-A6/A8 haben sich im Laufe der letzten Jahre die miteinander vergleichbaren PCR-Protokolle mit den Primern MY09/MY11 oder den Primern GP5+/GP6+ durchgesetzt (7); (8); (13); (18); (62); (76). Sie eignen sich insbesondere bei paraffineingebetteten oder formalinfixierten Proben, da sie ein Produkt liefern, das aus weniger Basenpaaren besteht als das der nested-PCR mit den Primern A5/A10-A6/A8 und somit auch stark beschädigte und fragmentierte DNA nachweisen können (40). Da das zu untersuchende Material in der vorliegenden Arbeit ausschließlich aus Frischgewebe bestand, wurden zunächst alle Proben mit der nested-PCR mit den Primern A5/A10-A6/A8 auf HPV-Genom untersucht. Es ist sicherlich von großer Bedeutung, auch aus kleinsten Mengen an DNA-Kopien einen möglichen HPV-Nachweis zu erlangen. 57 Diskussion 4.2 Prävalenz onkogener HPV im Oropharynx bei Patienten mit und ohne Tumorerkrankung Die Angaben in der Literatur über die Prävalenz onkogener HPV im Mundund Rachenraum von Patienten mit und ohne Tumorerkrankung schwanken stark. Die meisten vorliegenden Studien untersuchten das Vorkommen von High-risk-HPV in Karzinomgewebe des Oropharynx oder der Tonsillen. Eine Aussage über die Prävalenz dieser Viren in tumorfreiem Gewebe erfolgte über die jeweilige Kontrollgruppe, in der sich Probanden ohne Tumorerkrankung befanden (7); (8); (18); (46); (57); (76). Anders als beim Karzinom der Cervix uteri, wo bei fast allen malignen Tumoren eine persistierende HPV-Infektion angenommen wird, wird das Virus nur bei ca. einem Drittel der Karzinome in der Kopf- und Hals-Region für die maligne Entartung verantwortlich gemacht. Zahlreiche Studien haben sich mit dem Nachweis onkogener HPV in Kopf-Hals-Karzinomen beschäftigt und die Angaben über vorhandene HPV-DNA in diesen Tumoren schwanken zwischen 15% und 60%. Der Grund für diese Unterschiedlichkeit der Ergebnisse sind verschiedene Methoden zur Detektion, die Abhängigkeit der genauen Lokalisation des virusbefallenen Areals und die Abhängigkeit von den untersuchten Fallzahlen (7). Eine Studie von Klussmann et al. beschreibt im Mittel bei 25 % aller KopfHals-Plattenepithelkarzinome eine Assoziation mit dem Humanen Papillomavirus. Im Detail wurde in 18 % der Mundhöhlenkarzinome, in 45 % der Oropharynxkarzinome, in 25 % der hypopharyngeal lokalisierten Karzinome, in 8 % der Nasopharynxkarzinome und bei 7 % der Larynxkarzinome das Humane Papillomavirus gefunden. Mit 58 % positivem HPV-Nachweis waren die untersuchten Tonsillenkarzinome auffallend häufig HPV-assoziiert (44). Erklärbar erscheint dieses Ergebnis mit einer erhöhten Vulnerabilität des einschichtigen Kryptenepithels, das die Tonsillen charakterisiert. Im Vergleich zum mehrschichtigen Plattenepithel der oben aufgeführten Kopf-Hals-Regionen können onkogene Papillomaviren am Tonsillengewebe einfacher eindringen, dort persistieren und eine Infektion auslösen. Gillison et al. liefert in einer 253 Patienten umfassenden Studie ähnliche Ergebnisse. Hier wurden bei 26 % der untersuchten Kopf-Hals-Karzinome Humane Papillomaviren nachgewiesen. 58 Diskussion Eine von Kreimer et al. geführte weltweite Metaanalyse stellte gravierende Unterschiede in der Prävalenz HPV-positiver Tumoren in Abhängigkeit zur geographischen Lage, sowie der anatomischen Region dar (48). Während der Anteil HPV-positiver Mundhöhlenkarzinome in Nordamerika und Europa mit ca. 16 % annähernd gleich war, so war dieser in asiatischen Ländern mit 33 % weitaus höher. Beim Oropharynxkarzinom hingegen lag der Anteil der HPV-positiven Tumoren in Europa bei 28,2%, in Nordamerika mit 47 % jedoch signifikant höher. Herrero et al. beschreibt in seiner 10 Länder umfassenden MulticenterStudie bei 18,3% der Oropharynxkarzinome eine Assoziation mit HPV, konnte jedoch nur bei 3,9 % der untersuchten Mundhöhlenkarzinome Humanes Papillomavirus nachweisen. Diese aus Biopsien der Tumoren gewonnenen Ergebnisse verglich er mit zuvor entnommenen Abstrichen der gleichen Regionen und fand heraus, dass nur bei 8,9 % der oropharyngealen Karzinomabstriche und bei 3,9 % der Abstriche von Mundhöhlentumoren HPV-DNA nachzuweisen war. Die Ergebnisse der Abstriche wurden wiederum mit Abstrichen von tumorfreien Kontrollpatienten verglichen und hier lag die Prävalenz für HPV im MundRachenraum bei 6,9 %. Nicht unterschieden wurde bei dieser Studie zwischen den unterschiedlichen HPV-Typen (30). Wie bereits erwähnt, lassen sich zur Prävalenz orophayryngealer HPVInfektion bei Patienten ohne Tumorerkrankung nur wenige Studien finden (7); (8); (18); (76). Strome et al. fand in einer Studie bei einer 48 Personen umfassenden Kontrollgruppe in 3 Fällen HPV-16- DNA, was prozentual 6,3 % entspricht. Die Kontrollpatienten wurden auf Grund einer benignen Hyperplasie der Tonsillen tonsillektomiert (76). Ähnliche Ergebnisse liefert Chen et al. in zwei seiner Studien. In einer 2005 veröffentlichten Studie wurden Tonsillektomiepräparate von 212 zuvor wegen chronischer Tonsillitis oder Tonsillenhypertophie operierten Patienten mittels PCR auf HPV-DNA untersucht. Bei 13 dieser 212 Patienten (6,1 %) wurde HPV-DNA nachgewiesen, wobei es sich in allen Fällen um HPV 16 handelte (7). Eine zweite Studie des Autors verglich den HPV-16-Nachweis bei diesen 212 Patienten, die in der Klinik wegen einer Tonsillitis oder einer benignen 59 Diskussion Tonsillenhypertrophie operiert wurden, mit 189 Kontroll-Patienten, von denen Abstriche aus einer unauffälligen Tonsillenloge entnommen wurden. Bei 6,3 % der operierten Patienten wurde HPV-16-DNA detektiert, wohingegen nur bei 2,4 % der Kontrollpatienten dieses Virusgenom nachweisbar war (8). In einer älteren Studie, die 1993 von Fukushima veröffentlicht wurde, konnte man bei 9 von 103 tumorfreien Proben des Nasen-Rachenraumes HPV-16 DNA nachweisen, was 8,7 % entspricht (18). Kreimer untersuchte die Prävalenz für eine orale HPV-Infektion in Abhängigkeit zum Lebensalter und wies bei nur 2,9 % einer 210 Probanden umfassenden Gruppe junger Männer (durchschnittliches Alter 19 Jahre) HPV-DNA nach; in einer Gruppe älterer Männer (Durchschnittsalter 57 Jahre) waren es bereits 16 von 332 untersuchten Männern (4,8 %), bei denen sich eine orale HPV-Infektion nachweisen ließ (46). Eine große 1235 Teilnehmer umfassende Studie von Smith et al. untersuchte die Prävalenz von HPV in der Mundhöhle von Kindern und Jugendlichen. Dabei wurden Patienten zwischen 4 Monaten und 20 Jahren rekrutiert, die wegen jeglicher gesundheitlicher Probleme die pädiatrische Ambulanz aufsuchten. Sie wurden mittels Abstrich aus der Mundhöhle oder mittels einer Mundspülung auf HPV untersucht. Abgesehen von den Probanden, die unter einem Jahr alt waren, stieg die Rate an oralen HPVInfektion mit zunehmendem Lebensalter an und erreichte bei der Gruppe der 16 bis 20-Jährigen eine Rate von 3,3 % (73). Insgesamt entsprechen die Ergebnisse aller aufgeführten Studien in etwa den Ergebnissen, die die vorliegende Arbeit liefert. In dem untersuchten Kollektiv waren es vier von 77 Probanden, bei denen sich das Humane Papillomavirus im Oropharynx nachweisen ließ, das entspricht 5,2 %. Bei einem Probanden ergab die Typisierung eine Infektion mit dem Low-riskHPV Typ 11, bei drei Probanden konnte High-risk-HPV vom Typ 16 detektiert werden. Die Verteilung zwischen LR-HPV und onkogenen HRHPV entspricht mit 25 % zu 75 % in etwa den Ergebnissen vorheriger Studien (73); (80). 60 Diskussion 4.3 Diskussion der untersuchten Risikofaktoren für eine orale HPVInfektion Verschiedene Studien zeigen einen Zusammenhang zwischen dem Lebensalter und einer HPV-Infektion. Bei dem untersuchten Kollektiv war festzustellen, dass der Altersdurchschnitt bei der HPV-positiven Probandengruppe mit 59,67 Jahren höher lag als der Altersdurchschnitt bei der HPV-negativen Probandengruppe, die im Durchschnitt 43,03 Jahre alt war. Auf Grund eines sehr kleinen untersuchten Kollektivs weist dieses Ergebnis zwar keine statistische Signifikanz auf, dennoch gibt es einen Trend an, der auch in anderen Studien aufgezeigt wird. So ergab eine von Chen et al. durchgeführte Studie mit 189 KontrollPatienten, bei denen aus Abstrichen völlig unauffälliger Tonsillen nach HPV gefahndet wurde, dass in der Altersgruppe der im Durchschnitt 53,4jährigen Kontroll-Patienten die höchste Rate an HPV-Infektionen zu finden war (2,4%).(8) D’Souza et al. verglich männliche Probanden im Studentenalter (durchschnittlich 19 Jahre) mit einer Gruppe von Kontroll-Patienten, deren Alter bei durchschnittlich 57 Jahren lag. Bei den Studenten zeigte sich auch hier ein Anstieg der Rate an HPVInfizierten von 0,9 % bei den 18 bis 19-Jährigen und einer Rate von 5,0 % bei den 20 bis 23-Jährigen. Bei der Gruppe der weitaus älteren KontrollPatienten zeigte sich die höchste Rate der HPV-positiven Probanden bei denjenigen, deren Alter zwischen 40 und 56 Jahren lag, danach fiel die Infektionsrate ab bis auf 2,3 % bei über 65-jährigen (13). Diese Ergebnisse sind zunächst durch eine Zunahme der Sexualpartner mit steigendem Lebensalter erklärbar. Ab einem gewissen Alter kommt es möglicherweise seltener zu häufigem Partnerwechsel und damit bei vielen Probanden zu einem Ausheilen der viralen Infektion. Betrachtet man die in verschiedenen Studien ausgewerteten Fragebögen, so fällt tatsächlich auf, dass mit steigender Rate an HPV-Infektionen auch die Anzahl der Sexualpartner zunahm und Sexualpraktiken wie Oralverkehr häufiger angegeben wurden (13); (19). Außerdem fällt in der Studie von D’Souza auf, dass in beiden Gruppen unabhängig vom Alter die Rate der HPV-Nachweise bei 61 Diskussion Homosexuellen (8,1%) weitaus höher war als bei Heterosexuellen (3,6%) (13). Auch Smith et al. zeigte in einer Studie einen Zusammenhang zwischen steigender Anzahl an Sexualpartnern und dem Risiko einer HPV-Infektion. Bei der Untersuchung in einem Kollektiv aus Kindern und Jungendlichen (bis 20 Jahre) verglich die Arbeit den Anstieg der HPV-Nachweise aus der Mundhöhle mit dem Alter und mit den Lebensgewohnheiten. Dabei stellte sich heraus, dass bei der Gruppe der Teilnehmer, die im Alter zwischen 16 und 20 Jahren waren, mit 3,3% die höchste Rate der HPV-Infektionen nachgewiesen werden konnte. Diejenigen, die zum Untersuchungszeitpunkt niemals sexuellen Kontakt hatten, waren zu 1,9% HPV-positiv, jene, welche bereits sexuell aktiv waren, zu 3,9%. Ebenso fällt auf, dass Probanden, die angaben, mit maximal zwei Partnern bisher sexuellen Kontakt gehabt zu haben, in 2,5% Träger des HPV-Virus waren, die Probanden, die mit drei oder mehr Partnern sexuellen Kontakt hatten, in 5,5% HPV-positiv waren (73). Andere Studien belegen diese Beobachtung mit dem Nachweis einer genitalen HPV-Infektion bei steigender Zahl der Sexualpartner und im Zusammenhang mit dem Alter bei der Kohabitarche. Je jünger die Patienten beim ersten Geschlechtsverkehr waren, desto höher lag die Rate des HPV-Nachweises. Auch hier wird deutlich, dass eine HPV-Infektion als sexuell übertragene Infektion angesehen werden muss, prädisponiert durch zusätzliche Risikofaktoren (82). Eine ähnliche Tendenz lässt sich auch in den Ergebnissen der vorliegenden Arbeit erkennen. Auch wenn die statistische Signifikanz auf Grund eines sehr kleinen Kollektivs nicht gegeben ist, kann man beobachten, dass bei der HPV-16-positiven Gruppe die sexuelle Aktivität geringfügig früher aufgenommen wurde (17 Jahre) als bei der HPV-negativen Probandengruppe (17,54 Jahre). Bei der angegebenen Anzahl der Sexualpartner gaben HPV-16-positive Studienteilnehmer durchschnittlich 8,67 Sexualpartner an, Studienteilnehmer, die keinen Nachweis von HPV16 hatten, gaben an, mit durchschnittlich 7,03 Partnern sexuellen Kontakt gehabt zu haben. 62 Diskussion Auch andere Faktoren erhöhen das Risiko einer Infektion mit Humanen Papillomaviren. Dazu zählen vor allen Dingen Faktoren, die durch ihre immunsupprimierende systemische Wirkung eine transiente oder persistierende Infektion begünstigen. So wurde bei HIV-seropositiven Menschen eine höhere Rate oraler oder genitaler HPV-Infektionen festgestellt (6); (12); (47). Im Hinblick auf eine allgemeine Warzenanamnese und dem erhöhten Risiko für eine orale Infektion durch onkogene HPV zeigen einige Studien einen Zusammenhang (68); (73). Die Ergebnisse dieser Arbeit konnten eine solche Verbindung nicht darstellen. Nur einer der Patienten, bei dem eine orale Infektion mit onkogenen HPV nachgewiesen werden konnte, gab eine positive Warzenanamnese an. Bei der Analyse der Lebensgewohnheiten von HPV-positiven im Vergleich zu HPV-negativen Patienten ohne oropharyngeale Tumorerkrankung gibt es Hinweise, dass Tabakkonsum als prädisponierender Faktor für eine Infektion mit Humanen Papillomaviren angesehen werden kann. D’Souza et al. beschreibt in einer ihrer Studien einen Anstieg der Rate an oraler HPVInfektion bei Rauchern. Patienten, die die Frage nach aktuellem Tabakkonsum bejahten, hatten in 13,6% der untersuchten Fälle einen positiven HPV-Nachweis in der Mundhöhle. Nichtraucher hingegen wiesen nur in 4,9% eine HPV-Infektion auf. Ebenso stellte D’Souza fest, dass auch eine höhere Anzahl der täglich gerauchten Zigaretten einen Risikofaktor für eine Infektion darstellten. Je mehr Zigaretten täglich geraucht wurden, umso höher war die Rate der HPV-Infektionen (13). Auch eine Studie von Smith unter Jugendlichen zeigt eine deutliche Zunahme der Rate papillomavirusinfizierter Mundhöhlen, wenn aktueller Tabakkonsum angegeben wurde. 1,3% der Nichtraucher und 8,2% der rauchenden Jugendlichen hatten einen positiven Nachweis von HPV aus dem Oropharynx (73). Dieser Unterschied konnte in dem hier untersuchten Kollektiv nicht festgestellt werden. Teilnehmer, die einen positiven HPV-Nachweis hatten, gaben annähernd genauso häufig Tabakkonsum an wie auch HPV-negative Probanden. 63 Diskussion Der regelmäßige Konsum von Alkohol als genereller Risikofaktor für das Entstehen eines malignen Tumors im Mund- und Rachenraum gilt als gesichert (19); (29); (43); (64). Darüber, ob regelmäßiger Alkoholkonsum auch das Risiko einer HPV-Infektion erhöht, liegen auch in Studien über die Prävalenz onkogener Papillomaviren bei Patienten ohne maligne Tumorerkrankung des Oropharynx keine eindeutigen Ergebnisse vor (13). Auch in der hier vorliegenden Arbeit kann ein Zusammenhang zwischen Alkoholkonsum und oraler Infektion mit onkogenen Humanen Papillomaviren nicht festgestellt werden. Alle weiteren Merkmale und Lebensgewohnheiten, die in dieser Arbeit mit Hilfe des Fragebogens untersucht wurden, wie beispielsweise das Bruttojahreseinkommen, der Familienstand, oder ob über einen längeren Zeitraum kortisonhaltige Präparate angewendet wurden, zeigen keinen signifikanten Zusammenhang mit einer bestehenden HPV-Infektion. 4.4 Vergleichbarkeit verschiedener Methoden zur Detektion onkogener HPV Eine Fragestellung dieser Arbeit sollte sich mit den unterschiedlichen Methoden zur Detektion einer latenten, klinisch inapparenten oralen Infektion mit onkogenen Humanen Papillomaviren beschäftigen. Welches Verfahren könnte möglicherweise auch als Screening-Methode angesehen werden, so wie es in der Gynäkologie zur Risikoabschätzung für CervixKarzinome praktiziert wird? Dazu wurden drei verschiedene Methoden miteinander verglichen, die bereits zuvor von Autoren anderer Studien beschrieben wurden. Die Detektion erfolgte durch eine Mundspülung, durch einen Abstrich aus der Tonsillenloge beidseits und bei einigen Patienten durch Tonsillenfrischgewebe (44) (56); (70); (78); (94). Die Ergebnisse aus den Mundspülungen und den Abstrichproben sind in dieser Arbeit unmittelbar miteinander vergleichbar, denn diese Art der Probeentnahme wurde bei allen Probanden durchgeführt. Die Gewinnung von Frischgewebe aus den Tonsillen wurde nur bei einigen Probanden durchgeführt, da es sich um einen operativen und mit Risiken behafteten Eingriff handelt. Es wurde versucht, all jene Patienten zu rekrutieren, die in 64 Diskussion dem Zeitraum, in dem die Arbeit durchgeführt wurde, aus medizinischen Indikationen eine Tonsillektomie erhielten, nicht aber eine maligne Erkrankung in dieser Region aufwiesen. Die Tonsillektomie wird mehr und mehr als ein Standardeingriff der Hals-Nasen-Ohren-Heilkunde angesehen und die Durchführung erfolgt immer häufiger als ambulanter Eingriff in medizinischen Versorgungszentren oder Praxen, weniger in Universitätskliniken, wo die Probengewinnung und -aufarbeitung bei dieser Arbeit vorgenommen wurde. Keiner der 15 rekrutierten Patienten dieses Kollektivs wies im Oropharynx HPV-DNA auf, obwohl aus allen Gewebeproben generell der Nachweis von DNA gelang. Obwohl ein HPVNachweis aus frischem Gewebe als sehr sensitive Methode zur Detektion angesehen werden kann, rechtfertigt eine Probeentnahme bei Patienten ohne Erkrankung der Tonsillen eine solche Gewebeentnahme nicht. In 33,8% aller entnommenen Proben konnte keinerlei DNA nachgewiesen werden, was in den meisten dieser Fälle auf Abstriche aus der Tonsillenloge zutraf. Als Grund hierfür wird ein stark ausgeprägter Würgereflex verantwortlich gemacht, so dass die Probanden ein sehr intensives Abstreichen nicht tolerierten. Dennoch kann festgestellt werden, dass alle Nachweise von HPV-DNA aus Abstrichen und nicht aus den ebenfalls vorliegenden Mundspülungen gelangen. Der Grund dafür könnte darin liegen, dass ein Großteil klinisch apparent oder inapparent verlaufender HPV-Infektionen in den Tonsillen lokalisiert sind (44). Unklar ist, aus welchem Grund der HPV-16-Nachweis aus Mundspülungen von HPV-positiven Probanden in dieser Arbeit nicht gelungen ist, obwohl bei allen drei Mundspülungen bei der ß-Globin-PCR ein DNA-Nachweis gelang. Anhand dieser Arbeit fällt ein Vergleich der drei verschiedenen Methoden zur Detektion onkogener HPV-DNA schwer, da es sich um ein sehr kleines Kollektiv handelte und nur bei nachzuweisen war. 65 drei Probanden onkogene HPV Zusammenfassung 5 Zusammenfassung Die vorliegende Arbeit beschäftigt sich mit onkogenen Humanen Papillomaviren im Oropharynx. Es wurde ein Kollektiv von 77 Patienten untersucht, bei denen eine Mundspülung, ein Abstrich aus der Tonsillenloge und bei einigen Studienteilnehmern Tonsillenfrischgewebe entnommen wurde und dieses Material mittels PCR auf Papillomaviren untersucht wurde. Anschließend wurden die Ergebnisse miteinander verglichen. Außerdem lag von jedem Studienteilnehmer ein ausgefüllter Fragebogen über Lebensgewohnheiten und Risikofaktoren zu Auswertung vor. Die Häufigkeit nachgewiesener HPV deckte sich in der vorliegenden Arbeit annähernd mit der Prävalenz für HPV anderer Studien. Auch konnte HPVTyp 16 als häufigster onkogener HPV-Typ detektiert werden, ein Ergebnis das andere Studien ebenso lieferten. Es konnte in dieser Arbeit gezeigt werden, dass der Abstrich aus der Tonsillenloge als Verfahren zum Nachweis von Humanen Papillomaviren der Mundspülung überlegen war. Obwohl bei den Abstrichen HPV-PCR nachgewiesen werden konnte, zeigten die Mundspülungen der jeweiligen Probanden ein negatives Resultat. Der Vergleich mit dem HPV-Nachweis im Frischgewebe kann in dieser Arbeit nicht geliefert werden, da nicht von jedem Probanden Frischgewebe vorlag und keinem der Probanden, die sich einer elektiven Tonsillektomie unterzogen haben, ein positiver HPV-Nachweis aus dem Frischgewebe gelang. Bei der Betrachtung der Risikofaktoren und der Lebensgewohnheiten kann in dieser Arbeit nur schwer eine Aussage über den Zusammenhang mit einer HPV-Infektion getroffen werden. Der Hauptgrund dafür ist, dass das untersuchte Kollektiv mit 77 Studienteilnehmern keine statistisch signifikante Aussage zulässt. Dennoch lassen sich bei genauerer Beleuchtung der Lebensgewohnheiten, insbesondere des Sexualverhaltens Tendenzen erkennen, die auch in vergleichbaren Studien angegeben werden. So kann in dieser Arbeit gezeigt werden, dass das Alter der Kohabitarche bei der Gruppe der HPV-positiven Teilnehmer im Durchschnitt unter dem der HPV-negativen Teilnehmer lag. Die Zahl der Sexualpartner hingegen war zum untersuchten Zeitpunkt in der Gruppe der HPV-positiven Probanden höher als die der HPV-negativen Studienteilnehmer. Diese 66 Zusammenfassung Daten weisen hier, wie auch in vorangegangenen Studien darauf hin, dass das Humane Papillomavirus auch als Faktor für die Entstehung von Karzinomen im Hals-Rachenraum sexuell übertragbar ist, wie es beim Cervix-Karzinom heute als gesichert gilt. In Diskussionen um die Impfung gegen Humane Papillomaviren kann diese Tatsache Beachtung finden. 67 Literaturverzeichnis 6 1 Literatur Aguilar LV, Lazcano-Ponce E, et al. (2006). "Human papillomavirus in men: comparison of different genital sites." Sex Transm Infect 82(1): 313. 2 Baseman JG and Koutsky LA (2005). "The epidemiology of human papillomavirus infections." J Clin Virol 32 Suppl 1: S16-24. 3 Blohmer JU, Schmalisch G, et al. (1999). "Increased incidence of cervical intraepithelial neoplasia in young women in the Mitte district, Berlin, Germany." Acta Cytol 43(2): 195-200. 4 Bootz F, Breuninger H, et al. (2000). "Oncology of the head-neck region." HNO 48(2): 104-118. 5 Castellsague X and Munoz N (2003). "Chapter 3: Cofactors in human papillomavirus carcinogenesis--role of parity, oral contraceptives, and tobacco smoking." Journal of the National Cancer Institute Monographs (31): 20-28. 6 Chaturvedi AK, Madeleine MM, et al. (2009). "Risk of human papillomavirus-associated cancers among persons with AIDS." J Natl Cancer Inst 101(16): 1120-30. 7 Chen R, Aaltonen LM, et al. (2005). "Human papillomavirus type 16 in head and neck carcinogenesis." Rev Med Virol 15(6): 351-63. 8 Chen R, Sehr P, et al. (2005). "Presence of DNA of human papillomavirus 16 but no other types in tumor-free tonsillar tissue." J Clin Microbiol 43(3): 1408-10. 9 Crusius K, Auvinen E, et al. (1998). "The human papillomavirus type 16 E5-protein modulates ligand-dependent activation of the EGF receptor family in the human epithelial cell line HaCaT." Exp Cell Res 241(1): 7683. 10 Cuzick J, Szarewski A, et al. (2003). "Management of women who test positive for high-risk types of human papillomavirus: the HART study." Lancet 362(9399): 1871-6. 11 Das BC, Sharma JK, et al. (1992). "Analysis by Polymerase ChainReaction of the Physical State of Human Papillomavirus Type-16 Dna in 68 Literaturverzeichnis Cervical Preneoplastic and Neoplastic Lesions." Journal of General Virology 73: 2327-2336. 12 de Villiers EM (1989). "Prevalence of HPV 7 papillomas in the oral mucosa and facial skin of patients with human immunodeficiency virus." Arch Dermatol 125(11): 1590. 13 D'Souza G, Agrawal Y, et al. (2009). "Oral sexual behaviors associated with prevalent oral human papillomavirus infection." J Infect Dis 199(9): 1263-9. 14 Elfgren K, Kalantari M, et al. (2000). "A population-based five-year followup study of cervical human papillomavirus infection." Am J Obstet Gynecol 183(3): 561-567. 15 Favre M (1975). "Structural polypeptides of rabbit, bovine, and human papillomaviruses." J Virol 15(5): 1239-47. 16 Forastiere A, Koch W, et al. (2001). "Head and neck cancer." N Engl J Med 345(26): 1890-1900. 17 Francki RIBF, C.; Knudson, D. (1991). Classification and Nomenclature of Viruses: 5th Report of the International Committee on Taxonomy of Viruses. Archives of Virology Suppl. 2, Springer Verlag. 18 Fukushima K, Ogura H, et al. (1994). "Human papillomavirus type 16 DNA detected by the polymerase chain reaction in non-cancer tissues of the head and neck." Eur Arch Otorhinolaryngol 251(2): 109-12. 19 Furniss CS, McClean MD, et al. (2007). "Human papillomavirus 16 and head and neck squamous cell carcinoma." Int J Cancer 120(11): 238692. 20 Galloway DA and McDougall JK (1996). "The disruption of cell cycle checkpoints by papillomavirus oncoproteins contributes to anogenital neoplasia." Semin Cancer Biol 7(6): 309-15. 21 Gellrich N (2004). "Kopf-Hals-Tumoren - Empfehlungen zur standardisierten Diagnostik, Therapie und Nachsorge." Tumorzentrum Freiburg 1: 1-32. 22 Gillison ML, Koch WM, et al. (2000). "Evidence for a causal association between human papillomavirus and a subset of head and neck cancers." J Natl Cancer Inst 92(9): 709-20. 69 Literaturverzeichnis 23 Goncalves AK, Giraldo P, et al. (2006). "Secretory immunoglobulin A in saliva of women with oral and genital HPV infection." Braz J Infect Dis 124(2): 227-231. 24 Gravitt PE, Manos MM (1992). "Polymerase chain reaction-based methods for the detection of human papillomavirus DNA." IARC Sci Publ(119): 121-33. 25 Hallden C, Majmudar B (1986). "The relationship between juvenile laryngeal papillomatosis and maternal condylomata acuminata." J Reprod Med 31(9): 804-807. 26 Hansgen G, Kuhnt T, et al. (2002). "[Adjuvant simultaneous radiochemotherapy after operated uterine cervix carcinoma in high risk situation. Results of a pilot study]." Strahlenther Onkol 178(2): 71-7. 27 Harper DM, Franco EL, et al. (2004). "Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial." Lancet 364(9447): 1757-65. 28 Harro CD, Pang YY, et al. (2001). "Safety and immunogenicity trial in adult volunteers of a human papillomavirus 16 L1 virus-like particle vaccine." J Natl Cancer Inst 93(4): 284-92. 29 Herrero R (2003). "Chapter 7: Human papillomavirus and cancer of the upper aerodigestive tract." J Natl Cancer Inst Monogr (31): 47-51. 30 Herrero R, Castellsague X, et al. (2003). "Human papillomavirus and oral cancer: the International Agency for Research on Cancer multicenter study." J Natl Cancer Inst 95(23): 1772-83. 31 Hillemanns P (2007). "HPV-Infektion: Impfung, Diagnostik und Therapie." GebFra-Refresher ; 67 67: R1-R28. 32 Jacobs MV, Snijders PJ, et al. (1997). "A general primer GP5+/GP6(+)mediated PCR-enzyme immunoassay method for rapid detection of 14 high-risk and 6 low-risk human papillomavirus genotypes in cervical scrapings." J Clin Microbiol 35(3): 791-5. 33 Jeon S and Lambert PF (1995). "Integration of Human Papillomavirus Type-16 Dna Into the Human Genome Leads to Increased Stability of E6 and E7 Messenger-Rnas - Implications for Cervical Carcinogenesis." 70 Literaturverzeichnis Proceedings of the National Academy of Sciences of the United States of America 92(5): 1654-1658. 34 Jones DL, Alani RM, et al. (1997). "The human papillomavirus E7 oncoprotein can uncouple cellular differentiation and proliferation in human keratinocytes by abrogating p21(Cip1)-mediated inhibition of cdk2." Genes & Development 11(16): 2101-2111. 35 Kalantari M, Blennow E, et al. (2001). "Physical state of HPV16 and chromosomal mapping of the integrated form in cervical carcinomas." Diagnostic Molecular Pathology 10(1): 46-54. 36 Karlsson R, Jonsson M, et al. (1995). "Lifetime number of partners as the only independent risk factor for human papillomavirus infection: a population-based study." Sex Transm Dis 22(2): 119-27. 37 Kirschbaum M and M nstedt K (2005). Checkliste Gynäkologie und Geburtshilfe. Stuttgard, Georg Thieme Verlag. 38 Kleinsasser O (1988). Tumors of the Larynx and Hypopharynx, Thieme Medical Pub. 39 Klingelhutz AJ, Foster SA, et al. (1996). "Telomerase activation by the E6 gene product of human papillomavirus type 16." Nature 380(6569): 7982. 40 Klussmann JP (2003). "Nachweis und Charakterisierung onkogener humaner Papillomaviren (HPV) in Plattenepithelkarzinomen des Kopfes und des Halses." Klinik für HNO: 125. 41 Klussmann JP, Dinh S, et al. (2004). "[HPV-associated tonsillar cancer. An update]." Hno 52(3): 208-18. 42 Klussmann JP, Weissenborn S, et al. (2001). "Human papillomavirus infection as a risk factor for squamous-cell carcinoma of the head and neck." N Engl J Med 345(5): 376. 43 Klussmann JP, Weissenborn SJ, et al. (2003). "Human papillomaviruspositive tonsillar carcinomas: a different tumor entity?" Med Microbiol Immunol 192(3): 129-32. 44 Klussmann JP, Weissenborn SJ, et al. (2001). "Prevalence, distribution, and viral load of human papillomavirus 16 DNA in tonsillar carcinomas." Cancer 92(11): 2875-2884. 71 Literaturverzeichnis 45 Koutsky L (1997). "Epidemiology of genital human papillomavirus infection." Am J Med 102(5A): 3-8. 46 Kreimer AR (2009). "Oral sexual behaviors and the prevalence of oral human papillomavirus infection." J Infect Dis 199(9): 1253-4. 47 Kreimer AR, Alberg AJ, et al. (2004). "Oral human papillomavirus infection in adults is associated with sexual behavior and HIV serostatus." J Infect Dis 189(4): 686-98. 48 Kreimer AR, Clifford GM, et al. (2005). "Human papillomavirus types in head and neck squamous cell carcinomas worldwide: A systematic review." Cancer Epidemiology Biomarkers & Prevention 14(2): 467-475. 49 Ley C, Bauer HM, et al. (1991). "Determinants of genital human papillomavirus infection in young women." J Natl Cancer Inst 83(14): 997-1003. 50 Lindel K, Beer KT, et al. (2001). "Human papillomavirus positive squamous cell carcinoma of the oropharynx: a radiosensitive subgroup of head and neck carcinoma." Cancer 92(4): 805-13. 51 Mantovani F and Banks L (2001). "The Human Papillomavirus E6 protein and its contribution to malignant progression." Oncogene 20(54): 78747887. 52 Miller CS, Johnstone BM (2001). "Human papillomavirus as a risk factor for oral squamous cell carcinoma: a meta-analysis, 1982-1997." Oral Surg Oral Med Oral Pathol Oral Radiol Endod 91(6): 622-635. 53 Munoz N, Bosch FX, et al. (2003). "Epidemiologic classification of human papillomavirus types associated with cervical cancer." N Engl J Med 348(6): 518-527. 54 Negrini BP, Schiffman MH, et al. (1990). "Oral contraceptive use, human papillomavirus infection, and risk of early cytological abnormalities of the cervix." Cancer Res 50(15): 4670-5. 55 Oriel JD (1990). "Identification of people at high risk of genital HPV infections." Scand J Infect Dis Suppl 69: 169-172. 56 Ostwald C, Muller P, et al. (1994). "Human papillomavirus DNA in oral squamous cell carcinomas and normal mucosa." J Oral Pathol Med 23(5): 220-5. 72 Literaturverzeichnis 57 Parkin DM, Pisani P, et al. (1999). "Estimates of the worldwide incidence of 25 major cancers in 1990." Int J Cancer 80(6): 827-841. 58 Peters WA, 3rd, Liu PY, et al. (2000). "Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix." J Clin Oncol 18(8): 1606-13. 59 Pfister H (1996). "The role of human papillomavirus in anogenital cancer." Obstet Gynecol Clin North Am 23(3): 579-595. 60 Pfister H (2003). "Chapter 8: Human papillomavirus and skin cancer." J Natl Cancer Inst Monogr (31): 52-56. 61 Pschyrembel W and Hildebrandt H (1998). Pschyrembel Klinisches Wörterbuch. New York, Walter de Gruyter. 62 Qu W, Jiang G, et al. (1997). "PCR detection of human papillomavirus: comparison between MY09/MY11 and GP5+/GP6+ primer systems." J Clin Microbiol 35(6): 1304-10. 63 Regezi JA and Sciubba JJ (1989). squamous Papilloma / Oral verruca vulgaris. Philadelphia, Saunders WB company. 64 Ritchie JM, Smith EM, et al. (2003). "Human papillomavirus infection as a prognostic factor in carcinomas of the oral cavity and oropharynx." Int J Cancer 104(3): 336-344. 65 Rolfs A (1992). PCR clinical diagnostics and research. Berlin u.a., Springer-Verlag GmbH; Auflage: illustrated edition. 66 Sambrook J, Fritsch EF, et al. (1989). Molecular Cloning: A Laboratory Manual. New York, Cold Spring Harbor Laboratory Press. 67 Schuller DE, McGuirt WF, et al. (1980). "The prognostic significance of metastatic cervical lymph nodes." Laryngoscope 90(4): 557-570. 68 Schwartz SM, Daling JR, et al. (1998). "Oral cancer risk in relation to sexual history and evidence of human papillomavirus infection." Journal of the National Cancer Institute 90(21): 1626-1636. 69 Schwartz SR, Yueh B, et al. (2001). "Human papillomavirus infection and survival in oral squamous cell cancer: a population-based study." Otolaryngol Head Neck Surg 125(1): 1-9. 73 Literaturverzeichnis 70 Simonato LE, Garcia JF, et al. (2008). "Detection of HPV in mouth floor squamous cell carcinoma and its correlation with clinicopathologic variables, risk factors and survival." J Oral Pathol Med 37(10): 593-8. 71 Sisk EA, Bradford CR, et al. (2000). "Human papillomavirus infection in "young" versus "old" patients with squamous cell carcinoma of the head and neck." Head Neck 22(7): 649-57. 72 Smith EM, Ritchie JM, et al. (2004). "Age, sexual behavior and human papillomavirus infection in oral cavity and oropharyngeal cancers." Int J Cancer 108(5): 766-772. 73 Smith EM, Swarnavel S, et al. (2007). "Prevalence of human papillomavirus in the oral cavity/oropharynx in a large population of children and adolescents." Pediatr Infect Dis J 26(9): 836-40. 74 Stauber M and Weyerstahl T (2001). Gynäkologie und Geburtshilfe. Stuttgard, Georg Thieme Verlag (Duale Reihe). 75 Stone KM, Karem KL, et al. (2002). "Seroprevalence of human papillomavirus type 16 infection in the United States." J Infect Dis 186(10): 1396-402. 76 Strome SE, Savva A, et al. (2002). "Squamous cell carcinoma of the tonsils: a molecular analysis of HPV associations." Clin Cancer Res 8(4): 1093-1100. 77 Strutz J and Mann W (2001). Praxis der HNO-Heilkunde, Kopf- und Halschirurgie, Thieme, Stuttgart (Januar 2001). 78 Summersgill KF, Smith EM, et al. (2001). "Human papillomavirus in the oral cavities of children and adolescents." Oral Surg Oral Med Oral Pathol Oral Radiol Endod 91(1): 62-69. 79 Suzich JA, Ghim SJ, et al. (1995). "Systemic immunization with papillomavirus L1 protein completely prevents the development of viral mucosal papillomas." Proc Natl Acad Sci U S A 92(25): 11553-7. 80 Syrjanen S (2005). "Human papillomavirus (HPV) in head and neck cancer." J Clin Virol 32 Suppl 1: S59-S66. 81 Thiel F, Mehlhorn G, et al. (2009). "Update 2009 zur Diagnostik und Therapie des Zervixkarzinoms." Onkologie heute 2: 62-67. 82 Vaccarella S, Franceschi S, et al. (2006). "Sexual behavior, condom use, and human papillomavirus: pooled analysis of the IARC human 74 Literaturverzeichnis papillomavirus prevalence surveys." Cancer Epidemiol Biomarkers Prev 15(2): 326-33. 83 Villa LL, Costa RL, et al. (2005). "Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial." Lancet Oncol 6(5): 271-8. 84 Vokes EE, Weichselbaum RR, et al. (1993). "Medical Progress - Head and Neck-Cancer." New England Journal of Medicine 328(3): 184-194. 85 Walboomers JM, Jacobs MV, et al. (1999). "Human papillomavirus is a necessary cause of invasive cervical cancer worldwide." J Pathol 189(1): 12-19. 86 Wentzensen N and Doeberitz MV (2004). "Viral cancerogenesis of head and neck tumors." Pathologe 25(1): 21-30. 87 Wentzensen N, Ridder R, et al. (2002). "Characterization of viral-cellular fusion transcripts in a large series of HPV16 and 18 positive anogenital lesions." Oncogene 21(3): 419-426. 88 Werness BA, Munger K, et al. (1991). "Role of the human papillomavirus oncoproteins in transformation and carcinogenic progression." Important Adv Oncol 3-18. 89 Wieland U and Pfister H (1996). "Molecular diagnosis of persistent human papilloma virus infections." Intervirology 39(3): 145-57. 90 Wilczynski SP, Lin BT, et al. (1998). "Detection of human papillomavirus DNA and oncoprotein overexpression are associated with distinct morphological patterns of tonsillar squamous cell carcinoma." Am J Pathol 152(1): 145-156. 91 Wittekindt C, Meyer H, et al. (2002). UICC: TNM Klassifikation maligner Tumoren. Berlin Heidelberg New York, Springer Verlag. 92 Woodman CB, Collins S, et al. (2001). "Natural history of cervical human papillomavirus infection in young women: a longitudinal cohort study." Lancet 357(9271): 1831-6. 93 Xi LF, Koutsky LA, et al. (1997). "Genomic variation of human papillomavirus type 16 and risk for high grade cervical intraepithelial neoplasia." J Natl Cancer Inst 89(11): 796-802. 75 Literaturverzeichnis 94 Zhao M, Rosenbaum E, et al. (2005). "Feasibility of quantitative PCRbased saliva rinse screening of HPV for head and neck cancer." Int J Cancer 117(4): 605-10. 95 Zielinski GD, Snijders PJ, et al. (2003). "The presence of high-risk HPV combined with specific p53 and p16INK4a expression patterns points to high-risk HPV as the main causative agent for adenocarcinoma in situ and adenocarcinoma of the cervix." J Pathol 201(4): 535-543. 96 zur Hausen H (2002). "Papillomaviruses and cancer: from basic studies to clinical application." Nat Rev Cancer 2(5): 342-350. 76 Tabellenverzeichnis 7 Tabellenverzeichnis Tab. 1: UICC-Klassifikation des Larynxkarzinoms: T-Klassifikation. Tab. 2: UICC-Stadiengruppierungen des Larynxkarzinoms Tab. 3: 5-JÜR bei Kopf-Halstumoren nach UICC-Stadium Tab. 4: Klassifikation der Vorstadien des Cervixkarzinoms Tab. 5: Übersicht über CIN-Stadien Tab. 6: Stadieneinteilung des Cervixkarzinoms Tab. 7: Geschlechterverteilung der Probanden Tab.8: Geschlechterverteilung des Kollektivs Tab. 9: Patienten mit Tonsillektomie Tab. 10: ß-Globin-PCR negativ Tab. 11: onkogene HPV positiv Tab. 12: Alter und Ausbildungsdauer der HPV-16-positiven und -negativen Probanden Tab. 13: Einkommensverteilung Tab. 14: Risikofaktoren Tab.15: Vergleich der Durchschnittswerte der Risikofaktoren 77 Abbildungsverzeichnis 8 Abbildungsverzeichnis Abb.1: Genomorganisation von HPV-16 Abb. 2: FISH mit einer HPV16-spezifischen Sonde, Nachweis von HPV-16 Abb. 3: Dysplastische Zellen in einem HPV16-positiven Karzinom Abb. 4: Anatomische Strukturen des Halses und der Nackenregion Abb. 5: Plattenepithelkarzinom des Oropharynx, Abb. 6: typisches Bild eines HPV-positiven Tonsillenkarzinoms Abb. 7: Krankheitsfreies Überleben von Patienten mit HPV-positiven und HPV-negativen Oropharynxkarzinomen Abb. 8: ß-Globin-PCR nach Agarosegelelektrophorese Abb. 9: ß-Globin-PCR nach Agarosegelelektrophorese von Tonsillengewebe Abb. 10: Verdünnungsreihe HPV-Plasmid nach Agarosegelelektrophorese Abb. 12: Altersverteilung des untersuchten Kollektivs Abb. 12: Altersverteilung der HPV-16-positiven Patienten im Vergleich zum Gesamtkollektiv Abb. 13: Ausbildungsdauer der HPV-16-positiven Patienten im Vergleich zum Gesamtkollektiv Abb. 14: nested-PCR von Abstrichen und Mundspülungen Abb. 15: nested-PCR von Abstrichen und Mundspülungen Abb. 16: nested-PCR nach Agarosegelelektrophorese von Tonsillengewebe 78 Anhang 9 Anhang Patientenfragebogen 79 Anhang 80 Anhang 81 Anhang 82 Anhang 83 Anhang 84 Anhang 85 Anhang 86 Anhang 87 Anhang Einverständniserklärung 88 10 Lebenslauf Mein Lebenslauf wird aus Gründen des Datenschutzes elektronischen Fassung meiner Arbeit nicht veröffentlicht. 89 in der