Eisengruppe (PDF | 14 KB)
Werbung

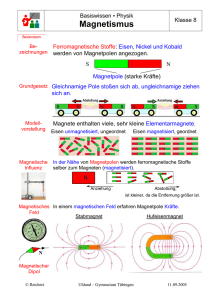
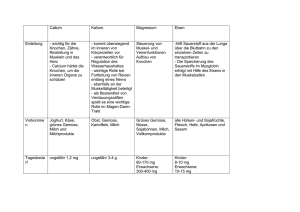
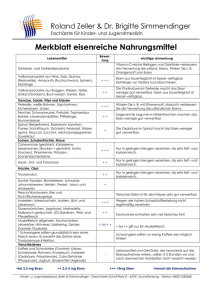
Prof. Dr. Feller Anorganische Chemie HTW Dresden Übungsaufgaben –Eisengruppe 1) Eisen zeigt sich an trockener Luft als auch in konzentrierter Schwefel- bzw. Salpetersäure beständig, in feuchter Luft hingegen nicht. Erklären Sie diesen Sachverhalt! 2) Eisen kann zum Schutz vor Korrosion mit Zink (verzinktes Blech) als auch mit Zinn (Weißblech) überzogen werden. Wieso wirken Zink und Zinn korrosionshemmend? Treten Defekte in den Überzügen auf, bilden sich Lokalelemente. Erklären Sie die eintretenden Korrosionsvorgänge! 3) Was versteht man unter pyrophorem Eisen? Geben Sie eine Möglichkeit zur Darstellung von pyrophorem Eisen an! 4) Kann eine Eisen(III)-chlorid-Lösung arsenige Säure oxidieren? Formulieren Sie die Reaktionsgleichung! 5) Welche Masse Eisen(II)-sulfid kann sich maximal in 100 ml 0,1 M Salzsäure lösen? 6) Welchen pH-Wert hat eine 0,1 M Eisen(III)-chlorid-Lösung (pKS([Fe(H2O)6]3+) = 2,2)? 7) Zu einer 0,1 M Eisen(III)-chlorid-Lösung wird Kalilauge hinzugefügt. Ab welchem pH-Wert beginnt die Fällung von Eisen(III)-hydroxid und ab welchem pH-Wert kann von einer quantitativen Fällung gesprochen werden (pKL(Fe(OH)3) = 37,42)? 8) Man bezeichnet Komplexe, die das Hexachloroferrat(III)-Ion enthalten als magnetisch normal und die, die das Hexacyanoferrat(III)-Ion enthalten als magnetisch anormal. Erklären Sie den Komplexaufbau, die Bindungsverhältnisse und das magnetische Verhalten der Ionen. Was versteht man unter den Begriffen Dia-, Para, Ferro-, Ferri- und Antiferromagnetismus? 9) Eisenkomplexe haben eine große Bedeutung für Nachweisreaktionen in der Analytik. Tragen Sie so viele Nachweisreaktionen wie möglich (mit Reaktionsgleichung) zusammen! 10) Wann weisen zweiwertige Eisenkomplexe eine höhere Stabilität auf als Komplexe mit dreiwertigem Eisen als Zentralion? Wie stellt sich die Stabilität von Kobaltkomplexen in Abhängigkeit von der Wertigkeit des Zentralions dar? Erklären Sie die Sachverhalte! Geben Sie geeignete Beispiele an! 11) Beschreiben Sie die oxidierende Wirkung von Cobalt(III)-Komplexen in Abhängigkeit von Liganden anhand geeigneter Beispiele! 12) Erläutern Sie die Bindungsverhältnisse in Nickeltetracarbonyl! 13) Zu einer 1 M K2[Ni(CN)4]-Lösung wird stöchiometrisch AgNO3-Lösung hinzugefügt. Ist die Bildung von K[Ag(CN)2] zu erwarten (lgβ([Ni(CN)4]2-) = 15,5; lgβ([Ag(CN)2]) = 21,1? Berechnen Sie die CN-- Konzentration in der Ausgangslösung und in der Produktlösung!