als PDF herunterladen - Unterrichtsmodule BW
Werbung

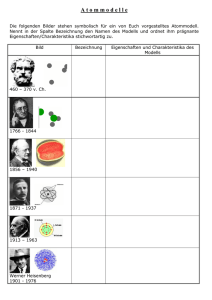
Periodensystem, Atommodelle und Atombau Modulbeschreibung Schularten: Fächer: Zielgruppen: Autor: Zeitumfang: Gymnasium; Realschule Chemie (Gym); Fächerverbund Naturwissenschaftliches Arbeiten (RS) 10 (Gym), 8 (RS) Joachim Drosdzol Acht Stunden Die Unterrichtseinheit ist in drei Sequenzen untergliedert: 1. Das Periodensystem der Elemente 2. Atombau und das Atommodell von Rutherford 3. Schalenmodell der Atomhülle. Im Unterrichtsgang wird ein Atommodell erarbeitet, mit dessen Hilfe die Einordnung der Hauptgruppenelemente im Periodensystem erklärbar werden. Damit werden die Voraus-setzungen geschaffen zur Erklärung der chemischen Bindung. Vorauszusetzende Kompetenzen fachlich: Die Schülerinnen und Schüler können ein sinnvolles Ordnungsschema zur Einteilung der Stoffe erstellen (Stoff, Stoffgemisch, Element, Verbindung, Metall, Nichtmetall) und können das Teilchenmodell zur Erklärung von Aggregatzuständen usw. anwenden. Sie wissen, dass ähnliche chemische Elemente in Elementgruppen zusammengefasst werden. Vorauszusetzende Kompetenzen methodisch: Beschreiben von Abbildungen; Arbeiten mit Modellen; Erstellen und Auswerten von Diagrammen; allgemein Informationen beschaffen und verarbeiten. Ergebnissicherung/Leistungsmessung: Tafelanschrieb, Arbeitsblätter, Auswertung von Materialien, Klassenarbeit. © 2012 LMZ-BW / SESAM - Unterrichtsmodule 1 Periodensystem, Atommodelle und Atombau Unterrichtsverlauf 1. und 2. Stunde – Begriffe "Element" und "Verbindung" Da im Weiteren auf dem Elementbegriff aufgebaut wird, werden zu Beginn die Begriffe "Element" und "Verbindung" aus der vorangegangenen Klassenstufe wiederholt. Hierzu werden den Schülerinnen und Schülern folgende aus der vorangegangenen Klassenstufe bekannte Verbindungen und Elemente vorgestellt: Verbindung: • • • • • MgO FeS2 H 2O CuO Cu2O Dazu enthaltene Elemente: • • • • • Mg und O Fe und S H und O Cu und O Cu und O Ein Vergleich der genannten Verbindungen mit den darin enthaltenen Elementen zeigt, dass Verbindungen ganz andere Eigenschaften besitzen als ihre Ausgangselemente. Verbindungen lassen sich außerdem, zum Beispiel durch Energiezufuhr, wieder in ihre Elemente zerlegen. Elemente hingegen können nicht mehr in andere Stoffe aufgetrennt werden. Die im Klassengespräch erarbeiteten bzw. wiederholten Begriffe werden abschließend zur Ergebnissicherung im Tafelanschrieb festgehalten. Kriterien einer Einteilung der Elemente: Da die Schülerinnen und Schüler selbst eine Einteilung der Elemente im Periodensystem erarbeiten sollen, wird zunächst darauf verzichtet, ein fertiges Periodensystem, zum Beispiel in Form einer Wandtafel, als Anschauungsmaterial zu verwenden. Ausgehend von den oben schon genannten chemischen Elementen nennen die Schülerinnen und Schüler im Klassengespräch weitere ihnen bekannte Elemente, die ebenfalls ins Tafelbild übernommen werden. Von der Lehrperson wird nun daraufhingewiesen, dass in der Chemie mittlerweile über hundert Elemente bekannt sind. Daraus leitet sich die Notwendigkeit ab, diese vielen Elemente in einem übersichtlichen System einzuordnen. Im Klassengespräch lassen sich dafür folgende Kriterien erarbeiten: © 2012 LMZ-BW / SESAM - Unterrichtsmodule 2 Periodensystem, Atommodelle und Atombau a) Unterscheidung Metalle – Nichtmetalle: Metalle: Mg, Cu, Zn, Na ...... Nichtmetalle: O, S, H, N .... b) Einteilung nach Elementfamilien, zum Beispiel Alkalimetalle, Halogene c) Sortieren nach Atommassen: 1H 4He 6,9Li usw., wobei die Werte für die Atommassen von der Lehrkraft vorgegeben werden. Die erarbeiteten Kriterien einer sinnvollen "Sortierung" der chemischen Elemente werden als Tafelanschrieb festgehalten. Erstellen einer Tabelle der Elemente: Auf der Folie 1.1 "Anordnung der chemischen Elemente – Folie" (für die Schülerinnen und Schüler zur Bearbeitung das Arbeitsblatt "Anordnung der chemischen Elemente") sind einige Elemente in alphabetischer Reihenfolge ausgewählt. Zunächst wird im Klassengespräch die Zugehörigkeit der einzelnen Elemente zu einer Elementfamilie erarbeitet. Dabei werden die Elemente einer Familie von den Schülerinnen und Schülern auf ihrem Arbeitsblatt jeweils in gleicher Weise markiert. Danach können die Schülerinnen und Schüler in Gruppenarbeit Lösungsvorschläge für die Einordnung der Elemente in die vorgegebene Tabelle erstellen, wobei die im Tafelbild oben aufgeführten Kriterien für die Einteilung der Elemente Berücksichtigung finden sollen. Die Schülerinnen und Schüler stellen nun ihre Lösungsvorschläge an der Tafel vor und begründen sie. Im Klassengespräch werden anschließend die gefundenen Lösungen miteinander verglichen. Mögliche Lösungen für die gestellte Aufgabe können aber auch mit Hilfe von Folie 1.2 "Möglichkeiten der Anordnung der chemischen Elemente" aufgezeigt und verglichen werden. Dabei entspricht Möglichkeit 2 auf der Folie dem üblichen Schema der Darstellung der chemischen Elemente im sogenannten Periodensystem. Zur Veranschaulichung kann jetzt beispielsweise eine Wandtafel mit dem Periodensystem zur Anwendung kommen. Im Klassengespräch lässt sich nun herausfinden, dass die Einteilung der Elemente in diesem Periodensystem folgenden Kriterien entspricht: • • • • Die Elemente einer Gruppe stehen untereinander. Elemente mit gleicher Wertigkeit (falls dieser Begriff schon eingeführt wurde) stehen untereinander. Metalle (links in der Tabelle), stehen den Nichtmetallen (rechts in der Tabelle) gegenüber. Auch der Wasserstoff wird in eine Gruppe (Alkalimetalle) eingebaut, mit deren Elementen er zwar auf den ersten Blick keine Ähnlichkeiten besitzt. Allerdings kann Wasserstoff unter sehr hohem Druck durchaus metallische Eigenschaften annehmen ("metallischer Wasserstoff"). Als solcher ist er zum Beispiel im Kern des Planeten Jupiter vorhanden. Periodensystem der Elemente: Die eben erarbeitete Möglichkeit der Anordnung der Elemente (2. Möglichkeit der Anordnung der Elemente nach Folie 1.2) weist aber scheinbar einen Fehler auf. Sie stellt nämlich in einem Falle keine exakte Sortierung der Elemente nach steigender Atommasse dar. Bei einer Anordnung nach steigender Atommasse müsste nämlich Kalium (39,1 u) vor Argon (39,9 u) und nicht hinter Argon © 2012 LMZ-BW / SESAM - Unterrichtsmodule 3 Periodensystem, Atommodelle und Atombau stehen. Damit würde sich Kalium aber unter den Edelgasen und Argon unter den Alkalimetallen befinden. Dies würde aber dem Prinzip widersprechen, dass in einer Elementgruppe nur chemisch ähnliche Elemente stehen dürfen. Für die Reihenfolge der Elemente ist also die Atommasse nicht das entscheidende Kriterium, da das Ordnungsprinzip der chemischen Verwandtschaft wichtiger ist. Um aber die Reihenfolge der Elemente eindeutig festlegen zu können, wurde für jedes Element eine sogenannte Ordnungszahl definiert, die zusätzlich zur Atommasse eines Elements angegeben wird. In der Tabelle von Folie 1.3 "Hauptgruppen des Periodensystems" bzw. dem Arbeitsblatt "Hauptgruppen des Periodensystems" ist demzufolge für jedes Element unter der Atommasse auch die Ordnungszahl gesetzt. Man erkennt, dass bei dieser Reihenfolge in der Tabelle Elemente periodisch wiederkehren, die ähnliche Eigenschaften aufweisen, also zur gleichen Elementgruppe gehören. Man bezeichnet folglich die Zusammenfassung der chemischen Elemente in einer derartigen Tabelle als "periodisches System der Elemente" oder kurz als "Periodensystem". Im Periodensystem zählt man die Zeilen (Perioden) mit arabischen Zahlen und die Spalten (Elementgruppen) mit römischen Zahlen durch. Eine genauere Begründung für die Einführung der Ordnungszahl ist hier allerdings noch nicht möglich. Den Schülerinnen und Schülern wird einfach mitgeteilt, dass erst eine Vertiefung des Wissens über den Bau der Atome zu einer genauen Definition der Ordnungszahl führen wird. Im Periodensystem von Folie 1.3 sind die Metalle grau markiert. Die Schülerinnen und Schüler sollen in ihrem Arbeitsblatt diese Markierung der Metalle übernehmen. Auch wenn das vorliegende Periodensystem mit den Hauptgruppen noch unvollständig ist, so ist doch schon erkennbar, dass die aufgeführten Elemente im Periodensystem nach links unten mehr metallische Eigenschaften und nach rechts oben mehr nichtmetallische Eigenschaften aufweisen. Wichtige Metalle, wie Kupfer, Silber, Gold, Zink usw. werden hier noch nicht aufgeführt. Diese kommen vielmehr in den sogenannten Nebengruppen des Periodensystems vor, auf die später noch etwas genauer eingegangen werden wird. 3. bis 5. Stunde – Atommodell Atommodell von DALTON (1803): Zum Verständnis der Stoffeigenschaften der Elemente ist es notwendig, das Wissen über den Bau der Atome zu vertiefen. Aus dem Chemieunterricht der vorhergehenden Klassenstufe ist den Schülerinnen und Schülern bekannt, dass Atome so klein sind, dass man sie auch mit den besten Mikroskopen nicht direkt betrachten kann. Zahlreiche Eigenschaften der Atome lassen sich aber messen oder mathematisch berechnen. Auf der Grundlage der mess- oder berechenbaren Eigenschaften verwendet man nun vereinfachende bildliche Darstellungen (Modelle), um die nicht sichtbare Wirklichkeit zu erklären. Ein sehr einfaches Modell ist das den Schülerinnen und Schülern vertraute Modell von DALTON (1803), das nun mit Hilfe von Folie 2.1 "Atommodell von Dalton") wiederholt wird. Im Klassengespräch wird zunächst herausgestellt, dass dieses Modell sehr einfach und einprägsam ist. Anschließend wird die Frage aufgeworfen, was das Atommodell von DALTON für die Chemie leistet. Können wir zum Beispiel mit seiner Hilfe die Eigenschaften der Elemente und ihre Stellung im PSE erklären? © 2012 LMZ-BW / SESAM - Unterrichtsmodule 4 Periodensystem, Atommodelle und Atombau Das Ergebnis des Klassengesprächs wird als Tafelanschrieb zusammengefasst: Atome sind auch mit Mikroskopen nicht sichtbar. Zu ihrer Beschreibung verwendet man Modelle, die auf der Grundlage der messbaren oder berechenbaren Eigenschaften der Atome erstellt werden. Ein sehr einfaches Atommodell ist das von DALTON aus dem Jahre 1803. Das Atommodell von Dalton erklärt: • • • • Atombegriff: ja Atommassen: ja Ordnungszahlen: ja Elementeigenschaften: nein Es zeigt sich also, dass das Modell von DALTON nicht ausreicht, die Eigenschaften der Atome zu beschreiben. Außerdem weist dieses Modell noch einen weiteren gravierenden Mangel auf: Es erklärt nämlich nicht, warum sich Stoffe elektrisch aufladen bzw. warum sie den elektrischen Strom leiten können. Grundbegriffe aus der Elektrizitätslehre: Zunächst ist es wichtig, die Schülerinnen und mit den wichtigsten Grundbegriffen aus der Elektrizitätslehre vertraut zu machen bzw. diese Begriffe zu wiederholen. Zur Demonstration elektrischer Phänomene ist zum Beispiel die Influenzmaschine gut geeignet, die wohl in den meisten Physiksammlungen vorhanden ist. Das Drehen der Kurbel der Influenzmaschine führt zu einer gegenläufigen Drehung der beiden Drehscheiben. Durch sogenannte Influenzeffekte laden sich dabei die beiden Drehscheiben entgegengesetzt auf, wobei es zu einer Ladungsübertragung auf die beiden Metallkugeln kommt. Wenn die Spannung zwischen den Kugeln groß genug ist, kommt es zu Blitzentladungen (Folie 2.2 "Influenzmaschine") (zur genauen Erklärung der Funktionsweise siehe die URL "Influenzmaschine"). Diese elektrische Aufladung ist in Wirklichkeit eine Ladungstrennung, da ursprünglich, das heißt im neutralen Zustand, auf jeder Kugel gleich viele negative und positive Ladungsträger vorhanden waren (Folie 2.3 "Ladungen an der Influenzmaschine"). Durch die Ladungstrennung erhält eine der beiden Kugeln einen positiven Ladungsüberschuss (wird "positiv") und die andere einen negativen Ladungsüberschuss (wird "negativ"). Kommt es nun zu einem Ladungsausgleich (zum Beispiel über Funken) werden beide Kugeln wieder neutral. Für die weiteren Überlegungen ist es wichtig, die Polarität der beiden Kugeln zu bestimmen. Dies kann sowohl mit Hilfe eines speziellen Prüfgerätes als auch mit einer Glimmlampe erfolgen (Folie 2.4 "Polbestimmung"). Dabei darf die Influenzmaschine nicht zu stark aufgeladen werden, damit keine schmerzhafte Entladung über die sich nähernde Hand erfolgt. Bei der Verwendung des Prüfgerätes wird erst die linke, dann die rechte Kugel der Influenzmaschine mit der Kugel des Prüfgerätes berührt. Das Prüfgerät zeigt dann die jeweilige Aufladung der Kugeln an. © 2012 LMZ-BW / SESAM - Unterrichtsmodule 5 Periodensystem, Atommodelle und Atombau Bei der Verwendung einer Glimmlampe ist zu beachten, dass eine Glimmlampe immer an dem Ende glüht, das mit negativer Ladung in Berührung kommt. In Folie 2.4 beispielsweise leuchtet die Glimmlampe an der Seite, die mit der linken Kugel der Influenzmaschine verbunden ist. Das bedeutet, dass die linke Kugel der abgebildeten Influenzmaschine negativ geladen ist. Wird eine über den Körper geerdete Glimmlampe aber an eine positiv geladene Kugel gehalten, so leuchtet die entgegengesetzte Glimmlampenseite auf, weil von der Erde negative Ladung "nachfließt", um die positive Ladung zu neutralisieren. Vereinfachend lässt sich dieses Verhalten der Glimmlampe damit erklären, dass nur die negative Ladung beweglich ist, da es sich bei der negativen Ladung um sehr kleine, bewegliche Teilchen handelt, die sogenannten Elektronen. Hingegen handelt es sich bei der positiven Ladung um Ladungsträger, die in den Atomen der Stoffe "fest eingebaut" und daher unbeweglich sind. Die obere Abbildung von Folie 2.5 ("Glimmlampe/Stromkreis") zeigt, wie die beweglichen Elektronen ihre Elektrode verlassen können. Sie treffen dabei auf die Neonatome der Gasfüllung, die dabei zum Leuchten angeregt werden. Auch in einem elektrischen Stromkreis fließen nur die negativen Ladungsträger, also die Elektronen, die durch eine "Elektronenpumpe" (Netzgerät oder Batterie) durch den Stromkreis gepumpt werden. Zur Verdeutlichung kann hier ein einfacher Stromkreis aus Batterie, Drähten und Birnchen aufgebaut werden (siehe unteren Teil von Folie 2.5: "Glimmlampe/Stromkreis"). Atommodell von THOMSON: Mit diesem Modell aus dem Jahr 1903 wurden die Erkenntnisse aus der Elektrizitätslehre aufgegriffen und das Modell von Dalton entsprechend verändert (siehe Folie 2.6 "Atommodell von Thomson"). Positive Ladung ist nach THOMSON in den Atomen gleichmäßig verteilt, fest eingebaut und daher unbeweglich. Auch die Masse des Atoms ist diffus verteilt. Demgegenüber ist die negative Ladung (Elektronen) in den Atomen beweglich. Sie kann daher auch nach außen abgegeben oder von außen aufgenommen werden. Abschließend wird das Modell von THOMSON mit den Grundbegriffen der Elektrizitätslehre kurz an der Tafel skizziert. Streuversuch von RUTHERFORD: Um Genaueres über die Verteilung von Masse und Ladung im Atom zu erfahren, hatte der Physiker Ernest RUTHERFORD 1910 die Idee, die Atome einer sehr dünnen Goldfolie mit den von ihm entdeckten sogenannten alpha-Strahlen zu beschießen; alpha-Strahlen werden von vielen radioaktiven Stoffen (zum Beispiel Radium) abgegeben. Sie sind schnell fliegende Heliumatome, denen zwei Elektronen fehlen und die daher zweifach positiv geladen sind. Für seinen Versuch brachte RUTHERFORD ein radioaktives Präparat (die Quelle der alpha-Strahlen) in einem Bleiblock unter, der aus einer engen Öffnung die Strahlen nur in Richtung der Goldfolie als Strahlenbündel durchließ (Folie 2.7 a"Versuch von Rutherford – Versuchsaufbau"). Da alpha-Strahlen von den Molekülen der Luft abgebremst werden, musste der Versuch im Vakuum durchgeführt werden. Nach der Erläuterung durch die Lehrkraft beschriften die Schülerinnen und Schüler ihr Arbeitsblatt "Versuch von Rutherford – Versuchsaufbau". © 2012 LMZ-BW / SESAM - Unterrichtsmodule 6 Periodensystem, Atommodelle und Atombau RUTHERFORD und seine Mitarbeiter erwarteten, dass bei ihrem Versuch die Strahlen weitgehend unverändert und fast ohne Richtungsänderung die sehr dünne Goldfolie passieren müssten. Bei ihren Überlegungen waren sie nämlich von THOMSONS Atommodell ausgegangen. Danach sollten alpha-Teilchen mit ihrer großen Bewegungsenergie Goldatome leicht durchdringen können, weil nach diesem Modell die Masse der Atome auf ein großes Volumen verteilt ist. Die Atome bieten somit den schnellen alpha-Teilchen kein richtiges Hindernis (Folie 2.7 b "Versuch von Rutherford – theoretische Vorhersage"). Dementsprechend müssten also die meisten alpha-Teilchen geradlinig oder nur wenig gestreut die Goldfolie passieren und so auf einem dahinterliegenden Zinksulfidschirm als Lichtblitze zu registrieren sein Folie 2.7 "Versuch von Rutherford – erwartetes/tatsächliches Messergebnis"). Die Schülerinnen und Schüler beschriften nun das Arbeitsblatt "Versuch von Rutherford – erwartetes Messergebnis". Anschließend wird der Klasse das tatsächliche Messergebnis präsentiert (Folie 2.7 c). Zwar passierte der größte Teil der Strahlen tatsächlich – wie vorhergesagt – fast ohne Ablenkung die Goldfolie. Manche alpha-Teilchen wurden aber viel stärker abgelenkt (gestreut) als erwartet und einige wenige prallten sogar von der Folie ab. RUTHERFORD musste sehr überrascht gewesen sein, als ein Mitarbeiter ihm dieses unerwartete Messergebnis präsentierte. Die Schülerinnen und Schüler vermerken anschließend das Ergebnis des Rutherfordversuchs im Arbeitsblatt "Versuch von Rutherford – tatsächliches Messergebnis" und diskutieren, wie dieses Ergebnis zu interpretieren ist. Dabei wird herausgearbeitet, dass die Atome der Goldfolie die alpha-Teilchen stärker als erwartet beeinflussen. Folie 2.7 d "Versuch von Rutherford – Versuchsergebnis" verdeutlicht diese Aussage. Von der Lehrkraft wird dann darauf hingewiesen, dass man auch im Forschungsteam um RUTHERFORD verwundert war, wie stark manche alpha-Teilchen durch die Atome der Goldfolie abgelenkt wurden. Die alpha-Teilchen mussten dabei von Teilchen beeinflusst worden sein oder mit Teilchen zusammengestoßen sein, die eine wesentlich größere Masse als sie selbst besitzen. Da diese physikalischen Vorgänge mit dem Atommodell von THOMSON nicht erklärt werden können, musste das Forscherteam anhand der Messwerte ein neues Atommodell berechnen. Das Atommodell nach RUTHERFORD: Diese Berechnungen führten zu der Annahme, dass es nur dann zu der beobachteten Ablenkung bzw. Rückstreuung von alpha-Teilchen kommen kann, wenn praktisch die gesamte Masse und die gesamte positive Ladung der Goldatome in einem kleinen Zentralbereich konzentriert ist. Diesen Bereich bezeichnete RUTHERFORD als Atomkern. Der positiv geladene Atomkern ist dann zum Ladungsausgleich von den negativ geladenen Elektronen umgeben, die praktisch masselos sind. Die Elektronen bewegen sich dabei in einem Bereich, dessen Radius 10 000 mal größer als der Kernradius ist und Atomhülle genannt wird, wobei der Raum zwischen den Elektronen leer sein muss. Somit kann erklärt werden, dass die meisten der alpha-Teilchen, die im Versuch von RUTHERFORD die Goldfolie durchdringen, nicht abgelenkt werden, weil sie überhaupt nicht auf einen Kern treffen. Jedoch werden diejenigen der positiv geladenen alpha-Teilchen, die dem ebenfalls positiven Kern zu nahe kommen, stark abgelenkt. Stoßen sie direkt auf den Atomkern, © 2012 LMZ-BW / SESAM - Unterrichtsmodule 7 Periodensystem, Atommodelle und Atombau prallen sie sogar zurück (Folie 2.7 e "Folgerungen aus dem Versuch von Rutherford" ). Des Weiteren nahm Rutherford an, dass die Elektronen auf beliebigen Bahnen um den Kern kreisen, was verhindert, dass sie auf den Kern stürzen ("Planeten-Bahnen"). Im Übrigen machte er keine genaueren Angaben über die Bahnen und den Aufenthalt der Elektronen. Das Modell, das von Rutherford, seinen Mitarbeitern und Kollegen entwickelt wurde, wird auch als Kern-Hülle-Atommodell bezeichnet (Folie 2.8: Atommodell von Rutherford – Kern-Hülle-Modell ). Zur Ergebnissicherung der erarbeiteten Sachverhalte beschriften die Schülerinnen und Schüler das Atommodell im Arbeitsblatt "Atommodell von Rutherford – Kern-Hülle-Modell" . Bausteine der Atome: Weitere Forschungen ergaben, dass auch der Atomkern aus einzelnen Teilchen besteht. Zunächst erkannte man, dass im Atomkern sogenannte Protonen vorkommen. Sie tragen jeweils eine positive Ladung und besitzen die Masse 1 u. Später entdeckte man, dass im Atomkern auch neutrale Teilchen existieren, die ebenfalls die Masse 1 u besitzen und als Neutronen bezeichnet werden. Atome sind also nicht unteilbar. Protonen, Neutronen und Elektronen sind die "Bausteine" der Atome. Die Schülerinnen und Schüler vervollständigen nun entsprechend der Folie 2.8 (Abschnitt: "Bestandteile der Atome“) ihr Arbeitsblatt "Atommodell von Rutherford – Kern-Hülle-Modell" . Berücksichtigt man den Aufbau eines Atomkerns aus Protonen und Neutronen, so erweitert sich das Atommodell von RUTHERFORD. Am Beispiel des He-Atoms wird dies mit der Klasse erarbeitet. Im Kern des He-Atoms mit der Masse 4 u (siehe Tafel mit dem Periodensystem) befinden sich vier Kernteilchen, die auch als Nukleonen bezeichnet werden. Dabei konnten die Forscher zeigen, dass es sich um zwei Protonen und zwei Neutronen handelt, wie es in Folie 2.9 "Kern-Hülle-Modell – Protonen, Neutronen und Elektronen" dargestellt wird. Zum Ladungsausgleich müssen dementsprechend zwei Elektronen in der Atomhülle vorhanden sein. Die Protonenzahl entspricht dabei der bereits erwähnten Ordnungszahl. Zur Ergebnissicherung wird nun der Aufbau eines He-Atoms als Tafelskizze erstellt und die neu eingeführten Begriffe im Tafelanschrieb festgehalten. Die Schülerinnen und Schüler erhalten nun den Arbeitsauftrag, in Gruppen nach gleichem Muster Skizzen für die Atome der Elemente Be, F und Na zu erarbeiten. Die Ergebnisse werden anschließend an der Tafel verglichen. Dieser Arbeitsauftrag könnte stattdessen aber auch Bestandteil einer Hausarbeit sein. Isotope: Am Beispiel von Chlor (Atommasse laut Periodensystemtafel 35,5 u) ergibt sich eine Schwierigkeit. Da nämlich jedes Nukleon ziemlich genau die Masse 1 u aufweist, sollten die Atomgesamtmassen auch jeweils ganzzahlige Werte aufweisen. Dabei wird vorausgesetzt, dass die Masse der Elektronen vernachlässigt werden kann (siehe Folie © 2012 LMZ-BW / SESAM - Unterrichtsmodule 8 Periodensystem, Atommodelle und Atombau 2.8). Dieser Widerspruch klärt sich auf, wenn man die Massen einzelner Chloratome bestimmt. Dabei findet man nämlich Chloratome mit der Masse 35 u (zu 75 %) und Chloratome mit der Masse 37 u (zu 25 %). Es gibt also Chloratome mit unterschiedlichen Massen. Der Wert von 35,5 u ist damit nur als Mittelwert dieser beiden "Sorten" von Cl-Atomen zu verstehen. Worin unterscheiden sich aber die beiden "Sorten" von Cl-Atomen? Nach dem bisher Gesagten unterscheiden sich die Atome der verschiedenen Elemente in ihrer Ordnungszahl (= Protonenzahl). Daraus folgt, dass sich die beiden "Sorten" von Cl-Atomen nicht in ihrer Protonenzahl, sondern nur in ihrer Neutronenzahl unterscheiden können: 1735Cl hat 18 Neutronen und 1737Cl hat 20 Neutronen. Diese beiden "Sorten" von Cl-Atomen sind chemisch völlig gleich. Sie unterscheiden sich nur in ihrer Masse. Sie gehören dem gleichen Element, nämlich Chlor, an und stehen somit an gleicher Stelle des Periodensystems (gr. isotopos = am gleichen Ort) und werden daher als Isotope bezeichnet. Diese im Klassengespräch erarbeiteten Sachverhalte werden nun im Tafelanschrieb festgehalten. Neben dem Chlor bestehen auch andere Elemente aus einem Gemisch von isotopen Atomen (zum Beispiel Magnesium, Schwefel ...). Solche Elemente nennt man Mischelemente. Die für ein Isotopengemisch ermittelte Atommasse stellt einen Mittelwert dar. Dieser ergibt sich, wie beim Chlor schon gezeigt, aus der Atommasse der Einzelatome und deren prozentualem Anteil am Isotopengemisch. Elemente wie Beryllium und Fluor hingegen bestehen nur aus einer Atomsorte. Sie werden als Reinelemente bezeichnet. Überraschenderweise handelt es sich auch beim Wasserstoff um ein Mischelement. Gewöhnlicher Wasserstoff besteht nämlich nicht nur aus 11H, sondern enthält noch 0,02 % 12H, das auch als Deuterium (gr. das Zweite, Symbol "D") bezeichnet wird. Daneben kommt noch in winzigen Spuren 13H vor, das Tritium (gr. das Dritte, Symbol "T") genannt wird. Die im Klassengespräch neu erarbeiteten Sachverhalte werden ebenfalls im Tafelanschrieb festgehalten. 6. bis 8. Stunde – Atommodell von Rutherford Grenzen des Atommodells von Rutherford: Im Klassengespräch wird die Frage aufgeworfen, was das Atommodell von Rutherford für die Chemie leistet. Kann es beispielsweise erklären, warum 24He ein Edelgas, aber 36,9Li ein Metall ist? Warum ist Sauerstoff reaktionsfreudig, das Nachbarelement Stickstoff hingegen sehr reaktionsträge? Ergebnis der Diskussion: Das Modell liefert eine Begründung für die unterschiedlichen Ordnungszahlen und Atommassen der einzelnen Elemente . Es erklärt aber nicht deren unterschiedliche chemischen Eigenschaften. Es erklärt auch nicht, wie die chemische Bindung zwischen Atomen zustandekommt. © 2012 LMZ-BW / SESAM - Unterrichtsmodule 9 Periodensystem, Atommodelle und Atombau Anmerkung: Das Atommodell von Rutherford ist unzulänglich, weil die Atomhülle einfach als Raum betrachtetet wird, in dem sich die Elektronen quasi frei bewegen können. Hier fehlen genauere Angaben zum "Verhalten" der Elektronen. Das Ergebnis der Diskussion wird als Tafelanschrieb in Tabellenform zusammengefasst: Das Atommodell von Rutherford erklärt: • • • • Atommassen: ja Ordnungszahlen: ja chemische Eigenschaften der Elemente: nein chemische Bindung: nein Anmerkung: Das Atommodell von Rutherford macht keine Angaben zum genauen Aufbau der Atomhülle. Elektronenabgabe von Atomen: Atome sind nach dem Modell von Rutherford nach außen elektrisch neutral, wenn die Zahl der Protonen des Atomkerns der Zahl der Elektronen entspricht. Zwischen der positiven Ladung des Kerns und der negativen Ladung der Elektronen bestehen elektrische Anziehungskräfte, die verhindern, dass die Elektronen die Atomhülle nach außen verlassen können. Die erste Hälfte von Folie 3.1"Ionisierung von H-Atomen" zeigt am Beispiel des Wasserstoffatoms, wie sich positive Ladung (Atomkern) und negative Ladung (Atomhülle) die Waage halten. Führt man aber Wasserstoffgas Energie zu (zum Beispiel energiereiche Strahlung), so können die Atome ihre Elektronen abgeben (zweite Hälfte von Folie 3.1). Das H-Atom zeigt nun nur noch die Ladung des Atomkerns, es ist also positiv geladen: Schreibweise: H (Energiezufuhr) -> H+ + e- Das H+-Teilchen wandert im elektrischen Feld in Richtung Minuspol. Es wird daher als Ion (gr. das Wandernde) bezeichnet. Die Abspaltung eines Elektrons wird Ionisierung genannt, wobei die Energie, die gerade ausreicht, um von einem Atom ein Elektron abzutrennen, die sogenannte Ionisierungsenergie darstellt. Diese unterscheidet sich zwischen den verschiedenen Atomsorten und wird zum Beispiel in MJ/mol angegeben. Für Wasserstoffatome lässt sich ein Wert von 1,3 MJ/mol messen. Zur Ergebnissicherung werden die eben besprochenen Vorgänge als Tafelanschrieb festgehalten. Beim nächsten Element des Periodensystems, dem Helium, können von dessen Atomen zwei Elektronen abgetrennt werden (siehe Folie 3.2 "Ionisierung von He-Atomen"). Messungen ergaben, dass für die Abspaltung des zweiten Elektrons ein höherer Energiebetrag aufgebracht werden muss als für die Abspaltung des ersten Elektrons. Dies ist darauf zurückzuführen, dass ein einzelnes Elektron alleine der Ladung und damit Anziehung der beiden Kernprotonen ausgesetzt ist. Die Energie zur Abspaltung des ersten Elektrons wird als erste Ionisierungsenergie und die für die Abspaltung des zweiten Elektrons als zweite Ionisierungsenergie bezeichnet. © 2012 LMZ-BW / SESAM - Unterrichtsmodule 10 Periodensystem, Atommodelle und Atombau Zur Ergebnissicherung werden alle neuen Sachverhalte dem obigen Tafelanschrieb hinzugefügt. Die Ionisierung von Li-Atomen: Die Ionisierungsenergien für die drei Elektronen des Lithiums sind in Folie 3.3 a "Ionisierung von Li-Atomen"angegeben. Dabei fällt die sprunghafte Zunahme der Ionisierungsenergie vom ersten zum zweiten Elektron auf. Verdeutlicht wird dies noch durch die Tabelle in Folie 3.3 b "Vergleich der Ionisierungsenergien“. Beim He ist der Wert für die zweite Ionisierungsenergie das 2,2fache des Wertes für die erste Ionisierungs-energie. Beim Li hingegen steigt der Wert auf das 14fache an. Dies ist nur zu erklären, wenn man für die Elektronen unterschiedliche "Aufenthaltsräume" annimmt (Folie 3.3 b): Elektronen, die näher am Kern sind, werden dabei stärker festgehalten. Zu ihrer Abspaltung ist eine größere Energiemenge nötig als zur Abspaltung kernfernerer Elektronen. Zur Ergebnissicherung übernehmen die Schülerinnen und Schüler die Beschriftung der Folie 3.3 b in den oberen Teil des Arbeitsblatts "Ionisierung von Li-Atomen und Elektronenschalen". Das Schalenmodell der Atomhülle: Die Lehrkraft gibt eine kurze Einführung zum Schalenmodell der Atomhülle: Das Atommodell von RUTHERFORD wurde von vielen Forschern weiterentwickelt. Schon Niels BOHR postulierte 1913, dass sich die Elektronen nicht auf beliebigen Bahnen in der Atomhülle bewegen können, sondern auf bestimmten, berechenbaren Kreisbahnen den Kern umrunden. Diese These wurde durch die Erkenntnisse der Physik und die Berechnung von Mathematikern untermauert und führte zum sogenannten Orbitalmodell der Atomhülle. Im Unterricht verwendet man häufig ein vereinfachtes ("didaktisches") Modell, das sogenannte Schalenmodell (siehe die Sachinformation "Schalenmodell der Atomhülle" ). In diesem Modell sind um den Kern herum Schalen angeordnet (wie bei einer Zwiebel). Diese Schalen repräsentieren Aufenthaltsräume für Elektronen, die in diesen Bahnen den Kern umkreisen. Nach den Gesetzen der Quantenphysik kann man die Bahnen (den Aufenthalt) der Elektronen nicht genau berechnen. Die Schalen stellen daher nur wahrscheinliche Aufenthaltsräume dar, die einem bestimmten Ionisierungsenergieniveau entsprechen. Folglich müssen für die Elektronen einer Schale in etwa "vergleichbare Energiemengen" für die Ionisierung aufgebracht werden. Folie 3.3 c " Schalen eines Li-Atoms" stellt nun ein solches Schalenmodell für das Li-Atom dar. Die Schülerinnen und Schüler übernehmen den Text der Folie in den unteren Teil ihres Arbeitsblatts "Ionisierung von Li-Atomen und Elektronenschalen". Die Schalen eines C-Atoms: Anhand der Werte für die Ionisierungsenergien ( Arbeitsblatt "Schalen eines C-Atoms") sollen die Schülerinnen und Schüler in Gruppenarbeit die Verteilung der sechs Elektro-nen in den beiden Elektronenschalen vornehmen. Die Ergebnisse der Schülerinnen und Schüler werden hinterher mit Folie 3.4 "Schalen eines C-Atoms" verglichen. Die Elektronenschalen von Na und Mg: Nachdem nun das Schema der Elektronenverteilung für Lithium und Kohlenstoff, also für zwei Elemente der zweiten © 2012 LMZ-BW / SESAM - Unterrichtsmodule 11 Periodensystem, Atommodelle und Atombau Periode des Periodensystems erarbeitet wurde, werden nun zwei Elemente der nächsten Periode betrachtet, nämlich Natrium und Magnesium. Zuerst sollen die Schülerinnen und Schüler die vorgegebenen Tabellenwerte des Arbeitsblatts "Ionisierungsenergien für Na und Mg" in die beigefügte Graphik übertragen. Diese Graphik wird anschließend im Klassengespräch ausgewertet, wobei zur Anschauung auf Folie 3.5 "Ionisierungsenergien für Na und Mg" zurückgegriffen werden kann. Aus den deutlich sichtbaren Abstufungen der Ionisierungsenergien kann auf die Zahl der Elektronenschalen geschlossen werden. Die Schülerinnen und Schüler sollen nun in Gruppenarbeit in das Arbeitsblatt "Elektronenschalen von Na und Mg" die Elektronen einzeichnen. Einzelne Gruppen tragen anschließend ihre Ergebnisse vor und begründen diese. Zur Ergebnissicherung kann außerdem Folie 3.6"Elektronenschalen von Na und Mg" Verwendung finden. Ionisierungsenergien und die Verteilung der Elektronen auf die Elektronenschalen der ersten 20 Elemente des Periodensystems: Aus den Ionisierungsenergien kann jetzt auch für weitere Elemente des Periodensystems auf die Elektronenverteilung geschlossen werden. Die Schülerinnen und Schüler erhalten zur Bearbeitung das Arbeitsblatt "Ionisierungsenergien und Verteilung der Elektronen". Nach der Vorgabe der Folien 3.7a und b "Ionisierungsenergien der ersten 20 Elemente und Elektronenverteilung auf die einzelnen Schalen" sollen auf diesem Arbeitsblatt die Energiestufen für die Ionisierungsenergien markiert werden. Daraus lässt sich ableiten, wie die Elektronen sich auf die einzelnen Schalen verteilen (Spalte "Elektronenverteilung" des Arbeitsblatts). Die gefundene Elektronenverteilung kann nun für die einzelnen Elemente in die untere Tabelle des Arbeitsblatts eingetragen werden. Die Ergebnisse lassen sich mit Hilfe der Folie 3.8 "Elektronenverteilung bei den ersten 20 Elementen des Periodensystems" vergleichen. Die Außenelektronenzahlen: Die Folie 3.8"Elektronenverteilung bei den ersten 20 Elementen des Periodensystems" (bzw. das entsprechende Arbeitsblatt) wird genauer analysiert. Dabei zeigt sich, dass die Elemente einer Spalte (Gruppe) in der äußersten Schale immer gleich viele Elektronen aufweisen. Diese Elektronen werden auch als Außenelektronen bezeichnet. Die Außenelektronenzahl eines Hauptgruppenelements entspricht dabei auch genau seiner Gruppenzahl im Periodensystem. Da dieses Zahl für die chemische Eigenschaften eines Elements sehr wichtig ist, sollen die Schülerinnen und Schüler die Außenelektronen in demArbeitsblatt "Außenelektronenzahlen bei Hauptgruppenelementen des Periodensystems" eintragen. Zur Ergebnissicherung können die Schülerergebnisse mit der Folie 3.9 "Außenelektronenzahlen bei Hauptgruppenelementen des Periodensystems" verglichen werden. Die Hauptgruppen des Periodensystems im Überblick: Folie 3.10"Hauptgruppen des Periodensystems" gibt einen Überblick zu den Hauptgruppen des Periodensystems. In der Folie sind die Metalle dunkelgrau, die Halbmetalle hellgrau und die Nichtmetalle unmarkiert. Für jedes Element sind jeweils drei Zahlenwerte angegeben: Atommasse, Ordnungszahl und Elektronegativitätszahl. Die letzte Zahl wird dabei zunächst nicht weiter erläutert. Es wird lediglich darauf verwiesen, dass sie im Laufe des Chemieunterrichts dieser Jahrgangsstufe noch eine Rolle spielen wird (siehe polare Atombindung). Die Schülerinnen und Schüler bekommen anschließend das gleichnamige Arbeitsblatt "Hauptgruppen des Periodensystems" ausgeteilt und vervollständigen es © 2012 LMZ-BW / SESAM - Unterrichtsmodule 12 Periodensystem, Atommodelle und Atombau entsprechend der oben erwähnten Folie. Haupt- und Nebengruppen des Periodensystems: Zum Schluss wird mit Hilfe der Folie 3.11 "Haupt- und Nebengruppen des Periodensystems" ein Überblick auch über die Nebengruppen des Periodensystems gegeben. Diese Folie kann gegebenenfalls auch als Arbeitsblatt an die Schülerinnen und Schüler ausgeteilt werden. © 2012 LMZ-BW / SESAM - Unterrichtsmodule 13 Periodensystem, Atommodelle und Atombau Bildungsplanbezug Gymnasium (auch geeignet für Realschule; Bezüge siehe unten) Chemie, Klasse 10 STOFFE UND IHRE TEILCHEN Die Schülerinnen und Schüler können • • • das Kern-Hülle-Modell von Atomen ( Protonen, Elektronen, Neutronen) und ein Erklärungsmodell für die energetisch differenzierte Atomhülle ( Ionisierungsenergie) beschreiben. die Molekülbildung durch Elektronenpaarbindung unter Anwendung der Edelgasregel erläutern (bindende und nichtbindende Elektronenpaare); den räumlichen Bau von Molekülen mithilfe eines geeigneten Modells erklären; ORDNUNGSPRINZIPIEN • Die Schülerinnen und Schüler können den Zusammenhang zwischen Atombau und Stellung der Atome im PSE erklären (Ordnungszahl, Protonenanzahl, Elektronenanzahl, Massenzahl, Valenzelektronen, Hauptgruppe, Periode). (Aus: Bildungsplan Baden-Württemberg 2004 – Gymnasium, Kompetenzen und Inhalte für Chemie, Klasse 10; Seiten 196-197) Realschule Naturwissenschaftliches Arbeiten, Klasse 8 KOMPETENZERWERB DURCH DAS ERSCHLIESSEN VON PHÄNOMENEN, BEGRIFFEN UND STRUKTUREN Die chemische Fachsprache und das Periodensystem nutzen © 2012 LMZ-BW / SESAM - Unterrichtsmodule 14 Periodensystem, Atommodelle und Atombau Die Schülerinnen und Schüler können mit den Begriffen Stoff – Reaktion – Element – Atom – Energie folgerichtig argumentieren. [...] Sie können aus dem Periodensystem Informationen entnehmen und Tabellen zur Eigenschaftsbeschreibung nutzen. KOMPETENZERWERB IM GRUNDLAGENORIENTIERTEN UNTERRICHT DER KLASSEN 8 UND 9 In den Klassen 8 und 9 steht die Erarbeitung von fachspezifischen Grundlagen im Vordergrund. Hier kann sowohl in Themeneinheiten als auch systematisch unterrichtet werden. Die Module des Fächerverbundes „Naturwissenschaftliches Arbeiten“ (Biologie, Chemie, Physik) können dabei nacheinander oder nebeneinander oder integrativ realisiert werden. (Aus: Bildungsplan Baden-Württemberg 2004 – Realschule, Kompetenzen und Inhalte für Naturwissenschaftliches Arbeiten, Klassen 5-10; Seite 98 bis 102) Ausführliche Informationen zum Bildungsplan Baden-Württemberg 2004 gibt es unter Bildung stärkt Menschen. © 2012 LMZ-BW / SESAM - Unterrichtsmodule 15