Vorlesung 7
Werbung

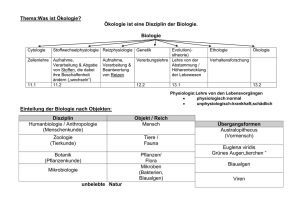
VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Marine Mikrobiologie II http://commtechlab.msu.edu/CTLProjects/dlc-me/zoo/ © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Welche Arten dominieren das Ökosystem? • Größenklassen, Arten • Wie analysiert man die Populationen? Welche Leistungen sind nachweisbar? • Aktivitäten • Wachstumsraten • Wodurch sind die Aktivitäten und Wachstum limitiert? • Wie mißt man die Leistungen? © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Größenklassen von Mikroben im Meerwasser Die wichtigsten Gruppen: Mesoplankton 0.2 - 20 mm Microplankton 20 - 200 µm Nanoplankton 2 - 20 µm Picoplankton 0.2 - 2 µm Femtoplankton 0.02 - 0.2 µm Phytoplankton Diatomeen Dinoflagellaten Mikroflagellaten Cyanobakterien Bakterioplankton Bakterien meist 0.03 bis 0.4 µm klein Zooplankton heterotrophe Nanoflagellaten Copepoden © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Wie analysiert man die Populationen? Phytoplankton (> Picopl.) im Mikroskop (Morphologie, Autofluoreszenz) Pigmente (Satelitenbilder, HPLC, Flowcytometrie) Bakterien: Kultivierung (MPN), Molekularbiologie (FISH, DGGE) © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Verteilung von Chlorophyll im Ozean © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Wind UV Oberfläche Bakterien Flowcytometrie 104 Synechococcus 20 m 103 Viren Mikrozooplankton Thermocline 80 m Prochlorococcus Synechococcus 101 Picoeucaryoten FL3-Height 102 Chlorophyll Picoeucaryotes 100 Prochlorococcus NO3 PO4 100 Fe 101 102 SSC-Height 103 104 150 m Abbildungen: Station Biologique de Roscoff CNRS and Université Pierre et Marie Curie, France © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Analyse von Bakteriengemeinschaften Kultivierung: MPN-Methode 1 2 3 4 5 6 7 8 9 10 11 12 A B C D 10 10-7 Parallele 3 -6 Parallele 2 H 10-5 Parallele 1 G 10-4 Kontrolle F 10-3 E 10-2 Anreicherung Ilsolierung Identifizierung © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Welche Aktivitäten zeigen Mikroorganismen? Phytoplankton: Produktion im Mittel 68.7 g Corg m 2 a -1 (etwa 1 Tafel Schokolade) Zooplankton: Freßraten von Flagellaten: 5 - 300 Bakterien h-1 Bakterien: Ekto-, Exoenzyme, zersetzen Detrituspartikel und Polymere Merke: Bakterien haben keine Zähne! ingestierte Partikel werden stets osmotroph aufgenommen das ganze Gewässer dient als Nahrungsvakuole der Bakterien Effektive Aufnahme von N, P, Fe © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Welche Wachstumsraten zeigen Mikroorganismen? Phytoplankton abhängig von Jahreszeit, N, P Fe, Licht etc. (Temp.?) Bakterien Verdopplungszeit von 1 - 20 d Wodurch sind die Aktivitäen und Wachstum limitiert? Nicht grundsätzlich durch Licht, Temperatur, CO2 Meist durch Nährstoffe: Fe > N > P > (Mn) (Si) © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Wie mißt man die Aktivitäten, Probleme??? System ist im Fließgleichgewicht (Es tut sich fast nichts) Erhebliche Veränderung der Situation durch: Div. Kontrollen Substratzusatz Ausschluß von Größenklassen oder Licht etc. => Tracer in Spurenkonzentrationen am besten geeignet © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Wie mißt man die Aktivitäten? Messung von Primäproduktion: 14CO -Fixierung 2 im Licht (minus Dunkelkontrolle) O2-Freisetzung (minus Dunkelkontrolle) Messung von Bakterienwachstum: 3H-Thymidin-Aufnahme (1/4 der DNA) Einbau von markierten Aminosäuren (Leucin) 35S-SO 24 Assimilation ATP-Zunahme Messung von mikrobiellen Abbauvorgängen: CO2-Freisetzung O2-Aufnahme Umsatz von Modellsubstraten MUF (Methylumbelliferyl-Rest fluoresziert nach Abspaltung durch (Exo)-Enzym) Bestimmung des "Heterotrophen Potentials„ durch Einbau von zugesetzten markierten Substraten © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Molekularbiologische Analyse von Bakteriengemeinschaften Die prokaryontisch 16S rRNA V7 V6 - in allen lebenden Organismen vorhanden - hohe Kopienzahl V5 V8 - ausreichend lang (16S rDNA: ca. 1.500 bp), - Mutation hat oft letale Wirkung Yves Van de Peer (1996), modifiziert 5’ V9 - von Umweltbedingungen unabhängiger V3 3’ (konstanter) Selektionsdruck V1 - Sekundärstruktur an vielen Stellen hochkonserviert - Vergleich analoger, variablerer Sequenzabschnitte absolut konserviert V2 hoch variabel E. coli, aber nicht in > 75% aller Bakterien Die Evolution des Moleküls spiegelt die ihrer Träger wider („molekulare Uhr“) © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Analyse von Bakteriengemeinschaften (TGGE / DGGE) Molekularbiologie: Aufbau TGGE Trennprinzip DGGE / TGGE Elektrophorese - + PCR-Produkt 30 % Doppelstrang Teilweise geschmolzen T2 [°C] T1 ∆T [cm] Linearer thermischer Gradient 70 % + Einzelstränge Denaturierender Gradient parallel zur Elektrophoreserichtung © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 Schematischer Verlauf einer TGGE Bakterien Reinkulturen Temperatur-Gradient Elektrophorese - Bakterien Gemeinschaften + © Bert Engelen VL Mikrobielle Ökologie: Standorte und Prozesse, 25.11.2003 „Fingerprinting“ von Bakteriengemeinschaften Umwelt-Probe Extraktion Nukleinsäuren DNA / RNA Sequenzierung 16S rDNA/rRNA Sequenzen PCR rT-PCR 16S rDNA / rRNA der Bakteriengemeinschaft DGGE Bildanalyse Digitalisierung TGGE Fingerprints der Bakteriengemeinschaft Phylogenetische Zuordnung Clusteranalyse © Bert Engelen