Cefuroxim Labatec® iv
Werbung

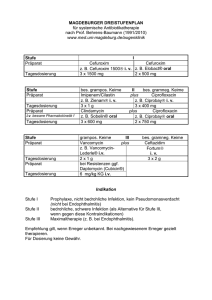
® Cefuroxim Labatec i.v. kombiniert werden Darreichungsform). Zusammensetzung Dosierung Wirkstoff: Cefuroximum (ut Cefuroximum natricum). Hilfsstoffe: keine. Galenische Form und Wirkstoffmenge pro Einheit Durchstechflasche zu 750 mg und 1,5 g Cefuroxim (resp. 789 mg und 1,578 g Cefuroxim-Natrium) Pulver zur Herstellung einer Injektionsoder Infusionslösung. (orale, rektale oder parenterale Die Dosis und die Art der Verabreichung richten sich nach dem Schweregrad der Infektion, der Empfindlichkeit des Erregers und dem Zustand des Patienten, die Dauer der Behandlung nach dem Ansprechen der Erreger und dem klinischen Bild. Übliche Dosis für Erwachsene und Jugendliche ab 14 Jahren Art der Infektion Einzel dosis Dosierungs intervall Tagesdosis Bei unkomplizierten Fällen mit sensiblen Erregern 750 mg i.v. alle 8 Std. 2,25 g Bei schweren Infektionen oder mässig sensiblen Erregern 1,5 g i.v. alle 8 oder 6 Std. 4,5–6,0 g Indikationen/Anwendungsmöglichkeiten Cefuroxim Labatec i.v. ist zur Behandlung von Infektionen indiziert, welche durch Cefuroxim-empfindliche Erreger verursacht werden: Wie Oberer Respirationstrakt: Sinusitis, Tonsillitis, Pharyngitis und Otitis media. Unterer Respirationstrakt: Akute und chronische Bronchitis, infizierte Bronchiektasen, bakterielle Pneumonie, Lungenabszess und postoperative Infektionen. Kinder ab 3 Monaten Harnwege: Je nach Schwere der Infektion 30–100 mg/kg KG/Tag, meist 60 mg/kg, aufgeteilt in 3 (–4) Einzeldosen. Akute und chronische Pyelonephritis und Zystitis. Neugeborene Weichteile: Die empfohlene Dosis beträgt 30–100 mg/kg KG/Tag, aufgeteilt in 2 (–3) Einzeldosen (siehe «Pharmakokinetik»). Erysipel und Wundinfektionen. Knochen und Gelenke: Bei Neugeborenen sind unter Berücksichtigung der 3–5× niedrigeren Nierenclearance die Dosierungsintervalle auf (8–) 12 Stunden zu verlängern. Osteomyelitis und septische Arthritis. Meningitis Gynäkologie: Infektionen im Bereich des Beckens. Andere Infektionen: Erwachsene und Jugendliche ab 14 Jahren: 3× tägl. 3 g i.v. (alle 8 Std.). Kinder ab 3 Monate: Initialdosis 150–250 mg i.v./kg KG/Tag, jedoch nicht mehr als die Erwachsenendosis, nach klinischer Besserung noch 100 mg i.v./kg KG/Tag aufgeteilt in 3 (–4) Einzeldosen. auch Sepsis, Meningitis und Peritonitis. Wo immer möglich sollte die Keimempfindlichkeit geprüft werden. In Notfallsituationen kann die Therapie mit Cefuroxim Labatec i.v. vor Eintreffen des Antibiogrammes eingeleitet werden. Neugeborene: Initialdosis 150 mg i.v./kg KG/Tag, nach klinischer Besserung noch 50 mg i.v./kg KG/Tag aufgeteilt in 2 (–3) Einzeldosen. Alternative Dosierung Cefuroxim Labatec i.v. eignet sich auch zur Infektionsprophylaxe bei operativen Eingriffen mit erhöhtem Infektionsrisiko (Operationen im Bereich Speiseröhre-Magen-Darm, Becken, Herz, Lungen, Gefässe, Gelenke und Knochen). Bitte beachten Sie die offiziellen Empfehlungen zum angemessenen Gebrauch von Antibiotika, insbesondere die Empfehlungen, die darauf abzielen, die zunehmende Resistenz gegen Antibiotika zu reduzieren. Dosierung/Anwendung Anwendung Cefuroxim Labatec i.v. wird intravenös verabreicht. Meist wird die Behandlung mit Cefuroxim Labatec i.v. allein erfolgreich sein, doch kann Cefuroxim Labatec i.v. auch, wenn angezeigt, mit einem Aminoglykosid-Antibiotikum kombiniert werden (aber nicht in der gleichen Spritze oder Infusionslösung mischen: vgl. «Inkompatibilitäten» und «Hinweise für die Handhabung». Allerdings ist sorgfältig auf die Nierenfunktion zu achten (vgl. «Interaktionen »). Zur Prophylaxe bei gynäkologischen Eingriffen oder Darmoperationen kann Cefuroxim Labatec i.v. auch mit Metronidazol Leichte bis mittelschwere, ausserhalb des Spitals erworbene Pneumonie: 2× täglich 1,5 g Cefuroxim Labatec i.v. für 48–72 Stunden, gefolgt von 2× täglich 500 mg cefuroxim oral von einem anderen Hersteller für 7–10 Tage. Akute Exacerbationen von chronischen Bronchitiden: 2× täglich 750 mg Cefuroxim Labatec i.v. für 48–72 Stunden gefolgt von 2× täglich 500 mg cefuroxim oral für 5–10 Tage. Der Zeitpunkt des Wechsels von der parenteralen auf die orale Therapie richtet sich nach dem Schweregrad der Infektion, dem klinischen Zustand des Patienten und der Empfindlichkeit des Keimes. Falls innerhalb von 72 Stunden keine klinische Besserung eingetreten ist, darf nicht auf die orale Behandlung mit Cefuroxim Labatec i.v. umgestellt werden. Spezielle Dosierungsanweisungen Patienten mit eingeschränkter Nierenfunktion Cefuroxim wird praktisch ausschliesslich über die Nieren ausgeschieden.Sowohl tierexperimentelle als auch klinische Ergebnisse zeigen eine sehr gute Nierenverträglichkeit von Cefuroxim. Trotzdem sollte bei Patienten mit offensichtlich eingeschränkter Nierenfunktion die Dosis reduziert werden, um eine verlangsamte Ausscheidung kompensieren zu können. Es gelten folgende Richtlinien: Bei einer Kreatinin-Clearance unter 20 ml/min sind die Dosen zu reduzieren: Beim Erwachsenen mit einer Kreatinin-Clearance von 10–20 ml/min werden 2× täglich 750 mg empfohlen, bei <10 ml/min 1× täglich 750 mg. Dialyse-Patienten sollten nach jeder Dialyse eine zusätzliche Dosis von 750 mg erhalten. Zusätzlich zur parenteralen Applikation kann Cefuroxim im Peritonealdialysat gelöst werden (im Allgemeinen 125 mg für 1 Liter Dialysat). Für Patienten mit Nierenversagen an kontinuierlicher Hämodialyse oder High-Flux-Hämofiltration auf der Intensivstation wird eine Dosierung von 2× täglich 750 mg empfohlen. Bei Low-FluxHämofiltration ist die Dosierung der Nierenfunktion anzupassen. Es gelten die gleichen Dosierungsempfehlungen wie bei eingeschränkter Nierenfunktion. Kontraindikationen Überempfindlichkeit gegenüber Cephalosporin-Antibiotika. Warnhinweise und Vorsichtsmassnahmen Vorsicht ist bei Penicillin-Allergie geboten, besonders bei Anaphylaxie in der Anamnese, wegen möglicher Kreuzallergie. Bei Patienten mit Bronchialasthma, Heuschnupfen oder Urtikaria ist bei der Anwendung von Cefuroxim Labatec i.v. besondere Vorsicht geboten, da bei diesen Patienten Überempfindlichkeitsreaktionen häufiger auftreten. Es wird empfohlen, vor der Behandlung die Reaktion dieser Patienten durch einen Intrakutantest abzuklären. Beim Auftreten von allergischen Reaktionen ist Cefuroxim Labatec i.v. abzusetzen und eine entsprechende Therapie einzuleiten. Bei akuten schweren Überempfindlichkeitsreaktionen sollten Adrenalin, Antihistaminika oder Kortikosteroide zur Anwendung kommen. Bei schweren und anhaltenden Durchfällen ist an eine antibiotikabedingte pseudomembranöse Kolitis zu denken, die lebensbedrohlich sein kann. In diesen Fällen ist Cefuroxim Labatec i.v. sofort abzusetzen und die Therapie mit einem gegen Clostridium spp. wirksamen Antibiotikum (z.B. Vancomycin) einzuleiten. Peristaltikhemmende Präparate sind kontraindiziert. Antibiotika sollten bei Patienten, die in der Vergangenheit an gastrointestinalen Erkrankungen, im Besonderen an Kolitis litten, mit Vorsicht verabreicht werden. Wie bei anderen Antibiotika kann bei Behandlung mit Cefuroxim ein gesteigertes Wachstum von Candida vorkommen. Bei längerer Behandlung kann ebenfalls ein gesteigertes Wachstum von nicht empfindlichen Keimen (z.B. Enterokokken, Clostridium difficile) vorkommen, was eine Unterbrechung der Behandlung erforderlich machen kann. Eine genaue Beobachtung des Patienten ist daher wesentlich. Tritt während der Behandlung eine Superinfektion auf, sind entsprechende Massnahmen zu ergreifen. Bei eingeschränkter Nierenfunktion muss die Dosierung von Cefuroxim Labatec i.v. dem Schweregrad der Niereninsuffizienz entsprechend angepasst werden (vgl. «Spezielle Dosierungsanweisungen»). Bei Kombination hoher Dosen von Cephalosporinen mit stark wirksamen Diuretika und/oder Aminoglykosiden ist Vorsicht geboten, da dadurch die Nierenfunktion ungünstig beeinflusst werden könnte (vgl. «Interaktionen»). Bei Patienten unter Kombinationstherapie sowie bei Patienten mit vorbestehender Nierenschädigung und allgemein bei älteren Patienten sollte die Nierenfunktion während der Therapie laufend überwacht werden. Bei der Meningitis-Behandlung mit Cefuroxim Labatec i.v. wurde bei wenigen Kindern eine leichte bis mittlere Beeinträchtigung des Hörvermögens festgestellt. Zudem wurden in der Zerebrospinalflüssigkeit nach 18–36 Stunden positive Kulturen von Haemophilus influenzae nachgewiesen, wobei jedoch die klinische Bedeutung dieses Phänomens noch nicht bekannt ist. Bei längerer Behandlung sollten die üblichen Kontrollen von Blutbild, Leber- und Nierenfunktion durchgeführt werden. Interaktionen Die Kombination von Cefuroxim Labatec i.v. mit einem Aminoglykosid-Antibiotikum zeigt in vitro zumeist eine additive, gelegentlich sogar eine synergistische Wirkung. Hohe Dosen von Cephalosporin-Antibiotika sollten jedoch nur mit grosser Vorsicht zusammen mit Aminoglykosiden und/oder stark wirksamen Diuretika wie Furosemid gegeben werden, da diese Kombinationen eine ungünstige Wirkung auf die Nierenfunktion haben können. Wird Cefuroxim Labatec i.v. mit einem Aminoglykosid-Antibiotikum kombiniert, sollen die beiden Präparate getrennt verabreicht werden, da Cephalosporine die Aminoglykoside in einer Mischlösung zum Teil inaktivieren. Wie andere Antibiotika auch, kann Cefuroxim die Darmflora beeinträchtigen, was zu verminderter Oestrogen-Resorption und Wirksamkeit von kombinierten oralen Kontrazeptiva führen kann. Selten wurde ein Antagonismus mit Cefoxitin, Imipenem und Chloramphenicol nachgewiesen. Die klinische Relevanz dieser in vitro Ergebnisse ist nicht bekannt. Probenecid verzögert die Ausscheidung von Cefuroxim Labatec i.v. durch die Nieren. Es erhöht dadurch die Konzentration und verlängert die Verweildauer von Cefuroxim Labatec i.v. im Organismus. Bakteriostatika können mit Cephalosporinen interferieren. der bakteriziden Wirkung von Schwangerschaft/Stillzeit Im Tierversuch ergaben sich keine Hinweise auf Teratogenität oder Embryotoxizität. Trotzdem sollte Cefuroxim Labatec i.v. während der Schwangerschaft nur in zwingenden Fällen verabreicht werden. Cefuroxim Labatec i.v. tritt in geringer Menge in die Muttermilch über. Beim gestillten Säugling ist die Möglichkeit einer Sensibilisierung, von Durchfällen und einer Sprosspilzbesiedlung nicht auszuschliessen. Während der Behandlung mit Cefuroxim Labatec i.v. soll nur in zwingenden Fällen gestillt werden. Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen Es existieren keine Studien zur Auswirkung von Cefuroxim Labatec i.v. auf die Verkehrstüchtigkeit und das Bedienen von Maschinen. Unerwünschte Wirkungen Bei den Häufigkeitskategorien, in welche die unerwünschten Reaktionen nachfolgend eingeordnet werden, handelt es sich um Schätzungen, da für die meisten solchen Reaktionen nur unzureichendes Datenmaterial zur Berechnung der Inzidenz zur Verfügung steht. Ausserdem könnte die Inzidenz von unerwünschten Reaktionen im Zusammenhang mit Cefuroxim Natrium von Indikation zu Indikation schwanken. Die Häufigkeit der sehr häufigen bis seltenen unerwünschten Effekte wurde dem Datenmaterial der klinischen Studien entnommen. Die Häufigkeiten aller anderen unerwünschten Reaktionen (d.h. Reaktionen mit einer Inzidenz <1/1’000) stammen vorwiegend aus den Daten der Erfahrungsberichte (Post-Marketing Reports) und entsprechen daher der Meldehäufigkeit anstatt der tatsächlichen Auftretenshäufigkeit. Bei der Klassifikation der Häufigkeit von unerwünschten Wirkungen wurden die folgenden Definitionen verwendet: Sehr häufig ≥1/10, häufig ≥1/100 und ≤1/10, gelegentlich ≥1/1’000 und <1/100, selten ≥1/10’000 und <1/1’000, sehr selten <1/10’000. Überdosierung Infektionen und Infestationen Eine Überdosierung parenteraler Cephalosporine kann Krämpfe verursachen (Dosierungsanpassung bei eingeschränkter Nierenfunktion beachten). Treten Krämpfe auf, sollte Cefuroxim Labatec i.v. sofort abgesetzt werden. Eine Behandlung mit Antikonvulsiva kann angebracht sein. Bei starker Überdosierung kann eine Hämodialyse sinnvoll sein. Selten: Gesteigertes Wachstum von nicht empfindlichen Erregern (z.B. Candida) bei einer Langzeitanwendung. Störungen des Blut- und Lymphsystems Häufig: Neutropenie, Eosinophilie. Gelegentlich: Leukopenie, Absinken der Hämoglobinkonzentration, positiver Coombs-Test. Selten: Thrombozytopenie. Sehr selten: Hämolytische Anämie. Eigenschaften/Wirkungen Cephalosporine als Wirkstoffklasse neigen dazu, sich an die Membranoberfläche der roten Blutkörperchen anzulagern und mit Antikörpern, welche gegen das Medikament gerichtet sind, zu reagieren, was einen positiven Coombs’Test und sehr selten eine hämolytische Anämie bewirkt. Die serologische Kreuzprobe kann beeinflusst werden. Cefuroxim ist ein halbsynthetisches Cephalosporin der 2. Generation zur parenteralen Applikation. Die bakterizide Wirksamkeit von Cefuroxim ergibt sich aus der Hemmung der Zellwandsynthese. Cefuroxim ist gegen die meisten β-Lactamasen stabil und wirkt in vitro gegen folgende Erreger: ATC-Code: J01DC02 Wirkungsmechanismus/Bakteriologie Störungen des Immunsystems MHK 50 MHK 90 Überempfindlichkeitsreaktionen, u.a. Gelegentlich: Makulopapulöse und urtikarielle Hautausschläge, Pruritus. Selten: Arzneimittelfieber. Sehr selten: Interstitielle Nephritis, anaphylaktischer Schock, kutane Vaskulitis (μg/ml) (μg/ml) Der anaphylaktische Schock erfordert sofortige Gegenmassnahmen. Siehe auch unter «Störungen der Hautund des Unterhautzellgewebes» und «Funktionsstörungen der Nieren und ableitenden Harnwege». Gastrointestinale Störungen Gelegentlich: Gastrointestinale Störungen (Nausea, Erbrechen und Diarrhea). Sehr selten: Colitis pseudomembranacea (durch Clostridium difficile verursacht; kann während oder nach der Behandlung auftreten, siehe «Warnhinweise und Vorsichtsmassnahmen»). Empfindliche Grampositive Erreger: Staphylococcus aureus (inkl. penicillinasebildende Stämme aber exkl. Methicillinresistente Stämme) 0,8 Staphylococcus epidermidis (inkl. penicillinasebildende Stämme aber exkl. Methicillinresistente Stämme) 0,3 1,0 Streptococcus pyogenes (und andere betahämolysierende Streptokokken) <0,06 0,05 Streptococcus agalactiae (Gruppe B) <0,06 0,1 Streptococcus pneumoniae <0,06 0,2 Streptococcus mitis (Gruppe viridans) <0,06 <0,06 Escherichia coli 1,9 5,0 Klebsiella spp. 1,4 3,5 Proteus mirabilis 0,6 1,3 Proteus rettgeri 1,1 4,8 Haemophilus influenzae (inkl. ampicillinresistente Stämme) 0,5 1,0 1,4 Funktionstörungen der Leber und der Galle Häufig: Vorübergehende Erhöhung der Serumwerte von Leberenzym. Gelegentlich: Vorübergehende Erhöhung des Bilirubinwerts. Vorübergehende Steigerungen der Leberenzym- oder Bilirubinwerte im Serum können auftreten, insbesondere bei Patienten mit vorbestehenden Lebererkrankungen, doch liegen keine Hinweise auf eine Schädigung der Leber vor. Funktionstörungen der Haut und des Unterhautzellgewebes Sehr selten: Erythema multiforme, toxische epidermale Nekrolyse und Stevens-Johnson-Syndrom. Siehe auch «Störungen des Immunsystems». Funktionsstörungen der Nieren und ableitenden Harnwege Sehr selten: Erhöhung der Serum-Kreatininwerte, Erhöhungen BUN (Blut-Harnstoff-Stickstoffes) im Blut und Verminderung Kreatinin-Clearance (vgl. auch «Warnhinweise Vorsichtsmassnahmen»). Siehe auch «Störungen Immunsystems». des der und des Empfindliche Gramnegative Erreger: Allgemeine Störungen und Reaktionen an der Applikationsstelle Häufig: Vorübergehender Schmerz an der Injektionsstelle, Thrombophlebitis. Die Thrombophlebitis kann nach der intravenösen Injektion auftreten; sie lässt sich allerdings durch langsames Injizieren (über 3–5 Minuten) weitgehend vermeiden. Haemophilus parainfluenzae (inkl. ampicillinresistente Stämme) <0,5 1,0 Mässig empfindliche Keime sind empfindlich bei hoher Dosierung oder wenn die Infektion auf Gewebe und Flüssigkeiten begrenzt ist, in denen hohe Antibiotikaspiegel erreicht werden. Eine bakterielle Resistenz kann natürlich oder erworben sein. Der am häufigsten beobachtete Resistenzmechanismus beruht auf der Produktion von β-Lactamasen. Neisseria gonorrhoeae (penicillinase- und nicht penicillinasebildende Stämme) <0,03 Neisseria meningitidis keine Werte verfügbar 0,06 Moraxella (Branhamella) catarrhalis 0,5 1,0 Salmonella spp. 4,0 8,0 0,25 Die Ausbildung von sekundären bakteriellen Resistenzen erfolgt in der Regel langsam (Vielschrittmechanismus). Eine Kreuzresistenz kann, wie bei anderen Penicillinen und Cephalosporinen, innerhalb derselben Antibiotikaklasse auftreten. Pharmakokinetik Absorption Nach einer i.v.-Injektion einer Einzeldosis von 500 mg bzw. 1000 mg über 3 Minuten beträgt die Serumkonzentration unmittelbar nach der Injektion 66 μg/ml resp. 99 μg/ml. Bei einer i.v.-Infusion über 30 Minuten von 500 mg bzw. 750 mg Cefuroxim werden Serumkonzentrationen von 38 μg/ml resp. 52 μg/ml erreicht. Empfindliche Anaerobier: Gram-positive und Gramnegative Kokken (inkl. Peptococcus spp. und Peptostreptococcus spp.) 0,13–0,5 Gram-positive Bacilli (inkl. Clostridium spp.) 2,0 4,0 Propionibacterium spp. 0,13 0,5 4,0 Distribution Nach einer i.v.-Injektion wird das Antibiotikum in den meisten Körperflüssigkeiten und Geweben verteilt. Das Verteilungsvolumen liegt bei gesunden Erwachsenen zwischen 9,3 und 15,8 l/1,73 m². Die Eiweissbindung beträgt 33–50%, je nach Bestimmungsmethode. Hohe Wirkstoffkonzentrationen werden in den Nieren, Herz, Gallenblase, Leber, Prostata, Ovarien, Uterus, Knochen, Fettgewebe, Speichel, Bronchialsekret, Wundexsudaten, Kammerwasser, Synovialflüssigkeit, Perikardialflüssigkeit, Peritonealflüssigkeit und Pleuralflüssigkeit nachgewiesen.Cefuroxim passiert die Blut-HirnSchranke nur bei entzündeten Meningen. Die folgenden Erreger sind nicht empfindlich Clostridium difficile, Pseudomonas spp., Campylobacter spp., Acinetobacter calcoaceticus, Methicillin-resistente Stämme von Staphylococcus aureus und epidermidis, Legionella spp., Listeria. Cefuroxim geht in die Muttermilch über. Einige Stämme der folgenden Erreger sind nicht empfindlich Enterococcus (Streptococcus) faecalis, Morganella morganii, Proteus vulgaris, Enterobacter spp., Citrobacter, Serratia spp. und Bacteroides spp. Cefuroxim wird nicht metabolisiert und im Laufe von 24 Stunden unverändert über die Nieren ausgeschieden. Bei durch mässig empfindliche Keime verursachten Infektionen ist die Durchführung eines Empfindlichkeitstestes zu empfehlen, um eine eventuelle Resistenz ausschliessen zu können. Die Empfindlichkeit auf Cefuroxim Labatec i.v. kann anhand von standardisierten Verfahren, wie sie beispielsweise vom Clinical and Laboratory Standards Institute (CLSI) empfohlen werden, mit Disk- oder Verdünnungsmethoden bestimmt werden.Dabei werden vom CLSI die folgenden Parameter als Empfindlichkeitskriterien empfohlen Die Serumhalbwertszeit nach i.v. Injektion beträgt 1–2 Stunden. 90– 100% einer Dosis werden im Laufe von 24 Stunden in antibiotisch wirksamer Form mit dem Urin ausgeschieden, die Hauptmenge in den ersten 6 Stunden. Die Ausscheidung erfolgt etwa zu gleichen Teilen mittels tubulärer Sekretion und glomerulärer Filtration. Metabolismus Elimination Kinetik spezieller Patientengruppen Niereninsuffizienz: Bei Patienten mit Nierenfunktionsstörungen wird die Serumhalbwertszeit verlängert. Die Verweildauer der Substanz im Organismus hängt vom Schweregrad der Nierenfunktionsstörung ab. Bei anurischen Patienten wurden Halbwertszeiten von 15–22 Stunden gemessen. Disktest (30 μg) Durchmesser Verdünnungs- test (mm) MHK (mg/l) Sensibel ≥18 ≤16 Intermediär 15–17 17–32 Pädiatrie: Beim Neugeborenen verhält sich die Halbwertszeit umgekehrt proportional zum Alter. Beim 3 Tage alten Neugeborenen (oder jünger) wurden Serumhalbwertszeiten von 5–6 Stunden gemessen. Resistent ≤14 >32 Dialyse: Cefuroxim kann durch Hämo- oder Peritonealdialyse aus dem Serum entfernt werden. Die Laborresultate im Dilutionstest oder im standardisierten DiskDiffusionstest sollten nach folgenden Kriterien beurteilt werden: Präklinische Daten Es sind keine für die Anwendung von Cefuroxim Labatec i.v. relevanten präklinischen Daten vorhanden. Sonstige Hinweise NaCl 0,225%; Hartmann. Inkompatibilitäten In einer Konzentration von 5 mg/ml ist Cefuroxim Labatec i.v. auch in 5%iger und 10%iger Xylitlösung stabil. Cefuroxim Labatec i.v. darf nicht zu einer NatriumhydrogencarbonatLösung gegeben werden. Das Arzneimittel darf nur mit den unter Hinweise für die Handhabung aufgeführten Arzneimitteln gemischt werden. Beeinflussung diagnostischer Methoden Unter Behandlung mit Cefuroxim Labatec i.v. kann der direkte Coombs-Test gelegentlich positiv ausfallen. Die serologische Kreuzprobe kann dadurch beeinflusst werden. Zur Bestimmung von Glukose im Blut/Plasma und Urin sollten enzymatische Methoden (Glukoseoxydase- oder HexokinaseMethode) verwendet werden. Interferenzen mit dem Reduktionsverfahren (Benedikt, Fehling, Clinitest) wurden beobachtet. Für die Kreatinin-Bestimmung sollte das alkalische Pikrat-Verfahren (Jaffé-Probe) verwendet werden. Haltbarkeit Haltbarkeit der Trockensubstanz Das Medikament darf nur bis zu dem auf der Packung mit «EXP.» bezeichneten Datum verwendet werden. Ringer und Ringer-Laktat; 1/6 Natriumlaktat; Arzneistofflösungen 1,5 g Cefuroxim Labatec i.v. gelöst in 15 ml Aqua ad inject. ist mit folgenden Arzneistofflösungen kompatibel: Metronidazol-Lösung (500 mg/100 ml); Azlocillin (1 g/15 ml oder 5 g/50 ml), Hydrocortison-Natriumphosphat in 0,9% NaCl oder in 5% Glukose; wässrige Lidocain-Lösungen bis zu 1% ; Heparin 10 IE/ml oder 50 IE/ml in 0,9% NaCl; Kaliumchlorid 10 oder 40 mEq/l in 0,9% NaCl. Die Haltbarkeit der Mischungen mit den erwähnten Infusionslösungen und Arzneistofflösungen beträgt bei Temperaturen unter 25°C 24 Stunden. Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Verdünnung/ Rekonstitution verwendet werden. Ungebrauchte Lösung wegwerfen. Wenn immer möglich sollten nur frisch zubereitete Lösungen verwendet werden. Sie sind gelblich und können beim Stehen nachdunkeln, ohne dass Wirkung oder Verträglichkeit sich kurzfristig ändern (vgl. «Sonstige Hinweise/Haltbarkeit»). Haltbarkeit der zubereiteten Cefuroxim Labatec i.v. –Lösungen Ausnahme: Azlocillin- und Lidocain-Gemische sind bei Raumtemperatur nur 5 Stunden stabil; Azlocillin- Gemische sind bei 4 °C 24 Stunden haltbar. Es sollten wenn immer möglich nur frisch zubereitete Lösungen verwendet werden. Wässrige Lösungen für direkte i.v.- Injektion sind bei 25 °C 5 Stunden und bei 4 °C 48 Stunden haltbar. Stärker verdünnte Lösungen (1,5 g in 50 ml Aqua ad iniect.) bleiben bei 25 °C 24 Stunden, bei 4 °C bis 72 Stunden stabil (vgl. auch «Hinweise für die Handhabung»). Zulassungsnummer Die Farbintensität der hergestellten Suspensionen und Lösungen kann sich innerhalb dieser Zeitspannen vertiefen, ohne dass sich Wirkung und Verträglichkeit ändern. Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Verdünnung/ Rekonstitution verwendet werden. Ungebrauchte Lösung wegwerfen. Besondere Lagerungshinweise Das Präparat ist beim Raumtemperatur (15-25 °C) und vor Licht geschützt in der Originalpackung aufzubewahren. Hinweise für die Handhabung Intravenöse Injektion Der 750 mg-Durchstechflasche müssen mindestens 6 ml Aqua ad iniect. zugefügt werden, der 1,5 g- Durchstechflasche 15 ml, um eine klare Lösung zu erhalten. Diese Lösungen können langsam (in 3–5 Min.) direkt i.v. injiziert werden. Kurzinfusion (bis zu 30 Min.) 1,5 g Cefuroxim Labatec i.v. Pulver werden in 20 ml Aqua ad iniectabilia gelöst und zu 50–100 ml Infusionslösung (compatible Infusionslösungen unten angegeben) hinzugefügt. Wird die Infusion intermittierend über ein Y-Stück gegeben, sollte während der Infusion von Cefuroxim Labatec i.v. die Zufuhr der anderen Lösung unterbrochen werden. Dauertropfinfusion Bei Zugabe zu einer Dauertropfinfusion werden 1,5 g Cefuroxim Labatec i.v. in 20 mL Aqua ad iniect. gelöst und in erforderlicher Menge der Infusionslösung beigegeben. Infusionslösungen Cefuroxim Labatec i.v. ist mit folgenden Infusionslösungen kompatibel NaCl 0,9%; Glukose 5% und 10%; Glukose 4% + NaCl 0,18%; Glukose 5% + NaCl 0,9%; Glukose 5% + NaCl 0,45%; Glukose 5% + 61’475 (Swissmedic). Packungen Cefuroxim Labatec i.v., 750 mg Pulver: Durchstechflasche (10 mL) 1 [A]. Cefuroxim Labatec i.v., 1,5 g Pulver: Durchstechflasche (20 mL) 1 [A]. Cefuroxim Labatec i.v., 1,5 g Pulver: Infusionsflasche (100 mL) 1 [A]. Zulassungsinhaberin Labatec Pharma SA, 1217 Meyrin (Genève) Stand der Information August 2010