Seminar „Fertigstellung von Proteinen“
Werbung

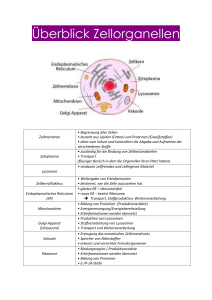
Seminar „Fertigstellung von Proteinen“ Die folgenden Fragen dienen exemplarisch zur Vorbereitung und bieten eine Möglichkeit zur Selbstkontrolle. 1. Durch welche Prozessierungsschritte entsteht biologisch aktives Insulin? 2. Erläutern Sie die Begriffe cotranslationaler Proteintransport und posttranslationaler Proteintransport. Welche Bedeutung haben diese jeweils für die Zielsteuerung von Proteinen? 3. Welche Signale definieren die Zielsteuerung von Proteinen zu a) Zellkern b) Lysosomen c) Mitochondrien d) Plasmamembran Erläutern Sie den jeweiligen Mechanismus und die beteiligten Transportsysteme. 4. Welche Arten der Membranverankerung von Proteinen gibt es? Wie werden diese molekular umgesetzt? 5. Welche Charakteristika weisen Transmembranproteine in ihrer Sequenz auf? 6. Erklären Sie den molekularen Wirkmechanismus der folgenden Toxine: a) Tetanustoxin b) Diphterietoxin c) Botulinumtoxin 7. Wie unterscheiden sich N- und O-Glykosylierung? Wie funktioniert die N-Glykosylierung? 8. Welche Konsequenzen können Mutationen im N-Acetylglucosamin-PhosphotransferaseGen haben? 9. Welche Funktionen hat der cytosolische Proteinabbau? Wie werden Proteine für diesen Abbau markiert? 10. Warum blieben die Zielerkennungssignale der Kernproteine dauerhaft, auch nach ihrem Import, erhalten, während die Signalsequenzen der mitochondrialen und der ER-Proteine sofort abgespalten werden? Siehe auch: IMPP-Gegenstandskatalog „Chemie Biochemie/Molekularbiologie“ IMPP-GK 1 (Januar 2014): für 19 Speicherung, Übertragung und Expression genetischer Information 19.3 Co- und posttranslationale Faltung und Modifikation von Proteinen 19.4 Proteolyse 20 Molekulare Zellbiologie 20.1 Eukaryontische Zellen 20.2 Membranen 20.3 Zellkern 20.4 Mitochondrien 20.5 Lysosomen 20.6 Peroxisomen 20.7 Endoplasmatisches Retikulum (ER) 20.8 Golgi-Apparat Mediziner und