Puromycin - TU Darmstadt Chemie
Werbung
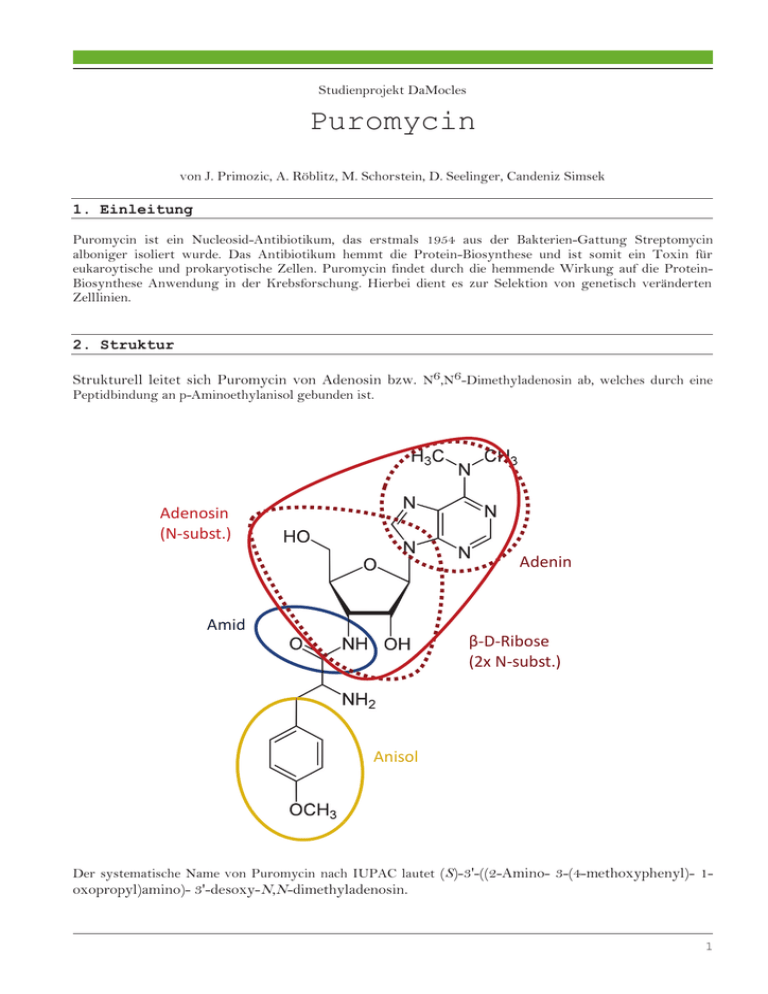
Studienprojekt DaMocles Puromycin von J. Primozic, A. Röblitz, M. Schorstein, D. Seelinger, Candeniz Simsek 1. Einleitung Puromycin ist ein Nucleosid-Antibiotikum, das erstmals 1954 aus der Bakterien-Gattung Streptomycin alboniger isoliert wurde. Das Antibiotikum hemmt die Protein-Biosynthese und ist somit ein Toxin für eukaroytische und prokaryotische Zellen. Puromycin findet durch die hemmende Wirkung auf die ProteinBiosynthese Anwendung in der Krebsforschung. Hierbei dient es zur Selektion von genetisch veränderten Zelllinien. 2. Struktur Strukturell leitet sich Puromycin von Adenosin bzw. N6,N6-Dimethyladenosin ab, welches durch eine Peptidbindung an p-Aminoethylanisol gebunden ist. Adenosin (N-subst.) Adenin Amid β-D-Ribose (2x N-subst.) Anisol Der systematische Name von Puromycin nach IUPAC lautet (S)-3'-((2-Amino- 3-(4-methoxyphenyl)- 1- oxopropyl)amino)- 3'-desoxy-N,N-dimethyladenosin. 1 3. Physikalische Eigenschaften Puromycin ist ein weißer, pulverförmiger, nicht brennbarer Feststoff, der sich mäßig in Wasser löst. Summenformel C22H29N7O5 Molare Masse 471,52 g/mol Schmelzpunkt 175,5-177°C Siedepunkt 752,16°C Dichte 1,51g/cm³ CAS-Nummer 53-79-2 Löslichkeit 50,3g/l bei 25°C in Wasser 4. Historisches Das Antibiotikum Puromycin wurde im Jahr 1952 von John N. Porter entdeckt. Bei der Untersuchung einer noch nicht identifizierten Spezies des Streptomycins ist aufgefallen, dass dieses ein Antibiotikum produziert, das gegen die Protozoen des Genus Trypanosoma, welches eine afrikanische Schlafkrankheit verursacht, aktiv wird. Da das Streptomycin schwarze Kolonien mit weißen Sporen entwickelte, nannte man es Streptomycin alboniger. Im Jahre 1954 gelang dann die Isolierung und Synthese des Puromycin und wurde als Patent 1956 von der Firma American Cyanamid & Co angemeldet. Später wurde dann versucht Puromycin als Mittel für die Chemotherapie auf verschiedene Copolymere als Trägermaterialien in den Körper für medizinische Zwecke zu schleusen. Da Puromycin aber auch für Eukaryoten toxisch wirkt, wird es heutzutage nur noch für Forschungszwecke in der Mikrobiologie verwendet. 5. Vorkommen Puromycin kann aus dem Streptomycin alboniger gewonnen werden, welcher zum Stamm der Actinobacteria gehört und in Waldböden beheimatet ist. In dem Streptomycin alboniger wird enzymkatalysiert S-adenosylL-methionine (SAM) zu O-dimethylpuromycin (ODMP) synthetisiert. Dieser finale Reaktionsschritt transferiert Methylgruppen und bildet das Antibiotikum. 6. Wirkung Rückblick zur Proteinbiosynthese Die Proteinbiosynthese beginnt mit der Transkription, bei der die RNA Polymerase einen DNA-Strang kopiert und die zugehörige mRNA erstellt. Diese mRNA dient nun als Matrize der Translation, dem Aufbau der Polypeptidketten. Das entsprechende Ribosom wandert die mRNA entlang und bindet die tRNA mit dem passendem Anticodon, welche an ihrem anderen Ende die Aminosäure enthält, für die das mRNA Stück codiert. Durch verbinden der Aminosäuren entsteht so beim entlangwandern des Ribosoms an der mRNA eine Polypetidkette, die nach der Termination der Translation ein Protein bildet. 2 Wirkungsweise des Puromycin Die Strukturformel des Puromycin ähnelt einer tRNA mit dem 3`Ende CCA: 3'-Ende einer tRNA Puromycin Durch diese strukturelle Ähnlichkeit ahmt das Molekül das Ende 3‘-Ende einer tRNA nach. Somit kann es an der Bindungsstelle des Ribosoms eintreten und wird dort kovalent gebunden. Kommt nun an die Eingangstelle A des Ribosoms das Codon GGU, so kann das Puromycin, statt der entsprechenden tRNA (CCA), an diese Stelle binden und einen vorzeitigen Kettenabbruch einleiten. 3 Die Polypeptidkette ist so gehindert die richtige Tertiärstruktur des Proteins anzunehmen. Das Protein ist so nicht funktionsfähig und die Zelle stirbt aufgrund von Mangelfunktion ihrer Proteine. Resistenz Das Enzym Puromycin-N-Acetyltransferase (PAC), für welches das Streptomycin alboniger und einige andere verwandte Bakterienarten ein Gen besitzen, inaktiviert Puromycin durch Derivatisierung. PAC An der wichtigen Aminogruppe, die mit für die Verwechslung mit einer tRNA verantwortlich ist, wird durch die Puromycin-N-Acetyl-Transferase als Katalysator ein Proton durch eine Carbonylverbindung substituiert, wodurch das Puromycin inaktiv wird. 7. Verwendung Puromycin findet durch die hemmende Wirkung auf die Protein-Biosynthese Anwendung in der Krebsforschung. Hierbei dient es zur Selektion von genetisch veränderten Zelllinien. Der Aufbau einer solchen Selektion ist in der folgenden Abbildung schematisch aufgezeigt: 4 Anreicherung Transkription und Verknüpfung mit Puromycin Mit Puromycin verknüpfte mRNA Translation Reverse Transkription mRNA-Display-Peptid Zuerst wird eine DNA-Bibliothek mit bis zu ͳͲଵହ verschiedenen Molekülen synthetisiert. Nach der Umwandlung in RNA und der Verknüpfung mit dem Puromycin werden durch Translation die mRNA Display Peptide hergestellt. Der verknüpfte RNA-Teil wird nach der Aufreinigung revers transkribiert. Mit den so hergestellten Molekülen werden die eigentlichen Selektionsschritte durchgeführt. Dazu werden nicht gebundene Moleküle der Bibliothek entfernt und die gewünschten eluiert. Nach mehrmaligem Durchlaufen des Selektionszyklus reichern sich die gewünschten Sequenzen an und können anschließend analysiert und charakterisiert werden. 8. Quellen · · · · · · · · A New Species of Streptomyces, C. W. Hesseltine, J. N. Porter, N. Deduck, Marie Hauck, N. Bohonos and J. H. Williams, Mycologia, Vol. 46, No. 1 (Jan. - Feb., 1954), pp. 16-23 http://www.scbio.de/datasheet-205821-puromycin.html http://chem.sis.nlm.nih.gov/chemidplus/rn/53-79-2 http://www.zmbh.uniheidelberg.de/mayer/Grundvorlesung_III_Teil_2_Molekularbiologie/09_Antibiotika.pdf http://www.zmbh.uniheidelberg.de/mayer/Grundvorlesung_III_Teil_2_Molekularbiologie/09_Antibiotika.pdf http://www2.estrellamountain.edu/faculty/farabee/BIOBK/biobookprotsyn.html http://de.wikipedia.org/wiki/Puromycin http://www.biospektrum.de/blatt/d_bs_pdf&_id=934179 5