Blatt 12
Werbung

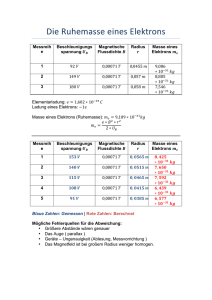
Name(n): Gruppe: 12. Übungsblatt PHYSIK III 2 Seiten! WS 2006/2007 Rückgabe: 25. Jan 2006 im Gruppenunterricht 12.1 Klassisches Wasserstoffatom (10 Punkte) Betrachten Sie das Wasserstoffatom als ein klassisches System, in dem das Elektron mit der Geschwindigkeit v auf einer Kreisbahn mit dem Radius r um das Proton läuft. Berechnen Sie die ungefähre Lebensdauer dieses Systems. Nehmen Sie an, dass der Energieverlust pro Umlauf klein ist, so dass die Bahn des Elektrons immer als Kreis angenommen werden kann. Der Anfangsradius ǫ0 h 2 entspreche dem Bohrradius a0 = πm (s. Aufgabe 12.2). e2 e 2 2 e a Hinweis: Die abgestrahlte Leistung einer mit a beschleunigten Ladung e ist Prad = 23 4πǫ 3. 0c a) Bestimmen Sie das Verhältnis von der Gesamtenergie und der potentiellen Energie im Coulombpotential. b) Finden Sie die Differenzialgleichung für r in der Form ṙ = f (r). c) Bestimmen Sie die Lebensdauer durch Integration von a0 bis 0. 12.2 Bohrsches Wasserstoffatom (10 Punkte) Aus der Aufgabe 12.1 folgt, dass die klassische Beschreibung keine stabilen Atome vorhersagt. Niels Bohr hat daher im Jahre 1913 sein Modell vorgeschlagen, das von der klassischen Vorstellung des Elektrons als um das Proton kreisendes Teilchen ausgeht. Zusätzlich postulierte Bohr, dass die Elektronen nur auf stationären Bahnen umlaufen, auf denen keine klassische Photonabstrahlung stattfindet. Diese stationären Bahnen werden durch die Bedingung definiert, dass sich die Elektronen im Wellenbild als stehende Wellen beschreiben lassen. Mit dieser Annahme muss der Kreisumfang ein ganzzahliges Vielfaches der de Broglie-Wellenlänge des Elektrons sein. a) Finden Sie die möglichen Radien der Elektronenbahnen und die diesen Bahnen entsprechenden Gesamtenergien (kinetische + potentielle Energien) des Elektrons. Zeigen Sie, dass die möglichen Zustände gequantelt sind. b) Finden Sie die allgemeine Formel für die möglichen Frequenzen von abgestrahlten Photonen bei Übergängen zwischen den Energieniveaus. Wurden solche Spektralserien beobachtet? c) Zeigen Sie, dass die obere Bedingung für die de Broglie-Wellenlänge des Elektrons einer Quantelung des Drehimpulses äquivalent ist. Vergleichen Sie die möglichen Drehimpulswerte mit dem Ergebnis der Quantemechanik (s. Vorlesung). Das Bohrsche Atommodell lieferte keine Erklärung für einzelne Intensitätsunterschiede von Spektrallinien, wie sie in vielen Experimenten beobachtet wurden. Es konnte auch nicht erklären, warum sich die Elektronen nur auf diesen diskreten Umlaufbahnen befinden. Eine korrekte Beschreibung ergab später die Quantenmechanik. 12.3 Quantenmechanisches Wasserstoffatom (10 Punkte) Die Wellenfunktion des Elektrons im Grundzustand des Wasserstoffatoms ist ψ = A exp(−r/a0 ) mit einer Konstanten A und dem Borschen Radius a0 . Finden Sie: a) den wahrscheinlichsten Abstand rW des Elektrons vom Proton; b) die Wahrscheinlichkeit der Anwesenheit des Elektrons im Bereich r < rW ; c) den mittleren Abstand hri des Elektrons vom Proton; d) den Mittelwert h F i der auf das Elektron wirkenden Coulombkraft. 12.4 Unschärferelation und gebundene Zustände (10 Punkte) Die Heisenbergsche Unschärferelation ∆x∆p ≥ h̄/2 kann verwendet werden, um die Energie des niedrigsten gebundenen Zustands (Grundzustand) in einem Potential abzuschätzen. a) Zeigen Sie für das Potential eines (eindimensionalen) harmonischen Oszillators V ( x) = 12 mω 2 x2 , dass durch die Unschärferelation eine minimale Energie für einen gebundenen Zustand existieren muss. Wie groß ist der Energie-Eigenwert für diesen Zustand? Welche Ausdehnung erwartet man? b) Zeigen Sie, dass die Bindungsenergie eines Elektrons im Coulombpotential eines Protons V (r) = e2 4πǫ0 r (Wasserstoffatom) durch die Unschärferelation begrenzt ist. Nehmen Sie dabei an, dass ∆x durch die radiale Ausdehnung der Wellenfunktion r gegeben sei. Wie groß ist die Bindungsenergie dieses Grundzustands? Vergleichen Sie die Ausdehnung r0 = ∆x der Wellenfunktion mit dem Radius der kleinsten Umlaufbahn des Elektrons im Bohrschen Atommodell.