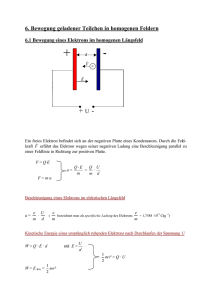
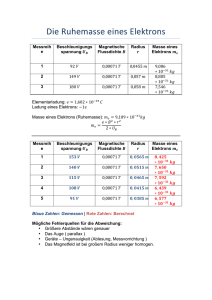
K102 Bohrsches Atommodel - HMTC
Werbung
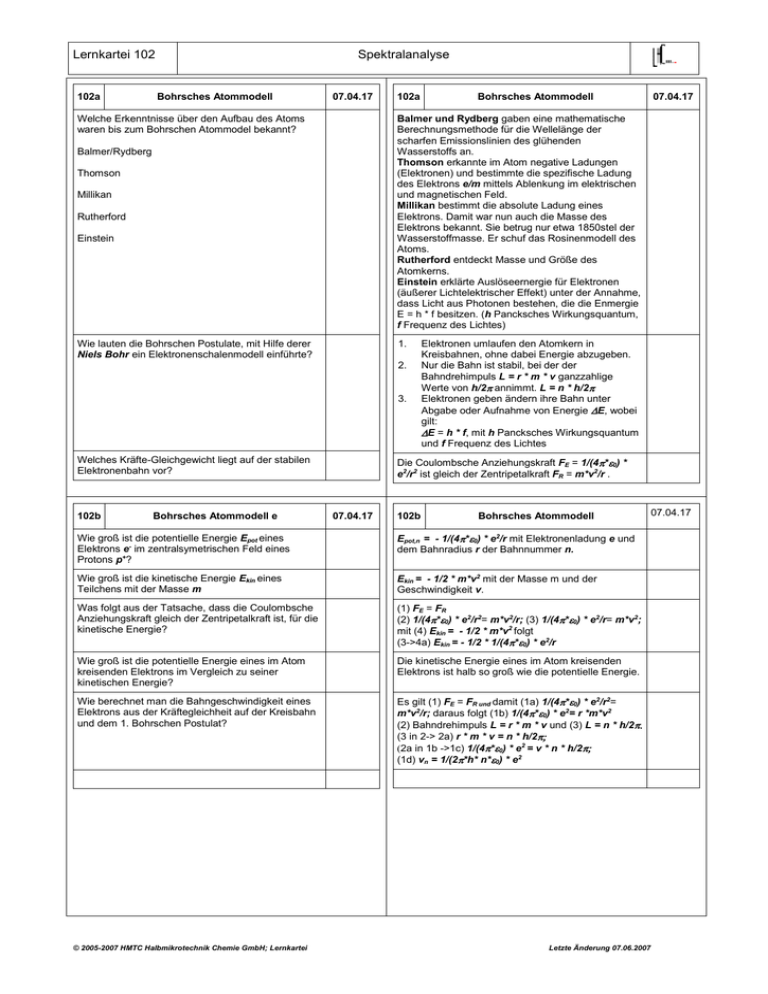
Lernkartei 102 102a Spektralanalyse Bohrsches Atommodell 07.04.17 102a Balmer/Rydberg Thomson Millikan Rutherford Einstein Wie lauten die Bohrschen Postulate, mit Hilfe derer Niels Bohr ein Elektronenschalenmodell einführte? 1. 2. 3. Elektronen umlaufen den Atomkern in Kreisbahnen, ohne dabei Energie abzugeben. Nur die Bahn ist stabil, bei der der Bahndrehimpuls L = r * m * v ganzzahlige Werte von h/2annimmt. L = n * h/2 Elektronen geben ändern ihre Bahn unter Abgabe oder Aufnahme von Energie E, wobei gilt: E = h * f, mit h Pancksches Wirkungsquantum und f Frequenz des Lichtes Die Coulombsche Anziehungskraft FE = 1/(4*0) * e2/r2 ist gleich der Zentripetalkraft FR = m*v2/r . Welches Kräfte-Gleichgewicht liegt auf der stabilen Elektronenbahn vor? Bohrsches Atommodell e 07.04.17 102b Bohrsches Atommodell Wie groß ist die potentielle Energie Epot eines Elektrons e- im zentralsymetrischen Feld eines Protons p+? Epot,n = - 1/(4*0) * e2/r mit Elektronenladung e und dem Bahnradius r der Bahnnummer n. Wie groß ist die kinetische Energie Ekin eines Teilchens mit der Masse m Ekin = - 1/2 * m*v2 mit der Masse m und der Geschwindigkeit v. Was folgt aus der Tatsache, dass die Coulombsche Anziehungskraft gleich der Zentripetalkraft ist, für die kinetische Energie? (1) FE = FR (2) 1/(4*0) * e2/r2= m*v2/r; (3) 1/(4*0) * e2/r= m*v2; mit (4) Ekin = - 1/2 * m*v2 folgt (3->4a) Ekin = - 1/2 * 1/(4*0) * e2/r Wie groß ist die potentielle Energie eines im Atom kreisenden Elektrons im Vergleich zu seiner kinetischen Energie? Die kinetische Energie eines im Atom kreisenden Elektrons ist halb so groß wie die potentielle Energie. Wie berechnet man die Bahngeschwindigkeit eines Elektrons aus der Kräftegleichheit auf der Kreisbahn und dem 1. Bohrschen Postulat? Es gilt (1) FE = FR und damit (1a) 1/(4*0) * e2/r2= m*v2/r; daraus folgt (1b) 1/(4*0) * e2= r *m*v2 (2) Bahndrehimpuls L = r * m * v und (3) L = n * h/2 (3 in 2-> 2a) r * m * v = n * h/2 2a in 1b ->1c) 1/(4*0) * e2 = v * n * h/2 (1d) vn = 1/(2*h* n*0) * e2 © 2005-2007 HMTC Halbmikrotechnik Chemie GmbH; Lernkartei 07.04.17 Balmer und Rydberg gaben eine mathematische Berechnungsmethode für die Wellelänge der scharfen Emissionslinien des glühenden Wasserstoffs an. Thomson erkannte im Atom negative Ladungen (Elektronen) und bestimmte die spezifische Ladung des Elektrons e/m mittels Ablenkung im elektrischen und magnetischen Feld. Millikan bestimmt die absolute Ladung eines Elektrons. Damit war nun auch die Masse des Elektrons bekannt. Sie betrug nur etwa 1850stel der Wasserstoffmasse. Er schuf das Rosinenmodell des Atoms. Rutherford entdeckt Masse und Größe des Atomkerns. Einstein erklärte Auslöseernergie für Elektronen (äußerer Lichtelektrischer Effekt) unter der Annahme, dass Licht aus Photonen bestehen, die die Enmergie E = h * f besitzen. (h Pancksches Wirkungsquantum, f Frequenz des Lichtes) Welche Erkenntnisse über den Aufbau des Atoms waren bis zum Bohrschen Atommodel bekannt? 102b Bohrsches Atommodell Letzte Änderung 07.06.2007 07.04.17