Moderne Physik
Werbung

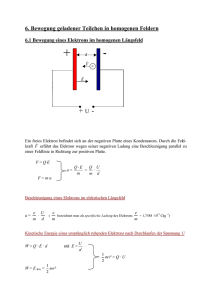
„..in dieser Wissenschaft schon fast alles erforscht sei, und es gelte, nur noch einige unbedeutende Lücken zu schließen“ Philipp von Jolly zu Max Planck in 1878 Moderne Physik Atom- und Kernphysik 1. Lord Kelvin: Nineteenth-Century Clouds over the Dynamical Theory of Heat and Light Elektromagnetische Strahlungen Lichtelektrischer Effekt Radiowellen, infrarotes sichtbares UV Röntgenstr., γ-Strahlung Licht Licht Licht Sichtbarer Bereich 400 - 800 nm blau rot Schwaches Lichrt e Metalplatte Starkes Licht Metalplatte e- e- e- e- e- ee Metalplatte Metalplatte Erklärung des Lichtelektrischen Effektes Lichtelektrischer Effekt: Lichtstrahlung f Photon Energiegleichung: E photon = hf = A + m v 1 2 Beobachtung beim z.B. Cäsium: Rotes Licht (650nm): Kein Elektronenaustritt Gelbes Licht (590 nm): Elektronen Grünes Licht (550 nm): treten aus Blaues Licht (450 nm): v 2 zb. bei Cäsium: A=1,94 eV Rotes Licht (650nm): Gelbes Licht (590 nm): Grünes Licht (550 nm): Blaues Licht (450 nm): 0,306 aJ 0,337 aJ 0,361 aJ 0,442 aJ (1,91 eV) X (2,11 eV) 9 (2,26 eV) 9 (2,76 eV) 9 Anzahl der ausgelösten Elektronen ist proportional zur Beleuchtungsstärke. Ist das Licht Wellen- oder Teilchenstrahlung? Das Licht ist Wellen UND Teilchenstrahlung Analogie: Münze Kopf oder Schrift? Kopf UND Schrift? Das Licht kann in Form von Welle und auch in Form von Teichen erscheinen. Teilchencharakter: Lichtelektrischer Effekt Wellencharakter: Interferenz, Beugung Photon: Teilchen (Quantum) des Lichtes. Energie des Photons: Ephoton = h f (Als Erinnerung: ν = c λ ) h = Planksches Wirkungsquantum 6,63·10-34 Js f = Frequenz λ f, E Radiowellen Licht Wellencharakter Rtg- u. γ Strahlung Teilchencharakter Beschreibung der Mikrowelt (Atome und kleinere Objekte) Allgemeine Bemerkungen: Die Energie ist nicht beliebig groß, sondern es gibt Energiequanten (zB. Lichtphoton) => Quantenmechanik Aufbau des Atoms Wie klein ist dieser Mikrowelt? Einige typische Größen m 100• meter Mann 10-3• millimeter Abstand der man mit Auge sehen kann 10-6• mikrometer Zelle (z.B. Blutkörpern) ∅ 7μm -9 10 • nanometer Protein 10-10 – Angström Durchmesser des Atoms, H Atom ∅ ≈ 1 Angström (Å) Atom = nicht teilbar Atomkern Atomkern+Elektronen Veranschaulichung: Bohrsches Atommodel 10-12• pikometer Wellenlenge der Röntgenstrahlung 10-15• femtométer Atomkern Bohrsches Atommodel r ist nicht eindeutig bestimmt. F F H-Atom Bohrsches Quantenbedingung: Bahndrehimpuls: rmv = n F: Coulombsche Kraft = = Zentripetalkraft F= 1 e2 v2 = m e 4πε 0 r 2 r Ganzer Zahl (1,2…) F F re 2me h2 = me2v 2 r 2 = n 2 2 4πε 0 4π r = n2 ε 0 h2 ~ n2 π me e 2 v= e2 2ε 0hn h 2π Kinetische Energie des Elektrons: n=1 Bahnenergie (E) =Ekin+Epot E n=2 0 E n = − Konst n=∞ n=3 n=3 n=2 1 n2 Bohrsches Frequenzbedingung: n=1 Beim Übergang des Elektrons von einer Bahn mit Energie Em zu einer Bahn mit geringerer Energie En wird die Energiedifferenz mit einem Photon abgegeben (Emission) hf=Em-En=ΔE n= Quantenzahl (Hauptquantenzahl) Elektronenübergänge: Energieaufnahme und Abnahme ΔE=hf n=1 n=1 n=2 Absorption n=2 Emission ΔE=hf Elektronenübergänge des Wasserstoffatoms Was ist wahr was ist nur schönes Bild? Bohr Molekülen Quantenmechanik Diskrete Energiezustände OK Absorption, Emission ΔE=hf OK E Elektronen bewegen sich an einem Kreisbahn Es gibt Elektronenschallen. Position des Elektrons kann nicht bestimmt werden. (Wellenfunktion) Elektronenübergang: Springen zwischen Elektonenbahnen Übergang zwischen Elektronenhüllen: Überlappung der Wellenfunktionen Beispiele für Biolumineszenz Lumineszenz Fluoreszenz E Molekülschwingungen! Phosphoreszenz E