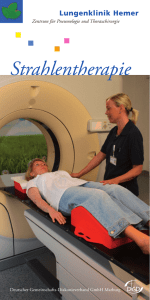
Strahlentherapie
Werbung

Kurs „Bildgebende Verfahren, Strahlenbehandlung und Strahlenschutz“ Script zur Vorlesung von Prof. Dunst im SS 15 Strahlentherapie Hinweis: Das Script fasst die wichtigsten Themenbereiche der Vorlesung nur sehr kurz und stichwortartig als Ergänzung zu den Vorlesungsfolien (daher hier nur Text und keine Bilder/Tabellen) zusammen und soll helfen, die Folien besser zu verstehen und die Vorlesung adäquat vor- und nachbereiten zu können; es ersetzt natürlich kein Lehrbuch. Allgemeine Einführung: Fachgebiet Strahlentherapie Strahlentherapie ist ein eigenständiges medizinisches Fachgebiet (Teil der Radiologie), Weiterbildungszeit 5 Jahre. Der Facharzt für Strahlentherapie führt Strahlenbehandlungen durch, überwiegend (>90%) bei Patienten mit Krebserkrankungen. Gute Kenntnisse über Krebserkrankungen, Erfahrung in medikamentöser Tumortherapie (also Chemotherapie und Einsatz von anderen antineoplatisch wirkenden Medikamenten gegen Krebserkrankungen), Schmerztherapie, Supportivtherapie und Palliativmedizin gehören daher zur Ausbildung. In Deutschland gibt es etwa 1200 Fachärzte für Strahlentherapie (plus 250 Ärzte in Weiterbildung), die an etwa 300 Einrichtungen arbeiten. Es gibt 37 Strahlenkliniken an Universitäten (jeweils 10 bis >25 Ärzte), etwa 100 Strahlenkliniken an nichtakademischen Krankenhäusern (ca. 5-10 Ärzte) und etwa 150 Praxen (jeweils 2-10 Ärzte). Außerdem sind in jeder Einrichtung Medizinphysiker bzw. Medizinphysik-Experten beschäftigt (etwa einer pro Facharzt, Aufgaben in der Bestrahlungsplanung, Qualitätssicherung und Geräteüberwachung), MTRAs (med.-technisch Radiologie-Assistenten; sie bedienen die Therapiegeräte, etwa 3-4 pro Großgerät) und weiteres Funktionspersonal. Das wichtigste Gerät ist der Linearbeschleuniger (sog. Großgerät, Anschaffungspreis: 1,5 bis 2,5 Mio €, Spezialgeräte über 5 Mio €; zum Vergleich: CT max. 500.000€, MRT max. ca. 1 Mio); damit werden die meisten Patienten (>90%) behandelt. Eine Strahlentherapie-Praxis hat meistens 1-2 Linearbeschleuniger, Kliniken 2-4 (in Lübeck: 2) und große Einrichtungen 6-7 (Unis Erlangen, Tübingen, Heidelberg). Aus betriebswirtschaftlichen Gründen muss man pro Gerät jährlich mindestens etwa 300-400 Patienten behandeln; eine normale Strahlentherapie hat also ein Einzugsgebiet von etwa 250.000 Einwohnern. Deutschland ist eines der wenigen Länder mit sehr großer Anzahl von Strahlentherapie-Einrichtungen (z.B. 10 Kliniken/Praxen in Schleswig-Holstein), während in anderen Ländern eine sehr viel stärkere Konzentration vorliegt (z.B. Großbritannien, Skandinavien; Dänemark hat mehr als doppelt so viele Einwohner wie Schleswig-Holstein, aber nur 7 Strahlentherapie-Einrichtungen). Die Konzentration (nicht nur in der Strahlentherapie, sondern auch bei anderen High-tech-Medizinbereichen) hat Vorteile (mehr Geräte, z.B. 13 Linearbeschleuniger an der Uni Kopenhagen oder 15 in Oslo, kürzere Investitionszyklen, größere Ärzteteams mit stärkerer Spezialisierung), aber auch Nachteile für Patienten (lange Anreisewege). Weitere in der Strahlentherapie benutzte Geräte sind: o CT-Simulator o Konventioneller Simulator o Brachytherapie-Geräte (Afterloading-Geräte) für Kontaktbestrahlungen o Röntgentherapiegerät Strahlentherapie ist eine wichtige Säule der Krebsbehandlung. 60% aller Krebspatienten erhalten eine Strahlentherapie. Strahlentherapie ist (neben der Operation) die wichtigste Therapiemethode, um eine dauerhafte Heilung zu erreichen (viel wichtiger als medikamentöse Therapie oder andere Verfahren). Keine andere medizinische Fachdisziplin behandelt so viele Krebspatienten und ein so breites Spektrum an Krebserkrankungen wie Strahlentherapie. Wenn ein Krankenhaus eine Strahlentherapie hat, werden dort die meisten Krebspatienten behandelt. Wenn Sie sich über das Fach und Ausbildungsmöglichkeiten informieren möchten, finden Sie Informationen auf der Website der Deutschen Gesellschaft für Radioonkologie, www.degro.org. Wir organisieren auch Famulaturen an Strahlenkliniken oder -praxen für Sie. Grundlagenwissen zum Thema „Krebs“ Krebs (bösartige Erkrankung, Malignom) ist eine Erkrankung vor allem des höheren Lebensalters. Die in den letzten Jahren beobachtete Zunahme der Neuerkrankungen beruht auf der demografischen Entwicklung (Zunahme älterer Menschen); altersbereinigt nimmt die Krebsinzidenz sogar leicht ab. Die Sterblichkeit (Zahl der Todesfälle) sinkt seit Jahren (trotz steigender Neuerkrankungen). Typische Charakteristika von Krebs sind: o Autonomes (unkontrolliertes) Wachstum o Invasion in die Umgebung (gutartige Tumoren wachsen nur verdrängend) o Ausbildung von Metastasen (Töchtergeschwülsten) in anderen Organen Der Zellzyklus ist extrem gut kontrolliert. Krebs kann nur entstehen, wenn die Zellen multiple genomische Veränderungen akkumuliert haben, nämlich Ausschalten von Kontrollgenen (Suppressorgene, z.B. p53) und gleichzeitige Hochregulierung von Wachstumsgegen (z.B. EGF). Die Apoptose-Fähigkeit ist bei Krebszellen meistens verloren gegangen. Eine spontane Rückbildung ist äußerst selten (es gibt aber Einzelfallberichte mit Spontanrückbildungen; bei einigen wenigen Erkrankungen kann es vorübergehende Remissionen geben). Als Faustregel gilt: jeder diagnostizierte Krebs (und auch die obligaten Vorstufen, z.B. DCIS = ductales carcinoma in situ der Mamma) sollte, wenn möglich, umgehend behandelt werden. Einzelne Ausnahme betreffen sehr langsam wachsende Tumoren im hohen Lebensalter (z.B. günstige Fälle von Prostatakrebs). Krebs entwickelt sich meistens langsam über Jahre. Im Verlauf nimmt die Geschwindigkeit meistens zu; fortgeschrittene Erkrankungen können sich akut verschlechtern. Die Heilungsaussicht hängt sehr stark von der Erkrankungssituation ab. Man unterscheidet folgende Gruppen: Unterscheidung nach Ursprungsort/Ausbreitung: o Solide Tumoren: Erkrankungen, die als Knoten an einer Stelle entstehen und sich vor dort in das Gewebe ausbreiten und metastasieren. Dazu gehören fast alle Tumoren, also Mammakarzinom (entstanden in der Brust), Bronchialkarzinom (entstanden in der Lunge), Darmkrebs, Hautkrebs, etc. o Systemerkrankungen: Erkrankungen, die überall im Körper auftreten können und im Regelfall bzw. oft primär generalisiert sind, also Lymphome, Leukämien, Plasmozytom. Unterscheidung nach histologischem Typ: o Karzinome: Tumoren epithelialen Ursprungs, also Mamma-Ca, Bronchial-Ca etc. o Sarkome: Tumoren mesenchymalen Ursprungs, also ausgehend von Knochenund Weichteilgewebe, z.B. Osteosarkom, Weichteilsarkom. o Gliome: Hirntumoren (auch mesenchymalen Ursprungs) o Lymphome: M.Hodgkin, Non-Hodgkon-Lymphome, Plasmozytom, Sonderformen Die Heilungschance ist im ersten Anlauf immer am besten. Daher gilt: die Ersttherapie muss gut geplant sein und korrekt durchgeführt werden. Das Rezidiv (Rückfall der Erkrankung) ist meistens tödlich oder zumindest mit schlechteren Heilungsaussichten verbunden. Rezidive treten meistens innerhalb der ersten zwei bis drei Jahre nach Abschluss der Therapie auf, weil man das Wachstum von verbliebenen Krebszellen nicht abstellen kann und diese innerhalb von 2-3 Jahren von Einzelzellen oder kleinen Zellnestern zu einem sichtbaren Tumor anwachsen. Wer mehr als 3-5 Jahre rückfallfrei war, hat danach praktisch eine normale Lebenserwartung, so als ob er den Krebs nicht gehabt hätte. Etwa zwei Drittel aller Krebspatienten werden dauerhaft geheilt. Die Heilungsrate ist bei Frühstadien fast 100%. Bei Lungenkrebs oder bei Vorliegen von Metastasen ist die Langzeitüberlebensrate nach 5 Jahren aber <5-10%. Die drei Säulen der Krebsbehandlung sind Operation, Strahlentherapie und medikamentöse Therapie. Die Krebserkrankungen werden nach dem TNM-System eingestuft (T= Tumorgröße, N = Befall der regionalen Lymphknoten; M = hämatogene Fernmetastasen oder Befall entfernter/juxtaregionärer Lymphknoten, z.B. T1 N0 M0 für ein kleines Karzinom ohne Lymphknotenbefall und ohne Nachweis von Fernmetastasen). Für einige Erkrankungen haben sich einfachere pragmatischere Stadieneinteilungen für die Praxis bewährt. Man unterscheidet kurative und palliative Therapie (gemeint ist das Therapieziel): Kurative Behandlung: Erkrankung ist heilbar, Heilung ist Therapieziel. Für dieses Ziel dürfen auch gewisse Risiken und Nebenwirkungen in Kauf genommen werden. Kurative Methoden sind vor allem Operation und Bestrahlung, in geringem Anteil auch medikamentöse Therapien. Etwa zwei Drittel der kurativ behandelten Patienten werden auch wirklich geheilt, bei einem Drittel ist die Behandlung erfolglos oder es kommt zum Rezidiv. Palliative Behandlung: die Erkrankung ist nicht mehr heilbar oder der Patient kann eine kurative Therapie nicht vertragen. In diesen Fällen versucht man, die Erkrankung vorübergehend zurück zu drängen und vor allem relevante Symptome (v.a. Schmerzen, aber auch Blutung, Husten, Luftnot, etc) zu lindern. Palliative Therapiemethoden sind vor allem medikamentöse Therapie und Strahlentherapie, in geringerem Maße auch operative Verfahren. Für die häufigsten Erkrankungen liegen Leitlinien zur Diagnostik und Therapie vor, die regelmäßig (meistens nach ca. 3 Jahren) von interdisziplinären Expertengruppen aktualisiert werden. Als besonders wichtig und verbindlich gelten Leitlinien der Entwicklungsstufe S3 (erstellt nach definiertem Vorgehen von einer interdisziplinären Expertengruppe im konsentierten Abstimmungsverfahren nach systematischer Literaturrecherche). Die Leitlinien sind auf der Website der Arbeitsgemeinschaft der wissenschaftlichen medizinischen Fachgesellschaften (AWMF) publiziert und allgemein zugänglich: www.awmf.org Kurzer geschichtlicher Abriss über technische Entwicklungen 1 1895: Entdeckung einer neuen Art von Strahlung durch Wilhelm Conrad Röntgen in Würzburg (Professor für Physik, erster Nobelpreisträger für Physik). Er bezeichnet diese unbekannten Strahlen als X-Strahlen (die Amerikaner verwenden diese Bezeichnung noch heute), in Europa setzt sich die Bezeichnung „Röntgenstrahlen“ durch. Das erste Röntgenbild wird angefertigt (es zeigt die Hand des Leiters der medizinischphysikalischen Gesellschaft in Würzburg). 1896: Antoine Henri Becquerel entdeckt die Radioaktivität von Urankaliumsulfat (das natürliche Pendant zur Röntgenstrahlung1). 1898 entdeckt Marie Curie die Radioaktivität von Pechblende und isoliert Radium und Polonium (Curie und Becquerel erhalten gemeinsam den Nobelpreis für Physik 1903). 1896: erste Therapie mit Röntgenstrahlen durch Freund in Wien. Behandelt wurde ein großer Tierfell-Nävus am Rücken eines Kindes. 1902: erste prophylaktische Nachbestrahlung bei Brustkrebs und Strahlentherapie von Lymphomen durch Pusey in Chicago. Die verwendeten Röntgenröhren erzeugen relativ schwache Röntgenstrahlung; für die Diagnostik ist dies ausreichend (optimaler Gewebekontrast bei ca. 60 kV). Im Lauf der nächsten Jahrzehnte erkennt man, dass stärkere Strahlung für die Therapie besser wäre. Allerdings kann man aus technischen Gründen keine Geräte mit Strahlung oberhalb von 300kV bauen. ca. 1910: Radium-Quellen werden zur Kontaktbestrahlung von Tumoren eingesetzt (Brachytherapie) 1911: erste Habilitation für das Fachgebiet „Strahlenheilkunde und Lichttherapie“ an der CAU Kiel (Prof. Hans Meyer, Begründer der Zeitschrift „Strahlentherapie“, der ersten und weltweit ältesten Fachzeitschrift für Strahlentherapie und Onkologie) 1928: Rolf Wideröe (ein Norweger) baut den ersten Linearbeschleuniger 1935: Max Steenbeck baut im Forschungslabor von Siemens in Berlin den ersten Elektronen-Kreisbeschleuniger für medizinische Anwendungen (Betatron) 1951: Einsatz des ersten Telekobaltgeräts in einem Krankenhaus in Kanada. Telekobaltgeräte erzeugen harte Gammastrahlung (1,17 und 1,33 MeV) durch Zerfall des künstlichen Nuklids Co-60 (das wird in Kernreaktoren durch Neutronenbeschuss hergestellt, Halbwertszeit 5,3a) und sind zwischen 1960 und etwa 1985 die Standardgeräte für Strahlentherapie. In Deutschland sind diese Geräte (am meisten eingesetzt: Gammatron der Fa. Siemens) noch bis etwa 1995 in Betrieb, später nur noch Linearbeschleuniger. In Schwellenländern ist das Telekobaltgerät weiterhin ein wichtiges Gerät, weil es technisch sehr robust und nahezu wartungsfrei ist. Kobaltgeräte mit extrem hoher Strahlungsleistung wurden in manchen Ländern zur Sterilisierung von Lebensmitteln verwendet (in Deutschland nicht erlaubt). Röntgenstrahlung = ionisierende Wellenstrahlung, die durch eine Röntgenröhre erzeugt wird. GammaStrahlung = ionisierende Wellenstrahlung, die durch radioaktiven Zerfall erzeugt wird. Physikalisch und biologisch sind diese Strahlungen identisch. Bei Erzeugung durch einen Linearbeschleuniger spricht man von ultraharter Photonenstrahlung. 1962: Henry Kaplan führt in Stanford die Großfeldbestrahlung bei M.Hodgkin ein (Mantelfeld, umgekehrtes Y-Feld); dadurch werden erstmals Langzeitheilungen bei dieser Erkrankung erreicht. Das ist auch der Beginn der individuell kollimierten Bestrahlungsfelder und ein Meilenstein in der Entwicklung der modernen Strahlentherapie. Ab Mitte der 70er Jahre ist diese (damals komplizierte) Technik optimiert und setzt sich nach und nach durch. In Deutschland sind die Unikliniken Freiburg (BRD, ca. 1975) und Halle (DDR, 1980) die ersten, die diese Technik einsetzen. Heute werden diese großen Strahlenfelder allerdings nicht mehr verwendet, sondern man bestrahlt nur noch die direkt betroffene Lymphknoten-Station („involved field“). Ab ca. 1970: Ganzkörperbestrahlung bei Knochenmarktransplantation, zuerst eingesetzt in Seattle. Die erste Uniklinik in Deutschland, an der Ganzkörperbestrahlungen gemacht werden, ist die Uni Kiel 1984. Ab 1980: der Elektronen-Linearbeschleuniger wird das Standardgerät für die Strahlentherapie. Ab 1980: CT-gestützte Bestrahlungsplanung, zunächst nur als 2D-Planung Ab ca. 1985: die Brachytherapie mit Radium (vor allem bei gynäkologischen Tumoren) wird durch Afterloading-Geräte (v.a. mit dem Strahler Iridium-192) ersetzt. Das Nachladeverfahren ermöglicht optimalen Strahlenschutz für das Personal und bessere Möglichkeiten der Bestrahlungsplanung. Beim Prostatakarzinom wird die Therapie mit Jod-Seeds (Permanentimplantation) eingeführt, heute die beste und schonendste Therapie für Frühstadien. 1985: Einführung der simultanen Radiochemotherapie beim Analkarzinom. In der Folge wird die simultane Radiochemotherapie (die Chemotherapie dient dabei zur Strahlensensibilisierung des Tumors) die Standardtherapie für zahlreiche andere Erkrankungen (u.a. nichtkleinzelliges Bronchialkarzinom, Plattenepithelkarzinome im HNO-Bereich, gastrointestinale Tumoren, Harnblasenkarzinom, Zervixkarzinom). 1989: erste Rotationsbestrahlung eines Linearbeschleunigers mit beweglichen Kollimatorblenden in Würzburg durch Prof. Richter (später Lehrstuhlinhaber für Strahlentherapie in Lübeck). Ab ca. 1990: 3D-Konformationsbestrahlung Ab 1995: stereotaktische Hochpräzisionsbestrahlung („Radiochirurgie“) Ab ca. 2000: IMRT (intensitätsmodulierte Radiotherapie) Ab ca. 2005: Radiochirurgie mit CyberKnife, Tomotherapie, Partikeltherapie mit Protonen und Ionen. Real-time-3D-Planning in der Brachytherapie. Ab ca. 2010: 4D-Bestrahlungsplanung, Bestrahlung bewegter Zielvolumina mit Gatingund Tracking-Techniken (v.a. CyberKnife, Tracking-Software stammt aus dem Institut für Robotik der Universität zu Lübeck), dynamische Rotations-IMRT („VMAT = volumemodulated arc therapy“, z.B. RapidArc). Autosegmentierung (Konturierung von Organen bei der Bestrahlungsplanung erfolgt automatisch durch das Planungsprogramm). Ab 2015-2020 (vermutlich): adaptive Strahlentherapie. Der Bestrahlungsplan wird täglich an die jeweilige Lage von Organen angepasst („plan of the day“) Ab ??: Real-time-planning (Bestrahlungsplanung und Bestrahlung in einem Arbeitsgang) Grundlagen der biologischen Strahlenwirkung Jede Zelle kann durch Bestrahlung mit ionisierenden Strahlen inaktiviert/zerstört werden; es gibt keine absolute Resistenz gegen Röntgenstrahlung (aber es gibt Resistenz gegen alle Zytostatika). Die Zielstruktur für Zell-Inaktivierung ist die DNA. Letale DNA-Schäden treten ab etwa 1Gy auf. Andere zelluläre Substrukturen (Membranen, Proteine) sind weitegehend strahlenresistent. → Klinische Bedeutung: Erythrozyten-Konzentrate, die für immunsupprimierte Patienten nach Knochenmark-Transplantation bestimmt sind, werden gelegentlich mit 30Gy bestrahlt, um sämtliche immunkompetente Zellen (Lymphozyten) zu zerstören (die Membranen der Erythrozyten bleiben erhalten). Dadurch kann eine Graft-versus-hostReaktion vermieden werden (die wenigen Lymphozyten des Spenders, die noch im EryKonzentrat vorhanden sind, würden den ganzen Körper des Empfängers, der ja passager keine Immunzellen hat, abstoßen). Wenn man Zellen ionisierender Strahlung aussetzt, treten an der DNS Schäden auf. Diese Schäden können durch direkte „Treffer“ der DNS (direkte Strahlenwirkung) oder indirekt durch Ionisation von Wasser und Bildung von Radikalen, die sekundäre DNS-Schäden verursachen (indirekte Strahlenwirkung) entstehen. Die meisten DNS-Schäden sind einfache Schäden (z.B. Einzelstrangbrüche, Basenverluste), die sehr schnell komplett repariert werden. Es können aber auch Doppelstrangbrüche oder komplexe Läsionen („bulky lesions“) entstehen, die für die Reparaturenzyme schwieriger zu reparieren sind. Mit zunehmender Strahlendosis nimmt die Zahl dieser komplexen DNS-Schäden überproportional zu. Dies führt zum Zelltod. Die Zelle stirbt aber nicht sofort (bei Zytostatika ist das oft der Fall), sondern meistens durchlaufen Zellen noch mehrere (abortive) Teilungen und sterben erst bei der dritten oder vierten Zellteilung nach Bestrahlung (sog. reproduktiver Zelltod). → Klinische Bedeutung: Da Tumorzellen nicht sofort sterben, sondern mehrere (abortive) Teilungen durchlaufen, kann man die Wirkung einer Strahlentherapie oft erst nach Wochen beurteilen. Bei sehr langsam wachsenden Tumoren (z.B. Prostatakarzinom) kann man in Biopsien noch nach einem Jahr vital erscheinende Zellen finden, die danach noch absterben. Bedeutung für den Patienten: Patienten darauf hinweisen, dass Wirkung allmählich eintritt. Wenn präoperativ bestrahlt wird, sollte man Tumorschrumpfung abwarten (OP nach ca. 6 Wochen). Die Strahlenwirkung kann im halblogarithmischen Diagramm (X-Achse: Strahlendosis D in Gray, linear; Y-Achse: Überlebende Zellfraktion/surviving fraction SF, logarithmisch) als „Schulterkurve“ dargestellt und mit einer mathematischen Funktion beschrieben werden: 2 –(D + D ) SF = e Diese Formel wird auch als linear-quadratisches Modell (weil die Dosis D linear und quadratisch im Exponenten auftaucht) oder (nach dem beiden Koeffizienten) als α-βModell bezeichnet. Bei einer Strahlendosis von 2Gy beträgt die Überlebensfraktion (SF2Gy) ca. 50%. Die Mindestdosis, bei der Zellen sterben können, beträgt etwa 0,5Gy bis 1,0Gy. Der größte Unterschied zwischen kritischen gesunden Organen (die durch eine Strahlentherapie nachhaltig geschädigt werden können) und den meisten Tumoren besteht im Bereich von etwa 1,0 bis 2,0Gy. → Klinische Bedeutung: Die meisten Patienten werden daher bei einer Strahlentherapie mit Einzeldosen von werktäglich (an 5 Wochentagen) 1,80Gy oder 2,00Gy behandelt. Bei dieser Fraktionierung (der Fachbegriff für die „Portionierung“ der Strahlentherapie) ist die therapeutische Breite am größten, und Langzeit-Nebenwirkungen (sog. Spätfolgen, früher sehr gefürchtet) treten sehr selten auf. Man bezeichnet diese Art der Fraktionierung (5x wöchentlich 1,8 bis 2,0Gy) auch als konventionelle Fraktionierung oder Normfraktionierung. Die zur Tumorheilung erforderliche Strahlendosis hat man im Lauf der letzten Jahrzehnte aus Empirie und durch klinische Studien ermittelt. Für die meisten Erkrankungen verwendet man (bei konventioneller Fraktionierung) eine Gesamtdosis von ca. 70Gy (appliziert in 7-8 Wochen bei werktäglicher Bestrahlung). Diese Dosis kann man auch mathematisch gut begründen, nämlich: o Ein typischer inoperabler Tumor von etwa 1cm Durchmesser enthält etwa 1 Milliarde teilungsfähige Krebszellen. o Die Heilungswahrscheinlichkeit H hängt ab von der Zahl der nach Bestrahlung überlebenden Zellen und kann berechnet werden als H = e –Zahl überlebender Zellen o Wenn man mit einer Einzeldosis von 2Gy bestrahlt und jede Bestrahlung etwa 50% der zum Zeitpunkt der Bestrahlung noch vorhandenen teilungsfähigen (clonogenen) Zellen inaktiviert, muss bei einer Ausgangszellzahl von 1x 109 eine Bestrahlung mit etwa 35 Fraktionen gegeben werden (wer´s nicht glaubt: nachrechnen). Eine „kurative“ (also auf definitive Heilung ausgerichtete) Behandlung wird also meistens mit einer Gesamtdosis von etwa 70Gy durchgeführt (wenn möglich); höhere Dosen sind bisher selten möglich und werden nur in klinischen Studien erprobt. Bei postoperativer Bestrahlung (geringere Ausgangszellzahl, also weniger Tumorzellen) reichen meistens 5060Gy. Nach Bestrahlung können sich Zellen, die nicht definitiv inaktiviert (getötet) wurden, erholen. Diese „Reparatur des subletalen Strahlenschadens“ läuft mit einer Halbwertszeit von etwa 20-30 Minuten ab. Nach 10 bis 12 Halbwertszeiten sind praktisch alle Strahlenschäden repariert. → Klinische Bedeutung: Wenn man zweimal täglich bestrahlt, soll ein Zeitintervall von mindestens 6 Stunden zwischen den Fraktionen liegen, damit sich das gesunde Gewebe erholen kann. 2 3 In Geweben mit geringem Zellumsatz und langer Lebensdauer der Zellen (v.a. z.B. ZNS) ist die Reparatur von DNS-Schäden sehr effektiv (evolutionär nötig als Schutzmechanismus dieser Gewebe); die Dosis-Effekt-Kurve hat eine breite Schulter. Bei schnell proliferierenden Geweben mit kurzer Lebensdauer der Zellen (z.B. Darmmukosa, Knochenmark) ist die Reparatur weniger effektiv (evolutionär auch nicht erforderlich); die Dosis-Effekt-Kurve hat eine schmale Schulter. Die Komponenten α und β sind also unterschiedlich, der Quotient (der sog. α/β-Wert) ist verschieden, nämlich bei den meisten langsam proliferierenden Geweben 2-3Gy und an schnell proliferierenden Geweben ca. 10Gy 2. Wenn man die α/β-Werte kennt (das trifft für alle Normalgewebe und die meisten Tumoren zu), kann man die biologische Wirkung einer fraktionierten Bestrahlung sehr gut berechnen. Tumoren haben meistens sehr hohe α/β-Werte von 10Gy bis 20Gy, d.h. sie verhalten sich wie schnell proliferierendes gesundes Normalgewebe. → Klinische Bedeutung: Wenn gesundes Gewebe im Zielgebiet der Bestrahlung (oder direkt daneben liegt), kann man Effekte am gesunden Gewebe (also Nebenwirkungen) versuchen zu vermeiden, indem man die Fraktionierung so wählt, dass der Effekt am Tumor groß und am gesunden Gewebe klein ist. Das funktioniert aber nur für langsam proliferierende Gewebe (dort entstehende Strahleneffekte manifestieren sich spät nach der Bestrahlung und heißen „Spätfolgen“), weil sich deren α/β-Werte (2-3Gy) deutlich von den α/β-Werten von Tumoren (10-20Gy) unterscheiden. Schnell proliferierende Gewebe (dort entstehende Strahleneffekte manifestieren sich schnell schon während der Bestrahlung und heißen „akute Strahlenreaktionen“) kann man durch optimale Fraktionierung nicht schützen, weil sie im Vergleich zum Tumor quasi identische α/βWerte haben3. Neben der konventionellen Fraktionierung (5x wöchentlich 2,0Gy, etwa 80% aller Patienten werden so behandelt) gibt es alternative Fraktionierungen, die man einsetzt, um den Unterscheid zwischen Normalgewebe und Tumor optimal auszunutzen oder die Behandlung für den Patienten vorteilhafter zu machen: o Hyperfraktionierung: Behandlung mit mehr als den üblichen Fraktionen („hyper“), also Einzeldosis pro Fraktion ≤1,6Gy. Da man die Behandlungszeit meistens nicht verlängern sollte, wird dann oft zweimal täglich bestrahlt. Der α/β-Wert wird in Gy angegeben; das hat aber nichts mit einer Bestrahlungsdosis zu tun, sondern ist 2 lediglich ein mathematischer Wert, der sich aus der Division von α (Einheit: 1/Gy) und β (Einheit: 1/Gy ) ergibt. 1.) Akute Reaktionen kann man zwar nicht durch Fraktionierung vermeiden, aber man sie durch optimale Bestrahlungsplanung vermindern und sie sind relativ harmlos, da sie nach der Strahlentherapie im Lauf von 2-3 Wochen spontan abklingen. 2.) Neuerdings wird die früher gültige Lehrbuchmeinung, dass alle Tumoren hohe α/β-Werte haben, kritisch hinterfragt. Das Prostatakarzinom hat vermutlich einen sehr niedrigen α/β-Wert (ca. 1,5Gy), beim Mammakarzinom liegt der α/βWert vermutlich bei etwa 3,0 bis 3,5Gy; die Konsequenzen daraus werden später erläutert. o Hypofraktionierung: Behandlung mit weniger („hypo“) als der üblichen Zahl von Fraktionen, also Einzeldosis pro Fraktionen >2,2Gy. Hypofraktionierung galt bisher als unsinnig bei kurativer Zielsetzung (weil man den Unterschied zwischen Normalgewebe und Tumor in den α/β-Werten nicht nutzt) und wurde nur bei palliativer Behandlungsintention eingesetzt. Neuerdings wird Hypofraktionierung aber wieder verstärkt auch bei kurativer Therapieintention geprüft (wichtiges Forschungsgebiet in Lübeck bei Brustkrebs und Prostatakrebs). o Akzelerierung: Verkürzung der Gesamtbehandlungszeit um mindestens 1 Woche gegenüber der Behandlungszeit bei konventioneller Fraktionierung, also z.B. eine Gesamtdosis von 60Gy in 5 Wochen (bei konventioneller Fraktionierung würde man dafür 6-7 Wochen benötigen). Starke Akzelerierung führt meist zu verstärkten Nebenwirkungen und wird daher kaum noch eingesetzt. o Ein klinisch oft eingesetztes Fraktionierungsschema ist die hyperfraktioniertakzelerierte Bestrahlung (z.B. 2x tägliche Bestrahlung mit jeweils 1,5Gy bis 45Gy, Dauer der Behandlung insgesamt also 3 Wochen. Diese Therapie beinhaltet ein Hyperfraktionierung (da Einzeldosis ≤1,6Gy) und auch eine moderate Akzelerierung (da die Gesamtbehandlungszeit, die bei 45Gy Gesamtdosis in konventioneller Fraktionierung mindestens 4,.5 Wochen betragen würde, um mehr als 1 Woche reduziert ist). Solche hyperfraktioniert-akzelerierte Behandlungen eignen sich für sehr schnell wachsende Tumoren, z.B. das kleinzellige Bronchialkarzinom (SCLC, small cell lung cancer). Mögliche Änderungen der bisher typischen Fraktionierungen werden zurzeit in klinischen Studien geprüft, vor allem beim Mammakarzinom und Prostatakarzinom. Aktuell wird vor allem eine Hypofraktionierung untersucht. Strahlenresistenz Echte (absolute) Strahlenresistenz gibt es nicht (!!), im Gegensatz zur Chemotherapie. Strahlenresistenz im immer nur relativ, d.h. bei ausreichend hoher Dosis besteht (theoretisch) eine Chance von 100% auf lokale Tumorheilung. Als Erfolgskriterium der Bestrahlung gilt die lokale Tumorkontrolle, also die Beherrschung des Tumors im Bestrahlungsvolumen (die Bestrahlung kann nur dort wirken, wo Strahlung hinkommt). Die lokalen Tumorkontrollraten (dauerhafte lokale Tumorkontrolle nach 5 Jahren) betragen: bei postoperativer Bestrahlung: o 90% bis >95% bei günstiger Ausganssituation nach Operation (z.B. Brustkrebs, Weichteilsarkome, T1-Pharynxkarzinome, jeweils R0-Resktion, also Resektion histologisch im Gesunden) o 70-80% bei ungünstiger Ausgangssituation (z.B. Larynx-Ca mit massivem LK-Befall trotz R0-Resektion, R1-Resektionen) bei definitiver (alleiniger) Strahlentherapie: o >95% bis 100% bei strahlenempfindlichen Tumoren (Lymphome, Seminon; diese Tumoren werden aber wegen des hohen Risikos für Dissemination im gesamten Körper überwiegend mit Chemotherapie und lediglich ergänzender/additiver Bestrahlung behandelt; die lokale Tumorkontrolle ist aber auch bei alleiniger Bestrahlung ohne Chemotherapie sehr gut). o >90% bei Tumoren, die relativ klein sind und mit hoher Dosis bestrahlt werden können, z.B. kleine Larynxkarzinome (Bestrahlung ist gute Alternative zur Laserresektion mit mindestens gelichwertigem Erfolg hinsichtlich Tumorkontrolle und Stimmerhalt), kleine Zervixkarzinome, Prostatakarzinom ohne LK-Befall o ca. 50-70% bei den meisten inoperablen Tumoren. Die Langzeitüberlebensrate (Heilungsrate) nach 5 Jahren ist in solchen Situationen aber oft sehr viel schlechter als die lokale Tumorkontrolle, weil ein hohes Risiko für Metastasen besteht. o ca. 30% bei weit fortgeschrittenen Tumoren (z.B. inop. Bronchialkarzinom Stadium III) Für Misserfolg der Bestrahlung (also Tumorpersistenz oder Lokalrezidiv) werden folgende Faktoren verantwortlich gemacht: o Großes Tumorvolumen: Je mehr Zellen zu vernichten sind, desto größer ist die dazu erforderliche Strahlendosis. Wenn umgekehrt die Strahlendosis durch das umgebende gesunde Gewebe limitiert ist, hat man bei einer bestimmten Dosis (z.B. 70Gy) eine recht gute Chance auf lokale Tumorkontrolle, wenn der Tumor klein ist. Die Chance sinkt mit größerem Tumorvolumen. o Schnelle Proliferation: manche Tumoren können sich sehr schnell teilen; die potenzielle Verdopplungszeit clonogener Zellen beträgt bei Oropharynxkarzinomen z.B. 3-4 Tage; klinisch bemerkt man das nicht, da meistens gleichzeitig ein hoher Zellverlust vorliegt, wodurch sich die klinische Verdopplungszeit deutlich verlängert (auf meistens 2-3 Monate, gelegentlich aber kürzer). Bei langen Behandlungszeiten spielt diese „Repopulierung“ von Tumorzellen aber eine Rolle. Als Faustregel gilt: bei mehr als drei bis vier Wochen Behandlungszeit gibt es einen Wirkungsverlust von 2-3Gy pro Woche, d.h. von den bei konventioneller Fraktionierung applizierten 10Gy pro Woche gehen 3Gy durch Repopulierung verloren. o Hypoxie: bei sehr niedrigen Sauerstoff-Partialdrücken (unter 5mm Hg) können normale (gesunde) Zellen im Regelfall nicht überleben; sie lösen das ApoptoseProgramm aus (Ausnahmen z.B. Erythropoetin-produzierende O2-Sensor-Areale in der Niere). Tumorzellen können unter diesen Bedingungen überleben (durch Umstellung auf anaeroben Stoffwechsel) und sogar aggressiver werden (erhöhtes Metastasierungspotenzial). Hypoxische Tumorzellen sind ziemlich resistent gegen Bestrahlung, weil die Strahlenwirkung durch Fehlen von molekularem Sauerstoff abgeschwächt ist (es entstehen weniger O2-Radikale, die indirekte Strahlenwirkung vermindert sich) und weil Hypoxie (über Hochregulierung von HIF) Schutzmechanismen der Zelle (z.B. verstärkte Invasion und Migration, „Ausweich-Mechanismus“) aktiviert werden. Hypoxie gilt als einer der wesentlichen Mechanismen für Strahlenresistenz (verminderte Strahlenwirkung bei Fehlen von Sauerstoff = Sauerstoff-Effekt). Man kann anhand theoretischer Berechnungen (belegt auch durch tierexperimentelle Studien) zeigen, dass bereits ein sehr kleiner Anteil hypoxischer Zellen mit reduzierter Strahlenempfindlichkeit die zur Tumorkontrolle erforderliche Strahlendosis sehr stark erhöht: die am wenigsten strahlenempfindliche Subpopulation entscheidet über die Heilung. → Klinische Bedeutung: Wenn ein Tumor schnell schrumpft, sollte man trotzdem keine relevanten Dosiskompromisse machen. Geschrumpft ist nämlich nur der strahlenempfindliche Anteil. → Klinische Bedeutung: Bei Chemotherapie schrumpfen Tumoren oft sehr schnell und weitgehend; dennoch erreicht man mit Chemotherapie fast nie (außer bei Lymphomen und seltenen anderen Erkrankungen) eine dauerhafte Heilung, weil praktisch immer resistente Zellen zurück bleiben. Selbst bei sehr chemotherapiesensiblen Erkrankungen (z.B. M.Hodgkin) kann die Bestrahlung die Heilungsaussichten verbessern. Die Resistenz der meisten soliden Tumoren gegenüber Chemotherapie beruht wahrscheinlich auf einer Resistenz der Tumorstammzellen4; diese Resistenz ist bei Bestrahlung nicht vorhanden oder zumindest deutlich geringer. Auch dann, wenn Chemotherapie nicht mehr wirkt, kann man mit Bestrahlung oft noch eine gute Remission des Tumors erreichen. 4 Überwindung von Strahlenresistenz ist möglich durch folgende Maßnahmen: o Höhere Strahlendosis: Das ist die einfachste Lösung, leider meistens (wegen Toleranz des gesunden Gewebes) limitiert. Grundsätzlich gilt aber, dass man bei größeren Tumoren oder Risikosituationen höhere Dosen verordnet, wenn möglich. o Akzelerierung: Verkürzen der Behandlungszeit ist eine gute Maßnahme gegen Repopulierung. Zu starke Akzelerierung erhöht aber das Risiko für Nebenwirkungen. Akzelerierung bringt vermutlich auch nichts, wenn Strahlenresistenz durch Hypoxie vorliegt. o Simultane Chemotherapie: gleichzeitige Chemotherapie (wenn gut abgestimmt auf die Strahlentherapie) kann die Strahlenwirkung in Tumorzellen überproportional stark verstärken („Radiosensibilisierung“); vermutlich werden auch hypoxische Zellen sensibilisiert (s. weiter unten). Seit einigen Jahren werden die dauerhaft teilungsfähigen Zellen in einem Tumor (sie machen nur einen Teil des gesamten Tumors aus) in der wissenschaftlichen Literatur als „Tumorstammzellen“ bezeichnet, da sie Ähnlichkeiten mit Stammzellen gesunder Gewebe haben. Ich persönlich finde die bereits früher von Strahlentherapeuten verwendete Bezeichnung „clonogene Zellen“ besser, weil das herausragende Merkmal dieser Tumorzellen ihre unbegrenzte Teilungsfähigkeit (Clonogenität) ist und nicht die zielgerichtete Differenzierungsmöglichkeit wie bei den Stammzellen des Normalgewebes. o Hyperthermie: Temperaturen von 42-43Grad über mehr als 30 Minuten sensibilisieren Tumorzellen gegen Bestrahlung. Allerdings ist das Verfahren sehr aufwendig, weil sich das Gewebe gegen Erhitzung schützt durch Hochregulation der Durchblutung. Hyperthermie mit strahlensensibilisierenden Temperaturen wird deshalb nur durch teure und komplizierte Großgeräte mit MikrowellenAntennen erreicht; solche Geräte sind nur an wenigen Standorten verfügbar (z.B. Strahlenklinik der Uni Erlangen)5. Die Wirkung der Hyperthermie ist vermutlich auch nicht besser als die einer simultanen Chemotherapie. o Spezifische Therapie gegen hypoxische Tumoranteile: früher hat man eine hyperbare Oxygenierung (HBO) probiert; der Patient wurde dabei vor der Bestrahlung in eine Sauerstoff-Druckkammer (heute z.B. noch verwendet bei Tauchunfällen) gebracht. HBO ist grundsätzlich wirksam, aber der Effekt ist gering, und diese Maßnahme ist aus technischen Gründen nicht mit modernen Bestrahlungsmethoden kompatibel. Heute werden vor allem drei Methoden in klinischen Forschungsprojekten erprobt, nämlich erstens eine PET-gesteuerte Dosiseskalation in hypoxischen Arealen, zweitens die Therapie mit high-LETStrahlung sowie drittens spezifische Medikamente gegen hypoxische Zellen („hypoxic cell sensitizer“). Zu erstens: unter Hypoxie werden membranöse Glukose-Transporter hochreguliert, hypoxische Areale sind daher gut im FDG-PET mit radioaktiver Glukose zu erkennen. Dort kann man mit modernen Bestrahlungsmethoden eine gezielt höhere Dosis applizieren, und das ist unproblematisch, weil dort keine normalen Zellen sein können. Damit könnte zukünftig eine gezielte Strahlentherapie hypoxischer Tumoranteile möglich werden; entsprechende Konzepte werden zurzeit weltweit untersucht. Zu zweitens: Bestrahlung mit schweren Teilchen, z.B. Kohlenstoffionen, hat eine höhere relative biologische Wirksamkeit (RBW) wegen eines höheren LET (linearer EnergieTransfer). Dadurch ist die Wirkung weitgehend unabhängig vom Sauerstoff-Effekt, d.h. in hypoxischen Arealen sind Ionen besser wirksam. Therapie mit Kohlenstoffionen ist aktuell aber nur verfügbar in Japan und in Deutschland am HIT in Heidelberger (HIT = Heidelberger Ionen-Therapie-Zentrum) sowie in Marburg. Zu drittens: Bestimmte Zytostatika wirken vor allem unter hypoxischen Bedingungen, z.B. Mitomycin C. In den 1970er und 80er Jahren wurden viele Studien mit solchen Substanzen durchgeführt, später aber wegen der sog. simultanen Radiochemotherapie verlassen, u.a. wegen der häufigen Nebenwirkungen dieser Substanzen. Neuerdings werden aber wieder Studien mit besser verträglichen Anti-Hypoxie-Zytostatika (z.B. Evofosfamid) durchgeführt; eindeutige Ergebnisse gibt es aber noch nicht. 5 Manche Reha-Kliniken, Praxen oder Privatkliniken bieten „Hyperthermie“ an; meistens werden dazu relativ preiswerte Geräte mit sog. kapazitiver Hyperthemie verwendet. Deren Wirksamkeit ist nach schulmedizinischem Kenntnisstand nicht eindeutig belegt. Außerdem erfolgt keine Messung der Gewebeerwärmung. An einigen wenigen Unikliniken wird Hyperthermie zur Strahlen- oder Chemosensibilisierung eingesetzt; man verwendet dabei sehr teure Geräte mit induktiver Hyperthermie (Mikrowellen) und non-invasiver MR-gestützter Temperaturmessung im hyperthermierten Gewebe. Hyperthermie zur Strahlenverstärkung ist in ausgewählten klinischen Situationen sinnvoll. Die Hyperthermie wird dann meistens 2x wöchentlich vor der jeweiligen Bestrahlung appliziert. Technische Grundlagen der (externen) Strahlentherapie Funktionsweise eines Linearbeschleunigers Elektronen werden in einem Hochfrequenzfeld auf nahezu Lichtgeschwindigkeit beschleunigt (es gelten dabei bereits die Gesetze der relativistischen Mechanik !), um 270 Grad umgelenkt und dann durch Aufprall auf ein spezielles Metall („Target“) abgebremst; dabei entsteht ultraharte Röntgenstrahlung (Bremsstrahlung, Photonenstrahlung, Megavoltstrahlung), 4 bis 18 MV (zum Vergleich: in einer Röntgenröhre im CT ca. 60 KV)6. Megavoltstrahlung hat eine bessere Tiefendosisverteilung und geringe Absorptionsunterschiede; sie ist also nicht zur Diagnostik, aber sehr gut zur Therapie geeignet. Die Elektronen können auch direkt als Strahlung verwendet werden; Elektronenstrahlung (Korpuskularstrahlung) hat aber nur eine begrenzte Eindringtiefe (im Gegensatz zur prinzipiell „unendlichen“ Reichweite von Photonenstrahlung) und wird nur selten (etwa 5% aller Patienten) verwendet, z.B. zur Behandlung von Hauttumoren oder anderen oberflächlich gelegenen Tumoren. Ein wichtiger Bestrandteil des Linearbeschleunigers ist der Multi-Leaf-Kollimator (MLC, Vielblatt-Lamellen-Kollimator). Er besteht aus etwa 120 kleinen Bleilamellen (etwa 1-3mm breit und 8cm hoch), die jede individuell durch einen Motor bewegt werden und dem Strahlungsfeld die jeweils richtige Kontur geben. Prinzip der externen (perkutanen) Bestrahlung mit Linearbeschleuniger: o Das Gerät (bzw. schwenkbarer Teil= Gantry) dreht sich um einen virtuellen Punkt im Raum (Isozentrum). o Das Isozentrum ist 1000mm vom Fokus (dem Ort der Strahlerzeugung im Gerät, punktförmig) entfernt o Das Isozentrum ist durch ein dreidimensionales Lasersysteme im Raum markiert. o Der Patient wird auf dem Bestrahlungstisch (der „Couch“) so gelagert, dass der geometrische Mittelpunkt des Zielvolumens (dieser Punkt liegt im Patienten und wurde vorher mittels 3D-Planung berechnet) im Isozentrum liegt. Der Fokus-HautAbstand (also Distanz zwischen dem Fokus im Gerät und dem Eintrittsort der Strahlung in den Patienten) ist also immer 1000mm minus Herdtiefe. o Das Gerät (bzw. der Strahl) „schaut“ immer auf den Mittelpunkt des Zielvolumens (im Planungsprogramm kann man das mit dem „Beam´s eye view“ veranschaulichen), auch wenn Gerät oder Tisch gedreht werden. o Das Zielvolumen wird von verschiedenen Seiten über mehrere Einstrahlrichtungen bestrahlt; man „schießt“ quasi mit den Röntgenstrahlen (Bremsstrahlung) durch den Körper (Eintrittsdosis und Austrittsdosis sind ähnlich, s. oben). Im Schnittpunkt der Strahlenfelder wird eine effektive (zellabtötende) Dosis erreicht. Beispiel: wenn man die Prostata wegen eines Prostatakarzinoms z.B. mit 8 einzelnen Stehfeldern aus unterschiedlichen Winkeln bestrahlt und alle Felder 6 Wer sich näher informieren will: es gibt ein sehr gutes Video der Firma Elekta zur Funktionsweise eines medizinischen Linearbeschleunigers (auf Englisch) auf YouTube. Titel: „How a linac works“ gleich wichtet und im Zielvolumen (der Prostata) eine Dosis von 2Gy appliziert, wird über jedes Feld ein Achtel der Dosis verabreicht (also 0,25Gy). Für das gesunde Gewebe in den Strahlenfeldern ist diese Dosis unschädlich (Zellen sterben erst ab 1Gy); nur dort, wo sich die acht Felder summieren, werden zellabtötende Strahlendosen erreicht. o An den Geräten befindet sich ein ausklappbarer Detektor, mit dem ein Bild erzeugt werden kann. Diese Bilder („portal imaging“, also ein Bild des jeweiligen Bestrahlungsfeldes) sind diagnostisch nicht zu gebrauchen und dienen lediglich der Positionierungskontrolle. Sonderausstattungen am Linearbeschleuniger: Cone-Beam-CT: Mit einer zusätzlichen ausklappbaren Röntgenröhre (angeordnet orthogonal, also 90Grad, zum Therapiestrahl)kann das Gerät vor der Bestrahlung ein CT (mit diagnostischer Bildqualität, da 60kV-Röntgenstrahlung verwendet wird) anfertigen. Dieses CT wird sofort mit dem Planungs-CT verglichen („Matching“), und Lageabweichungen des Zielgebietes werden berechnet, so dass der Tisch (Couch) nachpositioniert werden kann (dieser Prozess kann auch automatisch durch das Gerät erfolgen, allerdings muss jeder Schritt von einem Arzt oder ggf. der MTRA bestätigt werden). Cone-Beam-CT (CBCT) ermöglicht eine besonders genaue Positionierung des Patienten (z.B. bei IMRT oder Hochpräzisionsbestrahlungen). Stereotaktisches Positionierungs-Kontrollsystem (ExacTrac): Zwei Röntgenröhren im Boden (orthogonal angeordnet, ihr Zentralstrahl geht durch das Isozentrum) und Infrarotmarker am Patienten erlauben eine exakte Lagerungskontrolle vor und während der Strahlentherapie. Diese Systeme werden in Deutschland an ca. 20 Einrichtungen, überwiegend an Unikliniken (im Norden aktuell nur in Lübeck und am UKE Hamburg) eingesetzt. Gating-Systeme: das Gerät kann die Atemkurve des Patienten registrieren und (bei der Behandlung von atembeweglichen Tumoren) nur in definierten Atemphasen bestrahlen. Nachteil: da nur während eines Teils des Atemzyklus bestrahlt wird, dauert die Therapie deutlich länger. Eine andere Methode ist die Bestrahlung in kontrolliertem Atemstillstand („deep-inspiration-breath-hold“-Technik). Das funktioniert ähnlich wie bei einer Röntgen-Thorax-Aufnahme („tief einatmen und Luft anhalten“). Die Tiefe der Inspiration wird bei der Bestrahlung kontrolliert. Nachteil: nicht alle Patienten können die Luft ausreichend lang anhalten bzw. man muss die Bestrahlung mehrfach unterbrechen. Tracking-Systeme: Das Gerät kann Bewegungen des Zielgebietes erkennen und direkt verfolgen („tracking“) und den Strahl nachführen. Bisher ist dies in der Praxis nur möglich am CyberKnife (einem speziellen Bestrahlungsroboter). Die spezielle Tracking-Software kommt aus dem Institut für Robotik der Universität zu Lübeck (Prof. Dr. ing Achim Schweikard); das Gerät verfolgt nicht nur das Zielgebiet , sondern der Computer berechnet aus der Atemkurve eine Prädiktion über die Bewegung des Zielgebietes in den nächsten Millisekunden und überprüft das permanent (Ungenauigkeit 120msec). Ablauf einer täglichen Strahlenbehandlung: Patient kommt zum vorbestellten Termin, meistens ambulant (90%), Taxifahrten oder Krankentransporte zur nächstgelegenen Strahlentherapie-Einrichtungen werden von den Krankenkassen übernommen (sog. Serienbehandlung, gilt auch für Dialyse und Chemotherapie) Patient betritt Therapieraum, wird auf der Couch gelagert, Positionierung wird von den MTRAs überprüft. → Praktischer Hinweis: Für die exakte Positionierung des Patienten werden Lagerungshilfen verwenden (Knierolle, „Breast-board“, individuell angefertigte Masken im Kopf-Hals-Bereich). Der Patient soll bequem, aber reproduzierbar liegen. Der Tisch ist daher auch hart (weich wäre zu ungenau). Falls keine Maskensysteme verwendet werden, ist es nötig, Markierungen an der Haut anzubringen. Diese werden mit einem Pflaster beklebt (s. Anhang, Hautpflege) und sollen nicht entfernt werden. Personal verlässt den Raum (Therapieraum/Bunker ist während der Einschaltzeit des Linearbeschleunigers Sperrbereich, dort darf sich nur der Patient aufhalten; Patient wird mit Kamera und Mikrofon von außen aus dem Bedienraum überwacht), Strahlentherapie beginnt. Dauer etwa 5 Minuten, davon 1-2 Minuten Strahlzeit. Patient wird von der Couch geholt und verlässt die Abteilung. Gesamtdauer: ca. 10 Minuten pro Tag bei einfachen Bestrahlungen, ca. 1h bei komplizierten Behandlungen (Ganzkörperbestrahlung, Hochpräzisionsbestrahlung). Eigenschaften von Photonenstrahlung Die Photonenstrahlung (ultraharte Bremsstrahlung), die aus dem Gerät kommt, ist durch folgende Eigenschaften charakterisiert: o Aufbaueffekt: Das Dosismaximum wird erst in 2-3cm Gewebetiefe erreicht. Dadurch wird die Haut geschont. → Klinische Bedeutung: bei tief gelegenen Zielvolumina (z.B. Prostata, Lunge, Darm, Zervix, also bei den meisten Tumoren) ist die Hautdosis bei üblichen Bestrahlungstechniken (Mehrfelder-Techniken) so niedrig, dass eine Hautreaktion gar nicht auftreten kann (im Gegensatz zu früher) o Günstiger (flacher) Verlauf der Tiefendosiskurve: die Dosis fällt im Gegensatz zu diagnostischer Röntgenstrahlung nur wenig ab. Die Austrittsdosis ist meistens ebenso hoch wie (oder höher als) die Eintrittsdosis. Dadurch können auch tief im Körper gelegene Zielgebiet gut erreicht werden. → Klinische Bedeutung: eine Hautreaktion kann z.B. bei hochdosierter Bestrahlung von ventral auch am Rücken auftreten, wenn nur mit wenigen Feldern (z.B. einem einzelnen Stehfeld von vorn) bestrahlt wird. o Geringe Absorptionsunterschiede zwischen den Geweben: Knochen wird ähnlich wie Weichgewebe durchdrungen; dadurch können auch Tumoren, die hinter einem Knochen liegen, gut behandelt werden. → Klinische Bedeutung: diese Therapiestrahlung ist ungeeignet für diagnostische Zwecke. Kontrollaufnahmen mit Therapiestrahlung dienen lediglich zur Positionierungskontrolle. Falls eine Beurteilung der Tumorgröße während der Bestrahlung erforderlich ist, sind diagnostische Methoden (z.B. CT. MRT) notwendig. Alternativ zur Photonenstrahlung kann auch Elektronenstrahlung genutzt werden. Diese Korpuskularstrahlung hat eine begrenzte Eindringtiefe (1cm bis ca. 4cm) 7 und wird für die Behandlung von oberflächlichen Zielgebieten (z.B. Hauttumoren) verwendet. Bei Einsatz von Elektronenstrahlen müssen spezielle Tuben verwendet werden, um das Strahlenfeld in der Nähe des Patienten exakt einzugrenzen; dazu können auch Bleiabschirmungen (ca. 1cm Dicke) verwendet werden (nicht erlaubt bei Photonenstrahlung; dadurch würde der Aufbaueffekt verloren gehen!). Weitere in der Strahlentherapie benutzte spezifische Geräte sind: 7 CT-Simulator: speziell ausgerüstetes Computertomografie-Gerät für Bestrahlungsplanung. Vor allem sind Lasersysteme erforderlich, um die Positionierung des Patienten überprüfen und markieren zu können. Konventioneller Simulator: spezielles Durchleuchtungsgerät, das in seinen geometrischen Abmessungen einem Linearbeschleuniger entspricht. Man kann damit eine Bestrahlung unter Durchleuchtungsbedingungen (guter Bildkontrast) simulieren. Früher war das ein besonders wichtiges Gerät, weil die Positionierungskontrolle am Linearbeschleuniger schwierig war. Durch Verbesserung der Bildgebung am Linearbeschleuniger sind diese Geräte nahezu überflüssig geworden. Brachytherapie-Geräte (Afterloader): Diese Geräte dienen zur Kontaktbestrahlung von innen (intrakavitäre oder interstitielle Brachytherapie). An zwei deutschen Universitäten in Deutschland gibt es eine spezielle Professur für Brachytherapie, nämlich in Erlangen und in Lübeck (Prof. Kovacs). Die effektive Reichweite von Elektronen im Gewebe (in cm) kann man „über den Daumen“ berechnen, wenn man die Energie (MV- bzw. MeV-Zahl) durch 3 teilt, also effektive Reichweite 2cm bei 6MeV-Elektronen. Photonenstrahlen haben demgegenüber ja eine quasi „unendliche“ Reichweite. Klinisch sinnvoll ist der Einsatz von Elektronen nur, wenn das Zielgebiet in der Haut liegt und eine Tiefenausdehnung von maximal 3-4cm hat. Grundwissen über Bestrahlungsplanung Die Bestrahlungsplanung ist ein ganz wesentlicher Teil der Strahlenbehandlung und läuft in folgenden Schritten ab: Erstellen eines Behandlungsplanes Der Arzt legt fest, was bestrahlt werden soll (Zielvolumina), welche Dosis mit welcher Fraktionierung appliziert werden soll und welche zusätzlichen Maßnahmen (z.B. Chemotherapie, etc) erforderlich sind. Der Behandlungsplan muss auch die Stellung der Bestrahlung im multimodalen Therapiekonzept berücksichtigen (z.B. soll evtl. später noch operiert werden, etc), weitere Diagnostik, antizipierte Planänderungen etc. Akquisition eines 3D-Datensatzes Im Regelfall wird ein Planungs-CT der Körperregion, die bestrahlt werden soll, angefertigt. Spezielle Markierungen dienen der reproduzierbaren Lagerung. Dafür wird ein spezielles CT-gerät (CT-Simulator) verwendet. Konturierung von Zielvolumina und Risikoorganen Das Zielvolumen (oder meistens die Zielvolumina) werden im 3D-Datensatz konturiert. Bei der typischen Nachbestrahlung nach brusterhaltender Operation eines Mammakarzinoms werden meistens mindestens 2 Zielvolumina festgelegt, nämlich einmal die ganze Brust (ggf. mit regionalen Lymphknoten) und zweitens das ehemalige Tumorgebiet bzw. die OP-Region; dort wird nämlich eine etwas höhere Strahlendosis („Boost“) appliziert. Als ein Zielvolumen gilt dabei ein zusammenhängendes Volumen, das mit einer bestimmten Einzeldosis und Fraktionierung bis zu einer bestimmten Gesamtdosis bestrahlt wird. Wenn also zwei Knochenmetastasen bestrahlt werden (z.B. eine in der Hüfte, die andere in der Wirbelsäule) sind das zwei Zielvolumina. Zielvolumen-Definitionen: o GTV („gross tumor volume“): der makroskopisch sichtbare Tumor. Nach Operation gibt es kein GTV, da der Tumor meistens vollständig entfernt ist. o CTV („clinical target volume“): das ist das Gebiet, das mit der notwendigen Dosis bestrahlt werden soll. Es enthält den Tumor (wenn vorhanden, also das GTV) sowie die Umgebung, wo Tumorreste oder mikroskopische Anteile vermutet werden. Nach einer brusterhaltenden Operation ist der verbliebene Drüsenkörper der Brust (dort könnten noch Tumorzellen sein) sowie die Haut im OP-Zugangsweg das CTV. Es können mehrere CTVs vorhanden sein (z.B. bei Nachbestrahlung nach brusterhaltender Operation ist das CTV zunächst die ganze Brust, danach ist ein weiteres CTV das Boostvolumen, also das OP-Geiet, wo eine höhere Dosis appliziert werden soll. o PTV (planning target volume): das PTV ist größer als das CTV und schließt Lagerungsungenauigkeiten und Organbeweglichkeiten mit ein. Das PTV ist also das Gebiet, das bestrahlt wird, damit im CTV die richtige Dosis ankommt. Der Sicherheitsabstand zwischen CTV und PTV beträgt (abhängig von Lage des Organs) meistens 5-10mm. Dosisberechnung Speziell ausgebildete Medizinphysiker und Ingenieure (sog. Medizinphysik-Experten, MPE) erstellen einen Bestrahlungsplan und berechnen Einstrahlwinkel, Größe der Bestrahlungsfelder etc. Plan-Evaluation Arzt und MPE gemeinsam bewerten den Bestrahlungsplan (und versuchen ggf. ihn zu optimieren). Man prüft die Dosisverteilung (Isodosenplan), die Auslastung des PTV und CTV und die an den gesunden Organen (sog. Risikoorganen, z.B. Rückenmark, Lunge, Herz) applizierte Dosis. Im Dosis-Volumen-Histogramm (DVH) kann man die Dosis im CTV bzw. PTV und den Risikoorganen bewerten und verschiedene Pläne vergleichen. Für jedes Risikoorgan sind Toleranzdosen bekannt; wenn diese nicht überschritten werden, sind Langzeit-Nebenwirkungen der Strahlentherapie (sog. Spätfolgen, s.u.) praktisch ausgeschlossen (z.B. RM-Dosismaximum <50Gy). Damit die Toleranzdosen von vorneherein bei der Bestrahlungsplanung berücksichtigt werden, kann man dem Berechnungsprogramm bestimmte Grenzwerte vorgeben (sog. „dose constraints“; Voraussetzung ist aber eine „inverse Planung“ bei IMRT, s.u.). Qualitätskontrolle Alle Pläne werden mehrfach kontrolliert. Besonders komplizierte Bestrahlungen werden durch bestimmte Qualitätssicherungsmaßnahmen vor Beginn der Bestrahlung überprüft (z.B. Dosismessungen am Phantom). Ersteinstellung Bei der ersten Bestrahlung werden Lagerung des Patienten und sämtliche Bestrahlungsfelder überprüft (portal imaging, Cone-beam-CT). Spezielle Bestrahlungstechniken: Stehfeldbestrahlung Einfachste Form der Strahlentherapie, bei der nur ein einzelnes Bestrahlungs-Feld oder Gegenfelder verwendet werden. Diese einfachen Methoden können schnell berechnet werden und sind auch am Bestrahlungsgerät schnell zu applizieren. Sie eignen sich für einfache Zielvolumina bei Patienten, die nur kurz ruhig liegen können oder immobil sind (z.B. palliative Bestrahlung einer Knochenmetastase an den Extremitäten). 3D-Konformationsbestrahlung (3D-CRT) Bisher die Standardbehandlung. Das Zielgebiet wird in einem 3D-Datensatz konturiert. Meistens werden zahlreiche Bestrahlungsfelder verwendet, um eine optimale homogene Dosisverteilung zu erreichen. Diese Technik ist heute einfach und für viele Fälle ideal. Grenzen ergeben sich aber z.B. bei konkav geformten Zielvolumina. IMRT (intensitäts-modulierte Radiotherapie) Eine seit etwa 2005 zunehmend eingesetzte Methode, bei der die Intensität der Bestrahlung in den einzelnen Bestrahlungsfeldern während der Bestrahlung des Feldes verändert wird (Physiker bezeichnen das als „Fluenzmodulation“). Dadurch können sehr präzise Dosisverteilungen auch bei komplex konfigurierten Zielvolumina erreicht werden. Zur Berechnung der IMRT wird eine „inverse Planung“ angewendet, d.h. die Schritte der Bestrahlungsplanung werden umgekehrt: Bei der 3D-CRT werden nach Konturierung des Zielvolumens zunächst mögliche Einstrahlfelder festgelegt, dann wird die Dosis berechnet und ggf. optimiert. Bei der inversen Planung für IMRT werden nach Konturierung des Zielvolumens Rahmenbedingungen für die spätere Dosisverteilung („dose constraints“) festgelegt, und man überlässt dem Computer die Auswahl von Einstrahlfeldern. Das Planungsprogramm optimiert dann in einem iterativen Prozess die Dosisverteilung; da dies sehr hohe Rechenleistungen erfordert, ist dieses Berechnungsverfahren erst seit etwa 10 Jahren in der Routine verfügbar. Vorteile von IMRT gegenüber 3D-CRT: o Bessere Dosisverteilung bei konkav geformten Zielvolumina o Bessere Dosisverteilung bei großen Zielvolumina in anatomisch komplizierten Regionen (z.B. an der Schädelbasis, im Abdomen) o Möglichkeit der gezielten Dosisinhomogenität: Innerhalb eines Zielvolumens können bestimmte Subvolumina mit unterschiedlichen Dosen bestrahlt werden. Ein Boost auf ein kleineres Volumen kann während der Bestrahlung des größeren Volumens appliziert werden („simultan integrierter Boost“). Nachteile von IMRT gegenüber 3D-CRT: o Mehr Einstrahlfelder mit jeweils niedrigerer Dosis; dadurch wird ein größeres Volumen mit sehr niedriger Dosis belastet. Nebenwirkungen entstehen dadurch nicht (da die jeweiligen Schwellendosen für Nebenwirkungen nicht überschritten werden), aber das Risiko für Sekundärmalignome (dafür gibt es keine Schwelle nach unten) kann zunehmen. IMRT sollte deshalb bei Kindern und jüngeren Patienten (nur bei denen ist das relevant) nicht unkritisch eingesetzt werden. o Längere Bestrahlungszeiten, stärkere Dosisgradienten: IMRT dauerte bisher etwas länger als eine übliche 3D-CRT und gleichzeitig ist die Positionierungsgenauigkeit wichtiger als bei 3D-CRT. Daher müssen die Patienten länger als üblich ruhig gelagert werden können. Dieser Nachteil entfällt aber, da zunehmend neuere und schnellere Techniken („VMAT“, s.u.) eingesetzt werden. IGRT („image guided radiotherapy“, bildgeführte Strahlentherapie) Durch verbesserte Bildgebung an den Linearbeschleunigern (v.a. Cone-beam CT) kann man die Positionierungsgenauigkeit bei der Bestrahlung verbessern. Der Sicherheitsabstand zwischen PTV und CTV (s.o.) kann verringert werden, dadurch weniger Strahlenbelastung des gesunden Gewebes. Stereotaktische Radiotherapie Die Positionierung wird durch ein am Patienten angebrachtes Koordinatensystem (Stereotaxie-System, wie bei einer stereotaktischen Biopsie) oder durch stereotaktisch angeordnete Röntgenröhren (z.B. ExacTrac-System) kontrolliert. Dies ist vor allem bei Hochpräzisionsbestrahlungen (Radiochirurgie, s.u.) wichtig. Dynamische Rotations-IMRT („VMAT = volumetric modulated arc therapy“) Weiterentwicklung und Sonderform der IMRT, bei der das Gerät um den Patienten rotiert; gleichzeitig werden Felder (Konfiguration des Multi-Leaf-Kollimators) und Dosisleistung kontinuierlich verändert. Diese Methode ist seit etwa 2010 an modernen Geräten verfügbar. Man erreicht sehr gute Dosisverteilungen, und die Bestrahlung geht sehr schnell (ebenso schnell wie eine 3D-CRT oder sogar schneller). VMAT wird also zukünftig die Standard-Methode in der Strahlentherapie werden. In Lübeck verwenden wir Geräte der Fa. Varian, die eine besonders schnelle VMAT ermöglichen („RapidArc“); die Rotationsbestrahlung um den Patienten dauert ca. 90 Sekunden. Zukünftig: Adaptive Strahlentherapie Das Ziel besteht darin, die während jeder Bestrahlungssitzung stattfindenden Organbewegungen und –deformierungen z.B durch Atmung bei Bestrahlungen im Thorax- und Abdomen oder durch Schluckbewegungen während einer Bestrahlung im HNO-Bereich zu berücksichtigen. Wenn das gelingen sollte, würde das die Verträglichkeit der Bestrahlung sicher weiter verbessern. Erste Ansätze sind bereits realisiert, z.B. nachträgliche 4D-Kalkulation von Dosisverteilungen unter Berücksichtigung der während einer Bestrahlung gemessenen Organbewegungen (die Institute für Robotik und Medizinische Informatik der Uni Lübeck sind auf diesem Gebiet besonders ausgewiesen). Das längerfristige Ziel besteht darin, eine Echtzeit-Kontrolle der applizierten Dosis unter Berücksichtigung der während jeder Bestrahlungssitzung stattfindenden Organbewegungen und -deformierungen zu ermitteln und die Bestrahlungsdosis in Echtzeit anzupassen, dazu sind schnelle Bildgebung während der Bestrahlung und enorme Rechenleistungen zur kontinuierlichen Dosisoptimierung erforderlich. Die Vision ist, dass bei jeder Bestrahlung ein jeweils optimaler Bestrahlungsplan appliziert wird („plan of the day“); vielleicht können Bestrahlungsplanung und Bestrahlung selbst in einen Termin erfolgen. Ein erster Schritt auf dem Weg zur Realisierung dieser Vision ist der Einsatz von schneller MR-Bildgebung am Bestrahlungsgerät. Im Herbst 2014 wurde erstmals in USA ein Patient an einem dafür gesondert ausgerüsteten Bestrahlungsgerät behandelt; das entsprechende Gerät kann aktuell während einer Bestrahlung 18 MR-Bilder pro Sekunde vom Zielgebiet der Bestrahlung registrieren und ermöglicht eine Echtzeit-Kontrolle der applizierten Dosis unter Berücksichtigung der während jeder Bestrahlungssitzung stattfindenden Organbewegungen und -deformierungen. Simultane Radiochemotherapie Hintergrund: Normalerweise setzt man Chemotherapie ein, um den ganzen Körper zu erfassen und Mikrometastasen zu zerstören (adjuvante Chemotherapie), oder die Chemotherapie erfolgt als palliative Maßnahme gegen multiple Metastasen. Unter bestimmten Bedingungen kann die Chemotherapie aber auch genutzt werden, um die Strahlenwirkung in Tumorzellen zu verstärken („Strahlensensibilisierung“, die Wirkungsverstärkung im Tumor muss natürlich größer sein als im Normalgewebe). Bei entsprechender Kombination können überadditive (synergistische) Effekte resultieren („1+1=2,5“). Dazu müssen bestimmte Medikamente während der Strahlentherapie nach definiertem Schema verabreicht werden. Historische Entwicklung: Entdeckt wurde die Strahlensensibilisierung Mitte der 1980er Jahre eher zufällig beim Analkarzinom. Ferner zeigte die Subgruppen-Analyse der NSABPB06-Studie, dass eine Nachbestrahlung nach brusterhaltender Operation effektiver war bei Patientinnen, die eine Chemotherapie erhalten hatten. In den Folgejahren wurde die Kombinationswirkung systematisch erforscht. Strahlenbiologie: Die molekularen Mechanismen der Strahlensensibilisierung sind nicht vollständig bekannt. Überwiegend wird durch die Kombinationswirkung von Bestrahlung und den jeweiligen Medikamenten die zytotoxische Wirkung durch „Überforderung“ der DNS-Reparaturenzyme (z.B. bei Cisplatin) oder unterschiedliche Angriffspunkte (z.B. Pacliatxel) erreicht. Überadditive Wirkungen erfordern eine simultane Therapie (Chemotherapie während der Strahlentherapie-Serie) und spezielle ChemotherapieRegime, die sich an der Strahlensensibilisierung (in vitro bewiesen, klinisch nicht eindeutig belegt) orientieren. Die Strahlensensibilisierung wird erreicht (Beispiele): o bei Cisplatin nur, wenn Cisplatin kurz vor der Bestrahlung verabreicht wird o bei 5-FU nur, wenn 5-FU über lange Zeit (24h) nach der Bestrahlung verabreicht wird Dosierungen: Die Dosierungen sind also anders als bei alleiniger Chemotherapie. Meistens werden nur ein oder zwei Zytostatika in geringeren Dosen, dafür öfter eingesetzt (Ziel: möglichst viele Tage mit Strahlensensibilisierung). Die Nebenwirkungen sind daher geringer als bei alleiniger Chemotherapie. Viele Toxizitäten von Zytostatika beruhen nämlich auf der Peak-Konzentration im Serum (z.B. Ototoxizität bei Cisplatin) oder kumulativen Gesamtdosis (z.B. Neurotoxizität/Polyneuropathie). Diese Toxizitäten treten bei alleiniger Chemotherapie oft auf, sind bei simultaner Radiochemotherapie aber sehr selten. Wichtige und häufig eingesetzte Medikamente sind: o Cisplatin: sehr guter Strahlensensibilisator bei Plattenepithelkarzinomen im HNOBereich, der Lunge und Zervixkarzinomen. Typische Dosierung 5 Tage mit jeweils 25mg/m² in der ersten und fünften Bestrahlungswoche. Nebenwirkungen/Kontraindikationen: Nephrotoxizität (kann durch Spülprogramm vermieden werden), Ototoxizität, bei hohen Gesamtdosen Neurotoxizität (Polyneuropathie) o 5-FU: Dauerinfusion (am besten über Port-System) mit 1000mg/m²/Tag über 120 Stunden (also eine Woche lang) oder kontinuielrihc über 4 bis 6 Wochen mit 225mg/m² täglich. Einsatz bei gastrointestinalen Tumoren (v.a. Rektumkarzinom, Analkarzinom). Nebenwirkungen/Kontraindikationen: Mukositis (Schleimhautentzündungen), gelegentlich kardiale Nebenwirkungen (Angina-pectorisSymptomatik). Selten extrem heftige und potentiell letale Reaktion bei Patienten mit DPD-Mangel (dieses Enzym baut das Medikament ab). Als Ersatz für 5-FU-Dauerinfusion wird zunehmend Capecitabin (Xeloda) verwendet. Capecitabin ist ein Prodrug, das oral als Tablette gegeben wird (Vorteil für den Patienten) und im Körper in aktive Metaboliten umgewandelt wird und dann bei 2x täglicher Einnahme eine Dauerinfusion von 5-FU imitiert. o Mitoymcin C: Einsatz vor allem bei Analkarzinomen (Standard!, zusammen mit 5FU) oder HNO-Tumoren und Ösophaguskarzinomen. Dosis 10-15mg/m² als Injektion. Man vermutet, dass Mitomycin C besonders gut gegen hypoxische Zellen wirkt. Nebenwirkungen: lang anhaltende Leuko- und Thrombopenie, selten Lungenreaktionen. o Paclitaxel (Taxol®): „Spindelgift“ (behindert die Ausbildung der Mitosespindel), langanhalte Strahlensensibilisierung in vitro. Wird wegen der sehr guten Verträglichkeit oft als Ersatz für Cisplatin verwendet. o Cetuximab (Erbitux®): Antikörper gegen den EGF-Rezeptor, der vor allem auf Plattenepithelkarzinomen im HNO-Bereich exprimiert wird. Wirkt in Kombination mit Bestrahlung ähnlich sensibilisierend wie Cisplatin. Typische Nebenwirkung akne-ähnlicher Hautauschlag (ist aber auch ein indirektes Zeichen für Wirksamkeit, d.h. bei Patienten mit dieser AK-spezifischen Nebenwirkung ist die Wirkung der Therapie besser) Nebenwirkungen: Es entstehen zusätzliche (meistens vorübergehende Nebenwirkungen) durch die zusätzliche Chemotherapie. manche Nebenwirkungen der Bestrahlung können verstärkt werden (z.B. Mukositis). Wichtig: Das Risiko für radiogene Spätfolgen wird NICHT erhöht. Etablierte Indikationen für simultane Radiochemotherapie: Plattenepithelkarzinome im HNO-Bereich, definitive und adjuvante Radiochemotherapie Ösophaguskarzinome, präoperative und definitive Radiochemotherapie Nicht-kleinzellige Bronchialkarzinome: präoperative und definitive Radiochemotherapie Zervixkarzinome, prä- und postoperative und definitive Radiochemotherapie Rektumkarzinom, prä- und postoperative Radiochemotherapie Analkarzinom, definitive Radiochemotherapie Glioblastom, definitive und adjuvante Radiochemotherapie Magenkarzinom: adjuvante Radiochemotherapie Akute und chronische Strahlenreaktionen Akute Strahlenfolgen akute Nebenwirkungen treten während oder kurz nach einer Strahlentherapie-Serie an schnell proliferierenden gesunden Geweben (also Haut und Schleimhäuten) auf, z.B. Erythem und Dermatitis im Bestrahlungsfeld, Mukositis (Schleimhautentzündung) im Mund und Rachen bei Bestrahlung im HNO-Bereich, Ösophagitis mit Schluckbeschwerden bei Thoraxbestrahlungen, Übelkeit bei Oberbauchbestrahlung, radiogene Enteritis/Proktitis/Zystitis bei Beckenbestrahlungen, Hirnödem bei Bestrahlung großer Hirnvolumina (selten), hämatologische Nebenwirkungen mit Leukound Thrombopenie (selten, nur bei großvolumiger Bestrahlung des Knochenmarks) bei einer mehrwöchigen Bestrahlung beginnen diese Nebenwirkungen erst ab der 3. bis 4. Bestrahlungswoche, erreichen den Höhepunkt gegen Ende der Bestrahlung und klingen dann spontan innerhalb von 2-4 Wochen ab (die akuten Nebenwirkungen dauern so lange wie die Bestrahlung, nur 2-3 Wochen zeitlich nach hinten versetzt). Nebenwirkungen treten nur auf, wenn Haut oder Schleimhäute mitbestrahlt werden und treten auch nur im Zielvolumen oder der Nähe des Zielvolumens auf. Sie lassen sich meistens nicht vermeiden Akute Nebenwirkungen können sehr unangenehm sein für den Patienten, sind aber insofern harmlos, als sie praktisch immer vollständig abheilen. Häufigkeiten: bei ein Drittel der Patienten keine akuten Nebenwirkungen, bei einem Drittel leichte (nicht behandlungsbedürftig), bei einem Drittel schwere akute Nebenwirkungen. Therapie: symptomatisch, Supportivtherapie. Keine spezifische Therapie bekannt (außer Verringerung der Bestrahlungsintensität, das ist aber meist nicht sinnvoll). Bei schweren Verläufen kann eine Pause der Bestrahlung sinnvoll sein. Sonderfall: subakute Nebenwirkungen. Sie treten Wochen nach der Strahlentherapie auf. Beispiele: o L´hermitte-Syndrom bei Rückenmarkbestrahlung (Kribbelparästhesien bei Kopfbeugung nach vorn und Dehnung des RM; bildet sich innerhalb von Wochen spontan zurück) o Pneumonitis (subakute Lungenreaktion, geht langsam in Fibrose über, sympt. Therapie mit Cortison) Chronische Strahlenfolgen (Spätfolgen) Gefährlicher als akute Nebenwirkungen sind chronische Strahlenfolgen. Sie treten (Definition) ab 90 Tage nach der Strahlentherapie auf und sind meistens irreversibel. Ursache sind dauerhafte Gewebeschäden durch Fibrosierung oder mangelnde Durchblutung Typische chronische Strahlenfolgen sind z.B. Unterhautfibrose, chronische Proktitis nach Bestrahlung wegen Prostata-Ca, Lympödem nach OP und Strahlentherapie der Leistenlymphknoten (oft Kombinationsschaden aus OP und Bestrahlung), Urethrastenose nach Bestrahlung der Prostata, etc. Therapie: oft ist eine spezifische Therapie nicht möglich, manchmal operative Therapie (z.B. Resektion eines fibrotischen Darmabschnitts). Häufigkeit: selten ! Spätfolgen können meistens vermieden werden, wenn die Toleranzdosen der jeweiligen Organe bei der Bestrahlungsplanung berücksichtigt werden (das ist fast immer möglich). Beispiele: o Wenn bei Mammakarzinom mit klinisch unauffälliger Axilla (sog. Stadium cN0) eine Therapie der axillären Lymphknoten erforderlich ist, ist die Bestrahlung ebenso effektiv wie eine OP, aber die schonendere Methode. Lymphödeme sind nach OP häufiger als nach Bestrahlung (aktuelle Daten der AMAROS-Studie) o Beim low-risk-Prostatakarzinom ist die Brachytherapie die effektivste Therapie. Sie ist gleichzeitig auch die schonendste Therapie mit weniger Risiken und besserer Lebensqualität im Vergleich zur Operation. o Beim (nichtkleinzelligen) Bronchialkarzinom Stadium T1 N0 M0 sind Operation (Segmentresektion, Lobektomie) und Hochpräzisionsbestrahlung äquieffektiv, aber die Bestrahlung ist schonender (geringerer Einfluss auf Lungenfunktion). Bei Patienten mit schlechter Lungenfunktion ist die Bestrahlung die bessere Therapie. o Bei zahlreichen Tumoren (Zungengrund/Kehlkopf, Harnblase, Weichteiltumoren der Extremitäten) kann durch die Bestrahlung ein Organ- und Funktionserhalt erreicht werden mit besserer Lebensqualität als nach Radikaloperation bei gleichguter Heilungsrate. o etc., etc. Sonderfall: Wachstumsstörungen bei Kindern Das bei Kindern hochdosiert bestrahlte Gewebe (vor allem Muskel und Knochen) wächst langsamer. Je jünger das Kind bei der Bestrahlung, je größer das Zielvolumen und je höher die Dosis, desto ausgeprägter ist das spätere Wachstumsdefizit. Sonderfall: Sekundärmalignome Durch Bestrahlung (und auch durch Chemotherapie) kann selbst ein Malignom mitausgelöst werden (nach Chemotherapie eher Lymphome und Leukämien, nach Bestrahlung eher solide Tumoren). Es handelt sich um eine relative Risikoerhöhung, d.h. das spontane Risiko wird in dem bestrahlten Organ u einen bestimmten Prozentsatz erhöht. Das Risiko nimmt über Jahre zu und ist klinisch relevant (detektierbar) meistens erst nach mehr als 15 Jahren. Extrem hohes Risiko (absolut >25% für die verbleibende Lebenszeit): o Patienten mit genetischen Defekten, z.B. bilaterales Retinoblastom. Sehr selten!! Hohes Risiko (absolut >10% für die verbleibende Lebenszeit): o junge Mädchen mit Thoraxbestrahlung in der Pubertät und nachfolgendem Risiko für Mammakarzinom (z.B. frühere Großfeldbestrahlung bei M.Hodgkin, heute nicht mehr üblich). Die sich entwickelnde Brustdrüse ist sehr strahlenempfindlich, und Brustkrebs ist die häufigste Tumorerkrankung der Frau; diese Kombination ist gefährlich. o Kinder und Jugendliche mit großvolumigen Bestrahlungen (daher wenn möglich vermeiden) Mäßiges Risiko (absolut ca. 5 bis 10% für die verbleibende Lebenszeit): o „Jüngere“ Patienten (unter 50 Jahre) und intensiver onkologischer Behandlung Kleines Risiko (absolut ca. 1-5% für die verbleibende Lebenszeit): o Der weit überwiegende Anteil aller Patienten Vernachlässigbares Risiko (<1% für die verbleibende Lebenszeit): o alte Patienten o Strahlenbehandlung von gutartigen Erkrankungen Die Therapie und Prognose der Sekundärmalignome sind weitgehend gleich wie die der Primärtumoren, also Therapie mit Operation/Bestrahlung/Chemotherapie, Heilungsrate pauschal ähnlich wie Durchschnitt aller Krebserkrankungen. Das Risiko für Sekundärmalignome spielt bei der Indikationsstellung (also der Entscheidung, ob eine Bestrahlung erfolgen soll oder nicht) meistens keine Rolle, weil die kurz- und mittelfristigen Vorteile der Bestrahlung weit größer sind als das kleine und spät sich manifestierende Risiko durch Sekundärmalignome. NEU: Das Risiko für radiogene Sekundärmalignome wurde wahrscheinlich bisher überschätzt. Kürzlich wurden erstmals Langzeit-Daten aus randomisierten Studien ausgewertet; in diesen Studien war die Wirksamkeit einer Radiotherapie geprüft worden. Das Studiendesign war jeweils Operation + Radiotherapie. Die Häufigkeit von Zweitmalignomen (also neuen Tumoren) war bei Patienten mit und ohne Radiotherapie absolut identisch8. Das Risiko für radiogene Tumoren ist also bei den meisten Patienten, die mit modernen Therapiemethoden behandelt werden, sicher sehr gering. Das gilt nicht für Kinder und junge Erwachsene; für diese Gruppen gilt weiterhin, dass die Indikation zur Bestrahlung kritisch gestellt werden muss und dass, falls eine Bestrahlung erforderlich ist, die Strahlendosis am gesunden Gewebe so niedrig wie möglich sein sollte. 8 Wiltink LM et al. No increased risk of second cancer after radiotherapy in patients treated for rectal or endometrial cancer in the randomized TME, PORTEC-1, and PORTEC-2 trials. J Clin Oncol 2014 Hochpräzisionsbestrahlung („Strahlenchirurgie“) Grundprinzip und historische Entwicklung Normalerweise bestrahlt man nicht nur den sichtbaren Tumor, sondern auch die Umgebung wegen der dort vorhandenen mikroskopischen Tumoranteile (z.B. Nachbestrahlung der gesunden Brust nach brusterhaltender Operation wegen Mamma-Ca). Wenn man nur den Tumor bestrahlt und daher auf die gesunde Umgebung keine Rücksicht nehmen muss, kann man die Bestrahlung in einer einzigen Fraktion (quasi als Ersatz für die OP) applizieren. „Erfunden“ wurde diese Art der Strahlentherapie von dem schwedischen Neurochirurgen Lars Leksell, der nach einer Alternative zur OP bei gutartigen Hirntumoren (z.B. Meningeom, Akustikusneurinom) an operativ unzugänglichen Lokalisationen oder bei funktionell inoperablen Patienten suchte. Er bestrahlte nur den Tumor (gutartige Tumoren infiltrieren ja auch nicht in die Umgebung) und bezeichnete diese Art der Strahlentherapie als „Strahlenchirurgie“ (Bestrahlung als Alternative zur OP). Er entwickelte auch ein spezielles Gerät für diese Präzisionsbestrahlung, das sog. „Gamma-Knife“ (mit 201 Telekobalt-Quellen, der Name des Geräts, also Strahlenmesser, verdeutlicht das). Später wurde die Indikation auf andere gut abgegrenzte bösartige Tumoren ausgedehnt. Die Bezeichnung „Radiochirurgie“ (englisch: Radiosurgery) ist aus heutiger Sicht zwar unglücklich und gelegentlich irreführend (hat ja nichts mit Chirurgie zu tun), hat sich aber international etabliert. Voraussetzungen Radiochirurgie ist bei einem Teil der aktuell behandelten Patienten (ca. 5-10%, steigender Anteil) sinnvoll. Folgende Voraussetzungen müssen erfüllt sein: o Der Tumor muss gut abgegrenzt wachsen, z.B. gutartige Hirntumoren, Hirnmetastasen und Lungen-/Lebermetastasen (sie verdrängen das gesunde Gewebe), kleine gut abgegrenzte Bronchialkarzinome o Das Zielvolumen hat einen maximalen Durchmesser von etwa 3cm. Dann kann man durch Bestrahlung mit sehr vielen Einstrahlfeldern eine sehr gute Dosiskonzentration mit steilem Dosisabfall zur Umgebung erreichen. Bei größeren Volumina nimmt der Dosisgradient ab. Technik/spezielle Geräte o Gammaknife: erstes Spezialgerät mit Telekobaltquellen, aus heutiger Sicht sehr einfache (aber robuste) Technik, wird zukünftig eher seltener eingesetzt o Speziell ausgerüstete Linearbeschleuniger: im Prinzip können alle modernen Linearbeschleuniger für Hochpräzisionsbestrahlungen (Radiochirurgie) umgerüstet werden. Man benötigt spezielle Multi-Leaf-Kollimatoren, die besonders kleine Bestrahlungsfelder erzeugen können (Mikro-MLC) sowie spezielle Positionierungssysteme (z.B. Fixationssysteme für den Patienten, ExacTrac-System am Gerät). In Lübeck verwenden wir einen „normalen“ Linearbeschleuniger, der mit entsprechenden Zusatzkomponenten ausgestattet ist. o Dezidierte stereotaktische Linearbeschleuniger: Statt einzelne Komponenten zum Linearbeschleuniger hinzuzukaufen, bestellt man gleich ein komplettes fertiges System („dedicated radiosurgery linac“), z.B. Novalis, TrueBeam STX. o CyberKnife: Ein spezieller Bestrahlungsroboter Biologisches Prinzip und Ablauf der Behandlung o Bestrahlt wird nur der Tumor selbst („CTV = GTV“) mit sehr knappen Sicherheitsabstand (1mm) o Die gesamte Bestrahlungsdosis wird in einer einzigen Fraktion (z.B. 1x 25Gy) oder 3 bis 5 Fraktionen (z.B. 3x 15Gy, 5x 10Gy) appliziert. Wegen der hohen Einzeldosis ist diese Therapie sehr wirksam; im Zielvolumen wird eine Nekrose erzeugt (da nur Tumorzellen bestrahlt werden, resultiert kein Risiko für gesundes Gewebe). o Nebenwirkungen sind selten. Die Behandlung ist non-invasiv (es fließt kein Blut)und kann ambulant durchgeführt werden. Indikationen und Ergebnisse o Hirnmetastasen: bei 1-3 Hirnmetastasen ist die Radiochirurgie obligat, wenn möglich. Erfolgsquote gleich gut wie OP oder besser. OP (Resektion der Hirnmetastase) ist indiziert, wenn eine Histologie erforderlich ist und bei symptomatischen Metastasen, die eine schnelle Druckentlastung erfordern (z.B. Einblutung, Hirnstammkompression) o Gutartige Hirntumoren, z.B. Akustikusneurinome/Vestibularisschwannome (besserer Hörerhalt als bei OP), Meningeome, Hypophysenadenome. o Funktionelle Radiochirurgie bei Trigeminusneuralgie o Kleine Bronchialkarzinome T1 N0 als Alternative zur OP (vor allem bei funktioneller Inoperabilität oder bei Rezidiven) o Kleine Leber- und Lungenmetastasen Die Erfolgsquote generell ist vergleichbar mit einer Operation bei geringerem Risiko. NEU: Eine aktuelle Meta-Analyse zeigt, dass die Radiochirurgie bei kleinen Bronchialkarzinomen hinsichtlich der Überlebensrate besser ist als die bisher als Standard geltende Operation (Lobektomie)9. Die Tumorkontrolle war gleich gut, es traten aber weniger Nebenwirkungen nach Radiochirurgie auf. 9 Chang JY et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small cell lung cancer. Lancet Oncol 2015 ANHANG: Im Anhang finden Sie in paar Patienteninformationen, die wir zur Aufklärung und Beratung nutzen. Informationen für unsere Patienten Ablauf einer Strahlentherapie: 10 Fragen, 10 Antworten Was passiert beim ersten Termin in der Strahlenklinik? Ihre Ärzte, die bei Ihnen eine behandlungsbedürftige Erkrankung diagnostiziert haben, haben meistens schon mit uns Kontakt aufgenommen und alle Unterlagen gesandt. Bei Patienten mit Krebs sind oft schon alle Befunde im Kreis verschiedener Experten besprochen und eine Behandlungsempfehlung festgelegt worden (sog. Tumorkonferenz, im UKSH erfolgt dies für alle Patienten). Der erste Termin bei uns dient meistens nur zur Beratung und Untersuchung. Wir wollen uns ein möglichst gutes Bild von Ihrer Krankheitssituation machen („man behandelt keine Krankheiten, sondern Patienten mit Krankheiten“). Manchmal sind noch weitere Untersuchungen nötig, um die genaue Art der Bestrahlung festlegen zu können. Wir besprechen dann alle Befunde und die geplante Behandlung mit Ihnen. Bitte fragen Sie nach, wenn Sie etwas nicht verstanden haben. Wir haben keine Geheimnisse und möchten, dass Sie gut informiert sind. Bitte bringen Sie zu diesem Termin gern auch nahe Angehörige mit. Es gilt aber immer: Ob und wieviel Ihre Angehörigen erfahren, entscheiden Sie. Wie läuft die Strahlenbestrahlung ab? Meistens wird die Strahlentherapie ambulant durchgeführt, mit Terminen einmal täglich an allen Werktagen. Vor der eigentlichen Strahlentherapie sind noch ein bis zwei Termine zur Vorbereitung (Bestrahlungsplanung) nötig. Die Bestrahlungen selbst gehen schnell (pro Tag etwa 10 bis 15 Minuten, davon etwa 1 Minute echte Bestrahlungszeit). Welche Methoden der Strahlentherapie gibt es? Das Standardverfahren ist eine Bestrahlung von außen mit einem Linearbeschleuniger (sog. externe Strahlentherapie); mehr 95% aller Patientinnen werden so behandelt. Andere Verfahren sind Brachytherapie („Bestrahlung von innen“) oder Strahlenchirurgie (Hochpräzisionsbestrahlung). Wie lange dauert die Strahlentherapie? Bei der Standardbestrahlung (externe Strahlentherapie mit Linearbeschleunigern) sind meistens 25 bis 30 ambulante Termine erforderlich, jeweils einmal täglich an Werktagen; die gesamte Strahlenbehandlung dauert durchschnittlich also etwa fünf Wochen (mindestens zwei, maximal acht Wochen). Die täglichen Bestrahlungen gehen schnell (etwa 10 Minuten pro Tag). Was muss man während der Strahlentherapie beachten? Eigentlich gar nichts. Die normale Strahlenbehandlung soll Ihren Alltag nicht oder möglichst wenig beeinträchtigen. Es gibt keine Einschränkungen. Wichtig: Hautmarkierungen (sie dienen zur exakten Positionierung während der Bestrahlung) bitte nicht verändern und auch nicht abwischen; sie werden einem durchsichtigen Duschpflaster beklebt, so dass die beim Duschen und Waschen nicht verschwinden. Normale Körperpflege ist also gut möglich. Ist man während der Behandlung fahrtüchtig? Ja, fast immer. Einschränkungen der Fahrtüchtigkeit bestehen aber meistens bei Bestrahlungen des Gehirns und wenn bestimmte Medikamente eingenommen werden; wir besprechen das dann mit Ihnen. Unabhängig davon kann aber manchmal eine starke Müdigkeit auftreten (als Folge der Erkrankung und/oder der Behandlung), und es ist aus ärztlicher Sicht dann nicht sinnvoll, dass Sie selbst Auto fahren. Die Fahrtkosten zur Therapie werden im Regelfall von den Krankenkassen erstattet; eine entsprechende Bescheinigung erhalten Sie von unseren Ambulanzmitarbeitern. Muss man bei den eigenen Medikamenten oder Physiotherapie aufpassen? Andere Behandlungen (z.B. Physiotherapie, Lymphdrainage) können fortgeführt werden. Spezielle Medikamente sind wegen der Bestrahlungen meistens nicht erforderlich (manchmal aber wegen gleichzeitiger Chemotherapie). Eine Dauermedikation (z.B. bei Bluthochdruck oder Herzkrankheiten) soll unverändert fortgeführt werden; bitte informieren Sie uns aber über die Medikamente, die Sie regelmäßig einnehmen. Gibt es Nebenwirkungen und Risiken? Natürlich. Jede Behandlung birgt ein Risiko. Am Ende der mehrwöchigen Bestrahlung (oder in der Woche danach) treten fast immer vorübergehende Reaktionen an Haut und Schleimhäuten im Bestrahlungsfeld auf (z.B. Hautrötung ähnlich wie ein Sonnenbrand); diese Reaktionen sind aber harmlos und klingen spontan innerhalb von zwei bis drei Wochen nach Ende der Bestrahlung ab. Langzeitfolgen der Behandlung sind selten. Objektiv gilt: von den in der Krebsbehandlung eingesetzten Verfahren ist die Strahlentherapie oft die risikoärmste Therapie, und eine Bestrahlung ist auch bei älteren Patienten oder Patienten mit Begleiterkrankungen möglich, die eine Operation oder Chemotherapie gar nicht mehr vertragen würden. Die meisten Patienten vertragen die Strahlentherapie sehr gut. Wird man radioaktiv belastet? Nein. Die Bestrahlung ist nur örtlich wirksam. Radioaktivität im Körper entsteht nicht; der Patient ist strahlungsfrei. Sie können Ihren Partner und Ihre Kinder und Enkelkinder also ohne Sorgen in den Arm nehmen (Ausnahme: Seeds-Behandlung bei Prostatakrebs) Welche Behandlungsmethoden gibt es am UKSH? Eigentlich alles. Wir führen natürlich die Standard-Strahlentherapie durch (also sog. externe 3DKonformationsbestrahlung, IMRT), aber wir sind auch spezialisiert auf Präzisionsbestrahlungen („Strahlenchirurgie“), besonders aufwändige Strahlenbehandlungen (z.B. Strahlentherapie in kontrolliertem Atemstillstand, die man bei linksseitigem Brustkrebs zur Senkung der Strahlendosis am Herzen einsetzt, oder Ganzkörperbestrahlungen bei Knochenmarktransplantation) und Brachytherapie (Kontaktbestrahlung „von innen“, z.B. bei Gebärmutterkrebs oder Prostatakrebs; Seeds-Therapie bei Prostatakrebs). Auch für komplizierte Kombinationsbehandlungen (Radiochemotherapie) sind wir gut ausgerüstet, vor allem wegen der großen Bettenstation und der ambulanten Chemotherapie in unserer Klinik. Und wir fühlen uns als Universitätsklinik natürlich in besonderer Weise verpflichtet, Fortschritt schnell und konsequent im Interesse unserer Patienten umzusetzen. Unser Motto ist: Das Bessere ist der Feind des Guten. Prof. Dr. J. Dunst Prof. Dr. D. Rades Direktor der Klinik für Strahlentherapie Kiel/Lübeck/Heide Chefarzt am Campus Kiel Chefarzt am Campus Lübeck Information für unsere Patienten Hautpflege während der Strahlentherapie Sehr geehrte, liebe Patientin, Sehr geehrter, lieber Patient, früher traten bei einer Bestrahlung fast immer starke Hautreaktionen auf; heute ist dies eher selten. Meistens gehört die Haut nämlich nicht zum Zielgebiet. Dann tritt im Regelfall eine Strahlenreaktion an der Haut nicht auf. Bitte beachten Sie aber: Falls Hautmarkierungen erforderlich sind, diese bitte nicht abwaschen. Sie sind für die genaue Positionierung bei der Bestrahlung nötig und werden mit einem durchsichtigen Pflaster (Duschpflaster) beklebt. Spezielle Pflegemaßnahmen für die Haut sind nicht nötig. Falls die Haut mitbestrahlt wird (v.a. bei Hauttumoren, Tumoren im Halsbereich, Tumoren am After oder der Scheide, Brustkrebs, Weichgewebstumoren an Armen oder Beinen), beachten Sie bitte: Die Hautreaktion tritt verzögert (etwa 2-3 Wochen nach Beginn der Bestrahlung) auf und hält 2-3 Wochen nach Ende der Bestrahlung an. Kontakt der bestrahlten Haut mit allergie-auslösenden Stoffen (parfümierte Seifen, Deos, etc) vermeiden. Zur Hautpflege am besten nur Wasser und Seife, medizinische Produkte oder Hautpflegemittel für Babys verwenden. Normales Waschen ist aber möglich. Falls die Haut spannt, können Salben oder Öle angenehm sein. Bei schweren Verläufen: Pflege wie bei einer offenen Wunde Generell gilt aber: auch schwere Hautreaktionen bilden sich fast immer innerhalb von 3-4 Wochen nach der Behandlung vollständig zurück. Dauerhafte Folgen an der Haut bleiben nicht zurück. Falls eine Hautreaktion auftritt, informieren Sie bitte unsere Ärzte und Schwestern, damit wir die Behandlung mit Ihnen besprechen können. Falls Sie Fragen haben: fragen Sie uns bitte. Wir, die Mitarbeiter der Klinik, beraten Sie gern. Informationen für unsere Patienten Wie wirkt eigentlich eine Strahlentherapie ? Biologische Wirkung Röntgenstrahlen können Zellen schädigen und abtöten. Die Zellen unseres Körpers sind aber an kleine Mengen von Röntgenstrahlen gewöhnt, weil diese dauernd (z.B. aus dem Weltraum) auf uns treffen. Wenn allerdings eine bestimmte Menge überschritten wird, können die Zellen die von den Röntgenstrahlen verursachten Schäden nicht mehr vollständig reparieren. Diese „Reparaturgrenze“ ist bei Krebszellen meistens relativ niedrig, d.h. Krebszellen vertragen weniger Röntgenstrahlen als gesunde Körperzellen. Wenn man die Strahlenmenge also richtig „portioniert“ (Fachausdruck: Fraktionierung), kann man Strahlen erfolgreich zur Krebsbehandlung einsetzen. Die Krebszellen werden abgetötet, aber das gesunde Gewebe kann sich vollständig erholen. Was muss bestrahlt werden? Tumoren breiten sich in die Umgebung aus; der Tumor ist also bei einer mikroskopischen Untersuchung fast immer größer, als er mit bloßem Auge erscheint. Diese mikroskopisch kleinen Absiedlungen reagieren gut auf Röntgenstrahlen. Auch wenn ein Tumor vollständig entfernt wurde (dargestellt im Bild durch die schwarze Linie), können kleine Tumorzellnester in der Umgebung zurück geblieben sein. Dann ist eine Nachbestrahlung sinnvoll. Auch wenn keine Operation durchgeführt wird, ist es nötig, immer auch die gesund erscheinende Umgebung des Tumors mit einer niedrigen Dosis mitzubestrahlen. Technik Die Bestrahlung erfolgt meistens von außen („externe Bestrahlung“). Für eine punktgenaue Bestrahlung benötigt man starke Röntgenstrahlen, die tief eindringen können und auch Knochendurchdringen. Als Gerät wird deshalb ein Linearbeschleuniger (s. Bild) verwendet. Die Röntgenstrahlen werden im Strahlerkopf erzeugt. Das Gerät kann sich um einen virtuellen Punkt im Raum (Isozentrum) drehen. Die Lage des Isozentrums (exakt 1000mm vom Fokus entfernt) wird durch Lasersysteme markiert. Bei der Bestrahlung wird der Patient auf der Couch gelagert, und die Couch wird dann so positioniert, das der geometrische Mittelpunkt des Zielgebietes (dieser wurde deshalb vorher mit Computerplanung berechnet) mit dem Isozentrum übereinstimmt. Das Gerät „schaut“ also immer auf den Mittelpunkt des Zielgebietes. Die Bestrahlung wird heute von speziell ausgebildeten Physikern und Ingenieuren mittels Planungsprogrammen berechnet. Durch den Fortschritt in der Rechentechnik können auch sehr komplizierte Bestrahlungstechniken schnell und sicher berechnet werden; trotzdem veranschlagen wir für die Bestrahlungsplanung immer mehrere Tage, um die jeweils beste Bestrahlung berechnen zu können. Am Ende resultiert ein 3D-Bestrahlungsplan, der dem Arzt nicht nur die Verteilung der Strahlung im Zielgebiet, sondern auch die Strahlenbelastung aller anderen wichtigen Organe zeigt. Die Strahlen selbst sind für den Patienten nicht spürbar. Das Risiko für Komplikationen ist bei der heute verwendeten Technik sehr klein. Die Strahlentherapie ist oft eine schonende Alternative zu einer Krebsoperation und kann auch bei älteren Patienten oder Patienten mit hohem Narkoserisiko eingesetzt werden.